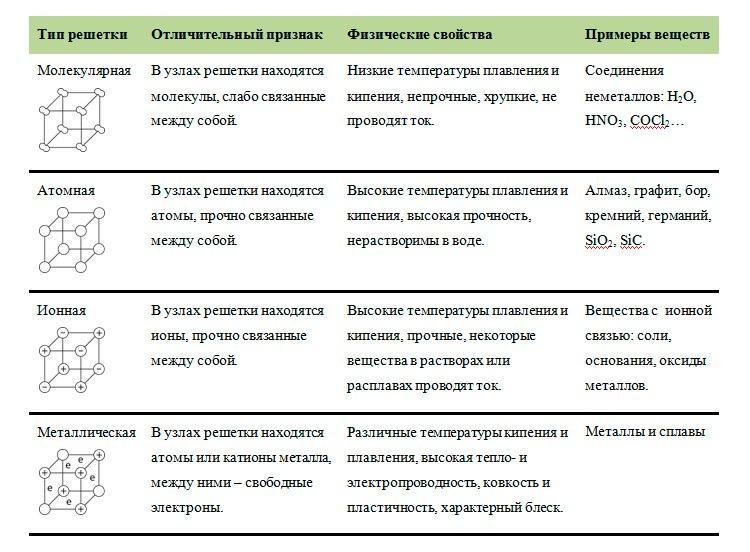
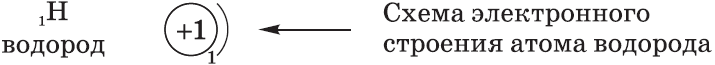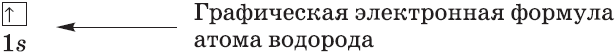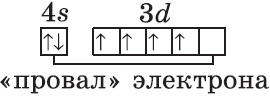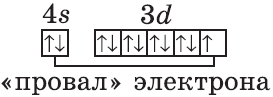Задание №1 ЕГЭ по химии
Описание задания
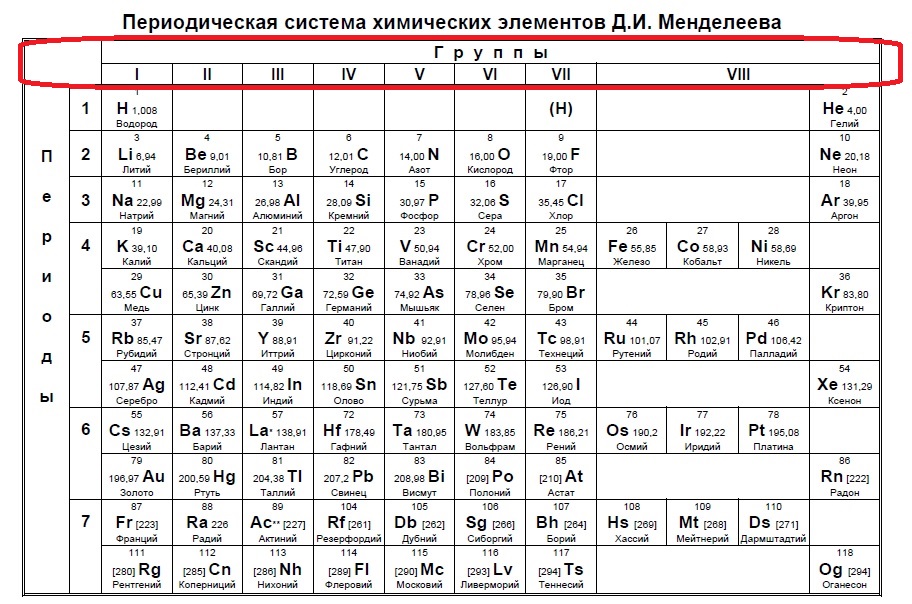
В Задании №1 нам необходимо уметь хорошо пользоваться таблицей Менделеева. Первое задание — это поиск атома или иона с заданной конфигурацией электронов, обычно это количество электронов на внешнем уровне (соответствует номеру группы).
Тематика заданий: электронная конфигурация атомов
Бал: 1
Сложность задания: ♦◊◊
Примерное время выполнения: 1 мин.
Разбор типовых вариантов заданий №1 ЕГЭ по химии
Вариант 1ЕХ1
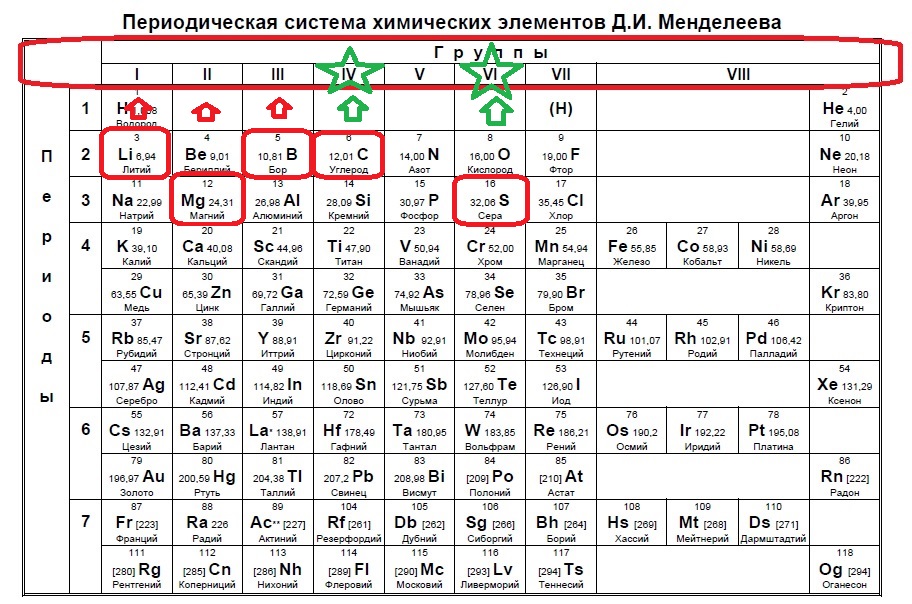
Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне пять электронов.
P
N
S
Al
O
Данный пример — типичный вариант первого задания — необходимо определить количество электронов на внешнем уровне. Вспоминаем, что на количество электронов на внешнем уровне указывает номер ГРУППЫ:
Напомню, что нам важно обращать внимание на то, в главной или побочной группе находится элемент. К сожалению, в таблице, которая дана на ЕГЭ нет деления на главные или побочные группы (какие-то элементы пишут правее, какие-то левее, но это не деление на главные и побочные группы), данная таблица не удобна, однако, по правилам можно пользоваться только ей. Обсуждать недостатки данной таблицы мы не будем, скажем лишь, что в условиях задания представлены всегда элементы главных групп, поэтому данный вопрос отпадает сам собой на экзамене (но нет гарантий, что не могут дать определить количество внешних электронов у кобальта, например, по номеру группы в данной таблице это не определишь).
Итак, находим наши пять элементов из условия:
Определяем номер группы — у алюминия 3 группа, у азота и фосфора — пятая, у кислорода и серы — шестая.
В условии нас спрашивают про пять электронов — значит выбираем элементы из пятой группы — азот и фосфор!
Ответ: 12
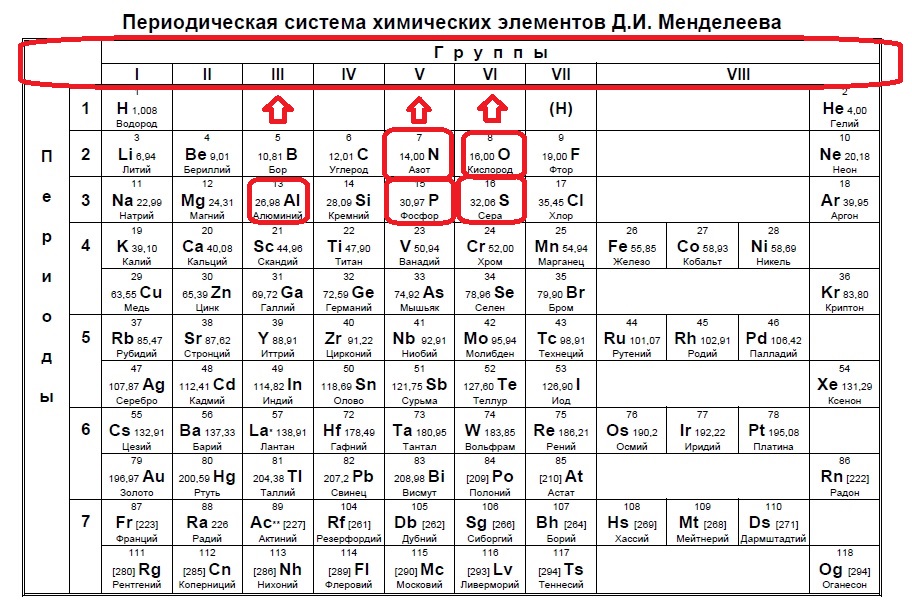
Вариант 1ЕХ2
Определите, двум атомам каких из указанных элементов до завершения внешнего уровня не хватает шести электронов.
Ba
At
Bi
Mg
Cs
Данное задание немного другого типа, в нем необходимо определить элементы, которым не хватает какого-то количества электронов до завершения внешнего уровня. В этом случае наш алгоритм прост: мы знаем, что на внешнем уровне должно быть 8 электронов (2 и 3 период, или главные группы 4,5,6.. — в заданиях в основном фигурируют именно эти элементы), а значит вычитаем из 8 заданное число — в нашем случае 6: 8-6=2. Значит, в нашем элементе должно быть два электрона на внешнем уровне и, следовательно, расположен он во второй группе. Определяем группы элементов из условия:
В данном случае элементы второй группы — магний и барий.
Ответ: 14
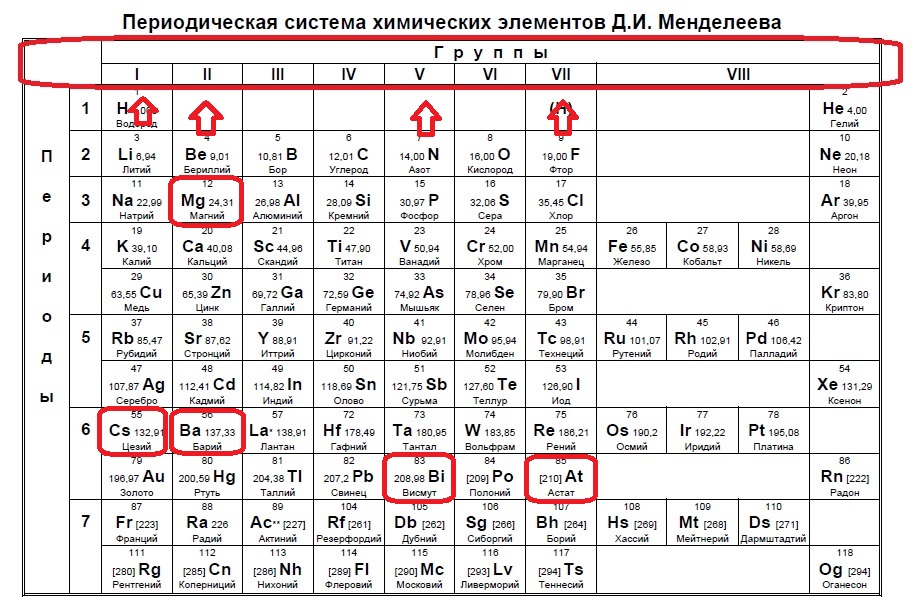
Вариант 1ЕХ3
Определите, атомы каких двух из указанных в ряду элементов в основном состоянии содержат один неспаренный электрон.
S
Na
Al
Si
Mg
Следующий вид задания на поиск элементов с неспаренным электроном. Тут все достаточно просто. Так как электроны у нас в орбиталях всегда располагаются по парам (если помните, то есть квадратик, в котором мы рисуем стрелочку вверх и низ), то логично, что неспаренный электрон образуется, когда количество электронов на внешнем уровне нечетно, то есть в элемент должен быть расположен в нечетной группе, а именно 1,3,5,7. Определяем группы указанных нам элементов:
Итак, натрий в первой группе, магний во второй, алюминий в третьей, кремний в четвертой, а сера в шестой.
Выбираем элементы в нечетных группах — это натрий и алюминий!
Ответ: 23
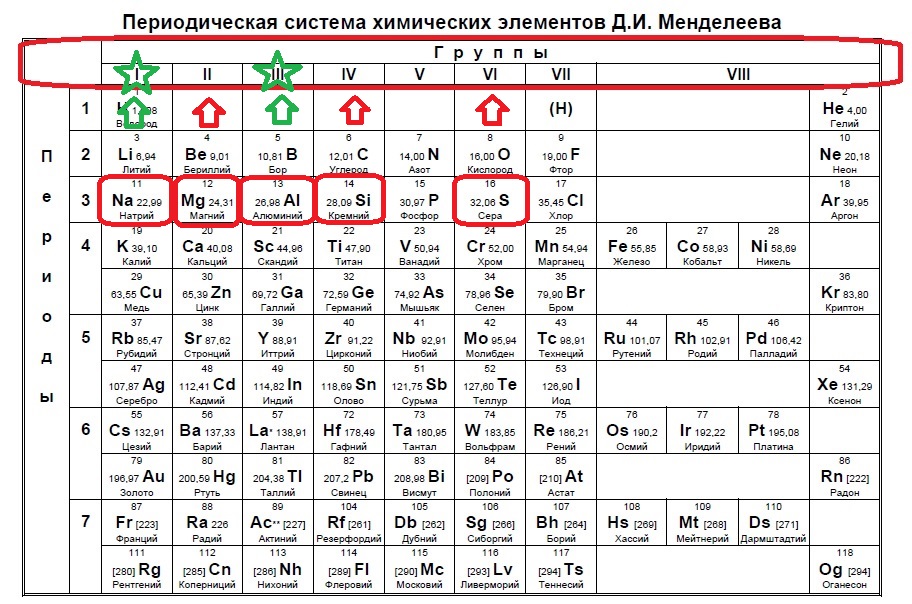
Вариант 1ЕХ4
Определите, атомы каких двух из указанных в ряду элементов в основном состоянии содержат два неспаренных электрона.
S
Mg
C
B
Li
В данном задании нужно найти два неспаренных электрона. Данное распределение можно найти, начиная с p-подуровня, а именно два неспаренных электрона образуются в четвертой группе, так как на s -подуровне два электрона + 2 должно быть на p-подуровне, и в шестой группе, где 2s+2p(спаренные)+2p(неспаренные) (так как в p-подуровне три орбитали по два электрона на каждой). Таким образом нужно найти элементы четвертой группы или шестой:
В нашем случае это углерод и сера.
Ответ: 13
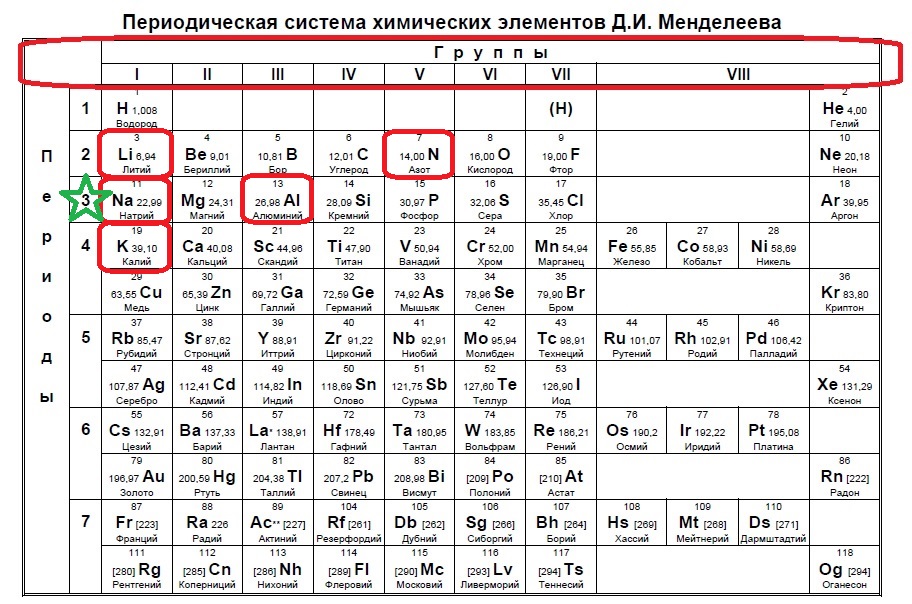
Вариант 1ЕХ5
Определите, какие два из указанных элементов образуют устойчивый положительный ион, содержащий 10 электронов.
Na
K
N
Li
Al
В данном варианте задания речь идет уже об ионе, причем положительном, который содержит 10 электронов. В такого вида заданиях необходимо определить, сколько заполнено уровней у иона в зависимости от количества электронов. В нашем случае 10 электронов — это полностью заполненные первый (2) и второй (8) уровни (или периоды в таблице). Так мы говорим о положительном ионе — значит элемент потерял электроны, но у него их было больше чем 10, а значит, он расположен в третьем периоде. Ищем такие элементы:
Нам подходят натрий и алюминий.
Ответ: 15
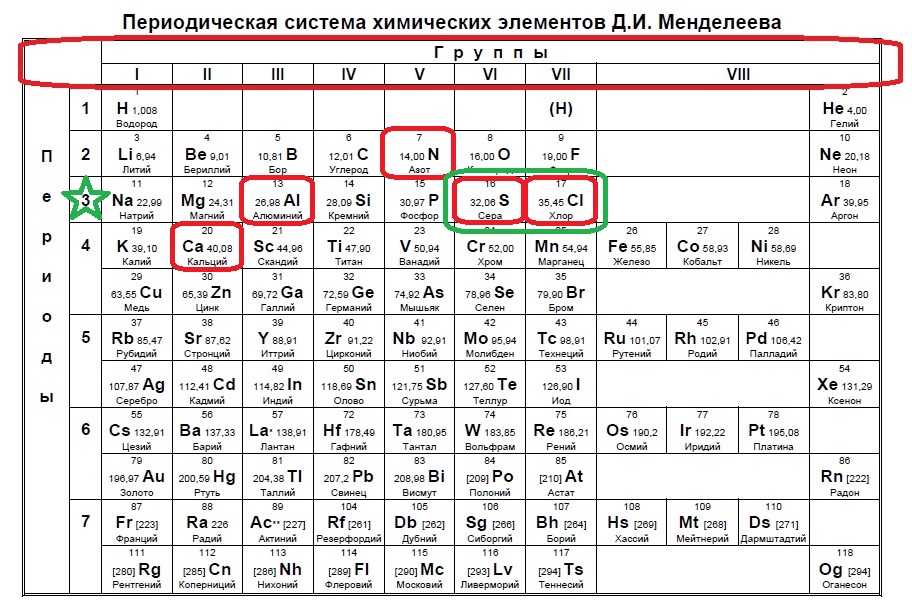
Вариант 1ЕХ6
Определите, какие из указанных элементов образуют устойчивый отрицательный ион, содержащий 18 электронов.
N
Al
S
Cl
Ca
Отрицательный ион получается путем добавления электронов к атому. 18 электронов — это полностью заполненный третий уровень или период, значит, наши элементы расположены именно в нем (в отличии от предыдущего задания, где мы искали в следующем периоде, так как ион положительный). Смотрим на предоставленные в условии элементы:
В данном случае в третий период попали алюминий, сера и хлор. Алюминий не может принять электроны до 18, так как является металлом и отдает электроны. Наиболее типичные элементы-любители электронов расположены правее. Это сера и хлор для данного задания.
Ответ: 34
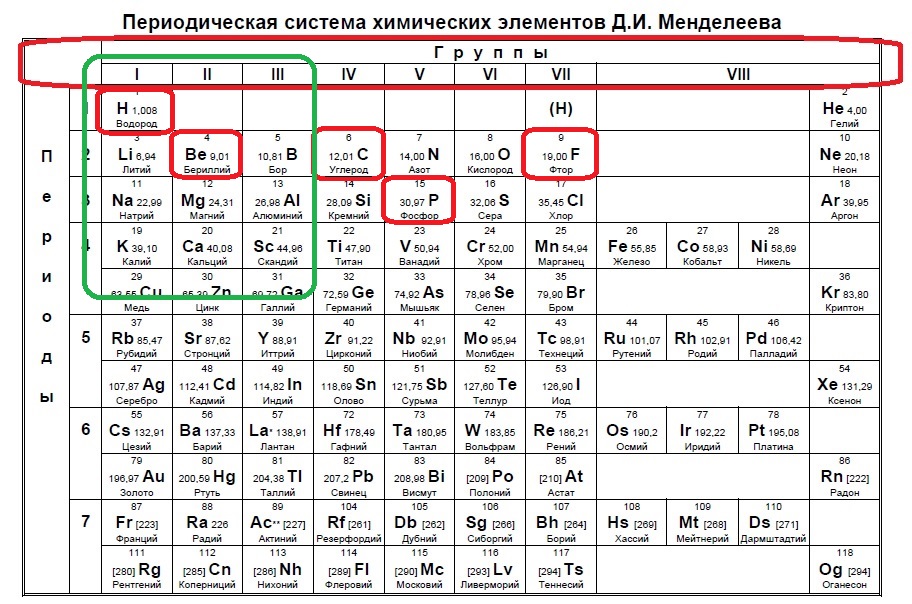
Вариант 1ЕХ7
Определите, какие из указанных элементов на внешнем уровне содержат больше s-электронов, чем p-электронов (в основном состоянии).
H
C
F
Be
P
Такие виды заданий часто встречаются в тренировочных вариантах, нужно либо определить кого меньше, когда равно или кого больше. Разберем для наглядности данный пример. s-электронов всего два, значит p-электронов должно быть 1, чтобы было меньше. В сумме у элемента на внешнем уровне получается максимум 3 электрона (но может быть и ноль p-электронов и один или два s!), а значит он в третьей, второй или первой группе.
Нам подходит водород и бериллий.
Ответ: 14.
Остальные задания очень похожи на разобранные, поэтому вы их точно сможете решить, разобравшись с выше представленными решениями.
Понятие атом возникло еще в античном мире для обо значения частиц вещества. В переводе с греческого атом означает «неделимый».
Электроны
Ирландский физик Стони на основании опытов пришел к выводу, что электричество переносится мельчайшими частицами, существующими в атомах всех химических элементов. В $1891$ г. Стони предложил эти частицы назвать электронами, что по-гречески означает «янтарь».
Через несколько лет после того, как электрон получил свое название, английский физик Джозеф Томсон и французский физик Жан Перрен доказали, что электроны несут на себе отрицательный заряд. Это наименьший отрицательный заряд, который в химии принят за единицу $(–1)$. Томсон даже сумел определить скорость движения электрона (она равна скорости света — $300 000$ км/с) и массу электрона (она в $1836$ раз меньше массы атома водорода).
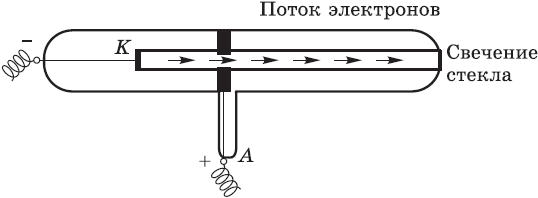
Томсон и Перрен соединяли полюса источника тока с двумя металлическими пластинами — катодом и анодом, впаянными в стеклянную трубку, из которой был откачан воздух. При подаче на пластины-электроды напряжения около 10 тысяч вольт в трубке вспыхивал светящийся разряд, а от катода (отрицательного полюса) к аноду (положительному полюсу) летели частицы, которые ученые сначала назвали катодными лучами, а затем выяснили, что это был поток электронов. Электроны, ударяясь об особые вещества, нанесенные, например, на экран телевизора, вызывают свечение.
Был сделан вывод: электроны вырываются из атомов материала, из которого сделан катод.
Свободные электроны или поток их можно получить и другими способами, например, при накаливании металлической проволоки или при падении света на металлы, образованные элементами главной подгруппы I группы таблицы Менделеева (например, цезий).
Состояние электронов в атоме
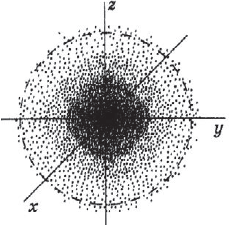
Под состоянием электрона в атоме понимают совокупность информации об энергии определенного электрона в пространстве, в котором он находится. Мы уже знаем, что электрон в атоме не имеет траектории движения, т.е. можно говорить лишь о вероятности нахождения его в пространстве вокруг ядра. Он может находиться в любой части этого пространства, окружающего ядро, и совокупность различных положений его рассматривают как электронное облако с определенной плотностью отрицательного заряда. Образно это можно представить себе так: если бы удалось через сотые или миллионные доли секунды сфотографировать положение электрона в атоме, как при фотофинише, то электрон на таких фотографиях был бы представлен в виде точки. При наложении бесчисленного множества таких фотографий получилась бы картина электронного облака с наибольшей плотностью там, где этих точек больше всего.
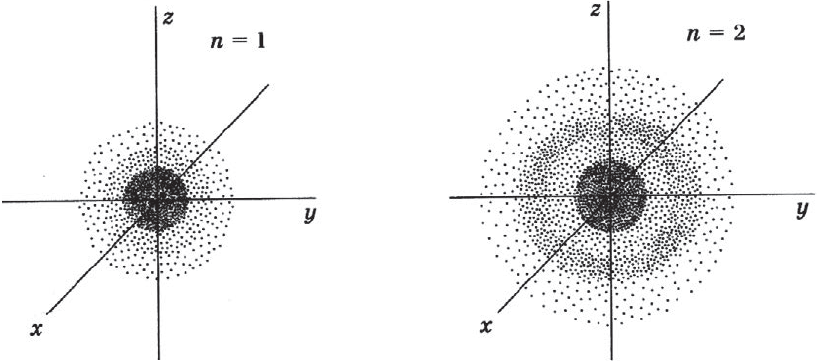
На рисунке показан «разрез» такой электронной плотности в атоме водорода, проходящей через ядро, а штриховой линией ограничена сфера, внутри которой вероятность обнаружения электрона составляет $90%$. Ближайший к ядру контур охватывает область пространства, в которой вероятность обнаружения электрона — $10%$, вероятность обнаружения электрона внутри второго от ядра контура составляет $20%$, внутри третьего — $≈30%$ и т.д. В состоянии электрона есть некая неопределенность. Чтобы охарактеризовать это особое состояние, немецкий физик В. Гейзенберг ввел понятие о принципе неопределенности, т.е. показал, что невозможно определить одновременно и точно энергию и местоположение электрона. Чем точнее определена энергия электрона, тем неопределеннее его положение, и наоборот, определив положение, нельзя определить энергию электрона. Область вероятности обнаружения электрона не имеет четких границ. Однако можно выделить пространство, где вероятность нахождения электрона максимальна.
Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью.
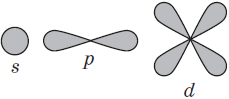
В нем заключено приблизительно $90%$ электронного облака, и это означает, что около $90%$ времени электрон находится в этой части пространства. По форме различают $4$ известных ныне типа орбиталей, которые обозначаются латинскими буквами $s, p, d$ и $f$. Графическое изображение некоторых форм электронных орбиталей представлено на рисунке.
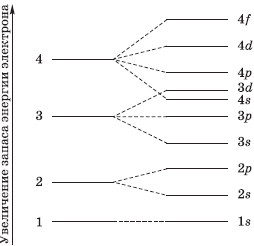
Важнейшей характеристикой движения электрона на определенной орбитали является энергия его связи с ядром. Электроны, обладающие близкими значениями энергии, образуют единый электронный слой, или энергетический уровень. Энергетические уровни нумеруют, начиная от ядра: $1, 2, 3, 4, 5, 6$ и $7$.
Целое число $n$, обозначающее номер энергетического уровня, называют главным квантовым числом.
Оно характеризует энергию электронов, занимающих данный энергетический уровень. Наименьшей энергией обладают электроны первого энергетического уровня, наиболее близкого к ядру. По сравнению с электронами первого уровня электроны последующих уровней характеризуются большим запасом энергии. Следовательно, наименее прочно связаны с ядром атома электроны внеш него уровня.
Число энергетических уровней (электронных слоев) в атоме равно номеру периода в системе Д. И. Менделеева, к которому принадлежит химический элемент: у атомов элементов первого периода один энергетический уровень; второго периода — два; седьмого периода — семь.
Наибольшее число электронов на энергетическом уровне определяется по формуле:
$N=2n^2,$
где $N$ — максимальное число электронов; $n$ — номер уровня, или главное квантовое число. Следовательно: на первом, ближайшем к ядру энергетическом уровне может находиться не более двух электронов; на втором — не более $8$; на третьем — не более $18$; на четвертом — не более $32$. А как, в свою очередь, устроены энергетические уровни (электронные слои)?
Начиная со второго энергетического уровня $(n = 2)$, каждый из уровней подразделяется на подуровни (подслои), несколько отличающиеся друг от друга энергией связи с ядром.
Число подуровней равно значению главного квантового числа: первый энергетический уровень имеет один под уровень; второй — два; третий — три; четвертый — четыре. Подуровни, в свою очередь, образованы орбиталями.
Каждому значению $n$ соответствует число орбиталей, равное $n^2$. По данным, представленным в таблице, можно проследить связь главного квантового числа $n$ с числом подуровней, типом и числом орбиталей и максимальным числом электронов на подуровне и уровне.
Главное квантовое число, типы и число орбиталей, максимальное число электронов на подуровнях и уровнях.
| Энергетический уровень $(n)$ | Число подуровней, равное $n$ | Тип орбитали | Число орбиталей | Максимальное число электронов | ||
| в подуровне | в уровне, равное $n^2$ | в подуровне | на уровне, равное $n^2$ | |||
| $K(n=1)$ | $1$ | $1s$ | $1$ | $1$ | $2$ | $2$ |
| $L(n=2)$ | $2$ | $2s$ | $1$ | $4$ | $2$ | $8$ |
| $2p$ | $3$ | $6$ | ||||
| $M(n=3)$ | $3$ | $3s$ | $1$ | $9$ | $2$ | $18$ |
| $3p$ | $3$ | $6$ | ||||
| $3d$ | $5$ | $10$ | ||||
| $N(n=4)$ | $4$ | $4s$ | $1$ | $16$ | $2$ | $32$ |
| $4p$ | $3$ | $6$ | ||||
| $4d$ | $5$ | $10$ | ||||
| $4f$ | $7$ | $14$ |
Подуровни принято обозначать латинскими буквами, равно как и форму орбиталей, из которых они состоят: $s, p, d, f$. Так:
- $s$-подуровень — первый, ближайший к ядру атома подуровень каждого энергетического уровня, состоит из одной $s$-орбитали;
- $р$-подуровень — второй подуровень каждого, кроме первого, энергетического уровня, состоит из трех $р$-орбиталей;
- $d$-подуровень — третий подуровень каждого, начиная с третьего, энергетического уровня, состоит из пяти $d$-орбиталей;
- $f$-подуровень каждого, начиная с четвертого, энергетического уровня, состоит из семи $f$-орбиталей.
Ядро атома
Но не только электроны входят в состав атомов. Физик Анри Беккерель обнаружил, что природный минерал, содержащий соль урана, тоже испускает неведомое излучение, засвечивая фотопленки, закрытые от света. Это явление было названо радиоактивностью.
Различают три вида радиоактивных лучей:
- $α$-лучи, которые состоят из $α$-частиц, имеющих заряд в $2$ раза больше заряда электрона, но с положительным знаком, и массу в $4$ раза больше массы атома водорода;
- $β$-лучи представляют собой поток электронов;
- $γ$-лучи — электромагнитные волны с ничтожно малой массой, не несущие электрического заряда.
Следовательно, атом имеет сложное строение — состоит из положительно заряженного ядра и электронов.
Как же устроен атом?
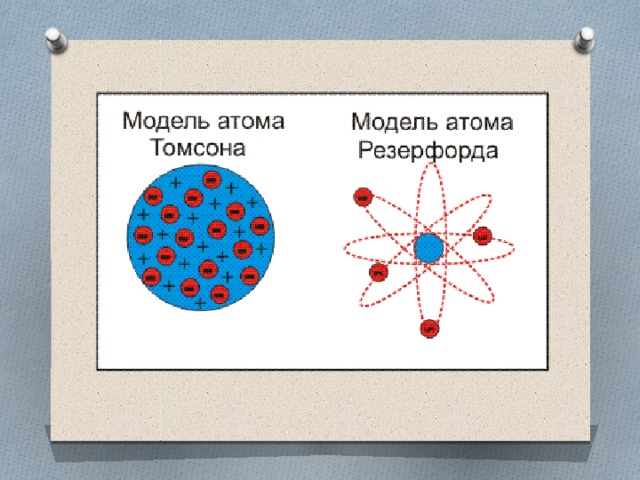
В 1910 г. в Кембридже, близ Лондона, Эрнест Резерфорд со своими учениками и коллегами изучал рассеяние $α$-частиц, проходящих через тоненькую золотую фольгу и падаюших на экран. Альфа-частицы обычно отклонялись от первоначального направления всего на один градус, подтверждая, казалось бы, равномерность и однородность свойств атомов золота. И вдруг исследователи заметили, что некоторые $α$-частицы резко меняли направление своего пути, будто наталкиваясь на какую-то преграду.
Разместив экран перед фольгой, Резерфорд сумел обнаружить даже те редчайшие случаи, когда $α$-частицы, отразившись от атомов золота, летели в противоположном направлении.
Расчеты показали, что наблюдаемые явления могли произойти, если бы вся масса атома и весь его положительный заряд были сосредоточены в крохотном центральном ядре. Радиус ядра, как выяснилось, в 100 000 раз меньше радиуса всего атома, той его области, в которой находятся электроны, имеющие отрицательный заряд. Если применить образное сравнение, то весь объем атома можно уподобить стадиону в Лужниках, а ядро — футбольному мячу, расположенному в центре поля.
Атом любого химического элемента сравним с крохотной Солнечной системой. Поэтому такую модель атома, предложенную Резерфордом, называют планетарной.
Протоны и нейтроны
Оказывается, и крошечное атомное ядро, в котором сосредоточена вся масса атома, состоит из частиц двух видов — протонов и нейтронов.
Протоны имеют заряд, равный заряду электронов, но противоположный по знаку $(+1)$, и массу, равную массе атома водорода (она принята в химии за единицу). Обо значаются протоны знаком $↙{1}↖{1}p$ (или $р+$). Нейтроны не несут заряда, они нейтральны и имеют массу, равную массе протона, т.е. $1$. Обозначают нейтроны знаком $↙{0}↖{1}n$ (или $n^0$).
Протоны и нейтроны вместе называют нуклонами (от лат. nucleus — ядро).
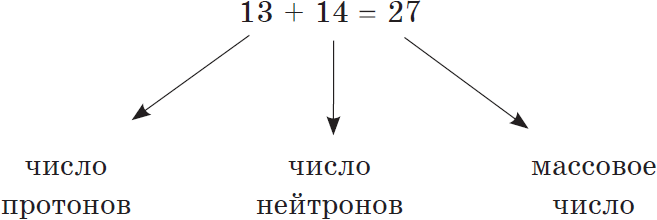
Сумма числа протонов и нейтронов в атоме называется массовым числом. Например, массовое число атома алюминия:
Так как массой электрона, ничтожно малой, можно пренебречь, то очевидно, что в ядре сосредоточена вся масса атома. Электроны обозначают так: $e↖{-}$.
Поскольку атом электронейтрален, также очевидно, что число протонов и электронов в атоме одинаково. Оно равно порядковому номеру химического элемента, присвоенному ему в Периодической системе. Например, в ядре атома железа содержится $26$ протонов, а вокруг ядра вращается $26$ электронов. А как определить число ней тронов?
Как известно, масса атома складывается из массы протонов и нейтронов. Зная порядковый номер элемента $(Z)$, т.е. число протонов, и массовое число $(А)$, равное сумме чисел протонов и нейтронов, можно найти число нейтронов $(N)$ по формуле:
$N=A-Z$
Например, число нейтронов в атоме железа равно:
$56 – 26 = 30$.
В таблице представлены основные характеристики элементарных частиц.
Основные характеристики элементарных частиц.
| Частица и ее обозначение | Масса | Заряд | Примечание |
| Протон — $p^+$ | $1$ | $+1$ | Число протонов равно порядковому номеру элемента |
| Нейтрон — $n^0$ | $1$ | $0$ | Число нейтронов находят по формуле: $N=A-Z$ |
| Электрон — $e↖{-}$ | ${1}/{1837}$ | $-1$ | Число электронов равно порядковому номеру элемента |
Изотопы
Разновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разное массовое число, называются изотопами.
Слово изотоп состоит из двух греческих слов: isos — одинаковый и topos — место, обозначает «занимающий одно место» (клетку) в Периодической системе элементов.
Химические элементы, встречающиеся в природе, являются смесью изотопов. Так, углерод имеет три изотопа с массой $12, 13, 14$; кислород — три изотопа с массой $16, 17, 18$ и т. д.
Обычно приводимая в Периодической системе относительная атомная масса химического элемента является средним значением атомных масс природной смеси изотопов данного элемента с учетом их относительного содержания в природе, поэтому значения атомных масс довольно часто являются дробными. Например, атомы природного хлора представляют собой смесь двух изотопов — $35$ (их в природе $75%$) и $37$ (их $25%$); следовательно, относительная атомная масса хлора равна $35.5$. Изотопы хлора записываются так:
$↖{35}↙{17}{Cl}$ и $↖{37}↙{17}{Cl}$
Химические свойства изотопов хлора совершенно одинаковы, как и изотопов большинства химических элементов, например калия, аргона:
$↖{39}↙{19}{K}$ и $↖{40}↙{19}{K}$, $↖{39}↙{18}{Ar}$ и $↖{40}↙{18}{Ar}$
Однако изотопы водорода сильно различаются по свойствам из-за резкого кратного увеличения их относительной атомной массы; им даже присвоены индивидуальные названия и химические знаки: протий — $↖{1}↙{1}{H}$; дейтерий — $↖{2}↙{1}{H}$, или $↖{2}↙{1}{D}$; тритий — $↖{3}↙{1}{H}$, или $↖{3}↙{1}{T}$.
Теперь можно дать современное, более строгое и научное определение химическому элементу.
Химический элемент — это совокупность атомов с одинаковым зарядом ядра.
Строение электронных оболочек атомов элементов первых четырех периодов
Рассмотрим отображение электронных конфигураций атомов элементов по периодам системы Д. И. Менделеева.
Элементы первого периода.
Схемы электронного строения атомов показывают распределение электронов по электронным слоям (энергетическим уровням).
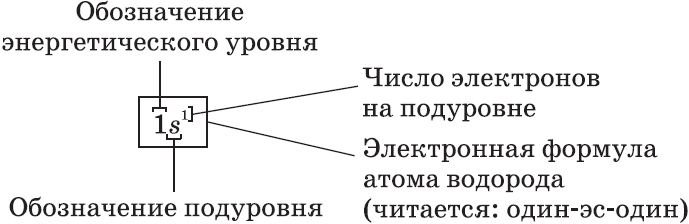
Электронные формулы атомов показывают распределение электронов по энергетическим уровням и под уровням.
Графические электронные формулы атомов показывают распределение электронов не только по уровням и под уровням, но и по орбиталям.
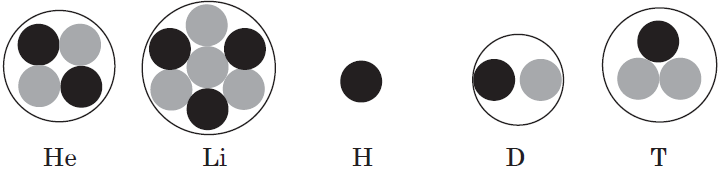
В атоме гелия первый электронный слой завершен — в нем $2$ электрона.
Водород и гелий — $s$-элементы, у этих атомов заполняется электронами $s$-орбиталь.
Элементы второго периода.
У всех элементов второго периода первый электронный слой заполнен, и электроны заполняют $s-$ и $р$-орбитали второго электронного слоя в соответствии с принципом наименьшей энергии (сначала $s$, а затем $р$) и правилами Паули и Хунда.
В атоме неона второй электронный слой завершен — в нем $8$ электронов.
Элементы третьего периода.
У атомов элементов третьего периода первый и второй электронные слои завершены, поэтому заполняется третий электронный слой, в котором электроны могут занимать 3s-, 3р- и 3d-под уровни.
Строение электронных оболочек атомов элементов третьего периода.
У атома магния достраивается $3,5$-электронная орбиталь. $Na$ и $Mg$ — $s$-элементы.
У алюминия и последующих элементов заполняется электронами $3d$-подуровень.
В атоме аргона на внешнем слое (третьем электронном слое) $8$ электронов. Как внешний слой завершен, но всего в третьем электронном слое, как вы уже знаете, может быть 18 электронов, а это значит, что у элементов третьего периода остаются незаполненными $3d$-орбитали.
Все элементы от $Al$ до $Ar$ — $р$-элементы.
$s-$ и $р$-элементы образуют главные подгруппы в Периодической системе.
Элементы четвертого периода.
У атомов калия и кальция появляется четвертый электронный слой, заполняется $4s$-подуровень, т.к. он имеет меньшую энергию, чем $3d$-подуровень. Для упрощения графических электронных формул атомов элементов четвертого периода:
- обозначим условно графическую электронную формулу аргона так: $Ar$;
- не будем изображать подуровни, которые у этих атомов не заполняются.
$К, Са$ — $s$-элементы, входящие в главные подгруппы. У атомов от $Sc$ до $Zn$ заполняется электронами 3d-подуровень. Это $3d$-элементы. Они входят в побочные подгруппы, у них заполняется предвнешний электронный слой, их относят к переходным элементам.
Обратите внимание на строение электронных оболочек атомов хрома и меди. В них происходит «провал» одного электрона с $4s-$ на $3d$-подуровень, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций $3d^5$ и $3d^{10}$:
$↙{24}{Cr}$ $1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{4} 4s^{2}…$
$↙{29}{Cu}$ $1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{9}4s^{2}…$
| Символ элемента, порядковый номер, название | Схема электронного строения | Электронная формула | Графическая электронная формула |
| $↙{19}{K}$ Калий | 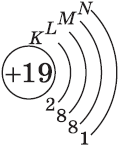 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^1$ | 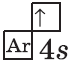 |
| $↙{20}{C}$ Кальций | 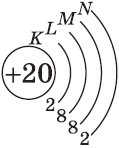 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2$ | 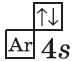 |
| $↙{21}{Sc}$ Скандий | 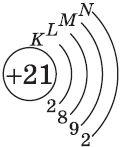 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^1{3}d^1$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^1{4}s^1$ | 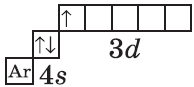 |
| $↙{22}{Ti}$ Титан | 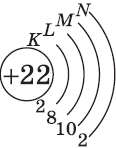 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2{3}d^2$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^2{4}s^2$ | 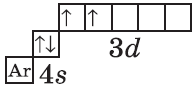 |
| $↙{23}{V}$ Ванадий | 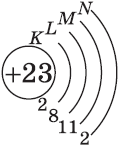 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2{3}d^3$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^3{4}s^2$ | 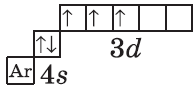 |
| $↙{24}{Сr}$ Хром | 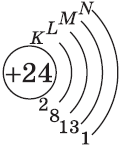 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^1{3}d^5$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^5{4}s^1$ | 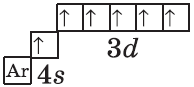 |
| $↙{29}{Сu}$ Хром | 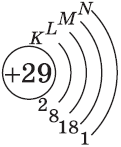 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^1{3}d^{10}$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^{10}{4}s^1$ | 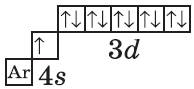 |
| $↙{30}{Zn}$ Цинк | 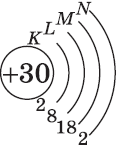 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2{3}d^{10}$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^{10}{4}s^2$ | 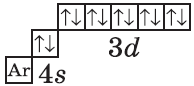 |
| $↙{31}{Ga}$ Галлий | 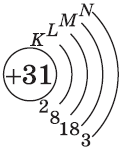 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2{3}d^{10}4p^{1}$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^{10}{4}s^{2}4p^{1}$ | 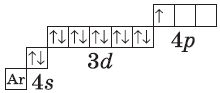 |
| $↙{36}{Kr}$ Криптон | 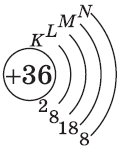 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2{3}d^{10}4p^6$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^{10}{4}s^{2}4p^6$ | 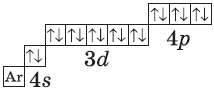 |
В атоме цинка третий электронный слой завершен — в нем заполнены все подуровни $3s, 3р$ и $3d$, всего на них $18$ электронов.
У следующих за цинком элементов продолжает заполняться четвертый электронный слой, $4р$-подуровень. Элементы от $Ga$ до $Кr$ — $р$-элементы.
У атома криптона внешний (четвертый) слой завершен, имеет $8$ электронов. Но всего в четвертом электронном слое, как вы знаете, может быть $32$ электрона; у атома криптона пока остаются незаполненными $4d-$ и $4f$-подуровни.
У элементов пятого периода идет заполнение подуровней в следующем порядке: $5s → 4d → 5р$. И также встречаются исключения, связанные с «провалом» электронов, у $↙{41}Nb$, $↙{42}Мо$, $↙{44}Ru$, $↙{45}Rh$, $↙{46}Pd$, $↙{47}Ag$. В шестом и седьмом периодах появляются $f$-элементы, т.е. элементы, у которых идет заполнение соответственно $4f-$ и $5f$-подуровней третьего снаружи электронного слоя.
$4f$-элементы называют лантаноидами.
$5f$-элементы называют актиноидами.
Порядок заполнения электронных подуровней в атомах элементов шестого периода: $↙{55}Cs$ и $↙{56}Ва$ — $6s$-элементы; $↙{57}La … 6s^{2}5d^{1}$ — $5d$-элемент; $↙{58}Се$ – $↙{71}Lu — 4f$-элементы; $↙{72}Hf$ – $↙{80}Hg — 5d$-элементы; $↙{81}Т1$ – $↙{86}Rn — 6d$-элементы. Но и здесь встречаются элементы, у которых нарушается порядок заполнения электронных орбиталей, что, например, связано с большей энергетической устойчивостью наполовину и полностью заполненных $f$-подуровней, т.е. $nf^7$ и $nf^{14}$.
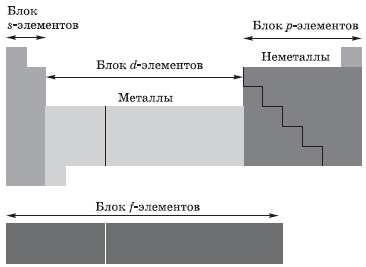
В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы, как вы уже поняли, делят на четыре электронных семейства, или блока:
- $s$-элементы; электронами заполняется $s$-подуровень внешнего уровня атома; к $s$-элементам относятся водород, гелий и элементы главных подгрупп I и II групп;
- $р$-элементы; электронами заполняется $р$-подуровень внешнего уровня атома; к $р$-элементам относятся элементы главных подгрупп III–VIII групп;
- $d$-элементы; электронами заполняется $d$-подуровень предвнешнего уровня атома; к $d$-элементам относятся элементы побочных подгрупп I–VIII групп, т.е. элементы вставных декад больших периодов, расположенных между $s-$ и $р-$элементами. Их также называют переходными элементами;
- $f$-элементы; электронами заполняется $f-$подуровень третьего снаружи уровня атома; к ним относятся лантаноиды и актиноиды.
Электронная конфигурация атома. Основное и возбужденное состояние атомов
Швейцарский физик В. Паули в $1925$ г. установил, что в атоме на одной орбитали может находиться не более двух электронов, имеющих противоположные (антипараллельные) спины (в переводе с английского — веретено), т.е. обладающих такими свойствами, которые условно можно представить себе как вращение электрона вокруг своей воображаемый оси по часовой стрелке или против. Этот принцип носит название принципа Паули.
Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны, т.е. электроны с противоположными спинами.
На рисунке показана схема деления энергетических уровней на подуровни.
$s-$Орбиталь, как вы уже знаете, имеет сферическую форму. Электрон атома водорода $(n = 1)$ располагается на этой орбитали и неспарен. По этому его электронная формула, или электронная конфигурация, записывается так: $1s^1$. В электронных формулах номер энергетического уровня обозначается цифрой, стоящей перед буквой $(1…)$, латинской буквой обозначают подуровень (тип орбитали), а цифра, которая записывается справа сверху от буквы (как показатель степени), показывает число электронов на подуровне.
Для атома гелия Не, имеющего два спаренных электрона на одной $s-$орбитали, эта формула: $1s^2$. Электронная оболочка атома гелия завершена и очень устойчива. Гелий — это благородный газ. На втором энергетическом уровне $(n = 2)$ имеются четыре орбитали, одна $s$ и три $р$. Электроны $s$-орбитали второго уровня ($2s$-орбитали) обладают более высокой энергией, т.к. находятся на большем расстоянии от ядра, чем электроны $1s$-орбитали $(n = 2)$. Вообще для каждого значения $n$ существует одна $s-$орбиталь, но с соответствующим запасом энергии электронов на нем и, следовательно, с соответствующим диаметром, растущим по мере увеличения значения $n$.$s-$Орбиталь, как вы уже знаете, имеет сферическую форму. Электрон атома водорода $(n = 1)$ располагается на этой орбитали и неспарен. По этому его электронная формула, или электронная конфигурация, записывается так: $1s^1$. В электронных формулах номер энергетического уровня обозначается цифрой, стоящей перед буквой $(1…)$, латинской буквой обозначают подуровень (тип орбитали), а цифра, которая записывается справа сверху от буквы (как показатель степени), показывает число электронов на подуровне.
Для атома гелия $Не$, имеющего два спаренных электрона на одной $s-$орбитали, эта формула: $1s^2$. Электронная оболочка атома гелия завершена и очень устойчива. Гелий — это благородный газ. На втором энергетическом уровне $(n = 2)$ имеются четыре орбитали, одна $s$ и три $р$. Электроны $s-$орбитали второго уровня ($2s$-орбитали) обладают более высокой энергией, т.к. находятся на большем расстоянии от ядра, чем электроны $1s$-орбитали $(n = 2)$. Вообще для каждого значения $n$ существует одна $s-$орбиталь, но с соответствующим запасом энергии электронов на нем и, следовательно, с соответствующим диаметром, растущим по мере увеличения значения $n$.
$р-$Орбиталь имеет форму гантели, или объемной восьмерки. Все три $р$-орбитали расположены в атоме взаимно перпендикулярно вдоль пространственных координат, проведенных через ядро атома. Следует подчеркнуть еще раз, что каждый энергетический уровень (электронный слой), начиная с $n= 2$, имеет три $р$-орбитали. С увеличением значения $n$ электроны занимают $р$-орбитали, расположенные на больших расстояниях от ядра и направленные по осям $x, y, z$.
У элементов второго периода $(n = 2)$ заполняется сначала одна $s$-орбиталь, а затем три $р$-орбитали; электронная формула $Li: 1s^{2}2s^{1}$. Электрон $2s^1$ слабее связан с ядром атома, поэтому атом лития может легко отдавать его (как вы, очевидно, помните, этот процесс называется окислением), превращаясь в ион лития $Li^+$.
В атоме бериллия Be четвертый электрон также размещается на $2s$-орбитали: $1s^{2}2s^{2}$. Два внешних электрона атома бериллия легко отрываются — $В^0$ при этом окисляется в катион $Ве^{2+}$.
У атома бора пятый электрон занимает $2р$-орбиталь: $1s^{2}2s^{2}2p^{1}$. Далее у атомов $C, N, O, F$ идет заполнение $2р$-орбиталей, которое заканчивается у благородного газа неона: $1s^{2}2s^{2}2p^{6}$.
У элементов третьего периода заполняются соответственно $3s-$ и $3р$-орбитали. Пять $d$-орбиталей третьего уровня при этом остаются свободными:
$↙{11}Na 1s^{2}2s^{2}2p^{6}3s^{1}$,
$↙{17}Cl 1s^{2}2s^{2}2p^{6}3s^{2}3p^{5}$,
$↙{18}Ar 1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}$.
Иногда в схемах, изображающих распределение электронов в атомах, указывают только число электронов на каждом энергетическом уровне, т.е. записывают сокращенные электронные формулы атомов химических элементов, в отличие от приведенных выше полных электронных формул, например:
$↙{11}Na 2, 8, 1;$ $↙{17}Cl 2, 8, 7;$ $↙{18}Ar 2, 8, 8$.
У элементов больших периодов (четвертого и пятого) первые два электрона занимают соответственно $4s-$ и $5s$-орбитали: $↙{19}K 2, 8, 8, 1;$ $↙{38}Sr 2, 8, 18, 8, 2$. Начиная с третьего элемента каждого большого периода, последующие десять электронов поступят на предыдущие $3d-$ и $4d-$орбитали соответственно (у элементов побочных подгрупп): $↙{23}V 2, 8, 11, 2;$ $↙{26}Fr 2, 8, 14, 2;$ $↙{40}Zr 2, 8, 18, 10, 2;$ $↙{43}Tc 2, 8, 18, 13, 2$. Как правило, когда будет заполнен предыдущий $d$-подуровень, начнет заполняться внешний (соответственно $4р-$ и $5р-$) $р-$подуровень: $↙{33}As 2, 8, 18, 5;$ $↙{52}Te 2, 8, 18, 18, 6$.
У элементов больших периодов — шестого и незавершенного седьмого — электронные уровни и подуровни заполняются электронами, как правило, так: первые два электрона поступают на внешний $s-$подуровень: $↙{56}Ba 2, 8, 18, 18, 8, 2;$ $↙{87}Fr 2, 8, 18, 32, 18, 8, 1$; следующий один электрон (у $La$ и $Са$) на предыдущий $d$-подуровень: $↙{57}La 2, 8, 18, 18, 9, 2$ и $↙{89}Ac 2, 8, 18, 32, 18, 9, 2$.
Затем последующие $14$ электронов поступят на третий снаружи энергетический уровень, на $4f$ и $5f$-орбитали соответственно лантоноидов и актиноидов: $↙{64}Gd 2, 8, 18, 25, 9, 2;$ $↙{92}U 2, 8, 18, 32, 21, 9, 2$.
Затем снова начнет застраиваться второй снаружи энергетический уровень ($d$-подуровень) у элементов побочных подгрупп: $↙{73}Ta 2, 8, 18, 32, 11, 2;$ $↙{104}Rf 2, 8, 18, 32, 32, 10, 2$. И, наконец, только после полного заполнения десятью электронами $d$-подуровня будет снова заполняться $р$-под уровень: $↙{86}Rn 2, 8, 18, 32, 18, 8$.
Очень часто строение электронных оболочек атомов изображают с помощью энергетических, или квантовых ячеек — записывают так называемые графические электронные формулы. Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электрон обозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули, согласно которому в ячейке (орбитали) может быть не более двух электронов, но с антипараллельными спинами, и правило Ф. Хунда, согласно которому электроны занимают свободные ячейки сначала по одному и имеют при этом одинаковое значение спина, и лишь затем спариваются, но спины при этом, по принципу Паули, будут уже противоположно направленными.
За это задание ты можешь получить 1 балл. На решение дается около 3 минут. Уровень сложности: базовый.
Средний процент выполнения: 79.2%
Ответом к заданию 1 по химии может быть последовательность цифр, чисел или слов. Порядок записи имеет значение.
Задача 1
1) N 2) S 3) P 4) Se 5) As
Определите, атомы каких из указанных в ряду элементов имеют в возбуждённом состоянии электронную конфигурацию внешнего энергетического уровня ns1np3nd1. Запишите в поле ответа номера выбранных элементов.
Решение
Электронная конфигурация ns1np3nd1 в возбужденном состоянии показывает, что на внешнем слое у атома будет расположено 5 электронов, значит нужны элементы из пятой группы главной подгруппы, таких три: азот, фосфор и мышьяк. Однако атом азота не может переходить в возбужденное состояние, так как на втором энергетическом уровне нет d — подуровня, следовательно, ответ: фосфор и мышьяк.
Ответ: 35
Задача 2
1) Te 2) I 3) O 4) S 5) Sr
Определите, анионы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня 5s25p6. Запишите в поле ответа номера выбранных элементов.
Решение
Анионы образуются из нейтральных атомов неметаллов при присоединении электронов:
$Э^0 + nē = Э^{n–}$
Электронную конфигурацию внешнего энергетического уровня $5s^{2}5p^{6}$ имеет ксенон Xe, который находится в главной подгруппе VIII группы пятого периода, следовательно, анионы с такой электронной конфигурацией могут образовывать атомы неметаллов, находящихся в пятом периоде, т. е. теллур (ответ — 1) и йод (ответ — 2).
Вывод: правильные ответы — 1, 2.
Ответ: 12
Задача 3
1) Al 2) S 3) P 4) Cr 5) Si
Определите, атомы каких из указанных в ряду элементов в основном состоянии во внешнем слое содержат один неспаренный электрон. Запишите в поле ответа номера выбранных элементов.
Решение
Здесь лучше всего расписать конфигурации атомов, но можно и запомнить, что 1 неспаренный электрон на внешнем уровне имеют атомы элементов 1,3 и 7 групп или атомы элементы с провалом электрона. В 3 группе находится алюминий (3s2 3p1), а у хрома имеется провал электрона (3d5 4s1)
Ответ: 14
Задача 4
1) Mg 2) Bi 3) Ba 4) Sr 5) Al
Определите, катионы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня 3s0. Запишите в поле ответа номера выбранных элементов.
Решение
Электронная конфигурация $3s^0$ описывает строение внешнего энергетического уровня, следовательно, элемент имеет три энергетических уровня, то есть находится в третьем периоде. Из предложенных элементов в третьем периоде находятся магний(Mg) и алюминий(Al). Обрати внимание, что речь идет про катионы!
Ответ: 15
Задача 5
1) I 2) N 3) Br 4) P 5) Cl
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns2np3. Запишите в поле ответа номера выбранных элементов.
Решение
Конфигурация внешнего энергетического уровня $ns^{2}np^{3}$ означает, что на внешнем энергетическом уровне атома находится 5 электронов, следовательно, это атом элемента, стоящего в главной подгруппе V группы таблицы Менделеева. Из предложенных элементов в главной подгруппе V группы находятся N и P.
Ответ: 24
Задача 6
1) Bi 2) N 3) Br 4) P 5) Cl
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns2np5. Запишите в поле ответа номера выбранных элементов.
Решение
Электронную конфигурацию $ns^{2}np^{5}$ имеют элементы, которые находятся в 7 группе главной подгруппы, такими элементами являются бром и хлор.
Ответ: 35
Задача 7
1) K 2) S 3) Na 4) Si 5) Se
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns2np4. Запишите в поле ответа номера выбранных элементов.
Решение
Конфигурация внешнего энергетического уровня $ns^{2}np^{4}$ означает, что на внешнем энергетическом уровне атома находится 6 электронов, а заполнение только s и p подуровней указывает на элементы главной подгруппы. Следовательно, это атомы элементов, стоящих в главной подгруппе VI группы таблицы Менделеева. Из предложенных элементов в главной подгруппе VI группы находятся S и Se.
Ответ: 25
Задача 8
1) S 2) Na 3) He 4) Cl 5) Se
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns2np4. Запишите в поле ответа номера выбранных элементов.
Решение
Электронную конфигурацию $ns^{2}np^{4}$ имеют элементы, которые находятся в 6 группе главной подгруппы, такими элементами являются сера и селен.
Ответ: 15
Задача 9
1) Mg 2) Al 3) Sb 4) N 5) Bi
Определите, катионы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня 3s0. Запишите в поле ответа номера выбранных элементов.
Решение
Конфигурация внешнего энергетического уровня КАТИОНА $3s^0$ означает, что данный элемент, образующий такой катион, имеет три энергетических уровня, следовательно, в таблице Менделеева находится в III периоде. Из представленных элементов в III периоде находятся Mg и Al.
Ответ: 12
Задача 10
1) Cu 2) Te 3) Se 4) Ag 5) O
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns1(n–1)d10. Запишите в поле ответа номера выбранных элементов.
Решение
Элементы с такой конфигурацией должны находиться в побочной подгруппе, поскольку заполняется d подуровень ( произошел перескок электрона в связи с устойчивостью полностью заполненного d подуровня), поскольку внешних электронов 1, то группа первая. Ищем элементы I группы побочной подгруппы.
Ответ: 14
Задача 11
1) Ti 2) Cl 3) Zr 4) I 5) F
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию энергетического уровня ns2(n–1)d2. Запишите в поле ответа номера выбранных элементов.
Решение
Электронная конфигурация $ns^{2}(n–1)d^2$ указывает на то, что перед нами d-элемент, а значит, находится в побочной подгруппе. Галогены Cl, I и F находятся в главной подгруппе VII группы, а титан Ti и цирконий Zr — в побочной подгруппе IV группы, имеют 2 электрона на внешнем энергетическом слое.
Ответ: 13
Задача 12
1) S 2) K 3) O 4) Te 5) Na
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns1. Запишите в поле ответа номера выбранных элементов.
Решение
Электронную конфигурацию внешнего энергетического уровня $ns^1$ имеют элементы главной подгруппы I группы. Из представленных к ним относятся калий К и натрий Na.
Ответ: 25
Задача 13
1) N 2) S 3) P 4) Se 5) As
Определите, атомы каких из указанных в ряду элементов имеют в возбуждённом состоянии электронную конфигурацию внешнего энергетического уровня ns1np3nd1. Запишите в поле ответа номера выбранных элементов.
Решение
Электронная конфигурация внешнего энергетического уровня $ns^1np^3nd^1$ означает, что на нём находится 5 электронов (в возбуждённом состоянии количество электронов не отличается от основного состояния), следовательно, элемент находится в V группе Периодической таблицы. Из предложенных элементов в главной подгруппе V группы находятся N, P и As, но азот не имеет d- подуровня, поэтому не может иметь такую конфигурацию внешнего энергетического уровня.
Ответ: 35
Задача 14
1) Mg 2) Cl 3) S 4) Br 5) Ca
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns2np5. Запишите в поле ответа номера выбранных элементов.
Решение
Электронная конфигурация внешнего энергетического уровня $ns^{2}np^{5}$ свидетельствует о наличии на внешнем энергетическом слое 7 электронов, следовательно, искать нужно элементы VII группы, к ним относятся Cl и Br.
Ответ: 24
Задача 15
1) Te 2) Be 3) I 4) Ba 5) Sr
Определите, катионы каких из указанных в ряду элементов могут иметь электронную конфигурацию внешнего энергетического уровня 5s2. Запишите в поле ответа номера выбранных элементов.
Решение
Электронная конфигурация $5s^2$ у катиона(!) показывает, что на внешнем слое было как минимум 3 электрона (часть от отдал, чтобы стать катионом), при этом внешний слой – пятый. Поэтому из всех элементов выбираем те, которые находятся в 5 периоде и в группах от третьей и дальше. Таких элементов два: теллур и иод, которые в степени окисления +4 и +5, соответственно, будут иметь конфигурацию $5s^2$.
Ответ: 13
Задача 16
1) Li 2) Se 3) K 4) S 5) Cs
Определите, атомы каких из указанных в ряду элементов в возбуждённом состоянии могут иметь электронную конфигурацию ns2np3nd1. Запишите в поле ответа номера выбранных элементов.
Решение
Электронная конфигурация $ns^{2}np^{3}nd^{1}$ говорит о наличии шести электронов на последнем энергетическом слое атома. В возбуждённом состоянии электроны переходят на другой энергетический подуровень, но количество их не меняется, поэтому оно равно номеру группы, следовательно, подходят элементы шестой группы — селен и сера.
Ответ: 24
Задача 17
1) O 2) S 3) N 4) Te 5) P
Определите, анионы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня 3s23p6. Запишите в поле ответа номера выбранных элементов.
Решение
Электронная конфигурация $3s^{2}3p^6$ описывает строение внешнего энергетического уровня, следовательно, элемент имеет 3 энергетических уровня, то есть находится в третьем периоде. Из предложенных элементов в третьем периоде находятся фосфор (P) и сера (S). Фосфор принимает 3 электрона, чтобы образовать анион P$^{3-}$, а сера принимает 2 электрона, чтобы образовать анион S$^{2-}$
Ответ: 25
Задача 18
1) Ga 2) S 3) B 4) In 5) Se
Определите, атомы каких из указанных в ряду элементов в возбуждённом состоянии имеют электронную конфигурацию внешнего энергетического уровня ns1np3nd2. Запишите в поле ответа номера выбранных элементов.
Решение
Электронная конфигурация $ns^1np^3nd^2$ в возбужденном состоянии показывает, что на внешнем слое у атома будет расположено 6 электронов, значит нужны элементы из шестой группы главной подгруппы, таких два: сера и селен.
Ответ: 25
Задача 19
1) As 2) Cr 3) Na 4) V 5) Sc
Определите, атомы каких из указанных в ряду элементов имеют 1 неспаренный электрон во внешнем слое в основном состоянии. Запишите в поле ответа номера выбранных элементов.
Решение
Для определения количества неспаренных электронов на внешнем слое нужно представить электронную конфигурацию атома. Атом натрия находится в 3 периоде, поэтому имеет 3 слоя. Всего он имеет 11 электронов, поэтому на последнем слое атом натрия имеет один неспаренный электрон. Атом хрома находится в 4 периоде, он имеет 4 слоя, 3d подуровень заполняется после 4s, но у хрома происходит провал электрона, один электрон с 4s падает на 3d, чтобы быть более энергетически устойчивым, так как в таком случае атом не будет иметь пустых орбиталей на 3d. У мышьяка 3 неспаренных электрона на внешнем слое. У скандия и ванадия их нет.
Ответ: 23
[su_box title=”Описание задания” style=”soft” box_color=”#c1e8cc” title_color=”#0c0a0a”]
В Задании №1 нам необходимо уметь хорошо пользоваться таблицей Менделеева. Первое задание – это поиск атома или иона с заданной конфигурацией электронов, обычно это количество электронов на внешнем уровне (соответствует номеру группы).
Тематика заданий: электронная конфигурация атомов
Бал: 1
Сложность задания: ♦◊◊
Примерное время выполнения: 1 мин.
[/su_box]
Вариант 1ЕХ1
[su_note note_color=”#defae6″]
Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне пять электронов.
- P
- N
- S
- Al
- O
[/su_note]
Данный пример – типичный вариант первого задания – необходимо определить количество электронов на внешнем уровне. Вспоминаем, что на количество электронов на внешнем уровне указывает номер ГРУППЫ:
Напомню, что нам важно обращать внимание на то, в главной или побочной группе находится элемент. К сожалению, в таблице, которая дана на ЕГЭ нет деления на главные или побочные группы (какие-то элементы пишут правее, какие-то левее, но это не деление на главные и побочные группы), данная таблица не удобна, однако, по правилам можно пользоваться только ей. Обсуждать недостатки данной таблицы мы не будем, скажем лишь, что в условиях задания представлены всегда элементы главных групп, поэтому данный вопрос отпадает сам собой на экзамене (но нет гарантий, что не могут дать определить количество внешних электронов у кобальта, например, по номеру группы в данной таблице это не определишь).
Итак, находим наши пять элементов из условия:
Определяем номер группы – у алюминия 3 группа, у азота и фосфора – пятая, у кислорода и серы – шестая.
В условии нас спрашивают про пять электронов – значит выбираем элементы из пятой группы – азот и фосфор!
Ответ: 12
Вариант 1ЕХ2
[su_note note_color=”#defae6″]
Определите, двум атомам каких из указанных элементов до завершения внешнего уровня не хватает шести электронов.
- Ba
- At
- Bi
- Mg
- Cs
[/su_note]
Данное задание немного другого типа, в нем необходимо определить элементы, которым не хватает какого-то количества электронов до завершения внешнего уровня. В этом случае наш алгоритм прост: мы знаем, что на внешнем уровне должно быть 8 электронов (2 и 3 период, или главные группы 4,5,6.. – в заданиях в основном фигурируют именно эти элементы), а значит вычитаем из 8 заданное число – в нашем случае 6: 8-6=2. Значит, в нашем элементе должно быть два электрона на внешнем уровне и, следовательно, расположен он во второй группе. Определяем группы элементов из условия:
В данном случае элементы второй группы – магний и барий.
Ответ: 14
Вариант 1ЕХ3
[su_note note_color=”#defae6″]
Определите, атомы каких двух из указанных в ряду элементов в основном состоянии содержат один неспаренный электрон.
- S
- Na
- Al
- Si
- Mg
[/su_note]
Следующий вид задания на поиск элементов с неспаренным электроном. Тут все достаточно просто. Так как электроны у нас в орбиталях всегда располагаются по парам (если помните, то есть квадратик, в котором мы рисуем стрелочку вверх и низ), то логично, что неспаренный электрон образуется, когда количество электронов на внешнем уровне нечетно, то есть в элемент должен быть расположен в нечетной группе, а именно 1,3,5,7. Определяем группы указанных нам элементов:
Итак, натрий в первой группе, магний во второй, алюминий в третьей, кремний в четвертой, а сера в шестой.
Выбираем элементы в нечетных группах – это натрий и алюминий!
Ответ: 23
Вариант 1ЕХ4
[su_note note_color=”#defae6″]
Определите, атомы каких двух из указанных в ряду элементов в основном состоянии содержат два неспаренных электрона.
- S
- Mg
- C
- B
- Li
[/su_note]
В данном задании нужно найти два неспаренных электрона. Данное распределение можно найти, начиная с p-подуровня, а именно два неспаренных электрона образуются в четвертой группе, так как на s -подуровне два электрона + 2 должно быть на p-подуровне, и в шестой группе, где 2s+2p(спаренные)+2p(неспаренные) (так как в p-подуровне три орбитали по два электрона на каждой). Таким образом нужно найти элементы четвертой группы или шестой:
В нашем случае это углерод и сера.
Ответ: 13
Вариант 1ЕХ5
[su_note note_color=”#defae6″]
Определите, какие два из указанных элементов образуют устойчивый положительный ион, содержащий 10 электронов.
- Na
- K
- N
- Li
- Al
[/su_note]
В данном варианте задания речь идет уже об ионе, причем положительном, который содержит 10 электронов. В такого вида заданиях необходимо определить, сколько заполнено уровней у иона в зависимости от количества электронов. В нашем случае 10 электронов – это полностью заполненные первый (2) и второй (8) уровни (или периоды в таблице). Так мы говорим о положительном ионе – значит элемент потерял электроны, но у него их было больше чем 10, а значит, он расположен в третьем периоде. Ищем такие элементы:
Нам подходят натрий и алюминий.
Ответ: 15
Вариант 1ЕХ6
[su_note note_color=”#defae6″]
Определите, какие из указанных элементов образуют устойчивый отрицательный ион, содержащий 18 электронов.
- N
- Al
- S
- Cl
- Ca
[/su_note]
Отрицательный ион получается путем добавления электронов к атому. 18 электронов – это полностью заполненный третий уровень или период, значит, наши элементы расположены именно в нем (в отличии от предыдущего задания, где мы искали в следующем периоде, так как ион положительный). Смотрим на предоставленные в условии элементы:
В данном случае в третий период попали алюминий, сера и хлор. Алюминий не может принять электроны до 18, так как является металлом и отдает электроны. Наиболее типичные элементы-любители электронов расположены правее. Это сера и хлор для данного задания.
Ответ: 34
Вариант 1ЕХ7
[su_note note_color=”#defae6″]
Определите, какие из указанных элементов на внешнем уровне содержат больше s-электронов, чем p-электронов (в основном состоянии).
- H
- C
- F
- Be
- P
[/su_note]
Такие виды заданий часто встречаются в тренировочных вариантах, нужно либо определить кого меньше, когда равно или кого больше. Разберем для наглядности данный пример. s-электронов всего два, значит p-электронов должно быть 1, чтобы было меньше. В сумме у элемента на внешнем уровне получается максимум 3 электрона (но может быть и ноль p-электронов и один или два s!), а значит он в третьей, второй или первой группе:
Нам подходит водород и бериллий.
Ответ: 14.
Остальные задания очень похожи на разобранные, поэтому вы их точно сможете решить, разобравшись с выше представленными решениями.
Даниил Романович | Просмотров: 16.5k
ЗАНЯТИЕ 1. СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКИЙ ЗАКОН
А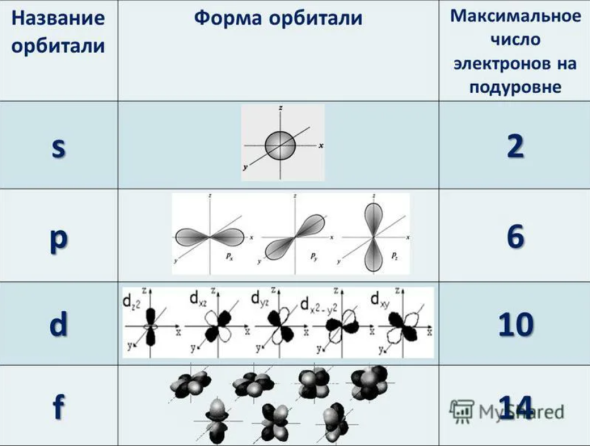
КАК ЗАПОЛНЯЮТСЯ ОРБИТАЛИ?
Э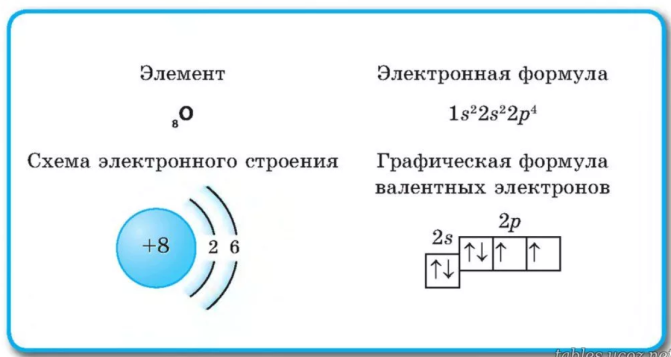
-
Принцип минимума энергии. Электрон «стремится» занять положени в атоме с наименьшей энергией. То есть электроны сначала «заселяют» низкоэнергетические орбитали. Рейтинг желаемых орбиталей выглядит так: 1s22s22p63s23p64s23d104p65s24d105р66s25d14f14…
Как будто электроны сначала выбирают малозаселённые этажи с небольшим количеством квартир. -
Принцип Паули. В атоме не может быть двух электронов с одинаковыми свойствами. То есть на каждой орбитали может находиться либо один неспаренный электрон, либо два электрона с разными спинами. Это похоже на дорогу с двусторонним движением: либо едет один автомобиль, либо два, но навстречу друг другу.
-
Правило Хунда. Наиболее устойчивое (основное) состояние атома достигается тогда, когда на одном уровне находится как можно больше неспаренных электронов. Можно провести такую аналогию: электроны сначала селятся по одному, а потом ищут себе пару.


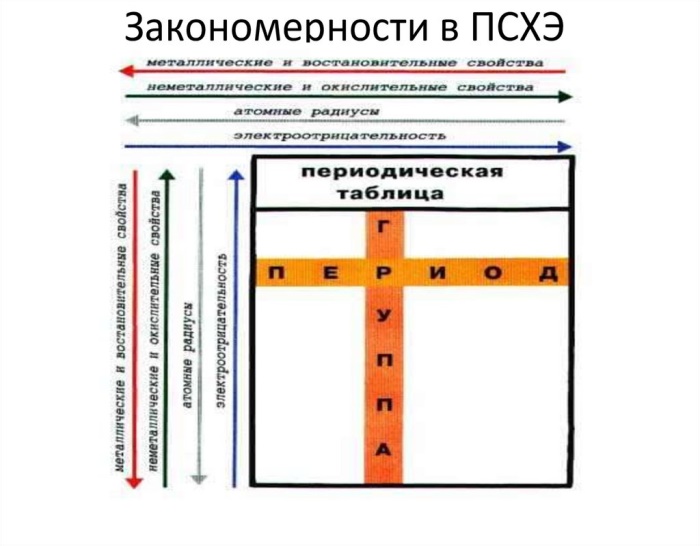
ЗАНЯТИЕ 2. ИЗМЕНЕНИЕ СВОЙСТВ В ПЕРИОДАХ И ГРУППАХ
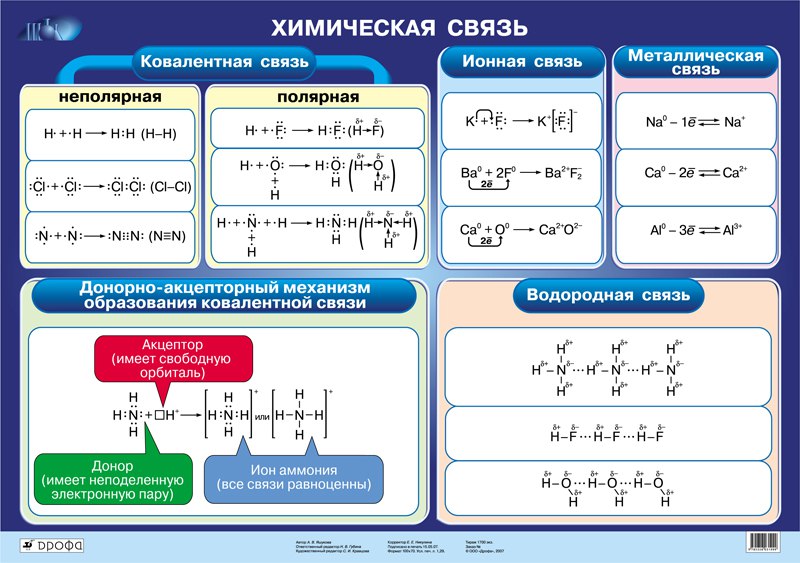
ЗАНЯТИЕ 3. ТИПЫ ХИМИЧЕСКИХ СВЯЗЕЙ

ЗАНЯТИЕ 4. КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ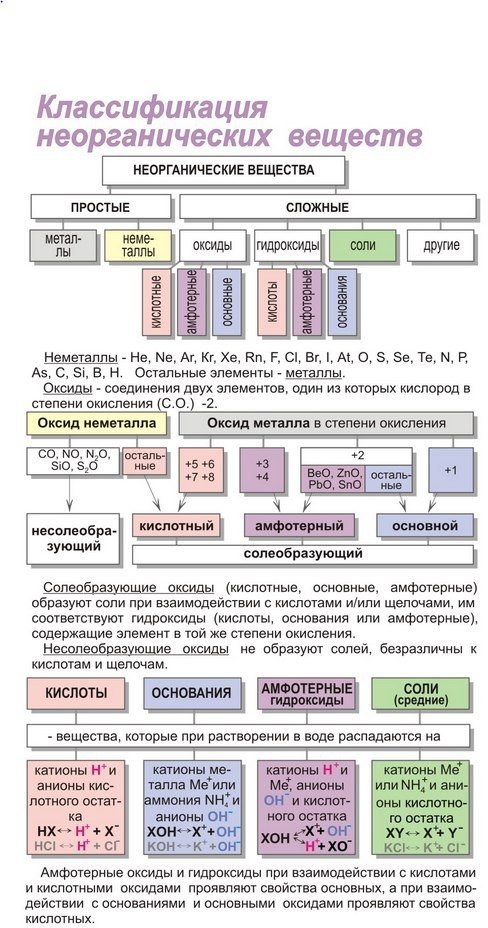

ЗАНЯТИЕ 5. ОКСИДЫ И ОСНОВАНИЯ. ИХ СВОЙСТВА И СПОСОБЫ ПОЛУЧЕНИЯ
Общие методы получения оксидов:
-
Окисление простых и сложных веществ кислородом:

ОСНОВНЫЕ ОКСИДЫ

+ кислотный оксид
Основный оксид + кислота = соль (ПРИ НАГРЕВАНИИ!)
+ амфотерный оксид
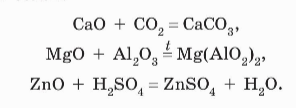
Оксиды щелочных и щелочноземельных металлов реагируют с водой с образованием оснований:


Ниже приведен подробный разбор демоверсии ЕГЭ-2023 по химии, проектная версия. Задания разобраны от 1 до 34 подряд, приведена логика рассуждения по каждому из них. Если есть желание разобраться более детально, то переходите по ссылкам в тексте или записывайтесь к нам на курс.
Для выполнения первого задания всегда рекомендую расписать электронно-графические формулы элементов (с ячейками). В большинстве случаев достаточно изобразить внешний и предвнешний уровень. Напомню также, что для элементов дальше IV периода не нужно изображать формулу целиком, а можно воспользоваться аналогией строения валентных подуровней с соседом из подгруппы. По приведенным элементам:
- Цезий находится в первой группе, главной подгруппе, аналог натрия по строению внешнего уровня. Имеет 1 электрон на 6s-подуровне, он же является неспаренным.
- Углерод находится в четвертой группе, главной подгруппе. На внешнем уровне имеет 4 электрона, из них неспаренных два, которые находятся на 2р-подуровне.
- Кислород находится в шестой группе, главной подгруппе. На внешнем уровне имеет 6 электронов, из них неспаренных два, которые находятся на 2р-подуровне.
- Хром находится в шестой группе, побочной подгруппе. Необходимо вспомнить о проскоке электрона, за счет которого на внешнем уровне, 4s-подуровне, имеет 1 электрон, а не предвнешнем, 3d-подуровне, – пять. Итого 6 неспаренных.
- Азот находится в пятой группе, главной подгруппе. На внешнем уровне имеет 5 электронов, из них неспаренных три, которые находятся на 2р-подуровне.
Выбираем углерод и кислород, у обоих по два неспаренных электрона.
Ответ: 23
Необходимо вспомнить, что к р-элементам можно отнести элементы главных подгрупп шести последних групп в периоде. Представители первых двух относятся к s-элементам, а элементы побочных подгрупп относим к d-элементам. Исходя из приведенных соображений, выбираем пункты 2), 3), 5).
Атомный радиус уменьшается направо по периоду, поэтому располагаем выбранные ранее элементы в порядке 2), 5), 3).
Ответ: 253
Для выполнения такого рода заданий рекомендую выписать на лист бумаги высшую и низшую степени окисления для каждого из элементов.
- Цезий имеет высшую степень окисления +1, низшую – 0. Разность 1.
- Углерод имеет высшую степень окисления +4, низшую – -4. Разность 8.
- Кислород имеет высшую степень окисления +2, низшую – -2. Разность 4.
- Хром имеет высшую степень окисления +6, низшую – 0. Разность 6.
- Азот имеет высшую степень окисления +5, низшую – -3. Разность 8.
Таким образом, выбираем углерод и азот.
Ответ: 25
В задании, по сути, есть два фильтра: по типу строения и по характеру связи. Начнем с типа строения. Поскольку необходимо выбрать вещества молекулярного строения, то сразу можно исключить соли и иные соединения, имеющие ионные связи. Убираем из рассмотрения пункты 1) и 4). Среди оставшихся нужно найти вещества с ковалентной полярной связью. Вспомним, что такая связь может возникать между атомами разных неметаллов (или сильно различающихся фрагментов в органических молекулах). По такому принципу можно исключить пункт 5). Остаются вещества 2) и 3).
Ответ: 23
К двухосновным кислотам относятся те из них, которые содержат в молекуле 2 атома водорода, способных замещаться на катионы металлов. Подобным требованиям отвечает сернистая кислота, пункт 4).
К средним можно отнести соли, не содержащие способных к замещению атомов водорода, фрагментов ОН, комплексных ионов и подобного. Из приведенного списка можно взять аммиачную селитру, тривиальное название нитрата аммония.
К амфотерным гидроксидам можно отнести гидроксиды металлов в степенях окисления +3 и +4, также гидроксиды бериллия, цинка, свинца, олова. Подойдет пункт 2).
Ответ: 482
Попробуем найти в приведенном списке сильные кислоты. Пункт 1) подходит, поскольку в пункте 3) находится слабая кислота. Таким образом X уже установлен.
Среди оставшихся пунктов нужно найти вещество, которое при добавлении вызовет растворение гидроксида алюминия. Поскольку гидроксид является амфотерным, то сможет прореагировать с кислотой, кроме наиболее слабых, или щелочью. Среди приведенных соединений можно взять 4), поскольку гидроксид калия является щелочью.
Ответ: 14
Для выполнения подобных заданий советую следующий порядок действий:
- Берем вещество из левого столбика
- Классифицируем его, вспоминаем характерные типы реакций для такого класса соединений
- Оцениваем его с точки зрения кислотно-основных и окислительно-восстановительных свойств
- Подбираем вещества и правого столбика, противоположные по свойствам и способные реагировать с веществом из правого столбика
Пункт А):
Сера относится к простым веществам-неметаллам, средняя по активности. Способна вступать в реакцию со щелочами, сильными окислителями и активными восстановителями. С водой и кислотами, кроме кислот-окислителей, реакции нет.
В пункте 1) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 2) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 3) водород выступит против серы в качестве восстановителя, хлор и кислород – окислители. Подходит.
В пункте 4) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 5) нет реакции уже с первым веществом, дальше не продолжаем.
Пункт Б):
Оксид серы (VI) относится к кислотным оксидам, реагирует с водой, большинством веществ основной и амфотерной природы. Восстановительных свойств не проявляет, может быть окислителем.
В пункте 1) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 2) оксид бария – основный, КОН – щелочь, с водой реакция тоже есть. Подходит.
В пункте 3) хлор и кислород – окислители, не подходит.
В пункте 4) нет реакции с уксусной кислотой, не подходит.
В пункте 5) нет реакции уже со вторым веществом, дальше не продолжаем.
Пункт В):
Гидроксид цинка относится к амфотерным гидроксидам, может реагировать со щелочами, кислотами. Выраженных окислительных или восстановительных свойств не проявляет. В воде нерастворим, с солями не обменивается.
В пункте 1) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 2) нет реакции с водой, не подходит.
В пункте 3) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 4) реагирует с кислотами и щелочью. Подходит.
В пункте 5) нет реакции с хлоридом бария, не подходит.
Пункт Г):
Бромид цинка относится к солям, может вступать в реакции обмена со щелочами и солями. Может проявлять восстановительные свойства за счет бромид-иона.
В пункте 1) обмен имеет смысл с первым и вторым веществам, с третьим будет ОВР. Подходит.
В пункте 2) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 3) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 4) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 5) нет реакции уже с первым веществом, дальше не продолжаем.
Ответ: 3241
Для ответа на вопрос имеет смысл оценить свойства веществ в каждой паре, а при необходимости записать уравнение реакции между ними. Сделаем и то, и другое.
В пункте А) магний является сильным восстановителем, а концентрированная серная кислота – окислителем. Магний способен восстановить серу до низшей степени окисления:
4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O
В пункте Б) встречаются основный оксид и кислота, произойдет обмен:
MgO + H2SO4 = MgSO4 + H2O
В пункте В) сера выступает в качестве восстановителя, а концентрированная серная кислота – окислитель. Произойдет ОВР:
S + 2H2SO4 = 3SO2 + 2H2O
В пункте Г) сероводород выступает в качестве восстановителя, а кислород – окислитель. Произойдет ОВР:
2H2S + 3O2 = 2SO2 + 2H2O
Ответ: 5144
Обратим внимание, что железо в одну стадию переходит в степень окисления +3. Для этого нам нужен сильный окислитель- хлор.
2Fe + 3Cl2 = 2FeCl3
Во второй реакции железо понижает степень окисления до +2, поэтому необходимо найти восстановитель. Им тут может быть только йодид калия.
2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl
Ответ: 43
Для установления соответствия имеет смысл найти в структурах из левого столбика характерные функциональные группы и фрагменты.
В структуре А) видим фрагмент -NH-, который можно отнести ко вторичному амину. Циклическая структура молекулы в данном случае ничего не значит.
В структуре Б) есть аминогруппа и карбоксильная группа. Соответственно, вещество можно отнести к аминокислотам.
В структуре В) есть структурный фрагмент -С(О)NH- и просматриваются два остатка от аминокислот, что указывает на дипептид.
Ответ: 231
К решению подобных заданий может быть несколько подходов. Можно для начала определить молекулярную формулу бутена-1, а затем сравнить ее с молекулярными формулами предложенных вариантов. Изомеры по определению должны иметь одинаковые молекулярные формулы.
Бутен-1 – С4Н8
- С4Н10
- С4Н8
- С4Н6
- С4Н6
- С4Н8
Ответ: 25
Поскольку подкисленный раствор перманганата проявляет сильные окислительные свойства, следует поискать вещества, которые могут окисляться с образованием карбоновой кислоты. Прокомментируем все предложенные пункты:
- Окисляется с разрывом кратной связи, кислота будет
- Не окисляется
- Окисляется по боковой цепи, кислота будет
- Не окисляется
- Окисляется до кислоты
Ответ: 135
Метиламин относится к первичным алифатическим аминам, проявляет выраженные основные свойства, вступает в реакции алкилирования, реагирует с азотистой кислотой. Прокомментируем все предложенные пункты:
- Алкан, низкая активность, реакции нет
- Хлоралкан, реакция алкилирования, реагирует
- Водород, гидрировать нечего, не реагирует
- Основание, не реагирует
- Кислота, образование соли, реагирует
Ответ: 25
Для решения имеет смысл записать классы соединений из левого столбика, далее оценить происходящие изменения:
А) 1,2-дигалогеналкан – алкен
Б) моногалогеналкан – алкен
В) моногалогеналкан – алкан
Г) 1,2-дигалогеналкан – алкин
По изменениям назвать тип происходящей реакции и подобрать к ней подходящий реагент:
А) дегалогенирование, магний
Б) дегидрогалогенирование, спиртовой раствор щелочи
В) реакция Вюрца, натрий
Г) дегидрогалогенирование, спиртовой раствор щелочи
Ответ: 1252
Для надежности перед выбором ответа имеет смысл преобразовать названия веществ в формулы и прописать предложенные реакции. Попробуем это сделать:
А) 2CH3COOH + Na2S = 2CH3COONa + H2S
Б) HCOOH + NaOH = HCOONa + H2O
В) HCOH + 4Cu(OH)2 = 2Cu2O + CO2 + 5H2O
Г) 2CH3CH2OH + 2Na = 2CH3CH2ONa + H2
Ответ: 5462
При рассмотрении цепочек превращений бывает полезно посмотреть через одну стадию и оценить, как можно осуществить такое превращение. Также очень полезно сравнить число атомов углерода в исходной молекуле и продукте, может навести на мысль.
В первых двух реакциях цепочки число атомов углерода удваивается, что наводит на мысль о реакции Вюрца. Если рассуждение верное, то веществом Х должен быть галогеналкан. Действительно, его можно получить в одну стадию из спирта, а затем превратить в алкан.
Следующее превращение можно понять, если посмотреть на условия реакции. Нагревание линейного алкана в присутствии хлорида алюминия приводит к его изомеризации в разветвленный алкан.
Ответ: 54
Для решения можно переписать вещества в парах в виде формул, оценить их окислительно-восстановительные свойства и возможность реакции между ними:
- K2S – восстановитель, KMnO4 – окислитель, имеет смысл
- H2SO4 – окислитель, NaCl – очень слабый восстановитель, не ОВР
- NH4Cl – очень слабый восстановитель, NaNO2 – окислитель, специфический случай обмена, сопровождаемого ОВР
- SiO2 – выраженных окислительно-восстановительных свойств не проявляет, Na2CO3 — выраженных окислительно-восстановительных свойств не проявляет, не ОВР
- HI – восстановитель, Na2Cr2O7 – сильный окислитель, имеет смысл
Для надежности можно записать уравнения реакций между ними:
- 2KMnO4 + 3K2S + 4H2O = 2MnO2 + 3S + 8KOH
- NaCl + H2SO4 = NaHSO4 + HCl
- NaNO2 + NH4Cl = NaCl + N2 + 2H2O
- Na2CO3 + SiO2 = Na2SiO3 + CO2
- Na2Cr2O7 + 14HI = 2NaI + 2CrI3 + 3I2 + 7H2O
Ответ: 135
Изменение давления не будет влиять на скорость реакций, в которых нет газообразных реагентов. Среди приведенных пунктов это будут 2), 3), 5).
Ответ: 235
Для решения подобных заданий нужно расставить степени окисления на атомах азота до и после реакции.
Если степень не меняется, то азот не проявляет окислительно-восстановительных свойств. Так будет в пункте А) (переход -3 в -3).
Если степень увеличится, то азот проявляет восстановительные свойства. Так будет в пунктах Б) (переход -3 в 0) и В) (переход -3 в +2).
Ответ: 422
В первом случае для решения необходимо вспомнить зависимость продуктов электролиза от состава соли:
А) соль образована катионом активного металла и кислородсодержащим анионом, на электродах выделятся водород и кислород.
Б) соль образована катионом активного металла и галогенид-ионом, на электродах выделятся водород и галоген.
В) соль образована катионом малоактивного металла и галогенид-ионом, на электродах выделятся металл и галоген.
Ответ: 342
Во втором случае нужно помнить, что алюминий получают при электролизе раствора оксида в расплаве криолита. Калий и подобные наиболее активные металлы только из расплавов галогенидов. Кислород в данном случае можно получить при электролизе водного раствора фторида калия.
Ответ: 124
Для начала имеет смысл определить класс каждого из соединений:
- Средняя соль
- Средняя соль
- Средняя соль
- Сильная кислота
Исходя из этого уже можно сказать, что наиболее низкое значение рН (самая кислая среда) будет в пункте 4).
Как разобраться с солями? Нужно оценить их способность к гидролизу и потенциальное влияние на среду раствора:
- Соль сильной кислоты и сильного основания, не гидролизуется, среда нейтральная
- Соль слабого основания и сильной кислоты, гидролиз по катиону, среда кислая
- Соль сильного основания и слабой кислоты, гидролиз по аниону, среда щелочная
Ответ: 4213
В задании на равновесие следует учитывать разные факторы. Пройдем по каждому из пунктов:
А) кислота при диссоциации может дать дополнительное количество ионов Н+, которые участвуют в равновесии. При увеличении их концентрации равновесие сместится в сторону обратной реакции.
Б) давление в данном случае не окажет влияния, поскольку нет участников-газов
В) повышение температуры сместит равновесие в сторону эндотермической реакции. В данном случае – прямой.
Г) твердая щелочь может раствориться и прореагировать с Н+, уменьшая концентрацию таких ионов в системе. Равновесие сместится в сторону прямой реакции.
Ответ: 2311
Задания подобного типа удобнее всего решать с помощью таблицы. Данный подход к решению задания ЕГЭ-2023 на равновесие в реакторе можно посмотреть по ссылке ниже:
Способ, на мой взгляд, наиболее оптимальный и доступный каждому.
Ответ: 25
В первом случае нужно подобрать такое вещество из правого столбика, которое реагирует с одним или двумя веществами из пары в левом столбике. При этом очень важно, чтобы реакция сопровождалась видимыми признаками:
Пара А):
- Есть реакция с азотной кислотой, сопровождается выделением газа и растворением твердого вещества. Нитрат натрия не реагирует. Подходит.
- Есть реакция с азотной кислотой, но внешних признаков нет. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
Пара Б):
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Есть реакция с гидроксидом калия, но внешних признаков нет. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Есть реакция с гидроксидом натрия, сопровождается образованием осадка. Хлорид калия не реагирует. Подходит.
Пара В):
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Есть реакция с хлоридом бария, сопровождается образованием осадка. Хлорид натрия не реагирует. Подходит.
Пара Г):
- Нет реакции ни с одним веществом из пары. Не подходит.
- Специфический случай, поскольку один из изначально образовавшихся нерастворимых гидроксидов (Al(OH)3) может раствориться снова при избытке щелочи. Подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
В заданиях второго типа имеет смысл записать происходящие реакции и попытаться себе их представить. Как может выглядеть и что увидим:
- 2CH3CH2COOH + 2Li = 2CH3CH2COOLi + H2
- 2CH3CH(OH)CH3 + 2K = 2CH3CH(OK)CH3 + H2
- Zn(OH)2 + 2CH3COOH = Zn(CH3COO)2 + 2H2O
- C2H2 + 2Br2 = CHBr2-CHBr2
В первом и втором случаях наблюдаем выделение газообразного водорода. В третьем наблюдаем растворение осадка гидроксида цинка. В четвертом исчезнет окраска брома, наблюдается обесцвечивание.
Ответ: 4415
Задание 25 охватывает несколько совершенно разнородных тем, каждая из которых требует отдельного блока знаний. Приведу здесь ссылки на полезные материалы по заданию, поскольку многое здесь нужно просто выучить.
По первому блоку следует знать, что сопряженные алкадиены используются для производства каучуков, а алкены – пластмасс. Метан в составе природного газа используют в качестве топлива.
По второму блоку можно относительно легко соотнести мономер и полимер, если представить себе структуру молекулы мономера. В молекуле этена всего два атома углерода, поэтому элементарное звено формулы полимера тоже содержит два атома углерода. По той же логике здесь можно действовать и для пропена с дивинилом.
Третий блок нужно просто выучить. По переработке углеводородов можно заглянуть сюда. Хорошее описание технологических процессов можно посмотреть здесь.
Ответ: 234; 214; 312
Для решения подобных заданий на растворы рекомендую использовать метод таблиц, подробно описанный здесь.
В итоге решение задачи сводится к уравнению вида
(15+х)/(150+х) = 0,12
15+х = 18+0,12х
0,88х = 3
х = 3,4
Ответ: 3,4 г
Задания такого типа сводятся к решению пропорции. Для начала переведем известный объем аммиака в количество:
n(NH3) = V(NH3)/Vm = 0,56/22,4 = 0,025 (моль)
2 моль – 92 кДж
0,025 моль – х кДж
х = 1,15 кДж
Ответ: 1,15 кДж
Для решения первой задачи запишем уравнение протекающей реакции:
CaCO3 + 2HNO3 = Ca(NO3)2 + CO2 + H2O
Далее вычислим количество нитрата кальция:
n(Ca(NO3)2) = m(Ca(NO3)2)/M(Ca(NO3)2) = 196800/164 = 1200 (моль)
Вычислим массу чистого карбоната кальция, который содержался в известняке:
m(CaCO3) = n(Ca(NO3)2)·M(Ca(NO3)2) = 1200·100 = 120000 (г) = 120 (кг)
Вычислим массу примесей в известняке:
m(примеси) = m(известняка) – m(CaCO3) = 150 — 120 = 30 (кг)
Определим массовую долю примеси в известняке:
ω(примеси) = m(примеси)/m(известняка)·100% = 30/150·100% = 20%
Ответ: 20%
Для решения второй задачи запишем уравнение протекающей реакции:
3С2Н2 = С6Н6
Вычислим количества ацетилена и практически полученного бензола:
n(С2Н2) = V(С2Н2)/Vm = 26,88/22,4 = 1,2 (моль)
n(С6Н6 практ.) = m(С6Н6)/M(С6Н6) = 23,4/78 = 0,3 (моль)
Вычислим теоретически возможное количество бензола и сравним его с практическим:
n(С6Н6 теор.) = n(С2Н2)/3 = 1,2/3 = 0,4 (моль)
η(С6Н6) = n(С6Н6 практ.)/n(С6Н6 теор.)·100% = 0,3/0,4·100% = 75%
Ответ: 75%
При выполнении заданий 29 и 30 имеет смысл записать все представленные вещества в виде молекулярных формул:
KMnO4, NaHCO3, Na2SO3, BaSO4, KOH, H2O2
Далее следует внимательно прочитать описание реакции. Поскольку должно происходить изменение цвета раствора, нужно найти окрашенный реагент. Из предложенных это может быть только KMnO4. Это вещество проявляет сильные окислительные свойства, поэтому нужно подобрать восстановитель. Осадка в ходе реакции образоваться не должно, поэтому брать нейтральную среду нельзя. В противном случае выпадет осадок MnO2. Среда может быть кислой или щелочной. Кислоты в предложенном наборе нет, поэтому выберем гидроксид калия для создания среды. Восстановителей в предложенном наборе два: сульфит натрия и пероксид водорода. Пероксид брать нельзя, поскольку по описанию реакции газа образоваться не должно. Таким образом приходим к выводу, что нужно взять сульфит, перманганат и щелочь. Приведем соответствующую реакцию и электронный баланс:
2KMnO4 + Na2SO3 + 2KOH = 2K2MnO4 + Na2SO4 + H2O
2∙ | Mn+7 + 1ē → Mn+6
1∙ | S+4 – 2ē → S+6
марганец в степени окисления +7 (или перманганат калия) является окислителем.
сера в степени окисления +4 (или сульфит натрия) – восстановителем.
Есть хороший инструмент для отработки данного задания, рекомендую.
При выполнении заданий 29 и 30 имеет смысл записать все представленные вещества в виде молекулярных формул:
KMnO4, NaHCO3, Na2SO3, BaSO4, KOH, H2O2
Далее следует внимательно прочитать описание реакции. К кислым солям здесь относится только NaHCO3. В обмен с ней вступит только гидроксид калия, поскольку кислое и щелочь точно смогут прореагировать. Приведем молекулярное, полное и сокращенное ионные уравнения:
2NaHCO3 + 2KOH = Na2CO3 + K2CO3 + 2H2O
2Na+ + 2HCO3− + 2K+ + 2OH− = 2Na+ + CO32− + 2K+ + CO32− + 2H2O
HCO3− + OH− = CO32− + H2O
Решение 31 номера сводится к знанию неорганической химии, свойств и реакций отдельных веществ. Приведем уравнения протекающих процессов:
2Cu(NO3)2 + 2H2O = 2Cu + O2 + 4HNO3
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
SO2 + 2H2S = 3S + 2H2O
3S + 6KOH = K2SO3 + 2K2S + 3H2O
При рассмотрении цепочек превращений бывает полезно посмотреть через одну стадию и оценить, как можно осуществить такое превращение. Также очень полезно сравнить число атомов углерода в исходной молекуле и продукте, может навести на мысль.
Начнем с циклогексана. Получить его путем гидрирования можно, например, из бензола. Его, в свою очередь, можно получить из гексана по реакции дегидроциклизации. Х1 – бензол. Далее в цепочке много неизвестных веществ, заглянем в самый конец. Циклогексанон относится к кетонам, получить его можно из вторичного спирта. Условия последней реакции на это указывают, поскольку там дан сильный окислитель в кислой среде. Тогда Х3 – циклогексанол. Получить такой спирт в две стадии нужно из циклоалкана. Тогда можно предположить последовательно галогенирование и замещение полученного галогенпроизводного под действием водного раствора щелочи. Тогда Х2 – хлорциклогексан, можно бромциклогексан. Последовательность реакций получается следующей:
Решение задачи начинается с анализа и расчета молекулярной формулы. Поскольку продуктами сгорания являются только углекислый газ и вода, можно приписать веществу формулу CxHyOz. Вычислим количества углекислого газа и воды:
n(H2O) = m(H2O)/M(H2O) = 1,8/18 = 0,1 (моль)
n(СО2) = V(CO2)/Vm = 4,48/22,4 = 0,2 (моль)
Тогда можно определить количества и массы элементов, входивших в состав исходного вещества:
n(С) = n(СО2) = 0,2 моль
m(С) = n(С)·M(С) = 0,2·12 = 2,4 г
n(H) = 2n(H2O) = 0,2 моль
m(H) = n(H)·M(H) = 0,2·1 = 0,2 г
m(О) = m(CxHyOz) − m(С) − m(H) = 3,4 − 2,4 − 0,2 = 0,8 (г)
n(O) = m(O)/M(O) = 0,8/16 = 0,05 (моль)
Вычислим молекулярную формулу неизвестного вещества:
x : y : z = n(С) : n(H) : n(O) = 0,2 : 0,2 : 0,05 = 4 : 4 : 1
Поскольку по условию один из фрагментов молекулы должен содержать 7 атомов углерода, разумным будет удвоить простейшее соотношение и получить формулу C8H8O2.
С8Н8О2 – молекулярная формула
Вещество по условию реагирует со щелочью, процесс гидролиза с образованием соли и спирта. В остатке кислоты 7 атомов углерода и малое количество атомов водорода, что вполне соответствует бензоату. Тогда на спирт приходится всего один атом углерода, что соответствует метанолу. Тогда можно предложить структуру метилбензоата:
Запишем уравнение его реакции с гидроксидом лития:
К заданию 34 следует приступать только после ПОЛНОГО выполнения и проверки всех остальных заданий КИМа. Убедитесь также, что все прочие задания перенесены в бланк ответов, а не остались на черновике. Времени на это задание нужно больше всего, поэтому велик риск потерять остальное и не успеть что-то перенести в бланк.
Для решения следует внимательно прочитать условие и написать реакции, которые сразу же очевидны, без дополнительных расчетов. Здесь их можно записать две:
Ca + 2HCl = CaCl2 + H2
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
Поскольку напрямую ничего не известно про массу и количество кальция и карбоната кальция, можно сказать, что кальция было х моль, а его карбоната у моль. Тогда в ходе реакций выделилось х моль водорода и у моль углекислого газа. Выразим массы указанных веществ:
m(Ca) = n·M = 40х г
m(CaCO3) = n·M = 100у г
m(Н2) = n·M = 2х г
m(CO2) = n·M = 44у г
Выразим массу раствора после добавления исходной твердой смеси к соляной кислоте:
m(р-ра) = m(Ca) + m(CaCO3) + m(р-ра HCl) − m(Н2) − m(CO2)
m(р-ра) = 40х + 100у + 300 − 2х − 44у = 330 (г)
38х + 56у = 30
Первое уравнение системы готово. Второе составим по массовой доле кальция в исходной смеси:
m(смеси) = m(Ca) + m(CaCO3) = 40х + 100у (г)
m(Ca) = 40х + 40у (г)
ω(Са) = m(Ca)/m(смеси)·100% = (40х+40у)/(40х+100у)·100% = 50%
(40х+40у)/(40х+100у) = 0,5
Составим и решим систему уравнений:
38х + 56у = 30
(40х + 40у)/(40х + 100у) = 0,5
38х + 56у = 30
(2х + 2у)/(2х + 5у) = 0,5
38х + 56у = 30
2х + 2у = х + 2,5у
38х + 56у = 30
х = 0,5у
75у = 30
у = 0,4
х = 0,2
n(Ca) = 0,2 моль
n(CaСО3) = 0,4 моль
Далее вычислим количество и массу углекислого газа:
n(СО2) = n(CaСО3) = 0,4 моль
m(СО2) = n(СО2)·M(СО2) = 0,4·44 = 17,6 г
Вычислим массу и количество гидроксида натрия:
m(NaOH) = m(р-ра NaOH)·ω(NaOH)/100% = 400·4%/100% = 16 (г)
n(NaOH) = m(NaOH)/M(NaOH) = 16/40 = 0,4 (моль)
Далее нужно сравнить количества щелочи и углекислого газа, чтобы понять, какая будет реакция между ними:
n(СО2)/n(NaOH) = 0,4/0,4 = 1:1
Соотношение 1:1, поэтому образуется кислая соль:
NaOH + CO2 = NaHCO3
Вычислим массу образовавшейся соли и массу раствора:
n(NaHCO3) = n(СО2) = 0,4 моль
m(NaHCO3) = n·M = 0,4·84 = 33,6 г
m(р-ра конечн.) = m(р-ра NaOH) + m(CO2) = 400 + 17,6 = 417,6 (г)
Вычислим массовую долю гидрокарбоната натрия в полученном растворе:
ω(NaHCO3) = m(NaHCO3)/m(р-ра конечн.)·100% = 33,6/417,6·100% = 8,05%
Ответ: 8,05%
Задание №1 ЕГЭ химия. Теория и практика
Первое задание в ЕГЭ по химии посвящено электронной конфигурации атома. Для его выполнения дается ряд химических элементов, среди которых нужно выбрать два с одинаковым свойством:
— одинаковое число валентных электронов;
— одинаковое количество неспаренных электронов в основном или возбужденном состоянии;
— одна и та же общая электронная конфигурация валентного уровня.
Для правильного выполнения этого задания полезно помнить последовательность заполнения электронами атомных орбиталей, которую можно легко понять и усвоить благодаря данному рисунку:
Рис.1 Порядок заполнения электронами атомных орбиталей.
Атом — электро нейтральная частицей. Положительный заряд ядра уравновешивается числом отрицательно заряженных электронов, которые движутся в его поле. Заряд ядра атома химического элемента равен его порядковому номеру в периодической системе Д.И. Менделеева. При переходе от одного элемента к следующему заряд ядра увеличивается на единицу. И на единицу возрастает число электронов в атоме. Каждый следующий добавляемый электрон занимает низшую свободную атомную орбиталь.
Рассмотрим электронную конфигурацию на примере атома водорода. Заряд ядра атома водорода +1. Значит, в поле ядра движется 1 электрон, и он занимает самую первую по энергии атомную орбиталь — 1s. Электронная формула атома водорода записывается 1s1

У атома гелия (заряд ядра +2) следующий электрон займет ту же самую s-орбиталь, однако спин у него будет противоположный (стрелка, изображающая электрон, направлена в другую сторону):
Рис.2.Конфигурация атома гелия в основном состоянии.
На этом ёмкость 1 энергетического уровня становится полностью заполненной. Поэтому следующий электрон, который появляется у атома лития и бериллия, займёт s- орбиталь второго энергетического уровня (2s-орбиталь):
Рис. 3. Конфигурации атома лития и бериллия в основном состоянии.
Правило Хунда: электроны заполняют атомную орбиталь таким образом, чтобы её суммарный спин был максимальным.
Иными словами, при заполнении p, d, f-орбиталей электроны сначала будут занимать квантовые ячейки орбитали по одному, и только потом будут спариваться. По этому поводу можно привести хорошую аналогию: при размещении пассажиров в изначально пустом автобусе, если все люди незнакомы, сначала они будут занимать места по одному, и только когда мест станет не достаточно, незнакомые люди станут занимать места рядом с теми, кто зашел в автобус раньше. На этом основании запишем электронную конфигурацию атома серы и изобразим распределение электронов по квантовым ячейкам:
Рис. 4. Конфигурация атома серы в основном состоянии. Красным цветом показаны электроны валентного уровня.
В образовании химических связей участвуют только электроны внешнего (валентного) энергетического уровня. В атоме серы таким уровнем является третий. На нём расположено шесть электронов, два из которых не спарены.
Число валентных электронов в атоме равно номеру группы (исключения: атомы кобальта и никеля, у них число валентных электронов равно 9 и 10, соответственно).
Особой энергетической устойчивостью обладают наполовину и полностью заполненные орбитали.
Запишем электронную конфигурацию атома хрома. Найдем хром в таблице Менделеева. Его порядковый номер — 24. Это означает, что заряд ядра атома Cr +24, следовательно, в поле ядра движется 24 электрона.
Распределим 24 электрона по орбиталям, пользуясь уже известными нам правилами. Помним, что между 4s и 4p-орбиталями заполняется 3d-орбиталь:
Однако, на d-орбитали не хватает одного электрона до наполовину заполненного состояния. А наполовину заполненные орбитали отличаются пониженной энергией. Всё в мире стремится к минимуму энергии; и атом тоже. Поэтому один электрон с 4s-орбитали перескакивает на 3d-орбиталь, благодаря близости энергий этих орбиталей.
Символом в квадратных скобках (у нас это — [Ar]) принято сокращать электронную конфигурацию полностью заполненных невалентных нижних энергетических уровней. У всех благородных газов, которые находятся в 18 группе длиннопериодного варианта периодической системы или в 8 группе краткопериодного, орбитали заполнены полностью, и чтобы не переписывать каждый раз одно и то же пользуются таким способом сокращения записи.
Таким же исключением из правил является атом меди. Ему не хватает одного электрона для полного заполнения 3d-орбитали. И он, как и хром, берет этот электрон с 4-s -орбитали
Именно на тех же основаниях электронная конфигурация молибдена — [Kr] 4d55s1, серебра — [Kr] 4d105s1.
Пользуясь информацией, изложенной выше, можно легко вычислить число валентных, внешних и неспаренных электронов в атоме и безошибочно выполнить первое задание ЕГЭ, за которое можно получить 1 первичный балл.
Задание 1
1) N 2) S 3) P 4) Se 5) As
Определите, атомы каких из указанных в ряду элементов имеют в возбуждённом состоянии электронную конфигурацию внешнего энергетического уровня ns1np3nd1. Запишите в поле ответа номера выбранных элементов.
Задание 2
1) Te 2) I 3) O 4) S 5) Sr
Определите, анионы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня 5s25p6. Запишите в поле ответа номера выбранных элементов.
Задание 3
1) Al 2) S 3) P 4) Cr 5) Si
Определите, атомы каких из указанных в ряду элементов в основном состоянии во внешнем слое содержат один неспаренный электрон. Запишите в поле ответа номера выбранных элементов.
Задание 4
1) Mg 2) Bi 3) Ba 4) Sr 5) Al
Определите, катионы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня 3s0. Запишите в поле ответа номера выбранных элементов.
Задание 4
1) I 2) N 3) Br 4) P 5) Cl
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns2np3. Запишите в поле ответа номера выбранных элементов.