Полезные справочные материалы к ЕГЭ
В данной рубрике выкладывается довольно разношерстный материал. Здесь вы можете найти ответы на часто возникающие при подготовке к ЕГЭ по химии вопросы, которые не удалось осветить в разделе Теория для подготовки к ЕГЭ. Например, здесь вы можете найти простые алгоритмы по нахождению правильных вариантов ответов на распространенные вопросы КИМов своеобразные «рецепты» получения ответов на отдельные задания из ЕГЭ по химии.
И хотя, заучивание данных «рецептов» несомненно будет для вас полезным, однако, вы все же не сможете обойтись без фундаментальной подготовки по программе кодификатора ЕГЭ по химии. Подготовку к ЕГЭ по химии вы можете проводить по пособиям для подготовки к ЕГЭ, либо же используя информацию с моего сайта, размещенную в разделе Теория для подготовки к ЕГЭ. Правда, на данный момент, этот раздел еще не полностью заполнен, поскольку все материалы пишутся лично мной, а не являются копипастом чужих работ.
Если у вас есть какие-либо интересные материалы, которые были бы весьма кстати в данном разделе и вы хотите ими поделиться присылайте их мне на почту shirokopoyas-s-i@yandex.ru.
6 августа 2021
В закладки
Обсудить
Жалоба
ЕГЭ по химии: справочные материалы
Предложенный материал адресован абитуриентам, преподавателям химии и ученикам 8-11 классов.
Материал содержит справочные таблицы, тривиальные названия неорганических и органических соединений, краткие теоретические сведения о гидролизе, электролизе, тренажёр для повторения большого количества неорганических реакций.
spr-himiya.docx
spr-himiya.pdf
Автор: Аветисян Сатеник Вагеевна.
Лидин р.А. Химия. Полный справочник для подготовки к егэ

Содержание
Предисловие
1. Распространенные элементы. строение
атомов. Электронные оболочки. Орбитали
2. Периодический закон. Периодическая
система. Электроотрицательность. Степени
окисления
3. Молекулы. Химическая связь. Строение
веществ
4. Классификация и взаимосвязь
неорганических веществ
5. Металлы главных подгрупп I–III групп
5.1. Натрий
5.2. Калий
5.3. Кальций
5.4. Жёсткость воды
5.5. Алюминий
6. Переходные металлы 4-го периода.
Свойства, способы получения. Общие
свойства металлов
6.1. Хром
6.2. Марганец
6.3. Железо
6.4. Общие свойства металлов. Коррозия
7. Неметаллы главных подгрупп IV–VII
групп
7.1. Водород
7.2. Галогены
7.2.1. Хлор. Хлороводород
7.2.2. Хлориды
7.2.3. Гипохлориты. Хлораты
7.2.4. Бромиды. Иодиды
7.3. Халькогены
7.3.1. Кислород
7.3.2. Сера. Сероводород. Сульфиды
7.3.3. Диоксид серы. Сульфиты
7.3.4. Серная кислота. Сульфаты
7.4. Неметаллы VA-группы
7.4.1. Азот. Аммиак
7.4.2. Оксиды азота. Азотная кислота
7.4.3. Нитриты. Нитраты
7.4.4. Фосфор
7.5. Неметаллы IVA-группы
7.5.1. Углерод в свободном виде
7.5.2. Оксиды углерода
7.5.3. Карбонаты
7.5.4. Кремний
8. Теория строения, многообразие,
классификация и номенклатура органических
соединений. Типы химических реакций
9. Углеводороды. Гомология и изомерия.
Химические свойства и способы получения
9.1. Алканы. Циклоалканы
9.2. Алкены. Алкадиены
9.3. Алкины
9.4. Арены
10. Кислородсодержащие органические
соединения
10.1. Спирты. Простые эфиры. Фенолы
10.2. Альдегиды и кетоны
10.3. Карбоновые кислоты. Сложные эфиры.
Жиры
10.4. Углеводы
11. Азотсодержащие органические
соединения
11.1. Нитросоединения. Амины
11.2. Аминокислоты. Белки
12. Химические реакции. Скорость,
энергетика и обратимость
12.1. Скорость реакций
12.2. Энергетика реакций
12.3. Обратимость реакций
13. Водные растворы. Растворимость и
диссоциация веществ. Ионный обмен.
Гидролиз солей
13.1. Растворимость веществ в воде
13.2. Электролитическая диссоциация
13.3. Диссоциация воды. Среда растворов
13.4. Реакции ионного обмена
13.5. Гидролиз солей
14. Окислительно-восстановительные
реакции. Электролиз
14.1. Окислители и восстановители
14.2. Подбор коэффициентов методом
электронного баланса
14.3. Ряд напряжений металлов
14.4. Электролиз расплава и раствора
15. Решение расчетных задач
15.1. Массовая доля растворенного вещества.
Разбавление, концентрирование и
смешивание растворов
15.2. Объемное отношение газов
15.3. Масса вещества (объем газа) по
известному количеству другого реагента
(продукта)
15.4. Тепловой эффект реакции
15.5. Масса (объем, количество вещества)
продукта по реагенту в избытке или с
примесями
15.6. Масса (объем, количество вещества)
продукта по реагенту с известной массовой
долей в растворе
15.7. Нахождение молекулярной формулы
органического соединения
Ответы
Предисловие
Справочник включает весь теоретический
материал школьного курса химии,
необходимый для сдачи ЕГЭ, – итоговой
аттестации учащихся. Этот материал
распределен по 14 разделам, содержание
которых соответствует темам, проверяемым
на ЕГЭ, – четырем содержательным
блокам: «Химический элемент», «Вещество»,
«Химическая реакция», «Познание и
применение веществ и химических реакций».
К каждому разделу даны тренировочные
задания из частей А и В – с выбором
ответа и кратким ответом. Раздел 15
полностью посвящен решению расчетных
задач, включенных в экзаменационную
часть С.
Тестовые задания составлены таким
образом, что, отвечая на них, учащийся
сможет более рационально повторить
основные положения школьного курса
химии.
В конце пособия приводятся ответы к
тестам, которые помогут школьникам и
абитуриентам проверить себя и восполнить
имеющиеся пробелы.
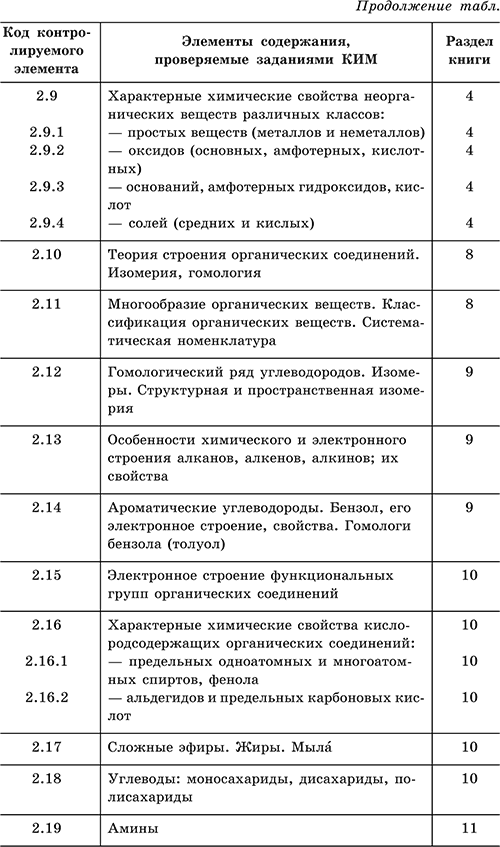
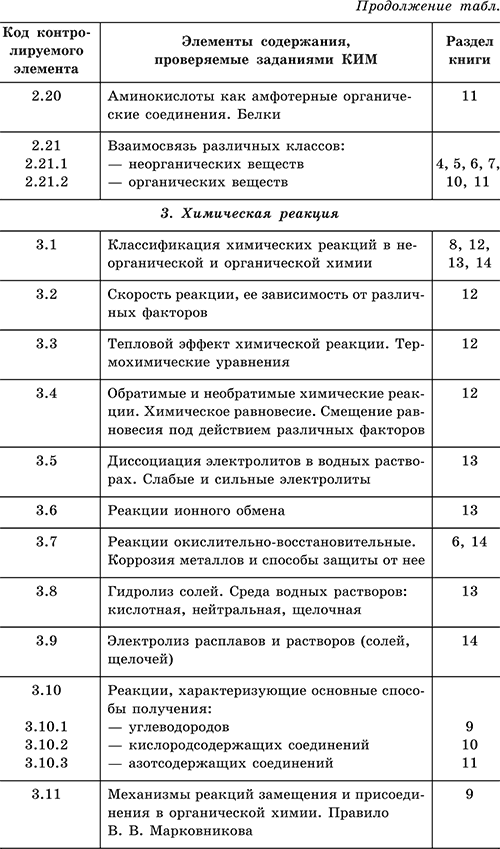
Для удобства работы с данным справочником
приведена таблица, где указано соответствие
между тематикой экзамена и разделами
книги.
Пособие адресовано старшим школьникам,
абитуриентам и учителям.





Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Терефталевая кислота
Фталевая кислота
О-ксилол
О-крезол
Кумол
Бензол
Фенол
Толуол
Анилин
Бензойная кислота
Пикриновая кислота
Глицин
Аланин
Уксусный ангидрид
CnH2nO
Гидрогенизация + Н2
Элеминирование (отщепление)
Декарбоксилирование Реакция Дюма – это сплавление солей карбоновых кислотw с щелочами. При этом отщепляется карбоксилатная группа (–COOMe), и образуется карбонат:
пропионат натрия → этан
бензоат калия → бензол
Электролиз по Кольбе
2CH3CH2–COONa + 2H2O → H2 + 2NaOH + 2CO2 + CH3CH2–CH2CH3
Разложение термически неустойчивых солей*
Соли двухвалентных металлов (Ca, Mg, Ba) термически неустойчивы, при нагревании они разлагаются с отщеплением карбоната, остатки молекулы соединяются с образованием кетона:
бензоат кальция → бензофенон
Термически неустойчивы также оксалаты любых металлов. Оксалаты разлагаются на карбонат и угарный газ:
Разложение термически неустойчивых кислот*
Важнейшие термически неустойчивые кислоты:
Муравьиная кислота разлагается до угарного газа:
Щавелевая кислота разлагается до углекислого и угарного газа:
Бензойная кислота при нагревании декарбоксилируется, образуется бензол:
Карбоновые кислоты, у которых карбоксильная группа находится рядом с электроноакцепторным заместителем, являются термически неустойчивыми, при нагревании такие кислоты теряют карбоксильную группу в виде CO2, например, пировиноградная кислота разлагается до ацетальдегида:
Окисление кумола
Хлористый ацетил
ацетилхлорид + вода → уксусная кислота + соляная кислота
ацетилхлорид + этанол → этиловый эфир уксусной кислоты + соляная кислота
ацетилхлорид + ацетат натрия → уксусный ангидрид + хлорид натрия
Синтез газ: C + H2O → H2 + CO.; CH4 + H2O → CO + 3H2
CO+2H2⇔СH3OH+90,8кДж
угарный газ + гидроксид натрия → (t°, p) → формиат натрия
Реакция первичных аминов с азотистой кислотой*
этиламин + азотистая кислота → этанол + азот↑ + вода
Гидролиз нитрилов
CH3CN + 2H2O + HCl → CH3COOH + NH4Cl
Электролиты:
Сильные а) кислоты НNO3 , HCl, HBr , HI НСlО4 (хлорная), НСlО3 (хлорноватая), H2SO4, HMnO4
б) основания –растворимые: Гидроксиды элементов главных подгрупп I и II групп периодической системы: LiОН, NaОН, КОН, Са(ОН)2
в) Все растворимые соли.
К слабым электролитам относятся а) некоторые неорганические и почти все органические кислоты: HF, H2S , H2SO3, H2CO3, HCN, Н3РО4,, H2SiO3, H3BO3, НСlО (Хлорноватистая кислота), СН3СООН ,
б) основания – нерастворимые Аl(OH)3, Cu(OH)2, Fe(OH)2, Fe(OH)3 и др. и гидроксид аммония NH4OH.
2KF тв + H2SO4 конц → K2SO4 (KHSO4)+ 2HF↑
2NaCl тв + H2SO4 конц → Na2SO4 + 2HCl↑
8NaBr + 5H2SO4 → H2S + 8Br + 4Na2SO4 + 4H2O
8NaI +5H2SO4 = 4I2 + H2S + 4Na2SO4 + 4H2O.
































