6 августа 2021
В закладки
Обсудить
Жалоба
ЕГЭ по химии: справочные материалы
Предложенный материал адресован абитуриентам, преподавателям химии и ученикам 8-11 классов.
Материал содержит справочные таблицы, тривиальные названия неорганических и органических соединений, краткие теоретические сведения о гидролизе, электролизе, тренажёр для повторения большого количества неорганических реакций.
spr-himiya.docx
spr-himiya.pdf
Автор: Аветисян Сатеник Вагеевна.
Таблицы на ЕГЭ и ОГЭ по химии
На сдаче ЕГЭ и ОГЭ по химии можно использовать три таблицы:
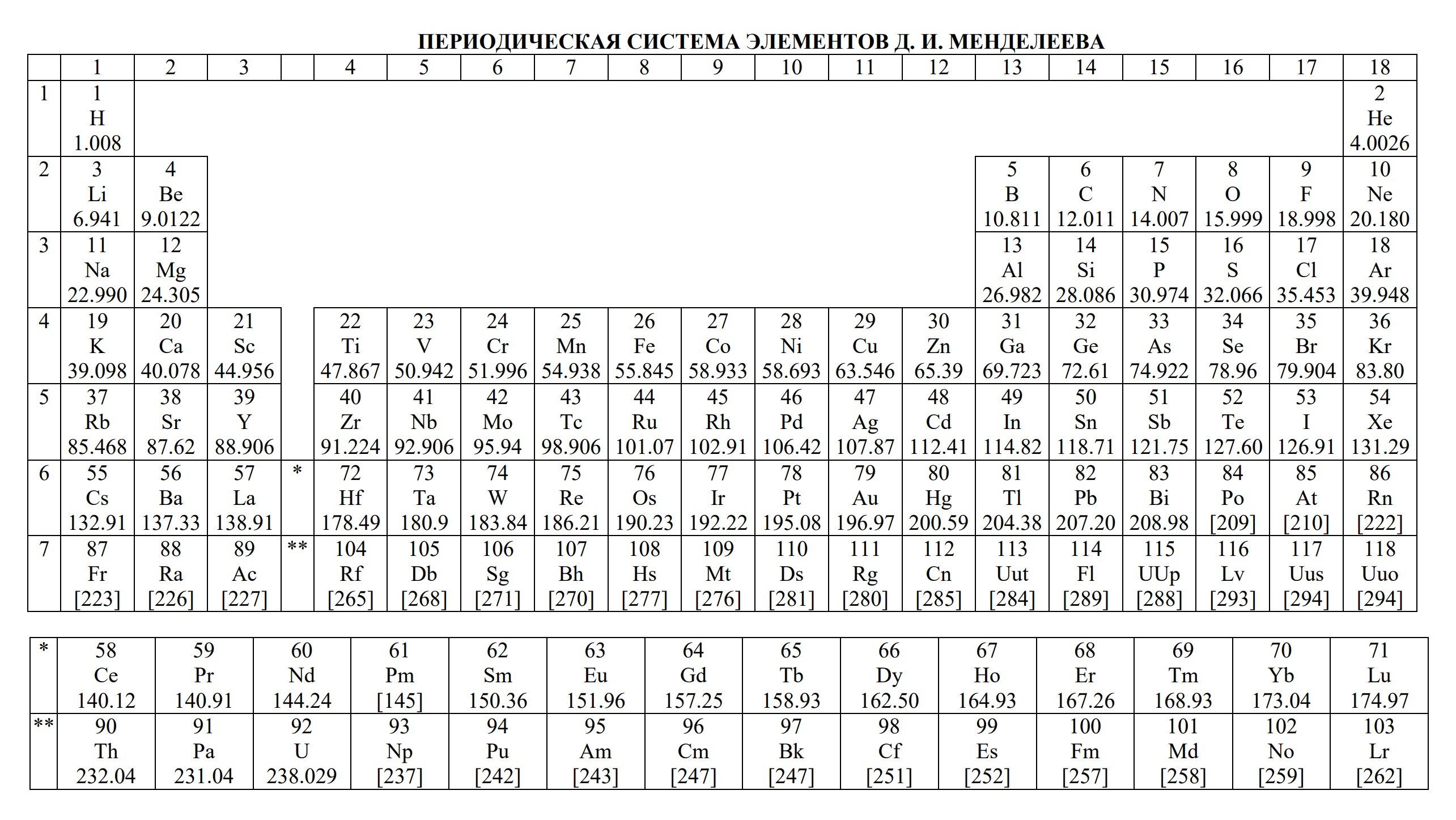
- периодическая система химических элементов Д.И. Менделеева
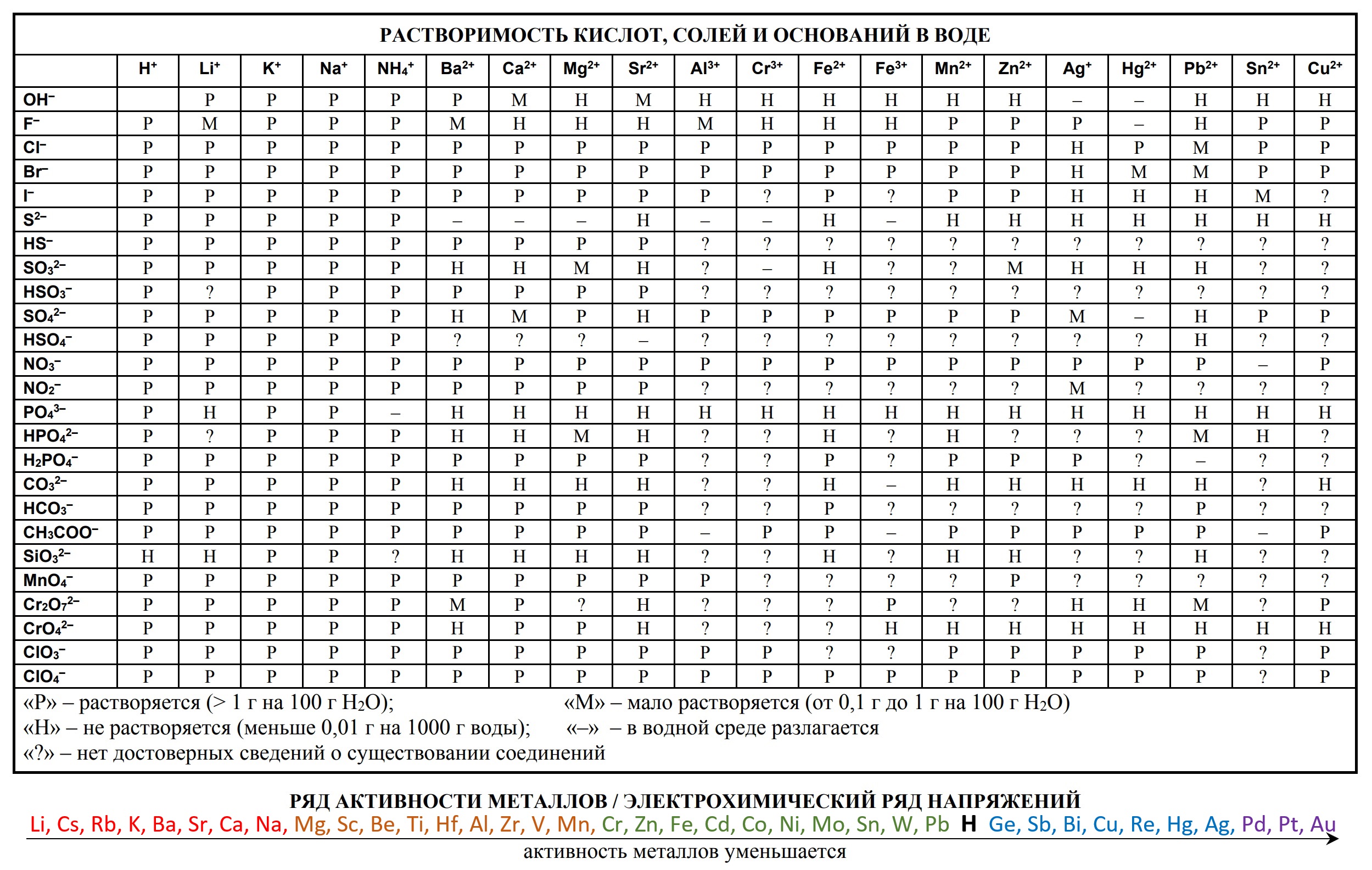
- таблица растворимости
- ряд активности металлов.
Они содержат в себе 80% информации, необходимой для решения большинства заданий.
Однако таблицы на форзацах разных учебников, продаваемые в книжных магазинах, располагающиеся на просторах интернета отличаются не только оформлением, но и содержанием. Что бы они оказались надёжно шпаргалкой, а не приятной неожиданностью, лучше с самого начала начинать работать с тем форматом, который официально разрешен на ЕГЭ твоего года.
Скачать эти таблицы можно ниже. А как сделать эти безликие таблицы наиболее информационными для тебя я расскажу на уроке.
- Таблица Д.И. Менделеева для ОГЭ и ЕГЭ
- Таблица растворимости и ряд активности для ОГЭ и ЕГЭ
- Таблица растворимости с расширенным рядом активности
- Таблица Д.И. Менделеева длиннопериодная для олимпиады
Таблицы для ЕГЭ по химии
- 31.10.2020
Приводим таблицы, которые можно использовать на ЕГЭ по химии, эти таблицы можно использовать на ЕГЭ в любом году, входит в пакет разрешённых документов, т.е. то, чем можно пользоваться на ЕГЭ по химии.
Из года в год эти таблицы не меняются. В 2023 году поменялась только таблица растворимости — информацию обновили. Используйте ссылки ниже.
В состав документа входят:
- Таблица растворимости солей
- Таблица Менделеева
Добавить комментарий
Комментарии без регистрации. Несодержательные сообщения удаляются.
Выдают ли на ЕГЭ калькулятор, или нужно приносить его с собой? Выдают ли на ЕГЭ по химии таблицу Менделеева и таблицу растворимости? Ниже вы найдете ответы на эти и другие вопросы. Внимательно прочитайте статью, поделитесь со своими друзьями. Помните — незнание правил ЕГЭ не освобождает от ответственности за их нарушение!
Ответы на эти и другие вопросы найти легко — на официальных порталах ЕГЭ: ege.edu.ru, fipi.ru, mathege.ru.
Перечень дополнительных устройств, которыми разрешается пользоваться во время экзаменов по каждому предмету ЕГЭ, ежегодно утверждается приказом Минобрнауки России.
Кроме того, в комплекты КИМ по некоторым предметам включены справочные материалы.
Ниже дан полный перечень разрешенных дополнительных устройств и материалов, составленный на основе спецификаций по предметам.
ЕГЭ по математике
Разрешается пользоваться линейкой.
Справочные материалы, которые можно использовать во время экзамена, выдаются каждому участнику ЕГЭ вместе с текстом его экзаменационной работы.
ЕГЭ по географии
Разрешено использование непрограммируемого калькулятора (на каждого ученика), линейки и транспортира.
Непрограммируемый калькулятор должен обеспечивать арифметические вычисления (сложение, вычитание, умножение, деление, извлечение корня) и вычисление тригонометрических функций (sin, cos, tg, ctg, arcsin, arcos, arctg).
Калькулятор не должен предоставлять возможность сохранения в своей памяти баз данных экзаменационных заданий и их решений, а также любой другой информации, знание которой прямо или косвенно проверяется на экзамене.
Калькулятор не должен предоставлять экзаменующемуся возможности получения извне информации во время сдачи экзамена. Коммуникационные возможности калькулятора не должны допускать беспроводного обмена информацией с любыми внешними источниками.
ЕГЭ по химии
Разрешено использование непрограммируемого калькулятора с возможностью вычисления тригонометрических функций (cos, sin, tg) и линейки.
Также к каждому варианту экзаменационной работы прилагаются следующие материалы:
- периодическая система химических элементов Д.И. Менделеева;
- таблица растворимости солей, кислот и оснований в воде;
- электрохимический ряд напряжений металлов.
ЕГЭ по физике
Разрешено использование непрограммируемого калькулятора (на каждого ученика) с возможностью вычисления тригонометрических функций (cos, sin, tg) и линейки.
Кроме того, каждый КИМ содержит справочные данные, которые могут понадобиться при выполнении работы.
ЕГЭ по иностранным языкам
Дополнительные материалы и оборудование на экзамене по иностранному языку включают звуковоспроизводящую аппаратуру, аудиокассеты или компакт-диски (CD) с материалами для выполнения заданий раздела 1 «Аудирование».
По остальным предметам использование дополнительного оборудования и материалов на экзамене не предусмотрено.
Всё, что не входит в спецификацию КИМ ЕГЭ по предмету, иметь и использовать на экзамене запрещено, в том числе:
- мобильные телефоны или иные средства связи;
- любые электронно-вычислительные устройства и справочные материалы и устройства.
При нарушении этих правил и отказе в их соблюдении организаторы совместно с уполномоченным представителем ГЭК вправе удалить участника ЕГЭ с экзамена с внесением записи в протокол проведения экзамена в аудитории с указанием причины удаления. На бланках и в пропуске проставляется метка о факте удаления с экзамена.
Обратите внимание!
- Калькулятор и ручку (с запасом) необходимо приносить на экзамен самому.
- Если вы просто пронесли телефон на экзамен, то организаторы имеют право удалить вас с экзамена, даже если вы этим телефоном не пользовались.
- На некоторые экзамены можно приносить непрограммируемый калькулятор, но с возможностью расчета тригонометрических функций. Заранее (в начале года) купите себе такой калькулятор, и весь год постарайтесь работать с ним, выполняя тренировочные и диагностические работы, чтобы привыкнуть к этому калькулятору.
- Ноутбуки, планшеты, КПК, смартфоны, компьютеры в часах использовать на экзамене ЕГЭ запрещено! За пользование ими вас могут удалить с экзамена.
Если у вас остались какие-то вопросы по поводу экзамена, вы можете задать их через форму обратной связи ниже. Рекомендую также прочитать остальные мои методические статьи)
Терефталевая кислота
Фталевая кислота
О-ксилол
О-крезол
Кумол
Бензол
Фенол
Толуол
Анилин
Бензойная кислота
Пикриновая кислота
Глицин
Аланин
Уксусный ангидрид
CnH2nO
Гидрогенизация + Н2
Элеминирование (отщепление)
Декарбоксилирование Реакция Дюма – это сплавление солей карбоновых кислотw с щелочами. При этом отщепляется карбоксилатная группа (–COOMe), и образуется карбонат:
пропионат натрия → этан
бензоат калия → бензол
Электролиз по Кольбе
2CH3CH2–COONa + 2H2O → H2 + 2NaOH + 2CO2 + CH3CH2–CH2CH3
Разложение термически неустойчивых солей*
Соли двухвалентных металлов (Ca, Mg, Ba) термически неустойчивы, при нагревании они разлагаются с отщеплением карбоната, остатки молекулы соединяются с образованием кетона:
бензоат кальция → бензофенон
Термически неустойчивы также оксалаты любых металлов. Оксалаты разлагаются на карбонат и угарный газ:
Разложение термически неустойчивых кислот*
Важнейшие термически неустойчивые кислоты:
Муравьиная кислота разлагается до угарного газа:
Щавелевая кислота разлагается до углекислого и угарного газа:
Бензойная кислота при нагревании декарбоксилируется, образуется бензол:
Карбоновые кислоты, у которых карбоксильная группа находится рядом с электроноакцепторным заместителем, являются термически неустойчивыми, при нагревании такие кислоты теряют карбоксильную группу в виде CO2, например, пировиноградная кислота разлагается до ацетальдегида:
Окисление кумола
Хлористый ацетил
ацетилхлорид + вода → уксусная кислота + соляная кислота
ацетилхлорид + этанол → этиловый эфир уксусной кислоты + соляная кислота
ацетилхлорид + ацетат натрия → уксусный ангидрид + хлорид натрия
Синтез газ: C + H2O → H2 + CO.; CH4 + H2O → CO + 3H2
CO+2H2⇔СH3OH+90,8кДж
угарный газ + гидроксид натрия → (t°, p) → формиат натрия
Реакция первичных аминов с азотистой кислотой*
этиламин + азотистая кислота → этанол + азот↑ + вода
Гидролиз нитрилов
CH3CN + 2H2O + HCl → CH3COOH + NH4Cl
Электролиты:
Сильные а) кислоты НNO3 , HCl, HBr , HI НСlО4 (хлорная), НСlО3 (хлорноватая), H2SO4, HMnO4
б) основания –растворимые: Гидроксиды элементов главных подгрупп I и II групп периодической системы: LiОН, NaОН, КОН, Са(ОН)2
в) Все растворимые соли.
К слабым электролитам относятся а) некоторые неорганические и почти все органические кислоты: HF, H2S , H2SO3, H2CO3, HCN, Н3РО4,, H2SiO3, H3BO3, НСlО (Хлорноватистая кислота), СН3СООН ,
б) основания – нерастворимые Аl(OH)3, Cu(OH)2, Fe(OH)2, Fe(OH)3 и др. и гидроксид аммония NH4OH.
2KF тв + H2SO4 конц → K2SO4 (KHSO4)+ 2HF↑
2NaCl тв + H2SO4 конц → Na2SO4 + 2HCl↑
8NaBr + 5H2SO4 → H2S + 8Br + 4Na2SO4 + 4H2O
8NaI +5H2SO4 = 4I2 + H2S + 4Na2SO4 + 4H2O.
Полезные справочные материалы к ЕГЭ
В данной рубрике выкладывается довольно разношерстный материал. Здесь вы можете найти ответы на часто возникающие при подготовке к ЕГЭ по химии вопросы, которые не удалось осветить в разделе Теория для подготовки к ЕГЭ. Например, здесь вы можете найти простые алгоритмы по нахождению правильных вариантов ответов на распространенные вопросы КИМов своеобразные «рецепты» получения ответов на отдельные задания из ЕГЭ по химии.
И хотя, заучивание данных «рецептов» несомненно будет для вас полезным, однако, вы все же не сможете обойтись без фундаментальной подготовки по программе кодификатора ЕГЭ по химии. Подготовку к ЕГЭ по химии вы можете проводить по пособиям для подготовки к ЕГЭ, либо же используя информацию с моего сайта, размещенную в разделе Теория для подготовки к ЕГЭ. Правда, на данный момент, этот раздел еще не полностью заполнен, поскольку все материалы пишутся лично мной, а не являются копипастом чужих работ.
Если у вас есть какие-либо интересные материалы, которые были бы весьма кстати в данном разделе и вы хотите ими поделиться присылайте их мне на почту shirokopoyas-s-i@yandex.ru.