Версия для печати и копирования в MS Word
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) иодоводородная кислота
2) нитрат калия
3) сульфат цинка
4) карбонат натрия
Запишите номера веществ в порядке убывания значения pH их водных растворов.
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») — водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
1
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) гидрокарбонат натрия
2) сульфат магния
3) сульфат натрия
4) соляная кислота
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
Спрятать решение
Решение.
Карбонат натрия — соль, образованная сильным основанием и слабой кислотой, в растворе гидролизуется по аниону, среда слабощелочная. Нитрат калия является солью сильного основания и сильной кислоты, гидролизу не подвергается, среда раствора нейтральная. Сульфат цинка — соль, образованная слабым основанием и сильной кислотой, в растворе происходит гидролиз по катиону, среда слабокислая. Иодоводородная кислота за счет диссоциации в растворе содержит наибольшее (из представленных) количество протонов среда кислая.
Ответ: 4231.
СДАМ ГИА:
РЕШУ ЕГЭ
Образовательный портал для подготовки к экзаменам
Математика профильного уровня
Математика профильного уровня
≡ Математика
Базовый уровень
Профильный уровень
Информатика
Русский язык
Английский язык
Немецкий язык
Французский язык
Испанский язык
Физика
Химия
Биология
География
Обществознание
Литература
История
Сайты, меню, вход, новости
СДАМ ГИАРЕШУ ЕГЭРЕШУ ОГЭРЕШУ ВПРРЕШУ ЦТ
Об экзамене
Каталог заданий
Варианты
Ученику
Учителю
Школа
Эксперту
Справочник
Карточки
Теория
Сказать спасибо
Вопрос — ответ
Чужой компьютер
Зарегистрироваться
Восстановить пароль
Войти через ВКонтакте
Играть в ЕГЭ-игрушку
Новости
10 марта
Как подготовиться к ЕГЭ и ОГЭ за 45 дней
6 марта
Изменения ВПР 2023
3 марта
Разместили утвержденное расписание ЕГЭ
27 января
Вариант экзамена блокадного Ленинграда
23 января
ДДОС-атака на Решу ЕГЭ. Шантаж.
6 января
Открываем новый сервис: «папки в избранном»
22 декабря
Открыли новый портал Решу Олимп. Для подготовки к перечневым олимпиадам!
4 ноября
Материалы для подготовки к итоговому сочинению 2022–2023
31 октября
Сертификаты для учителей о работе на Решу ЕГЭ, ОГЭ, ВПР
21 марта
Новый сервис: рисование
31 января
Внедрили тёмную тему!
НАШИ БОТЫ
Все новости
ЧУЖОЕ НЕ БРАТЬ!
Экзамер из Таганрога
10 апреля
Предприниматель Щеголихин скопировал сайт Решу ЕГЭ
Наша группа
Задания
Версия для печати и копирования в MS Word
Задания Д6 № 28915
В треугольнике ABC угол C равен 90°, Найдите
Решение.
Это задание ещё не решено, приводим решение прототипа.
В треугольнике ABC угол C равен 90°, Найдите
##
Ответ: 0,1.
Аналоги к заданию № 27220: 28881 28977 28883 28885 28887 28889 28891 28893 28895 28897 … Все
Прототип задания
·
О проекте · Редакция · Правовая информация · О рекламе
© Гущин Д. Д., 2011—2023
ЕГЭ по химии задание 21
План
Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Гидролиз
Гидролиз – самый распространенный химический процесс на нашей Земле, определяющий наличие жизни на нашей планете. В результате гидролиза образуются вещества, которые определяют основной химический состав жидкостей во всех живых системах: крови, плазме, тканевой жидкости. Благодаря гидролизу между мембранами клеток функционирует натрий – калиевый насос и регулируется количество основных ионов Na + и K + .
Самый известный на Земле растворитель – вода. Почти все органические и неорганические соединения готовы растворяться в водном растворе.
По химическим свойствам H 2 O слабый электролит, плохо разлагающийся на ионы. Для водного раствора свойственна нейтральная среда. В данной среде концентрация ионов водорода и гидроксид-ионов равны.
Растворяя всевозможные вещества в воде, возможно получить различные концентрации ионов H + и OH — . Это будет находиться в зависимости от природы вещества и степени его диссоциации.
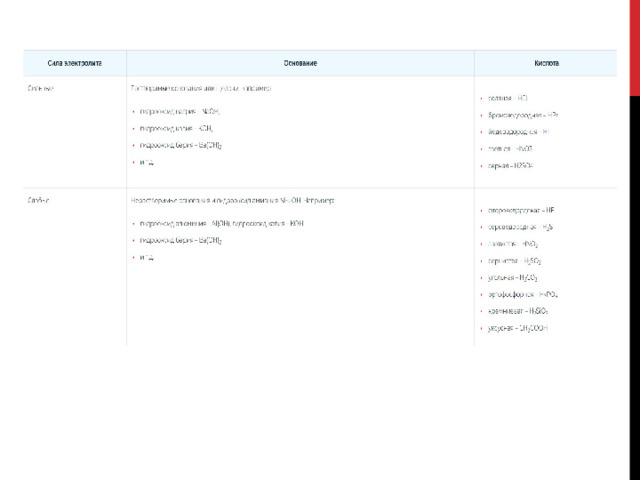
В зависимости от этого различают слабые и сильные электролиты. К сильным электролитам относятся растворимые соли, кислоты и щелочи.
Соли в водных растворах не просто растворяются, а разлагаются на ионы. Подобный процесс получил название гидролиза .
Состав солей определяется кислотой и основанием, их степенью диссоциации и химическими свойствами. Кислоты и основания могут быть сильными и слабыми.
В зависимости от состава органические вещества относятся к разной степени гидролизуемых веществ: чем выше ионизация в молекуле, тем большему гидролизу подвергается вещество.
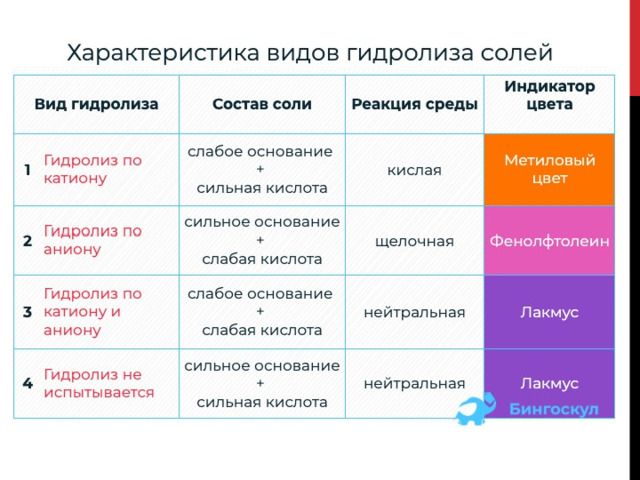
Типы гидролиза солей
1. Для солей, которые включают слабое основание и сильную кислоту, свойственен гидролиз по катиону .
К примеру CuCl 2 , — это средняя соль. Состав представлен слабым основанием Cu(OH) 2 (нерастворимым в воде) и сильной кислотой HCl .
Все растворимые соли считаются сильными электролитами, вследствие этого при растворении в воде всецело диссоциируют на ионы.
Раствор представляет собой частичную диссоциацию молекулы воды и абсолютное разложение на ионы хлорида меди (II). OH — анионы объединяются с катионом Cu 2+ и образуют нерастворимое соединение, которое не диссоциирует на ионы. Ионы H + и Cl — связываются в молекулу сильного электролита – соляную кислоту. В итоге получается накопление в растворе ионов H + , которые обеспечивают, кислую реакцию среды раствора и изменение цвета индикаторов. Индикатор может быть метиловым оранжевым. В нейтральной среде имеет оранжевый цвет, в кислой окрашивается в красный.
Представляем процесс в виде уравнений реакции: 1) Cu 2+ + H 2 O = Cu(OH) 2 ↓ + 2H + — сокращенное ионное уравнение 2) Cu 2+ + 2Cl — + 2H 2 O = Cu(OH) 2 ↓ + 2H + + 2Cl — — полное ионное уравнение 3) CuCl 2 + 2H 2 O = Cu(OH) 2 ↓ + 2HCl — молекулярное уравнение реакции
2. Для солей, которые включают сильное основание и слабую кислоту, характерен гидролиз по аниону .
К примеру, Na 2 CO 3 представляет собой соль, образованную сильным основанием NaOH (водорастворимым) и слабой кислотой H 2 CO 3 .
Когда карбонат натрия растворяется в воде, он полностью распадается на ионы, а молекулы воды отчасти диссоциируют на ионы. В итоге процесса гидролиза ионы Na + и OH — объединяются и получается сильный электролит гидроксид натрия. В растворе накапливается избыточное общее количество гидроксильных анионов OH — , которые свойственны для щелочной реакции среды. Катионы H + и анионы CO3 2- образуют слабую углекислоту, которая в растворе распадается на воду и углекислый газ.
Составляем уравнение гидролиза: 1) CO3 2- + H 2 O = 2OH — + H 2 O + CO 2 ↑— сокращенное ионное уравнение 2) 2 Na + + CO3 2- + 2 H 2 O = 2 Na + + 2OH — + CO 2 ↑ — полное ионное уравнение 3) Na 2 CO 3 + 2 H 2 O = 2 NaOH + H 2 CO 3 — молекулярное уравнение реакции
Углекислота очень слабая, в растворе распадается на H 2 O и CO 2 .
Уравнение будет выглядеть так:
Na 2 CO 3 + 2 H 2 O = 2 NaOH + H 2 O + CO 2 ↑
3. Гидролиз по катиону и аниону характерен для солей, которые состоят из слабого основания и слабой кислоты.Например, (NH 4 ) 2 S представляет собой среднюю соль, образованную слабым основанием NH 4 OH и слабой кислотой H 2 S .
При растворении сульфида аммония в водном растворе происходит образование малодиссоциирующих веществ-гидроксида аммония и сероводорода. В растворе остаются лишь только молекулы воды, растворная среда станет нейтральной.
Составляем уравнение гидролиза: 1) (NH 4 ) 2 S + H 2 O = 2NH 3 ↑ + H 2 O +H 2 S ↑ — молекулярное уравнение реакции 2) Полное и сокращенное ионные уравнения отсутствуют
4. Гидролизу не подвергается соль, состоящая из сильного основания и сильной кислоты.Например, BaCl 2 представляет собой соль, образованную сильным основанием Ba(OH) 2 (водорастворимым) и сильной кислотой HCl .
Представленный тип солей не содержит кислотных остатков и катионов металлов, реагирующих с водой, т. е. способных влиять на РН водного раствора. Консистенции таких солей имеют нейтральную реакционную среду. В процессе растворения в воде образуются сильные электролиты, полностью распадающиеся на ионы.
Процессы диссоциации и гидролиза считаются обратимыми и подчиняются совокупным закономерностям смещения химического равновесия. Данные процессы возможно усиливать и замедлять, добавляя в раствор одноименный ион, разбавляя раствор или же нагревая его.
Для составления уравнений гидролиза солей существует конкретный алгоритм:
1. Запишите формулу соли и определите ее растворимость в воде, применяя таблицу растворимости солей, кислот и оснований в воде.
- ZnCl 2 растворимый в воде
- ZnCl 2 растворимый в воде
2. В случае если соль растворима, составьте уравнение диссоциации
- ZnCl 2 ⟷ Zn 2+ + 2Cl —
- ZnCl 2 ⟷ Zn 2+ + 2Cl —
3. Определите состав соли

4. Сделайте вывод, какой из ионов соли подвергается гидролизу:
- Zn 2+ — ион, образующий слабый электролит, поэтому он подвергается гидролизу.В данном случае гидролиз проходит по катиону.
- Zn 2+ — ион, образующий слабый электролит, поэтому он подвергается гидролизу.В данном случае гидролиз проходит по катиону.
5. Составляем краткое ионное уравнение
- Zn 2+ + 2H 2 O = Zn(OH) 2 ↓ +2H +
- Zn 2+ + 2H 2 O = Zn(OH) 2 ↓ +2H +
6. Определите среду и рН раствора соли. Если в кратком ионном уравнении появляется 2H + — кислый раствор среды, рН OH — , то среда в растворе щелочная, рН 7.
- В данном случае среда является кислой.
- В данном случае среда является кислой.
7. Составьте полное ионное уравнение соли
- Zn 2+ + 2Cl — + 2 H 2 O = Zn(OH) 2 ↓ +2H + + 2Cl-
- Zn 2+ + 2Cl — + 2 H 2 O = Zn(OH) 2 ↓ +2H + + 2Cl-
8. Составим молекулярное уравнение гидролиза
- ZnCl 2 + 2H 2 O = Zn(OH) 2 ↓ + 2HCl
- ZnCl 2 + 2H 2 O = Zn(OH) 2 ↓ + 2HCl
Задание для подготовки к егэ
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) гидрокарбонат натрия
2) сульфат магния
3) сульфат натрия
4) соляная кислота
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
Ответ: 4231.
Пояснение
Домашняя работа
Вариант № 5510468
Ссылка — https:// chem-ege.sdamgia.ru/test?id=5510468
Исполнитель преобразует число на экране.
У исполнителя есть две команды, которые обозначены латинскими буквами:
A. Вычти (2)
B. Найди целую часть от деления на (2)
Первая команда уменьшает число на экране на (2), вторая заменяет число на экране на целую часть от деления числа на (2).
Программа для исполнителя — это последовательность команд.
Сколько существует программ, для которых при исходном числе (40) результатом является число (2) и при этом траектория вычислений программы содержит число (10)?
Траектория вычислений программы — это последовательность результатов выполнения всех команд. Например, для программы (ABB) при исходном числе (13) траектория будет состоять из чисел (11), (5), (2)
Решение:
Python
def F(n, target):
if n < target:
return 0
if n == target:
return 1
return F(n - 2, target) + F(n // 2, target)
print(F(40, 10) * F(10, 2))
Ответ: (40)
За это задание ты можешь получить 1 балл. На решение дается около 7 минут. Уровень сложности: повышенный.
Средний процент выполнения: 68.7%
Ответом к заданию 21 по химии может быть последовательность цифр, чисел или слов. Порядок записи имеет значение.
Разбор сложных заданий в тг-канале
Задачи для практики
Задача 1
Это задача старого формата ЕГЭ, но её полезно решить для хорошего понимания темы
Установите соответствие между формулой соли и типом её гидролиза: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | ТИП ГИДРОЛИЗА |
| А) $Li_2CO_3$ Б) $CH_3COOK$ В) $Mg(NO_3)_2$ Г) $BeBr_2$ |
1) по катиону 2) по аниону 3) по катиону и аниону 4) гидролизу не подвергается |
Запишите выбранные цифры под соответствующими буквами.
Решение
А: Литий – сильное основание, а вот вторая часть – остаток слабой кислоты, так что гидролиз протекает по аниону.
Б: Ацетат калия – остаток слабой кислоты и достаточно сильного основания, так что гидролиз снова протекает по аниону.
В: Остаток сильной кислоты и слабого основания, гидролиз протекает по катиону.
Г: Точно также, слабое основание и остаток сильной кислоты, так что гидролиз по катиону.
Ответ: 2211
Задача 2
Установите соответствие между формулой соли и средой её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | СРЕДА РАСТВОРА |
| А) $LiNO_3$ Б) $Fe_2(SO_4)_3$ В) $KNO_3$ Г) $CH_3COONa$ |
1) кислая 2) щелочная 3) нейтральная |
Запишите выбранные цифры под соответствующими буквами.
Решение
А: Нитрат лития – сильный анион и сильный катион, гидролиза нет, среда нейтральная.
Б: Железо образует слабое основание, а $SO_4$ – остаток сильной кислоты, гидролиз по катиону, поэтому и образуется кислая среда.
В: Калий образует сильное основание, как и нитрат — сильную кислоту, гидролиза нет, нейтральная среда.
Г: В данном случае имеем катион сильного основания и анион слабой кислоты, гидролиз по аниону, кислая среда.
Ответ: 3132
Задача 3
Это задача старого формата ЕГЭ, но её полезно решить для хорошего понимания темы
Установите соответствие между названием соли и отношением этой соли к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ СОЛИ | ТИП ГИДРОЛИЗА |
| А) хлорид меди(II) Б) сульфид калия В) нитрат магния Г) нитрат натрия |
1) гидролизуется по катиону 2) гидролизуется по аниону 3) гидролизуется по катиону и аниону 4) гидролизу не подвергается |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) Хлорид меди, соль соляной кислоты и слабого основания, гидролизуется по катиону.
Б) Сульфид натрия, соль слабой кислоты и сильного основания, гидролизуется по аниону.
В) Нитрат магния, соль сильной кислоты и слабого основания, гидролизуется по катиону.
Г) Нитрат натрия, соль сильной кислоты и сильного основания, поэтому он не может подвергаться гидролизу.
Ответ: 1214
Задача 4
Установите соответствие между формулой соли и уравнением её гидролиза: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | УРАВНЕНИЕ ГИДРОЛИЗА |
| А) $Fe(OH)_2Cl$ Б) $Fe(OH)Cl_2$ В) $FeCl_3$ Г) $FeCl_2$ |
1) $Fe^{3+} + H_2O ⇄ (FeOH)^{2+} + H^{+}$ 2) $Fe^{2+} + H_2O ⇄ FeOH^{+} + H^{+}$ 3) $Fe(OH)^{2+} + H_2O ⇄ Fe(OH)_2^{+} + H^{+}$ 4) $Fe(OH)_2^{+} + H_2O ⇄ Fe(OH)_3 + H^{+}$ 5) $Cl^– + H_2O ⇄ HCl + OH^–$ 6) гидролиз не происходит |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) В соли $Fe(OH)_2Cl$ (дигидроксохлорид железа(III)) катион — $Fe(OH)_2^{+}$, поэтому в растворе при диссоциации эта соль даст его, что соответствует уравнению под номером 4.
Б) В соли $Fe(OH)Cl_2$ (гидроксохлорид железа(III)) катион — $Fe(OH)^{2+}$, поэтому в растворе при диссоциации эта соль даст его, что соответствует уравнению под номером 3.
В) Соль $FeCl_3$ диссоциирует в растворе с образованием иона $Fe^{3+}$, при этом гидролиз обратимый, значит в нём не может образовываться нейтральных частиц, таких как гидроксид железа(III), поэтому подходит уравнение под номером 1 — гидролиз по первой ступени.
Г) Соль $FeCl_2$ диссоциирует в растворе с образованием иона $Fe^{2+}$, при этом гидролиз обратимый, значит в нём не может образовываться нейтральных частиц, таких как гидроксид железа (II), поэтому подходит уравнение под номером 2 — гидролиз по первой ступени.
Ответ: 4312
Задача 5
Это задача старого формата ЕГЭ, но её полезно решить для хорошего понимания темы
Установите соответствие между формулой соли и ионным уравнением гидролиза этой соли: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | ИОННОЕ УРАВНЕНИЕ ГИДРОЛИЗА |
| А) $AlCl_3$ Б) NaCl В) $Na_2S$ Г) $Al_2S_3$ |
1) не подвергается гидролизу 2) $2Al^{3+} + 3S^{2–} + 6H_2O ⇄ 2Al(OH)_3 + 3H_2S$ 3) $S^{2–} + H_2O ⇄ HS^– + OH^–$ 4) $Na^{+} + H_2O ⇄ NaOH + H^{+}$ 5) $Al^{3+} + H_2O ⇄ AlOH^{2+} + H^{+}$ 6) $Cl^– + H_2O ⇄ HCl + OH^–$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
1) $AlCl_3$ — хлорид алюминия — соль амфотерного гидроксида $Al(OH)_3$ (слабый электролит) и сильной соляной кислоты HCl, подвергается гидролизу по катиону.
$Al^{3+} + HOH ⇄ AlOH^{2+} + H^{+}$
Вывод: ответ А — 5.
2) NaCl — хлорид натрия — соль сильного основания NaOH и сильной кислоты HCl, гидролизу не подвергается.
Вывод: ответ Б — 1.
3) $Na_2S$ — сульфид натрия — соль сильного основания NaOH и слабой кислоты $H_2S$, подвергается гидролизу по аниону:
$S^{2–} + HOH ⇄ HS^{–} + ОH^{–}$
Вывод: ответ В — 3.
4) $Al_2S_3$ — сульфид алюминия — соль образована амфотерным гидроксидом $Al(OH)_3$ и слабой кислотой $H_2S$, подвергается гидролизу и по катиону, и по аниону:
$2Al^{3+} + 3S^{2–} + 6HOH = 2Al(OH)_3 + 3H_2S$
Вывод: ответ Г — 2.
Ответ: 5132
Задача 6
Установите соответствие между формулой соли и уравнением её гидролиза: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | УРАВНЕНИЕ ГИДРОЛИЗА |
| А) $ZnSO_4$ Б) $K_2CO_3$ В) $CH_3COOK$ Г) $(NH_4)_2SO_4$ |
1) $CH_3COO^– + H_2O ⇄ CH_3COOH + OH^–$ 2) $NH_4^{+} + H_2O ⇄ NH_3 · H_2O + H^{+}$ 3) $Zn ^{2+} + H_2O ⇄ ZnOH^{+} + H^+$ 4) $СO_3 ^{2–} + H_2O ⇄ HCO_3^– + OH^–$ 5) $Zn^{2+} + 2H_2O ⇄ Zn(OH)_2 + _2H^{+}$ 6) $K^{+} + H_2O ⇄ KOH + H^{+}$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
Проверяем возможность протекания гидролиза и составляем ионные уравнения гидролиза.
А) $ZnSO_4$ — сульфат цинка — образован амфотерным гидроксидом $Zn(OH)_2$ и сильной кислотой $H_2SO_4$, гидролиз протекает по катиону:
$Zn^{2+} + H_2O ⇄ ZnOH^{+} + H^{+}$
Вывод: ответ А — 3.
Б) $K_2CO_3$ — карбонат калия — образован сильным основанием KOH и слабой кислотой $H_2CO_3$, гидролиз протекает по аниону:
$СO_3^{2–} + H_2O ⇄ HCO_3^{–} + OH^–$
Вывод: ответ Б — 4.
В) $CH_3COOK$ — ацетат калия — образована сильным основанием KOH и слабой кислотой $CH_3COOH$, гидролиз протекает по аниону:
$CH_3COO^{–} + H_2O ⇄ CH_3COOH + OH^–$
Вывод: ответ В — 1.
Г) $(NH_4)_2SO_4$ — сульфат аммония — соль слабого основания $NH_4OH$ и сильной кислоты $H_2SO_4$, гидролиз происходит по катиону:
$NH_4^{+} + H_2O ⇄ NH_3 · H_2O + H^+$
Вывод: ответ Г — 2.
Ответ: 3412
Задача 7
Это задача старого формата ЕГЭ, но её полезно решить для хорошего понимания темы
Установите соответствие между формулой соли и типом гидролиза этой соли: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | ТИП ГИДРОЛИЗА |
| А) $(NH_4)_2CO_3$ Б) $FeCl_3$ В) $K_2CO_3$ Г) $NaNO_2$ |
1) по катиону 2) по аниону 3) по катиону и аниону 4) гидролиз не происходит |
Запишите выбранные цифры под соответствующими буквами.
Решение
Гидролиз соли — реакция взаимодействия соли с водой, в результате которой происходит смещение положения равновесия диссоциации воды. С водой взаимодействуют ионы слабого электролита, образующиеся при диссоциации соли.
1) $(NH_4)_2CO_3$, или карбонат аммония, — соль слабого основания $NH_4OH$ и слабой кислоты $H_2CO_3$, гидролиз происходит и по катиону, и по аниону (ответ А — 3).
2) $FeCl_3$, или хлорид железа(III), — соль амфотерного гидроксида $Fe(OH)_3$ и сильной соляной кислоты, гидролиз происходит по катиону (ответ Б — 1).
3) $К_2CO_3$, или карбонат калия, — соль сильного основания КOH и слабой угольной кислоты $H_2CO_3$, гидролиз происходит по аниону (ответ В — 2).
4) $NaNO_2$, или нитрит натрия, — соль сильного основания NaOH и слабой азотистой кислоты $HNO_2$, гидролиз происходит по аниону (ответ Г — 2).
Ответ: 3122
Задача 8
Установите соответствие между формулой соли и типом её гидролиза в водном растворе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | ТИП ГИДРОЛИЗА |
| А) $Cr_2S_3$ Б) $АlСl_3$ В) $Na_2SO_4$ Г) $K_3PO_4$ |
1) гидролиз по катиону 2) гидролиз по аниону 3) гидролиз по катиону и аниону 4) гидролизу не подвергается |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) $Cr_2S_3$ — соль слабого основания и слабой кислоты, гидролизуется по катиону и аниону.
Б) $AlCl_3$ — соль слабого основания и сильной кислоты, гидролизуется по катиону.
В) $Na_2SO_4$ — соль сильного основания и сильной кислоты, гидролизу не подвергается.
Г) $K_3PO_4$ — соль сильного основания и слабой кислоты, гидролизиуется по аниону.
Ответ: 3142
Задача 9
Установите соответствие между названием соли и уравнением реакции, которая преимущественно протекает при растворении соли в воде: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ СОЛИ | УРАВНЕНИЕ ГИДРОЛИЗА |
| А) фосфат калия Б) гидрофосфат калия В) сульфид калия Г) гидросульфид калия |
1) $PO_4^{3–} + H_2O ⇄ HPO_4^{2–} + OH^–$ 2) $HPO_4^{2–} + H_2O ⇄ H_2PO_4^– + OH^–$ 3) $HSO_3^– + H_2O ⇄ H_2SO_3 + OH^–$ 4) $S^{2–} + H_2O ⇄ HS^– + OH^–$ 5) $HS^– + H_2O ⇄ H_2S + OH^–$ 6) $K^+ + H_2O ⇄ KOH + H^+$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
Перед нами уравнения гидролиза. Гидролиз идет по той части соли, которая образована слабым основанием или слабой кислотой.
А: Из всех вариантов только первый имеет ион $PO_4^{-3}$, который содержится в фосфате калия, так как калий – сильное основание, а фосфат – остаток слабой кислоты.
Б: Калий снова сильное основание, но нужен ион гидрофосфата, такой есть только во второй строчке.
В: Сульфид калия гидролизуется по слабому аниону, ищем гидролиз сульфид-иона — строчка 4.
Г: Все также, только ищем ион гидросульфида, который находится в 5 строчке.
Ответ: 1245
Задача 10
Установите соответствие между формулой соли и средой её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | СРЕДА РАСТВОРА |
| А) $(CH_3COO)_2Ca$ Б) $Fe(NO_3)_2$ В) $K_2SiO_3$ Г) $CuCl_2$ |
1) кислая 2) нейтральная 3) щелочная |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) $(CH_3COO)_2Ca$ — соль сильного основания и слабой кислоты, гидролизуется по аниону, среда щелочная.
Б) $Fe(NO_3)_3$ — соль слабого основания и сильной кислоты, гидролизуется по катиону, среда кислая.
В) $K_2SiO_3$ — соль сильного основания и слабой кислоты, гидролизуется по аниону, среда щелочная.
Г) $CuCl_2$ — соль слабого основания и сильной кислоты, гидролизуется по катиону, среда кислая.
Ответ: 3131
Задача 11
Установите соответствие между названием соли и её отношением к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
| А) бромид натрия Б) сульфат цинка В) фосфат цезия Г) гидрофосфат натрия |
1) гидролиз по катиону 2) гидролиз по аниону 3) гидролиз по катиону и аниону 4) гидролизу не подвергается |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) Бромид натрия — соль сильной кислоты и сильного основания, гидролизу не подвергается.
Б) Сульфат цинка — соль сильной кислоты и слабого основания, гидролизуется по катиону.
В) Фосфат цезия — соль слабой кислоты и сильного основания, гидролизуется по аниону.
Г) Гидрофосфат натрия — соль слабой кислоты и сильного основания, гидролизуется по аниону.
Ответ: 4122
Задача 12
Установите соответствие между названием соли и средой её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ СОЛИ | СРЕДА РАСТВОРА |
| А) хлорид натрия Б) сульфат аммония В) сульфат меди(II) Г) ортофосфат калия |
1) кислая 2) нейтральная 3) щелочная |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) хлорид натрия — соль сильного основания и сильной кислоты, раствор имеет нейтральную среду.
Б) сульфат аммония — соль слабого основания и сильной кислоты, раствор имеет кислую среду.
В) сульфат меди(II) — соль слабого основания и сильной кислоты, раствор имеет кислую среду.
Г) ортофосфат калия — соль сильного основания и слабой кислоты, раствор имеет щелочную среду.
Ответ: 2113
Рекомендуемые курсы подготовки
- 09.03.2023
Пятый тренировочный вариант, составленный на основе демоверсии ЕГЭ 2023 года по химии от ФИПИ. Вариант включает все задания кодификатора 2023 года и учитывает все изменения, которые произошли в 2023 году (полный список изменений). Вариант содержит правильные ответы и подробные разборы для второй части теста — задания повышенной сложности. Ответы сохранены в конце варианта.
- Другие тренировочные варианты по химии
В варианте присутствуют задания на знание химических элементов и соединений, на составление и балансировку химических уравнений, на расчет массы вещества и концентрации растворов, а также на проведение простых химических экспериментов. Сам тренировочный вариант состоит из нескольких частей. В первой части представлены задания на знание химических элементов и соединений. Вторая часть содержит задания на балансировку химических уравнений и расчет массы вещества. Третья часть включает задания на расчет концентрации растворов и проведение простых химических экспериментов.
Задания из тренировочного варианта №5
Вещества для заданий с 1 по 3. 1) Не 2) Са 3) Cr 4) Cl 5) Se
Задание 1. Из указанных в ряду элементов выберите два элемента, атомы которых имеют сходную конфигурацию внешнего электронного слоя.
Задание 2. Из указанных в ряду химических элементов выберите три элемента, находящихся в одном периоде. Расположите выбранные элементы в порядке увеличения электроотрицательности.
Задание 3. Из указанных в ряду элементов выберите два элемента, в соединении с которыми водород способен проявлять отрицательную степень окисления.
Задание 4. Из предложенного перечня выберите два вещества, между молекулами которых образуются водородные связи.
- метилэтиловый эфир
- аланин
- триметиламин
- плавиковая кислота
- серная кислота
Задание 11. Из предложенного перечня выберите два вещества, являющиеся межклассовыми изомерами.
- нитроэтан
- пропанол-1
- глицин
- диметиловый эфир
- этиламин
Задание 13. Из предложенного перечня выберите два вещества, с каждым из которых может взаимодействовать метиламин.
- С6Н6
- О2
- СН4
- KOH
- СН3(СН2)2СООН
Задание 17. Из предложенного перечня выберите все наборы веществ, реакция между которыми протекает без изменения степени окисления.
- C2H6 и Cl2 (hν)
- фенол и NaOH
- NO2 и H2O
- Na2O2 и H2O (t°)
- K2CrO4 и H2SO4
Задание 18. Из предложенного перечня выберите все факторы, приводящие к уменьшению скорости реакции алюминиевой пластинки с 15%-ным раствором серной кислоты.
- добавление твердой щелочи
- добавление хлорида алюминия
- увеличение концентрации кислоты до 95%
- использование пластинки большей толщины
- замена серной кислоты на уксусную такой же концентрации
Задание 21. Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
- поваренная соль
- серная кислота
- нитрит натрия
- акриловая кислота
Запишите номера веществ в порядке возрастания значения pH их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
Смотреть в PDF:
Или прямо сейчас: cкачать в pdf файле.