Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при уменьшении давления в системе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) практически не смещается
Запишите в ответ цифры, расположив их в порядке, соответствующим буквам:
Спрятать решение
Решение.
Если на систему, находящуюся в равновесии оказать внешнее воздействие, то равновесие сместится в сторону, ослабляющую это воздействие. Если внешним воздействием является уменьшение давления, то система будет стремиться увеличить давление, а значит, равновесие будет смещаться в сторону большего количества газообразных частиц.
А) 1 моль ↔ 4 моль, равновесие сместится в сторону продуктов реакции (1).
Б) 2 моль ↔ 3 моль, равновесие сместится в сторону продуктов реакции (1).
В) 4 моль ↔ 2 моль, равновесие сместится в сторону исходных веществ (2).
Г) 2 моль ↔ 2 моль, равновесие практически не смещается (3).
Ответ: 1123.
Источник: Типовые тестовые задания по химии под редакцией Ю. Н. Медведева. 2016 г.
Пройти тестирование по 10 заданиям
Пройти тестирование по всем заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) смещается в сторону продуктов реакции
2) смещается в сторону исходных веществ
3) не происходит смещения равновесия
Запишите в ответ цифры, расположив их в порядке, соответствующим буквам:
Источник: Демонстрационная версия ЕГЭ—2016 по химии
2
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) практически не смещается
Запишите в ответ цифры, расположив их в порядке, соответствующим буквам:
Источник: Типовые тестовые задания по химии под редакцией Ю. Н. Медведева. 2016 г.
3
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) практически не смещается
Запишите в ответ цифры, расположив их в порядке, соответствующим буквам:
Источник: Типовые тестовые задания по химии под редакцией Ю. Н. Медведева. 2016 г.
4
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) практически не смещается
Запишите в ответ цифры, расположив их в порядке, соответствующим буквам:
Источник: Типовые тестовые задания по химии под редакцией Ю. Н. Медведева. 2016 г.
5
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при уменьшении давления в системе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) практически не смещается
Запишите в ответ цифры, расположив их в порядке, соответствующим буквам:
Источник: Типовые тестовые задания по химии под редакцией Ю. Н. Медведева. 2016 г.
Пройти тестирование по этим заданиям
SuperEGE.ru
- 34
- 36
- 37
- 38
- 39
- 40
- 41
- 42
- 43
- 44
- 45
- 46
- 47
- 48
- 49
- 50
- 51
- 52
- 53
- 54
- 55
- 56
- 57
- 58
- 59
- 60
- 61
- 62
- 63
- 64
- 65
- 66
- 67
- 68
- 81
- 527
- 528
- 529
- 530
- 531
- 532
- 533
- 534
- 535
- 536
- 537
- 538
- 539
- 540
- 541
- 542
- 543
- 544
- 545
- 546
- 547
- 548
- 549
- 550
- 551
- 552
- 553
- 554
- 555
- 556
- 557
- 558
- 559
- 560
- 561
- 562
- 563
- 564
- 565
- 566
- 567
- 568
- 569
- 570
- 571
- 572
- 573
- 574
- 575
- 576
- 577
- 578
- 579
- 580
- 581
- 582
- 583
- 584
- 585
- 586
- 587
- 588
- 589
- 590
- 591
- 592
- 593
- 594
- 595
- 596
- 597
- 598
- 599
- 600
- 601
- 602
- 603
- 604
- 605
- 606
- 607
- 608
- 609
- 610
- 611
- 612
- 613
- 614
- 615
- 616
- 617
- 618
- 619
- 620
- 621
- 622
- 623
- 624
- 625
- 626
- 627
- 628
- 629
- 630
- 631
- 667
- 668
- 669
- 670
- 671
- 672
- 673
- 674
- 675
- 676
- 677
- 678
- 679
- 680
- 681
- 682
- 683
- 684
- 685
- 686
- 687
- 688
- 689
- 690
- 691
- 692
- 693
- 694
- 695
- 696
- 697
- 698
- 699
- 700
- 701
- 702
- 703
- 704
- 705
- 706
- 707
- 708
- 709
- 710
- 711
- 712
- 713
- 714
- 715
- 716
- 717
- 718
- 719
- 720
- 721
- 722
- 723
- 724
- 725
- 726
- 727
- 728
- 729
- 730
- 731
- 732
- 733
- 734
- 735
- 736
- 737
- 738
- 739
- 740
- 741
- 742
- 743
- 744
- 745
- 746
- 747
- 748
- 749
- 750
- 751
- 752
- 753
- 754
- 755
- 756
- 757
- 758
- 759
- 760
- 761
- 762
- 763
- 764
- 765
- 766
- 767
- 768
- 769
- 770
- 771
- 772
- 773
- 774
- 776
- 777
- 778
- 779
- 780
- 781
- 782
- 783
- 784
- 785
- 786
- 787
- 788
- 789
- 790
- 791
- 792
- 793
- 794
- 795
- 796
- 797
- 798
- 799
- 800
- 801
- 802
- 803
- 804
- 805
- 806
- 807
- 808
- 809
- 810
- 811
- 812
- 813
- 814
- 815
- 816
- 817
- 818
- 819
- 820
- 821
- 822
- 823
- 824
- 825
- 826
- 827
- 828
- 829
- 830
- 831
- 832
- 833
- 834
- 835
- 836
- 837
- 838
- 839
- 840
- 841
- 842
- 843
- 844
- 845
- 846
- 847
- 848
- 849
- 850
- 851
- 852
- 853
- 854
- 855
- 856
- 857
- 858
- 859
- 860
- 861
- 862
- 863
- 864
- 865
- 866
- 867
- 868
- 869
- 870
- 871
- 872
- 873
- 874
- 875
- 876
- 877
- 878
- 879
- 880
- 881
- 882
- 883
- 884
- 885
- 886
- 887
- 888
- 889
- 890
- 891
- 892
- 893
- 894
- 895
- 896
- 897
- 898
- 899
- 900
- 901
- 902
- 903
- 904
- 905
- 906
- 907
- 908
- 909
- 910
- 911
- 912
- 913
- 914
- 915
- 916
- 917
- 918
- 919
- 920
- 921
- 922
- 923
- 924
- 925
- 926
- 927
- 928
- 929
- 930
- 931
- 932
- 933
- 934
- 935
- 936
- 937
- 938
- 939
- 940
- 941
- 942
- 943
- 944
- 945
- 946
- 947
- 948
- 949
- 950
- 951
- 952
- 953
- 954
- 955
- 956
- 957
- 958
- 959
- 960
- 961
- 962
- 963
- 964
- 965
- 966
- 967
- 968
- 969
- 970
- 971
- 972
- 973
- 974
- 975
- 976
- 977
- 978
- 979
- 980
- 981
- 982
- 983
- 984
- 985
- 986
- 987
- 988
- 989
- 990
- 991
- 992
- 993
- 994
- 995
- 996
- 997
- 998
- 999
- 1000
- 1001
- 1002
- 1003
- 1004
- 1005
- 1006
- 1007
- 1008
- 1009
- 1010
- 1011
- 1012
- 1013
- 1014
- 1015
- 1016
- 1017
- 1018
- 1019
- 1020
- 1021
- 1022
- 1023
- 1024
- 1025
- 1026
- 1027
- 1028
- 1029
- 1030
- 1031
- 1032
- 1033
- 1034
- 1035
- 1036
- 1037
- 1038
- 1039
- 1040
- 1041
- 1042
- 1043
- 1044
- 1045
- 1046
- 1047
- 1048
- 1049
- 1050
- 1051
- 2918
- 2919
- 2920
- 2921
- 2922
- 2923
- 2924
- 2925
- 2926
- 2927
- 2928
- 2929
- 2930
- 2931
- 2932
- 2933
- 2934
- 2935
- 2936
- 2937
- 2938
- 2939
- 2940
- 2941
- 2942
- 2943
- 2944
- 2945
- 2946
- 2947
- 2948
- 2949
- 2950
- 2951
- 2952
- 2953
- 2954
- 2955
- 2956
- 2957
- 2958
- 2959
- 2960
- 2961
- 2962
- 2963
- 2964
- 2965
- 2966
- 2967
- 2968
- 2969
- 2970
- 2971
- 2972
- 2973
- 2974
- 2975
- 2976
- 2977
- 2978
- 2979
- 2980
- 2981
- 2982
- 2983
- 2984
- 2985
- 2986
- 2987
- 3026
- 3027
- 3028
- 3029
- 3030
- 3031
- 3032
- 3033
- 3034
- 3035
- 3036
- 3037
- 3038
- 3039
- 3040
- 3041
- 3042
- 3043
- 3044
- 3045
- 3046
- 3047
- 3048
- 3049
- 3050
- 3051
- 3052
- 3053
- 3054
- 3055
- 3056
- 3057
- 3058
- 3059
- 3060
- 3841
- 3876
- 3905
- 3954
- 3989
- 4124
- 4159
- 4194
- 4229
- 4264
- 4369
- 4524
- 4559
- 4594
- 4805
- 4806
- 4807
- 4808
- 4809
- 4810
- 4811
- 4812
- 4813
- 4814
- 4815
- 4816
- 4817
- 4818
- 4819
- 4820
- 4821
- 4822
- 4823
- 4824
- 4825
- 4826
- 4827
- 4828
- 4829
- 4830
- 4831
- 4832
- 4833
- 4834
- 4835
- 4836
- 4837
- 4838
- 4839
- 4841
- 4842
- 4843
- 4844
- 4845
- 4846
- 4847
- 4848
- 4849
- 4850
- 4851
- 4852
- 4853
- 4854
- 4855
- 4856
- 4857
- 4858
- 4859
- 4860
- 4861
- 4862
- 4863
- 4864
- 4865
- 4866
- 4867
- 4868
- 4869
- 4870
- 4871
- 4872
- 4873
- 4874
- 4875
- 4876
- 4877
- 4878
- 4879
- 4880
- 4881
- 4882
- 4883
- 4884
- 4885
- 4886
- 4887
- 4888
- 4889
- 4890
- 4891
- 4892
- 4893
- 4894
- 4895
- 4896
- 4897
- 4898
- 4899
- 4900
- 4901
- 4902
- 4903
- 4904
- 4905
- 4906
- 4907
- 4908
- 4909
- 4910
- 4946
- 4947
- 4948
- 4949
- 4950
- 4951
- 4952
- 4953
- 4954
- 4955
- 4956
- 4957
- 4958
- 4959
- 4960
- 4961
- 4962
- 4963
- 4964
- 4965
- 4966
- 4967
- 4968
- 4969
- 4970
- 4971
- 4972
- 4973
- 4974
- 4975
- 4976
- 4977
- 4978
- 4979
- 4980
- 4981
- 4982
- 4983
- 4984
- 4985
- 4986
- 4987
- 4988
- 4989
- 4990
- 4991
- 4992
- 4993
- 4994
- 4995
- 4996
- 4997
- 4998
- 4999
- 5000
- 5001
- 5002
- 5003
- 5004
- 5005
- 5006
- 5007
- 5008
- 5009
- 5010
- 5011
- 5012
- 5013
- 5014
- 5015
- 5016
- 5017
- 5018
- 5019
- 5020
- 5021
- 5022
- 5023
- 5024
- 5025
- 5026
- 5027
- 5028
- 5029
- 5030
- 5031
- 5032
- 5033
- 5034
- 5035
- 5036
- 5037
- 5038
- 5039
- 5040
- 5041
- 5042
- 5043
- 5044
- 5045
- 5046
- 5047
- 5048
- 5049
- 5050
- 5051
- 5052
- 5053
- 5054
- 5055
- 5056
- 5057
- 5058
- 5059
- 5060
- 5061
- 5062
- 5063
- 5064
- 5065
- 5066
- 5067
- 5068
- 5069
- 5070
- 5071
- 5072
- 5073
- 5074
- 5075
- 5076
- 5077
- 5078
- 5079
- 5080
- 5081
- 5082
- 5083
- 5084
- 5085
- 5086
- 5087
- 5088
- 5089
- 5090
- 5091
- 5092
- 5093
- 5094
- 5095
- 5096
- 5097
- 5098
- 5099
- 5100
- 5101
- 5102
- 5103
- 5104
- 5105
- 5106
- 5107
- 5108
- 5109
- 5110
- 5111
- 5112
- 5113
- 5114
- 5115
- 5116
- 5117
- 5118
- 5119
- 5120
- 5123
- 5124
- 5125
- 5126
- 5127
- 5128
- 5129
- 5130
- 5131
- 5132
- 5133
- 5134
- 5135
- 5136
- 5137
- 5138
- 5139
- 5140
- 5141
- 5142
- 5143
- 5144
- 5145
- 5146
- 5147
- 5148
- 5149
- 5150
- 5151
- 5152
- 5153
- 5154
- 5155
- 5156
- 5157
- 5158
- 5159
- 5160
- 5161
- 5162
- 5163
- 5164
- 5165
- 5166
- 5167
- 5168
- 5169
- 5170
- 5171
- 5172
- 5173
- 5174
- 5175
- 5176
- 5177
- 5178
- 5179
- 5180
- 5181
- 5182
- 5183
- 5184
- 5185
- 5186
- 5187
- 5188
- 5189
- 5190
- 5191
- 5192
- 5275
- 5277
- 5279
- 5280
- 5281
- 5282
- 5283
- 5284
- 5285
- 5286
- 5287
- 5288
- 5289
- 5290
- 5291
- 5292
- 5293
- 5294
- 5295
- 5296
- 5297
- 5298
- 5299
- 5300
- 5301
- 5302
- 5303
- 5304
- 5305
- 5306
- 5307
- 5310
- 5312
- 5314
- 5315
- 5316
- 5317
- 5318
- 5319
- 5320
- 5321
- 5322
- 5323
- 5324
- 5325
- 5326
- 5327
- 5328
- 5329
- 5330
- 5331
- 5332
- 5333
- 5334
- 5335
- 5336
- 5337
- 5338
- 5339
- 5340
- 5341
- 5342
- 5345
- 5347
- 5349
- 5350
- 5351
- 5352
- 5353
- 5354
- 5355
- 5356
- 5357
- 5358
- 5359
- 5360
- 5361
- 5362
- 5363
- 5364
- 5365
- 5366
- 5367
- 5368
- 5369
- 5370
- 5371
- 5372
- 5373
- 5374
- 5375
- 5376
- 5377
- 5440
- 5442
- 5444
- 5445
- 5446
- 5447
- 5448
- 5449
- 5450
- 5451
- 5452
- 5453
- 5454
- 5455
- 5456
- 5457
- 5458
- 5459
- 5460
- 5461
- 5462
- 5463
- 5464
- 5465
- 5466
- 5467
- 5468
- 5469
- 5470
- 5471
- 5472
- 5475
- 5477
- 5479
- 5480
- 5481
- 5482
- 5483
- 5484
- 5485
- 5486
- 5487
- 5488
- 5489
- 5490
- 5491
- 5492
- 5493
- 5494
- 5495
- 5496
- 5497
- 5498
- 5499
- 5500
- 5501
- 5502
- 5503
- 5504
- 5505
- 5506
- 5507
- 5510
- 5512
- 5514
- 5515
- 5516
- 5517
- 5518
- 5519
- 5520
- 5521
- 5522
- 5523
- 5524
- 5525
- 5526
- 5527
- 5528
- 5529
- 5530
- 5531
- 5532
- 5533
- 5534
- 5535
- 5536
- 5537
- 5538
- 5539
- 5540
- 5541
- 5542
- 5876
- 5877
- 5878
- 5879
- 5880
- 5881
- 5882
- 5883
- 5884
- 5885
- 5886
- 5887
- 5888
- 5889
- 5890
- 5891
- 5892
- 5893
- 5894
- 5895
- 5896
- 5897
- 5898
- 5899
- 5900
- 5901
- 5902
- 5903
- 5904
- 5905
- 5906
- 5907
- 5908
- 5909
- 5910
- 5941
- 5945
- 5946
- 5947
- 5948
- 5949
- 5950
- 5951
- 5952
- 5953
- 5954
- 5955
- 5956
- 5957
- 5958
- 5959
- 5960
- 5961
- 5962
- 5963
- 5964
- 5965
- 5966
- 5967
- 5968
- 5969
- 5970
- 5976
- 5980
- 5981
- 5982
- 5983
- 5984
- 5985
- 5986
- 5987
- 5988
- 5989
- 5990
- 5991
- 5992
- 5993
- 5994
- 5995
- 5996
- 5997
- 5998
- 5999
- 6000
- 6001
- 6002
- 6003
- 6004
- 6005
- 6011
- 6015
- 6016
- 6017
- 6018
- 6019
- 6020
- 6021
- 6022
- 6023
- 6024
- 6025
- 6026
- 6027
- 6028
- 6029
- 6030
- 6031
- 6032
- 6033
- 6034
- 6035
- 6036
- 6037
- 6038
- 6039
- 6040
- 6046
- 6050
- 6051
- 6052
- 6053
- 6054
- 6055
- 6056
- 6057
- 6058
- 6059
- 6060
- 6061
- 6062
- 6063
- 6064
- 6065
- 6066
- 6067
- 6068
- 6069
- 6070
- 6071
- 6072
- 6073
- 6074
- 6075
- 6081
- 6085
- 6086
- 6087
- 6088
- 6089
- 6090
- 6091
- 6092
- 6093
- 6094
- 6095
- 6096
- 6097
- 6098
- 6099
- 6100
- 6101
- 6102
- 6103
- 6104
- 6105
- 6106
- 6107
- 6108
- 6109
- 6110
- 6116
- 6120
- 6121
- 6122
- 6123
- 6124
- 6125
- 6126
- 6127
- 6128
- 6129
- 6130
- 6131
- 6132
- 6133
- 6134
- 6135
- 6136
- 6137
- 6138
- 6139
- 6140
- 6141
- 6142
- 6143
- 6144
- 6145
- 6151
- 6155
- 6156
- 6157
- 6158
- 6159
- 6160
- 6161
- 6162
- 6163
- 6164
- 6165
- 6166
- 6167
- 6168
- 6169
- 6170
- 6171
- 6172
- 6173
- 6174
- 6175
- 6176
- 6177
- 6178
- 6179
- 6180
- 6186
- 6190
- 6191
- 6192
- 6193
- 6194
- 6195
- 6196
- 6197
- 6198
- 6199
- 6200
- 6201
- 6202
- 6203
- 6204
- 6205
- 6206
- 6207
- 6208
- 6209
- 6210
- 6211
- 6212
- 6213
- 6214
- 6215
- 6221
- 6225
- 6226
- 6227
- 6228
- 6229
- 6230
- 6231
- 6232
- 6233
- 6234
- 6236
- 6237
- 6238
- 6239
- 6240
- 6241
- 6242
- 6243
- 6244
- 6245
- 6246
- 6247
- 6248
- 6249
- 6250
- 6256
- 6260
- 6261
- 6262
- 6263
- 6264
- 6265
- 6266
- 6267
- 6268
- 6269
- 6270
- 6271
- 6272
- 6273
- 6274
- 6275
- 6276
- 6277
- 6278
- 6279
- 6280
- 6281
- 6282
- 6283
- 6284
- 6285
- 6373
- 6377
- 6378
- 6379
- 6380
- 6381
- 6382
- 6383
- 6384
- 6385
- 6386
- 6387
- 6388
- 6389
- 6390
- 6391
- 6392
- 6393
- 6394
- 6395
- 6396
- 6397
- 6398
- 6399
- 6400
- 6401
- 6402
- 6408
- 6412
- 6413
- 6414
- 6415
- 6416
- 6417
- 6418
- 6419
- 6420
- 6421
- 6422
- 6423
- 6424
- 6425
- 6426
- 6427
- 6428
- 6429
- 6430
- 6431
- 6432
- 6433
- 6434
- 6435
- 6436
- 6437
- 6443
- 6447
- 6448
- 6449
- 6450
- 6451
- 6452
- 6453
- 6454
- 6455
- 6456
- 6457
- 6458
- 6459
- 6460
- 6461
- 6462
- 6463
- 6464
- 6465
- 6466
- 6467
- 6468
- 6469
- 6470
- 6471
- 6472
- 6478
- 6482
- 6483
- 6484
- 6485
- 6486
- 6487
- 6488
- 6489
- 6490
- 6491
- 6492
- 6493
- 6494
- 6495
- 6496
- 6497
- 6498
- 6499
- 6500
- 6501
- 6502
- 6503
- 6504
- 6505
- 6506
- 6507
- 6513
- 6517
- 6518
- 6519
- 6520
- 6521
- 6522
- 6523
- 6524
- 6525
- 6526
- 6527
- 6528
- 6529
- 6530
- 6531
- 6532
- 6533
- 6534
- 6535
- 6536
- 6537
- 6538
- 6539
- 6540
- 6541
- 6542
- 6581
- 6582
- 6583
- 6584
- 6585
- 6586
- 6587
- 6588
- 6589
- 6590
- 6591
- 6592
- 6593
- 6594
- 6595
- 6596
- 6597
- 6598
- 6599
- 6600
- 6601
- 6602
- 6603
- 6604
- 6605
- 6606
- 6607
- 6608
- 6609
- 6610
- 6611
- 6612
- 6613
- 6614
- 6996
- 7001
- 7002
- 7030
- 7035
- 7064
- 7069
- 7098
- 7103
- 7132
- 7137
- 7166
- 7171
- 7200
- 7205
- 7234
- 7239
- 7268
- 7273
- 7302
- 7307
- 7336
- 7341
- 7370
- 7375
- 7404
- 7409
- 7438
- 7443
- 7502
- 7503
- 7506
- 7511
- 7519
- 7524
- 7527
- 7528
- 7530
- 7601
- 7602
- 7603
- 7604
- 7605
- 7606
- 7607
- 7608
- 7609
- 7610
- 7611
- 7612
- 7613
- 7614
- 7615
- 7616
- 7617
- 7618
- 7619
- 7620
- 7621
- 7622
- 7623
- 7624
- 7625
- 7626
- 7627
- 7628
- 7629
- 7630
- 7631
- 7632
- 7633
- 7634
- Войти в свой аккаунт
-
Химия
-
Биология
-
Русский язык
-
Математика базовая
-
Математика профильная
Задания
для подготовки
1. Задание 24 № 4774
Установите соответствие между уравнением
химической реакции и направлением смещения химического равновесия при
увеличении давления в системе: к каждой позиции, обозначенной буквой, подберите
соответствующую позицию, обозначенную цифрой.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ УРАВНЕНИЕ
РЕАКЦИИ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
3) не
происходит смещения равновесия
Запишите в ответ цифры, расположив их
в порядке, соответствующим буквам:
Решение.
По правилу Ле-Шателье, при увеличении
давления в системе равновесие сдвинется в сторону реакции с меньшим
количеством моль газов в качестве продукта,
значит:
—
1) смещается в сторону
продуктов реакции.
—
1) смещается в сторону
продуктов реакции.
—
3) не происходит смещения равновесия.
— 1) смещается в
сторону продуктов реакции.
Ответ: 1131.
1/59
2. 6278
НАПРАВЛЕНИЕ СМЕЩЕНИЯ УРАВНЕНИЕ
РЕАКЦИИ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
3)
практически не смещается
Запишите в ответ цифры, расположив их
в порядке, соответствующим буквам:
Решение.
Если на систему, находящуюся в
равновесии оказать внешнее воздействие, то равновесие сместится в сторону, ослабляющую
это воздействие. Если внешним воздействием является увеличение давления, то
система будет стремиться уменьшить давление, а значит, равновесие будет
смещаться в сторону меньшего количества газообразных
частиц.
А) 1 моль ↔ 2 моль, равновесие
сместится в сторону исходных веществ (2).
Б) 3 моль ↔ 2 моль, равновесие
сместится в сторону продуктов реакции
(1).
В) 2 моль ↔ 2 моль, равновесие
практически не смещается (3).
Г) 2 моль ↔ 1 моль, равновесие
сместится в сторону продуктов реакции
(1).
Ответ: 2131.
2/59
3. 6279
УРАВНЕНИЕ
РЕАКЦИИ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
3)
практически не смещается
Запишите в ответ цифры, расположив их
в порядке, соответствующим буквам:
Решение.
Если на систему, находящуюся в
равновесии оказать внешнее воздействие, то равновесие сместится в сторону,
ослабляющую это воздействие. Если внешним воздействием является увеличение
давления, то система будет стремиться уменьшить давление, а значит, равновесие
будет смещаться в сторону меньшего количества
газообразных частиц.
А) 4 моль ↔ 2 моль, равновесие
сместится в сторону продуктов
реакции (1).
Б) 3 моль ↔ 2 моль, равновесие
сместится в сторону продуктов
реакции (1).
В) 2 моль ↔ 2 моль, равновесие
практически не смещается (3).
Г) 1 моль ↔ 2 моль, равновесие
сместится в сторону исходных
веществ (2).
Ответ: 1132.
3/59
4. 6280
НАПРАВЛЕНИЕ СМЕЩЕНИЯ УРАВНЕНИЕ
РЕАКЦИИ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
3)
практически не смещается
Запишите в ответ цифры, расположив их
в порядке, соответствующим буквам:
Решение.
Если на систему, находящуюся в
равновесии оказать внешнее воздействие, то равновесие сместится в сторону,
ослабляющую это воздействие. Если внешним воздействием является увеличение
давления, то система будет стремиться уменьшить давление, а значит, равновесие
будет смещаться в сторону меньшего количества
газообразных частиц.
А) 1 моль ↔ 2 моль, равновесие
сместится в сторону исходных
веществ (2).
Б) 3 моль ↔ 2 моль, равновесие
сместится в сторону продуктов
реакции (1).
В) 2 моль ↔ 2 моль, равновесие
практически не смещается (3).
Г) 4 моль ↔ 2 моль, равновесие
сместится в сторону продуктов
реакции (1).
Ответ: 2131.
4/59
5. 6281
уменьшении
УРАВНЕНИЕ
РЕАКЦИИ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
3)
практически не смещается
Запишите в ответ цифры, расположив их
в порядке, соответствующим буквам:
Решение.
Если на систему, находящуюся в
равновесии оказать внешнее воздействие, то равновесие сместится в сторону,
ослабляющую это воздействие. Если внешним воздействием является уменьшение
давления, то система будет стремиться увеличить давление, а значит, равновесие
будет смещаться в сторону большего количества
газообразных частиц.
А) 1 моль ↔ 4 моль, равновесие
сместится в сторону продуктов
реакции (1).
Б) 2 моль ↔ 3 моль, равновесие
сместится в сторону продуктов
реакции (1).
В) 4 моль ↔ 2 моль, равновесие
сместится в сторону исходных
веществ (2).
Г) 2 моль ↔ 2 моль, равновесие
практически не смещается (3).
Ответ: 1123.
5/59
6. 6282
НАПРАВЛЕНИЕ СМЕЩЕНИЯ
УРАВНЕНИЕ
РЕАКЦИИ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
3)
практически не смещается
Запишите в ответ цифры, расположив их
в порядке, соответствующим буквам:
Решение.
Если на систему, находящуюся в
равновесии оказать внешнее воздействие, то равновесие сместится в сторону,
ослабляющую это воздействие. Если внешним воздействием является увеличение
давления, то система будет стремиться уменьшить давление, а значит, равновесие
будет смещаться в сторону меньшего количества
газообразных частиц.
А) 0 моль ↔ 1 моль (учитываем только газы),
равновесие сместится в сторону
исходных веществ (2).
Б) 2 моль ↔ 3 моль, равновесие
сместится в сторону исходных
веществ (2).
В) 0 моль ↔ 0 моль (учитываем только газы),
равновесие практически не
смещается (3).
Г) 2 моль ↔ 1 моль, равновесие
сместится в сторону продуктов
реакции (1).
Ответ: 2231.
6/59
7. 6283
УРАВНЕНИЕ
РЕАКЦИИ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
3)
практически не смещается
Запишите в ответ цифры, расположив их
в порядке, соответствующим буквам:
Решение.
Если на систему, находящуюся в
равновесии оказать внешнее воздействие, то равновесие сместится в сторону,
ослабляющую это воздействие. Если внешним воздействием является увеличение
давления, то система будет стремиться уменьшить давление, а значит, равновесие
будет смещаться в сторону меньшего количества
газообразных частиц.
А) 4 моль ↔ 2 моль, равновесие
сместится в сторону продуктов
реакции (1).
Б) 3 моль ↔ 2моль, равновесие
сместится в сторону продуктов
реакции (1).
В) 2 моль ↔ 2 моль, равновесие
практически не смещается (3).
Г) 2 моль ↔ 1 моль, равновесие
сместится в сторону продуктов
реакции (1).
Ответ: 1131.
7/59
8. 6284
НАПРАВЛЕНИЕ СМЕЩЕНИЯ УРАВНЕНИЕ
РЕАКЦИИ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
3)
практически не смещается
Запишите в ответ цифры, расположив их
в порядке, соответствующим буквам:
Решение.
Если на систему, находящуюся в
равновесии оказать внешнее воздействие, то равновесие сместится в сторону,
ослабляющую это воздействие. Если внешним воздействием является увеличение
давления, то система будет стремиться уменьшить давление, а значит, равновесие
будет смещаться в сторону меньшего количества
газообразных частиц.
А) 1 моль ↔ 2 моль, равновесие
сместится в сторону исходных
веществ (2).
Б) 3 моль ↔ 2моль, равновесие
сместится в сторону продуктов
реакции (1).
В) 2 моль ↔ 4 моль, равновесие
сместится в сторону исходных
веществ (2).
Г) 2 моль ↔ 2 моль, равновесие
практически не смещается (3).
Ответ: 2123.
8/59
9. 6285
уменьшении
НАПРАВЛЕНИЕ СМЕЩЕНИЯ УРАВНЕНИЕ
РЕАКЦИИ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
3)
практически не смещается
Запишите в ответ цифры, расположив их
в порядке, соответствующим буквам:
Решение.
Если на систему, находящуюся в
равновесии оказать внешнее воздействие, то равновесие сместится в сторону,
ослабляющую это воздействие. Если внешним воздействием является уменьшение
давления, то система будет стремиться увеличить давление, а значит, равновесие
будет смещаться в сторону большего количества
газообразных частиц.
А) 0 моль ↔ 1 моль (учитываем только газы),
равновесие сместится в сторону
продуктов реакции (1).
Б) 3 моль ↔ 2моль, равновесие
сместится в сторону исходных
веществ (2).
В) 4 моль ↔ 2 моль, равновесие
сместится в сторону исходных
веществ (2).
Г) 1 моль ↔ 2 моль (учитываем только газы),
равновесие сместится в сторону
продуктов реакции (1).
Ответ: 1221.
9/59
НАПРАВЛЕНИЕ СМЕЩЕНИЯ УРАВНЕНИЕ
РЕАКЦИИ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
3)
практически не смещается
Запишите в ответ цифры, расположив их
в порядке, соответствующим буквам:
Решение.
Если на систему, находящуюся в
равновесии оказать внешнее воздействие, то равновесие сместится в сторону, ослабляющую
это воздействие. Если внешним воздействием является увеличение давления, то
система будет стремиться уменьшить давление, а значит, равновесие будет
смещаться в сторону меньшего количества
газообразных частиц.
А) 2 моль ↔ 1 моль, равновесие
сместится в сторону продуктов
реакции (1).
Б) 3 моль ↔ 2 моль, равновесие
сместится в сторону продуктов
реакции (1).
В) 1 моль ↔ 2 моль (учитываем только газы),
равновесие сместится в сторону
исходных веществ (2).
Г) 2 моль ↔ 1 моль, равновесие
сместится в сторону продуктов
реакции (1).
Ответ: 1121.
10/59
НАПРАВЛЕНИЕ СМЕЩЕНИЯ
УРАВНЕНИЕ
РЕАКЦИИ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
3)
практически не смещается
Запишите в ответ цифры, расположив их
в порядке, соответствующим буквам:
Решение.
Если на систему, находящуюся в равновесии
оказать внешнее воздействие, то равновесие сместится в сторону, ослабляющую это
воздействие. Если внешним воздействием является увеличение давления, то система
будет стремиться уменьшить давление, а значит, равновесие будет смещаться в
сторону меньшего количества
газообразных частиц.
А) 1 моль ↔ 2 моль (учитываем только газы),
равновесие сместится в сторону
исходных веществ (2).
Б) 2 моль ↔ 1 моль (учитываем только газы),
равновесие сместится в сторону
продуктов реакции (1).
В) 0 моль ↔ 0 моль (учитываем только газы),
равновесие практически не
смещается (3).
Г) 2 моль ↔ 3 моль, равновесие
сместится в сторону исходных
веществ (2).
Ответ: 2132.
11/59
12. 6401
химической реакции и изменением
условий, которое
приводит к смещению равновесия в сторону продуктов: к каждой
позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.
РАВНОВЕСИЕСМЕЩАЕТСЯ В
УРАВНЕНИЕ
РЕАКЦИИ
СТОРОНУ
ПРОДУКТОВ ПРИ
3) понижении давления
Запишите в ответ цифры, расположив их
в порядке, соответствующим буквам:
Решение.
Если на систему, находящуюся в
равновесии оказать внешнее воздействие, то равновесие сместится в сторону,
ослабляющую это воздействие.
Если внешним воздействием является
увеличение давления, то система будет стремиться уменьшить давление, а
значит, равновесие будет смещаться в
сторону меньшего количества
газообразных частиц.
Если внешним воздействием является
охлаждение, то система будет стремиться повысить температуру, а значит,
равновесие будет смещаться в
сторону экзотермической реакции.
А) 1 моль ↔ 1 моль (учитываем только
газы), реакция экзотермическая, равновесие сместиться в сторону
продуктов при охлаждении (1).
Б) 1 моль ↔ 3 моль, реакция
эндотермическая, равновесие сместиться в сторону продуктов при понижении
давления (3).
В) 1 моль ↔ 2 моль (учитываем только
газы), реакция эндотермическая, равновесие сместиться в сторону
продуктов при понижении
давления (3).
Г) 1 моль ↔ 4 моль, реакция
эндотермическая, равновесие сместиться в сторону продуктов при
понижении давления (3).
Ответ: 1333.
12/59
13. 6441
химической реакции и
изменением условий, которое
приводит к смещению равновесия в сторону продуктов: к каждой
позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.
РАВНОВЕСИЕСМЕЩАЕТСЯ В
УРАВНЕНИЕ
РЕАКЦИИ
СТОРОНУ
ПРОДУКТОВ ПРИ
3)
нагревании
Запишите в ответ цифры, расположив их
в порядке, соответствующим буквам:
Решение.
Если на систему, находящуюся в равновесии
оказать внешнее воздействие, то равновесие сместится в сторону, ослабляющую это
воздействие.
Если внешним воздействием является
увеличение давления, то система будет стремиться уменьшить давление, а значит,
равновесие будет смещаться в сторону меньшего количества газообразных частиц.
Если внешним воздействием является
нагревание, то система будет стремиться понизитьтемпературу, а значит,
равновесие будет смещаться в сторону эндотермической реакции.
А) 4 моль ↔ 2 моль, реакция
экзотермическая, равновесие сместиться в сторону продуктов при повышении
давления (1).
Б) 2 моль ↔ 2 моль, реакция
эндотермическая, равновесие сместиться в сторону продуктов при нагревании (3).
В) 3 моль ↔ 2 моль, реакция
экзотермическая, равновесие сместиться в сторону продуктов при повышении
давления (1).
Г) 1 моль ↔ 2 моль (учитываем
только газы), реакция экзотермическая, равновесие сместиться в сторону
продуктов при понижении давления (2).
Ответ: 1312.
13/59
14. 6481
обратимой химической
реакции и направлением смеще‐
ния химического равновесия в результате уменьшения объёма
(сжатия) системы при постоянной температуре.
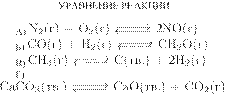
СМЕЩЕНИЯ РАВНОВЕСИЯ
1) равновесие
смещается в сторонупродуктов
2) равновесие
смещается в сторону реагентов
3) положение
равновесия не изменяется
Запишите в ответ цифры, расположив их
в порядке, соответствующим буквам:
Решение.
Если на систему, находящуюся в
равновесии оказать внешнее воздействие, то равновесие сместится в сторону,
ослабляющую это воздействие.
Если внешним воздействием является
увеличение давления (сжатие), то система будет стремиться уменьшить давление, а
значит, равновесие будет смещаться в сторону меньшего количества газообразных
частиц.
А) 2 моль ↔ 2 моль, положение
равновесия не изменяется (3).
Б) 2 моль ↔ 1 моль, равновесие
смещается в сторону продуктов (1).
В) 1 моль ↔ 2 моль (учитываем только газы),
равновесие смещается в сторону реагентов
(2).
Г) 0 моль ↔ 1 моль (учитываем только газы),
равновесие смещается в сторону реагентов
(2).
Ответ: 3122.
14/59
15. 6521
обратимой химической
реакции и направлением смеще‐
ния химического равновесия в результате увеличения
объёма (расширения) системы при постоянной температуре: к каждой позиции,
обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
УРАВНЕНИЕ
РЕАКЦИИ НАПРАВЛЕНИЕ
СМЕЩЕНИЯ РАВНОВЕСИЯ
3)
положение равновесия не изменяется
Запишите в ответ цифры, расположив их
в порядке, соответствующим буквам:
Решение.
Если на систему, находящуюся в равновесии
оказать внешнее воздействие, то равновесие сместится в сторону, ослабляющую это
воздействие.
Если внешним воздействием является
уменьшение давления (расширение), то система будет стремиться увеличить
давление, а значит, равновесие будет смещаться в сторону большего количества
газообразных частиц.
А) 3 моль ↔ 3 моль (учитываем только газы),
положение равновесия не изменяется (3).
Б) 2 моль ↔ 2 моль, положение равновесия не
изменяется (3).
В) 2 моль ↔ 4 моль, равновесие смещается в сторону
продуктов (1).
Г) 2 моль ↔ 1 моль, равновесие смещается в сторону
реагентов (2).
Ответ: 3312.
15/59
16. 6566
ского при увеличении давления в системе: к каждой позиции,
обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ УРАВНЕНИЕ
РЕАКЦИИ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
3)
практически не смещается
Запишите в ответ цифры, расположив их
в порядке, соответствующим буквам:
Решение.
Если на систему, находящуюся в
равновесии оказать внешнее воздействие, то равновесие сместится в сторону,
ослабляющую это воздействие.
Если внешним воздействием является
увеличение давления, то система будет стремиться уменьшить давление, а
значит, равновесие будет смещаться в
сторону меньшего количества
газообразных частиц.
А) 0 моль ↔ 1 моль (учитываем только газы),
равновесие смещается в сторону реагентов (2).
Б) 2 моль ↔ 3 моль, равновесие
смещается в сторону
реагентов (2).
В) 1 моль ↔ 2 моль (учитываем только газы),
равновесие смещается в
сторону реагентов (2).
Г) 2 моль ↔ 1 моль, равновесие
смещается в сторону продуктов
(1).
Ответ: 2221.
16/59
17. 6567
химической реакции и
направлением смещения химиче‐
ского равновесия при увеличении давления в системе: к каждой
позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ УРАВНЕНИЕ
РЕАКЦИИ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
3)
практически не смещается
Запишите в ответ цифры, расположив их
в порядке, соответствующим буквам:
Решение.
Если на систему, находящуюся в
равновесии оказать внешнее воздействие, то равновесие сместится в сторону,
ослабляющую это воздействие.
Если внешним воздействием является
увеличение давления, то система будет стремиться уменьшить давление, а
значит, равновесие будет смещаться в сторону
меньшего количества газообразных частиц.
А) 1 моль ↔ 2 моль, равновесие
смещается в сторону реагентов (2).
Б) 3 моль ↔ 2 моль, равновесие
смещается в сторону продуктов (1).
В) 3 моль ↔ 2 моль, равновесие
смещается в сторону продуктов (1).
Г) 2 моль ↔ 1 моль, равновесие
смещается в сторону продуктов (1).
Ответ: 2111.
17/59
18. 6568
ского при увеличении давления в системе: к каждой
позиции, обозначенной буквой, подберите
соответствующую позицию,
обозначенную цифрой.
НАПРАВЛЕНИЕ
СМЕЩЕНИЯ
|
УРАВНЕНИЕ |
ХИМИЧЕСКОГО |
3)
практически не смещается
Запишите в ответ цифры,
расположив их в порядке,
соответствующим буквам:
Решение.
Если на систему, находящуюся в
равновесии оказать внешнее воздействие, то равновесие сместится в сторону,
ослабляющую это воздействие.
Если внешним воздействием является
увеличение давления, то система будет стремиться уменьшить давление, а
значит, равновесие будет смещаться в сторону
меньшего количества газообразных частиц.
А) 0 моль ↔ 1 моль (учитываем только газы),
равновесие смещается в сторону реагентов
(2).
Б) 2 моль ↔ 1 моль, равновесие
смещается в сторону продуктов (1).
В) 4 моль ↔ 2 моль, равновесие
смещается в сторону продуктов (1).
Г) 1 моль ↔ 2 моль (учитываем только газы),
равновесие смещается в сторону реагентов
(2).
Ответ: 2112.
18/59
19. 6569
химической реакции и
направлением смещения химиче‐
ского равновесия при увеличении давления в системе: к каждой
позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ УРАВНЕНИЕ
РЕАКЦИИ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
3)
практически не смещается
Запишите в ответ цифры, расположив их
в порядке, соответствующим буквам:
Решение.
Если на систему, находящуюся в
равновесии оказать внешнее воздействие, то равновесие сместится в сторону,
ослабляющую это воздействие.
Если внешним воздействием является
увеличение давления, то система будет стремиться уменьшить давление, а
значит, равновесие будет смещаться в сторону
меньшего количества газообразных частиц.
А) 1 моль ↔ 2 моль, равновесие
смещается в сторону реагентов (2).
Б) 3 моль ↔ 2 моль, равновесие
смещается в сторону продуктов (1).
В) 2 моль ↔ 4 моль, равновесие
смещается в сторону реагентов (2).
Г) 4 моль ↔ 1 моль, равновесие
смещается в сторону продуктов (1).
Ответ: 2121.
19/59
20. 6570
ского при увеличении давления в системе: к каждой позиции,
обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ УРАВНЕНИЕ
РЕАКЦИИ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
3)
практически не смещается
Запишите в ответ цифры, расположив их
в порядке, соответствующим буквам:
Решение.
Если на систему, находящуюся в равновесии
оказать внешнее воздействие, то равновесие сместится в сторону, ослабляющую это
воздействие.
Если внешним воздействием является
увеличение давления, то система будет стремиться уменьшить давление, а значит,
равновесие будет смещаться в сторону меньшего количества газообразных частиц.
А) 1 моль ↔ 2 моль (учитываем только газы),
равновесие смещается в сторону реагентов (2).
Б) 3 моль ↔ 2 моль, равновесие смещается в сторону
продуктов (1).
В) 2 моль ↔ 2 моль, равновесие практически не
смещается (3).
Г) 2 моль ↔ 1 моль, равновесие смещается в сторону
продуктов (1).
Ответ: 2131.
20/59
21. 6618
обратимой химической
реакции и факторами, способ‐
ствующими смещению равновесия в сторону продуктов: к каждой
позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.
ФАКТОРЫ,
СПОСОБСТВУЮЩИЕ
УРАВНЕНИЕ
РЕАКЦИИ СМЕЩЕНИЮ
РАВНОВЕСИЯ В СТО‐
РОНУ ПРОДУКТОВ
3)
нагревание, увеличение давления
Запишите в ответ цифры, расположив их
в порядке, соответствующим буквам:
Решение.
Установим соответствие.
А) — эндотермическая реакция в которой
выделяется газообразный продукт, поэтому
равновесие сместится вправо под
действием факторов из варианта
№ 1.
Б) — экзотермическая реакция, в которой
происходит уменьшение количества газообразных веществ, поэтому равновесие
сместится вправо под действием факторов из варианта № 2.
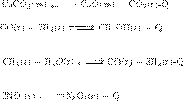
реакция в которой происходит увеличение количества газообразных продуктов,
поэтому равновесие сместится вправо под действием факторов из
варианта № 1.
Г ) — экзотермическая реакция, где
происходит уменьшение объема газов, поэтому
равновесие сместится вправо под
действием факторов из варианта
№ 2.
Ответ: 1212.
21/59
22. 6658
химической реакции и
факторами, способ‐
ствующими смещению равновесия в сторону реагентов: к каждой
позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.
ФАКТОРЫ,
СПОСОБСТВУЮЩИЕ СМЕЩЕ‐
УРАВНЕНИЕ РЕАКЦИИ
НИЮ
РАВНОВЕСИЯ
В СТОРОНУ РЕАГЕНТОВ
3) охлаждение,
увеличение давления
Запишите в ответ цифры, расположив их
в порядке, соответствующим буквам:
Решение.
Установим соответствие.
А) — эндотермическая реакция, где
происходит увеличение объема газов, поэтому
равновесие сместится в сторону
реагентов под действием
факторов из варианта № 3.
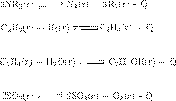
реакция, где происходит уменьшение объема газов, поэтому равновесие сместится в
сторону реагентов под действием факторов из варианта № 1.
В) — экзотермическая реакция, где
происходит уменьшение объема газов, поэтому равновесие сместится в сторону
реагентов под действием факторов из варианта № 1.
Г ) — эндотермическая реакция, где
происходит увеличение объема газов, поэтому равновесие сместится в сторону
реагентов под действием факторов из варианта № 3.
Ответ: 3113.
22/59
23. 6698
обратимой химической
реакции и направлением смеще‐
ния химического равновесия при нагревании: к каждой позиции, обозначенной
буквой, подберите соответствующую позицию, обозначенную цифрой.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ УРАВНЕНИЕ
РЕАКЦИИ
ХИМИЧЕСКОГО
РАВНОВЕСИЯ
3)
положение равновесия не
зависит от температуры
Запишите в ответ цифры, расположив их
в порядке, соответствующим буквам:
Решение.
Установите соответствие.
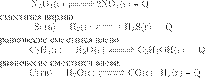
) — эндотермическая реакция, поэтому
при нагревании равновесие
Б
) — экзотермическая
реакция, поэтому при нагревании
В)
— экзотермическая
реакция, поэтому при нагревании
Г ) — эндотермическая реакция, поэтому
при нагревании равновесие сместится вправо.
Ответ: 1221.
23/59
24. 6738
химической реакции и
направлением смеще‐
ния химического равновесия при охлаждении: к каждой позиции,
обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ
УРАВНЕНИЕ
РЕАКЦИИ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
Запишите в ответ цифры, расположив их
в порядке, соответствующим буквам:
Решение.
Установим соответствие.
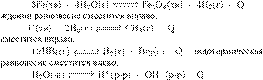
) экзотермическая
реакция, поэтому при охла‐
Б)
экзотермическая
реакция, поэтому при охлаждении равновесие
В реакция,
поэтому при охлаждении
Г ) эндотермическая реакция, поэтому
при охлаждении равновесие сместится влево.
Ответ: 1122.
24/59
25. 6787
Установите соответствие между
способом воздействия на
равновесную систему
и смещением химического
равновесия в результате этого воздействия: к каждой позиции,
обозначенной буквой, подберите соответствующую позицию,
обозначенную цифрой.
СМЕЩЕНИЕ
ХИМИЧЕСКОГО
ВОЗДЕЙСТВИЕ НА
СИСТЕМУ
РАВНОВЕСИЯ
А) уменьшение температуры 1)
в сторону прямой реакции
Б) уменьшение
концентрации углекислого газа 2)
в сторону обратной реакции
В) уменьшение давления 3)
практически не смещается
Г) добавление катализатора
Запишите в ответ цифры, расположив их
в порядке, соответствующим буквам:
Решение.
Это экзотермическая реакция в которой
происходит уменьшение количества газообразных веществ, поэтому:
А) уменьшение температуры приведет к
смещению химического равновесия в сторону прямой реакции (1).
Б) уменьшение концентрации углекислого
газа приведет к смещению химического равновесия в сторону
обратной реакции (2).
В) уменьшение давления
приведет к смещению химического равновесия в сторону обратной реакции
(2).
Г) добавление катализатора влияет лишь
на скорость реакций, а не на состояние химического равновесия,
поэтому практически не
смещается (3).
Ответ: 1223.
25/59
26. 6827
химической реакции и
направлением смеще‐
ния химического равновесия при увеличении давления: к каждой
позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ
УРАВНЕНИЕ
РЕАКЦИИ
ХИМИЧЕСКОГО
РАВНОВЕСИЯ
3)
положение равновесия не
зависит от давления
Запишите в ответ цифры, расположив их
в порядке, соответствующим буквам:
Решение.
При увеличении давления равновесие
обратимой реакции сдвигается в сторону уменьшения давления, то есть в
сторону меньшего количества газообразных
частиц:
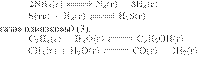
в сторону исходных веществ (2).
Б)
— положение равновесия не зависит от
давления (количества моль
В) —
в сторону продуктов реакции (1).
Г) —
в сторону исходных веществ (2).
Ответ: 2312.
26/59
27. 6867
между уравнением обратимой
химической реакции и направлением смеще‐
ния химического равновесия при уменьшении давления: к каждой
позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ УРАВНЕНИЕ
РЕАКЦИИ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
3)
положение равновесия не
зависит от давления
Запишите в ответ цифры, расположив их
в порядке, соответствующим буквам:
Решение.
При уменьшении давления равновесие
обратимой реакции сдвигается в сторону увеличения давления, то есть в
сторону большего количества газообразных
продуктов:
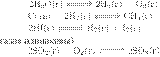
1) в сторону продуктов реакции.
Б) —
2) в сторону исходных веществ.
В)
— 3) положение равновесия не зависит от
давления (количества моль
Г) —
2) в сторону исходных веществ.
Ответ: 1232.
27/59
28. 7102
увеличении давления в системе
подберите соответствующую позицию, обозначенную цифрой.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ УРАВНЕНИЕ
РЕАКЦИИ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
3) не происходит смещения
равновесия
Запишите в ответ цифры, расположив их
в порядке, соответствующем буквам:
Решение.
По правилу Ле-Шателье, при увеличении
давления в системе равновесие сдвинется в сторону реакции с меньшим
количеством моль газов в качестве продукта,
значит:
—
1) смещается в сторону прямой
реакции.
—
1) смещается в сторону прямой
реакции.
— 3
) не происходит смещения равновесия.
—
1) смещается в сторону прямой
реакции.
Ответ: 1131.
28/59
29. 9637
Установите соответствие между способом воздействия на
равновесную систему
и направлением смещения
химического равновесия в результате этого воздействия: к каждой
позиции, обозначенной буквой, подберите соответствующую
позицию, обозначенную цифрой.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ
|
ВОЗДЕЙСТВИЕ НА СИСТЕМУ |
ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
|
А) увеличение концентрации оксида углерода Б) повышение температуры В) понижение давления Г) увеличение концентрации |
1) смещается в сторону 2) практически не смещается 3) смещается в сторону |
Запишите в ответ цифры, расположив их в порядке,
соответствующем буквам:
Решение.
Увеличение температуры смещает
равновесие экзотермической реакции в сторону обратной реакции. Увеличение
концентрации реагентов смещает равновесие в сторону прямой реакции. Понижение
давления смещает равновесие в сторону реакции, ведущей к увеличению числа
молекул газа в системе.
Ответ: 3113.
29/59
30. 9678
добавлении в систему паров воды
подберите соответствующую позицию, обозначенную цифрой.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ
УРАВНЕНИЕ
РЕАКЦИИ
РАВНОВЕСИЯ
3) не смещается
Запишите в ответ цифры, расположив их
в порядке, соответствующем буквам:
Решение.
Данное задание направлено на знание
принципа Ле-Шателье, которое звучит следующим образом: «Если на систему,
находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо
из условий равновесия (температура, давление, концентрация, внешнее
электромагнитное поле), то в системе усиливаются процессы, направленные на
компенсацию внешнего воздействия».
Таким образом, увеличивая концентрацию
реагентов, равновесие будет смещаться в сторону продуктов реакции. Увеличивая
концентрацию продуктов, равновесие будет смещаться в сторону реагентов.
Ответ: 2112.
30/59
31. 9711
между уравнением
химической реакции и направлением смещения
химического равновесия при уменьшении температуры: к каждой
позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ
УРАВНЕНИЕ РЕАКЦИИ
РАВНОВЕСИЯ
3) не смещается
Запишите в ответ цифры, расположив их в порядке,
соответствующем буквам:
Решение.
Данное задание направлено на знание
принципа Ле-Шателье, которое звучит следующим образом: «Если на систему,
находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо
из условий равновесия (температура, давление, концентрация, внешнее
электромагнитное поле), то в системе усиливаются процессы, направленные на
компенсацию внешнего воздействия».
Если реакция идет с поглощением энергии,
то при уменьшении температуры равновесие будет смещаться в сторону реагентов,
если реакция идет с выделением энергии, то уменьшение температуры приведет к
смещению равновесия в сторону продуктов реакции.
Ответ: 1212.
31/59
32. 9746
уменьшении
НАПРАВЛЕНИЕ СМЕЩЕНИЯ
УРАВНЕНИЕ
РЕАКЦИИ
РАВНОВЕСИЯ
3) не
смещается
Запишите в ответ цифры, расположив их
в порядке, соответствующем буквам:
Решение.
Данное задание направлено на знание
принципа Ле-Шателье, которое звучит следующим образом: «Если на систему,
находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо
из условий равновесия (температура, давление, концентрация, внешнее
электромагнитное поле), то в системе усиливаются процессы, направленные на
компенсацию внешнего воздействия».
Давление влияет только на компоненты в
газовом агрегатном состоянии. Если количество (по стехиометрическим
коэффициентам) газа больше среди реагентов и будет повышение давления, то
равновесие реакции сместится в сторону продуктов реакции. Если количество (по
стехиометрическим коэффициентам) газа больше среди продуктов реакции и будет
повышение давления, то равновесие реакции сместится в сторону реагентов.
А) реагентов газов 2 — продуктов газов
1, уменьшая давление, равновесие смещается в сторону реагентов.
Б) 2 → 3, уменьшая давление, равновесие смещается в
сторону продуктов реакции.
В) 2 → 2, количество газов одинаковое и увеличение
давления не приведет к смещению равновесия.
Г) 1 → 2, уменьшая давление, равновесие смещается в
сторону продуктов реакции.
Ответ: 1232.
32/59
33. 9780
между уравнением
химической реакции и направлением смещения
химического равновесия при нагревании: к каждой позиции,
обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ
|
УРАВНЕНИЕ РЕАКЦИИ |
РАВНОВЕСИЯ |
3) не смещается
Запишите в ответ цифры, расположив их в порядке,
соответствующем буквам:
Решение.
Данное задание направлено на знание
принципа Ле-Шателье, которое звучит следующим образом «Если на систему,
находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо
из условий равновесия (температура, давление, концентрация, внешнее
электромагнитное поле), то в системе усиливаются процессы, направленные на
компенсацию внешнего воздействия».
Если реакция идет с поглощением энергии,
то при повышении температуры равновесие будет смещаться в сторону продуктов
реакции, если реакция идет с выделение энергии, то увеличение температуры
приведет к смещению равновесия в сторону реагентов.
Ответ: 2211.
33/59
34. 9817
увеличении
НАПРАВЛЕНИЕ СМЕЩЕНИЯ УРАВНЕНИЕ
РЕАКЦИИ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
3) не
смещается
Запишите в ответ цифры, расположив их
в порядке, соответствующем буквам:
Решение.
Данное задание направлено на знание
принципа Ле-Шателье, которое звучит следующим образом: «Если на систему,
находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо
из условий равновесия (температура, давление, концентрация, внешнее
электромагнитное поле), то в системе усиливаются процессы, направленные на
компенсацию внешнего воздействия».
Давление влияет только на компоненты в
газовом агрегатном состоянии. Если количество (по стехиометрическим
коэффициентам) газа больше среди реагентов и будет повышение давления, то
равновесие реакции сместится в сторону продуктов реакции. Если количество (по
стехиометрическим коэффициентам) газа больше среди продуктов реакции и будет
повышение давления, то равновесие реакции сместится в сторону реагентов.
А) реагентов газов 2 — продуктов газов
1, увеличивая давление, равновесие смещается в сторону продуктов.
Б) 3 → 2, увеличивая давление, равновесие смещается
в сторону продуктов реакции.
В) 1 → 2, увеличивая давление, равновесие смещается
в сторону реагентов.
Г) 2
→ 2, количество газов одинаковое и увеличение давления не приведет к
смещению равновесия.
Ответ: 2213.
34/59
35. 9851
между уравнением
химической реакции и направлением смещения химиче‐
ского равновесия при
добавлении в систему
водорода: к каждой позиции,
обозначенной буквой, подберите
соответствующую позицию,
обозначенную цифрой.
НАПРАВЛЕНИЕ
СМЕЩЕНИЯ
УРАВНЕНИЕ
РЕАКЦИИ
ХИМИЧЕСКОГО
РАВНОВЕСИЯ
А)
1) смещается в сторону
реагентов
Б) 2) смещается в
сторону продуктов
В) 3) не смещается
Г)
Запишите в ответ цифры,
расположив их в порядке,
соответствующем буквам:
Решение.
Данное задание направлено на знание
принципа Ле-Шателье, которое звучит следующим образом «Если на систему,
находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо
из условий равновесия (температура, давление, концентрация, внешнее
электромагнитное поле), то в системе усиливаются процессы, направленные на
компенсацию внешнего воздействия».
Таким образом, увеличивая концентрацию
реагентов, равновесие будет смещаться в сторону продуктов реакции. Увеличивая
концентрацию продуктов, равновесие будет смещаться в сторону реагентов.
Ответ: 2112.
35/59
36. 9885
увеличении
НАПРАВЛЕНИЕ СМЕЩЕНИЯ
УРАВНЕНИЕ РЕАКЦИИ
РАВНОВЕСИЯ
Запишите в ответ цифры, расположив их в порядке,
соответствующем буквам:
Решение.
Данное задание направлено на знание
принципа Ле-Шателье, которое звучит следующим образом: «Если на систему,
находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо
из условий равновесия (температура, давление, концентрация, внешнее
электромагнитное поле), то в системе усиливаются процессы, направленные на
компенсацию внешнего воздействия».
Давление влияет только на компоненты в
газовом агрегатном состоянии. Если количество (по стехиометрическим
коэффициентам) газа больше среди реагентов и будет повышение давления, то
равновесие реакции сместится в сторону продуктов реакции. Если количество (по
стехиометрическим коэффициентам) газа больше среди продуктов реакции и будет
повышение давления, то равновесие реакции сместится в сторону реагентов.
А) реагентов газов 0 — продуктов газов
1, увеличивая давление, равновесие смещается в сторону реагентов.
Б) 1 → 0, увеличивая давление, равновесие смещается
в сторону продуктов реакции.
В) 1 → 2, увеличивая давление, равновесие смещается
в сторону реагентов.
Г) 4
→ 4, количество газов одинаковое и увеличение давления не приведет к
смещению равновесия.
Ответ: 1213.
36/59
37. 9919
между уравнением
химической реакции и направлением смещения
химического равновесия при добавлении в систему водорода: к
каждой позиции, обозначенной буквой, подберите соответствующую позицию,
обозначенную цифрой.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ
УРАВНЕНИЕ РЕАКЦИИ
РАВНОВЕСИЯ
3) не смещается
Запишите в ответ цифры, расположив их в порядке,
соответствующем буквам:
Решение.
Данное задание направлено на знание
принципа Ле-Шателье, которое звучит следующим образом «Если на систему,
находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо
из условий равновесия (температура, давление, концентрация, внешнее
электромагнитное поле), то в системе усиливаются процессы, направленные на
компенсацию внешнего воздействия».
Таким образом, увеличивая концентрацию
реагентов, равновесие будет смещаться в сторону продуктов реакции. Увеличивая
концентрацию продуктов, равновесие будет смещаться в сторону реагентов.
Ответ: 2112.
37/59
38. 10400
химического равновесия при увеличении общего давления.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ УРАВНЕНИЕ
РЕАКЦИИ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
3) практически не смещается
Запишите в таблицу выбранные цифры под соответствующими
буквами.
Решение.
По правилу Ле-Шателье, при увеличении
давления в системе равновесие сдвинется в сторону реакции с меньшим
количеством моль газов в качестве продукта,
значит:
А) — 2) смещается в
сторону обратной реакции;
Б)
— 2)
смещается в сторону обратной
реакции;
В) — 1)
смещается в сторону прямой
реакции;
Г) —
3) практически не смещается.
Ответ: 2213.
39. Задание 24 № 10439
Установите соответствие между уравнением
химической реакции и направлением смещения химического равновесия при
уменьшении общего давления.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ УРАВНЕНИЕ
РЕАКЦИИ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
3) практически не смещается
Запишите в таблицу выбранные цифры под соответствующими
буквами.
Решение.
По правилу Ле-Шателье, при уменьшении
давления в системе равновесие сдвинется в сторону реакции с большим
количеством моль газов в качестве продукта,
значит:
А) —
2) смещается в сторону обратной
реакции;
Б) — 2) смещается
в сторону обратной реакции; В) — 1)
смещается в сторону прямой
реакции; Г) — 3) практически не смещается.
Ответ: 2213.
38/59
40. 10670
химического равновесия при уменьшении температуры.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ
УРАВНЕНИЕ
РЕАКЦИИ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
2) 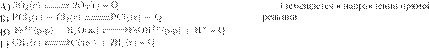
направленииобратной реакции
3) практически не смещается
Запишите в таблицу выбранные цифры под соответствующими
буквами.
Решение.
По правилу Ле-Шателье, если на систему,
находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо
из условий равновесия (температура, давление, концентрация, внешнее
электромагнитное поле), то в системе усиливаются процессы, направленные в
сторону противодействия изменениям.
В реакциях с поглощением тепла
(-Q) при уменьшении температуры направление реакции будет смещаться в сторону
исходных веществ, т. е. влево, т. е. в сторону обратной реакции. Для реакций с
выделением тепла (+Q) равновесие смещается в сторону прямой реакции.
Ответ: 2122.
39/59
41. 10705
химического равновесия при нагревании.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ
УРАВНЕНИЕ
РЕАКЦИИ ХИМИЧЕСКОГО
РАВНОВЕСИЯ
2) 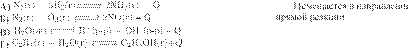
направленииобратной реакции
3) практически не
смещается
Запишите в таблицу выбранные цифры под соответствующими
буквами.
Решение.
По правилу Ле-Шателье, если на систему,
находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо
из условий равновесия (температура, давление, концентрация, внешнее
электромагнитное поле), то в системе усиливаются процессы, направленные в
сторону противодействия изменениям.
В реакциях с поглощением тепла
(-Q) при увеличении температуры направление реакции будет смещаться в сторону
продуктов реакции, т. е. вправо, т. е. в сторону прямой реакции. Для реакций с
выделением тепла (+Q) равновесие смещается в сторону обратной реакции.
Ответ: 2112.
40/59
42. 11085
Установите соответствие между способом воздействия на
равновесную систему
и смещением химического равновесия в результате этого
воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую
позицию, обозначенную цифрой
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ВОЗДЕЙСТВИЕ НА
СИСТЕМУ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
А)
увеличение концентрации водорода 1) смещается в сторону прямой
Б) добавление катализатора реакции
В)
понижение температуры 2) смещается в сторону
обратной
Г) повышение давления реакции
3) практически не смещается
Запишите в ответ цифры, расположив их
в порядке, соответствующем буквам:
Решение.
По правилу Ле-Шателье, равновесие
смещается в сторону реакции ослабляющей внешнее воздействие. Катализатор не
влияет на смещение равновесия.
А) увеличение концентрации водорода приводит
к смещению равновесия в сторону обратной реакции (расходование водорода)
Б) добавление катализатора не влияет на смещение
равновесия
В) понижение температуры приводит к
смещению равновесия в сторону обратной реакции (экзотермической реакции)
Г) повышение давления приводит к
смещению равновесия в сторону обратной реакции (меньшего числа газообразных
частиц)
Ответ: 2322.
41/59
43. 11165
химического равновесия при добавлении в систему водорода.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ
УРАВНЕНИЕ
РЕАКЦИИ ХИМИЧЕСКОГО
РАВНОВЕСИЯ
А)
1) смещается в направлении
Б) прямой
реакции
В)
2)
смещается в направлении
обратной реакции
Г)
3) практически не
смещается
Запишите в таблицу выбранные цифры под соответствующими
буквами.
Решение.
По правилу Ле-Шателье, если на систему,
находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо
из условий равновесия (температура, давление, концентрация, внешнее
электромагнитное поле), то в системе усиливаются процессы, направленные в
сторону противодействия изменениям.
Если водород является реагентом,
то его концентрация в прямой реакции уменьшается и при добавлении его в систему
равновесие будет смещаться вправо. Если водород – продукт, то наоборот, влево,
в сторону обратной реакции.
Ответ: 1221.
42/59
44. 11230
химического равновесия при добавлении в систему водорода.
УРАВНЕНИЕ РЕАКЦИИ
РАВНОВЕСИЯ
А)
1) смещается в направлении
Б) прямой
реакции
В)
2)
смещается в направлении
обратной реакции
Г)
3) практически не
смещается
Запишите в таблицу выбранные цифры под соответствующими
буквами.
Решение.
По правилу Ле-Шателье, если на систему,
находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо
из условий равновесия (температура, давление, концентрация, внешнее
электромагнитное поле), то в системе усиливаются процессы, направленные в
сторону противодействия изменениям.
Если водород является реагентом, то его
концентрация в прямой реакции уменьшается и при добавлении его в систему равновесие
будет смещаться вправо. Если водород – продукт, то наоборот, влево, в сторону
обратной реакции.
Ответ: 1212.
43/59
45. 11268
между уравнением
химической реакции и направлением смещения химиче‐
ского равновесия при
увеличении общего давления
НАПРАВЛЕНИЕ
СМЕЩЕНИЯ
УРАВНЕНИЕ
РЕАКЦИИ ХИМИЧЕСКОГО
РАВНОВЕ‐
СИЯ
А) 1)
смещается в направлении пря‐
Б) мой
реакции
В) 2)
смещается в направлении об‐
ратной реакции
Г)
3)
практически не смещается
Запишите в таблицу
выбранные цифры под
соответствующими
буквами.
Решение.
По правилу Ле-Шателье, если на систему,
находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо
из условий равновесия (температура, давление, концентрация, внешнее
электромагнитное поле), то в системе усиливаются процессы, направленные в
сторону противодействия изменениям.
При изменении давления мы обращаем внимание
на количество вещества газовых компонентов реакции. При увеличении давления
равновесие сместиться в сторону меньшего количества газа. Установим
соответствие:
А) 3 моль -> 2 моль (1)
Б) 0 моль <- 1 моль (2)
В) 2 моль <- 3 моль (2)
Г) 1 моль -> 0 моль (1)
Ответ: 1221.
44/59
46. 11303
химического равновесия при понижении общего давления.
УРАВНЕНИЕ РЕАКЦИИ
РАВНОВЕСИЯ
А)
1) смещается в направлении
Б) прямой
реакции
В)
2)
смещается в направлении
обратной реакции
Г)
3) практически не
смещается
Запишите в таблицу выбранные цифры под соответствующими
буквами.
Решение.
По правилу Ле-Шателье, если на систему,
находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо
из условий равновесия (температура, давление, концентрация, внешнее
электромагнитное поле), то в системе усиливаются процессы, направленные в
сторону противодействия изменениям.
При изменении давления мы обращаем
внимание на количество вещества газовых компонентов реакции.
Установим соответствие:
А) 1 -> 4 (1)
Б) 0 -> 1 (1)
В) 2 -> 0 (2)
Г) 3 -> 2 (2)
Ответ: 1122.
45/59
47. 11338
между
уравнением химической реакции и направлением смещения
химического равновесия при понижении температуры.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ
УРАВНЕНИЕ
РЕАКЦИИ ХИМИЧЕСКОГО
РАВНОВЕСИЯ
2) смещается в
направленииобратной реакции
3) практически не
смещается
Запишите в таблицу выбранные цифры под соответствующими
буквами.
Решение.
По правилу Ле-Шателье, если на
систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя
какое-либо из условий равновесия (температура, давление, концентрация, внешнее
электромагнитное поле), то в системе усиливаются процессы, направленные в
сторону противодействия изменениям.
Если в реакции происходит поглощение
тепла, то при понижении температуры равновесие смещается влево, в сторону
обратной реакции. При выделении тепла наоборот.
Ответ: 2121.
46/59
48. 11373
химического равновесия при нагревании
УРАВНЕНИЕ РЕАКЦИИ
РАВНОВЕСИЯ
2) смещается в
направленииобратной реакции
3) практически не
смещается
Запишите в таблицу выбранные цифры под соответствующими
буквами.
Решение.
По правилу Ле-Шателье, если на систему,
находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо
из условий равновесия (температура, давление, концентрация, внешнее
электромагнитное поле), то в системе усиливаются процессы, направленные в
сторону противодействия изменениям.
Если в реакции происходит поглощение
тепла, то при повышении температуры равновесие смещается вправо, в сторону
прямой реакции. При выделении тепла наоборот.
Ответ: 1221.
47/59
49. 12379
между способом воздействия на
равновесную систему, в которой протекает реакция , и направлением
смещения равновесия при этом воздействии.
СПОСОБ
ВОЗДЕЙСТВИЯ НАПРАВЛЕНИЕ СМЕЩЕНИЯ РАВНОВЕСИЯ
А) нагревание 1)
смещается в направлении прямой реакции
Б)
увеличение общего давления 2) смещается в
направлении обратной реакции
В) добавление паров воды 3)
практически не смещается
Г) введение катализатора
Запишите в таблицу выбранные цифры под соответствующими
буквами.
Решение.
По правилу Ле-Шателье, если на
систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя
какое-либо из условий равновесия (температура, давление, концентрация, внешнее
электромагнитное поле), то в системе усиливаются процессы, направленные в
сторону противодействия изменениям.
Если в реакции происходит
поглощение тепла, то при понижении температуры равновесие смещается влево, в
сторону обратной реакции. При выделении тепла наоборот. Катализаторы не влияют
на положение равновесия.
Ответ: 1213.
48/59
50. 12414
между способом воздействия на
равновесную систему, в которой протекает реакция , и направлением
смещения равновесия при этом воздействии.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ
СПОСОБ ВОЗДЕЙСТВИЯ
РАВНОВЕСИЯ
А)
нагревание 1)
смещается в направлении
Б) увеличение общего давления прямой
реакции
В) добавление паров воды 2) смещается в
направлении Г) введение катализатора обратной реакции
3) практически не
смещается
Запишите в таблицу выбранные цифры под соответствующими
буквами.
Решение.
По правилу Ле-Шателье, если на
систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя
какое-либо из условий равновесия (температура, давление, концентрация, внешнее
электромагнитное поле), то в системе усиливаются процессы, направленные в
сторону противодействия изменениям.
Если в реакции происходит поглощение
тепла, то при понижении температуры равновесие смещается влево, в сторону
обратной реакции. При выделении тепла наоборот.
А) 2, т.к. реакция экзотермическая.
Б) 1, т.к. из двух молей газа образуется 1 моль газа.
В) 1, т.к. пары воды расходуются в ходе реакции.
Г) 3
Ответ: 2113.
49/59
,
и направлением смещения равновесия при этом воздействии.
СПОСОБ
НАПРАВЛЕНИЕ
А)
охлаждение 1) смещается в
направлении прямой реакции
Б)
уменьшение общего давления 2) смещается в направлении
обратной реакции
В) добавление водорода 3)
практически не смещается
Г) добавление твёрдого железа
Запишите в таблицу выбранные цифры под соответствующими
буквами.
Решение.
По правилу Ле-Шателье, если на
систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя
какое-либо из условий равновесия (температура, давление, концентрация, внешнее
электромагнитное поле), то в системе усиливаются процессы, направленные в
сторону противодействия изменениям.
Если в реакции происходит поглощение
тепла, то при понижении температуры равновесие смещается влево, в сторону
обратной реакции. При выделении тепла наоборот.
А. 1, т. к. реакция экзотермическая.
Б. 3, т. к. из четырёх молей газообразной воды образуется
четыре моля газообразного водорода.
В. 2, т. к. водород накапливается в ходе реакции.
Г. 3, т. к. изменение количества твёрдого вещества не
влияет на равновесие.
Ответ: 1323.
50/59
52. 12648
между способом
воздействия на равновесную систему, в которой протекает
реакция
,
и направлением смещения равновесия при этом воздействии.
СПОСОБ
НАПРАВЛЕНИЕ
А)
нагревание 1) смещается в
направлении прямой реакции
Б)
уменьшение давления 2) смещается в
направлении обратной реакции
В) добавление кислорода 3)
практически не смещается
Г) добавление твёрдого оксида бария
Запишите в таблицу выбранные цифры под соответствующими
буквами.
Решение.
По правилу Ле-Шателье, если на систему,
находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо
из условий равновесия (температура, давление, концентрация, внешнее
электромагнитное поле), то в системе усиливаются процессы, направленные в
сторону противодействия изменениям.
Если в реакции происходит поглощение
тепла, то при понижении температуры равновесие смещается влево, в сторону
обратной реакции. При выделении тепла наоборот.
А. 2, т. к. реакция экзотермическая.
Б. 2, т. к. в левой части уравнения 1
моль газа, а в правой части газ отсутствует, только твёрдый продукт.
В. 1, т. к. кислород расходуется в ходе реакции.
Г. 3, т. к. концентрация оксида бария практически не
изменится.
Ответ: 2213.
51/59
53. 12862
между уравнением
обратимой химической реакции и направлением
смещения химического равновесия при уменьшении общего
давления: к каждой позиции, обозначенной буквой, подберите соответствующую
позицию, обозначенную цифрой.
УРАВНЕНИЕ
РЕАКЦИИ НАПРАВЛЕНИЕ СМЕЩЕНИЯ РАВНОВЕСИЯ
3) практически не смещается
Запишите в таблицу выбранные цифры под соответствующими
буквами.
Решение.
По правилу Ле-Шателье, если на систему,
находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо
из условий равновесия (температура, давление, концентрация, внешнее
электромагнитное поле), то в системе усиливаются процессы, направленные в
сторону противодействия изменениям.
Если в реакции присутствуют газообразные
вещества, то при понижении общего давления равновесие смещается в сторону
большего количества газов.
А. 1, т. к. в правой части уравнения больше молей газа.
Б. 1, т. к. в правой части уравнения 1
моль газа, а в левой части газ отсутствует, только твёрдый продукт.
В. 2, т. к. в правой части уравнения суммарно 3 моля
газов, а в левой — 2.
Г. 3, т. к. количество молей газов одинаково в левой и
правой частях уравнения.
Ответ: 1123.
52/59
54. 13030
между
уравнением химической реакции и направлением смещения
химического равновесия при увеличении общего давления: к
каждой позиции, обозначенной буквой, подберите соответствующую позицию,
обозначенную цифрой.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ
УРАВНЕНИЕ РЕАКЦИИ
РАВНОВЕСИЯ
3) практически не смещается
Запишите в таблицу выбранные цифры под соответствующими
буквами.
Решение.
По правилу Ле-Шателье, если на систему,
находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо
из условий равновесия (температура, давление, концентрация, внешнее
электромагнитное поле), то в системе усиливаются процессы, направленные в
сторону противодействия изменениям.
Если в реакции присутствуют газообразные
вещества, то при повышении общего давления равновесие смещается в сторону
меньшего количества газов.
А. 1, т. к. в левой части уравнения 1
моль газа, а в правой части газ отсутствует, только твёрдый продукт.
Б. 2, т. к. в правой части уравнения 2 моль газа, а в
левой части — 1 моль.
В. 1, т. к. в правой части уравнения 1 моль газа, а в
левой — 5.
Г. 3, т. к. количество молей газов одинаково в левой и
правой частях уравнения.
Ответ: 1213.
53/59
55. 13092
реакция и направлением смещения равновесия
при этом воздействии.
СПОСОБ
ВОЗДЕЙСТВИЯ НАПРАВЛЕНИЕ СМЕЩЕНИЯ РАВНОВЕСИЯ
А)
нагревание 1) смещается в
направлении прямой реакции
Б)
добавление кислорода 2) смещается в
направлении обратной реакции
В) уменьшение давления 3)
практически не смещается
Г) добавление катализатора
Запишите в таблицу выбранные цифры под соответствующими
буквами.
Решение.
По правилу Ле-Шателье, если на систему,
находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо
из условий равновесия (температура, давление, концентрация, внешнее
электромагнитное поле), то в системе усиливаются процессы, направленные в
сторону противодействия изменениям.
А. 1, т. к. реакция эндотермическая.
Б. 2, т. к. кислород является продуктом.
В. 1, т. к. в правой части есть газообразные вещества, а в
левой — нет.
Г. 3.
Ответ: 1213.
54/59
56. 13127
между способом воздействия на
равновесную систему, в которой протекает реакция и направлением
смещения равновесия при этом воздействии.
СПОСОБ
ВОЗДЕЙСТВИЯ НАПРАВЛЕНИЕ СМЕЩЕНИЯ РАВНОВЕСИЯ
А)
уменьшение давления 1) смещается в
направлении прямой реакции
Б)
добавление кислорода 2) смещается в
направлении обратной реакции
В) охлаждение 3)
практически не смещается
Г) добавление катализатора
Запишите в таблицу выбранные цифры под соответствующими
буквами.
Решение.
По правилу Ле-Шателье, если на систему,
находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо
из условий равновесия (температура, давление, концентрация, внешнее
электромагнитное поле), то в системе усиливаются процессы, направленные в
сторону противодействия изменениям.
А. 1, т. к. в правой части уравнения 1
моль газа, а в левой части газ отсутствует, только твёрдый реагент.
Б. 2, т. к. кислород является продуктом реакции.
В. 2, т. к. реакция эндотермическая.
Г. 3.
Ответ: 1223.
55/59
57. 13554
Установите соответствие между способом воздействия на
равновесную систему
и направлением смещения химического равновесия в результате
этого воздействия: к каждой позиции, обозначенной буквой, подберите
соответствующую позицию, обозначенную цифрой.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ
ХИМИЧЕСКОГО
ВОЗДЕЙСТВИЕ НА СИСТЕМУ
РАВНОВЕСИЯ
А) добавление катализатора 1)
смещается в сторону прямой реакции
Б) повышение температуры 2)
смещается в сторону обратной реакции
В) повышение давления 3)
практически не смещается
Г) уменьшение концентрации водорода
Запишите в таблицу выбранные цифры под соответствующими
буквами.
Решение.
По правилу Ле-Шателье, если на систему,
находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо
из условий равновесия (температура, давление, концентрация, внешнее
электромагнитное поле), то в системе усиливаются процессы, направленные в
сторону противодействия изменениям.
А. 3.
Б. 2, т. к. реакция экзотермическая.
В. 3, т. к. количество моль газов в
левой части уравнения равно количеству моль газов в правой части уравнения.
Г. 1, т. к. водород является продуктом реакции.
Ответ: 3231.
56/59
58. 13627
между способом
воздействия на равновесную систему, в которой протекает
реакция и направлением смещения равновесия
при этом воздействии.
СПОСОБ
ВОЗДЕЙСТВИЯ НАПРАВЛЕНИЕ СМЕЩЕНИЯ РАВНОВЕСИЯ
А)
нагревание 1) смещается в
направлении прямой реакции
Б)
добавление водорода 2) смещается в
направлении обратной реакции
В) уменьшение давления 3)
практически не смещается
Г) добавление иодоводорода
Запишите в таблицу выбранные цифры под соответствующими
буквами.
Решение.
По правилу Ле-Шателье, если на систему,
находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо
из условий равновесия (температура, давление, концентрация, внешнее
электромагнитное поле), то в системе усиливаются процессы, направленные в
сторону противодействия изменениям.
А. 1, т. к. реакция эндотермическая.
Б. 2, т. к. водород является продуктом реакции.
В. 3, т. к. одинаковое количество моль газообразных
веществ в левой и правой части уравнения.
Г. 1, т. к. иодоводород расходуется в ходе реакции.
Ответ: 1231.
57/59
59. 13662
Установите соответствие
реакция и направлением смещения равновесия
при этом воздействии.
СПОСОБ
ВОЗДЕЙСТВИЯ НАПРАВЛЕНИЕ СМЕЩЕНИЯ РАВНОВЕСИЯ
А)
нагревание 1) смещается в
направлении прямой реакции
Б)
добавление углекислого газа 2) смещается в
направлении обратной реакции
В) увеличение давления 3)
практически не смещается
Г) увеличение объёма сосуда
Запишите в таблицу выбранные цифры под соответствующими
буквами.
Решение.
По правилу Ле-Шателье, если на систему,
находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо
из условий равновесия (температура, давление, концентрация, внешнее
электромагнитное поле), то в системе усиливаются процессы, направленные в
сторону противодействия изменениям.
А. 2, т. к. реакция экзотермическая.
Б. 1, т. к. углекислый газ является реагентом.
В. 1, т. к. в левой части уравнения 1
моль газа, а в правой части уравнения газообразные вещества отсутствуют.
Г. 2, т. к. в левой части уравнения 1
моль газа, а в правой части уравнения газообразные вещества отсутствуют.
Ответ: 2112.
58/59
60. 13701
Установите соответствие между способом воздействия на
равновесную систему
и направлением смещения химического равновесия в результате
этого воздействия: к каждой позиции, обозначенной буквой, подберите
соответствующую позицию, обозначенную цифрой.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ
ХИМИЧЕСКОГО
ВОЗДЕЙСТВИЕ НА СИСТЕМУ
РАВНОВЕСИЯ
А) повышение температуры 1)
смещается в сторону прямой реакции
Б) понижение давления 2)
смещается в сторону обратной реакции
В) уменьшение концентрации водорода 3)
практически не смещается
Г) добавление катализатора
Запишите в таблицу выбранные цифры под соответствующими
буквами.
Решение.
По правилу Ле-Шателье, если на систему,
находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо
из условий равновесия (температура, давление, концентрация, внешнее
электромагнитное поле), то в системе усиливаются процессы, направленные в
сторону противодействия изменениям.
А. 1, т. к. реакция эндотермическая.
Б. 1, т. к. в правой части реакции присутствуют
газообразные вещества, а в левой — нет.
В. 1, т. к. водород является продуктом реакции.
Г. 3.
Ответ: 1113.
59/59
Автор статьи — профессиональный репетитор О. В. Овчинникова.

Трудность такого задания в том, что школьники слабо представляют себе экспериментальную, не «бумажную» химию. Не все понимают используемые термины и протекающие процессы. Попробуем разобраться.
Очень часто понятия, которые химику кажутся совершенно ясными, абитуриентами воспринимаются неправильно. Вот кратких словарь таких понятий.
Словарь непонятных терминов.
- Навеска — это просто некоторая порция вещества определенной массы (её взвесили на весах). Она не имеет отношения к навесу над крыльцом
- Прокалить — нагреть вещество до высокой температуры и греть до окончания химических реакций. Это не «смешивание с калием» и не «прокалывание гвоздём».
- «Взорвали смесь газов» — это значит, что вещества прореагировали со взрывом. Обычно для этого используют электрическую искру. Колба или сосуд при этом не взрываются!
- Отфильтровать — отделить осадок от раствора.
- Профильтровать — пропустить раствор через фильтр, чтобы отделить осадок.
- Фильтрат — это профильтрованный раствор.
- Растворение вещества — это переход вещества в раствор. Оно может происходить без химических реакций (например, при растворении в воде поваренной соли NaCl получается раствор поваренной же соли NaCl, а не щелочь и кислота отдельно), либо в процессе растворения вещество реагирует с водой и образует раствор другого вещества (при растворении оксида бария получится раствор гидроксида бария). Растворять можно вещества не только в воде, но и в кислотах, в щелочах и т.д.
- Выпаривание — это удаление из раствора воды и летучих веществ без разложения содержащихся в растворе твёрдых веществ.
- Упаривание — это просто уменьшение массы воды в растворе с помощью кипячения.
- Сплавление — это совместное нагревание двух или более твёрдых веществ до температуры, когда начинается их плавление и взаимодействие. С плаванием по реке ничего общего не имеет
- Осадок и остаток.
Очень часто путают эти термины. Хотя это совершенно разные понятия.
«Реакция протекает с выделением осадка» — это означает, что одно из веществ, получающихся в реакции, малорастворимо. Такие вещества выпадают на дно реакционного сосуда (пробирки или колбы).
«Остаток» — это вещество, которое осталось, не истратилось полностью или вообще не прореагировало. Например, если смесь нескольких металлов обработали кислотой, а один из металлов не прореагировал — его могут назвать остатком. - Насыщенный раствор — это раствор, в котором при данной температуре концентрация вещества максимально возможная и больше уже не растворяется.
Ненасыщенный раствор — это раствор, концентрация вещества в котором не является максимально возможной, в таком растворе можно дополнительно растворить ещё какое-то количество данного вещества, до тех пор, пока он не станет насыщенным.
Пересыщенный раствор – это раствор, в котором при данной температуре растворено больше вещества, чем в насыщенном.
Разбавленный и «очень» разбавленный раствор — это весьма условные понятия, скорее качественные, чем количественные. Подразумевается, что концентрация вещества невелика.
Для кислот и щелочей также используют термин «концентрированный» раствор. Это тоже характеристика условная. Например, концентрированная соляная кислота имеет концентрацию всего около 40%. А концентрированная серная — это безводная, 100%-ная кислота.
Для того, чтобы решать такие задачи, надо чётко знать свойства большинства металлов, неметаллов и их соединений: оксидов, гидроксидов, солей. Необходимо повторить свойства азотной и серной кислот, перманганата и дихромата калия, окислительно-восстановительные свойства различных соединений, электролиз растворов и расплавов различных веществ, реакции разложения соединений разных классов, амфотерность, гидролиз солей и других соединений, взаимный гидролиз двух солей.
Кроме того, необходимо иметь представление о цвете и агрегатном состоянии большинства изучаемых веществ — металлов, неметаллов, оксидов, солей.
Именно поэтому мы разбираем этот вид заданий в самом конце изучения общей и неорганической химии.
Рассмотрим несколько примеров подобных заданий.
-
Пример 1: Продукт взаимодействия лития с азотом обработали водой. Полученный газ пропустили через раствор серной кислоты до прекращения химических реакций. Полученный раствор обработали хлоридом бария. Раствор профильтровали, а фильтрат смешали с раствором нитрита натрия и нагрели.
Решение:
- Литий реагирует с азотом при комнатной температуре, образуя твёрдый нитрид лития:
- При взаимодействии нитридов с водой образуется аммиак:
- Аммиак реагирует с кислотами, образуя средние и кислые соли. Слова в тексте «до прекращения химических реакций» означают, что образуется средняя соль, ведь первоначально получившаяся кислая соль далее будет взаимодействовать с аммиаком и в итоге в растворе будет сульфат аммония:
- Обменная реакция между сульфатом аммония и хлоридом бария протекает с образованием осадка сульфата бария:
- После удаления осадка фильтрат содержит хлорид аммония, при взаимодействии которого с раствором нитрита натрия выделяется азот, причём эта реакция идёт уже при 85 градусах:
-
Пример 2: Навеску алюминия растворили в разбавленной азотной кислоте, при этом выделялось газообразное простое вещество. К полученному раствору добавили карбонат натрия до полного прекращения выделения газа. Выпавший осадок отфильтровали и прокалили, фильтрат упарили, полученный твёрдый остаток сплавили с хлоридом аммония. Выделившийся газ смешали с аммиаком и нагрели полученную смесь.
Решение:
- Алюминий окисляется азотной кислотой, образуя нитрат алюминия. А вот продукт восстановления азота может быть разным, в зависимости от концентрации кислоты. Но надо помнить, что при взаимодействии азотной кислоты с металлами не выделяется водород! Поэтому простым веществом может быть только азот:
- Если к раствору нитрата алюминия добавить карбонат натрия, то идёт процесс взаимного гидролиза (карбонат алюминия не существует в водном растворе, поэтому катион алюминия и карбонат-анион взаимодействуют с водой). Образуется осадок гидроксида алюминия и выделяется углекислый газ:
- Осадок — гидроксид алюминия, при нагревании разлагается на оксид и воду:
- В растворе остался нитрат натрия. При его сплавлении с солями аммония идёт окислительно-восстановительная реакция и выделяется оксид азота (I) (такой же процесс происходит при прокаливании нитрата аммония):
- Оксид азота (I) — является активным окислителем, реагирует с восстановителями, образуя азот:
-
Пример 3: Оксид алюминия сплавили с карбонатом натрия, полученное твёрдое вещество растворили в воде. Через полученный раствор пропускали сернистый газ до полного прекращения взаимодействия. Выпавший осадок отфильтровали, а к профильтрованному раствору прибавили бромную воду. Полученный раствор нейтрализовали гидроксидом натрия.
Решение:
- Оксид алюминия — амфотерный оксид, при сплавлении со щелочами или карбонатами щелочных металлов образует алюминаты:
- Алюминат натрия при растворении в воде образует гидроксокомплекс:
- Растворы гидроксокомплексов реагируют с кислотами и кислотными оксидами в растворе, образуя соли. Однако, сульфит алюминия в водном растворе не существует, поэтому будет выпадать осадок гидроксида алюминия. Обратите внимание, что в реакции получится кислая соль — гидросульфит калия:
- Гидросульфит калия является восстановителем и окисляется бромной водой до гидросульфата:
- Полученный раствор содержит гидросульфат калия и бромоводородную кислоту. При добавлении щелочи нужно учесть взаимодействие с ней обоих веществ:
-
Пример 4: Сульфид цинка обработали раствором соляной кислоты, полученный газ пропустили через избыток раствора гидроксида натрия, затем добавили раствор хлорида железа (II). Полученный осадок подвергли обжигу. Полученный газ смешали с кислородом и пропустили над катализатором.
Решение:
- Сульфид цинка реагирует с соляной кислотой, при этом выделяется газ — сероводород:
- Сероводород — в водном растворе реагирует со щелочами, образуя кислые и средние соли. Поскольку в задании говорится про избыток гидроксида натрия, следовательно, образуется средняя соль — сульфид натрия:
- Сульфид натрия реагирует с хлоридом двухвалентного железа, образуется осадок сульфида железа (II):
- Обжиг — это взаимодействие твёрдых веществ с кислородом при высокой температуре. При обжиге сульфидов выделяется сернистый газ и образуется оксид железа (III):
- Сернистый газ реагирует с кислородом в присутствии катализатора, образуя серный ангидрид:
-
Пример 5: Оксид кремния прокалили с большим избытком магния. Полученную смесь веществ обработали водой. При этом выделился газ, который сожгли в кислороде. Твёрдый продукт сжигания растворили в концентрированном растворе гидроксида цезия. К полученному раствору добавили соляную кислоту.
Решение:
- При восстановлении оксида кремния магнием образуется кремний, который реагирует с избытком магния. При этом получается силицид магния:
Можно записать при большом избытке магния суммарное уравнение реакции:
- При растворении в воде полученной смеси растворяется силицид магния, образуется гидроксид магния и силан (окисд магния реагирует с водой только при кипячении):
- Силан при сгорании образует оксид кремния:
- Оксид кремния — кислотный оксид, он реагирует со щелочами, образуя силикаты:
- При действии на растворы силикатов кислот, более сильных, чем кремниевая, она выделяется в виде осадка:
Задания С2 из вариантов ЕГЭ по химии для самостоятельной работы.
- Нитрат меди прокалили, полученный твёрдый осадок растворили в серной кислоте. Через раствор пропустили сероводород, полученный чёрный осадок подвергли обжигу, а твёрдый остаток растворили при нагревании в концентрированной азотной кислоте.
- Фосфат кальция сплавили с углём и песком, затем полученное простое вещество сожгли в избытке кислорода, продукт сжигания растворили в избытке едкого натра. К полученному раствору прилили раствор хлорида бария. Полученный осадок обработали избытком фосфорной кислоты.
- Медь растворили в концентрированной азотной кислоте, полученный газ смешали с кислородом и растворили в воде. В полученном растворе растворили оксид цинка, затем к раствору прибавили большой избыток раствора гидроксида натрия.
- На сухой хлорид натрия подействовали концентрированной серной кислотой при слабом нагревании, образующийся газ пропустили в раствор гидроксида бария. К полученному раствору прилили раствор сульфата калия. Полученный осадок сплавили с углем. Полученное вещество обработали соляной кислотой.
- Навеску сульфида алюминия обработали соляной кислотой. При этом выделился газ и образовался бесцветный раствор. К полученному раствору добавили раствор аммиака, а газ пропустили через раствор нитрата свинца. Полученный при этом осадок обработали раствором пероксида водорода.
- Порошок алюминия смешали с порошком серы, смесь нагрели, полученное вещество обработали водой, при этом выделился газ и образовался осадок, к которому добавили избыток раствора гидроксида калия до полного растворения. Этот раствор выпарили и прокалили. К полученному твёрдому веществу добавили избыток раствора соляной кислоты.
- Раствор иодида калия обработали раствором хлора. Полученный осадок обработали раствором сульфита натрия. К полученному раствору прибавили сначала раствор хлорида бария, а после отделения осадка — добавили раствор нитрата серебра.
- Серо-зелёный порошок оксида хрома (III) сплавили с избытком щёлочи, полученное вещество растворили в воде, при этом получился тёмно-зелёный раствор. К полученному щелочному раствору прибавили пероксид водорода. Получился раствор желтого цвета, который при добавлении серной кислоты приобретает оранжевый цвет. При пропускании сероводорода через полученный подкисленный оранжевый раствор он мутнеет и вновь становится зелёным.
- (МИОО 2011, тренинговая работа) Алюминий растворили в концентрированном растворе гидроксида калия. Через полученный раствор пропускали углекислый газ до прекращения выделения осадка. Осадок отфильтровали и прокалили. Полученный твердый остаток сплавили с карбонатом натрия.
- (МИОО 2011, тренинговая работа) Кремний растворили в концентрированном растворе гидроксида калия. К полученному раствору добавили избыток соляной кислоты. Помутневший раствор нагрели. Выделившийся осадок отфильтровали и прокалили с карбонатом кальция. Напишите уравнения описанных реакций.
Ответы к заданиям для самостоятельного решения:
или
Читаем дальше: Задачи на сплавы и смеси на ЕГЭ по химии.
Задача С5 на ЕГЭ по химии. Определение формул органических веществ.
Благодарим за то, что пользуйтесь нашими статьями.
Информация на странице «Задача 31 на ЕГЭ по химии. Особенности и подводные камни» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать необходимые и поступить в ВУЗ или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из разделов нашего сайта.
Публикация обновлена:
09.03.2023
Задание 7204
Введите ответ в поле ввода
Решение
→
Задание 5538
Введите ответ в поле ввода
Решение
→
Задание 5661
Введите ответ в поле ввода
Решение
→
Задание 5991
Внимательно прочитайте текст задания и выберите верный ответ из списка
Решение
→
Задание 6340
Введите ответ в поле ввода
Решение
→
Задание 6281
Внимательно прочитайте текст задания и выберите верный ответ из списка
Решение
→
Задание 6280
Внимательно прочитайте текст задания и выберите верный ответ из списка
Решение
→
Задание 7068
Внимательно прочитайте текст задания и выберите верный ответ из списка
Решение
→
Задание 5305
Внимательно прочитайте текст задания и выберите верный ответ из списка
Решение
→
Задание 6353
Внимательно прочитайте текст задания и выберите верный ответ из списка
Решение
→
Задание 6404
Внимательно прочитайте текст задания и выберите верный ответ из списка
Решение
→
Задание 6872
Введите ответ в поле ввода
Решение
→
Задание 5211
Внимательно прочитайте текст задания и выберите верный ответ из списка
Решение
→
Задание 5680
Внимательно прочитайте текст задания и выберите верный ответ из списка
Решение
→
Задание 5831
Введите ответ в поле ввода
Решение
→
Задание 6993
Введите ответ в поле ввода
Решение
→
Задание 7269
Внимательно прочитайте текст задания и выберите верный ответ из списка
Решение
→
Задачи 32 из реального ЕГЭ по химии-2020, все задачи на неорганическую химию (мысленный эксперимент) из реального экзамена ЕГЭ по химии, задания 32 из реального ЕГЭ 2020 (основная волна и резервные дни — 16 июля 2020 года, 24 июля 2020) с текстовыми решениями и ответами.
1. Карбид алюминия сожгли. Полученное твёрдое вещество поместили в раствор гидроксида натрия. Через образовавшийся прозрачный раствор пропустили газ, полученный при действии на магний концентрированной серной кислоты. При пропускании газа происходило выпадение белого осадка и образование соли бескислородной кислоты.
Al4C3 + 6O2 = 3CO2 + 2Al2O3
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O
H2S + 2Na[Al(OH)4] = 2Al(OH)3 + Na2S + 2H2O (допустимо образование NaHS)
2. Натрий растворили в воде. Образовавшееся газообразное вещество при нагревании пропустили через железную окалину. Получившееся простое вещество при нагревании растворили в необходимом количестве концентрированной серной кислоты, при этом образовался бесцветный газ с резким запахом. К полученному раствору добавили раствор карбоната калия.
2Na + 2H2O = 2NaOH + H2
Fe3O4 + 4H2 = 3Fe + 4H2O
2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O
Fe2(SO4)3 + 3K2CO3 + 3H2O = 2Fe(OH)3 + 3CO2 + 3K2SO4
3. Натрий сгорел в избытке кислорода. Образовавшееся при этом вещество поместили в раствор, содержащий перманганат калия и серную кислоту. Полученное простое вещество при нагревании прореагировало с пиритом. Образовавшееся при этом твёрдое вещество растворили в иодоводородной кислоте.
2Na + O2 = Na2O2
5Na2O2 + 2KMnO4 + 8H2SO4 = 5O2 + 2MnSO4 + 5Na2SO4 + K2SO4 + 8H2O
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Fe2O3 + 6HI = 2FeI2 + I2 + 3H2O
4. Алюминий добавили к раствору гидроксида калия. Через образовавшийся прозрачный раствор пропустили газ, полученный при растворении магния в концентрированной серной кислоте. Образовавшийся осадок отделили, а к полученному раствору добавили раствор перманганата калия. При этом наблюдали образование осадка простого вещества.
2Al + 2KOH + 6H2O = 2K[Al(OH)4] + 3H2
4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O
H2S + 2K[Al(OH)4] = 2Al(OH)3 + K2S + 2H2O (допустимо образование KHS)
3K2S + 2KMnO4 + 4H2O = 3S + 2MnO2 + 8KOH
5. Железную окалину растворили в разбавленной серной кислоте. Полученный раствор обработали дихроматом калия. Полученное соединение хрома выделили и поместили в раствор карбоната натрия. Образовавшийся осадок отделили и нагрели с хлоратом калия в присутствии гидроксида калия.
Fe3O4 + 4H2SO4 = FeSO4 + Fe2(SO4)3 + 4H2O
6FeSO4 + K2Cr2O7 + 7H2SO4 = 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
Cr2(SO4)3 + 3Na2CO3 + 3H2O = 2Cr(OH)3 + 3CO2 + 3Na2SO4
2Cr(OH)3 + KClO3 + 4KOH = 2K2CrO4 + KCl + 5H2O
6. Оксид меди(I) растворили в концентрированном растворе азотной кислоты. Полученный в результате бурый газ поглотили холодным раствором гидроксида натрия. К образовавшемуся раствору добавили подкисленный серной кислотой раствор дихромата натрия. Образовавшееся соединение хрома выделили и поместили в раствор карбоната калия.
Cu2O + 6HNO3 = 2Cu(NO3)2 + 2NO2 + 3H2O
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
3NaNO2 + Na2Cr2O7 + 4H2SO4 = 3NaNO3 + Cr2(SO4)3 + Na2SO4 + 4H2O
Cr2(SO4)3 + 3K2CO3 + 3H2O = 2Cr(OH)3 + 3CO2 + 3K2SO4
7. К раствору дигидрофосфата калия добавили избыток раствора гидроксида кальция. Образовавшийся осадок отделили, высушили и нагрели с кремнезёмом и углём. Полученное простое вещество вступило в реакцию с хлоратом калия. Полученный при этом оксид поместили в избыток раствора гидроксида натрия.
2KH2PO4 + 3Ca(OH)2 = Ca3(PO4)2 + 2KOH + 4H2O
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 5CO + 2P
6P + 5KClO3 = 3P2O5 + 5KCl
P2O5 + 6NaOH = 2Na3PO4 + 3H2O
8. Фосфид алюминия растворили в соляной кислоте. К полученному при этом раствору добавили раствор сульфита калия и наблюдали образование белого осадка и выделение бесцветного газа. Полученный газ разделили на две части, одну часть поглотили раствором дихромата натрия, подкисленным серной кислотой. Другую часть газа поглотили концентрированным раствором азотной кислоты.
AlP + 3HCl = AlCl3 + PH3
2AlCl3 + 3K2SO3 + 3H2O = 2Al(OH)3 + 3SO2 + 6KCl
3SO2 + Na2Cr2O7 + H2SO4 = Cr2(SO4)3 + Na2SO4 + H2O
SO2 + 2HNO3 = H2SO4 + 2NO2
9. К раствору сульфата хрома(III) добавили раствор сульфита натрия и наблюдали образование осадка и выделение бесцветного газа. Полученный газ поглотили раствором перманганата калия, подкисленным серной кислотой, а осадок обработали раствором, содержащим пероксид водорода и гидроксид натрия, и нагрели. В полученный при этом жёлтый раствор добавили раствор серной кислоты.
Cr2(SO4)3 + 3Na2SO3 + 3H2O = 2Cr(OH)3 + 3SO2 + 3Na2SO4
5SO2 + 2KMnO4 + 2H2O = 2MnSO4 + K2SO4 + 2H2SO4
2Cr(OH)3 + 3H2O2 + 4NaOH = 2Na2CrO4 + 8H2O
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
10. Провели электролиз раствора нитрата серебра. Выделившееся на аноде простое вещество при нагревании прореагировало с железом. Образовавшееся при этом твёрдое вещество черного цвета поместили в раствор иодоводородной кислоты. Полученное при этом простое вещество при нагревании прореагировало с раствором гидроксида натрия.
4AgNO3 + 2H2O = 4Ag + O2 + 4HNO3
2O2 + 3Fe = Fe3O4
Fe3O4 + 8HI = 3FeI2 + I2 + 4H2O
3I2 + 6NaOH = NaIO3 + 5NaI + 3H2O
11. Нитрат хрома(III) прокалили. Образовавшееся при этом твёрдое вещество нагрели с хлоратом натрия и гидроксидом натрия. Одно из полученных веществ прореагировало с концентрированным раствором хлороводородной кислоты. Образовавшуюся при этом соль хрома выделили, растворили в воде и полученный раствор прилили к раствору карбоната натрия.
4Cr(NO3)3 = 2Cr2O3 + 12NO2 + 3O2
Cr2O3 + NaClO3 + 4NaOH = 2Na2CrO4 + NaCl + 2H2O
2Na2CrO4 + 16HCl = 2CrCl3 + 3Cl2 + 4NaCl + 8H2O
2CrCl3 + 3Na2CO3 + 3H2O = 2Cr(OH)3 + 3CO2 + 6NaCl
12. Перхлорат натрия сплавили с оксидом хрома(III) и гидроксидом натрия. Полученное соединение хрома поместили в разбавленный раствор серной кислоты. В образовавшийся раствор добавили серную кислоту и поместили иодид натрия. Образовавшееся простое вещество при нагревании прореагировало с гидроксидом калия.
3NaClO4 + 4Cr2O3 + 16NaOH = 8Na2CrO4 + 3NaCl + 8H2O
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Na2Cr2O7 + 6NaI + 7H2SO4 = 3I2 + Cr2(SO4)3 + 4Na2SO4 + 7H2O
3I2 + 6KOH = KIO3 + 5KI + 3H2O
13. Дихромат аммония прокалили. Образовавшееся при этом твёрдое вещество нагрели с пероксидом водорода и гидроксидом калия. Одно из полученных веществ прореагировало с концентрированным раствором бромоводородной кислоты. Образовавшуюся при этом соль хрома выделили, растворили в воде и полученный раствор прилили к раствору карбоната калия.
(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O
Cr2O3 + 3H2O2 + 4KOH = 2K2CrO4 + 5H2O
2K2CrO4 + 16HBr = 2CrBr3 + 3Br2 + 4KBr + 8H2O
2CrBr3 + 3K2CO3 + 3H2O = 2Cr(OH)3 + 3CO2 + 6KBr
14. Пероксид натрия поместили в раствор, содержащий перманганат калия и серную кислоту. Полученное простое вещество при нагревании прореагировало с железом. Образовавшееся при этом твёрдое вещество черного цвета поместили в раствор иодоводородной кислоты. Образовавшуюся при этом соль железа выделили, растворили в воде и полученный раствор прилили к раствору карбоната натрия.
5Na2O2 + 2KMnO4 + 8H2SO4 = 5O2 + 2MnSO4 + 5Na2SO4 + K2SO4 + 8H2O
2O2 + 3Fe = Fe3O4
Fe3O4 + 8HI = 3FeI2 + I2 + 4H2O
FeI2 + Na2CO3 = FeCO3 + 2NaI
15. К раствору дигидрофосфата кальция добавили избыток раствора гидроксида калия. Образовавшийся осадок отделили, высушили и нагрели с кремнезёмом и углём. Полученное простое вещество вступило в реакцию с хлоратом калия. Полученную соль растворили в воде и подвергли электролизу.
3Ca(H2PO4)2 + 12KOH = Ca3(PO4)2 + 4K3PO4 + 12H2O
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 5CO + 2P
6P + 5KClO3 = 3P2O5 + 5KCl
2KCl + 2H2O = H2 + Cl2 + 2KOH
16. Оксид меди(I) растворили в концентрированном растворе азотной кислоты. Образовавшуюся в результате соль выделили и прокалили. Образовавшийся твёрдый остаток прореагировал при нагревании с газом, полученным при нагревании смеси гидрофосфата аммония и гидроксида кальция.
Cu2O + 6HNO3 = 2Cu(NO3)2 + 2NO2 + 3H2O
2Cu(NO3)2 = 2CuO + 4NO2 + O2
2(NH4)2HPO4 + 3Ca(OH)2 = Ca3(PO4)2 + 4NH3 + 6H2O
2NH3 + 3CuO = 3Cu + N2 + 3H2O
17. К раствору сульфата цинка добавили избыток раствора гидроксида калия. Через полученный раствор пропустили сероводород. Образовавшийся при этом осадок обработали горячей концентрированной азотной кислотой. Выделившийся бурый газ пропустили через раствор гидроксида бария.
ZnSO4 + 4KOH = K2[Zn(OH)4] + K2SO4
K2[Zn(OH)4] + 2H2S = ZnS + K2S + 4H2O (допустимо образование KHS)
ZnS + 8HNO3 = ZnSO4 + 8NO2 + 4H2O
4NO2 + 2Ba(OH)2 = Ba(NO2)2 + Ba(NO3)2 + 2H2O
18. Оксид хрома(VI) поместили в раствор гидроксида натрия. В полученный при этом жёлтый раствор добавили раствор серной кислоты. Образовавшийся раствор дополнительно подкислили серной кислотой и пропустили через этот раствор фосфин. Образовавшуюся при этом соль хрома выделили, растворили в воде и полученный раствор прилили к раствору карбоната калия.
CrO3 + 2NaOH = Na2CrO4 + H2O
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
3PH3 + 4Na2Cr2O7 + 16H2SO4 = 3H3PO4 + 4Cr2(SO4)3 + 4Na2SO4 + 16H2O
Cr2(SO4)3 + 3K2CO3 + 3H2O = 2Cr(OH)3 + 3CO2 + 3K2SO4
19. Хлорную кислоту нейтрализовали гидроксидом натрия. Образовавшуюся при этом соль выделили, высушили и сплавили с оксидом хрома(III) и гидроксидом натрия. Полученное соединение хрома поместили в разбавленный раствор серной кислоты. Образовавшийся раствор дополнительно подкислили серной кислотой и пропустили через этот раствор сероводород.
HClO4 + NaOH = NaClO4 + H2O
3NaClO4 + 4Cr2O3 + 16NaOH = 8Na2CrO4 + 3NaCl + 8H2O
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
3H2S + Na2Cr2O7 + 4H2SO4 = 3S + Cr2(SO4)3 + Na2SO4 + 7H2O
20. Через раствор силиката натрия пропустили углекислый газ. Полученный при этом осадок отделили, а оставшийся раствор смешали с раствором хлорида железа(III). Выпавший при этом осадок отделили и прокалили. Твёрдый остаток растворили в иодоводородной кислоте.
Na2SiO3 + CO2 + H2O = H2SiO3 + Na2CO3 (допустимо образование NaHCO3)
3Na2CO3 + 2FeCl3 + 3H2O = 2Fe(OH)3 + 6NaCl + 3CO2
2Fe(OH)3 = Fe2O3 + 3H2O
Fe2O3 + 6HI = 2FeI2 + I2 + 3H2O
21. Алюминат калия растворили в серной кислоте. К полученному при этом раствору добавили раствор сульфита натрия. Выделившийся газ разделили на две части, одну часть поглотили раствором дихромата натрия, подкисленным серной кислотой. Другую часть газа поглотили бромной водой.
2KAlO2 + 4H2SO4 = K2SO4 + Al2(SO4)3 + 4H2O
Al2(SO4)3 + 3Na2SO3 + 3H2O = 2Al(OH)3 + 3SO2 + 3Na2SO4
3SO2 + Na2Cr2O7 + H2SO4 = Cr2(SO4)3 + Na2SO4 + H2O
SO2 + Br2 + 2H2O = H2SO4 + 2HBr
22. Оксид железа(III) поместили в раствор бромоводородной кислоты. Через получившийся раствор пропустили аммиак. Образовавшийся при этом осадок отделили и прокалили. Полученное бурое вещество сплавили с твёрдым гидроксидом калия.
Fe2O3 + 6HBr = 2FeBr3 + 3H2O
FeBr3 + 3NH3 + 3H2O = Fe(OH)3 + 3NH4Br
2Fe(OH)3 = Fe2O3 + 3H2O
Fe2O3 + 2KOH = 2KFeO2 + H2O
23. Карбонат калия сплавили с оксидом цинка. Выделившийся газ прореагировал с избытком твёрдого гидроксида натрия. Полученную соль растворили в воде и добавили раствор хлорида алюминия. Образовавшийся при этом осадок отделили и поместили в раствор гидроксида калия.
K2CO3 + ZnO = K2ZnO2 + CO2
CO2 + 2NaOH = Na2CO3 + H2O
3Na2CO3 + 2AlCl3 + 3H2O = 2Al(OH)3 + 3CO2 + 6NaCl
Al(OH)3 + KOH = K[Al(OH)4]
24. Через раствор силиката калия пропустили углекислый газ. Полученный при этом осадок отделили, а оставшийся раствор смешали с раствором сульфата железа(III). Выпавший при этом осадок отделили и прокалили. Полученное бурое вещество сплавили с твёрдым карбонатом натрия.
K2SiO3 + CO2 + H2O = H2SiO3 + K2CO3 (допустимо образование KHCO3)
3K2CO3 + Fe2(SO4)3 + 3H2O = 2Fe(OH)3 + 3CO2 + 3K2SO4
2Fe(OH)3 = Fe2O3 + 3H2O
Fe2O3 + Na2CO3 = 2NaFeO2 + CO2
25. Алюминат натрия растворили в серной кислоте. К полученному при этом раствору добавили раствор сульфида натрия. Выделившийся газ разделили на две части, одну часть поглотили раствором дихромата натрия, подкисленным серной кислотой. Другую часть газа поглотили бромной водой.
2NaAlO2 + 4H2SO4 = Na2SO4 + Al2(SO4)3 + 4H2O
Al2(SO4)3 + 3Na2S + 6H2O = 2Al(OH)3 + 3H2S + 3Na2SO4
3H2S + Na2Cr2O7 + 4H2SO4 = 3S + Cr2(SO4)3 + Na2SO4 + 7H2O
H2S + Br2 = S + 2HBr
26. Медь нагрели с оксидом меди(II), при этом образовалось вещество красного цвета. Это вещество растворили в концентрированном растворе азотной кислоты. Полученный в результате бурый газ поглотили холодным раствором гидроксида калия. К образовавшемуся раствору добавили подкисленный серной кислотой раствор дихромата калия.
Cu + CuO = Cu2O
Cu2O + 6HNO3 = 2Cu(NO3)2 + 2NO2 + 3H2O
2NO2 + 2KOH = KNO2 + KNO3 + H2O
3KNO2 + K2Cr2O7 + 4H2SO4 = 3KNO3 + Cr2(SO4)3 + K2SO4 + 4H2O
27. Цинк сплавили с твёрдым гидроксидом калия. Полученное в результате твёрдое вещество растворили в необходимом количестве раствора серной кислоты. В образовавшийся раствор добавили сульфид калия, в результате чего образовался белый осадок. Осадок отделили и при нагревании растворили в концентрированной серной кислоте, при этом образовался бесцветный газ с резким запахом.
Zn + 2KOH = K2ZnO2 + H2
K2ZnO2 + 2H2SO4 = K2SO4 + ZnSO4 + 2H2O
ZnSO4 + K2S = ZnS + K2SO4
ZnS + 4H2SO4 = ZnSO4 + 4SO2 + 4H2O
28. Нитрат железа(II) прокалили. Полученное твердое вещество сплавили с твердым гидроксидом калия. Образовавшийся твердый продукт растворили в необходимом количестве бромоводородной кислоты. Через полученный раствор пропустили аммиак.
4Fe(NO3)2 = 2Fe2O3 + 8NO2 + O2
Fe2O3 + 2KOH = 2KFeO2 + H2O
KFeO2 + 4HBr = KBr + FeBr3 + 2H2O
FeBr3 + 3NH3 + 3H2O = Fe(OH)3 + 3NH4Br
29. Карбонат натрия сплавили с оксидом цинка. Выделившийся газ пропустили через раствор силиката натрия. Образовавшийся осадок отделили, а оставшийся раствор смешали с раствором хлорида железа(III), при этом наблюдали образование осадка и выделение газа. Полученный осадок отделили и поместили в раствор иодоводородной кислоты.
Na2CO3 + ZnO = Na2ZnO2 + CO2
Na2SiO3 + CO2 + H2O = H2SiO3 + Na2CO3 (допустимо образование NaHCO3)
3Na2CO3 + 2FeCl3 + 3H2O = 2Fe(OH)3 + 6NaCl + 3CO2
2Fe(OH)3 + 6HI = 2FeI2 + I2 + 6H2O
30. Нитрат цинка прокалили. Полученное простое вещество прореагировало с оксидом азота(II). Полученный продукт прореагировал с холодным раствором гидроксида натрия. К образовавшемуся раствору прилили раствор, содержащий дихромат натрия и серную кислоту.
2Zn(NO3)2 = 2ZnO + 4NO2 + O2
O2 + 2NO = 2NO2
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
3NaNO2 + Na2Cr2O7 + 4H2SO4 = 3NaNO3 + Cr2(SO4)3 + Na2SO4 + 4H2O
31. К раствору сульфата цинка добавили избыток раствора гидроксида натрия. Через полученный раствор пропустили сероводород. Образовавшийся при этом осадок при нагревании растворили в концентрированной серной кислоте, при этом образовался бесцветный газ с резким запахом. Полученный газ поглотили раствором перманганата калия, подкисленным серной кислотой.
ZnSO4 + 4NaOH = Na2[Zn(OH)4] + Na2SO4
Na2[Zn(OH)4] + 2H2S = ZnS + Na2S + 4H2O (допустимо образование NaHS)
ZnS + 4H2SO4 = ZnSO4 + 4SO2 + 4H2O
5SO2 + 2KMnO4 + 2H2O = 2MnSO4 + K2SO4 + 2H2SO4
32. К раствору нитрата алюминия добавили раствор сульфида натрия. Полученный газ поглотили раствором перманганата калия, подкисленным серной кислотой, при этом наблюдали образование осадка. Осадок отделили и обработали горячим концентрированным раствором гидроксида калия. Полученную при этом кислородосодержащую соль добавили в раствор, содержащий дихромат калия и серную кислоту.
2Al(NO3)3 + 3Na2S + 6H2O = 2Al(OH)3 + 3H2S + 6NaNO3
5H2S + 2KMnO4 + 3H2SO4 = 5S + 2MnSO4 + K2SO4 + 8H2O
3S + 6KOH = 2K2S + K2SO3 + 3H2O
3K2SO3 + K2Cr2O7 + 4H2SO4 = 4K2SO4 + Cr2(SO4)3 + 4H2O
33. Оксид хрома(VI) поместили в раствор гидроксида калия. В полученный при этом раствор добавили раствор серной кислоты. Образовавшийся раствор дополнительно подкислили серной кислотой и пропустили через этот раствор сероводород. Образовавшийся при этом осадок отделили и поместили в горячий концентрированный раствор гидроксида калия.
CrO3 + 2KOH = K2CrO4 + H2O
2K2CrO4 + H2SO4 = K2Cr2O7 + K2SO4 + H2O
3H2S + K2Cr2O7 + 4H2SO4 = 3S + Cr2(SO4)3 + K2SO4 + 7H2O
3S + 6KOH = 2K2S + K2SO3 + 3H2O
34. Фосфид цинка растворили в соляной кислоте. Полученный газ поглотили концентрированным раствором азотной кислоты при нагревании, при этом наблюдали выделение бурого газа. Бурый газ пропустили через раствор гидроксида натрия. К полученному раствору добавили раствор, содержащий дихромат натрия и серную кислоту.
Zn3P2 + 6HCl = 3ZnCl2 + 2PH3
PH3 + 8HNO3 = H3PO4 + 8NO2 + 4H2O
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
3NaNO2 + Na2Cr2O7 + 4H2SO4 = 3NaNO3 + Cr2(SO4)3 + Na2SO4 + 4H2O
35. Алюминий добавили к раствору гидроксида натрия. Через образовавшийся прозрачный раствор пропустили газ, полученный при растворении серы в концентрированной серной кислоте. Образовавшийся осадок отделили, а к полученному раствору добавили раствор перманганата калия.
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
S + 2H2SO4 = 3SO2 + 2H2O
SO2 + 2Na[Al(OH)4] = 2Al(OH)3 + Na2SO3 + H2O (допустимо образование NaHSO3)
3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 + 2MnO2 + 2KO

