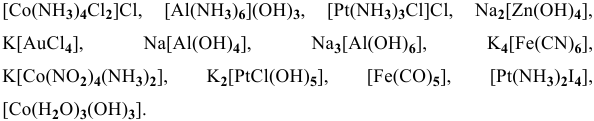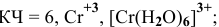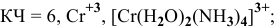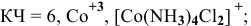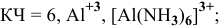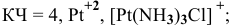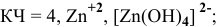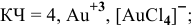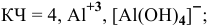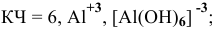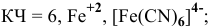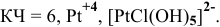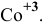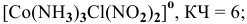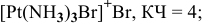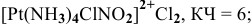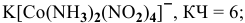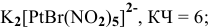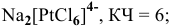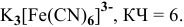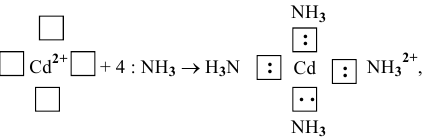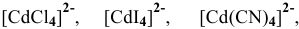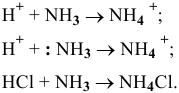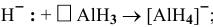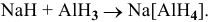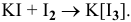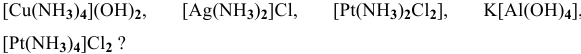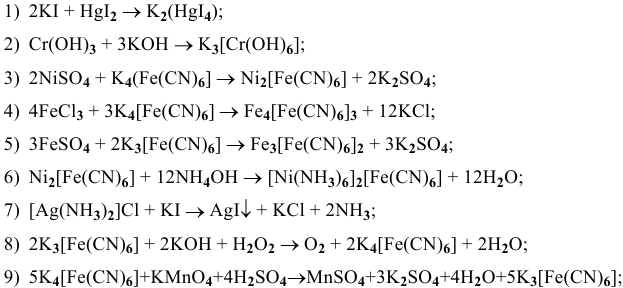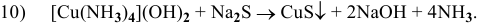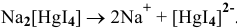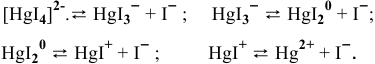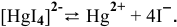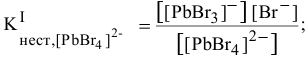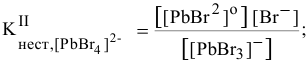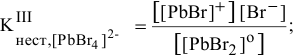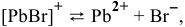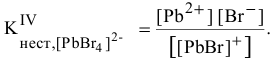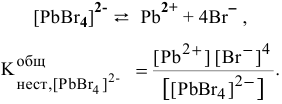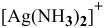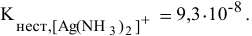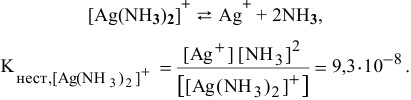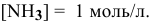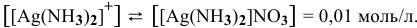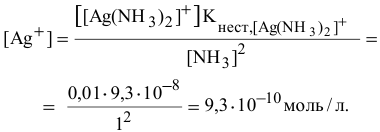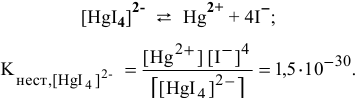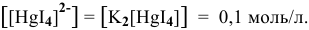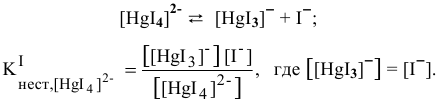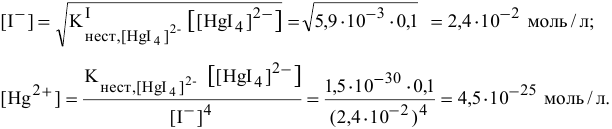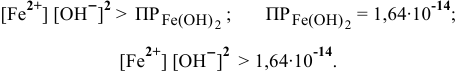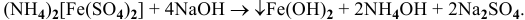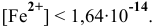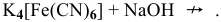Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Состав комплексных соединений
Номенклатура комплексных соединений
Реакции образования комплексных соединений
Реакции разрушения комплексных соединений
Диссоциация комплексных соединений
Примеры решения задач
Задачи для самостоятельного решения
Состав комплексных соединений
Рис. 1. Состав комплексного соединения
Комплексное соединение, рисунок 1, состоит из внутренней и внешней сферы. Центральная частица, вокруг которой расположены окружающие ее лиганды, называется комплексообразователем. Число лигандов комплексообразователя называется координационным числом.
Номенклатура комплексных соединений
Комплексное соединение может состоять из комплексного катиона, комплексного аниона или может быть нейтральным.
Соединения с комплексными катионами. Вначале называют внешнесферный анион, затем перечисляют лиганды, затем называют комплексообразователь в родительном падеже (ему дается русское название данного элемента). После названия комплексообразователя в скобках римской цифрой указывается его степень окисления.
К латинскому названию анионного лиганда добавляется окончание “о” (F— — фторо, Cl— -хлоро, ОН— — гидроксо, CN— — циано и т.д). Аммиак обозначают термином “аммин”, СО – карбонил, NO – нитрозил, H2O – аква.
Число одинаковых лигандов называют греческим числительным: 2 –ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта и т.д.
[Cu(NH3)4]SO4 – сульфат тетраамминмеди (II),
[Ni(H2O)6]Cl2 – хлорид гексаакваникеля (II).
Вначале перечисляют лиганды анионные, затем нейтральные, затем катионные. Например,
[Pt(NH3)5Cl]Cl3 – хлорид хлоропентаамминплатины (IV) .
Если в комплексе имеются несколько лигандов одинакового знака заряда, то они называются в алфавитном порядке:
[CoCl2(H2O)(NH3)3]Cl – хлорид дихлороакватриамминкобальта (III).
Соединения с комплексными анионами. Вначале называют комплексный анион в именительном падеже: перечисляют лиганды, затем комплексообразователь (ему дается латинское название и к названию добавляется окончание “ат”). После названия комплексообразователя указывается его степень окисления. Затем в родительном падеже называется внешнесферный катион.
Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия;
K4[Fe(CN)6] – гексацианоферрат (II) калия;
K2[СuCl4] – тетрахлорокупрат (II) калия.
Соединения без внешней сферы. Вначале называют лиганды, затем комплексообразователь в именительном падеже с указанием его степени окисления. Все название пишется слитно.
[Ni(CО)4] – тетракарбонилникель (0);
[Pt(NH3)2Cl4] – тетрахлородиамминплатина (IV).
Реакции образования комплексных соединений
Комплексные соединения обычно получают действием избытка лигандов на содержащее комплексообразователь соединение. Координационное число, как правило, в 2 раза больше степени окисления комплексообразователя. Из этого правила бывают, однако, исключения.
Образование гидроксокомплексов.
AlCl3 + 6NaOH(изб) = Na3[Al(OH)6] + 3NaCl
AlCl3 + 4NaOH(изб) = Na[Al(OH)4] + 3NaCl
ZnSO4 + 4NaOH(изб) = Na2[Zn(OH)4] + Na2SO4
Образование комплексных солей.
Если комплексообразователем является Fe2+ или Fe3+, то координационные числа в обоих случаях равны шести:
FeCl2 + 6KCN(изб) = K4[Fe(CN)6] + 2KCl
Fe2(SO4)3 + 12KCN(изб) = 2 K3[Fe(CN)6] + 3K2SO4
Координационные числа ртути и меди, как правило, равны четырем:
Hg(NO3)2 + 4KI(изб) = K2[HgI4] + 2KNO3
CuCl2 + 4NH3(изб) = [Cu(NH3)4]Cl2
Для большинства аква- и амминных комплексов ионов d-элементов координационное число равно шести:
NiCl2 + 6NH3 (изб) = [Ni(NH3)6]Cl2
Реакции разрушения комплексных соединений
Разрушение комплексных соединений происходит в результате:
-
-
- образования малорастворимого соединения с комплексообразователем:
-
[Cu(NH3)4]SO4 + Na2S = CuS↓ + 4NH3↑ + Na2SO4
-
-
- образования более прочного комплексного соединения с комплексообразователем или с лигандом:
-
[Cu(NH3)4]SO4 + 4KCN(изб) = K2[Cu(CN)4] + 4NH3↑ + K2SO4
[Cu(NH3)4]SO4 + 4HCl = 4NH4Cl + CuSO4
-
-
- образования малодиссоциированного электролита:
-
Na2[Zn(OH)4] + 4HCl(изб) = 2NaCl + ZnCl2 + 4H2O
-
-
- действия любой сильной кислоты на гидрокомплексы; в этом случае образуется соль и вода:
-
К3[Al(OH)6] + 6HCl(изб) = 3KCl + AlCl3 + 6H2O
-
-
- нагревания некоторых комплексных соединений:
-
[Cu(NH3)4]SO4 → CuSO4 + 4NH3↑
Na[Al(OH)4] → NaAlO2 + 2H2O
-
-
- окислительно-восстановительных реакций:
-
2Na[Ag(CN)2] + Zn = Na2[Zn(CN)4] + 2Ag
6K4[Fe(CN)6] +K2Cr2O7 +7H2SO4=6K3[Fe(CN)6] +Cr2(SO4)3 +4K2SO4 +7H2O
Диссоциация комплексных соединений
Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы. В то же время комплексный ион диссоциирует в незначительной степени как ассоциированный электролит. Количественной характеристикой диссоциации внутренней сферы в растворе является константа нестойкости, представляющая собой константу равновесия процесса диссоциации комплексного иона.
Например, в растворе комплексное соединение [Ni(NH3)6]SO4 диссоциирует следующим образом:
[Ni(NH3)6]SO4 = [Ni(NH3)6]2+ + SO42-
Для комплексного иона [Ni(NH3)6]2+, диссоциирующего по уравнению
[Ni(NH3)6]2+ → Ni2+ + 6NH3
константа равновесия процесса диссоциации носит название константы нестойкости Кн. Для рассматриваемого процесса Кн равна
Кн = [Ni2+]·[NH3]6 / [[Ni(NH3)6]2+] (1)
Величина, обратная Кн, называется константой устойчивости:
Ку = 1/Кн (2)
Она представляет собой константу равновесия процесса образования комплексного иона:
Ni2+ + 6NH3 ↔ [Ni(NH3)6]2+
Константа нестойкости Кн связана с изменением энергии Гиббса процесса диссоциации комплекса уравнением:
ΔGTо = — RTln Кн (3)
Примеры решения задач:
Задача 1. Вычислите:
1) Концентрацию ионов NO3— в 0,01 М растворе [Ag(NH3)2]NO3.
2) Концентрацию Ag+ в 0,01 М растворе [Ag(NH3)2]NO3, содержащем 2 моль/л избыточного аммиака,
если Кн[Ag(NH3)2]+ = 5,7× 10— 8 при 298 К.
3) Величину ΔGo298 процесса диссоциации комплексного иона.
Решение:
1)
[Ag(NH3)2]NO3 = [Ag(NH3)2]+ + NO3—
[NO3— ] = 0,01М, поскольку комплекс диссоциирует как сильный электролит на комплексный ион и ионы внешней сферы.
2) Комплексный ион диссоциирует незначительно:
[Ag(NH3)2]+ → Ag+ + 2NH3
Положение равновесия комплексного иона в присутствии избытка NH3 еще больше смещено влево.
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Ag+ и 2x моль/л аммиака. Суммарная концентрация аммиака равна (2x+2) моль/л. Концентрация недиссоциированного комплексного иона [Ag(NH3)2]+ составляет: (0,01–x) моль/л.
Концентрация аммиака, связанная с диссоциацией комплексного иона, ничтожно мала по сравнению с избытком аммиака. Доля комплексного иона, подвергшегося диссоциации, также ничтожно мала. Значит,
x = 1,43× 10— 10
Следовательно, [Ag+] = 1,43× 10— 10 моль/л.
Константа нестойкости связана с изменением энергии Гиббса процесса диссоциации [Ag(NH3)2]+ уравнением:
ΔGоT = — RTln Кн .
Значит, при Т = 298 К получаем:
ΔGо298 = — 8,314× 298× ln5,7× 10— 8 = 41326 Дж = 413,3 кДж.
Задача 2. Произойдет ли осаждение AgCl при сливании 0,01М раствора [Ag(NH3)2]NO3, содержащего 2 моль/л избыточного NH3, с равным объемом 0,5М раствора KCl, если при 298 К ПР(AgCl) = 1,73× 10— 10, Кн.[Ag(NH3)2]+ = 5,7× 10— 8.
Решение. Осадок выпадет при условии: [Ag+][Сl— ] > ПР(AgCl), т.е. если произведение концентраций ионов Ag+ и Сl— в растворе будет больше ПР, то раствор окажется пересыщенным и из него будет выпадать осадок.
После смешения равных объемов растворов концентрации [Ag(NH3)2]NO3, NH3 и KCl уменьшатся в 2 раза и станут равными 5× 10-3, 1 и 0,25 М соответственно.
Найдем концентрацию [Ag+] тем же способом, что и в предыдущей задаче,
откуда x = 2,85× 10— 10.
Значит, [Ag+] = 2,85× 10— 10 моль/л, а [Сl— ] = 0,25 моль/л.
Следовательно, произведение концентраций ионов равно:
[Ag+][Сl— ] = 2,85× 10— 10× 0,25 = 7,1× 10— 11(моль/л)2.
Поскольку [Ag+][Сl— ] = 7,1× 10— 11 < 1,73× 10— 10, то осадок не выпадет.
Задача 3. При какой концентрации ионов S2- начнется выпадение осадка CdS из 0,6М раствора Na2[Cd(CN)4], содержащего 0,04 моль/л избыточного NaCN, если ПР(CdS) = 7,9× 10— 27, Кн[Cd(CN)4]2- = 7,8× 10— 18.
Решение. Осадок выпадет при условии: [Cd2+][S2- ] > ПР(CdS), т.е. если произведение концентраций ионов Cd2+ и S2- в растворе будет больше ПР. Следовательно, выпадение осадка начнется при [S2-] > ПР(CdS):[Cd2+].
Na2[Cd(CN)4] = [Cd(CN)4]2- + 2Na+
Комплексный ион диссоциирует незначительно:
[Cd(CN)4]2- → Cd2+ + 4CN—
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Cd2+ и 4x моль/л ионов CN— . Суммарная концентрация ионов CN— равна (4x + 0,04) моль/л. Концентрация недиссоциированного комплексного иона [Cd(CN)4]2- составляет: (0,6 – x) моль/л.
Кн[Cd(CN)4]2- = [Cd2+ ] · [CN—]4/ [[Cd(CN)4]2-]
x = 1,8·10— 12 .
Следовательно, [Cd2+] = 1,8·10— 12 моль/л.
Выпадение осадка начнется при [S2- ] > 7,9·10— 27: 1,8·10— 12 > 4,39·10— 15 моль/л.
Задачи для самостоятельного решения
1. Назовите следующие комплексные соединения:
Na2[Pt(CN)4Cl2],
[Cu(NH3)4](NO3)2,
[Cu(H2O)4]SO4
|
Na2[Pt(CN)4Cl2] – дихлоротетрацианоплатинат (IV) натрия; [Cu(NH3)4](NO3)2 – нитрат тетраамминмеди (II); [Cu(H2O)4]SO4 – сульфат тетрааквамеди (II); |
2. Назовите следующие комплексные соединения
[Co(H2O)3Cl3],
[Ni(NH3)6][PtCl4].
|
[Co(H2O)3Cl3] – трихлоротриаквакобальт (III); [Ni(NH3)6][PtCl4] – тетрахлороплатинат (II) гексаамминникеля (II). |
3. Составьте уравнение химической реакции:
Cr2(SO4)3 + NaOH (изб.)→
4. Составьте уравнение химической реакции:
Cd(NO3)2 + Na2SO3 (изб.)→
5. Составьте уравнение химической реакции:
[Ag(NH3)2]NO3 + Na2S →
6. Составьте уравнение химической реакции:
[Ag(NH3)2]NO3 -t→
7. Составьте уравнение химической реакции:
K4[Fe(CN)6] + Н2O2 + H2SO4 →
8. Сколько граммов серебра содержится в виде ионов в 0,04М растворе K[Ag(CN)2], содержащем в избытке 1,3 г KCN в 1 л раствора. Константа нестойкости иона [Ag(CN)2] — равна 1,4·10— 20.
9. Произойдет ли осаждение сульфида ртути, если к 1 л 0,3 М раствора K2[HgI4], содержащему избыточных 0,01 моль KI, добавить 1·10— 4 моль K2S? ПР(HgS) = 1,6·10— 52, Кн [HgI4]2- = 1,5·10— 31.
10. При какой концентрации ионов Cl— начнется выпадение осадка AgCl из 0,6М раствора [Ag(NH3)2]NO3, содержащего 1,2 моль/л избыточного аммиака, если ПР(AgCl) = 1,73·10—10, Кн [Ag(NH3)2]+ = 5,7·10— 8.
Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
КЛАСС/ГРУППА
1) соль средняя
2) оксид кислотный
3) оксид несолеобразующий
4) соль кислая
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Демонстрационная версия ЕГЭ—2017 по химии, Демонстрационная версия ЕГЭ—2020 по химии, Демонстрационная версия ЕГЭ—2018 по химии, Демонстрационная версия ЕГЭ−2019 по химии
2
Установите соответствие между формулой вещества и классом (группой) неорганических соединений, к которому(-ой) оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
ФОРМУЛА НЕОРГАНИЧЕСКОГО ВЕЩЕСТВА
КЛАСС (ГРУППА) НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1) основный оксид
2) амфотерный оксид
3) кислотный оксид
4) пероксид
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ
3
Установите соответствие между формулой вещества и классом (группой) неорганических соединений, к которому(-ой) оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
КЛАСС (ГРУППА) НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1) кислота
2) основание
3) основный оксид
4) амфотерный оксид
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ
4
Установите соответствие между классом неорганических веществ и химической формулой его представителя: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
КЛАСС ВЕЩЕСТВ
A) кислая соль
Б) средняя соль
B) кислота
ХИМИЧЕСКАЯ ФОРМУЛА ПРЕДСТАВИТЕЛЯ
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ
5
Установите соответствие между формулой соли и группой солей, к которой она принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
ГРУППА СОЛЕЙ
1) основные
2) кислые
3) средние
4) комплексные
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ
Пройти тестирование по этим заданиям
3 ноября 2021
В закладки
Обсудить
Жалоба
Комплексные (координационные) соединения
Презентация предназначена для изучения материала по теме «Комплексные соединения» на углубленном уровне в 11 классе.
Комплексные соединения (КС) – это вещества, в состав которых входят сложные ионы, существующие как в кристалле, так и в растворе.
kompleks-s.pptx
kompleks-s.pdf
Автор: Плис Татьяна Фёдоровна.
Комплексные соединения
Задача 107
Назвать следующие комплексные соединения. Определить координационное число, заряд комплексообразователя и заряд внутренней сферы: 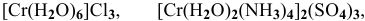
Решение:
а) Катионные комплексы:
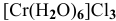
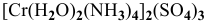
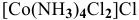
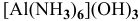
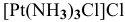
б) Анионные комплексы:
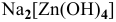
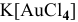
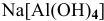
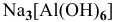
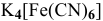
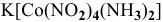
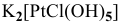
в) Нейтральные комплексы: 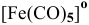
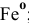
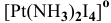
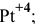
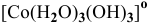
Задача 108
Написать формулы следующих комплексных соединений по их названиям. Определить координационное число и заряд внутренней сферы.
Решение:
Далее приводятся одновременно названия комплексных соединений и их формулы:
1) трихлоромононитродиамминплатина — 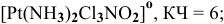
2) динитромонохлоротриамминкобальт —
3) монобромотриамминплатина(П) бромид —
4) монохлоромононитротетраамминплатина(1У) хлорид —
5) гексаамминжелеза(Ш) иодид — 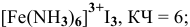
6) тетранитродиамминкобальтат(Ш) калия —
7) монобромопентанитроплатинат (1V) калия —

9) гексацианоферрат(Ш) калия —
Задача 109
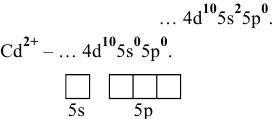
Применив метод валентных схем, найти координационное число 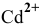
Решение:
Электронная конфигурация атома 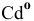
Для катиона
Обладая 4 свободными квантовыми ячейками, катион 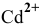
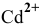
Например:
т.е.
Аналогично:
Задача 110
Обладая какой степенью окисления, водород может входить в состав комплексных ионов ?
Решение:
В состоянии окисления +1 водород может играть роль акцептора электронной пары, значит, он может образовывать комплекс, играя роль лиганда, с комплексообразователем, играющим роль донора, т.е. имеющим свободную электронную пару, например:
В состоянии окисления -1 водород должен играть роль донора, например:
Задача 111
Почему растворимость иода выше в растворе KI, чем в воде?
Решение:
Более высокая растворимость иода в водном растворе KI по сравнению с растворимостью в воде объясняется образованием комплекса 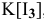
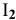
Задача 112
Исходя из каких веществ и каким способом можно получить следующие комплексные соединения: 
Решение:
1) 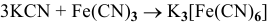
2) 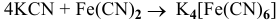
3) 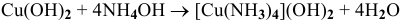
4) 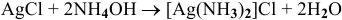
5) 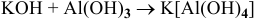
6) 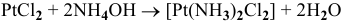
7) 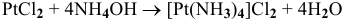
Задача 113
Составить и уравнять следующие схемы реакции.
Решение:
Далее приводятся уже составленные и уравненные химические реакции:
Задача 114
Написать уравнения электролитической диссоциации следующих комплексных соединений: 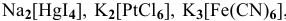
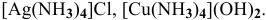
Пример решения: Комплексная соль 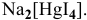
Комплексное соединение диссоциирует на ион внутренней сферы и ионы внешней сферы как сильный электролит:
Комплексный ион диссоциирует как слабый электролит — диссоциация ступенчатая:
Суммарное уравнение диссоциации комплексного иона следующее:
Задача 115
Написать математическое выражение констант нестойкости следующих комплексных ионов: 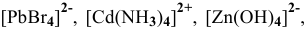
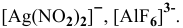
Пример решения: Для комплексного иона 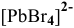
I ступень
II ступень 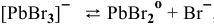
III ступень 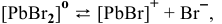
IV ступень
Суммарное уравнение диссоциации комплексного иона:
Задача 116
Рассчитать концентрацию ионов 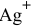
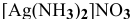
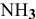
Решение:
Константа нестойкости комплексного иона
Суммарное уравнение его диссоциации:
Концентрация ионов, создаваемая диссоциацией комплексного иона, ничтожна по сравнению с созданной концентрацией 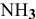
Предположив, что диссоциация комплексной соли на комплексный ион и ионы внешней сферы протекает полностью, находим концентрацию иона по формуле
Находим концентрацию ионов серебра:
Задача 117
Рассчитать концентрацию ионов 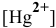
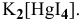
Решение:
Суммарное уравнение диссоциации 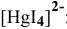
Предположив, что диссоциация комплексной соли на комплексный ион и ионы внешней сферы протекает полностью, находим концентрацию комплексного иона по формуле
Концентрацию ионов 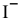
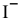
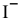
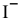
Отсюда
Задача 118
Можно ли получить осадок 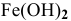
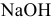
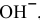
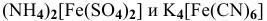
Решение:
Осаждение малорастворимого соединения начинается тогда, когда достигается величина произведения растворимости. Необходимое условие осаждения 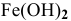
Так как [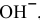
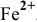
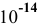
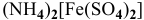
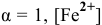
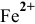
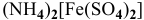
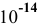
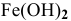
Для комплексной соли 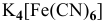
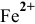
Таким образом, осаждение 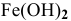
Эти задачи взяты со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:
Денисова А.В.
Задачи «Комбинированные задачи ЕГЭ по химии».
В современном образовании наблюдается
тенденция усложнения и усиления базы ЕГЭ.Так,в 2020 году, значительно прошли преобразования формулировок и внутренних контекстов
заданий.В 34 задаче ЕГЭ по химии каждый год наблюдаются изменения.В пролом году это были задачи на растворимость
в составе комплексной задачи, в этом
году задачи на атомистику.
Предлагаю вашему вниманию авторские комплексные
задачи, которые позволят отработать основные темы курса решения расчетных
задач, а так же послужат
тренировочной базой для сдающих ЕГЭ 2020-2021 году ученикам.
1.Для проведения электролиза( на инертных
электродах) приготовили 20%раствор нитрата серебра, содержащий 2 моль катионов.После
того, как на аноде выделилось 4 л
газа(н.у), электролиз остановили.Из полученного раствора отобрали порцию массой
300 г.Вычислите массу 40% раствора гидроксида натрия, который нужно добавить к отобранной порции.В решении запишите уравнения
реакции и приведите нужные расчёты.
2.Для проведения электролиза(на инертных
электродах)приготовили 15%раствор нитрата ртути,содержащий 2 моль анионов.Когда на катоде выпало 16г
осадка,электролиз остановили.А из
полученного раствора отобрали порцию массой 45г.В порцию добавили 6 г меди.Определите
массовую долю соли в полученном растворе.В решении запишите уравнения реакции и
приведите нужные расчёты.
3. Для проведения электролиза(на инертных
электродах)приготовили 25%раствор сульфата
меди(II),содержащий 9,03*1023 атомов меди.После того,как на аноде
выделилось 11,2л газа, электролиз
остановили.Из полученного раствора отобрали порцию массой 600г.Вычислите массу
15% раствора гидроксида натрия,который нужно добавить к отобранной порции.
4.При частичном разложении 160г50%раствора нитрата алюминия выделилось
16л смеси газов.В полученный раствор добавили избыток 30% раствора гидроксида
калия,содержащего 1,75 моль катионов. Определите массовую долю солей в
образовавшемся растворе.
…
Здесь приведены задачи к разделу Комплексные соединения: структура, классификация, номенклатура комплексных соединений, а также их устойчивость и химические свойства.
Задача 1. Из сочетаний частиц Hg2+, NH3, I— и K+ можно составить 5 координационных формул комплексных соединений ртути. Укажите формулы данных соединений, если координационное число ртути равно четырем. Назовите эти соединения и запишите уравнения их диссоциации на ионы.
Показать решение »
Решение.
Из сочетаний частиц Hg2+, NH3, I— и K+ можно составить следующие 5 координационных формул комплексных соединений ртути Hg2+ (к.ч. = 4):
[Hg(NH3)2I2] – дийодоамминортуть (II)
Диссоциация протекает ступенчато:
1 ст. [Hg(NH3)2I2] = [Hg(NH3)2I]+ + I—
2 ст. [Hg(NH3)2I]+ = [Hg(NH3)2]2+ + I—
3 ст. [Hg(NH3)2]2+ = [Hg(NH3)]2+ + NH3
4 ст. [Hg(NH3)]2+ = Hg2+ + NH3
Суммарная диссоциация:
[Hg(NH3)2I2] = Hg2+ + 2NH3 + 2I—
K[Hg(NH3)I3] – моноамминотрийодомеркурат (II) калия
Первичная диссоциация:
K[Hg(NH3)I3] = K+ + [Hg(NH3)I3]—
Вторичная диссоциация протекает ступенчато (см. пример выше).
[Hg(NH3)I3]— = Hg2+ + 3NH3 + 3I—
K2[HgI4] — тетрайодомеркурат (II) калия
Первичная диссоциация:
K2[HgI4] = 2K+ + [HgI4]2-
Вторичная диссоциация протекает ступенчато; суммарно выглядит следующим образом:
[HgI4]2- = Hg2+ + 4I—
[Hg(NH3)3I]I – йодид триамминомонойодортути (II)
Первичная диссоциация
[Hg(NH3)3I]I = [Hg(NH3)3I]+ + I—
Вторичная диссоциация идет по ступеням; суммарно выглядит следующим образом:
[Hg(NH3)3I]+ = Hg2+ + I— + 3NH3
[Hg(NH3)4]I2 – йодид тетраамминортути (II)
Первичная диссоциация
[Hg(NH3)4]I2 = [Hg(NH3)4]2+ + 2I—
Вторичная диссоциация протекает ступенчато; суммарно выглядит следующим образом:
[Hg(NH3)4]2+ = Hg2+ + 4NH3
Задача 2. Рассмотрите следующую реакцию:
2[Co(H2O)6)]Cl2 + 2NH4Cl + 10 NH3 + H2O2 → 2[Co(NH3)6]Cl3 + 14 H2O,
катализатором которой является древесный уголь. Какую степень окисления имеет атом кобальта в комплексных соединениях [Co(H2O)6)]Cl2 и [Co(NH3)6]Cl3? Какую роль играет пероксид водорода и какую — аммиак?
Показать решение »
Решение.
В целом, комплексное соединение нейтрально. Составим уравнение, в котором заряд иона кобальта обозначим через x:
[Co(H2O)6)]Cl2
x + 6·0 + 2·(-1) = 0
x = +2
Co+2
[Co(NH3)6]Cl3
x + 6·0 + 3·(-1) = 0
x = +3
Co+3
Координационное число в обоих соединениях равно к.ч. = 6
2[Co(H2O)6)]Cl2 + 2NH4Cl + 10 NH3 + H2O2 → 2[Co(NH3)6]Cl3 + 14H2O
В данной реакции H2O2 играет роль окислителя, Co+2 — роль восстановителя, а аммиак принимает участие в образовании аммиачного комплекса.
Задача 3. Составьте уравнения диссоциации на ионы комплексных солей: Cr(NH3)5Сl3; Cr(NH3)4(H2O)Cl3; Co(NH3)5(NO2)3; KСo(NH3)2(NO2)4, заключив формулы комплексных ионов в квадратные скобки и имея в виду, что координационное число как хрома, так и кобальта равно шести.
Показать решение »
Решение.
Координационное число показывает количество лигандов, окружающих комплексообразователь. В данном примере к.ч = 6.
Cr(NH3)5Сl3
[Cr(NH3)5Сl]Сl2 = [Cr(NH3)5Сl]2+ + 2Cl— [Cr(NH3)5Сl]2+ = Cr3+ + 5NH3 + Сl—
Cr(NH3)4(H2O)Cl3
[Cr(NH3)4(H2O)Cl]Cl2 = [Cr(NH3)4(H2O)Cl]2+ + 2Cl— [Cr(NH3)4(H2O)Cl]2+ = Cr3+ + 4NH3 + H2O + Cl—
Co(NH3)5(NO2)3
[Co(NH3)5(NO2)](NO2)2 = [Co(NH3)5(NO2)]2+ + 2NO2— [Co(NH3)5(NO2)]2+ = Co3+ + 5NH3 + NO2—
KСo(NH3)2(NO2)4
K[Сo(NH3)2(NO2)4] = K+ + [Сo(NH3)2(NO2)4]—
[Сo(NH3)2(NO2)4]— = Сo3+ + 2NH3 + 4NO2—
Задача 4. Пользуясь таблицей констант нестойкости, определите, в каких случаях произойдет взаимодействие между растворами электролитов. Укажите для этих случаев молекулярные и ионные формы уравнений:
а) K2[HgBr4] +KCN; б) Na3[Ag(S2O3)2] + KCN; в) [Cu(NH3)4](NO3)2 +KCN;
Показать решение »
Решение.
Реакция протекает в сторону образования более прочного соединения. Чтобы определить вероятность протекания реакции, необходимо сравнить константы нестойкости исходного и образовавшегося комплексных соединений. Комплексное соединение тем прочнее, чем более низкое значение имеет константа нестойкости.
а) K2[HgBr4] + 4KCN = K2[Hg(CN)4] + 4KBr
2K+ + [HgBr4]2- + 4K+ + 4CN— = 2K+ + [Hg(CN)4]2- + 4K+ + 4Br—
[HgBr4]2- + 4CN— = [Hg(CN)4]2- + 4Br—
Kн(K2[HgBr4]) > Kн(K2[Hg(CN)4])
б) Na3[Ag(S2O3)2] + 4KCN = Na[Ag(CN)2] + 2K2S2O3 + 2NaCN
3Na+ + [Ag(S2O3)2]3- + 4K+ + 4CN— = Na+ + [Ag(CN)2]— + 4K+ + 2S2O32- + 2Na+ + 2CN—
Kн(Na3[Ag(S2O3)2]) > Kн(Na[Ag(CN)2])
в) [Cu(NH3)4](NO3)2 + 4KCN = K2[Cu(CN)4] + 4NH3 + 2KNO3
[Cu(NH3)4]2+ + 2NO3— + 4K+ + 4CN— = 2K+ + [Cu(CN)4]2- + 4NH3 + 2K+ + 2NO3— [Cu(NH3)4]2+ + 4CN— = [Cu(CN)4]2- + 4NH3
Kн([Cu(NH3)4](NO3)2) > Kн(K2[Cu(CN)4])
Во всех приведенных реакциях Kн исходных комплексных соединений имеют большее значение, чем Kн образовавшихся комплексных соединений, поэтому между всеми растворами электролитов произойдет взаимодействие.
Задача 5. Приведите схемы диссоциации и выражения констант нестойкости следующих комплексных ионов:
а) [Fe(CN)6]4-; б) [Ag(NH3)(H2O)]+; в) [Cr(H2O)6]3+.
Определите степень окисления указанных комплексообразователей.
Показать решение »
Решение.
Обозначим степень окисления центрального атома через х:
а) [Fe(CN)6]4-;
х + 6(-1) = -4
х = +2
[Fe(CN)6]4- = Fe2+ + 6CN—
Kн = ([Fe2+]· [CN—]6)/ [[Fe(CN)6]4-]
б) [Ag(NH3)(H2O)]+;
х + 0 + 0 = +1
х = +1
[Ag(NH3)(H2O)]+ = Ag+ + NH3 + H2O
Kн = ([Ag+]·[NH3]·[H2O])/ [[Ag(NH3)(H2O)]+]
в) [Cr(H2O)6]3+
х + 6(0) = +3
х = +3
[Cr(H2O)6]3+ = Cr3+ + 6H2O
Kн = ([Cr3+]· [H2O]6)/ [[Cr(H2O)6]3+]
Задача 6. Укажите названия соединений, определите степень окисления комплексообразователя:
а) [Cr(NH3)6]Cl3; б) [Cu(NH3)4]SO4; в) K4[Fe(CN)6]; г)Na2[Be(OH)4]; д) [Co(NH3)3Cl3]; е)K[Pt(NH3)Cl3].
Составьте уравнения электролитической диссоциации перечисленных веществ и запишите соответствующие им выражения констант нестойкости комплексных ионов.
Показать решение »
Решение.
Чтобы определить степень окисления центрального атома, необходимо решить простое уравнение, обозначив через х степень окисления комплексообразователя:
а) [Cr(NH3)6]Cl3 – хлорид гексаамминхрома (III)
х + 6·0 + 3·(-1) = 0
х = +3
[Cr(NH3)6]Cl3 = [Cr(NH3)6]3+ + 3Cl— [Cr(NH3)6]3+ = Cr3+ + 6NH3
Kн = ([Cr3+]·[NH3]6)/[[Cr(NH3)6]3+]
б) [Cu(NH3)4]SO4 – сульфат тетраамминмеди (II)
х + 4·0 + 1·(-2) = 0
х = +2
[Cu(NH3)4]SO4 = [Cu(NH3)4]2+ + SO42- [Cu(NH3)4]2+ = Cu2+ + 4NH3
Kн = ([Cu2+]·[NH3]4)/[[Cu(NH3)4]2+]
в) K4[Fe(CN)6] – гексацианоферрат(II) калия
4·1 + х + 6·(-1) = 0
х = +2
K4[Fe(CN)6] = 4K+ + [Fe(CN)6]4-
[Fe(CN)6]4- = Fe2+ + 6CN—
Kн = ([Fe2+]·[CN]6)/[[Fe(CN)6]4-]
г) Na2[Be(OH)4] – тетрагидроксоберрилат(II) натрия
2·1 + х + 4·(-1) = 0
х = +2
Na2[Be(OH)4] = 2Na+ + [Be(OH)4]2-
[Be(OH)4]2- = Be2+ + 4OH—
Kн = ([Be2+]·[OH—]4)/[[Be(OH)4]2-]
д) [Co(NH3)3Cl3] – триамминтрихлорокобальтат(III)
х + 3·0 + 3·(-1) = 0
х = +3
[Co(NH3)3Cl3] = Co3+ + 3NH3 + 3Cl—
Kн = ([Co3+]·[NH3]3·[Cl—]3)/[[Co(NH3)3Cl3]]
е) K[Pt(NH3)Cl3] – амминтрихлороплатинат(II) калия
1·1 + х + 1·0 + 3·(-1) = 0
х = +2
K[Pt(NH3)Cl3] = K+ + [Pt(NH3)Cl3]—
[Pt(NH3)Cl3]— = Pt2+ + NH3 + 3Cl—
Kн = ([Pt2+]·[NH3]·[Cl—]3)/[[Pt(NH3)Cl3]—]
Задача 7. Напишите формулы комплексных соединений по указанным названиям:
а) хлорид тетраамминцинка (II), б) тетраиодокобальтат (III) натрия.
Составьте уравнение реакции между указанными соединениями и раствором KNO2 в молекулярной и ионно-молекулярной формах. Назовите образующиеся комплексные соединение.
Показать решение »
Решение.
а) хлорид тетраамминцинка (II) – [Zn(NH3)4]Cl2
[Zn(NH3)4]Cl2 + 4KNO2 = K2[Zn(NO2)4] + 2KCl + 4NH3 [Zn(NH3)4]2+ + 2Cl— + 4K+ + 4NO2— = 2K+ + [Zn(NO2)4]2- + 2K+ + 2Cl— + 4NH3 [Zn(NH3)4]2+ + 4NO2— = [Zn(NO2)4]2- + 4NH3
K2[Zn(NO2)4] – тетранитроцинкат(II) калия
б) тетраиодокобальтат (III) натрия — Na[CoI4]
Na[CoI4] + 4KNO2 = Na[Co(NO2)4] + 4KI
Na+ + [CoI4]— + 4K+ + 4NO2— = Na+ + [Co(NO2)4]— + 4K+ + 4I—
[CoI4]— + 4NO2— = [Co(NO2)4]— + 4I—
Na[Co(NO2)4] — тетранитрокобальтат(III) натрия
Задача 8. Эмпирическая формула соли CrCl3×5 H2O. Исходя из того, что координационное число хрома равно шести, определите, какой объем 1 н. раствора AgNO3 понадобится для осаждения внешнесферно связанного хлора, содержащегося в 300 мл 0,1 М раствора комплексной соли. При вычислениях считать, что вся вода, входящая в состав соли, связана внутрисферно.
Показать решение »
Решение.
CrCl3×5H2O
Известно, что вся вода связана внутрисферно, а к.ч. = 6, поэтому формула соединения следующая:
[Cr(H2O)5Cl]Cl2 – хлорид пентааквахлорохрома (III)
[Cr(H2O)5Cl]Cl2 + 2AgNO3 = [Cr(H2O)5Cl](NO3)2 + 2AgCl
Используя «золотое правило аналитики», найдем какой объем 1 н. раствора AgNO3 понадобится для осаждения внешнесферно связанного хлора, содержащегося в 300 мл 0,1 М раствора комплексной соли:
C1V1 = C2V2,
где С1 и С2 – молярные концентрации растворов AgNO3 и комплексной соли, а V1 и V2 – их объемы.
Для AgNO3 нормальная концентрация совпадает с молярной концентрацией. Подставим значения в формулу:
1·V1 = 0,1·0,3
V1 = 0,03 л = 30 мл.
Из уравнения реакции видно, что на осаждение всего хлора понадобится 2 моля AgNO3, поэтому:
V(AgNO3) = 2·30 = 60 мл.
Задача 9. При взаимодействии раствора [Cu(NH3)4]Cl2 c раствором KCN образуется соль K2[Cu(CN)4]. Составьте уравнение реакции и объясните причину её протекания.
Показать решение »
Решение.
[Cu(NH3)4]Cl2 + 4KCN = K2[Cu(CN)4] + 2KCl + NH3 [Cu(NH3)4]2+ + 2Cl— + 4K+ + 4CN— = 2K+ + [Cu(CN)4]2- + 2K+ + 2Cl— + 4NH3 [Cu(NH3)4]2+ + 4CN— = [Cu(CN)4]2- + 4NH3
Известно, что имея один и тот же комплексообразователь, цианидные комплексы более устойчивы аммиачных.
Это можно увидеть по значениям констант нестойкости этих комплексов. Пользуясь таблицей констант нестойкости, определим:
Kн([Cu(NH3)4]2+) = 9,33·10-13
Kн([Cu(CN)4]2-) = 5,0·10-28
Комплексное соединение тем прочнее, чем более низкое значение имеет константа нестойкости. А реакция всегда протекает в сторону образования более прочного комплекса, поэтому данная реакция возможна.
Составление координационных формул комплексных соединений
Решение задач на составление уравнений диссоциации комплексных соединений
Задание 301
Определите заряд комплексного нона, степень окисления и координационное число комплексообразователя в соединениях [Cu(NH3)4]SO4, К2[PtCl6], К[Аg(CN)2]. Напишите уравнения диссоциации этих соединений в водных растворах.
Решение:
Заряд комплексного иона равен заряду внешней сферы, но противоположен ему по знаку. Координационное число комплексообразователя равно числу лигандов, координированных вокруг него. Степень окисления комплексообразователя определяется так же, как степень окисления атома в любом соединении, исходя из того, что сумма степеней окисения всех атомов в молекуле равна нулю. Заряды нейтральных молекул (Н2О,NH3) равны нулю. Заряды кислотных остатков определяют из формул соответствующих кислот. Отсюда:
Заряд иона Координ. число Степень окисл.
а) [Cu(NH3)4]SO4 2+ 4 +2
б) К2[PtCl6] 2- 6 +4
в) К[Аg(CN)2] 1- 2 +1
Комплексные соединения диссоциируют как сильные электролиты необратимо:
а) [Cu(NH3)4]SO ⇔ [Cu(NH3)4]2+ + SO42-;
б)К2[PtCl6] ⇔ 2К+ + [PtCl6]2-;
в) К[Аg(CN)2] ⇔ К+ + [Аg(CN)2]—
Задание 302
Составьте координационные формулы следующих комплексных соединений платины:
РtCl4 . 6NH3; РtCl4 . 4NH3; РtCl4. 2NH3. Координационное число платины (IV) равно шести. Напишите уравнение диссоциации этих соединений в водных растворах. Какое из соединений является комплексным неэлектролитом?
Решение:
Формулы комплексных соединений:
а) РtCl4 . 6NH3: [Pt(NH3)6]Cl4 – хлорид гексаамминплатины(IV);
б)4NH3; РtCl4: [Pt(NH3)4Cl2]Cl2 – хлорид дихлоротетраамминплатины(IV);
в) РtCl4. 2NH3: [Pt(NH3)2Cl4] – тетрахлородиамминплатина.
Уравнения диссоциации этих комплексных соединений:
а) [Pt(NH3)6]Cl4 ⇔ [Pt(NH3)6]4+ + 4Сl—;
б) [Pt(NH3)4Cl2]Cl2 ⇔ [Pt(NH3)4Cl2]2+ + 2Cl—;
в) [Pt(NH3)2Cl4] – данное соединение является неэлектролитом.
Задание 303
Составьте координационные формулы следующих комплексных соединений кобальта:
СоCl3 . 6NH3; СоCl3 . 5NH3; СоCl3 . 4NH3. Координационное число кобальта (III) равно шести .Напишите уравнения диссоциации этих соединений в водных растворах.
Решение:
Формулы комплексных соединений:
а) СоCl3 . 6NH3: [Со(NH3)6]Cl3 – хлорид гексаамминкобальта(III);
б) СоCl3 . 5NH3: [Co(NH3)5Cl]Cl2 – хлорид хлоропентаамминкобальта(III);
в) СоCl3 . 4NH3: [Со(NH3)4Cl2]Cl – хлорид дихлоротетрамминкобальта(III).
Уравнения диссоциации этих комплексных соединений:
а) [Со(NH3)6]Cl3 ⇔ [Со(NH3)6]3+ + 3Сl—;
б) [Co(NH3)5Cl]Cl2 ⇔ [Co(NH3)5Cl]2+ + 2Cl—;
в) [Со(NH3)4Cl2]Cl ⇔ [Со(NH3)4Cl2]+ + Cl—