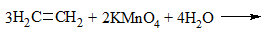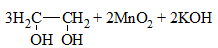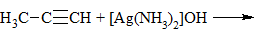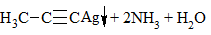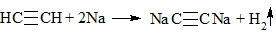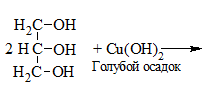| Соединение, функциональная группа | Реагент | Что наблюдается, уравнение реакции |
|
Алкены >C=C< |
Водный раствор KMnO4 |
Наблюдают исчезновение фиолетовой окраски KMnO4 и образование хлопьевидного осадка диоксида марганца бурого цвета 3 >C=C< + 2KMnO4 + 4H2O → 3 >C(OH)-C(OH)< + 2MnO2↓ + 2KOH |
| Раствор Br2 в органическом растворителе или воде (бромная вода) |
Исчезает желто-коричневая окраска раствора брома из-за протекания реакции: >C=C< + Br2 → >C(Br)-C(Br)< |
|
| Алкины -С≡С- | Раствор Br2 в органическом растворителе или воде (бромная вода) |
Исчезает желто-коричневая окраска раствора брома из-за протекания реакции: R-С≡С-R’ + 2Br2 → R-CBr2-CBr2-R’ |
|
Водные растворы аммиачных комплексов Ag(I), например, аммиачный раствор оксида серебра [Ag(NH3)2]OH |
Алкины с тройной связью на конце молекулы дают желтый осадок: R-С≡СН + [Ag(NH3)2]OH → R-С≡СAg↓ + 2NH3 + H2O Алкины, у который при тройной связи нет атомов водорода в такую реакцию не вступают |
|
|
Водный раствор аммиачных комплексов одновалентной меди Cu(I), например, аммиачный раствор оксида меди (I) [Cu(NH3)2]OH |
Алкины с тройной связью на конце молекулы дают красный осадок : R-С≡СН + [Cu(NH3)2]OH → R-С≡СCu↓ + 2NH3 + H2O Алкины, у которых при тройной связи нет атомов водорода в такую реакцию не вступают, что позволяет отличить их друг от друга |
|
| Бензол | Нитрующая смесь – смесь конц. азотной и серной кислот |
Образование желтой жидкости с запахом горького миндаля на дне реакционной смеси |
| Гомологи бензола | Нейтральный водный раствор KMnO4 |
При кипячении с каким-либо гомологом бензола водный раствор перманганата калия обесцвечивается и выпадает бурый осадок оксида марганца (IV). На примере с толуолом и этилбензолом реакции выглядят следующим образом: C6H5CH3 +2KMnO4 = C6H5COOK + 2MnO2↓ + KOH + H2O (при кипячении) C6H5CH2CH3 + 4KMnO4 = C6H5COOK + K2CO3 + 2H2O + 4MnO2↓ + KOH (при нагревании) |
| Подкисленный водный раствор перманганата калия KMnO4(водн.), H+ |
Постепенное обесцвечивание подкисленного раствора KMnO4. Выпадения бурого осадка MnO2 не наблюдается, поскольку марганец восстанавливается до практически бесцветной соли двухвалентного марганца. Чаще всего в качестве подкислителя изпользуют серную кислоту. На примере с толуолом реакция выглядит следующим образом: 5C6H5CH3 + 6KMnO4 + 9H2SO4 → 5C6H5COOH + 6MnSO4 + 3K2SO4 +14H2O |
|
| Фенол | Бромная вода |
Исчезновение желто-коричневой окраски бромной воды с одновременным выпадением белого осадка трибромфенола: |
|
Разбавленный водный раствор соли железа (III), например, FeCl3 |
Светло-желтая окраска разбавленного раствора соли трехвалентного железа сменяется на фиолетовую | |
| Анилин | Бромная вода |
Исчезновение желто-коричневой окраски бромной воды с одновременным выпадением белого осадка триброманилина: |
|
Одноатомные первичные и вторичные спирты CH3OH, C2H5OH, (CH3)2CH-OH и т.д. |
Оксид меди (II) CuO |
Черный CuO при нагревании со спиртом изменяет свою окраску на красную в связи с восстановлением до Cu0. Первичный спирт при этом превращается в альдегид: R-CH2-OH + CuO =to=> R-CHO + Cu + H2O, вторичный — в кетон: R-C(OH)-R’+ CuO =to=> R-C(O)-R’ + Cu + H2O, В случае метанола появляется легко узнаваемый запах формальдегида (естественно, чтобы он был узнаваемым, нужно до этого быть знакомым с его запахом:-) ) В случае реакции с CuO этилового спирта чувствуется специфический запах ацетальдегида, схожий с ароматом прелых яблок сорта «антоновка» |
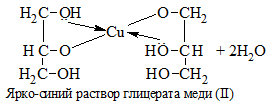
| Многоатомные спирты | Свежеосажденный Cu(OH)2 (II) |
Растворение голубого осадка Cu(OH)2 с образование ярко-синего раствора комплексного соединения меди. На примере с глицерином уравнение реакции выглядит следующим образом: |
|
Альдегиды, —CHO |
Аммиачный раствор оксида серебра [Ag(NH3)2]OH |
Так называемая реакция серебряного зеркала. В результате восстановления Ag+1 в металлическое серебро Ag0 на стенках сосуда образуется зеркало. При небрежном смешении реагентов или в недостаточно чистом сосуде вместо серебряного зеркала может образоваться черный осадок, состоящий из мелкодисперсных частиц металлического серебра. В обоих случаях наблюдаемые явления описываются уравнением в общем виде: R-CHO + 2[Ag(NH3)2]OH = R-СООNH4 + 2Ag↓ + 3NH3↑ + H2O |
|
Свежеосажденный Cu(OH)2 |
Образование оранжево-красного осадка Cu2O при нагревании в результате реакции: R-CHO + 2Cu(OH)2 = R-COOH + Cu2O↓ + 2H2O |
|
|
Карбоновые кислоты, -COOH |
Лакмус | Окрашивание лакмуса в красный цвет |
| Карбонаты, например, K2CO3 |
Выделение углекислого газа в результате разложения образующейся нестойкой угольной кислоты H2CO3: 2R-COOH + CO32- → CO2 + H2O + R-COO— |
|
| Спирт + конц. H2SO4 |
Появление запаха сложного эфира, образующегося в результате реакции: R-COOH + R’-OH → R-COO-R’ + H2O Запахи эфиров весьма разнообразны, но общим является ярко выраженная пахучесть, нередко, могут напоминать ароматы различных фруктов. |
|
|
Муравиная кислота -СНО и -СООН |
Лакмус |
Окрашивание лакмуса в красный цвет, по причине кислой среды, создаваемой муравьиной кислотой: HCOOH ↔ HCOO— + H+ |
|
Аммиачный раствор оксида серебра [Ag(NH3)2]OH |
Молекуле муравьиной кислоты, не смотря на ее малый размер удается сочетать в себе помимо карбоксильной группы также и карбонильную, которая позволяет вступать муравьиной кислоте в реакцию серебряного зеркала подобно альдегидам: HCOOH + 2[Ag(NH3)2]OH → 2Ag↓ + 4NH3↑ + CO2↑ + 2H2O |
|
|
Растворимые соли жирных карб. кислот, например, стеарат натрия CH3(CH2)16COONa (мыло) |
Любая сильная неорганическая кислота или кислота средней силы H2SO4 (разб.) HCl HI HBr HNO3 (разб.) H3PO4 |
Выпадение хлопьевидного белого осадка малорастворимой жирной кислоты: CH3(CH2)16COONa + H+ → Na+ + CH3(CH2)16COOH |
| Раствор соли Ca или Mg |
Выпадение белого осадка нерастворимой кальциевой или магниевой соли жирной кислоты. Ионное уравнение в общем виде: 2R-COO— + Ca2+ → (R-COO)2Ca↓, где R-длинный углеводородный радикал. На примере, стеарата натрия и хлорида кальция молекулярное уравнение реакции выглядит так: 2CH3(CH2)16COONa + CaCl2 → (CH3(CH2)16COONa)2Ca↓ |
|
| Фенолфталеин |
Окрашивание фенолфталеина в малиновый цвет как в щелочах, ввиду того, что соли жирных кислот гидролизуются по аниону: CH3(CH2)16COO— + H2O → CH3(CH2)16COOH + OH— |
|
|
Олеиновая кислота, -COOH; >C=C< |
Водный раствор KMnO4(водн.) |
Наблюдают исчезновение фиолетовой окраски KMnO4 и образование хлопьевидного осадка оксида марганца бурого цвета MnO2 3>C=C< + 2KMnO4 + 4H2O → 3>C(OH)-C(OH)< + 2MnO2↓ + 2KOH |
| Раствор Br2 в орг. растворителе или воде (бромная вода) |
Исчезает желто-коричневая окраска раствора брома из-за протекания реакции (указан структурный фрагмент молекулы олеиновой кислоты): >C=C< + Br2 → C(Br)=C(Br)< |
|
| Раствор щелочи, например, NaOH |
Олеиновая кислота, будучи практически нерастворимой в воде жирной кислотой, растворяется в водных растворах щелочей: C17H33COOH + NaOH → C17H33COONa + H2O |
|
|
Глюкоза, -CHO -C(OH)-C(OH)- |
Аммиачный раствор оксида серебра [Ag(NH3)2]OH |
Глюкоза относится к так называемым альдегидоспиртам, т.к. ее молекулы содержат альдегидную группу и 5 гидроксильных групп. Поэтому она вступает в реакцию «серебряного зеркала» |
|
Свежеосажденный Cu(OH)2 |
Если раствор глюкозы прибавить к свежеосажденному гидроксиду меди без нагревания наблюдается растворение осада гидроксида меди и образование синего раствора. В этом случае глюкоза реагирует как многоатомный спирт — с образованием растворимых комплексов меди. Если же полученный синий раствор нагреть, выпадает оранжево-красный осадок одновалентного оксида меди Cu2O. При этом глюкоза реагирует как альдегид — альдегидная группа молекулы глюкозы окисляется до карбоксильной — образуется глюконовая кислота. | |
| Крахмал |
Йод, I2 |
Появление синей окраски |
| Белок |
концентрированная азотная кислота НNО3(конц.) |
Ксантопротеиновая реакция Появление ярко-желтого окрашивания по причине нитрования бензольных колец молекул белка |
|
Свежеосажденный Cu(OH)2 |
Появляется сине-фиолетовое окрашивание раствора в следствие образование комплексов меди (II) с белком |
Качественные реакции органических соединений
Таблица. Качественные реакции на органические вещества
| Органическое вещество | Реактив | Наблюдаемая реакция |
| Алкены, алкины, алкадиены
(этилен, ацетилен, дивинил и др.) |
Бромная вода, Br2 (р-р) | Обесцвечивание раствора (видеоопыт реакция этилена с бромной водой, ацетилен с бромной) |
| Алкены, алкины, алкадиены
(этилен, ацетилен, дивинил и др.) |
Перманганат калия KMnO4 | Обесцвечивание раствора (видеоопыт) |
| Алкины с тройной связью на конце цепи
(ацетилен С2Н2, пропин и др.) |
Аммиачный раствор оксида серебра, [Ag(NH3)2]OH | Выпадение осадка соли серебра (видеоопыт) |
| Многоатомные спирты (этиленгликоль, глицерин и др.) | Свежеосажденный гидроксид меди (II) Сu(OH)2 | Образование ярко-синего раствора комплекса (видеоопыт) |
| Фенолы
(С6Н5ОН — фенол и др.) |
Бромная вода, Br2 (р-р) | Выпадение белого осадка |
| Раствор хлорида железа (III) FeCl3 | Образование фиолетового раствора | |
| Альдегиды
(СН2О — муравьиный альдегид и др.) + муравьиная кислота НСООН + глюкоза (и другие углеводы-альдозы) + восстанавливающие дисахариды (мальтоза, лактоза, целлобиоза) |
Свежеосажденный гидроксид меди (II) Сu(OH)2 при нагревании | Образование красного осадка Cu2O |
| Аммиачный раствор оксида серебра, [Ag(NH3)2]OH при нагревании | Выпадение осадка металлического серебра (реакция серебряного зеркала) | |
| Карбоновые кислоты
(уксусная кислота CH3СООН и др.) |
Гидрокарбонат натрия (сода) NaHCO3 | Выделение бесцветного газа СО2 |
| Анилин | Бромная вода, Br2 (р-р) | Выпадение белого осадка 2,4,6-триброманилина |
| Аминокислоты (содержащие ароматическое кольцо) | Азотная кислота, HNO3 | Желтое окрашивание |
| Белки | Азотная кислота, HNO3 | Желтое окрашивание (ксантопротеиновая реакция) |
| Свежеосажденный гидроксид меди (II) Сu(OH)2 | Образование фиолетового раствора (биуретовая реакция) | |
| Крахмал | Раствор йода, I2 (р-р) | Синее окрашивание |
| Первичные амины
(CH3NH2 метиламин и др.) |
Азотистая кислота HNO2 | Выделение бесцветного газ, не поддерживающего горение (азот) |
| Вторичные амины
((CH3)2NH диметиламин и др.) |
Азотистая кислота HNO2 | Желтое окрашивание |
Качественные реакции на неорганические вещества и ионы
Теория к заданию 24 из ЕГЭ по химии
Разбор сложных заданий в тг-канале:
Качественные реакции на катионы и анионы некоторых неорганических веществ
Качественные реакции на анионы.
| Анион | Условие, реактив, катион | Признаки и сокращенное ионное уравнение реакции |
| $Cl^{-}$ | Нитрат серебра $Ag^{+}$ | Белый творожистый осадок:$Ag^{+}+Cl^{-}→AgCl↓$ |
| $Br^{-}$ | Нитрат серебра $Ag^{+}$ | Желтоватый творожистый осадок: $Ag^{+}+Br^{-}→AgBr↓$ |
| $I^{-}$ | Нитрат серебра $Ag^{+}$ | Желтый творожистый осадок: $Ag^{+}+I^{–}→AgI↓$ |
| $SO_4^{2-}$ | Растворимые соли бария $Ba^{2+}$ | Белый осадок: $Ba^{2+}+SO_4^{2-}→BaSO_4↓$ |
| $NO_3^{-}$ | $H_2SO_4(конц)$ и $Cu$ | Выделение бурого газа: $Cu+NO_3^{-}+2H^{+}=Cu^{2+}+NO_2↑+H_2O$ |
| $PO_4^{3-}$ | Нитрат серебра $Ag^{+} | Ярко-желтый осадок:$3Ag^{+}+PO_4^{3-}→Ag_3PO_4↓$ |
| $CrO_4^{2-}$ | Растворимые соли бария $Ba^{2+}$ | Желтый осадок: $Ba^{2+}+CrO_4^{2-}=BaCrO_4↓$ |
| $S^{2-}$ | Растворимые соли меди $Cu^{2+}$ | Черный осадок: $Cu^{2+}+S^{2–}=CuS↓$ |
| $CO_3^{2-}$ | Кислоты $H^{+}$ | Выделение газа без запаха: $2H^{+}+CO_3^{2-}=H_2O+CO_2↑$ |
| $OH^{-}$ | Лакмус | Синий цвет раствора |
| Фенолфталеин | Малиновый цвет раствора | |
| Метиловый оранжевый | Желтый цвет раствора |
Качественные реакции на катионы.
| Катион | Условие, реактив, анион | Признаки, сокращенное ионное уравнение реакции |
| $H^{+}$ | Лакмус | Красный цвет раствора |
| Метиловый оранжевый | Розовый цвет раствора | |
| $NH_4^{+}$ | Щелочь, $OH^{–}$, $t°$ | Выделение газа с резким запахом: $NH_4^{+}+OH^{-}=NH_3↑+H_2O$ |
| $Ag^{+}$ | Соляная кислота, растворы хлоридов, $Cl^{–} | Белый творожистый осадок: $Ag^{+}+Cl^{–}→AgCl↓$ |
| $Li^{+}$ | Пламя | Красное окрашивание |
| $Na^{+}$ | Пламя | Желтое окрашивание |
| $K^{+}$ | Пламя | Фиолетовое окрашивание |
| $Ca^{2+}$ | Пламя | Кирпично-красное окрашивание |
| Растворы карбонатов, $CO_3^{2−}$ | Белый осадок: $Ca^{2+}+CO_3^{2-}→CaCO_3↓$ | |
| $Ba^{2+}$ | Пламя | Желто-зеленое окрашивание |
| Серная кислота, растворы сульфатов, $SO_4^{2−}$ | Белый (мелкокристаллический) осадок: $Ba^{2+}+SO_4^{2-}→BaSO_4↓$ | |
| $Cu^{2+}$ | Пламя | Зеленое окрашивание |
| Вода | Гидратированные ионы $Cu^{2+}$ имеют голубую окраску | |
| Щелочь, $OH^{–}$ | Синий осадок: $Cu^{2+}+2OH^{-}=Cu(OH)_2↓$ | |
| $Fe^{2+}$ | Щелочь, $OH^{–}$ | Зеленоватый осадок: $Fe^{2+}+2OH^{–}=Fe(OH)_2↓$ |
| Красная кровяная соль $K_3[Fe(CN)_6], Fe(CN)_6^{3−}$ | Синий осадок (турнбулева синь): $3Fe^{2+}+2[Fe(CN)_6]^{3-}=Fe_3[Fe(CN)_6]_2↓$ | |
| $Fe^{3+}$ | Щелочь, $OH^{–}$ | Бурый осадок: $Fe^{3+}+3OH^{–}=Fe(OH)_3↓$ |
| Роданид аммония $NH_4SCN, SCN^{–}$ | Кроваво-красный осадок: $3Fe^{3+}+3CNS^{-}⇄Fe(SCN)_3↓$ | |
| $Fe^{3+}$ | Желтая кровяная соль $K_4[Fe(CN)_6]$ | Темно-синий осадок (берлинская лазурь): $4Fe^{3+}+3[Fe(CN)_6]^{4–}=Fe_4[(CN)_6]_3↓$ |
| $Al^{3+}$ | Щелочь, $OH^{–}$ | Желеобразный осадок белого цвета, растворяется в избытке раствора щелочи: $Al^{3+}+3OH^{–}=Al(OH)_3↓$ |
Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВА
А) пропанон и пропанол-2
Б) анилин и триэтиламин
В) пентин-2 и этилацетат
Г) бензол и гексен-2
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Демонстрационная версия ЕГЭ—2014 по химии
2
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВА
А) Бензол и гексен
Б) Бутин–1 и бутин–2
В) Глюкоза и сорбит
Г) Пропионовая кислота и пропанол
РЕАКТИВ
1) Бромная вода
2) Фенолфталеин
3) Соляная кислота
4) Раствор карбоната натрия
5) Аммиачный раствор оксида серебра
Запишите в ответ цифры, расположив их в порядке, соответствующим буквам:
Источник: Задание Яндекса
3
Установите соответствие между признаками качественной химической реакции и веществами, которые дают эту реакцию: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПРИЗНАКИ РЕАКЦИИ
А) Исчезновение окраски раствора и выпадение белого осадка
Б) Исчезновение окраски раствора и выпадение бурого осадка
В) Обесцвечивание раствора без выпадения осадка
Г) Образование раствора с интенсивной синей окраской
ВЕЩЕСТВА
1) Водный раствор перманганата калия и этилен
2) Фенол и бромная вода
3) Раствор лакмуса и уксусная кислота
4) Пропен и бромная вода
5) Этиленгликоль и гидроксид меди (II)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Задание Яндекса
4
Установите соответствие между веществом и качественной реакцией на вещества этого класса: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВА
А) Ацетальдегид
Б) Сорбит
В) Фенол
Г) Ацетилен
КАЧЕСТВЕННЫЕ РЕАКЦИИ
1) Фиолетовое окрашивание раствора хлорида железа (III)
2) Белый осадок с аммиачным раствором оксида серебра
3) Образование фиолетового раствора с гидроксидом меди (II)
4) Образование раствора с интенсивной синей окраской с гидроксидом меди (II)
5) Реакция «серебряного зеркала»
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Задание Яндекса
5
Установите соответствие между веществами, которые необходимо различить, и реактивом, с помощью которого можно это сделать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВА
А) Бутен–1 и бутан
Б) Растворы глицерина и пропанола
В) Растворы глюкозы и этаналя
Г) Уксусная и муравьиная кислоты
РЕАКТИВ
1) Бромная вода
2) Фенолфталеин
3) Гидроксид меди (II)
4) Раствор карбоната натрия
5) Аммиачный раствор оксида серебра
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Задание Яндекса
Пройти тестирование по этим заданиям
Задание 25. Качественные реакции (подробно)
1. Как распознать алкены и стирол (в случае стирола в реакции вступает только двойная связь боковой цепи, а не бензольное кольцо)
1) + Br2 (бромная вода) → обесцвечивание раствора (реакция протекает в обычных условиях)
CH2=CH2 + Br2 → CH2Br-CH2Br
2) + KMnO4 (водный раствор) → обесцвечивание раствора, образование осадка MnO2 бурого цвета:
Раствор перманганат калия фиолетового цвета. В результате реакции окраска исчезает, образуется осадок MnO2 бурого цвета.
2. Как распознать алкины
1) + Br2 (бромная вода) → обесцвечивание раствора (реакция протекает в обычных условиях):
C2H2 + 2Br2 → CHBr2-CHBr2
2) + KMnO4 (водный раствор) → обесцвечивание раствора, образование осадка MnO2 бурого цвета:
3C2H2 + 8KMnO4 → 3K2C2O4 + 8MnO2 + 2KOH + 2H2O (K2C2O4 — соль щавелевой кислоты)
3) + [Ag(NH3)2]OH → выпадение осадка в случае концевой тройной связи:
4) + Металл → выпадение осадка и выделение водорода в случае концевой тройной связи
3. Как распознать бензол
1) Бензол горит коптящим пламенем из-за большого содержания углерода.
Благодаря устойчивой ароматической системе бензол не вступает в реакции с водным раствором Br2 и раствором KMnO4.
4. Как распознать одноатомные спирты
1) + CuO → наблюдаем выделение металлической меди:
CH3-CH2-OH + CuO → CH3-CHO + Cu + H2O (t, окисление спиртов до альдегидов)
2) + Na → наблюдаем выделение газа:
2C2H5-OH + 2Na → 2C2H5-ONa + H2
С основаниями одноатомные спирты не взаимодействуют.
5. Как распознать многоатомные спирты
1) + Cu(OH)2 → растворение голубого осадка и появление ярко-синей окраски раствора:
С щелочами многоатомные спирты не взаимодействуют.
6. Как распознать фенолы
1) + Br2 → выпадение белого осадка 2,4,6-трибромфенола
2) + FeCl3 → раствор фиолетового цвета
7. Как распознать альдегиды
1) + [Ag(NH3)2]OH → восстановление металлического серебра
2) + Cu(OH)2 → выпадение осадка Cu2O кирпично-красного цвета
8. Как распознать карбоновые кислоты
1) раствор лакмуса → изменение окраски на красную
2) + Na2CO3/NaHCO3 → выделение газа CO2
9. Как распознать соли высших карбоновых кислот
1) + HCl (любая сильная кислота) → появление хлопьев нерастворимых высших кислот
10. Как отличить муравьиную кислоту от уксусной
Муравьиная кислота содержит и альдегидную группу тоже, следовательно, возможны реакции, характерные альдегидам:
1) + [Ag(NH3)2]OH → восстановление металлического серебра и выделение газа (так как кислота окисляется до CO2)
2) + Cu(OH)2 → выпадение осадка Cu2O кирпично-красного цвета и выделение газа (так как кислота окисляется до CO2).
11. Как распознать низшие амины
1) раствор лакмуса → изменение окраски на синюю (так как среда раствора щелочная)
1) раствор фенолфталеина → изменение окраски на малиновую
12. Как распознать анилин
1) + Br2 → выпадение белого осадка 2,4,6-триброманилина
13. Как распознать белок
1) + HNO3 → желтое окрашивание (ксантопротеиновая реакция)
2) + Cu(OH)2 → фиолетовое окрашивание (биуретовая реакция)
14. Как распознать глюкозу C6H12O6
1) + Cu(OH)2 → растворение голубого осадка и появление ярко-синей окраски раствора (реакция на несколько гидроксильных групп)
2) + Cu(OH)2 → при нагревании образуется осадок Cu2O красного цвета (реакция на альдегидную группу)
3) + [Ag(NH3)2]OH → восстановление металлического серебра
15. Как распознать крахмал
1) + I2 → появление синей окраски.
Качественные реакции органических соединений
Вещество, функциональная группа
Реактив
Схема реакции
Характерные признаки
Алкены (двойная связь)
р-р KMnO4+ Н2О
СН2=СН2 + Н2О + KMnO4→ КОН + MnO2↓+ СН2 (ОН)-СН2 (ОН)
обесцвечивание р-ра
р-р Br2 (бромная вода)
СН2=СН2 + Br2 → СН2 (Br)-СН2(Br)
обесцвечивание р-ра
Диены
(две двойные связи)
р-р KMnO4+ Н2О
3СН2=СН — СН=СН2 +8 Н2О + 4KMnO4 → 4КОН + 4MnO2↓ + 3(ОН) СН2-СН(ОН)-СН (ОН)-СН2(ОН)
обесцвечивание р-ра
р-р Br2 (бромная вода)
СН2=СН-СН=СН2 + Br2 →СН2(Br)-СН(Br)СН=СН2
обесцвечивание р-ра
Алкины
(тройная связь)
р-р KMnO4+ Н2О
СН≡СН + Н2О + KMnO4 → КОН + MnO2↓ +
НООС-СООН
обесцвечивание р-ра
р-р Br2 (бромная вода)
СН≡СН + Br2 → (Br)-СН2=СН2-(Br)
обесцвечивание р-ра
Аммиачный р-р Ag2O (Терминальные алкины)
СН≡СН + [Ag(NH3) 2]OH → AgC≡CAg↓ + NH3↑ + H2O
образование осадка желтого цвета (взрывоопасен)
K, Na (Терминальные алкины)
2СН≡СН + 2Na → 2СН≡СNa + Н2
Выделение газа Н2
Спирты
(гидроксильная группа)
р-р FeCl3
(светло-желтый) (Фенол)
6С6H5OH + FeCl3→Н3 [(C6H5O)6Fe] +3HCl
Окрашивание р-ра в фиолетовый цвет
р-р Br2 (бромная вода)
C6H5OH + 3Br2 → C6H2Br3OH↓ + 3HBr
образование белого осадка со специфическим запахом
CuO (прокаленная медная проволока)
C2H5OH + CuO → Cu↓ + CH3CHO + H2O
выделение металлической меди, специфический запах ацетальдегида
K, Na
C2H5OH + Na → C2H5ONa + Н2
Выделение газа Н2
Многоатомные спирты
(две или более гидроксильных групп)
Свежеосажденный Cu(OH)2 в сильно щелочной среде
ярко-синее окрашивание р-ра
Белок
НNO3 (конц.) t, °С
ксантопротеиновая реакция (происходит нитрование бензольных колец в молекуле белка)
без нагревания – появляется желтое окрашивание р-ра; при нагревании и добавлении раствора аммиака белок окрашивается в желтый цвет
Свежеосажденный Сu(OH)2
биуретовая реакция (образуется комплексное соединение)
сине-фиолетовое окрашивание р-ра
Альдегиды
(карбонильная группа)
р-р KMnO4+ Н2О
3 HCOOH + 2 KMnO4 → CO2 + 2 H2O + 2 KHCO3 + 2 MnO2↓
обесцвечивание р-ра
р-р Br2 (бромная вода)
+ Br2 + H2O →
+ 2HBr
обесцвечивание р-ра
Свежеосажденный Сu(OH)2
+ 2 Сu(OH)2 →
+ Cu2O↓ + 2H2O
образование красного осадка Сu2O
Аммиачный р-р Ag2O
-CHO+ 2 [Ag(NH3)2]OH → 2 Ag↓ + -COONH4 + 3NH3 +H2O
«серебряное зеркало» на стенках сосуда
Кислоты
(карбоксильная группа)
NaHCO3 , Na2CO3
2CH3COOH + Na2CO3 → 2CH3COONa + CO2 + H2O
Выделение газа CO2
K, Na
2CH3COOH + 2Na → 2CH3COONa + H2
Выделение газа Н2
Муравьиная кислота
Свежеосажденный Сu(OH)2
HCOOH + Cu(OH)2 → Cu2O↓ + H2O + CO2↑
образование красного осадка Сu2O
р-р Br2 (бромная вода)
HCOOH + Br2 → CO2 + 2HBr
обесцвечивание р-ра
р-р KMnO4+ Н2О
3 HCOOH + 2 KMnO4 → CO2 + 2 H2O + 2 KHCO3 + 2 MnO2↓
обесцвечивание р-ра
аммиачныйр-р Ag2O
HCOOH + 2[Ag(NH3)2]OH → 2Ag↓ + 2H2O + CO2↑+ 4NH3
«серебряное зеркало» на стенках сосуда
Амины
(аминогруппа)
Первичная алифатическая аминогруппаNH2 , HNO2
CH3NH2 + HNO2 → CH3OH + N2 +H2O
Выделение газа N2
р-р Br2 (бромная вода) (Анилин)
C6H5NH2 + 3Br2 → C6H2Br3 NH2↓ + 3HBr
образование белого осадка со специфическим запахом
Углеводы
Аммиачный р-р Ag2O
С5Н11О5CHO+ 2 [Ag(NH3)2]OH → 2 Ag↓ + С5Н11О5COONH4 + 3NH3 +H2O
«серебряное зеркало» на стенках сосуда
Свежеосажденный Сu(OH)2
+ 2 Сu(OH)2 →
+ Cu2O↓ + 2H2O
образование красного осадка Сu2O
р-р Br2 (бромная вода)
+ Br2 + H2O →
+ 2HBr
обесцвечивание р-ра
Свежеосажденный Сu(OH)2
сине-фиолетовое окрашивание р-ра
Качественные реакции органической химии
09-Дек-2012 | комментариев 10 | Лолита Окольнова
Качественные реакции органической химии
В качественном анализе используют легко выполнимые, характерные химические реакции, при которых наблюдается появление или исчезновение окрашивания, выделение или растворение осадка, образование газа и др. Реакции должны быть как можно более селективны и высокочувствительны.
Это означает, что качественные реакции — это реакции с ощутимым эффектом -цвет, запах, изменение состояния вещества. «Селективность» — означает, что желательно, чтобы такая реакция на данный класс веществ или на данное вещество была уникальна. Высокая чувствительность — даже очень небольшое количество вещества должно проявляться в такой реакции.
С уникальностью в органической химии немного проблематично, но тем не менее, есть достаточно много реакций для определения того или иного вещества.
Итак, классы органических соединений и соответствующие им качественные реакции:
| Класс органических соединений | Качественные реакции |
| Алканы | У алканов нет качественных реакций. Их определяют методом исключения |
| Алкены | 1. Обесцвечивание бромной воды: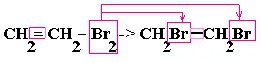 2. Изменение окраски раствора 2. Изменение окраски раствора
перманганата калия: 3СH2=CH2 + 2KMnO4 + 4H2O → 3C2H4(OH)2 + 2MnO2 + 2KOH |
| Циклоалканы | Обесцвечивание бромной воды: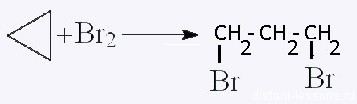 |
| Алкины | 1. Обесцвечивание бромной воды, 2. Образование ацетиленидов серебра и меди: 
3. Изменение окраски перманганата калия: (KMnO4 → MnO2) C2H2 → HOOC-COOH |
| Алкадиены | Т.к. алкадиены содержат 2 двойные связи, то они так же как и алкены, обесцвечивают бромную воду |
| Арены | 1. Взаимодействие с бромом (в присутствии катализатора)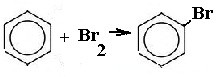
|
| Спирты | Реакция с оксидом меди — в осадок выпадает медь: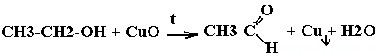 |
| Многоатомные спирты | С гидрокисдом меди (II) — Cu(OH)2 образуется комплекс синего цвета |
| Альдегиды |
Реакция «серебряного зеркала» и реакция «медного зеркала»: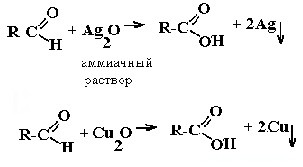 |
| Кислоты органические | Дают окрашенные соли тяжелых металлов — см. таблицу растворимости |
| Амины | Качественных реакций нет (только анилин — имеет характерный запах) |
Как вы видите, все вещества, имеющие кратные связи (кратные=двойные и тройные), обесцвечивают бромную воду. Многие из них изменяют окраску раствора перманганата калия. Поэтому эти вещества надо разделять по их индивидуальным, характерным только для них качественным реакциям.
Здесь перечислены самые основные качественные реакции органической химии. Если говорить о высокомолекулярных соединениях — белках, жирах, углеводах, то для них качественные реакции определяются функциональными группами, входящими в состав. Зная функциональную группу, вы легко сможете подобрать реактив, т.к. в таблице они разобраны именно по классам.
- в ЕГЭ это вопрос B6— Качественные реакции органических соединений
Обсуждение: «Качественные реакции органической химии»
(Правила комментирования)