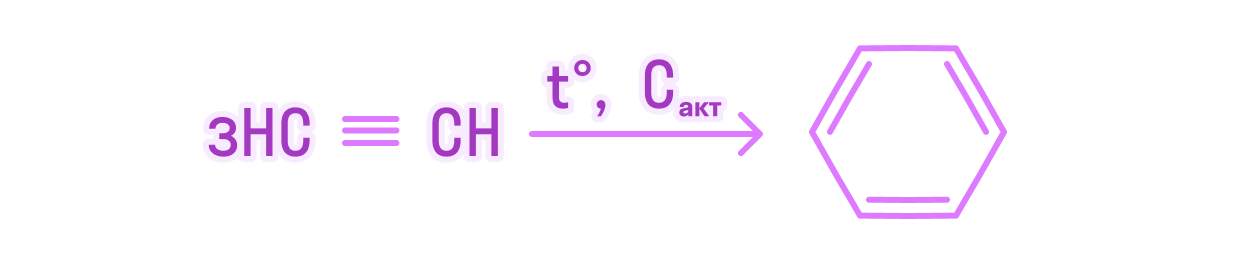Ниже приведен подробный разбор демоверсии ЕГЭ-2023 по химии, проектная версия. Задания разобраны от 1 до 34 подряд, приведена логика рассуждения по каждому из них. Если есть желание разобраться более детально, то переходите по ссылкам в тексте или записывайтесь к нам на курс.
Для выполнения первого задания всегда рекомендую расписать электронно-графические формулы элементов (с ячейками). В большинстве случаев достаточно изобразить внешний и предвнешний уровень. Напомню также, что для элементов дальше IV периода не нужно изображать формулу целиком, а можно воспользоваться аналогией строения валентных подуровней с соседом из подгруппы. По приведенным элементам:
- Цезий находится в первой группе, главной подгруппе, аналог натрия по строению внешнего уровня. Имеет 1 электрон на 6s-подуровне, он же является неспаренным.
- Углерод находится в четвертой группе, главной подгруппе. На внешнем уровне имеет 4 электрона, из них неспаренных два, которые находятся на 2р-подуровне.
- Кислород находится в шестой группе, главной подгруппе. На внешнем уровне имеет 6 электронов, из них неспаренных два, которые находятся на 2р-подуровне.
- Хром находится в шестой группе, побочной подгруппе. Необходимо вспомнить о проскоке электрона, за счет которого на внешнем уровне, 4s-подуровне, имеет 1 электрон, а не предвнешнем, 3d-подуровне, – пять. Итого 6 неспаренных.
- Азот находится в пятой группе, главной подгруппе. На внешнем уровне имеет 5 электронов, из них неспаренных три, которые находятся на 2р-подуровне.
Выбираем углерод и кислород, у обоих по два неспаренных электрона.
Ответ: 23
Необходимо вспомнить, что к р-элементам можно отнести элементы главных подгрупп шести последних групп в периоде. Представители первых двух относятся к s-элементам, а элементы побочных подгрупп относим к d-элементам. Исходя из приведенных соображений, выбираем пункты 2), 3), 5).
Атомный радиус уменьшается направо по периоду, поэтому располагаем выбранные ранее элементы в порядке 2), 5), 3).
Ответ: 253
Для выполнения такого рода заданий рекомендую выписать на лист бумаги высшую и низшую степени окисления для каждого из элементов.
- Цезий имеет высшую степень окисления +1, низшую – 0. Разность 1.
- Углерод имеет высшую степень окисления +4, низшую – -4. Разность 8.
- Кислород имеет высшую степень окисления +2, низшую – -2. Разность 4.
- Хром имеет высшую степень окисления +6, низшую – 0. Разность 6.
- Азот имеет высшую степень окисления +5, низшую – -3. Разность 8.
Таким образом, выбираем углерод и азот.
Ответ: 25
В задании, по сути, есть два фильтра: по типу строения и по характеру связи. Начнем с типа строения. Поскольку необходимо выбрать вещества молекулярного строения, то сразу можно исключить соли и иные соединения, имеющие ионные связи. Убираем из рассмотрения пункты 1) и 4). Среди оставшихся нужно найти вещества с ковалентной полярной связью. Вспомним, что такая связь может возникать между атомами разных неметаллов (или сильно различающихся фрагментов в органических молекулах). По такому принципу можно исключить пункт 5). Остаются вещества 2) и 3).
Ответ: 23
К двухосновным кислотам относятся те из них, которые содержат в молекуле 2 атома водорода, способных замещаться на катионы металлов. Подобным требованиям отвечает сернистая кислота, пункт 4).
К средним можно отнести соли, не содержащие способных к замещению атомов водорода, фрагментов ОН, комплексных ионов и подобного. Из приведенного списка можно взять аммиачную селитру, тривиальное название нитрата аммония.
К амфотерным гидроксидам можно отнести гидроксиды металлов в степенях окисления +3 и +4, также гидроксиды бериллия, цинка, свинца, олова. Подойдет пункт 2).
Ответ: 482
Попробуем найти в приведенном списке сильные кислоты. Пункт 1) подходит, поскольку в пункте 3) находится слабая кислота. Таким образом X уже установлен.
Среди оставшихся пунктов нужно найти вещество, которое при добавлении вызовет растворение гидроксида алюминия. Поскольку гидроксид является амфотерным, то сможет прореагировать с кислотой, кроме наиболее слабых, или щелочью. Среди приведенных соединений можно взять 4), поскольку гидроксид калия является щелочью.
Ответ: 14
Для выполнения подобных заданий советую следующий порядок действий:
- Берем вещество из левого столбика
- Классифицируем его, вспоминаем характерные типы реакций для такого класса соединений
- Оцениваем его с точки зрения кислотно-основных и окислительно-восстановительных свойств
- Подбираем вещества и правого столбика, противоположные по свойствам и способные реагировать с веществом из правого столбика
Пункт А):
Сера относится к простым веществам-неметаллам, средняя по активности. Способна вступать в реакцию со щелочами, сильными окислителями и активными восстановителями. С водой и кислотами, кроме кислот-окислителей, реакции нет.
В пункте 1) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 2) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 3) водород выступит против серы в качестве восстановителя, хлор и кислород – окислители. Подходит.
В пункте 4) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 5) нет реакции уже с первым веществом, дальше не продолжаем.
Пункт Б):
Оксид серы (VI) относится к кислотным оксидам, реагирует с водой, большинством веществ основной и амфотерной природы. Восстановительных свойств не проявляет, может быть окислителем.
В пункте 1) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 2) оксид бария – основный, КОН – щелочь, с водой реакция тоже есть. Подходит.
В пункте 3) хлор и кислород – окислители, не подходит.
В пункте 4) нет реакции с уксусной кислотой, не подходит.
В пункте 5) нет реакции уже со вторым веществом, дальше не продолжаем.
Пункт В):
Гидроксид цинка относится к амфотерным гидроксидам, может реагировать со щелочами, кислотами. Выраженных окислительных или восстановительных свойств не проявляет. В воде нерастворим, с солями не обменивается.
В пункте 1) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 2) нет реакции с водой, не подходит.
В пункте 3) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 4) реагирует с кислотами и щелочью. Подходит.
В пункте 5) нет реакции с хлоридом бария, не подходит.
Пункт Г):
Бромид цинка относится к солям, может вступать в реакции обмена со щелочами и солями. Может проявлять восстановительные свойства за счет бромид-иона.
В пункте 1) обмен имеет смысл с первым и вторым веществам, с третьим будет ОВР. Подходит.
В пункте 2) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 3) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 4) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 5) нет реакции уже с первым веществом, дальше не продолжаем.
Ответ: 3241
Для ответа на вопрос имеет смысл оценить свойства веществ в каждой паре, а при необходимости записать уравнение реакции между ними. Сделаем и то, и другое.
В пункте А) магний является сильным восстановителем, а концентрированная серная кислота – окислителем. Магний способен восстановить серу до низшей степени окисления:
4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O
В пункте Б) встречаются основный оксид и кислота, произойдет обмен:
MgO + H2SO4 = MgSO4 + H2O
В пункте В) сера выступает в качестве восстановителя, а концентрированная серная кислота – окислитель. Произойдет ОВР:
S + 2H2SO4 = 3SO2 + 2H2O
В пункте Г) сероводород выступает в качестве восстановителя, а кислород – окислитель. Произойдет ОВР:
2H2S + 3O2 = 2SO2 + 2H2O
Ответ: 5144
Обратим внимание, что железо в одну стадию переходит в степень окисления +3. Для этого нам нужен сильный окислитель- хлор.
2Fe + 3Cl2 = 2FeCl3
Во второй реакции железо понижает степень окисления до +2, поэтому необходимо найти восстановитель. Им тут может быть только йодид калия.
2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl
Ответ: 43
Для установления соответствия имеет смысл найти в структурах из левого столбика характерные функциональные группы и фрагменты.
В структуре А) видим фрагмент -NH-, который можно отнести ко вторичному амину. Циклическая структура молекулы в данном случае ничего не значит.
В структуре Б) есть аминогруппа и карбоксильная группа. Соответственно, вещество можно отнести к аминокислотам.
В структуре В) есть структурный фрагмент -С(О)NH- и просматриваются два остатка от аминокислот, что указывает на дипептид.
Ответ: 231
К решению подобных заданий может быть несколько подходов. Можно для начала определить молекулярную формулу бутена-1, а затем сравнить ее с молекулярными формулами предложенных вариантов. Изомеры по определению должны иметь одинаковые молекулярные формулы.
Бутен-1 – С4Н8
- С4Н10
- С4Н8
- С4Н6
- С4Н6
- С4Н8
Ответ: 25
Поскольку подкисленный раствор перманганата проявляет сильные окислительные свойства, следует поискать вещества, которые могут окисляться с образованием карбоновой кислоты. Прокомментируем все предложенные пункты:
- Окисляется с разрывом кратной связи, кислота будет
- Не окисляется
- Окисляется по боковой цепи, кислота будет
- Не окисляется
- Окисляется до кислоты
Ответ: 135
Метиламин относится к первичным алифатическим аминам, проявляет выраженные основные свойства, вступает в реакции алкилирования, реагирует с азотистой кислотой. Прокомментируем все предложенные пункты:
- Алкан, низкая активность, реакции нет
- Хлоралкан, реакция алкилирования, реагирует
- Водород, гидрировать нечего, не реагирует
- Основание, не реагирует
- Кислота, образование соли, реагирует
Ответ: 25
Для решения имеет смысл записать классы соединений из левого столбика, далее оценить происходящие изменения:
А) 1,2-дигалогеналкан – алкен
Б) моногалогеналкан – алкен
В) моногалогеналкан – алкан
Г) 1,2-дигалогеналкан – алкин
По изменениям назвать тип происходящей реакции и подобрать к ней подходящий реагент:
А) дегалогенирование, магний
Б) дегидрогалогенирование, спиртовой раствор щелочи
В) реакция Вюрца, натрий
Г) дегидрогалогенирование, спиртовой раствор щелочи
Ответ: 1252
Для надежности перед выбором ответа имеет смысл преобразовать названия веществ в формулы и прописать предложенные реакции. Попробуем это сделать:
А) 2CH3COOH + Na2S = 2CH3COONa + H2S
Б) HCOOH + NaOH = HCOONa + H2O
В) HCOH + 4Cu(OH)2 = 2Cu2O + CO2 + 5H2O
Г) 2CH3CH2OH + 2Na = 2CH3CH2ONa + H2
Ответ: 5462
При рассмотрении цепочек превращений бывает полезно посмотреть через одну стадию и оценить, как можно осуществить такое превращение. Также очень полезно сравнить число атомов углерода в исходной молекуле и продукте, может навести на мысль.
В первых двух реакциях цепочки число атомов углерода удваивается, что наводит на мысль о реакции Вюрца. Если рассуждение верное, то веществом Х должен быть галогеналкан. Действительно, его можно получить в одну стадию из спирта, а затем превратить в алкан.
Следующее превращение можно понять, если посмотреть на условия реакции. Нагревание линейного алкана в присутствии хлорида алюминия приводит к его изомеризации в разветвленный алкан.
Ответ: 54
Для решения можно переписать вещества в парах в виде формул, оценить их окислительно-восстановительные свойства и возможность реакции между ними:
- K2S – восстановитель, KMnO4 – окислитель, имеет смысл
- H2SO4 – окислитель, NaCl – очень слабый восстановитель, не ОВР
- NH4Cl – очень слабый восстановитель, NaNO2 – окислитель, специфический случай обмена, сопровождаемого ОВР
- SiO2 – выраженных окислительно-восстановительных свойств не проявляет, Na2CO3 — выраженных окислительно-восстановительных свойств не проявляет, не ОВР
- HI – восстановитель, Na2Cr2O7 – сильный окислитель, имеет смысл
Для надежности можно записать уравнения реакций между ними:
- 2KMnO4 + 3K2S + 4H2O = 2MnO2 + 3S + 8KOH
- NaCl + H2SO4 = NaHSO4 + HCl
- NaNO2 + NH4Cl = NaCl + N2 + 2H2O
- Na2CO3 + SiO2 = Na2SiO3 + CO2
- Na2Cr2O7 + 14HI = 2NaI + 2CrI3 + 3I2 + 7H2O
Ответ: 135
Изменение давления не будет влиять на скорость реакций, в которых нет газообразных реагентов. Среди приведенных пунктов это будут 2), 3), 5).
Ответ: 235
Для решения подобных заданий нужно расставить степени окисления на атомах азота до и после реакции.
Если степень не меняется, то азот не проявляет окислительно-восстановительных свойств. Так будет в пункте А) (переход -3 в -3).
Если степень увеличится, то азот проявляет восстановительные свойства. Так будет в пунктах Б) (переход -3 в 0) и В) (переход -3 в +2).
Ответ: 422
В первом случае для решения необходимо вспомнить зависимость продуктов электролиза от состава соли:
А) соль образована катионом активного металла и кислородсодержащим анионом, на электродах выделятся водород и кислород.
Б) соль образована катионом активного металла и галогенид-ионом, на электродах выделятся водород и галоген.
В) соль образована катионом малоактивного металла и галогенид-ионом, на электродах выделятся металл и галоген.
Ответ: 342
Во втором случае нужно помнить, что алюминий получают при электролизе раствора оксида в расплаве криолита. Калий и подобные наиболее активные металлы только из расплавов галогенидов. Кислород в данном случае можно получить при электролизе водного раствора фторида калия.
Ответ: 124
Для начала имеет смысл определить класс каждого из соединений:
- Средняя соль
- Средняя соль
- Средняя соль
- Сильная кислота
Исходя из этого уже можно сказать, что наиболее низкое значение рН (самая кислая среда) будет в пункте 4).
Как разобраться с солями? Нужно оценить их способность к гидролизу и потенциальное влияние на среду раствора:
- Соль сильной кислоты и сильного основания, не гидролизуется, среда нейтральная
- Соль слабого основания и сильной кислоты, гидролиз по катиону, среда кислая
- Соль сильного основания и слабой кислоты, гидролиз по аниону, среда щелочная
Ответ: 4213
В задании на равновесие следует учитывать разные факторы. Пройдем по каждому из пунктов:
А) кислота при диссоциации может дать дополнительное количество ионов Н+, которые участвуют в равновесии. При увеличении их концентрации равновесие сместится в сторону обратной реакции.
Б) давление в данном случае не окажет влияния, поскольку нет участников-газов
В) повышение температуры сместит равновесие в сторону эндотермической реакции. В данном случае – прямой.
Г) твердая щелочь может раствориться и прореагировать с Н+, уменьшая концентрацию таких ионов в системе. Равновесие сместится в сторону прямой реакции.
Ответ: 2311
Задания подобного типа удобнее всего решать с помощью таблицы. Данный подход к решению задания ЕГЭ-2023 на равновесие в реакторе можно посмотреть по ссылке ниже:
Способ, на мой взгляд, наиболее оптимальный и доступный каждому.
Ответ: 25
В первом случае нужно подобрать такое вещество из правого столбика, которое реагирует с одним или двумя веществами из пары в левом столбике. При этом очень важно, чтобы реакция сопровождалась видимыми признаками:
Пара А):
- Есть реакция с азотной кислотой, сопровождается выделением газа и растворением твердого вещества. Нитрат натрия не реагирует. Подходит.
- Есть реакция с азотной кислотой, но внешних признаков нет. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
Пара Б):
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Есть реакция с гидроксидом калия, но внешних признаков нет. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Есть реакция с гидроксидом натрия, сопровождается образованием осадка. Хлорид калия не реагирует. Подходит.
Пара В):
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Есть реакция с хлоридом бария, сопровождается образованием осадка. Хлорид натрия не реагирует. Подходит.
Пара Г):
- Нет реакции ни с одним веществом из пары. Не подходит.
- Специфический случай, поскольку один из изначально образовавшихся нерастворимых гидроксидов (Al(OH)3) может раствориться снова при избытке щелочи. Подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
В заданиях второго типа имеет смысл записать происходящие реакции и попытаться себе их представить. Как может выглядеть и что увидим:
- 2CH3CH2COOH + 2Li = 2CH3CH2COOLi + H2
- 2CH3CH(OH)CH3 + 2K = 2CH3CH(OK)CH3 + H2
- Zn(OH)2 + 2CH3COOH = Zn(CH3COO)2 + 2H2O
- C2H2 + 2Br2 = CHBr2-CHBr2
В первом и втором случаях наблюдаем выделение газообразного водорода. В третьем наблюдаем растворение осадка гидроксида цинка. В четвертом исчезнет окраска брома, наблюдается обесцвечивание.
Ответ: 4415
Задание 25 охватывает несколько совершенно разнородных тем, каждая из которых требует отдельного блока знаний. Приведу здесь ссылки на полезные материалы по заданию, поскольку многое здесь нужно просто выучить.
По первому блоку следует знать, что сопряженные алкадиены используются для производства каучуков, а алкены – пластмасс. Метан в составе природного газа используют в качестве топлива.
По второму блоку можно относительно легко соотнести мономер и полимер, если представить себе структуру молекулы мономера. В молекуле этена всего два атома углерода, поэтому элементарное звено формулы полимера тоже содержит два атома углерода. По той же логике здесь можно действовать и для пропена с дивинилом.
Третий блок нужно просто выучить. По переработке углеводородов можно заглянуть сюда. Хорошее описание технологических процессов можно посмотреть здесь.
Ответ: 234; 214; 312
Для решения подобных заданий на растворы рекомендую использовать метод таблиц, подробно описанный здесь.
В итоге решение задачи сводится к уравнению вида
(15+х)/(150+х) = 0,12
15+х = 18+0,12х
0,88х = 3
х = 3,4
Ответ: 3,4 г
Задания такого типа сводятся к решению пропорции. Для начала переведем известный объем аммиака в количество:
n(NH3) = V(NH3)/Vm = 0,56/22,4 = 0,025 (моль)
2 моль – 92 кДж
0,025 моль – х кДж
х = 1,15 кДж
Ответ: 1,15 кДж
Для решения первой задачи запишем уравнение протекающей реакции:
CaCO3 + 2HNO3 = Ca(NO3)2 + CO2 + H2O
Далее вычислим количество нитрата кальция:
n(Ca(NO3)2) = m(Ca(NO3)2)/M(Ca(NO3)2) = 196800/164 = 1200 (моль)
Вычислим массу чистого карбоната кальция, который содержался в известняке:
m(CaCO3) = n(Ca(NO3)2)·M(Ca(NO3)2) = 1200·100 = 120000 (г) = 120 (кг)
Вычислим массу примесей в известняке:
m(примеси) = m(известняка) – m(CaCO3) = 150 — 120 = 30 (кг)
Определим массовую долю примеси в известняке:
ω(примеси) = m(примеси)/m(известняка)·100% = 30/150·100% = 20%
Ответ: 20%
Для решения второй задачи запишем уравнение протекающей реакции:
3С2Н2 = С6Н6
Вычислим количества ацетилена и практически полученного бензола:
n(С2Н2) = V(С2Н2)/Vm = 26,88/22,4 = 1,2 (моль)
n(С6Н6 практ.) = m(С6Н6)/M(С6Н6) = 23,4/78 = 0,3 (моль)
Вычислим теоретически возможное количество бензола и сравним его с практическим:
n(С6Н6 теор.) = n(С2Н2)/3 = 1,2/3 = 0,4 (моль)
η(С6Н6) = n(С6Н6 практ.)/n(С6Н6 теор.)·100% = 0,3/0,4·100% = 75%
Ответ: 75%
При выполнении заданий 29 и 30 имеет смысл записать все представленные вещества в виде молекулярных формул:
KMnO4, NaHCO3, Na2SO3, BaSO4, KOH, H2O2
Далее следует внимательно прочитать описание реакции. Поскольку должно происходить изменение цвета раствора, нужно найти окрашенный реагент. Из предложенных это может быть только KMnO4. Это вещество проявляет сильные окислительные свойства, поэтому нужно подобрать восстановитель. Осадка в ходе реакции образоваться не должно, поэтому брать нейтральную среду нельзя. В противном случае выпадет осадок MnO2. Среда может быть кислой или щелочной. Кислоты в предложенном наборе нет, поэтому выберем гидроксид калия для создания среды. Восстановителей в предложенном наборе два: сульфит натрия и пероксид водорода. Пероксид брать нельзя, поскольку по описанию реакции газа образоваться не должно. Таким образом приходим к выводу, что нужно взять сульфит, перманганат и щелочь. Приведем соответствующую реакцию и электронный баланс:
2KMnO4 + Na2SO3 + 2KOH = 2K2MnO4 + Na2SO4 + H2O
2∙ | Mn+7 + 1ē → Mn+6
1∙ | S+4 – 2ē → S+6
марганец в степени окисления +7 (или перманганат калия) является окислителем.
сера в степени окисления +4 (или сульфит натрия) – восстановителем.
Есть хороший инструмент для отработки данного задания, рекомендую.
При выполнении заданий 29 и 30 имеет смысл записать все представленные вещества в виде молекулярных формул:
KMnO4, NaHCO3, Na2SO3, BaSO4, KOH, H2O2
Далее следует внимательно прочитать описание реакции. К кислым солям здесь относится только NaHCO3. В обмен с ней вступит только гидроксид калия, поскольку кислое и щелочь точно смогут прореагировать. Приведем молекулярное, полное и сокращенное ионные уравнения:
2NaHCO3 + 2KOH = Na2CO3 + K2CO3 + 2H2O
2Na+ + 2HCO3− + 2K+ + 2OH− = 2Na+ + CO32− + 2K+ + CO32− + 2H2O
HCO3− + OH− = CO32− + H2O
Решение 31 номера сводится к знанию неорганической химии, свойств и реакций отдельных веществ. Приведем уравнения протекающих процессов:
2Cu(NO3)2 + 2H2O = 2Cu + O2 + 4HNO3
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
SO2 + 2H2S = 3S + 2H2O
3S + 6KOH = K2SO3 + 2K2S + 3H2O
При рассмотрении цепочек превращений бывает полезно посмотреть через одну стадию и оценить, как можно осуществить такое превращение. Также очень полезно сравнить число атомов углерода в исходной молекуле и продукте, может навести на мысль.
Начнем с циклогексана. Получить его путем гидрирования можно, например, из бензола. Его, в свою очередь, можно получить из гексана по реакции дегидроциклизации. Х1 – бензол. Далее в цепочке много неизвестных веществ, заглянем в самый конец. Циклогексанон относится к кетонам, получить его можно из вторичного спирта. Условия последней реакции на это указывают, поскольку там дан сильный окислитель в кислой среде. Тогда Х3 – циклогексанол. Получить такой спирт в две стадии нужно из циклоалкана. Тогда можно предположить последовательно галогенирование и замещение полученного галогенпроизводного под действием водного раствора щелочи. Тогда Х2 – хлорциклогексан, можно бромциклогексан. Последовательность реакций получается следующей:
Решение задачи начинается с анализа и расчета молекулярной формулы. Поскольку продуктами сгорания являются только углекислый газ и вода, можно приписать веществу формулу CxHyOz. Вычислим количества углекислого газа и воды:
n(H2O) = m(H2O)/M(H2O) = 1,8/18 = 0,1 (моль)
n(СО2) = V(CO2)/Vm = 4,48/22,4 = 0,2 (моль)
Тогда можно определить количества и массы элементов, входивших в состав исходного вещества:
n(С) = n(СО2) = 0,2 моль
m(С) = n(С)·M(С) = 0,2·12 = 2,4 г
n(H) = 2n(H2O) = 0,2 моль
m(H) = n(H)·M(H) = 0,2·1 = 0,2 г
m(О) = m(CxHyOz) − m(С) − m(H) = 3,4 − 2,4 − 0,2 = 0,8 (г)
n(O) = m(O)/M(O) = 0,8/16 = 0,05 (моль)
Вычислим молекулярную формулу неизвестного вещества:
x : y : z = n(С) : n(H) : n(O) = 0,2 : 0,2 : 0,05 = 4 : 4 : 1
Поскольку по условию один из фрагментов молекулы должен содержать 7 атомов углерода, разумным будет удвоить простейшее соотношение и получить формулу C8H8O2.
С8Н8О2 – молекулярная формула
Вещество по условию реагирует со щелочью, процесс гидролиза с образованием соли и спирта. В остатке кислоты 7 атомов углерода и малое количество атомов водорода, что вполне соответствует бензоату. Тогда на спирт приходится всего один атом углерода, что соответствует метанолу. Тогда можно предложить структуру метилбензоата:
Запишем уравнение его реакции с гидроксидом лития:
К заданию 34 следует приступать только после ПОЛНОГО выполнения и проверки всех остальных заданий КИМа. Убедитесь также, что все прочие задания перенесены в бланк ответов, а не остались на черновике. Времени на это задание нужно больше всего, поэтому велик риск потерять остальное и не успеть что-то перенести в бланк.
Для решения следует внимательно прочитать условие и написать реакции, которые сразу же очевидны, без дополнительных расчетов. Здесь их можно записать две:
Ca + 2HCl = CaCl2 + H2
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
Поскольку напрямую ничего не известно про массу и количество кальция и карбоната кальция, можно сказать, что кальция было х моль, а его карбоната у моль. Тогда в ходе реакций выделилось х моль водорода и у моль углекислого газа. Выразим массы указанных веществ:
m(Ca) = n·M = 40х г
m(CaCO3) = n·M = 100у г
m(Н2) = n·M = 2х г
m(CO2) = n·M = 44у г
Выразим массу раствора после добавления исходной твердой смеси к соляной кислоте:
m(р-ра) = m(Ca) + m(CaCO3) + m(р-ра HCl) − m(Н2) − m(CO2)
m(р-ра) = 40х + 100у + 300 − 2х − 44у = 330 (г)
38х + 56у = 30
Первое уравнение системы готово. Второе составим по массовой доле кальция в исходной смеси:
m(смеси) = m(Ca) + m(CaCO3) = 40х + 100у (г)
m(Ca) = 40х + 40у (г)
ω(Са) = m(Ca)/m(смеси)·100% = (40х+40у)/(40х+100у)·100% = 50%
(40х+40у)/(40х+100у) = 0,5
Составим и решим систему уравнений:
38х + 56у = 30
(40х + 40у)/(40х + 100у) = 0,5
38х + 56у = 30
(2х + 2у)/(2х + 5у) = 0,5
38х + 56у = 30
2х + 2у = х + 2,5у
38х + 56у = 30
х = 0,5у
75у = 30
у = 0,4
х = 0,2
n(Ca) = 0,2 моль
n(CaСО3) = 0,4 моль
Далее вычислим количество и массу углекислого газа:
n(СО2) = n(CaСО3) = 0,4 моль
m(СО2) = n(СО2)·M(СО2) = 0,4·44 = 17,6 г
Вычислим массу и количество гидроксида натрия:
m(NaOH) = m(р-ра NaOH)·ω(NaOH)/100% = 400·4%/100% = 16 (г)
n(NaOH) = m(NaOH)/M(NaOH) = 16/40 = 0,4 (моль)
Далее нужно сравнить количества щелочи и углекислого газа, чтобы понять, какая будет реакция между ними:
n(СО2)/n(NaOH) = 0,4/0,4 = 1:1
Соотношение 1:1, поэтому образуется кислая соль:
NaOH + CO2 = NaHCO3
Вычислим массу образовавшейся соли и массу раствора:
n(NaHCO3) = n(СО2) = 0,4 моль
m(NaHCO3) = n·M = 0,4·84 = 33,6 г
m(р-ра конечн.) = m(р-ра NaOH) + m(CO2) = 400 + 17,6 = 417,6 (г)
Вычислим массовую долю гидрокарбоната натрия в полученном растворе:
ω(NaHCO3) = m(NaHCO3)/m(р-ра конечн.)·100% = 33,6/417,6·100% = 8,05%
Ответ: 8,05%
Подготовка к ЕГЭ по химии
Как проходит ЕГЭ по химии в 2023 году
На ЕГЭ по химии, как и в случае с большинством других предметов, ученик 11 класса должен будет справиться с 2 частями экзамена:
-
1-я часть: 28 заданий с кратким ответом;
-
2-я часть: 6 заданий с развернутым ответом.
Чтобы решить все 34 задания единого государственного экзамена, у ученика будет 210 минут. За это время нужно будет успеть ответить на вопросы обеих частей, подготовить полное решение для задач 2-й части и перенести ответы в бланк.
Кстати, в отличие от ОГЭ, на ЕГЭ по химии не будет задания-эксперимента. Только обычные химические задания разной сложности. В таблице ниже можно посмотреть, сколько будет легких, средних и сложных вопросов.
| Уровень сложности заданий на ЕГЭ по химии | |
|---|---|
| Базовая | 17 |
| Повышенная | 11 |
| Высокая | 6 |
Если вы хотите больше узнать об особенностях экзамена и подготовки к нему, советуем заглянуть в раздел «Демоверсии, спецификации, кодификаторы» сайта ФИПИ. Там вы найдете всю актуальную информацию о ЕГЭ по химии и методические рекомендации. Все это поможет распланировать подготовку к экзамену так, чтобы сдать его на 100 баллов.
Изменения в ЕГЭ по химии
По сравнению с 2022 годом экзамен по химии немного изменится. Вот список нововведений:
-
Немного поменялось условие задания 23, в котором нужно рассчитать концентрацию веществ. Теперь данные в нем будут записаны текстом, а не в таблице.
-
Задания 33 и 34 поменялись местами.
-
Задания 9, 12 и 16 теперь станут повышенной сложности.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
Как хорошо сдать ЕГЭ по химии: разбор сложных задач
Как мы узнали из таблицы в предыдущем разделе, экзамен по химии — один из самых сложных. На 34 задания в нем приходится целых 11 повышенной сложности и 6 — высокой. Но если вы хотите поступить в вуз мечты, советуем научиться их решать так, чтобы не упустить ни одного балла. А потому предлагаем начать подготовку прямо сейчас и вместе разобрать несколько таких задач.
Задание 7
Это задание проверяет буквально все ваши знания в области неорганической химии. Здесь нужно знать как химические свойства простых соединений, так и химические свойства сложных соединений. Давайте разберем одно из таких заданий, чтобы понять, как их решать, чтобы сдать ЕГЭ по химии.
Установите соответствие между веществом и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| Вещество | Реагенты |
|---|---|
| А) S | 1) AgNO3, K3PO4, Cl2 |
| Б) SO3 | 2) BaO, NaOH, H2O |
| В) Zn(OH)2 | 3) H2, Cl2, O2 |
| Г) ZnBr2 | 4) HBr, LiOH, CH3COOH (p-p) |
| 5) H3PO4 (p-p), BaCl2, CuO |
Решение:
-
Вариант под буквой А — простое вещество, сера. Как правило, простые вещества взаимодействуют с другими простыми веществами, значительно реже со сложными веществами. Под это описание подходит вариант № 3.
-
Вещество под буквой Б — кислотный оксид. Кислотные оксиды не реагируют с кислотами, поэтому смело вычеркиваем варианты, где присутствует хоть одна кислота. Остаются варианты № 1–3. Реагенты под цифрой 3 тоже можем вычеркнуть, так как кислотный оксид уже в своей максимальной степени окисления и дальше взаимодействовать с кислородом не может. Остаются варианты № 1 и № 2. Оксид серы (VI) может реагировать с основным оксидом с образованием соли, со щелочью с образованием соли и воды, и с водой, при этом образуя кислоту. Выбираем № 2.
-
Амфотерный нерастворимый в воде гидроксид цинка может взаимодействовать только с теми, что способны его растворить. Единственно верный вариант под № 4, где указаны кислоты и щелочь.
-
При взаимодействии соли с другими сложными веществами надо помнить про три признака протекания химической реакции: выпадения осадка, выделение газа и образование малодиссоциирующего вещества — воды. Под это описание подходит вариант под № 1. Но как же хлор? Дело в том, что вышестоящие в группе галогены способны вытеснить нижестоящие из их солей.
Ответ: 3241.
Задание 15
Это задание Единого государственного экзамена проверит ваши знания химических свойств органических соединений. Чтобы справиться с ним, нужно по записанным словами реагирующим веществам составить уравнение реакции и выбрать из перечня один из получившихся продуктов. Давайте рассмотрим на примере, как решать такую задачу.
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| Реагирующие вещества | Продукт взаимодействия |
|---|---|
| А) уксусная кислота и сульфид калия | пропионат калия |
| Б) муравьиная кислота и гидроксид калия | этилат калия |
| В) муравьиный альдегид и гидроксид меди (II) при нагревании | формиат меди (II) |
| Г) этанол и калий | формиат калия |
| ацетат калия | |
| углекислый газ |
Решение:
-
Органические кислоты могут реагировать с солями, если те имеют летучий анион. В результате взаимодействия образуется соль уксусной кислоты и сероводород (летучее соединение). Соль, которая образована в таких условиях, — ацетат калия. Это вещество № 5.
-
Муравьиная кислота проявляет свойства неорганической кислоты и может взаимодействовать с щелочами с образованием соли и воды. Соль муравьиной кислоты — формиат. Правильный ответ № 4.
-
Под буквой В описана качественная реакция на альдегиды с образованием соответствующей кислоты, оксида меди (I) и воды. Исключение — муравьиный альдегид. Он окисляется до углекислого газа, а остальные продукты реакции те же. Соответственно, правильный ответ № 6.
-
Калий как активный металл может замещать протон водорода в гидроксогруппе у спиртов с образованием алкоголята. Правильный ответ: № 2.
Ответ: 5462.
Задание 16
Это задание всё так же проверяет ваши знания по химическим свойствам и, как следствие, умение записывать превращения в рамках органической химии. Однако оно усложняется тем, что теперь вам самим нужно подобрать такой реактив, чтобы произошло уже известное превращение. Давайте попробуем решить один из вариантов такой задачи вместе — это повысит ваши шансы сдать ЕГЭ на 100 баллов.
Задана схема превращений веществ:
Определите, какие из указанных веществ являются веществами х и у:
-
2-бромбутан;
-
этаналь;
-
этен;
-
метилпропан;
-
хлорэтан.
Решение:
Посмотрим, что случилось с известными нам веществами.
-
У спирта исчезла ОН-группа, затем что-то произошло, и углеродная цепочка увеличилась вдвое. Мы помним, что когда цепочка увеличивается вдвое, то, скорее всего, это реакция Вюрца. А в неё вступают только галогеналканы. Ищем нужный нам вариант. Он находится под номером 5. Первое вещество найдено.
-
Бутан подвергают нагреванию с использованием катализатора. Нужно помнить, что в таких условиях проводится изомеризация алканов. Из бутана получается метилпропан. Ответ: № 4.
Ответ: 54.
Задание 26
Теперь разберем задачи, которые заканчивают тестовую часть ЕГЭ по химии. Рассмотрим условие одной из них на нахождение массы соли, которую необходимо добавить для получения раствора с новой заданной массовой долей.
Вычислите массу нитрата калия (в граммах), которую следует растворить в 160 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%. Ответ округлите до десятых.
Чтобы решить эту задачу, вспомним основную формулу нахождения массовой доли:
-
Найдем массу изначально растворенного нитрата калия в растворе, выразив из формулы выше:
подставим значения:
-
Чтобы увеличить массовую долю соли в растворе, необходимо ее добавить еще. Но мы не знаем сколько, поэтому примем массу добавляемой соли за Х и подставим в исходную формулу нахождения массовой доли с учетом новых значений:
-
Далее в дело вступает чистая математика. Разделим обе части уравнения на 100%:
-
По пропорции перемножим крест-накрест:
0,12 * (160 + X) = 16 + X.
-
Раскроем скобки:
19,2 + 0,12Х = 16 + Х.
-
Приведем подобные: с Х в одну сторону, без Х — в другую:
3,2 = 0,88Х.
-
Найдем Х:
Масса нитрата калия, которую необходимо добавить для увеличения массовой доли раствора до 12%, равна 3,6 граммам.
Ответ: 3,6.
Задание 28
Эта задача может встретиться на экзамене в нескольких вариантах. Давайте разберем один из них — задание на нахождение доли выхода продукта реакции.
В результате реакции тримеризации ацетилена объемом 26,88 л (н.у) получили 24,96 г бензола. Вычислите массовую долю выхода продукта реакции от теоретически возможного.
Решение:
-
Для начала напишем формулу, по которой считается доля выхода продукта:
Как определить, какая масса практическая, а какая — теоретическая? Значения, которые даются после слова «получили», — это практическая масса. Та, которая получилась в результате проведения химической реакции в реальных условиях. Масса теоретическая — та, которую рассчитывают из уравнения реакции, зная массу исходных реагентов.
-
Напишем уравнение химической реакции тримеризации ацетилена:
-
Найдем количество вещества ацетилена:
подставим значения:
-
Перейдем на количество вещества бензола, получаемого из ацетилена:
-
Зная количество вещества бензола, найдем его массу:
подставим значения:
m = 0,4 * 78 = 31,2 грамма.
-
Масса, рассчитываемая по уравнению реакции, является теоретической. Масса практическая дана нам по условию. Подставим полученные данные по массам в формулу для нахождения доли выхода продукта реакции:
Доля выхода бензола из данного объема ацетилена составляет 80%.
Ответ: 80.
Как оценивают готовые работы на ЕГЭ по химии
1-я часть
В 1-й части Единого государственного экзамена по химии задания 1–5, 9–13, 16–21, 25–28 оценивают 1 баллом, если вы запишете верный ответ по эталону. При этом в заданиях 1, 3, 4, 11, 12, 13, 17 и 18 ответ — это ряд цифр. То, в каком порядке вы их запишете, не влияет на оценку. Например, если в задании верны варианты под номерами 1 и 4, их можно записать как 14 или как 41. И в обоих случаях ответ засчитают как верный.
За правильные ответы в заданиях 6, 7, 8, 14, 15, 22, 23 и 24 можно получить по 2 балла. Если ваш ответ отличается от эталона на один символ, его оценят в 1 балл. Во всех остальных случаях задание считают выполненным неверно и ставят 0 баллов.
2-я часть
В этой части нужно записать не только ответ, но и решение. А значит, и оценивать такие задания будут сразу по нескольким критериям. Зато за верный ответ в некоторых вопросах можно получить больше баллов, чем за любое задание 1-й части. Максимум — 5 баллов. А теперь давайте разберемся, как именно их будут оценивать.
| Задание № 29 | Баллы |
|---|---|
| Ответ верный и полный: ученик выбрал вещества и записал уравнение химической реакции, составил электронный баланс, указал окислитель и восстановитель | 2 |
| Есть только один верный элемент ответа | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 2 |
| Задание № 30 | Баллы |
|---|---|
| Ответ верный и полный: ученик выбрал вещества, записал все нужные уравнения реакции | 2 |
| Есть только один верный элемент ответа | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 2 |
| Задание № 31 | Баллы |
|---|---|
| Правильно записаны 4 уравнения реакции | 4 |
| Правильно записаны 3 уравнения реакции | 3 |
| Правильно записаны 2 уравнения реакции | 2 |
| Правильно записано 1 уравнение реакции | 1 |
| Все уравнения реакции записаны неверно | 0 |
| Максимальный балл | 4 |
| Задание № 32 | Баллы |
|---|---|
| Правильно записаны 5 уравнений реакции | 5 |
| Правильно записаны 4 уравнения реакции | 4 |
| Правильно записаны 3 уравнения реакции | 3 |
| Правильно записаны 2 уравнения реакции | 2 |
| Правильно записано 1 уравнение реакции | 1 |
| Все уравнения реакции записаны неверно | 0 |
| Максимальный балл | 5 |
| Задание № 33 | Баллы |
|---|---|
| Ответ верный и полный, записаны все 3 элемента | 3 |
| Правильно записаны только 2 элемента ответа | 2 |
| Правильно записан только 1 элемент ответа | 1 |
| Все элемента ответа записаны неверно | 0 |
| Максимальный балл | 3 |
| Задание № 34 | Баллы |
|---|---|
| Ответ верный и полный, записаны все 4 элемента | 4 |
| Правильно записаны только 3 элемента ответа | 3 |
| Правильно записаны только 2 элемента ответа | 2 |
| Правильно записан только 1 элемент ответа | 1 |
| Все элемента ответа записаны неверно | 0 |
| Максимальный балл | 4 |
Как сдать ЕГЭ по химии на 3, 4 и 5
Мы уже познакомились с критериями, по которым будут оценивать работы на ЕГЭ. А теперь давайте разберемся, сколько баллов нужно получить для оценок 3, 4 или 5. Официально ЕГЭ не оценивают по пятибалльной системе с 2008 года. Если вам так проще оценить свои знания, их можно перевести. Но это будет лишь примерный перевод.
Будьте внимательны: баллы из таблиц выше — первичные, а требования к абитуриентам на поступление выражены в тестовых. Чтобы понять, сколько заданий точно нужно решить, чтобы поступить, надо перевести баллы из одной системы в другую. Это можно сделать по таблице ниже.
| Первичные баллы | Тестовые баллы | Оценка |
|---|---|---|
| <11 | <36 | 2 |
| 11–25 | 36–55 | 3 |
| 26–38 | 56–72 | 4 |
| 39–56 | 73–100 | 5 |
6 рекомендаций, как подготовиться к ЕГЭ по химии
Единый государственный экзамен — это ответственная задача, от результатов подготовки к которой иногда многое зависит. Чтобы немного облегчить для вас этот путь, мы собрали 6 простых, но рабочих советов от наших преподавателей. Следуйте им и тогда сможете подготовиться к экзамену по химии как можно лучше.
-
Узнайте все о структуре ЕГЭ и научитесь работать с КИМами.
-
Начинайте готовиться заранее. Но если получилось так, что осталось мало времени, составьте новый экспресс-план с помощью вашего преподавателя.
-
Ведите календарь подготовки к экзамену. Отмечайте на нем запланированные темы, разные методики, занятия у репетитора, пробные ЕГЭ и самоподготовку.
-
Распределяйте время на темы, исходя из ваших знаний. Больше учите то, что «западает», остальное — повторяйте.
-
Советуйтесь с учителем. Это может быть ваш преподаватель по химии или репетитор. Круто, если он сможет поделиться с вами опытом подготовки к ЕГЭ.
-
Заботьтесь о своем здоровье, не забывайте отдыхать, не лишайте себя живого общения. Все это может сказаться на вашем самочувствии, а значит, и баллах тоже.
Если вы хотите сдать ЕГЭ по химии на 100 баллов, советуем тщательно продумать, как вы будете готовиться к нему. Лучший из них — совмещать самостоятельную работу и дополнительные занятия.
На курсах подготовки к ЕГЭ по химии в Skysmart школьники отрабатывают все типы задач и разбирают критерии оценок. Для каждого из них мы составляем индивидуальный план, который приведет к нужным баллам. Он учитывает уровень знаний ученика и время до экзамена, что позволяет «выжать» максимум из подготовки. А еще мы рассказываем о ЕГЭ без «страшилок» и прикрас, чтобы школьник точно знал, что его ждет на экзамене. Ждем на первом бесплатном занятии!
Полный курс подготовки к ЕГЭ по химии-2023. Здесь приведена теория по каждому заданию в соответствии с спецификацией и кодификатором ЕГЭ по химии. Учебные материалы и теория, необходимые для подготовки к ЕГЭ по химии.
Вы можете поддержать работу сайта, разработку новых материалов и тестов. Донаты принимаются через форму:
Обратите внимание! Форма выше — это не оплата курса по химии, это форма для сбора донатов на работу сайта)
Кодификатор ЕГЭ по химии-2022
| 1 | ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ | |
| |
1.1. | Современные представления о строении атома |
| 1.1.1. | Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояния атомов
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами) |
|
| 1.2 | Периодический закон и Периодическая система химических элементов Д.И. Менделеева |
|
| 1.2.1. | Закономерности изменения свойств элементов и их соединений по периодам и группам
Тренировочные тесты в формате ЕГЭ по теме «Периодический закон» (задание 2 ЕГЭ по химии) ( с ответами) |
|
| 1.2.2. | Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. | |
| 1.2.3. | Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов | |
| 1.2.4. | Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов | |
| 1.3. | Химическая связь и строение вещества |
|
| 1.3.1 | Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Тренировочные тесты в формате ЕГЭ по теме «Химические связи» (задание 4 ЕГЭ по химии) ( с ответами) |
|
| 1.3.2. | Электроотрицательность. Степень окисления и валентность химических элементов
Тренировочные тесты в формате ЕГЭ по теме «Степень окисления и валентность» (задание 3 ЕГЭ по химии) ( с ответами) |
|
| 1.3.3. | Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения | |
| 1.4. | Химическая реакция | |
| 1.4.1. | Классификация химических реакций в неорганической и органической химии
Тренировочные тесты в формате ЕГЭ по теме «Классификация реакций» ( с ответами) |
|
| 1.4.2. | Тепловой эффект химической реакции. Термохимические уравнения | |
| 1.4.3. | Скорость реакции, ее зависимость от различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Скорость реакции» ( с ответами) |
|
| 1.4.4. | Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Химическое равновесие реакции» ( с ответами) |
|
| 1.4.5. |
Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты | |
| 1.4.6. | Реакции ионного обмена | |
| 1.4.7. |
Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Тренировочные тесты в формате ЕГЭ по теме «Гидролиз» (с ответами) |
|
| 1.4.8. |
Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
Тренировочные тесты в формате ЕГЭ по теме «Окислительно-восстановительные реакции» (задание 19 ЕГЭ по химии) ( с ответами) |
|
| 1.4.9. |
Электролиз расплавов и растворов (солей, щелочей, кислот)
Тренировочные тесты в формате ЕГЭ по теме «Электролиз» (задание 20 ЕГЭ по химии) ( с ответами) |
|
| 1.4.10. |
Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии | |
| 2 | НЕОРГАНИЧЕСКАЯ ХИМИЯ | |
| 2.1. | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация неорганических веществ» (задание 5 ЕГЭ по химии) ( с ответами) |
|
| 2.2. | Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа) | |
| 2.3. | Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния | |
| 2.4. | Характерные химические свойства оксидов: основных, амфотерных, кислотных | |
| 2.5. | Характерные химические свойства оснований и амфотерных гидроксидов | |
| 2.6. | Характерные химические свойства кислот | |
| 2.7. | Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере соединений алюминия и цинка) | |
| 2.8. | Взаимосвязь различных классов неорганических веществ | |
| 3. | ОРГАНИЧЕСКАЯ ХИМИЯ | |
| 3.1. | Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах
Тренировочные тесты в формате ЕГЭ по теме «Теория строения орг. соединений» ( с ответами) |
|
| 3.2. | Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа | |
| 3.3. | Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация орг. соединений» ( с ответами) |
|
| 3.4. | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола) | |
| 3.5. | Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. | |
| 3.6. | Характерные химические свойства альдегидов, карбоновых кислот, сложных эфиров | |
| 3.7. | Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот
Тренировочные тесты в формате ЕГЭ по теме «Свойства азотсодержащих соединений» ( с ответами) |
|
| 3.8. | Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды) | |
| 3.9. | Взаимосвязь органических соединений | |
| 4. | МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ | |
| 4.1. | Экспериментальные основы химии | |
| 4.1.1. | Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии | |
| 4.1.2. | Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ | |
| 4.1.3. | Определение характера среды водных растворов веществ. Индикаторы | |
| 4.1.4. | Качественные реакции на неорганические вещества и ионы | |
| 4.1.5. | Качественные реакции органических соединений | |
| 4.1.6. | Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам неорганических соединений | |
| 4.1.7. | Основные способы получения углеводородов (в лаборатории): алканов, алкенов, алкинов, циклоалканов, алкадиенов, аренов | |
| 4.1.8. | Основные способы получения органических кислородсодержащие соединений (в лаборатории): спиртов, альдегидов и кетонов, карбоновых кислот | |
| 4.2.1. | Понятие о металлургии: общие способы получения металлов | |
| 4.2.2. | Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия | |
| 4.2.3. | Природные источники углеводородов, их переработка | |
| 4.2.4. | Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки | |
| 4.3. | Расчеты по химическим формулам и уравнениям реакций | |
| 4.3.1. | Расчеты с использованием понятия «массовая доля вещества в растворе» | |
| 4.3.2. | Расчеты объемных отношений газов при химических реакциях | |
| 4.3.3. | Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ | |
| 4.3.4. | Расчеты теплового эффекта реакции | |
| 4.3.5. | Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси) | |
| 4.3.6. | Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества | |
| 4.3.7. | Установление молекулярной и структурной формулы вещества | |
| 4.3.8. | Расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного | |
| 4.3.9. | Расчеты массовой доли (массы) химического соединения в смеси |
1.1.1. Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояния атомов
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами)
1.2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Тренировочные тесты в формате ЕГЭ по теме «Периодический закон» (задание 2 ЕГЭ по химии) ( с ответами)
1.2.1. Закономерности изменения свойств элементов и их соединений по периодам и группам
1.2.2. Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов.
1.2.3. Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов
1.2.4. Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов
1.3. Химическая связь и строение вещества
1.3.1. Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Тренировочные тесты в формате ЕГЭ по теме «Химические связи» (задание 4 ЕГЭ по химии) ( с ответами)
1.3.2. Электроотрицательность. Степень окисления и валентность химических элементов
Тренировочные тесты в формате ЕГЭ по теме «Степень окисления и валентность» (задание 3 ЕГЭ по химии) ( с ответами)
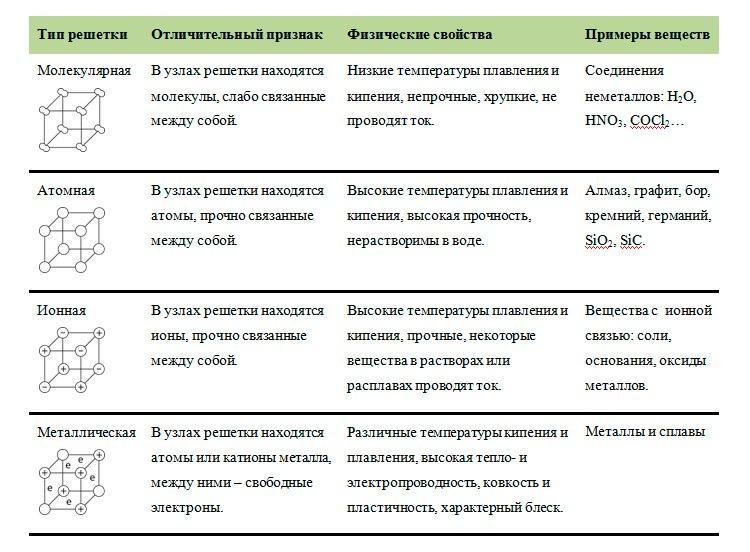
1.3.3. Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
1.4. Химическая реакция
1.4.1. Классификация химических реакций в неорганической и органической химии
1.4.2. Тепловой эффект химической реакции. Термохимические уравнения
1.4.3. Скорость реакции, ее зависимость от различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Скорость реакции» (задание 20 ЕГЭ по химии) ( с ответами)
1.4.4. Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Химическое равновесие реакции» (задание 24 ЕГЭ по химии) ( с ответами)
1.4.5. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты
1.4.6. Реакции ионного обмена
1.4.7. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Тренировочные тесты в формате ЕГЭ по теме «Гидролиз» (задание 23 ЕГЭ по химии) ( с ответами)
1.4.8. Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
Тренировочные тесты в формате ЕГЭ по теме «Окислительно-восстановительные реакции» (задание 21 ЕГЭ по химии) ( с ответами)
1.4.9. Электролиз расплавов и растворов (солей, щелочей, кислот)
Тренировочные тесты в формате ЕГЭ по теме «Электролиз» (задание 22 ЕГЭ по химии) ( с ответами)
1.4.10. Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии
2. НЕОРГАНИЧЕСКАЯ ХИМИЯ
2.1. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация неорганических веществ» (задание 5 ЕГЭ по химии) ( с ответами)
2.2. Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
2.3. Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
2.4. Характерные химические свойства оксидов: основных, амфотерных, кислотных
2.5. Характерные химические свойства оснований и амфотерных гидроксидов
2.6. Характерные химические свойства кислот
2.7. Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере соединений алюминия и цинка)
2.8. Взаимосвязь различных классов неорганических веществ
3. ОРГАНИЧЕСКАЯ ХИМИЯ
3.1. Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах
3.2. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа
3.3. Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная)
3.4. Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола)
3.5. Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола.
3.6. Характерные химические свойства альдегидов, карбоновых кислот, сложных эфиров
3.7. Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот
3.8. Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды)
3.9. Взаимосвязь органических соединений
4. МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ
4.1. Экспериментальные основы химии
4.1.1. Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
4.1.2. Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ
4.1.3. Определение характера среды водных растворов веществ. Индикаторы
4.1.4. Качественные реакции на неорганические вещества и ионы
4.1.5. Качественные реакции органических соединений
4.1.6. Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам неорганических соединений
4.1.7. Основные способы получения углеводородов (в лаборатории): алканов, алкенов, алкинов, циклоалканов, алкадиенов, аренов
4.1.8. Основные способы получения органических кислородсодержащие соединений (в лаборатории): спиртов, альдегидов и кетонов, карбоновых кислот
4.2.1. Понятие о металлургии: общие способы получения металлов
4.2.2. Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия
4.2.3. Природные источники углеводородов, их переработка
4.2.4. Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки
4.3. Расчеты по химическим формулам и уравнениям реакций
4.3.1. Расчеты с использованием понятия «массовая доля вещества в растворе»
4.3.2. Расчеты объемных отношений газов при химических реакциях
4.3.3. Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ
4.3.4. Расчеты теплового эффекта реакции
4.3.5. Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси)
4.3.6. Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества
4.3.7. Установление молекулярной и структурной формулы вещества
4.3.8. Расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного
4.3.9. Расчеты массовой доли (массы) химического соединения в смеси
Курс подготовки к ЕГЭ или ОГЭ (ГИА) по химии:
Общая химия
Часть 1. Строение вещества
1. Строение атома. Электронные формулы атомов
2. Периодический закон
3. Строение молекул. Типы химических связей. Основные характеристики ковалентной связи. Межмолекулярные связи
4. Строение вещества (кристаллические решетки). Основные физические свойства различных кристаллов
5. Степень окисления и валентность химических элементов.
Часть 2. Основы неорганической химии
1. Классификация неорганических веществ
2. Номенклатура неорганических веществ
3. Способы получения оксидов
4. Химические свойства основных оксидов
5. Химические свойства кислотных оксидов
6. Химические свойства амфотерных оксидов
7. Химические свойства и способы получения кислот
8. Химические свойства и способы получения солей
9. Химические свойства и способы получения оснований
10. Взаимосвязь основных классов неорганических веществ
11. Бинарные соединения — гидриды.
12. Реакции разложения в неорганической химии
Часть 3. Физико-химия растворов:
1. Понятие о растворах, растворимость
2. Теория электролитической диссоциации
3. Реакции ионного обмена
4. Гидролиз.
Часть 4. Окислительно-восстановительные реакции
1. Окислительно-восстановительные реакции.
2. Электролиз солей. Электролиз солей карбоновых кислот. Коррозия.
Часть 5. Особенности работы в лаборатории
Часть 6. Химические реакции. Закономерности их протекания
1. Классификация химических реакций.
2. Кинетика (скорость) химических реакций и ее зависимость от разных факторов.
3. Термодинамика химических реакций: химическое равновесие и его смещение.
Органическая химия
1. Теория строения органических веществ. Классификация органических веществ. Гомологи и изомеры. Виды изомерии.
2. Алканы: химические и физические свойства, строение, получение, изомерия.
3. Алкены: химические и физические свойства, строение, получение, изомерия.
4. Алкины: химические и физические свойства, строение, получение, изомерия.
5. Алкадиены: химические и физические свойства, строение, получение, изомерия.
6. Арены: химические и физические свойства, строение, получение, изомерия.
7. Циклоалканы: химические и физические свойства, строение, получение, изомерия.
8. Спирты: химические и физические свойства, строение, изомерия и способы получения. Фенолы: химические свойства, способы получения, строение и изомерия.
9. Альдегиды и кетоны: химические и физические свойства, строение и изомерия, получение.
10. Карбоновые кислоты: химические и физические свойства, строение, номенклатура и изомерия, способы получения.
11. Сложные эфиры: химические и физические свойства, строение, получение, изомерия.
12. Жиры: химические и физические свойства, строение, получение.
13. Углеводы: химические и физические свойства, строение, получение.
14. Амины: химические и физические свойства, строение, получение, изомерия.
15. Аминокислоты: химические и физические свойства, строение, получение, изомерия.
16. Белки: химические и физические свойства, строение и получение.
17. Взаимосвязь разных классов органических веществ.
18. Качественные реакции в органической химии.
Характерные реакции в органической химии:
Реакция Дюма Электролиз солей карбоновых кислот Пиролиз метана Реакция Вагнера
Химия элементов
Часть 1. Химия щелочных металлов и их соединений. Пероксиды щелочных металлов. Гидроксиды щелочных металлов.
Часть 2. Химия щелочноземельных металлов. Оксиды щелочноземельных металлов. Гидроксиды щелочноземельных металлов.
Часть 3. Химия алюминия и его соединений. Оксид алюминия. Гидроксид алюминия. Соли алюминия.
Часть 4. Химия углерода. Оксид углерода (II) и оксид углерода (IV). Угольная кислота и ее соли (карбонаты и гидрокарбонаты).
Часть 5. Химия кремния. Оксид кремния (IV). Кремниевая кислота. Силан. Силикаты.
Часть 6. Химия азота и его соединений. Оксиды азота. Аммиак. Нитриды. Азотная кислота и азотистая кислота. Нитраты.
Часть 7. Химия фосфора и его соединений. Фосфин. Фосфиды металлов. Оксиды фосфора III и V. Фосфорные кислоты и их соли (фосфаты, гидрофосфаты и дигидрофосфаты, пирофосфаты и метафосфаты). Фосфористая кислота.
Часть 8. Химия кислорода и его соединений.
Часть 9. Химия серы и ее соединений. Сероводород и сульфиды. Оксиды серы – сернистый газ и серный ангидрид. Серная кислота и ее свойства. Сернистая кислота. Особенности химии сульфатов и сульфитов.
Часть 10. Химия галогенов и их соединений.
Часть 11. Химия d-элементов: железа, хрома, цинка, меди.
Часть 12. Химия водорода и его соединений.
Задачи: базовый блок
1. Атомно -молекулярное учение
2. Способы выражения концентрации в растворах: массовая доля, растворимость, молярная концентрация.
3. Расчеты по уравнению реакции
4. Задачи на избыток-недостаток
5. Задачи на примеси
6. Задачи на выход
Задачи повышенной сложности
1. Задачи на электролиз
2. Задачи на кристаллогидраты
3. Задачи на пластинки
4. Задачи на порции
5. Неполное разложение
6. Задачи на альтернативные реакции (кислые/средние соли, амфотерность)
7. Задачи на атомистику
8. Задачи на смеси и сплавы
9. Задачи на растворимость
Диагностические и тренировочные работы
Все реальные варианты КИМ ЕГЭ по химии
Тренировочная работа по химии в формате ЕГЭ 26 октября 2017 года
Тренировочная работа по химии для 11 классов 30 ноября 2017 года
Досрочный ЕГЭ по химии 25.03.2019
Видеоопыты
Видеоопыты по общей и неорганической химии
Видеоопыты по органической химии
Спецификация ЕГЭ по химии-2022
ЕГЭ по химии состоит из двух частей и 34 заданий.
Первая часть содержит 29 заданий с кратким ответом, в их числе 20 заданий базового уровня сложности: №1–9, 12–17, 20–21, 27–29. Девять заданий повышенного уровня сложности: №9–11,17–19, 22–26.
Вторая часть содержит 5 заданий высокого уровня сложности с развёрнутым ответом: №30–34
Задания базового уровня сложности с кратким ответом проверяют усвоение содержания важнейших разделов школьного курса химии: теоретические основы химии, неорганическая химия, органическая химия, методы познания в химии, химия и жизнь.
Задания повышенного уровня сложности с кратким ответом ориентированы на проверку обязательных элементов содержания основных образовательных программ по химии не только базового, но и углубленного уровня. В сравнении с заданиями предыдущей группы они предусматривают выполнение большего разнообразия действий по применению знаний в изменённой, нестандартной ситуации (например, для анализа сущности изученных типов реакций), а также умения систематизировать и обобщать полученные знания.
Задания с развёрнутым ответом, в отличие от заданий двух предыдущих типов, предусматривают комплексную проверку усвоения на углубленном уровне нескольких элементов содержания из различных содержательных блоков.
Методика решения задач по химии
При решении задач необходимо руководствоваться несколькими простыми правилами:
- Внимательно прочитать условие задачи;
- Записать, что дано;
- Перевести, если это необходимо, единицы физических величин в единицы системы СИ (некоторые внесистемные единицы допускаются, например литры);
- Записать, если это необходимо, уравнение реакции и расставить коэффициенты;
- Решать задачу, используя понятие о количестве вещества, а не метод составления пропорций;
- Записать ответ.
В целях успешной подготовки по химии следует внимательно рассмотреть решения задач, приводимых в тексте, а также самостоятельно решить достаточное число их. Именно в процессе решения задач будут закреплены основные теоретические положения курса химии. Решать задачи необходимо на протяжении всего времени изучения химии и подготовки к экзамену.
Вы можете использовать задачи на этой странице, а можете скачать хороший сборник задач и упражнений с решением типовых и усложненных задач (М. И. Лебедева, И. А. Анкудимова).
Моль, молярная масса
Молярная масса – это отношение массы вещества к количеству вещества, т.е.
М(х) = m(x)/ν(x), (1)
где М(х) – молярная масса вещества Х, m(x) – масса вещества Х, ν(x) – количество вещества Х. Единица СИ молярной массы – кг/моль, однако обычно используется единица г/моль. Единица массы – г, кг. Единица СИ количества вещества – моль.
Любая задача по химии решается через количество вещества. Необходимо помнить основную формулу:
ν(x) = m(x)/ М(х) = V(x)/Vm = N/NA, (2)
где V(x) – объем вещества Х(л), Vm – молярный объем газа (л/моль), N – число частиц, NA – постоянная Авогадро.
1. Определите массу иодида натрия NaI количеством вещества 0,6 моль.
Дано: ν(NaI)= 0,6 моль.
Найти: m(NaI) =?
Решение. Молярная масса иодида натрия составляет:
M(NaI) = M(Na) + M(I) = 23 + 127 = 150 г/моль
Определяем массу NaI:
m(NaI) = ν(NaI)•M(NaI) = 0,6 • 150 = 90 г.
2. Определите количество вещества атомного бора, содержащегося в тетраборате натрия Na2B4O7 массой 40,4 г.
Дано: m(Na2B4O7)=40,4 г.
Найти: ν(B)=?
Решение. Молярная масса тетрабората натрия составляет 202 г/моль. Определяем количество вещества Na2B4O7:
ν(Na2B4O7)= m(Na2B4O7)/ М( Na2B4O7) = 40,4/202=0,2 моль.
Вспомним, что 1 моль молекулы тетрабората натрия содержит 2 моль атомов натрия, 4 моль атомов бора и 7 моль атомов кислорода (см. формулу тетрабората натрия). Тогда количество вещества атомного бора равно: ν(B)= 4 • ν (Na2B4O7)=4 • 0,2 = 0,8 моль.
Расчеты по химическим формулам. Массовая доля.
Массовая доля вещества – отношение массы данного вещества в системе к массе всей системы, т.е. ω(Х) =m(Х)/m, где ω(X)– массовая доля вещества Х, m(X) – масса вещества Х, m – масса всей системы. Массовая доля – безразмерная величина. Её выражают в долях от единицы или в процентах. Например, массовая доля атомного кислорода составляет 0,42, или 42%, т.е. ω(О)=0,42. Массовая доля атомного хлора в хлориде натрия составляет 0,607, или 60,7%, т.е. ω(Cl)=0,607.
3. Определите массовую долю кристаллизационной воды в дигидрате хлорида бария BaCl2 • 2H2O.
Решение: Молярная масса BaCl2 • 2H2O составляет:
М(BaCl2 • 2H2O) = 137+ 2 • 35,5 + 2 • 18 =244 г/моль
Из формулы BaCl2 • 2H2O следует, что 1 моль дигидрата хлорида бария содержит 2 моль Н2О. Отсюда можно определить массу воды, содержащейся в BaCl2 • 2H2O:
m(H2O) = 2 • 18 = 36 г.
Находим массовую долю кристаллизационной воды в дигидрате хлорида бария BaCl2 • 2H2O.
ω(H2O) = m(H2O)/ m(BaCl2 • 2H2O) = 36/244 = 0,1475 = 14,75%.
4. Из образца горной породы массой 25 г, содержащей минерал аргентит Ag2S, выделено серебро массой 5,4 г. Определите массовую долю аргентита в образце.
Дано: m(Ag )=5,4 г; m = 25 г.
Найти: ω(Ag2S) =?
Решение: определяем количество вещества серебра, находящегося в аргентите: ν(Ag ) =m(Ag )/M(Ag ) = 5,4/108 = 0,05 моль.
Из формулы Ag2S следует, что количество вещества аргентита в два раза меньше количества вещества серебра. Определяем количество вещества аргентита:
ν( Ag2S)= 0,5 • ν (Ag) = 0,5 • 0,05 = 0,025 моль
Рассчитываем массу аргентита:
m(Ag2S) = ν( Ag2S) • М(Ag2S) = 0,025• 248 = 6,2 г.
Теперь определяем массовую долю аргентита в образце горной породы, массой 25 г.
ω(Ag2S) = m(Ag2S)/ m = 6,2/25 = 0,248 = 24,8%.
Вывод формул соединений
5. Определите простейшую формулу соединения калия с марганцем и кислородом, если массовые доли элементов в этом веществе составляют соответственно 24,7, 34,8 и 40,5%.
Дано: ω(K) =24,7%; ω(Mn) =34,8%; ω(O) =40,5%.
Найти: формулу соединения.
Решение: для расчетов выбираем массу соединения, равную 100 г, т.е. m=100 г. Массы калия, марганца и кислорода составят:
m (К) = m ω(К); m (К) = 100 • 0,247= 24,7 г;
m (Mn) = m ω(Mn); m (Mn) =100 • 0,348=34,8 г;
m (O) = m ω(O); m (O) = 100 • 0,405 = 40,5 г.
Определяем количества веществ атомных калия, марганца и кислорода:
ν(К)= m(К)/ М( К) = 24,7/39= 0,63 моль
ν(Mn)= m(Mn)/ М( Mn) = 34,8/ 55 = 0,63 моль
ν(O)= m(O)/ М(O) = 40,5/16 = 2,5 моль
Находим отношение количеств веществ:
ν(К) : ν(Mn) : ν(O) = 0,63 : 0,63 : 2,5.
Разделив правую часть равенства на меньшее число (0,63) получим:
ν(К) : ν(Mn) : ν(O) = 1 : 1 : 4.
Следовательно, простейшая формула соединения KMnO4.
6. При сгорании 1,3 г вещества образовалось 4,4 г оксида углерода (IV) и 0,9 г воды. Найти молекулярную формулу вещества, если его плотность по водороду равна 39.
Дано: m(в-ва) =1,3 г; m(СО2)=4,4 г; m(Н2О)=0,9 г; ДН2 =39.
Найти: формулу вещества.
Решение: Предположим, что искомое вещество содержит углерод, водород и кислород, т.к. при его сгорании образовались СО2 и Н2О. Тогда необходимо найти количества веществ СО2 и Н2О, чтобы определить количества веществ атомарных углерода, водорода и кислорода.
ν(СО2) = m(СО2)/ М(СО2) = 4,4/44 = 0,1 моль;
ν(Н2О) = m(Н2О)/ М(Н2О) = 0,9/18 = 0,05 моль.
Определяем количества веществ атомарных углерода и водорода:
ν(С)= ν(СО2); ν(С)=0,1 моль;
ν(Н)= 2•ν(Н2О); ν(Н)= 2 • 0,05 = 0,1 моль.
Следовательно, массы углерода и водорода будут равны:
m(С) = ν( С) • М(С) = 0,1• 12 = 1,2 г;
m(Н) = ν( Н) • М(Н) = 0,1• 1 =0,1 г.
Определяем качественный состав вещества:
m(в-ва) = m(С) + m(Н) = 1,2 + 0,1 = 1,3 г.
Следовательно, вещество состоит только из углерода и водорода (см. условие задачи). Определим теперь его молекулярную массу, исходя из данной в условии задачи плотности вещества по водороду.
М(в-ва) = 2 • ДН2 = 2 • 39 = 78 г/моль.
Далее находим отношение количеств веществ углерода и водорода:
ν(С) : ν(Н) = 0,1 : 0,1
Разделив правую часть равенства на число 0,1, получим:
ν(С) : ν(Н) = 1 : 1
Примем число атомов углерода (или водорода) за «х», тогда, умножив «х» на атомные массы углерода и водорода и приравняв эту сумму молекулярной массе вещества, решим уравнение:
12х + х = 78. Отсюда х= 6. Следовательно, формула вещества С6Н6 – бензол.
Молярный объем газов. Законы идеальных газов. Объемная доля.
Молярный объем газа равен отношению объема газа к количеству вещества этого газа, т.е.
Vm= V(X)/ ν(x),
где Vm – молярный объем газа — постоянная величина для любого газа при данных условиях; V(X) – объем газа Х; ν(x) – количество вещества газа Х. Молярный объем газов при нормальных условиях (нормальном давлении рн= 101 325 Па ≈ 101,3 кПа и температуре Тн= 273,15 К ≈ 273 К) составляет Vm= 22,4 л/моль.
В расчетах, связанных с газами, часто приходится переходить от данных условий к нормальным или наоборот. При этом удобно пользоваться формулой, следующей из объединенного газового закона Бойля-Мариотта и Гей-Люссака:
pV pнVн
──── = ─── (3)
Т Тн
Где p – давление; V – объем; Т- температура в шкале Кельвина; индекс «н» указывает на нормальные условия.
Состав газовых смесей часто выражают при помощи объемной доли – отношения объема данного компонента к общему объему системы, т.е.
φ(Х) = V(X)/V
где φ(Х) – объемная доля компонента Х; V(X) – объем компонента Х; V — объем системы. Объемная доля – безразмерная величина, её выражают в долях от единицы или в процентах.
7. Какой объем займет при температуре 20оС и давлении 250 кПа аммиак массой 51 г?
Дано: m(NH3)=51 г; p=250 кПа; t=20oC.
Найти: V(NH3) =?
Решение: определяем количество вещества аммиака:
ν(NH3) = m(NH3)/ М(NH3) = 51/17 = 3 моль.
https://5-ege.ru/kak-reshat-zadachi-po-ximii/
Объем аммиака при нормальных условиях составляет:
V(NH3) = Vm • ν(NH3) = 22,4 • 3 = 67,2 л.
Используя формулу (3), приводим объем аммиака к данным условиям [температура Т= (273 +20)К = 293 К]:
pнTVн(NH3) 101,3•293•67,2
V(NH3) =──────── = ───────── = 29,2 л.
pТн 250•273
8. Определите объем, который займет при нормальных условиях газовая смесь, содержащая водород, массой 1,4 г и азот, массой 5,6 г.
Дано: m(N2)=5,6 г; m(H2)=1,4 ; н.у.
Найти: V(смеси)=?
Решение: находим количества вещества водорода и азота:
ν(N2) = m(N2)/ М(N2) = 5,6/28 = 0,2 моль
ν(H2) = m(H2)/ М(H2) = 1,4/ 2 = 0,7 моль
Так как при нормальных условиях эти газы не взаимодействуют между собой, то объем газовой смеси будет равен сумме объемов газов, т.е.
V(смеси)=V(N2) + V(H2)=Vm•ν(N2) + Vm•ν(H2) = 22,4•0,2 + 22,4•0,7 = 20,16 л.
Расчеты по химическим уравнениям
Расчеты по химическим уравнениям (стехиометрические расчеты) основаны на законе сохранения массы веществ. Однако в реальных химических процессах из-за неполного протекания реакции и различных потерь веществ масса образующихся продуктов часто бывает меньше той, которая должна образоваться в соответствии с законом сохранения массы веществ. Выход продукта реакции (или массовая доля выхода) – это выраженное в процентах отношение массы реально полученного продукта к его массе, которая должна образоваться в соответствии с теоретическим расчетом, т.е.
η = [mp(X) •100]/m(X) (4)
Где η– выход продукта, %; mp(X) — масса продукта Х, полученного в реальном процессе; m(X) – рассчитанная масса вещества Х.
В тех задачах, где выход продукта не указан, предполагается, что он – количественный (теоретический), т.е. η=100%.
9. Какую массу фосфора надо сжечь для получения оксида фосфора (V) массой 7,1 г?
Дано: m(P2O5)=7,1 г.
Найти: m(Р) =?
Решение: записываем уравнение реакции горения фосфора и расставляем стехиометрические коэффициенты.
4P+ 5O2 = 2P2O5
Определяем количество вещества P2O5, получившегося в реакции.
ν(P2O5) = m(P2O5)/ М(P2O5) = 7,1/142 = 0,05 моль.
Из уравнения реакции следует, что ν(P2O5)= 2•ν(P), следовательно, количество вещества фосфора, необходимого в реакции равно:
ν(P2O5)= 2•ν(P) = 2• 0,05= 0,1 моль.
Отсюда находим массу фосфора:
m(Р) = ν(Р) • М(Р) = 0,1• 31 = 3,1 г.
10. В избытке соляной кислоты растворили магний массой 6 г и цинк массой 6,5 г. Какой объем водорода, измеренный при нормальных условиях, выделится при этом?
Дано: m(Mg)=6 г; m(Zn)=6,5 г; н.у.
Найти: V(H2) =?
Решение: записываем уравнения реакции взаимодействия магния и цинка с соляной кислотой и расставляем стехиометрические коэффициенты.
Zn + 2 HCl = ZnCl2 + H2↑
Mg + 2 HCl = MgCl2 + H2↑
Определяем количества веществ магния и цинка, вступивших в реакцию с соляной кислотой.
ν(Mg) = m(Mg)/ М(Mg ) = 6/24 = 0,25 моль
ν(Zn) = m(Zn)/ М(Zn) = 6,5/65 = 0,1 моль.
Из уравнений реакции следует, что количество вещества металла и водорода равны, т.е. ν(Mg) = ν(Н2); ν(Zn) = ν(Н2), определяем количество водорода, получившегося в результате двух реакций:
ν(Н2) = ν(Mg) + ν(Zn) = 0,25 + 0,1= 0,35 моль.
Рассчитываем объем водорода, выделившегося в результате реакции:
V(H2) = Vm • ν(H2) = 22,4 • 0,35 = 7,84 л.
11. При пропускании сероводорода объемом 2,8 л (нормальные условия) через избыток раствора сульфата меди (II) образовался осадок массой 11,4 г. Определите выход продукта реакции.
Дано: V(H2S)=2,8 л; m(осадка)= 11,4 г; н.у.
Найти: η =?
Решение: записываем уравнение реакции взаимодействия сероводорода и сульфата меди (II).
H2S + CuSO4 = CuS ↓+ H2SO4
Определяем количество вещества сероводорода, участвующего в реакции.
ν(H2S) = V(H2S) / Vm = 2,8/22,4 = 0,125 моль.
Из уравнения реакции следует, что ν(H2S) = ν(СuS) = 0,125 моль. Значит можно найти теоретическую массу СuS.
m(СuS) = ν(СuS) • М(СuS) = 0,125 • 96 = 12 г.
Теперь определяем выход продукта, пользуясь формулой (4):
η = [mp(X) •100]/m(X)= 11,4 • 100/ 12 = 95%.
12. Какая масса хлорида аммония образуется при взаимодействии хлороводорода массой 7,3 г с аммиаком массой 5,1 г? Какой газ останется в избытке? Определите массу избытка.
Дано: m(HCl)=7,3 г; m(NH3)=5,1 г.
Найти: m(NH4Cl) =? m(избытка) =?
Решение: записываем уравнение реакции.
HCl + NH3 = NH4Cl
Эта задача на «избыток» и «недостаток». Рассчитываем количества вещества хлороводорода и аммиака и определяем, какой газ находится в избытке.
ν(HCl) = m(HCl)/ М(HCl) = 7,3/36,5 = 0,2 моль;
ν(NH3) = m(NH3)/ М(NH3) = 5,1/ 17 = 0,3 моль.
Аммиак находится в избытке, поэтому расчет ведем по недостатку, т.е. по хлороводороду. Из уравнения реакции следует, что ν(HCl) = ν(NH4Cl) = 0,2 моль. Определяем массу хлорида аммония.
m(NH4Cl) = ν(NH4Cl) • М(NH4Cl) = 0,2• 53,5 = 10,7 г.
Мы определили, что аммиак находится в избытке (по количеству вещества избыток составляет 0,1 моль). Рассчитаем массу избытка аммиака.
m(NH3) = ν(NH3) • М(NH3) = 0,1• 17 = 1,7 г.
13. Технический карбид кальция массой 20 г обработали избытком воды, получив ацетилен, при пропускании которого через избыток бромной воды образовался 1,1,2,2 –тетрабромэтан массой 86,5 г. Определите массовую долю СаС2 в техническом карбиде.
Дано: m = 20 г; m(C2H2Br4)=86,5 г.
Найти: ω(СаC2) =?
Решение: записываем уравнения взаимодействия карбида кальция с водой и ацетилена с бромной водой и расставляем стехиометрические коэффициенты.
CaC2 +2 H2O = Ca(OH)2 + C2H2
C2H2 +2 Br2 = C2H2Br4
Находим количество вещества тетрабромэтана.
ν(C2H2Br4) = m(C2H2Br4)/ М(C2H2Br4) = 86,5/ 346 = 0,25 моль.
Из уравнений реакций следует, что ν(C2H2Br4) =ν(C2H2) = ν(СаC2) =0,25 моль. Отсюда мы можем найти массу чистого карбида кальция (без примесей).
m(СаC2) = ν(СаC2) • М(СаC2) = 0,25• 64 = 16 г.
Определяем массовую долю СаC2 в техническом карбиде.
ω(СаC2) =m(СаC2)/m = 16/20 = 0,8 = 80%.
Растворы. Массовая доля компонента раствора
14. В бензоле объемом 170 мл растворили серу массой 1,8 г. Плотность бензола равна 0,88 г/мл. Определите массовую долю серы в растворе.
Дано: V(C6H6) =170 мл; m(S) = 1,8 г; ρ(С6C6)=0,88 г/мл.
Найти: ω(S) =?
Решение: для нахождения массовой доли серы в растворе необходимо рассчитать массу раствора. Определяем массу бензола.
m(С6C6) = ρ(С6C6) •V(C6H6) = 0,88•170 = 149,6 г.
Находим общую массу раствора.
m(р-ра) = m(С6C6) + m(S) =149,6 + 1,8 = 151,4 г.
Рассчитаем массовую долю серы.
ω(S) =m(S)/m=1,8 /151,4 = 0,0119 = 1,19 %.
15. В воде массой 40 г растворили железный купорос FeSO4•7H2O массой 3,5 г. Определите массовую долю сульфата железа (II) в полученном растворе.
Дано: m(H2O)=40 г; m(FeSO4•7H2O)=3,5 г.
Найти: ω(FeSO4) =?
Решение: найдем массу FeSO4 содержащегося в FeSO4•7H2O. Для этого рассчитаем количество вещества FeSO4•7H2O.
ν(FeSO4•7H2O)=m(FeSO4•7H2O)/М(FeSO4•7H2O)=3,5/278=0,0125моль
Из формулы железного купороса следует, что ν(FeSO4)= ν(FeSO4•7H2O)=0,0125 моль. Рассчитаем массу FeSO4:
m(FeSO4) = ν(FeSO4) • М(FeSO4) = 0,0125•152 = 1,91 г.
Учитывая, что масса раствора складывается из массы железного купороса (3,5 г) и массы воды (40 г), рассчитаем массовую долю сульфата железа в растворе.
ω(FeSO4) =m(FeSO4)/m=1,91 /43,5 = 0,044 =4,4 %.
Задачи для самостоятельного решения
- На 50 г йодистого метила в гексане подействовали металлическим натрием, при этом выделилось 1,12 л газа, измеренного при нормальных условиях. Определите массовую долю йодистого метила в растворе. Ответ: 28,4%.
- Некоторый спирт подвергли окислению, при этом образовалась одноосновная карбоновая кислота. При сжигании 13,2 г этой кислоты получили углекислый газ, для полной нейтрализации которого потребовалось 192 мл раствора КОН с массовой долей 28%. Плотность раствора КОН равна 1,25 г/мл. Определите формулу спирта. Ответ: бутанол.
- Газ, полученный при взаимодействии 9,52 г меди с 50 мл 81 % раствора азотной кислоты, плотностью 1,45 г/мл, пропустили через 150 мл 20 % раствора NaOH плотностью 1,22 г/мл. Определите массовые доли растворенных веществ. Ответ: 12,5% NaOH; 6,48% NaNO3; 5,26% NaNO2.
- Определите объем выделившихся газов при взрыве 10 г нитроглицерина. Ответ: 7,15 л.
- Образец органического вещества массой 4,3 г сожгли в кислороде. Продуктами реакции являются оксид углерода (IV) объемом 6,72 л (нормальные условия) и вода массой 6,3 г. Плотность паров исходного вещества по водороду равна 43. Определите формулу вещества. Ответ: С6Н14.
Рекомендуем:
Чтобы поделиться, нажимайте
Задания ЕГЭ по номерам (по темам)
Предлагаем вам Задания ЕГЭ по номерам формата ЕГЭ 2022 по химии с ответами и видео-объяснениями. Листайте ниже и выбирайте тот номер задания, который вы хотите выполнить.
- Первая часть (указывается только ответ, без решения)
1. Электронная конфигурация атома
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
2. Закономерности изменения химических свойств элементов. Характеристика элементов
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
3. Электроотрицательность, степень окисления и валентность химических элементов
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
4. Характеристики химических связей. Зависимость свойств веществ от их состава и строения
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
5. Классификация и номенклатура неорганических веществ
- Часть 1 (30 заданий с ответами) — старый формат
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения) — старый формат
- Часть 3 (10 заданий с ответами) — новый формат 2022 года
6. Свойства оснований, амфотерных гидроксидов, кислот и солей. Ионный обмен и диссоциация
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
7. Свойства неорганических веществ
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
8. Свойства неорганических веществ
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
9. Взаимосвязь неорганических веществ
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
10. Классификация и номенклатура органических веществ
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
11. Теория строения органических соединений. Типы связей в молекулах органических веществ. Изомеры. Гомологи
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
12. Свойства углеводородов и кислородосодержащих соединений. Получение углеводородов и кислородосодержащих соединений
- Часть 1 (30 заданий с ответами) — старый формат
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения) — старый формат
- Часть 3 (30 заданий с ответами) — старый формат
- Часть 4 (30 заданий с ответами, а для некоторых заданий — видеообъяснения) — старый формат
- Часть 5 (5 заданий с ответами) — новый формат 2022 года
13. Свойства азотсодержащих органических соединений. Белки, жиры, углеводы
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
14. Характерные химические свойства углеводородов. Механизмы реакций
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
15. Свойства спиртов, альдегидов, кислот, сложных эфиров, фенола
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
16. Взаимосвязь углеводородов и кислородосодержащих органических соединений
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
17. Классификация химических реакций в неорганической и органической химии
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
18. Скорость реакции, ее зависимость от различных факторов
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
19. Реакции окислительно-восстановительные
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
20. Электролиз расплавов и растворов
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
21. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная. pH
- Часть 1 (30 заданий с ответами) — старый формат
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения) — старый формат
- Часть 3 (5 заданий с ответами) — новый формат 2022 года
22. Обратимые и необратимые химические реакции. Химическое равновесие
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
23. Химическое равновесие. Расчёты концентраций — новое задание 2022 года
- Часть 1 (5 заданий с ответами)
24. Качественные реакции органических и неорганических соединений
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
25. Химическая лаборатория. Химическая промышленность. Полимеры
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
26. Расчёты с использованием понятия «массовая доля вещества в растворе»
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
27. Расчеты теплового эффекта (по термохимическим уравнениям)
- Часть 1 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
28. Расчет массы или объёма вещества по параметрам одного из участвующих в реакции веществ. Выход продукта. Примеси. Массовая доля вещества в смеси
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
- Часть 3 (29 заданий с ответами, а для некоторых заданий — видеообъяснения)
- Часть 4 (5 заданий с ответами, а для некоторых заданий — видеообъяснения) — задачи, которых не было до 2022 года
- Вторая часть (оформляется подробным решением на бланках ответов)
29. Окислительно-восстановительные реакции
- Часть 1 (30 заданий с ответами)
- Часть 2 (17 заданий с ответами, реальный ЕГЭ 2018)
- Часть 3 (22 задания с ответами, а также для некоторых заданий — видеообъяснения)
- Часть 4 (23 задания с ответами, реальный ЕГЭ 2019)
- Часть 5 (33 задания с ответами, реальный ЕГЭ 2020)
30. Реакции ионного обмена
- Часть 1 (30 заданий с ответами)
- Часть 2 (17 заданий с ответами, реальный ЕГЭ 2018)
- Часть 3 (22 задания с ответами, а также для некоторых заданий — видеообъяснения)
- Часть 4 (23 заданий с ответами, реальный ЕГЭ 2019)
- Часть 5 (32 задания с ответами, реальный ЕГЭ 2020)
31. Взаимосвязь различных классов неорганических веществ: описание реакций
- Часть 1 (30 заданий с ответами)
- Часть 2 (17 заданий с ответами, реальный ЕГЭ 2018)
- Часть 3 (22 задания с ответами, а также для некоторых заданий — видеообъяснения)
- Часть 4 (23 задания с ответами, реальный ЕГЭ 2019)
- Часть 5 (36 заданий с ответами, реальный ЕГЭ 2020)
32. Взаимосвязь органических соединений
- Часть 1 (30 заданий с ответами)
- Часть 2 (17 заданий с ответами, реальный ЕГЭ 2018)
- Часть 3 (22 задания с ответами, а также для некоторых заданий — видеообъяснения)
- Часть 4 (23 задания с ответами, реальный ЕГЭ 2019)
- Часть 5 (35 заданий с ответами, реальный ЕГЭ 2020)
33. Расчёты с использованием понятий растворимость, массовая доля вещества в растворе, избыток, примеси. Расчёты массовой доли химического соединения (атомов элемента) в смеси
- Часть 1 (17 задач с решениями и видео-объяснениями, реальный ЕГЭ 2018)
- Часть 2 (30 задач с решениями и видео-объяснениями, реальный ЕГЭ 2019)
- Часть 3 (27 задач с решениями и видео-объяснениями, пробные и тренеровочные варианты)
- Часть 4 (43 задачи с решениями и видео-объяснениями, реальный ЕГЭ 2020)
- Часть 5. Задачи на «атомистику» (66 задач с видео-объяснениями, появились на ЕГЭ 2020)
- Часть 6 (16 задач с видео-объяснениями и ответами, реальный ЕГЭ 2021)
- Часть 7 (38 задач с видео-объяснениями и ответами, возможные задачи ЕГЭ 2022)
34. Нахождение молекулярной и структурной формулы органического вещества
- Часть 1 (17 задач с решениями и видео-объяснениями, реальный ЕГЭ 2018)
- Часть 2 (21 задача с решениями и видео-объяснениями, реальные ЕГЭ 2019)
- Часть 3 (27 задач с решениями и видео-объяснениями, пробные и тренеровочные варианты)
- Часть 4 (43 задачи с решениями и видео-объяснениями, реальный ЕГЭ 2020)
- Часть 5 (31 задача с решениями и видео-объяснениями, возможные задачи ЕГЭ 2022)
Задания ЕГЭ 2021, которых НЕ будет в таком формате в ЕГЭ 2022:
Химические свойства неорганических веществ
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Реальный вариант ЕГЭ по химии 2021. Центр
- Реальный вариант ЕГЭ по химии 2021. Сибирь
- Реальный вариант ЕГЭ по химии 2021. Урал
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
- Все видео-объяснения вы можете найти на YouTube канале, нажав на эту строку
-
ЗАНЯТИЕ 1. СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКИЙ ЗАКОН
А
КАК ЗАПОЛНЯЮТСЯ ОРБИТАЛИ?
Э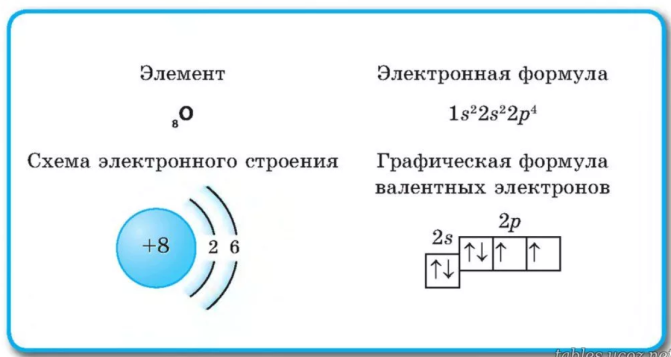
-
Принцип минимума энергии. Электрон «стремится» занять положени в атоме с наименьшей энергией. То есть электроны сначала «заселяют» низкоэнергетические орбитали. Рейтинг желаемых орбиталей выглядит так: 1s22s22p63s23p64s23d104p65s24d105р66s25d14f14…
Как будто электроны сначала выбирают малозаселённые этажи с небольшим количеством квартир. -
Принцип Паули. В атоме не может быть двух электронов с одинаковыми свойствами. То есть на каждой орбитали может находиться либо один неспаренный электрон, либо два электрона с разными спинами. Это похоже на дорогу с двусторонним движением: либо едет один автомобиль, либо два, но навстречу друг другу.
-
Правило Хунда. Наиболее устойчивое (основное) состояние атома достигается тогда, когда на одном уровне находится как можно больше неспаренных электронов. Можно провести такую аналогию: электроны сначала селятся по одному, а потом ищут себе пару.


ЗАНЯТИЕ 2. ИЗМЕНЕНИЕ СВОЙСТВ В ПЕРИОДАХ И ГРУППАХ
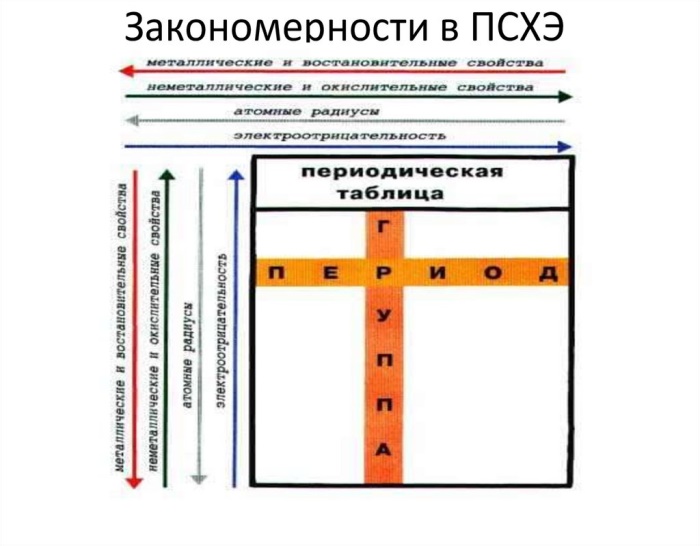
ЗАНЯТИЕ 3. ТИПЫ ХИМИЧЕСКИХ СВЯЗЕЙ
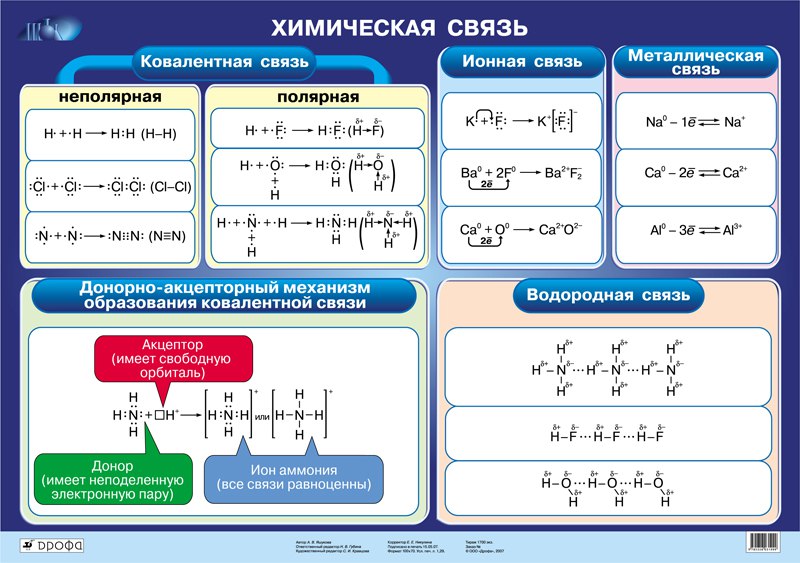

ЗАНЯТИЕ 4. КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ

ЗАНЯТИЕ 5. ОКСИДЫ И ОСНОВАНИЯ. ИХ СВОЙСТВА И СПОСОБЫ ПОЛУЧЕНИЯ
Общие методы получения оксидов:
-
Окисление простых и сложных веществ кислородом:

ОСНОВНЫЕ ОКСИДЫ

+ кислотный оксид
Основный оксид + кислота = соль (ПРИ НАГРЕВАНИИ!)
+ амфотерный оксид
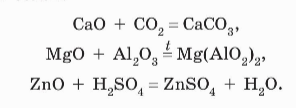
Оксиды щелочных и щелочноземельных металлов реагируют с водой с образованием оснований: