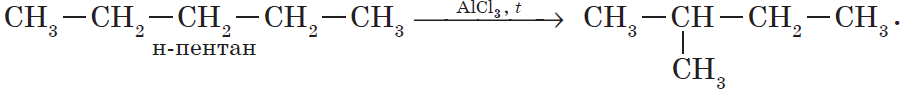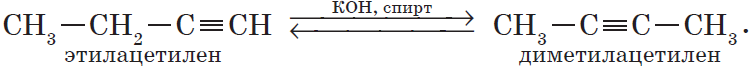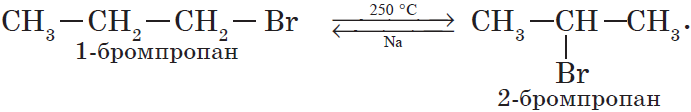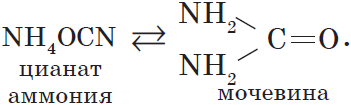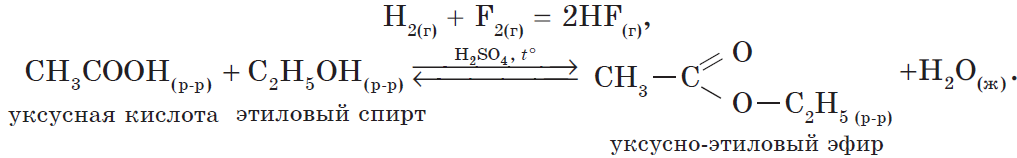Пройти тестирование по 10 заданиям
Пройти тестирование по всем заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Тип 19 № 32
Установите соответствие между уравнением реакции и свойством азота, которое он проявляет в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СВОЙСТВО АЗОТА
1) окислитель
2) восстановитель
3) и окислитель, и восстановитель
4) не окислитель, не восстановитель
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Демонстрационная версия ЕГЭ—2012 по химии
2
Установите соответствие между уравнением реакции и изменением степени окисления восстановителя в данной реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ
1) 0 → +6
2) 0 → −2
3) −1 → 0
4) +6 → +4
5) −2 → 0
6) +4 → +2
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 1
3
Установите соответствие между уравнением реакции и изменением степени окисления восстановителя в данной реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ
1) 0 → +1
2) 0 → −2
3) −1 → 0
4) +6 → +4
5) +4 → +5
6) +4 → +6
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 2
4
Установите соответствие между формулой заряженной частицы и степенью окисления хрома в ней: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ЗАРЯЖЕННОЙ ЧАСТИЦЫ
СТЕПЕНЬ ОКИСЛЕНИЯ ХРОМА
1) +1
2) +2
3) +3
4) +4
5) +5
6) +6
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 4
5
Установите соответствие между уравнением реакции и изменением степени окисления восстановителя в данной реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ
1) +2 → 0
2) −3 → 0
3) 0 → −2
4) −2 → +4
5) −3 → +3
6) 0 → +1
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Сибирь. Вариант 1
Пройти тестирование по этим заданиям
За это задание ты можешь получить 1 балл. На решение дается около 7 минут. Уровень сложности: базовый.
Средний процент выполнения: 75.2%
Ответом к заданию 19 по химии может быть последовательность цифр, чисел или слов. Порядок записи имеет значение.
Разбор сложных заданий в тг-канале
Задачи для практики
Задача 1
Установите соответствие между изменением степени окисления хрома и уравнением реакции, в которой это изменение происходит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ | УРАВНЕНИЕ РЕАКЦИИ |
| А) $Cr^{+3} → Cr^{0}$ Б) $Cr^{+6} → Cr^{0}$ В) $Cr^{0} → Cr^{+3}$ |
1) $2Cr + 6H_2SO_{4(конц.)} = Cr_2(SO_4)_3 + 3SO_2 + 6H_2O$ 2) $2CrO_3 + 3H_2S_{(р-р)} = 2Cr(OH)_3 + 3S$ 3) $K_2Cr_2O_7 + 4Al = 2Cr + Al_2O_3 + 2KAlO_2$ 4) $Cr_2O_3 + 3Ca = 2Cr + 3CaO$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
1)в 4 реакции хром- восстановитель, понижает степень окисления с +3 до 0, следовательно, выбираем А
2) в 3 реакции хром -восстановитель, понижает степень окисления с +6 до 0, следовательно, выбираем Б
3) в 1 реакции хром- окислитель, повышает степень окисления с 0 до +3, следовательно, выбираем В
Ответ: 431
Задача 2
Установите соответствие между схемой изменения степени окисления хлора в реакции и формулами веществ, которые вступают в эту реакцию: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ | ФОРМУЛЫ ИСХОДНЫХ ВЕЩЕСТВ |
| А) $Cl^0 → Cl^{–1}$ Б) $Cl^{–1} → Cl^0$ В) $Cl^{+5} → Cl^{–1}$ |
1) $KClO_3$ (нагревание) 2) $Cl_2$ и NaOH (гор. раствор) 3) KCl и $H_2SO_4$ (конц.) 4) HCl и $F_2$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
Рассмотрим указанные реакции
А: $Cl_2 + 2NaOH = NaClO + NaCl + H_2O$
Хлор в данной реакции является и окислителем и восстановителем, в одном случае он стал +1, а в другом -1.
Б: Фтор вытесняет хлор, тем самым окисляя его до $Cl_2$.
В: $4KClO_3 = 3KClO_4 + KCl$
Хлор снова проявляет свойства как окислителя, так и восстановителя.
Ответ: 241
Задача 3
Установите соответствие между уравнением реакции и изменением степени окисления восстановителя в ней: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| УРАВНЕНИЕ РЕАКЦИИ | ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ |
| А) $2NH_3 + 2Li = 2LiNH_2 + H2_$ Б) $H_2S + 2Na = Na_2S + H_2$ В) $4NH_3 + 6NO = 5N_2 + 6H_2O$ |
1) от +2 до 0 2) от –3 до 0 3) от 0 до –2 4) от –2 до +4 5) от 0 до +1 |
Запишите выбранные цифры под соответствующими буквами.
Решение
Восстановитель повышает степень окисления, поэтому варианты 1 и 3 не подходят сразу. Типичными восстановителями являются металлы. В реакции А это литий, в реакции Б — натрий, оба повышают степень окисления от 0 до +1. В реакции В, восстановителем является азот в степени -3, окисляется он до степени 0, так как стал простым веществом.
Ответ: 552
Задача 4
Установите соответствие между схемой окислительно-восстановительной реакции и свойством азота, которое он проявляет в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | СВОЙСТВО АЗОТА |
| А) $2NO + O_2 → 2NO_2$ Б) $СuО + NH_3 → N_2 + Cu + Н_2O$ В) $NH_3 + O_2 → N_2 + Н_2O$ |
1) окислитель 2) восстановитель 3) и окислитель, и восстановитель 4) не проявляет окислительно-восстановительных свойств |
Запишите выбранные цифры под соответствующими буквами.
Решение
Окислитель понижает свою степень окисления, а восстановитель ее повышает. Исходя из этого рассмотрим три реакции:
А) Азот повышает степень с +2 до +4, поэтому он восстановитель.
Б) Азот до реакции имеет степень -3, после реакции ноль, опять восстановитель.
В) В этой реакции все точно также.
Ответ: 222
Задача 5
Установите соответствие между схемой химической реакции и изменением степени окисления окислителя: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ОКИСЛИТЕЛЯ |
| А) $FeCl_3 + HI → FeCl_2 + I_2 + HCl$ Б) $FeCl_2 + Cl_2 → FeCl_3$ В) $Fe_3O_4 + HI → FeI_2 + I_2 + H_2O$ |
1) $I^{–1} → I^0$ 2) $Fe^{+3} → Fe^{+2}$ 3) $Cl^0 → Cl^{–1}$ 4) $Fe^{+2} → Fe^{+3}$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
В окислительно-восстановительных реакциях окислитель принимает электроны и понижает свою степень окисления. Вычисляем степени окисления элементов и устанавливаем соответствие между схемой реакции и превращением окислителя.
1) $Fe^{+3}Cl_3^{–1} + H^{+1}I^{–1} → Fe^{+2}Cl_2^{–1} + I_2^{0} + H^{+1}Cl^{–1}$ (А — 2)
2) $Fe^{+2}Cl_2^{–1} + Cl_2^{0} → Fe^{+3}Cl_3^{–1}$ (Б — 3)
3) $Fe^{+2}O^{–2} · Fe_2^{+3}O_3^{–2} + H^{+1}I^{–1} → Fe^{+2}I_2^{–1} + I_2^{0} + H_2^{+1}O^{–2}$ (В — 2)
Ответ: 232
Задача 6
Установите соответствие между схемой окислительно-восстановительной реакции и свойством фосфора, которое он проявляет в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | СВОЙСТВО ФОСФОРА |
| А) $P_4 + KOH + H_2O →KH_2PO_2 + PH_3$ Б) $PCl_5 + KOH → KCl + K_3PO_4 + H_2O$ В) $P_2O_5 + C → P + CO$ |
1) является окислителем 2) является восстановителем 3) является и окислителем, и восстановителем 4) не проявляет окислительно-восстановительных свойств |
Запишите выбранные цифры под соответствующими буквами.
Решение
Окислитель принимает электроны и уменьшает степень окисления. Восстановитель отдаёт электроны и повышает степень окисления. Свойства и окислителя, и восстановителя проявляются в реакциях диспропорционирования, в которых атомы одного и того же элемента, находящие в одной степени, участвуют в окислительновосстановительной реакции.
А) $P_4^0 + KOH + H_2O → KH_2P^{+1}O_2 + P^{–3}H_3$
Степень окисления фосфора и увеличилась ($P^0 → P^{+1}$) и уменьшилась ($P^0 → P^{–3}$), то есть проявляет свойства и окислителя, и восстановителя. Ответ А — 3.
Б) $P^{+5}Cl_5 + KOH → KCl + K_3P^{+5}O_4 + H_2O$
Степень окисления фосфора не изменяется ($P^{+5} → P^{+5}$), то есть не проявляет окислительно-восстановительных свойств. Ответ Б — 4.
В) $P_2^{+5}O_5 + C → P^0 + CO$
Степень окисления фосфора уменьшается ($P^{+5} → P^0$), то есть фосфор проявляет свойства окислителя. Ответ В — 1.
Ответ: 341
Задача 7
Установите соответствие между изменением степени окисления серы в реакции и формулами веществ, которые вступают в эту реакцию: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ | ФОРМУЛЫ ВЕЩЕСТВ |
| А) $S^{+4} → S^{+6}$ Б) $S^{–2} → S^0$ В) $S^{+6} → S^{+4}$ |
1) Cu и $H_2SO_4$ (разб.) 2) $H_2S$ и $O_2$ 3) S и $H_2SO_4$ (конц.) 4) $SO_2$ и $O_2$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
Степень окисления — условный заряд атома в соединении, вычисленный исходя из предположения, что все связи в соединении — ионные, т. е. электронные пары полностью смещены к атому с большей электроотрицательностью. Степень окисления вычисляют исходя из требования: сумма всех положительных и всех отрицательных зарядов должна равняться нулю, то есть соединение должно быть электронейтральным.
Составляем уравнения реакций и вычисляем степени окисления серы:
1) $Cu^{0} + H_2^{+}S^{+6}O^{–2}_{4(разб.)} ≠$
2) $2H_2^{+1}S^{–2} + O_2^0= 2S^{0} + 2H_2^{+1}O^{–2}$ (Б — 2)
3) $S^0 + 2H_2^{+1}S^{+6}O^{–2}_{4(конц.)} = 3S^{+4}O^{–2}_2 + 2H_2^{+1}O^{–2}$ (В — 3)
4) $2S^{+4}O_2^{–2} + O_2^0= 2S^{+6}O_3^{–2}$ (А — 4)
Ответ: 423
Рекомендуемые курсы подготовки
7922. Установите соответствие между схемой реакции и свойством элемента серы, которое она проявляет в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) Na2SO3 → Na2S + Na2SO4
Б) FeSO4 + O2 + H2SO4 → Fe2(SO4)3 + H2O
В) BaSO4 + C → BaS + CO
СВОЙСТВО СЕРЫ
1) окислитель
2) восстановитель
3) и окислитель, и восстановитель
4) не проявляет окислительно-восстановительных свойств

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7922.
7887. Установите соответствие между уравнением реакции и формулой вещества, которое в данной реакции является окислителем: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
УРАВНЕНИЕ РЕАКЦИИ
А) 2SO3 + 2KI = I2 + SO2 + K2SO4
Б) S + 3NO2 = SO3 + 3NO
В) 2S + C = CS2
ФОРМУЛА ОКИСЛИТЕЛЯ
1) NO2
2) S
3) SO3
4) C

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7887.
7852. Установите соответствие между формулой вещества и степенью окисления азота в нём: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) Ca(NO3)2
Б) NF3
В) NH4HCO3
СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА
1) -3
2) -1
3) +3
4) +5

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7852.
7817. Установите соответствие между схемой реакции и формулой недостающего в ней вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) H2S + Cl2 → … + HCl
Б) Cu + H2SO4 (конц.) → CuSO4 + … + H2O
В) S + HNO3 (конц.) → … + NO2 + H2O
ФОРМУЛА ВЕЩЕСТВА
1) SO2
2) H2SO4
3) SO3
4) S

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7817.
7782. Установите соответствие между схемой реакции и формулой недостающего в ней вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) H2S + O2 (изб.) → H2O + …
Б) FeS2 + O2 → Fe2O3 + …
В) H2SO4 (разб.) + Al → Al2(SO4)3 + …
ФОРМУЛА ВЕЩЕСТВА
1) SO3
2) SO2
3) H2S
4) H2

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7782.
7747. Установите соответствие между изменением степени окисления хлора в реакции и веществами, которые вступают в эту реакцию: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ
А) Cl-1 → Cl0
Б) Cl0 → Cl+5
В) Cl0 → Cl-1
ИСХОДНЫЕ ВЕЩЕСТВА
1) Cl2 и NaOH (гор. р-р)
2) KCl и H2SO4 (конц.)
3) HCl и MnO2
4) KCl и O2

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7747.
7712. Установите соответствие между уравнением реакции и изменением степени окисления окислителя в данной реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
УРАВНЕНИЕ РЕАКЦИИ
А) 4NH3 + 6NO = 5N2 + 6H2O
Б) SO2 + NO2 = SO3 + NO
В) 2NH3 + 2Na = 2NaNH2 + H2
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ОКИСЛИТЕЛЯ
1) -1 → 0
2) +4 → +2
3) +1 → 0
4) +2 → 0

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7712.
7677. Установите соответствие между формулой частицы и способностью этой частицы проявлять окислительно-восстановительные свойства: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ЧАСТИЦЫ
А) SO32-
Б) C-4
В) N-3
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА
1) только окислитель
2) только восстановитель
3) и окислитель, и восстановитель
4) не проявляет окислительно-восстановительных свойств

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7677.
7642. Установите соответствие между уравнением окислительно-восстановительной реакции и изменением степени окисления серы в ней: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
УРАВНЕНИЕ РЕАКЦИИ
А) 2H2S + 3O2 = 2H2O + 2SO2
Б) 2Al + 3S = Al2S3
В) 2SO2 + O2 = 2SO3
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ СЕРЫ
1) от -2 до +4
2) от 0 до -2
3) от +6 до +4
4) от +4 до +6

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7642.
7607. Установите соответствие между схемой реакции и формулой вещества-восстановителя в ней: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) H2O2 + Cl2 → HCl + O2
Б) Cl2 + KOH → KCl + KClO + H2O
В) H2O2 + Ag2O → Ag + O2 + H2O
ФОРМУЛА ВОССТАНОВИТЕЛЯ
1) KOH
2) Cl2
3) H2O2
4) Ag2O

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7607.
Для вас приятно генерировать тесты, создавайте их почаще
Классификация химических реакций в неорганической и органической химии
Химические реакции, или химические явления, — это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и (или) строению.
При химических реакциях обязательно происходит изменение веществ, при котором рвутся старые и образуются новые связи между атомами.
Химические реакции следует отличать от ядерных реакций. В результате химической реакции общее число атомов каждого химического элемента и его изотопный состав не меняются. Иное дело ядерные реакции — процессы превращения атомных ядер в результате их взаимодействия с другими ядрами или элементарными частицами, например, превращение алюминия в магний:
$↙{13}↖{27}{Al}+ {}↙{1}↖{1}{H}={}↙{12}↖{24}{Mg}+{}↙{2}↖{4}{He}$
Классификация химических реакций многопланова, т.е. в ее основу могут быть положены различные признаки. Но под любой из таких признаков могут быть отнесены реакции как между неорганическими, так и между органическими веществами.
Рассмотрим классификацию химических реакций по различным признакам.
Классификация химических реакций по числу и составу реагирующих веществ. Реакции, идущие без изменения состава вещества
В неорганической химии к таким реакциям можно отнести процессы получения аллотропных модификаций одного химического элемента, например:
$С_{(графит)}⇄С_{(алмаз)}$
$S_{(ромбическая)}⇄S_{(моноклинная)}$
$Р_{(белый)}⇄Р_{(красный)}$
$Sn_{(белое олово)}⇄Sn_{(серое олово)}$
$3О_{2(кислород)}⇄2О_{3(озон)}$.
В органической химии к этому типу реакций могут быть отнесены реакции изомеризации, которые идут без изменения не только качественного, но и количественного состава молекул веществ, например:
1. Изомеризация алканов.
Реакция изомеризации алканов имеет большое практическое значение, т.к. углеводороды изостроения обладают меньшей способностью к детонации.
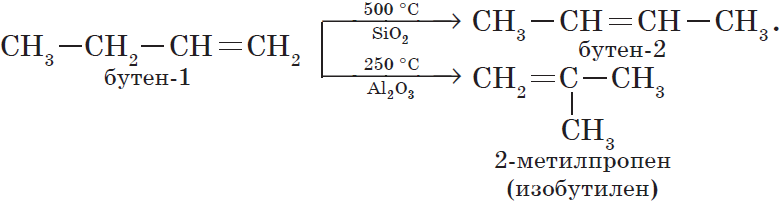
2. Изомеризация алкенов.
3. Изомеризация алкинов (реакция А. Е. Фаворского).
4. Изомеризация галогеналканов (А. Е. Фаворский).
5. Изомеризация цианата аммония при нагревании.
Впервые мочевина была синтезирована Ф. Велером в 1882 г. изомеризацией цианата аммония при нагревании.
Реакции, идущие с изменением состава вещества
Можно выделить четыре типа таких реакций: соединения, разложения, замещения и обмена.
1. Реакции соединения — это такие реакции, при которых из двух и более веществ образуется одно сложное вещество.
В неорганической химии все многообразие реакций соединения можно рассмотреть на примере реакций получения серной кислоты из серы:
1) получение оксида серы (IV):
$S+O_2=SO_2$ — из двух простых веществ образуется одно сложное;
2) получение оксида серы (VI):
$2SO_2+O_2{⇄}↖{t,p,кат.}2SO_3$ — из простого и сложного веществ образуется одно сложное;
3) получение серной кислоты:
$SO_3+H_2O=H_2SO_4$ — из двух сложных веществ образуется одно сложное.
Примером реакции соединения, при которой одно сложное вещество образуется из более чем двух исходных, может служить заключительная стадия получения азотной кислоты:
$4NO_2+O_2+2H_2O=4HNO_3$.
В органической химии реакции соединения принято называть реакциями присоединения. Все многообразие таких реакций можно рассмотреть на примере блока реакций, характеризующих свойства непредельных веществ, например этилена:
1) реакция гидрирования — присоединение водорода:
$CH_2{=}↙{этен}CH_2+H_2{→}↖{Ni,t°}CH_3{-}↙{этан}CH_3;$
2) реакция гидратации — присоединение воды:
$CH_2{=}↙{этен}CH_2+H_2O{→}↖{H_3PO_4,t°}{C_2H_5OH}↙{этанол};$
3) реакция полимеризации:
${nCH_2=CH_2}↙{этилен}{→}↖{p,кат.,t°}{(-CH_2-CH_2-)_n}↙{полиэтилен}$
2. Реакции разложения — это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ.
В неорганической химии все многообразие таких реакций можно рассмотреть на примере блока реакций получения кислорода лабораторными способами:
1) разложение оксида ртути (II):
$2HgO{→}↖{t°}2Hg+O_2↑$ — из одного сложного вещества образуются два простых;
2) разложение нитрата калия:
$2KNO_3{→}↖{t°}2KNO_2+O_2↑$ — из одного сложного вещества образуются одно простое и одно сложное;
3) разложение перманганата калия:
$2KMnO_4{→}↖{t°}K_2MnO_4+MnO_2+O_2↑$ — из одного сложного вещества образуются два сложных и одно простое, т.е. три новых вещества.
В органической химии реакции разложения можно рассмотреть на примере блока реакций получения этилена в лаборатории и промышленности:
1) реакция дегидратации (отщепления воды) этанола:
$C_2H_5OH{→}↖{H_2SO_4,t°}CH_2=CH_2+H_2O;$
2) реакция дегидрирования (отщепления водорода) этана:
$CH_3—CH_3{→}↖{Cr_2O_3,500°C}CH_2=CH_2+H_2↑;$
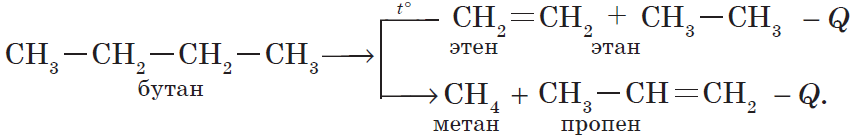
3) реакция крекинга (расщепления) пропана:
$CH_3-CH_2CH_3{→}↖{t°}CH_2=CH_2+CH_4↑.$
3. Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы какого-либо элемента в сложном веществе.
В неорганической химии примером таких процессов может служить блок реакций, характеризующих свойства, например, металлов:
1) взаимодействие щелочных и щелочноземельных металлов с водой:
$2Na+2H_2O=2NaOH+H_2↑$
2) взаимодействие металлов с кислотами в растворе:
$Zn+2HCl=ZnCl_2+H_2↑$;
3) взаимодействие металлов с солями в растворе:
$Fe+CuSO_4=FeSO_4+Cu;$
4) металлотермия:
$2Al+Cr_2O_3{→}↖{t°}Al_2O_3+2Cr$.
Предметом изучения органической химии являются не простые вещества, а только соединения. Поэтому как пример реакции замещения приведем наиболее характерное свойство предельных соединений, в частности метана, — способность его атомов водорода замещаться на атомы галогена:
$CH_4+Cl_2{→}↖{hν}{CH_3Cl}↙{хлорметан}+HCl$,
$CH_3Cl+Cl_2→{CH_2Cl_2}↙{дихлорметан}+HCl$,
$CH_2Cl_2+Cl_2→{CHCl_3}↙{трихлорметан}+HCl$,
$CHCl_3+Cl_2→{CCl_4}↙{тетрахлорметан}+HCl$.
Другой пример — бромирование ароматического соединения (бензола, толуола, анилина):
$C_6H_6Br_2{→}↖{FeBr_3}{C_6H_5Br}↙{бромбензол}+HBr$.
Обратим внимание на особенность реакций замещения у органических веществ: в результате таких реакций образуются не простое и сложное вещества, как в неорганической химии, а два сложных вещества.
В органической химии к реакциям замещения относят и некоторые реакции между двумя сложными веществами, например, нитрование бензола:
$C_6H_6+{HNO_3}↙{бензол}{→}↖{H_2SO_4(конц.),t°}{C_6H_5NO_2}↙{нитробензол}+H_2O$
Она формально является реакцией обмена. То, что это реакция замещения, становится понятным только при рассмотрении ее механизма.
4. Реакции обмена — это такие реакции, при которых два сложных вещества обмениваются своими составными частями.
Эти реакции характеризуют свойства электролитов и в растворах протекают по правилу Бертолле, т.е. только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (например, $Н_2О$).
В неорганической химии это может быть блок реакций, характеризующих, например, свойства щелочей:
1) реакция нейтрализации, идущая с образованием соли и воды:
$NaOH+HNO_3=NaNO_3+H_2O$
или в ионном виде:
$OH^{–}+H^{+}=H_2O$;
2) реакция между щелочью и солью, идущая с образованием газа:
$2NH_4Cl+Ca(OH)_2=CaCl_2+2NH_3↑+2H_2O$
или в ионном виде:
$NH_4^{+}+OH^{–}=NH_3↑+H_2O$;
3) реакция между щелочью и солью, идущая с образованием осадка:
$CuSO_4+2KOH=Cu(OH)_2↓+K_2SO_4$
или в ионном виде:
$Cu^{2+}+2OH^{-}=Cu(OH)_2↓$
В органической химии можно рассмотреть блок реакций, характеризующих, например, свойства уксусной кислоты:
1) реакция, идущая с образованием слабого электролита — $H_2O$:
$CH_3COOH+NaOH⇄NaCH_3COO+H_2O$
или
$CH_3COOH+OH^{-}⇄CH_3COO^{-}+H_2O$;
2) реакция, идущая с образованием газа:
$2CH_3COOH+CaCO_3=2CH_3COO^{–}+Ca^{2+}+CO_2↑+H_2O$;
3) реакция, идущая с образованием осадка:
$2CH_3COOH+K_2SiO_3=2KCH_3COO+H_2SiO_3↓$
или
$2CH_3COOH+SiO_3^{−}=2CH_3COO^{−}+H_2SiO_3↓$.
Классификация химических реакций по изменению степеней окисления химических элементов, образующих вещества
Реакции, идущие с изменением степеней окисления элементов, или окислительно-восстановительные реакции.
К ним относится множество реакций, в том числе все реакции замещения, а также те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество, например:
1.${Mg}↖{0}+{2H}↖{+1}+SO_4^{-2}={Mg}↖{+2}SO_4+{H_2}↖{0}↑$
${{Mg}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Mg}↖{+2}$
${{2H}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{H_2}↖{0}$
2.${2Mg}↖{0}+{O_2}↖{0}={2Mg}↖{+2}{O}↖{-2}$
${{Mg}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Mg}↖{+2}|4|2$
${{O_2}↖{0}+4{e}↖{-}}↙{окислитель}{→}↖{восстановление}{2O}↖{-2}|2|1$
Как вы помните, сложные окислительно-восстановительные реакции составляются с помощью метода электронного баланса:
${2Fe}↖{0}+6H_2{S}↖{+6}O_{4(k)}={Fe_2}↖{+3}(SO_4)_3+3{S}↖{+4}O_2+6H_2O$
${{Fe}↖{0}-3{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Fe}↖{+3}|2$
${{S}↖{+6}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{S}↖{+4}|3$
В органической химии ярким примером окислительно-восстановительных реакций могут служить свойства альдегидов:
1. Альдегиды восстанавливаются в соответствующие спирты:
${CH_3-{C}↖{+1} {}↖{O↖{-2}}↙{H↖{+1}}+{H_2}↖{0}}↙{text»уксусный альдегид»}{→}↖{Ni,t°}{CH_3-{C}↖{-1}{H_2}↖{+1}{O}↖{-2}{H}↖{+1}}↙{text»этиловый спирт»}$
${{C}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{C}↖{-1}|1$
${{H_2}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}2{H}↖{+1}|1$
2. Альдегиды окисляются в соответствующие кислоты:
${CH_3-{C}↖{+1} {}↖{O↖{-2}}↙{H↖{+1}}+{Ag_2}↖{+1}{O}↖{-2}}↙{text»уксусный альдегид»}{→}↖{t°}{CH_3-{Ag}↖{0}{C}↖{+3}{O}↖{-2}{OH}↖{-2+1}+2{Ag}↖{0}↓}↙{text»этиловый спирт»}$
${{C}↖{+1}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{C}↖{+3}|1$
${2{Ag}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}2{Ag}↖{0}|1$
Реакции, идущие без изменения степеней окисления химических элементов.
К ним, например, относятся все реакции ионного обмена, а также:
- многие реакции соединения:
$Li_2O+H_2O=2LiOH;$
- многие реакции разложения:
$2Fe(OH)_3{→}↖{t°}Fe_2O_3+3H_2O;$
- реакции этерификации:
$HCOOH+CH_3OH⇄HCOOCH_3+H_2O$.
Классификация химических реакций по тепловому эффекту
По тепловому эффекту реакции делят на экзотермические и эндотермические.
Экзотермические реакции.
Эти реакции протекают с выделением энергии.
К ним относятся почти все реакции соединения. Редкое исключение составляют эндотермические реакции синтеза оксида азота (II) из азота и кислорода и реакция газообразного водорода с твердым иодом:
$N_2+O_2=2NO – Q$,
$H_{2(г)}+I{2(т)}=2HI – Q$.
Экзотермические реакции, которые протекают с выделением света, относят к реакциям горения, например:
$4P+5O_2=2P_2O_5+Q,$
$CH_4+2O_2=CO_2+2H_2O+Q$.
Гидрирование этилена — пример экзотермической реакции:
$CH_2=CH_2+H_2{→}↖{Pt}CH_3-CH_3+Q$
Она идет при комнатной температуре.
Эндотермические реакции
Эти реакции протекают с поглощением энергии.
Очевидно, что к ним относятся почти все реакции разложения, например:
а) обжиг известняка:
$CaCO_3{→}↖{t°}CaO+CO_2↑-Q;$
б) крекинг бутана:
Количество выделенной или поглощенной в результате реакции энергии называют тепловым эффектом реакции, а уравнение химической реакции с указанием этого эффекта называют термохимическим уравнением, например:
$H_{2(г)}+Cl_{2(г)}=2HCl_{(г)}+92.3 кДж,$
$N_{2(г)}+О_{2(г)}=2NO_{(г)} – 90.4 кДж$.
Классификация химических реакций по агрегатному состоянию реагирующих веществ (фазовому составу)
Гетерогенные реакции.
Это реакции, в которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях (в разных фазах):
$2Al_{(т)}+3CuCl_{2(р-р)}=3Cu_{(т)}+2AlCl_{3(р-р)}$,
$СаС_{2(т)}+2Н_2О_{(ж)}=С_2Н_2↑+Са(ОН)_{2(р-р)}$.
Гомогенные реакции.
Это реакции, в которых реагирующие вещества и продукты реакции находятся в одном агрегатном состоянии (в одной фазе):
Классификация химических реакций по участию катализатора
Некаталитические реакции.
Некаталитические реакции идут без участия катализатора:
$2HgO{→}↖{t°}2Hg+O_2↑$,
$C_2H_4+3O_2{→}↖{t°}2CO_2+2H_2O$.
Каталитические реакции.
Каталитические реакции идут с участием катализатора:
$2KClO_3{→}↖{MnO_2,t°}2KCl+3O_2↑,$
${C_2H_5OH}↙{этанол}{→}↖{H_2SO-4,t°}{CH_2=CH_2}↙{этен}↑+H_2O$
Так как все биологические реакции, протекающие в клетках живых организмов, идут с участием особых биологических катализаторов белковой природы — ферментов, все они относятся к каталитическим или, точнее, ферментативным.
Следует отметить, что более $70%$ химических производств используют катализаторы.
Классификация химических реакций по направлению
Необратимые реакции.
Необратимые реакции протекают в данных условиях только в од ном направлении.
К ним можно отнести все реакции обмена, сопровождающиеся образованием осадка, газа или малодиссоциирующего вещества (воды), и все реакции горения.
Обратимые реакции.
Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях.
Таких реакций подавляющее большинство.
В органической химии признак обратимости отражают названия-антонимы процессов:
- гедрирование — дегидрирование;
- гидратация — дегидратация;
- полимеризация — деполимеризация.
Обратимы все реакции этерификации (противоположный процесс, как вы знаете, носит название гидролиза) и гидролиза белков, сложных эфиров, углеводов, полинуклеотидов. Обратимость лежит в основе важнейшего процесса в живом организме — обмена веществ.
В результате выполнения задания 19 ЕГЭ по химии проверяются следующие требования/умения:
Коды проверяемых требований к уровню подготовки (по кодификатору):
Читать подробнее…
Коды проверяемых элементов содержания (по кодификатору):
Уровень сложности задания:
Максимальный балл за выполнение задания:
Примерное время выполнения задания выпускником, изучавшим предмет:
Установите соответствие между веществом, которое вступает в реакцию с этанолом, и преимущественно образующимся углеродсодержащим продуктом этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) СuО
Б) KMnO4(H+)
В) Н2SO4 (конц. 180)
Г) K
ПРОДУКТ РЕАКЦИИ
1) ацетат калия
2) этилат калия
3) ацетальдегид
4) уксусная кислота
5) диметиловый эфир
6) этилен
Установите соответствие между схемой реакции и органическим веществом, которое является продуктом этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) CH3CHO → Cu(OH)2
Б) CH3CHO →H2
В) CH3CH2OH→CuO
Г) CH3CH2OH →H2SO4 t
ПРОДУКТ РЕАКЦИИ
1) этанол
2) ацетат калия
3) ацетальдегид
4) диэтиловый эфир
5) ацетат меди(II)
6) этановая кислота
Установите соответствие между схемой реакции и веществом X, принимающим в ней участие: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) бутанол-2 —X→ бутен-2
Б) бутанол-2 —X→ 2-бромбутан
В) бутанол-2 —X→ бутанон
Г) бутанол-1 —X→ бутаналь
ВЕЩЕСТВО X
1) бром
2) H2SO4(конц.)
3) вода
4) СuО (t)
5) NaBr
6) бромоводород
Установите соответствие между веществом и углеродсодержащими продуктом реакции, который преимущественно образуется при взаимодействии этого вещества с оксидом меди(II): к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) уксусная кислота
Б) этанол
В) метанол
Г) пропанол-2
ПРОДУКТ РЕАКЦИИ
1) ацетон
2) ацетальдегид
3) формальдегид
4) пропаналь
5) формиат меди(II)
6) ацетат меди(II)
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) фенол и натрий
Б) фенол и сода
В) фенол и бромная вода
Г) уксусная кислота и сода
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) трибромфенол
2) ацетат натрия
3) формиат натрия
4) фенолят натрия
5) монобромфенол
6) бензоат натрия
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) CH3COOK и КОН
Б) СН3СООН и СН3ОН
В) СН3ОН и К
Г) СН3ОН и H2SO4
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) диэтиловый эфир
2) метилацетат
3) метилат калия
4) метан
5) диметиловый эфир
6) метаналь
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) пропанол-1 и оксид меди(II)
Б) пропанол-2 и оксид меди(II)
В) пропанол-2 и муравьиная кислота
Г) пропин и вода
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) пропаналь
2) ацетон
3) пропен
4) изопропанол
5) пропилацетат
6) изопропилформиат
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) этанол и оксид меди(II)
Б) уксусная кислота и оксид меди(II)
В) этанол и натрий
Г) этанол и гидроксид натрия
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) ацетат меди(I)
2) ацетат меди(II)
3) этилат натрия
4) этилнатрий
5) этаналь
6) не взаимодействуют
Установите соответствие между реагирующими веществами и органическим веществом, которое является продуктом взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) фенол и гидроксид калия
Б) фенол и калий
В) фенолят калия и углекислый газ
Г) фенолят калия и бромметан
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) трибромфенол
2) фенолят калия
3) фенол
4) метилфениловый эфир
5) монобромфенол
6) бензоат натрия
Из предложенного перечня выберите два типа реакций, к которым можно отнести взаимодействие этанола с пропионовой кислотой.
1) присоединения
2) окисления
3) нейтрализации
4) этерификации
5) обратимая
- 17.02.2019
Сборник заданий «Как решать задачу №19» из ЕГЭ по химии в формате 2021 года (по демоверсии)
Каждое задание содержит правильный ответ (в конце документа) и подробный разбор, благодаря которому вы поймете как правильно решать задания такого типа.
- Посмотреть другие задания ЕГЭ по химии
Замечательный материал для самоподготовки — сохрани его к себе!
- Пробные варианты ЕГЭ по химии
Смотреть в PDF:
Или прямо сейчас: cкачать в pdf файле.
Добавить комментарий
Комментарии без регистрации. Несодержательные сообщения удаляются.