Пройти тестирование по 10 заданиям
Пройти тестирование по всем заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
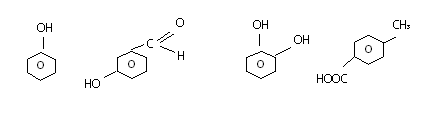
Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) метилбензол
Б) анилин
В) 3-метилбутаналь
КЛАСС/ГРУППА
1) альдегиды
2) амины
3) аминокислоты
4) углеводороды
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Демонстрационная версия ЕГЭ—2017 по химии, Демонстрационная версия ЕГЭ—2018 по химии, Демонстрационная версия ЕГЭ−2019 по химии
2
Установите соответствие между названием соединения и общей формулой гомологического ряда, к которому оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЕДИНЕНИЯ
А) бутен-1
Б) циклопропан
В) бутадиен-1,3
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ
3
Установите соответствие между названием соединения и общей формулой гомологического ряда, к которому оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЕДИНЕНИЯ
А) бутин
Б) циклогексен
В) бутадиен-1,2
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ
4
Установите соответствие между названием соединения и общей формулой гомологического ряда, к которому оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЕДИНЕНИЯ
А) бутан
Б) бутин-1
В) циклогексан
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ
5
Установите соответствие между названием соединения и общей формулой гомологического ряда, к которому оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЕДИНЕНИЯ
А) бутадиен-1,3
Б) 2-метилпропанол-1
В) этилформиат
КЛАСС (ГРУППА) ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1) простые эфиры
2) сложные эфиры
3) спирты
4) углеводороды
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ
Пройти тестирование по этим заданиям
|
Тест «Алканы 2.0» |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 |
|
|
Цепочки «Алканы» |
|
|
1 2 3 4 5 6 7 8 9 10 |
|
|
Тест «Алкены 2.0» |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 |
|
|
Цепочки «Алкены» |
|
|
1 2 3 4 5 6 7 8 9 10 |
|
|
Тест «Циклы и алкадиены» |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 |
|
|
Цепочки «Циклы и алкадиены» |
|
|
1 2 3 4 5 6 7 8 9 10 |
|
|
Тест «Алкины» |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 |
|
|
Сложные эфиры |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 |
|
|
Цепочки «Сложные эфиры» |
|
|
1 2 3 4 5 |
|
|
Цепочки «Алкины» |
|
|
1 2 3 4 5 6 7 8 9 10 |
|
|
Тест «Арены 2.0» |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 |
|
|
Цепочки «Арены» |
|
|
1 2 3 4 5 6 7 8 9 10 |
|
|
Тест «Спирты и фенолы» |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 |
|
|
Цепочки «Спирты и фенолы» |
|
|
1 2 3 4 5 6 7 8 9 10 |
|
|
Цепочки «Альдегиды и кетоны» |
|
|
1 2 3 4 5 6 7 8 9 10 |
|
|
Цепочки «Карбоновые кислоты» |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 |
|
|
Карточки с похожими реакциями |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 |
|
|
Задание №10 ЕГЭ. Номенклатура и классификация органических веществ. |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 |
|
|
Задание №11 ЕГЭ. Строение органических веществ. Изомеры и гомологи. |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 |
|
|
Задание №12. Свойства углеводородов и кислородсодержащих веществ |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 |
|
|
Задание №13 ЕГЭ. Азотсодержащие вещества, углеводы, жиры |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 |
|
|
Задание №14 ЕГЭ. Свойства углеводородов |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 |
|
|
Задание №33 ЕГЭ. Вывод формулы органического вещества |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 |
|
|
Свойства и способы получения углеводородов |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 |
|
|
Свойства и способы получения кислородсодержащих органических веществ |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 |
|
Строение алкенов. Уместно начинать с него, так как все свойства алкенов тесно связаны с особенностями их строения. У алкенов в составе электронных орбиталей находится одно негибридное облако, которое образует пи-связь с атомом углерода. Для молекул алкенов характерна геометрическая структурная изометрия: из-за того, что P-орбитали перекрываются в двух местах, затруднено вращение относительно углерод-углеродной связи. А если так, значит, есть возможность различного взаиморасположения групп (пример: цис-бутен-2, транс-бутен-2).
Химические свойства алкенов и алканов: сравнение. Наиболее характерный механизм реакции у алканов — радикальный цепной механизм, и реакция начинается с образования свободного радикала. Для алкенов же характерен ионный механизм взаимодействия. Далее, поскольку активная форма молекулы у алкена — двойная углерод-углеродная, то, в отличие от алканов, алкены относятся к ненасыщенным углеводородам и им характерна реакция присоединения. Для алканов характерна реакция замещения. Благодаря высокой химической активности, алкены вступают в реакцию при обычных условиях, а алканам нужны дополнительные факторы — свет, тепло, искра или какой-то другой внешний фактор. И алкены, и алканы реагируют с галогенами (хлор и бром), но для алкенов это реакция присоединения (радикального характера), а для алканов — замещения. Водород присоединяется к алкенам при отсутствии катализатора; алкены могут также присоединять воду и взаимодействовать с кислотами (при этом характер реакций будет ионный). Алканы ни с водой, ни с водородом не реагируют.
Правило Марковникова гласит, что при присоединении протонных кислот или воды к несимметричным алкенам атом водорода будет присоединяться к тому атому углерода, который наиболее гидрогенизирован. Удобно, что все реакции с участием алкинов типовые и запоминаются относительно легко. Научите учеников моделировать реакцию: одни и те же связи разрываются и возникают, например, при взаимодействии алкина с водородом и с бромовой водой.
Из правила Марковникова есть исключения:
1. Когда двойная связь в молекуле алкена соседствует с электронно-акцепторной группой (например, трифторметил). Электронная плотность изменяется, и продукты реакции получаются иные, чем по правилу Марковникова. Атомы фтора сильно электроотрицательны и смещают двойную P-связь.
2. Строго для гидробромирования: взаимодействие несимметричного алкена с бромоводородом при участии органической перекиси. Тогда реакция протекает по радикальному механизму.
3. Сопряженные системы: двойная углерод-углеродная связь сопряжена с двойной углерод-водородной или углерод-азотной связью. Здесь также происходит смещение электронной плотности по P-связи. На атоме углерода возникает избыточный отрицательный заряд, в результате происходит «антимарковниковский» эффект.
Всегда ли для алкенов возможны только реакции присоединения? Согласно теории Бутлерова, достаточно знать строение молекулы, чтобы предсказать свойства вещества. Рассмотрим молекулу алкена пропена. В ней отчетливо выделяются две части: первая от этилена, где атомы углерода в sp2 гибридном состоянии, вторая — от алкана (метана), в которой находится sp3 гибридный атом углерода. Следовательно, пропен сочетает в себе свойства этилена и метана; а для метана характерна реакция замещения под воздействием внешних факторов (например, внешнего облучения). Реакция замещения у пропена возможна благодаря устойчивости аллельного радикала. Для всех алкенов, начиная от пропена, возможны аналогичные реакции, хотя это и не самое характерное свойство данной группы.
Реакция полимеризации. Эта реакция имеет огромное практическое значение, потому что с ее помощью возникает целый ряд углеводородов и их производных — полимеров. Чтобы реакция началась, нужен инициатор — радикал. Он взаимодействует с молекулой, например, этилена; двойная связь в этилене распадается, образовавшаяся частица взаимодействует с другой CH-группой, затем с ещё одной, и так процесс полимеризации идет до тех пор, пока связь не оборвется (это произойдет тогда, когда встретятся два радикала).

Органическая химия в тестовых заданиях. Профильный уровень. 10–11 классы. Учебное пособие
Учебное пособие предназначено для учащихся 10-11 классов общеобразовательных учреждений. Оно окажет помощь в закреплении и углублении знаний по органической химии. В пособии предлагаются задания различной степени сложности, представленные в тестовой форме.
Купить
У учеников часто возникают трудности, когда в задании требуется написать уравнение подобной реакции. Есть простой прием: объемные заместители пишем внизу. Так формула становится нагляднее.
Окисление алкенов. С одной стороны, двойная связь всегда энергетически обязательно сильнее, чем одинарная. С другой стороны, двойная связь — это наиболее активная часть молекулы, поэтому именно двойная связь подвержена окислению. При мягком окислении разрывается двойная связь, образуются двухатомные спирты. Эта реакция проходит в нейтральной среде без нагревания.
Что ещё почитать?
- Демоверсия ЕГЭ-2019 по химии
- Методические подходы к изучению ОВР в основной школе
- Методическая помощь учителю химии
- Изучение сероорганических соединений
- К методике изучения классов неорганических соединений
Если в реакции присутствует серная кислота, происходит жесткое окисление: атом углерода максимально окружает себя атомами кислорода, но одинарные связи по-прежнему не разрушаются. Здесь основная сложность — правильно определить степени окисления и расставить коэффициенты (см. видео).
Получение алкенов. Опорой для изучения этой темы должна быть хорошо усвоенная информация о химических свойствах алканов. Дегидрирование алканов по сути и является процессом получения алкенов. Другой способ — крекинг алканов: при этой реакции всегда образуется два углеводорода, алкен и алкан; интуитивно это ясно, так как на два алкена просто не хватит атомов водорода. Другие способы получения алкенов можно изучить через повторение химических свойств самих алкенов. Например: гидратация алкенов дает спирты, а если от спирта отщепить воду, нагревая его с серной кислотой, получим алкен.
Правило Зайцева. При отщеплении воды от спирта, водород преимущественно отделяется от того атома углерода, у которого водородов меньше (то есть, от вторичного). Примерно та же ситуация наблюдается при дегидрохлорировании, однако, если хлороводород присоединяется к алкену легко, то отщепить его можно только при воздействии щелочи, растворенной в спирте.
Можно присоединить галоген к алкену, получается дигалогеналкан. Отщепить галогены тоже можно, под действием активного двухвалентного металла. Часто у учеников возникает вопрос, можно ли использовать одновалентный металл? Отвечаем: можно, но это нетипичная реакция.
Циклоалканы. Снова начнем со строения. Перед нами цикличные молекулы, изомерные алкенам, не содержащие двойных углерод-углеродных связей. Здесь возможна геометрическая изомерия. Ученикам, сдающим ЕГЭ по химии, полезно знать устойчивые конформации, свойственные тем или иным циклоалканам. Еще запомним правило: малые циклы (трехчлены и четырехчлены) — напряженные, как сжатые пружины, а большие циклы (пяти- и шестичлены) менее напряжены. Для первых характерны реакции присоединения, для вторых — замещения.
Химические свойства циклоалканов. Что могут присоединить малые циклы? Водород, галоген, галогеноводород, при определенных условиях — воду. Большие циклы реагируют примерно так же, как и большие алканы: с бромом, азотной кислотой, возможны реакции дегидрирования.
Получение циклоалканов. Здесь нужно повторить уравнения реакций при взаимодействии дигалогеналканов с активными двухвалентными металлами. Эти уравнения будут очень нужны при выполнении заданий на восстановление цепочки превращений и при решении задач на нахождение формулы вещества.
#ADVERTISING_INSERT#
Вебинар по теме
1 лист.
Реакции к основным темам курса 10 класса (для запоминания), проф. класс.
1. Алканы (предельные, насыщенные). Общая формула – СпН2п+2.
М (СпН2п+2)=(14п+2)г/моль, σ-связи, SP3-гибридизация, <109’28», тетраэдр.
1. р.галогенирования (р. замещения по радикальному механизму) проходит на свету: R-Н + Вr2 →R-Вr + НВr (галогены только в газообразном состоянии);
2. р. нитрования – р. Коновалова (р. замещения, радик. мех-зм):
R-Н + НО – NО2(разб) −→ R-NО2 + Н2О │
внимание: замещение атомов водорода у третичного атома (—с—) проходит легче, чем у вторичного атома(—с—) и тем более первичного атома (с—).
3. р. изомеризации (у С4Н10 и следующих) в присутствии катализатора – AlCl3:
СН3-СН2-СН2-СН3 —→ СН3-СН (СН3)-CН3
4.крекинг (разрыв связей между атомами углеродов, радик. мех-зм) под действием температуры и катализатора:
С8Н18→С4Н10+С4Н8
5. р. элиминирования – образование веществ с кратными связями за счет отрыва атомов или групп атомов: 2СН4→С2Н4↑+2Н2↑ при t=5000С-10000С
2СН4→С2Н2↑+3Н2↑ при t=10000С-15000С
2СН4→2С+4Н2↑ при t>15000С (пиролиз)
6. р. ароматизации – получение ароматических углеводородов за счёт отрыва атомов водородов в присутствии катализаторов: С6Н12 → С6Н6 + 3Н2↑
7. р. горения — ( + О2) СпН2п+2 + (3п+1)/2О2 → пСО2↑ + (п+1) Н2О + Q (экзотерм.)
. р. окисления метана ( +[О]) даёт продукты, в зависимости от условий:
СН4 из воздуха→ СН3ОН
→НСНО
→НСООН
8. р. Вюрца («удвоение») 2СН3Cl + 2Na → 2NaCl + C2H6, в кислой среде.
9. получение алканов: а) С+2Н2 → СН4↑ под действием эл. разряда;
б) СН3-СООNa + NaOH → CH4↑ + Na2CO3 при спекании сухих веществ
в) Al4C3 + 12НОН → 3СН4↑ + 4Al(ОН)3↓; г) Al4C3 + 12НСl→ 3СН4↑ + 4AlСl3.
2. Циклоалканы (предельные). Общая формула – СпН2п.
М (СпН2п)= 14п г/моль, σ-связи, SP3-гибридизация, <от 60′ до 109′, цикл.
1. р. присоединения (+Н2, +Вr2,+НI) у циклов с 3,4 5 атомами углерода
C3H6 + Br2 = Br-CH2-CH2-CH2Br;
2. р. замещения – аналогично алканам (циклы с 6 и > атомами углерода);
3. р. элиминирования (дегидрирования) С6Н12 → С6Н6 + 3Н2↑(катализ: Ni, t)
4. р. окисления – на примере циклогексана сильным окислителем:
С6Н12 + 4[О] → СН2-СН2-СООН
│
СН2-СН2-СООН (адипиновая кислота)
3. Алкены (непредельные). Общая формула – СпН2п.
М (СпН2п)= 14п г/моль, σ- и π-связи, SP2-гибридизация, < 120′, треугольник.
1.р. присоединение Н2, НГ, Г2 и Н2О (разрыв С=С связи, электрофильный мех-зм)
а) гидрогалогенирование:СН2=СН2 + НBr → СН3-СН2Br
в случае несимметричной π-связи по правилу Марковникова (Н к СН2):
2 лист
СН3-СН=СН2 + НBr → СН3-СНBr-СН3; продолжение см. дальше.
б) гидратация:СН3-С=СН2 + НОН → СН3-С(ОН)-СН3 (в присутствии минерал кислот)
│ │
СН3 СН3
в) галогенирование (обесцвечивание раствора бромной воды – Br2) – качественная реакция на кратную связь, как и реакция с раствором КМпО4:
СН2 = СН2 + Br2 → BrСН2-СН2Br
г)гидрирование: СН3-СН=СН2 + Н2 → СН3-СН2-СН3 (катализатор – Ni, t)
2.р. замещения (радикальный мех-зм) – замещение атома Н на соседнем с двойной связью атоме углерода, при t=5000С: СН3-СН=СН2 + Cl2 → ClСН2-СН=СН3 + НCl
3.р. окисления:а) мягкое – холодным раствором КМпО4(р. Вагнера)
СН2 = СН2 + [О] + Н2О → СН2ОН-СН2ОН (упрощенная запись)
или 3СН2 = СН2 + 2КМпО4 + 4Н2О → 3СН2ОН-СН2ОН + 2МпО2↓ + 2КОН
б)жесткое – кипящим раствором КМпО4 в кислой среде
СН3-СН=СН-СН3 + 4[О] → 2 СН3-СООН
4.р. полимеризации: пСН2=СН2 → ( — СН2-СН2 — ) в кислой среде.
5.получение алкенов: а) С7Н16 —→ C4Н10 + CН3-CН=CН2 (t,Kat);
б) СН3-СН2-СНBr-СН3 + КОН (спирт)→СН3-СН=СН-СН3 + КBr + Н2О
в) СН3-СН-СН3 → СН3-СН=СН2 + Н2О (t=1500С, в кислой среде) по правилу Зайцева
│
ОН
г) СН2Br- СНBr-СН3 + 2К → СН2=СН-СН3 + 2КBr – синтез Вюрца—Крафтса
д) СН3-СН2-СН3 → СН3-СН=СН2 + Н2↑ в присутствии Kat – Cr2O3
4. Алкадиены (непредельные). Общая формула – СпН2п-2.
М (СпН2п-2)= (14п-2) г/моль, σ- и 2π-связи, SP2-гибридизация.
1. р. присоединения: →СН2Br-СНBr-СН=СН2 (присоединение по 1,2)
СН2=СН-СН=СН2 + Br2 →[
→ СН2Br-СН=СН=СН2Br (присоединение по 1,4)
2. р. полимеризации: пСН2=СН-СН=СН2 → (-СН2-СН=СН-СН2-) в кислоте
3. диеновый синтез – р. Дильса-Альдера- р.циклизации
СН2-СН=СН-СН2 + СН2=СН2 → С6Н10 при нагревании, под давлением.
4. получение алкадиенов:
а) СН3-СН2-СН2-СН3 → СН2=СН-СН=СН2 + 2Н2↑ при t, Kat – Cr2O3;
б) 2С2Н5ОН → СН2=СН-СН=СН2 + Н2↑ + 2Н2О при t, Kat – Al2O3, ZnO р. Лебедева.
5. Алкины (непредельные). Общая формула – СпН2п-2.
М (СпН2п-2)= (14п-2) г/моль, σ- и 2π-связи, SP-гибридизация, линейное строение
обладают слабыми кислотными свойствами
1.р. электрофильного присоединения (медленнее, чем у алкенов) — Br2, Н2 и НСl
СН≡СН + Br2 → СНBr=СНBr, далее СНBr=СНBr+ Br2 → СНBr2-СНBr2
2.р. гидратации – р. Кучерова, в кислой среде, Kat – Hg2+
любой алкин образует кетон СН3-С≡СН + НОН →СН3-С (СН3)=О,
только ацетилен СН≡СН + НОН →СН3-СНО — альдегид
3. р. окисления раствором КМпО4: R-C≡C-R’ + 3[О] + HOH → R-COOH + R’-COOH
4.р. гидрирования СН3-С≡СН + Н2 → СН3-СН=СН2, далее СН3-СН=СН2 +Н2 →С3Н8
3 лист
при нагревании, в присутствии катализатора – Pt, Pd
продолжение см дальше
5.слабые кислотные свойства у алкинов с «концевой» кратной связью:
2СН≡СН + 2Na → 2NaC≡CNa + H2, с аммиачным раствором оксида серебра
СН≡СН + [Ag(NH3)2]OH → AgC≡CAg + 4NH3 + 2H2O
6. р. полимеризации: СН≡СН + СН≡СН → СН2=СН-СН=СН2, катализатор –NH4CL
или р. Зелинского 3СН≡СН → С6Н6, условия – активир-ый уголь (Сакт, t=6000С)
7. а): СаС2 + 2НОН → С2Н2↑ + Са(ОН)2↓; б) СаС2 + 2НCL → С2Н2↑ + СаCL2;
в) 2СН4 → С2Н2↑ + 3H2 при t=15000С
6. Арены (непредельные, циклические, ароматические).
Общая формула – СпН2п-6, М (СпН2п-6)= (14п-6) г/моль,
локализованное π-облако, SP2-гибридизация, циклическое строение
1. Р. электрофильного замещения:
а) галогенирование: С6Н6 + CL2 → С6Н5CL + НCL , катализатор – АLCL3
б) нитрование: С6Н6 + НО – NО2 → С6Н5-NО2 + Н2О, в присутствии H2SO4
в) алкилирование — р. Фриделя-Крафтса – удлинение цепи атомов углерода
С6Н6 + RCl → C6H5-R + HCl, где R – CnH2n+1 (радикалы), катализатор — АLCL3
2. р. присоединения в жёстких условиях – свет, катализатор— Ni (присоединение Н2) а) С6Н6 + 3Н2 → С6Н12
б) С6Н6 + 3CL2 → С6Н6CL6 на свету
3. для гомологов бензола:
а) замещение атомов водорода в цикле (катализаторы FeBr3 и H2SO4)
С6Н5-СН3 + Br2 → о—С6Н4(Br)СН3 +НBr в ортоположении, т.е. 1-бром-2-метилбензол
а также →п—С6Н4(Br)СН3 +НBr в параположении, т.е. 1-бром-4-метилбензол
помнить: у гомологов бензола замещение в цикле атомов водорода
происходит с равной вероятностью в положении 2, 4, 6 относительно имеющегося радикала в присутствии катализаторов FeBr3 и H2SO4.
б) С6Н5-СН3 + 3НО – NО2 → С6Н2(NО2)3 + 3Н2О 1-метил-2,4,6,-тринитробензол.
в) присоединение 2 С6Н5-СН3+ 5Н2 → 2 С6Н11-СН3 или −СН3, метилциклогексан.
г) радикальное замещение в боковую цепь на свету:
С6Н5-СН3 + Br2 → С6Н5-СН2Br + НBr
д) окисление кислым раствором КМпО4
С6Н5-СН3 + 2[О] → С6Н-СООН — упрощенная запись, полная запись:
5С6Н5-СН3 + 6КМпО4 + 9H2SO4 → 5С6Н5-СООН + 3К2SO4 + 6МпSO4 + 14Н2О
электронно-ионный баланс:
С6Н5-СН30 + 2Н2О0 −6е —_→ С6Н5-СООН0 + 6Н+ │5
МпО4— + 8Н+ +5е—→ Мп2+ + 4Н2О │6
4. получение аренов: а) С6Н14 → С6Н6 + 4Н2↑, условия: t, Р, катализатор – Сr2O3
б) С6Н12→ С6Н6 + 3Н2↑, условия: t, катализатор – Pd
в) 3СН≡СН→ С6Н6, условия – активир-ый уголь (Сакт, t=6000С)
г) С6Н5-СООNa + NaOH → C6H6 + Na2CO3 при спекании сухих веществ.
4 лист
Кислородсодержащие соединения.
1. Одноатомные спирты — алканолы (предельные).
Общая формула – R-ОН или СпН2п+2О, М (СпН2п+2О)= (14п+18) г/моль,
Наличие гидроксогруппы — ОН в молекулах спиртов проявляется в слабых кислотных и основных свойств.
1. проявляют кислотные свойства (только реакции с щелочными Ме), убывающие от первичных к третичным спиртам: 2 С2Н5ОН + 2К → 2 С2Н5ОК + Н2↑;
2. слабые основные свойства, возрастающие от первичных к третичным спиртам:
R – ОН + НBr → R – Br + H2O
3. р. этерификации – взаимодействие с кислотами и образование сложных эфиров:
Н+
RСООН + НОR’ ↔ RСООR’ + Н2О (в кислой среде);
4. р. окисления подкисленными растворами КМпО4 или К2Сr2О7: а) первичные окисляются в 2 стадии до кислот т.к. имеют 2 атома [Н] на углероде при ОН-группе: 1стад. 2 стад.
R — СН2 – ОН + [О] → R — СН2 = О (альдегид); …+ [О] → R – СООН (кислота);
б) вторичные окисляются до кетонов т.к. имеют1 атом [Н] на углероде при ОН-группе: 1стад.
R — СН – ОН + [О] → R — С = О
│ │
R’ R’
5. р. дегидратации в присутствии раствора Н2SO4 (Al2O3, H3PO4 конц) зависит от температуры:
а) при t > 1500С – внутримолекулярная (Н2О отрывается от 1 молекулы):
СН3 – СН2 – СН2 – ОН (+Н2SO4) → СН3 – СН = СН2 + Н2О, продукт — алкен
б) при t < 1500С – межмолекулярная (Н2О отрывается от 2 молекул):
СН3 – СН2 –– ОН + СН3 – СН2 –– ОН (+Н2SO4) → СН3 –СН2 — О – СН2 – СН3+ Н2О,
продукт – простой эфир.
Различные классы спиртов дегидратируются при различных условиях:
первичные: СН2 – СН2 (конц. Н2SO4 при нагревании) → СН2 = СН2
│ │
Н ОН
вторичные: СН2 – СН – СН3 (конц. Н2SO4 при подогреве) → СН2 = СН
│ │ │
Н ОН СН3
СН3 СН3
│ │
третичные: СН2 – С – СН3 (конц. Н2SO4 на холоде) → СН2 = С
│ │ │
Н ОН СН3
6.Галогенирование: в присутствии PCl5, SOCl2 или HCL
СН3 – СН2 – ОН + SOCl2 → СН3 – СН2 – Cl + SO2 + HCL
6. Получение: а) СН3 – СН=СН2 + НОН → СН3 – С (СН3)Н — ОН (из алкенов);
5 лист
б) R – Br + NaOH (раствор) → R – ОН + NaBr (щелочной гидролиз галогеналканов); в) R – СНО + 2[Н] → R — СН2 – ОН (из альдегидов);
г) С≡О + 2Н2 (t, p, ZnO) → СН3ОН (из синтез-газа);
д) С6Н12О6 (брожение) → С2Н5ОН + 2СО2↑. см. продолжение.
7. качественные реакции на: а) предельные одноатомные спирты – CuO, t
С2Н5ОН + CuO → СН3 – СНО + Cu + Н2О
б) предельные многоатомные спирты – Cu (ОН)2, свежеприготовленный раствор
2 СН2 – ОН + Cu (OН)2 → (СН2 – О)2Cu + 2 Н2О
│ │
СН2 – ОН СН2 – ОН – ярко-синий раствор.
2. Ароматические спирты – фенолы (циклические, непредельные).
Общая формула – R-(ОН)m или СпН2п-6-m(ОH)m,
М (СпН2п-6-m(ОН)m)= (14п-6 +16m) г/моль,
SP2 – гибридизация
1. подвижность атома водорода и выраженные кислотные свойства –
а) реакции с Ме: С6Н5ОН + К → С6Н5ОК + 0,5Н2 ↑;
б) реакции со щелочами: С6Н5ОН + КОН → С6Н5ОК + НОН;
в) реакция с р-ром карбоната натрия (фенол в нём растворяется, но в отличие от обычных кислот не образует диоксида углерода):
С6Н5ОН(aq) + CO32-(aq) −→ C6H5O—(aq) + HCO3—(aq)
2. реакции с хлор-альдегидом: С6Н5ОН + СН3ССlO → С6Н5 – О – C(CH3)O + HCl;
3. р. электрофильного замещения протекают легче, чем у аренов:
С6Н5ОН + СН3 – С = О −→С6Н5 – О – С = О + НСl
│ │
Cl СН3
а) реакция с раствором бромной воды – 1-я качественная реакция на фенолы
С6Н5ОН + 3 Br2 → С6Н2(ОН)Br3↓ + 3НBr – 2,4,6 – трибромфенол (белая эмульсия)
б) реакция нитрования — С6Н5ОН + 3 НО – NO2 → С6Н2(ОН)(NO2)3 + 3 НОН
в присутствии Н2SO4 получается 2,4,6 – тринитрофенол,
в) получение фенолформальдегидной смолы – р. поликонденсации
С6Н5ОН (фенол) + НСНО (формальдегид) →С6Н4(ОН) – СН2ОН — 1-я стадия;
n С6Н4(ОН) – СН2ОН + n С6Н5ОН →( С6Н4(ОН) – СН2 – С6Н4(ОН))n + n НОН.
4. реакция с раствором FeCl3 – 2-я качественная реакция на фенолы
3 C6Н5ОН + FeCl3 → (С6Н5О-)3Fe + 3НCl (ярко-фиолетовый раствор).
4. Получение: а) из каменноугольной смолы;
б) С6Н5 Br + КОН → С6Н5ОН + КBr
в) С6Н5 – СН (СН3)2 + 2 [О] → С6Н5 – ОН + (СН3)2СО.
3. Альдегиды. Общая формула – R-С = О или СпН2п О.Мr (СпН2пО) =(14п+16)
│
Н
SP2 – гибридизация
1.Реакции нуклеофильного присоединения:
6 лист
а) R – СНО + НСN −KCN→ R – CH(OH) – C ≡ N;
б) R – СНО + R’OH −H+→ R – CH – OH −R’OH→ R – CH — OR’ + H2O
│ │
OR’ (полуацеталь) OR’ (ацеталь);
см. дальше
╔O ╔O
в) R – СНО + NaHSO3 (:S – ONa) → R – CH – S — ONa
│ │ O╝
OH OH
г) р. восстановления R – СНО + H2 −LiAlH4→ R – CH2 – OH
Внимание: водород легко присоединяется по связи С=С и очень трудно – по связи С=О. LiAlH4 восстанавливает связи С=О до С – ОН, не затрагивая связь С=С.
О ← ОН
║ │ │
СН3 – С – Н + Н – О – СН3 → СН3 – СН – О – СН3, LiAlH4 — алюмогидрид лития.
2. Окисление: легко окисляются в кислоты – качественные реакции на альдегиды – реакции «серебряного» и «медного» зеркала
а) R – CHO + 2 [Aq(NH3)2]OH → R – COO – NH4 + 2Aq↓ + 2NH3↑ + H2O:
реактив [Aq(NH3)2]OH – реактив Толленса
б) R – CHO + 2 Cu(OH)2 → R – COOH + Cu2O↓ + 2H2O:
реактив Cu(OH)2 – реактив Фелинга
или упрощённо — R – CHO + [О] → R – CОOН
3. Получение: а) из спиртов R–СН2-ОН + CuО −t→ R–СНО + Н2О + Cu
б) из дигалогензамещённых алканов:
R – CHCl2 + 2 NaОН → R – CHO + 2 NaCl + Н2О
4. Кетоны. Общая формула – R-С = О или СпН2п О. Мr (СпН2пО) =(14п+16)
│
R
SP2 – гибридизация
1. Химические свойства отличаются от свойств альдегидов:
а) менее активны в реакциях нуклеофильного присоединения, чем альдегиды (с цианидом водорода в присутствии цианида калия)
R – С=О + НСN −KCN→ R – C (OH) – C ≡ N;
│ │
R R
б) присоединение реактива Гриньяра – R – MqBr с образованием третичного спирта
R – С=О + R – MqBr −2HCl→ R – C (OH) – R + MqCl2 + HBr
│ │
R R
в) гидрирование кетонов с образованием вторичных спиртов
7 лист
R – С=О + Н2− → R – CН (OH)
│ │
R R
г) окисление с трудом, не взаимодействуют с соединениями серебра и меди
2. Иодоформный тест – если карбонильная группа связана со 2-ым атомом углерода от конца углеродной цепи (со щелочным раствором иода)
СН3 – СО – R + I2 −OH-→ R – COO—(aq) + CHI3(тв), жёлтый осадок, такой же, как и для CH3 – CH (OH)R.
5. Карбоновые кислоты. Общая формула – R-С = О или СпН2пО.
│
Мr (СпН2пО) =(14п+16) ОН
SP2 – гибридизация
1. Диссоциируют, т.е. являются донором катиона водорода – слабые электролиты, самая сильная из них – муравьиная НСООН
R – СООН ↔ R – СОО— + Н+, сл-но, характерны свойства, типичные для кислот – взаимодействие с Ме, основными оксидами, основаниями и солями слабых кислот.
2. р.замещения группы ОН на хлор, взаимодействие с хлоридом Р(V)
R – СООН + РСl5 → R – С = О + POCl3 + HCl
│
Сl
3.межмолекулярная дегидратация в присутствии Р2О5 или НРО3
R – СООН + Н – О – СО – R — Р2О5→ R – СО – О – СО — R + Н2О (ангидрид к-ты),
4. р. этерификации – образование сложных эфиров в присутствии Н2SO4
R – СООН + Н — О R′ − Н2SO4→ R – СО — О R′ + Н2О
остаток кислоты ↓ остаток спирта
5. получение амидов в реакциях с раствором аммиака, при нагревании
R – С = О + NH3 −t→ R – С = О + H2O
│ │
ОН NH2
6. р. замещения атома водорода у α–атома (С) на атом брома, в присутствии Ркр
СН3 – СН2 – СООН + Br2 − Ркр→ CH3 – CHBr – COOH + HBr;
7. р. дегидратации и гидрирование, в присутствии LiAlH4 (см. «альдегиды»)
R – С = О + 2 Н2 −LiAlH4→ R – СН2ОН + Н2О т.е. восстановление до спиртов.
│
ОН
8.Внимание: муравьиная кислота – самая сильная из органических кислот и
сильный восстановитель,
отсюда следует:
а) НСООН − Н2SO4→ СО2↑ + Н2О;
б) р. «зеркала» НСООН + 2 [Ag(NH3)2]OH −t→ 2 Ag↓ + (NH4)2CO3 + 2NH3 + H2O
или упрощенно НСООН + Ag2О −t→ 2Ag↓ + СО2↑ + Н2О;
в) НСООН + Cl2 → CO2↑ + 2HCl
9. Получение: а) из спиртов (окисление, т.е. + [О])
R – СН2 – ОН + [О] → R – СНО (альдегид) и дальше + [О] → R – СООН (кислота);
б) из альдегидов – р. «серебряного и медного зеркала»
8 лист.
R – СНО + [Ag(NH3)2]OH −t→ Ag↓ + R – СООNН4 + Н2О + NH3
б) из реактива Гриньяра (R – MgBr) – р. элиминирования и гидратации (последовательное взаимодействие с СО2 и Н2О):
R – MgBr + CO2 → R – COO – MgBr…….. + H2O → R – COOH + Mg (OH) Br
в) из трихлорзамещенного алкана (последовательное замещение атомов хлора на группы ОН из щелочей и дегидратация)
R – С (Cl)3 + 2 NaOH → 3NaCl + R – C(OH)3….→ R – COOH + H2O
R – C (OH)3 – трёхатомный спирт – вещество очень слабое и нестабильное.
продолжение см. дальше
6. Сложные эфиры карбоновых кислот. Общая формула – R-С = О
│
О R′
Мr (СпН2п+1СОО)(СпН2п+1)′ = (14п+46)
1. р. гидролиза: а) кислотного СН3СООСН3 + НОН −H+→ СН3СООН + НОСН3
(кислота) (спирт)
б) щелочного СН3СООСН3 + NaOH → СН3СООNa + СН3ОН
р. гидролиза с Н2О идёт медленно, её катализируют (ускоряют) кислоты и щёлочи
2. р. восстановления, в присутствии LiAlH4 с образованием 2-х спиртов:
R – СОО — R′ + 4 [Н+] −LiAlH4→ R – CH2 – OH + R′ОН (аналогично альдегидам);
3. Получение: а) р. этерификации R – СООН + НО R′ − Н2SO4↔ R – СОО — R′ + Н2О
особенность: медленная реакция, обратимая, с низким выходом.
б) р. ацилирования спирта хлоридом кислоты
СН3СОCl + НОСН2СН3 → СН3СООСН2СН3 + HCl (р. быстрая, хороший выход).
Хлорангидриды и ангидриды кислот
Эти два вида производных карбоновых кислот химически очень активны. Хлорангидриды даже более активны, чем ангидриды, и более летучи, что делает обращение с ними очень трудным. Они вступают в быструю реакцию на холоде с водой, аммиаком и с их производными, спиртами и аминами. В каждом случае атом водорода реагирующей молекулы замещается ацильной группой – это реакции ацилирования, а хлорангидриды и ангидриды кислот-ацилирующие агенты.
С хлорангидридами:
а) вода: СН3СОCl + НОН → СН3СО – ОН (кислота) + HCl;
б) спирт: СН3СОCl + НОСН2СН3 → СН3СО – ОСН2СН3 (эфир) + HCl;
в) аммиак: СН3СОCl + 2Н−NH2 → СН3СО – NH2 (амид) + NH4Cl;
г) амин: СН3СОCl + НNHСН3 → СН3СО – NHСН3 (замещ. амид) + HCl;
↑
этот атом водорода замещается на ацильную группу.
С ангидридами кислот:
а) вода: СН3СОООССН3 + НОН → СН3СО – ОН + СН3СООН;
б) спирт: СН3СОООССН3 + НОСН2СН3 → СН3СО – ОСН2СН3 + СН3СООН;
в) аммиак: СН3СОООCСН3 + Н−NH2 → СН3СО – NH2 + СН3СООН;
г) амин: СН3СОООCН3 + НNHСН3 → СН3СО – NHСН3 + СН3СООН.
7. Углеводы. Общая формула – Сn (Н2О)m. Mr = 12n + 18m.
9 лист
1. Глюкоза – альдегидоспирт СН2ОН – (СНОН)4 — СНО, т.е. имеет р. «зеркала»
СН2ОН – (СНОН)4 – СНО + 2 [Ag(NH3)2]OH −t→ СН2ОН – (СНОН)4 – СОО — NH4 + 3NH3 + H2O + 2 Ag↓
2. р. восстановления до многоатомных спиртов:
СН2ОН – (СНОН)4 – СНО + 2[Н] → СН2ОН – (СНОН)4 – СН2ОН (сорбит);
3. синее окрашивание с Си(ОН)2, как у многоатомных спиртов;
4. р. межмолекулярной дегидратации со спиртами: → простые эфиры;
5. р. этерификации с альдегидами → сложные эфиры;
6. брожение: С6Н12О6 −дрожжи→ 2 С2Н5ОН + 2 СО2↑ — спиртовое брожение;
С6Н12О6 −→ 2 СН3 – СН (ОН) – СООН — молочнокислое брожение.
8. Азотсодержащие соединения – амины. Общая формула – R- NH2,
R – NH – R или N(R)3. Мr (R- NH2) = (14п+17)
1. Амины обладают основными свойствами, поэтому, как основания,
а) реагируют с водой: R- N:H2 + Н2О ↔ [R- NH3]+ ОН−
б) реагируют с кислотами: R- N:H2 + Нδ+Cl δ- ↔ [R- NH3]+ Cl−
2. Реакция горения: 4 С2Н5 + N:H2 + 15О2 → 8СО2↑ + 2N2↑ + 14Н2О.
3. Р. нитрирования (с НО – NО) проходит по-разному:
а) у первичных аминов:
R- NH2 + НО – NО (NaNO2 + HCl) → R – OH + N2↑ + NaCl + H2O;
б) у вторичных аминов:
R2 – NH + НО – NО (NaNO2 + HCl) → R2N – N=O + NaCl + H2O.
4. Анилин – ароматический амин с формулой С6Н5 — NH2
в реакции нитрирования:
С6Н5 — NH2 + НО – NО (NaNO2 + HCl) → [С6Н5 — N≡N]+Cl− + NaCl + 2H2O;
5. Качественная реакция на анилин – реакция с раствором брома:
С6Н5 — NH2 + 3Br2 → C6H2Br3NH2↓ + 3 HBr
6. Получение аминов:
а) NH3 + CH3Cl −t→ CH3 – NH2 + HCl;
б) R – NO2 + 4 [H] −LiAlH4→ R – NH2 + 2H2O
7. Получение анилина:
) C6H5 – NO2 + 6 [H] −Fe + HCl→ C6H5 – NH2 + 2H2O
9. Азотсодержащие соединения – аминокислоты
…β α
Общая формула – R – СН — СООН
│
NH2 Мr (к-ты) = (14п+75)
1.Аминокислоты обладают амфотерными свойствами, поэтому реагируют:
а) с кислотами H2N – CH2 – COOH + HCl → Cl [NH3 – CH2 — COOH];
б) c щелочами H2N – CH2 – COOH + NaOH → NH2 – CH2 – COONa + H2O.
2. Р. этерификации – взаимодействие со спиртами:
H2N – CH2 – COOH + С2Н5OH −H+→ H2N – CH2 – COO – С2Н5 + Н2О
3. Р. поликонденсации — взаимодействие кислот между собой с образованием пептидов: пептидная связь
H2N – CH2 – COOH + H—N – CH2 – COOH → H2N – CH2 – CO—N – CH2 – COOH
│ Дипептид │
Н Н
4. Получение: α- аминокислоты из α-хлорзамещенных карбоновых кислот
R – СН – СООН + 2 H3N → R – СН – СООН + NH4 Cl
│ │
Cl NH2
Окислительно – восстановительные реакции в органической химии.
А. Углеводороды.
1. СН2 = СН – СН2 – СН3 + КМпО4 + Н2О → СН2 – СН – СН2 – СН3 + МпО2 + КОН
│ │
ОН ОН
2. С6Н5 – СН2 – СН3 + КМпО4 + Н2SО4 → С6Н5СOOН + MnSO4 + K2SO4 + CO2 + H2O
3. СН2 = СН – СН2 – СН3 + КМпО4+ Н2SО4 → HCOOH + CH3COOH + MnSO4 + K2SO4 + H2O
4. CH ≡ CH + КМпО4 + Н2О → H2C2O4 + MnO2 + KOH
5. С6Н5 – СН3 + КМпО4 + Н2SО4 → С6Н5СOOН + MnSO4 + K2SO4 + H2O
6.
презентация содержит материал, который поможет выпускнику подготовить к ЕГЭ по химии
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
=> ПОЛУЧИТЬ СУПЕРСПОСОБНОСТИ УЧИТЕЛЯ <=
Просмотр содержимого
документа Трудные вопросы органической химии в заданиях ЕГЭ
Тестовая работа по органической химии
1 вариант
Часть А
1. Класс веществ, к которому принадлежит вещество
CH3-CH2-CH=CH-CH=CH2 имеет формулу
1) CnH2n-2 2) CnH2n 3) CnH2n-6 4) СnН2n+2.
2. Даны структурные формулы веществ CH3-O-CH3; CH3-CH2-OH; CH3-CH3;
O CH3 CH3 CH3
// /
CH3-CH2-C CH3-CH-CH3 CH-OH C
¦ | / /
H OH CH3 H OH
Среди них изомеров
1) 4 2) 7 3) 2 4) 3.
3. Веществу C6H5COOH изомерно соединение
1) 2) 3) 4)
4. Бензол может взаимодействовать с
1) водой; 2) бромоводородом; 3) бромом; 4) гидроксидом натрия
5. Дана цепочка превращений:
1 2 3 O 4 O 5 O
C2H4 → C2H5Cl → C2H5OH → CH3-C → CH3-C
→ CH3-C
H OH O-C2H5
Альдегид образуется на стадии
1) 2 2) 3 3) 4 4) 5
6. Алкан, структурная формула которого CH3-CH-CH2-CH2— CH — CH2 ,
| | |
называется CH3 CH3 CH3
-
1, 2, 5-триметилгексан;
-
2, 5-диметилгептан;
-
3, 6-диметилгептан;
-
2, 5, 6-триметилгексан.
7. Для предельных углеводородов характерны реакции
-
полимеризации;
-
замещения;
-
присоединения;
-
этерификации
8. Карбид кальция подвергли гидролизу. Полученный газ
1) метан 2) этилен 3) этан 4) ацетилен
9. Вещество CH2=CH-CH-CH-CH3 называется
| |
CH3CH3
-
2,3-диметилпентен-4;
-
2,3-диметилпентен-1;
-
3,4-диметилпентен-1;
-
3,4-диметилпентен-2
10. Алкен массой 0,21 г способен присоединить 0,8 г брома. Относительная молекулярная масса этого углеводорода равна
1) 44 2) 40 3) 42 4) 46
11. Атомы углерода в молекуле бензола находятся в состоянии гибридизации типа
1) sp3 2) sp 3) sp2 4) sp3d1
12. Гомологом бензола является углеводород состава
-
C7H8
-
C6H14
-
C6H12
-
C8H8
13. При тримеризации ацетилена образуется
-
циклогексан;
-
гексин;
-
гексен;
-
бензол
14. Восстановить водородом можно вещество
O O
1) CH3-C 2) CH3-C
3) CH3-CH2-OH 4) СН3 – О – СН3
H OH
15. Карбоновые кислоты содержат функциональную группу
O O
1) –OH 2) –C 3) –C
4) –NH2.
H OH
16. При взаимодействии карбоновых кислот со спиртами образуются
-
соли;
-
алкоголяты;
-
простые эфиры;
-
сложные эфиры.
17. Гидроксид меди (II) взаимодействует со спиртом
1) CH3OH 2) CH2-CH2 3) CH3-CH2-CH2-OH 4) C2H5OH
| |
OH OH
18. Из приведенных соединений к сложным эфирам относится
1) CH3-C-CH3 2) CH3-O-CH3 3) O 4) O
|| CH3-C CH3 — C
О O-CH3 H
19. В результате гидролиза сахарозы получают
-
глюкозу;
-
фруктозу;
-
глюкозу и фруктозу;
-
глюкозу и галактозу.
20. Даны формулы веществ:
CH3-C=O CH3 CH3
| /
NH2 NH C6H5-N СН3— NH2
/
CH3 CH3
среди них аминов
1) 1; 2) 2; 3) 3; 4) 4.
21. Более сильное основание
-
анилин;
-
аммиак;
-
метиламин;
-
диметиламин.
22. Аминокислоты могут взаимодействовать с
-
кислотами;
-
щелочами;
-
кислотами и щелочами;
-
ни с кислотами, ни с щелочами.
23. Белковые молекулы из аминокислот образуются по реакции
-
полимеризации;
-
сополимеризации;
-
поликонденсации;
-
сополиконденсации.
24. Раствор аминокислоты глицин NH2-CH2-COOH имеет реакцию среды
-
кислую;
-
слабокислую;
-
щелочную;
-
нейтральную.
25. При гидролизе белков нарушается структура белка
-
первичная;
-
вторичная;
-
третичная;
-
все структуры.
Часть В
В1. Установите соответствие между формулой вещества и его названием
|
Формула |
Название вещества |
|
А) СН3СН2СОН Б) НО-С6Н4-СН3 В) Cl-СН2-СООН Г) Br-С6Н4-NН2 |
1) пропаналь 2) хлоруксусная кислота 3) 4-броманилин 4) 4-метилфенол 5) этанол |
Получившуюся последовательность цифр запишите в бланк ответов без пробелов и других символов.
Часть С
Запишите полное решение заданий С3 и С5.
С3. Напишите уравнения реакций, с помощью которых можно осуществить превращения:
t0, кат. HCl AgNO3
циклогексен → Х1→C6H5-NO2 → Х2 → X3 → X4
С5. При сгорании 9 г предельного вторичного амина выделилось 2,24 л азота. Определите молекулярную формулу амина.
2 вариант
Часть А
1. Циклопарафины имеют общую формулу
-
CnH2n
-
CnH2n-6
-
CnH2n+2
-
СnH2n-2
2. Общей формуле CnH2n-2 отвечает углеводород
1. CH3-CH2-CН=CН-CH3
2. CH3-CH=C-CH3
|
CH3
3. CH3-CH2-CH2-CH=CH2
4. Н2С=С=СН2
3. Атомы углерода в этилене находятся в гибридном состоянии типа
-
sp3
-
sp2
-
sp
-
sp3d1.
O
4. Формулой R-C можно выразить строение веществ, принадлежащих к классу
H
-
спиртов;
-
карбоновых кислот;
-
альдегидов;
-
кетонов.
5. Общую формулу Cn(H2O)m имеет класс
-
углеводородов;
-
углеводов;
-
жиров;
-
сложных эфиров.
6. Дана цепочка превращений:
1 2 3 О 4 О 5
C→CH4 → CH3OH → H-C → H-C
→ HCOOCH3
H OH
Сложный эфир образуется на стадии
1) 2 2) 3 3) 4 4) 5.
7. Вещество CH2=CН-CH-CH-CH2 называется
| | |
CH3 CH3 CH3
-
3, 4, 5-триметилпентен-1;
-
3, 4-диметилгексен-1;
-
1, 2, 3-триметилпентен-4;
-
3, 4-диметилгексен-5.
8. 3-метилпентадиен-1,2 имеет структурную формулу
1) CH2 = CH-C = CH-CH3 2) CH2 = C = C-CH2-CH3
| |
CH3 CH3
3) CH2 = CH-CH-CH2-CH3 4) CH2 = C = C-CH-CH3
| |
CH3 С2Н5
9. При окислении этилена перманганатом калия образуется
-
уксусная кислота;
-
этиловый спирт;
-
этиленгликоль;
-
оксид этилена.
10. Гомологом бензола является углеводород состава
-
C8H10
-
C8H16
-
C6H12
-
С7Н16.
11. Для алкенов наиболее характерны реакции
-
замещения;
-
присоединения;
-
разложения;
-
гидролиза.
12. С раствором гидроксида калия может взаимодействовать
-
этанол;
-
фенол;
-
глицерин;
-
этаналь.
13. Молярная масса 2, 3, 4 — триметилгексена — 2 равна
-
128 г/моль;
-
140 г/моль;
-
126 г/моль;
-
130 г/моль.
14. При сжигании 1 моль газа образовалось 22,4 л углекислого газа и 36 г воды. Кислорода, затраченного на сжигание 1 моль этого газа, потребуется
-
1 моль;
-
2 моль;
-
3 моль;
-
4 моль.
15. Самую высокую степень диссоциации имеет вещество, формула которого
-
CH3-COOH;
-
Cl-CH2-COOH;
-
F-CH2-COOH;
-
CF3-COOH.
16. Жидкоемылоимеетформулу:
-
C17H35COONa;
-
C17H35COOK;
-
C17H35COOH;
-
C17H33COOH.
17. Глюкоза при окислении превращается в
-
этиловый спирт;
-
глюконовую кислоту;
-
молочную кислоту;
-
шестиатомный спирт – сорбит.
18. Природным полимером является
-
полиэтилен;
-
капрон;
-
сахароза;
-
крахмал.
19. Мономером природного каучука является вещество, формула которого
1) CH2 = C-CH = CH2 3) CH2-C = C = CH2
| |
Cl CH3
2) CH3 4) СН2 = С-СН = СН2
| |
CH2 = C-C = CH2 СН3
|
CH3
20. Альдегиды содержат функциональную группу
О
1) –OH 2) -C 3) –COOH 4) –NO2
H
21. Реакция среды водного раствора метиламина
-
кислая;
-
слабокислая;
-
нейтральная;
-
щелочная.
22. С метиламином не взаимодействует
-
вода;
-
гидроксид калия;
-
серная кислота;
-
кислород.
23. Из перечисленных веществ к нитросоединениям относят
CH2-O-NO2
| CH3
CH-O-NO2 CH3-NO2 СН3-NH3NO3
| NO2
CH2-O-NO2
-
одно;
-
два;
-
три;
-
четыре.
24. Сколько различных дипептидов может быть получено из глицина и аланина?
-
Один;
-
два;
-
три;
-
четыре.
25. Сколько веществ образуется в результате гидролиза соединения
О О
|| || О
NH2-CH2-C-NH-CH-C-NH-CH2-C
| O-C2H5
CH3
1) два 2) три 3) четыре 4) пять.
Часть В
В1. Установите соответствие между формулой вещества и названием гомологического ряда.
|
Формула |
Название вещества |
|
А) С6Н5-СН2-СН3 Б) СН3-С(СН3)2-СН2-СН3 В) СН2=С=СН-СН3 Г) СН3-СН=СН-СН3 |
1) алкадиены 2) алканы 3) арены 4) алкены 5) алкины |
Получившуюся последовательность цифр запишите в бланк ответов без пробелов и других символов.
Часть С
Запишите полное решение заданий С3 и С5.
С3. Напишите уравнения реакций, с помощью которых можно осуществить превращения:
СН3Cl, AlCl3 Cl2,hν NaOH,H2O
метан → Х1 → бензол → Х2 → Х3 → X4
С5. При взаимодействии 11,6 г предельного альдегида с избытком гидроксида меди (II) при нагревании образовался осадок массой 28,8 г. Выведите молекулярную формулу альдегида.
Тестовая работа по органической химии
(решение и ответы)
1 вариант
Часть А
|
Вопрос |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
|
Ответ |
1 |
3 |
2 |
3 |
2 |
2 |
2 |
4 |
3 |
3 |
3 |
1 |
4 |
|
Вопрос |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
|
Ответ |
1 |
3 |
4 |
2 |
3 |
3 |
3 |
4 |
3 |
4 |
4 |
4 |
В1 1 4 2 3
С3
t, Pt H2SO4 (конц)
1) С6Н10 → С6Н6 + 2Н2 2) С6Н6 + HO-NO2 → С6Н5-NO2 + H2O
3) С6Н5-NO2 + 6H → С6Н5-NH2 + 2 H2O
4) С6Н5-NH2 + HCl → С6Н5-NH3Cl
5) С6Н5-NH3Cl + AgNO3 → С6Н5-NH3NO3 + AgCl↓
С5
R1-NH-R2 + O2 → N2 + CO2 + H2O
n(N2) = 2,24 л / 22,4 л/моль = 0,1 моль
n(R1-NH-R2) = 0,2 моль
М(R1-NH-R2) = 9 г/ 0,2 моль = 45 г/моль
М(R1) = М(R2) = 45 – 15 = 30 г/моль
R1 = R2 = CH3,CH3-NH- CH3 — диметиламин.
2 вариант
Часть А
|
Вопрос |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
|
Ответ |
1 |
4 |
2 |
3 |
2 |
4 |
2 |
2 |
3 |
1 |
2 |
2 |
3 |
|
Вопрос |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
|
Ответ |
2 |
4 |
2 |
2 |
4 |
4 |
2 |
4 |
2 |
2 |
4 |
3 |
В1 3 2 1 4
С3 t Cакт., t
1) 2CH4 → C2H2 + 3H2 2) 3C2H2 → C6H6
AlCl3
3) C6H6 + CH3Cl → C6H5CH3 + HCl
hν
4) C6H5CH3 + Cl2 → C6H5CH2Cl + HCl
H2O
5) C6H5CH2Cl + NaOH → C6H5CH2OH + NaCl
C5
CnH2n+1CHO + 2Cu(OH)2 → CnH2n+1COOH + Cu2O↓ + 2H2O
n(Cu2O) = 28,8 г / 144г/моль = 0,2 моль
n(CnH2n+1CHO) = 0,2 моль
M(CnH2n+1CHO) = 11,6 г / 0,2 моль = 58 г/моль
12n + 2n + 1 + 12 + 1 + 16 = 58
n = 2,CH3-CH2-CHO пропионовый альдегид.
Вопросы с 1–25 оцениваются 1 баллом, задание В1 – 2 баллами,
С3 – 5 баллами, С5 – 3 баллами. Максимальное количество баллов – 35.
Шкала перевода баллов в отметку:
28–35 баллов — «5», 20–27 баллов — «4», 14–19 баллов — «3».
В зависимости от подготовленности класса
шкала перевода может быть изменена.