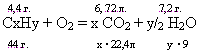Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Тип 33 № 48
Cложный эфир массой 30 г подвергнут щелочному гидролизу. При этом получено 34 г натриевой соли предельной одноосновной кислоты и 16 г спирта. Установите молекулярную формулу этого эфира.
2
Некоторый сложный эфир массой 7,4 г подвергнут щелочному гидролизу. При этом получено 9,8 г калиевой соли предельной одноосновной кислоты и 3,2 г спирта. Установите молекулярную формулу этого эфира.
3
При полном сгорании углеводорода образовалось 27 г воды и 33,6 л (н. у.). Относительная плотность углеводорода по аргону равна 1,05. Установите его молекулярную формулу.
4
Определите молекулярную формулу ацетиленового углеводорода, если молярная масса продукта его реакции с избытком бромоводорода в 4 раза больше, чем молярная масса исходного углеводорода.
5
При сгорании 0,45 г газообразного органического вещества выделилось 0,448 л (н. у.) углекислого газа, 0,63 г воды и 0,112 л (н. у.) азота. Плотность исходного газообразного вещества по азоту 1,607. Установите молекулярную формулу этого вещества.
Пройти тестирование по этим заданиям
Задачи 35 из реального ЕГЭ по химии-2021, все задачи на определение формулы из реального экзамена ЕГЭ по химии, задания 35 из реального ЕГЭ 2021 (основная волна и резервные дни — 30 мая 2021 года) с текстовыми решениями и ответами.
1. Вещество А содержит 37,5% углерода, 1,56% водорода, 35,94% натрия по массе, остальное – кислород. Вещество А образуется при обработке избытком раствора гидроксида натрия вещества Б без нагревания. Известно, что функциональные группы в молекуле вещества Б не находятся у соседних атомов углерода. Напишите уравнение реакции получения вещества А из вещества Б и гидроксида натрия.
Общая формула вещества А — CxHyOzNam
ω(O) = 100 — 37,5 — 1,56 — 35,94 = 25%
x : y : z : m = 37,5 / 12 : 1,56 / 1 : 25 / 16 : 35,94 / 23 = 2 : 1 : 1 : 1 = 6 : 3 : 3 : 3
Молекулярная формула вещества А — C6H3O3Na3
Структурная формула вещества А:
Уравнение реакции:
2. Вещество А содержит 30% углерода, 1,25% водорода, 48,75% калия по массе, остальное – кислород. Вещество А образуется при обработке избытком раствора гидроксида калия вещества Б без нагревания. Известно, что функциональные группы в молекуле вещества Б не находятся у соседних атомов углерода. Напишите уравнение реакции получения вещества А из вещества Б и гидроксида калия.
Общая формула вещества А — CxHyOzKm
ω(O) = 100 — 30 — 1,25 — 48,75 = 20%
x : y : z : m = 30 / 12 : 1,25 / 1 : 20 / 16 : 48,75 / 39 = 2 : 1 : 1 : 1 = 6 : 3 : 3 : 3
Молекулярная формула вещества А — C6H3O3K3
Структурная формула вещества А:
Уравнение реакции:
3. Вещество А содержит 47,52% углерода, 6,93% азота, 39,60% брома по массе и водород. Вещество А образуется при действии бромэтана на азотсодержащее вещество Б. Напишите уравнение реакции получения вещества А из вещества Б и бромэтана.
Общая формула вещества А — СxHyNzBrm
ω(H) = 100 — 47,52 — 6,93 — 36,90 = 5,95%
х : y : z : m = 47,52 / 12 : 5,95 / 1 : 6,93 / 14 : 39,6 / 80 = 3,96 : 5,95 : 0,495 : 0, 495 = 8 : 12 : 1 : 1
Молекулярная формула вещества А — C8H12NBr
Структурная формула вещества А:
Уравнение реакции получения вещества А:
4. При сгорании органического вещества А массой 3,03 г получили 3,136 л (н.у.) углекислого газа, 448 мл (н.у.) хлороводорода, 224 мл (н.у.) азота и 3,06 г воды. Вещество А образуется при действии хлорэтана на азотсодержащее вещество Б, молекула которого содержит четвертичный атом углерода. Напишите уравнение реакции получения вещества А из вещества Б и хлорэтана.
n(CO2) = 3,136 / 22,4 = 0,14 моль; n(C) = 0,14 моль
n(HCl) = 0,448 / 22,4 = 0,02 моль; n(Cl) = 0,02 моль
n(N2) = 0,224 / 22,4 = 0,01 моль ; n(N) = 0,02 моль
n(H2O) = 3,06 / 18 = 0,17 моль; n(H) = 0,17 · 2 + 0,02 = 0,36 моль
m(O) = 3,03 — 0,14 · 12 — 0,02 · 35,5 — 0,02 · 14 — 0,36 · 1 = 0
Вещество А не содержит кислорода.
Молекулярная формула вещества А — C7H18NCl
Структурная формула вещества А :
Уравнение реакции получения вещества А:
5. При сгорании органического вещества А массой 2,87 г получили 3,136 л (н.у.) углекислого газа, 448 мл (н.у.) хлороводорода, 224 мл (н.у.) азота и 1,62 г воды. Вещество А образуется при действии хлорметана на азотсодержащее вещество Б. Напишите уравнение реакции получения вещества А из вещества Б и хлорметана.
n(CO2) = 3,136 / 22,4 = 0,14 моль; n(C) = 0,14 моль
n(HCl) = 0,448 / 22,4 = 0,02 моль; n(Cl) = 0,02 моль
n(N2) = 0,224 / 22,4 = 0,01 моль; n(N) = 0,02 моль
n(H2O) = 1,62 / 18 = 0,09 моль; n(H) = 0,09 · 2 + 0,02 = 0,2 моль
m(O) = 2,87 — 0,14 · 12 — 0,02 · 35,5 — 0,02 · 14 — 0,2 · 1 = 0 г
Вещество А не содержит кислорода.
Молекулярная формула вещества А — C7H10NCl.
Структурная формула вещества А:
Уравнение реакции получения вещества А:
6. При сгорании органического вещества А массой 6,975 г получили 5,5 г углекислого газа и 3,36 л (н.у.) хлороводорода. При гидролизе вещества А в присутствии гидроксида калия образуется органическая соль Б, не содержащая атомов хлора. Молекула вещества А содержит четвертичный атом углерода. Напишите уравнение реакции гидролиза вещества А в присутствии гидроксида калия.
n(CO2) = 5,5 / 44 = 0,125 моль; n(C) = 0,125 моль
n(HCl) = 3,36 / 22,4 = 0,15 моль; n(Cl) = 0,15 моль
n(H) = 0,15 моль
m(O) = 6,975 — 0,125 · 12 — 0,15 · 35,5 — 0,15 · 1 = 0 г
Вещество А не содержит кислорода.
Молекулярная формула вещества А — C5H6Cl6.
Структурная формула вещества А:
Уравнение реакции получения вещества Б:
7. При сгорании органического вещества А массой 13,95 г получили 5,6 л (н.у.) углекислого газа и 6,72 л (н.у.) хлороводорода. При гидролизе вещества А в присутствии гидроксида натрия образуется органическая соль Б, не содержащая атомов хлора. Молекула вещества А содержит четвертичный атом углерода. Напишите уравнение реакции гидролиза вещества А в присутствии гидроксида натрия.
n(CO2) = 5,6 / 22,4 = 0,25 моль; n(C) = 0,25 моль
n(HCl) = 6,72 / 22,4 = 0,3 моль; n(Cl) = 0,3 моль
n(H) = 0,3 моль
m(O) = 13,95 — 0,25 · 12 — 0,3 · 35,5 — 0,3 · 1 = 0 г
Вещество А не содержит кислорода.
Молекулярная формула вещества А — C5H6Cl6.
Структурная формула вещества А:
Уравнение реакции получения вещества Б:
8. При сгорании органического вещества А массой 27,3 г получили 19,8 г углекислого газа и 13,44 л (н.у.) хлороводорода. При гидролизе вещества А в присутствии гидроксида калия образуется органическое вещество Б, которое взаимодействует при нагревании с гидроксидом меди(II) в молярном соотношении 1 : 4. Напишите уравнение реакции гидролиза вещества А в присутствии гидроксида калия.
n(CO2) = 19,8 / 44 = 0,45 моль; n(C) = 0,45 моль
n(HCl) =13,44 / 22,4 = 0,6 моль; n(Cl) = 0,6 моль
n(H) = 0,6 моль
m(O) = 27,3 — 0,45 · 12 — 0,6 · 35,5 — 0,6 · 1 = 0 г
Вещество А не содержит кислорода.
Молекулярная формула вещества А — C3H4Cl4.
Структурная формула вещества А:
Уравнение реакции получения вещества Б:
9. Вещество А содержит 45,71% углерода, 30,48% кислорода, 21,9% натрия по массе и водород. При нагревании вещества А с избытком гидроксида натрия образуется органическое вещество Б, которое не обесцвечивает бромную воду. Известно, что функциональные группы в веществе А максимально удалены друг от друга. Напишите уравнение реакции, протекающей при нагревании вещества А с избытком гидроксида натрия.
Общая формула вещества А — СxHyNazOm
ω(H) = 100 — 45,71 — 30,48 — 21,9 = 1,91%
х : y : z : m = 45,71 / 12 : 1,91 / 1 : 21,9 / 23 : 30,48 / 16 = 3,81 : 1,91 : 0,95 : 1,91 = 4 : 2 : 1 : 2
Молекулярная формула вещества А — C8H4Na2O4
Структурная формула вещества А:
Уравнение реакции получения вещества Б:
10. Вещество А содержит 34,09% углерода, 36,36% кислорода, 26,14% натрия по массе и водород. При нагревании вещества А с избытком гидроксида натрия образуется органическое вещество Б, молекула которого содержит только вторичный и первичные атомы углерода. Вещество А содержит четвертичный атом углерода. Напишите уравнение реакции, протекающей при нагревании вещества А с избытком гидроксида натрия.
Общая формула вещества А — СxHyNazOm
ω(H) = 100 — 34,09 — 36,36 — 26,14 = 3,41%
х : y : z : m = 34,09 / 12 : 3,41 / 1 : 26,14 / 23 : 36,36 / 16 = 2,84 : 3,41 : 1,137 : 2,27 = 2,5 : 3 : 1 : 2
Молекулярная формула вещества А — C5H6Na2O4
Структурная формула вещества А:
Уравнение реакции получения вещества Б:
11. При сгорании 38,5 г органического вещества получили 92,4 г углекислого газа и 18,9 г воды. Известно, что функциональные группы в молекуле этого вещества находятся у соседних атомов углерода. Напишите уравнение реакции этого вещества с избытком водного раствора гидроксида натрия.
n(CO2) = 92,4 / 44 = 2,1 моль; n(C) = 2,1 моль
n(H2О) =18,9 / 18 = 1,05 моль; n(Н) = 2,1 моль
m(O) = 38,5 — 2,1 · 12 — 2,1 · 1 = 11,2 г
n(O) = 11,2 / 16 = 0,7 моль
Молекулярная формула вещества — C6H6О2.
Структурная формула вещества:
Уравнение реакции вещества с избытком водного раствора гидроксида натрия.:
12. Вещество А содержит 2,6% водорода, 20,78% кислорода, 29,87% натрия по массе, остальное – углерод. Вещество А образуется при обработке избытком раствора гидроксида натрия вещества Б без нагревания. Известно, что функциональные группы в молекуле вещества Б находятся у соседних атомов углерода. Напишите уравнение реакции получения вещества А из вещества Б и гидроксида натрия.
Общая формула вещества А — СxHyNazOm
ω(С) = 100 — 2,6 — 20,78 — 29,87 = 53,25%
х : y : z : m = 46,75 / 12 : 2,6 / 1 : 29,87 / 23 : 20,78 / 16 = 3,9 : 2,6 : 1,3 : 1,3 = 3 : 2 : 1 : 1
Молекулярная формула вещества А — C6H4Na2O2
Структурная формула вещества А:
Уравнение реакции получения вещества А:
13. Вещество А содержит 46,75% углерода, 20,78% кислорода, 29,87% натрия по массе, остальное – водород. Вещество А образуется при обработке избытком раствора гидроксида натрия вещества Б без нагревания. Известно, что функциональные группы в молекуле вещества Б максимально удалены друг от друга. Напишите уравнение реакции получения вещества А из вещества Б и гидроксида натрия.
Общая формула вещества А — СxHyNazOm
ω(H) = 100 — 46,75 — 20,78 — 29,87 = 2,6%
х : y : z : m = 46,75 / 12 : 2,6 / 1 : 29,87 / 23 : 20,78 / 16 = 3,9 : 2,6 : 1,3 : 1,3 = 3 : 2 : 1 : 1
Молекулярная формула вещества А — C6H4Na2O2
Структурная формула вещества А:
Уравнение реакции получения вещества А:
14. При сгорании 12,11 г органического вещества получили 18,48 г углекислого газа, 5,67 г бромоводорода и 2,52 г воды. Известно, что функциональные группы в молекуле этого вещества находятся у соседних атомов углерода. Напишите уравнение реакции этого вещества с избытком водного раствора гидроксида натрия без нагревания.
n(CO2) = 18,48 / 44 = 0,42 моль; n(C) = 0,42 моль
n(HBr) = 5,67 / 81 = 0,07 моль; n(Br) = 0,07 моль
n1(H) = 0,07 моль
n(H2O) = 2,52 / 18 = 0,14 моль; n2(H) = 0,28 моль
n(H) = 0,07 + 0,28 = 0,35 моль
m(O) = 12,11 — 0,42 · 12 — 0,07 · 80 — 0,35 · 1 = 1,12 г
n(O) = 1,12 / 16 = 0,07 моль
Молекулярная формула вещества — C6H5BrO.
Структурная формула вещества:
Уравнение реакции взаимодействия вещества с раствором гидроксида натрия:
15. При сгорании 5,19 г органического вещества получили 4,032 л (н.у.) углекислого газа, 2,43 г бромоводорода и 1,08 г воды. Известно, что функциональные группы в молекуле этого вещества максимально удалены друг от друга. Напишите уравнение реакции этого вещества с избытком водного раствора гидроксида калия без нагревания.
n(CO2) = 4,032 / 22,4 = 0,18 моль; n(C) = 0,18 моль
n(HBr) = 2,43 / 81 = 0,03 моль; n(Br) = 0,03 моль
n1(H) = 0,03 моль
n(H2O) = 1,08 / 18 = 0,06 моль; n2(H) = 0,12 моль
n(H) = 0,03 + 0,12 = 0,15 моль
m(O) = 5,19 — 0,18 · 12 — 0,03 · 80 — 0,15 · 1 = 0,48 г
n(O) = 0,48 / 16 = 0,03 моль
Молекулярная формула вещества — C6H5BrO.
Структурная формула вещества:
Уравнение реакции взаимодействия вещества с раствором гидроксида калия:
Немного необычные задачи на нахождение формулы органического вещества.
Задание №1
При сжигании 8,9 г неизвестного органического вещества было получено 1,12 л азота (н.у.), 6,3 г воды и 6,72 л углекислого газа (н.у.). Известно, что 1 моль этого вещества может прореагировать с 3 моль железа в кислой среде, а его молекула имеет несимметричное строение.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение взаимодействия этого вещества с избытком алюминия в растворе соляной кислоты (используйте структурные формулы органических веществ).
Решение
Ответ:
1) молекулярная формула органического вещества: C3H7NO2
2) структурная формула вещества, которая однозначно определяет порядок связи атомов в его молекуле:
CH3-CH2-CH2-NO2
3) уравнение реакции искомого вещества с избытком алюминия в растворе соляной кислоты:
CH3-CH2-CH2-NO2 + 2Al + 7HCl → CH3-CH2-CH2-NH3Cl + 2AlCl3 + 2H2O
Решение:
1) Поскольку в продуктах сгорания вещества присутствуют азот, вода и углекислый газ, то можно представить его молекулярную формулу в виде CxHyOzNk.
Вычислим количества и массы элементов, составляющих искомое органическое вещество:
ν(N2) = V/Vm = 1,12 л/22,4 л/моль = 0,05 моль;
ν(N) = 2ν(N2) = 2 · 0,05 моль = 0,1 моль;
m(N) = M · ν = 14 г/моль · 0,1 моль = 1,4 г;
ν(H2O) = m/M = 6,3 г/18 г/моль = 0,35 моль;
ν(H) = 2ν(H2O) = 2 · 0,35 моль = 0,7 моль;
m(H) = M · ν = 1 г/моль · 0,7 моль = 0,7 г;
ν(CO2) = V/Vm = 6,72 л/22,4 л/моль = 0,3 моль;
ν(C) = ν(CO2) = 0,3 моль;
m(C) = M · ν = 12 г/моль · 0,3 моль = 3,6 г.
Далее по разности проверим наличие в веществе кислорода:
m(O) = m(CxHyOzNk) − m(N) − m(H) − m(C) = 8,9 г − 1,4 г − 0,7 г − 3,6 г = 3,2 г.
Вычислим количество кислорода:
ν(O) = m/M = 3,2 г/16 г/моль = 0,2 моль.
Запишем соотношение по молям для элементов, составляющих структуру CxHyOzNk:
x : y : z : k = ν(C) : ν(H) : ν(O) : ν(N) = 0,3 : 0,7 : 0,2 : 0,1 = 3 : 7 : 2 : 1.
Следовательно, C3H7NO2 – молекулярная формула искомого органического соединения.
2) Далее по описанию в задаче попытаемся установить структурную формулу вещества. Общая формула CnH2n+1NO2 может соответствовать предельной аминокислоте, либо мононитроалкану. По условию вещество реагирует с железом в кислой среде в соотношении 1:3, что характерно для процесса восстановления нитрогруппы до амина, следовательно, искомым органическим веществом является мононитроалкан, для которого характерно два изомера – 1-нитропропан и 2-нитропропан. Поскольку молекула вещества имеет несимметричное строение, следовательно, этим веществом является 1-нитропропан.
Структурная формула органического соединения (1-нитропропан):
CH3-CH2-CH2-NO2
3) Запишем уравнение взаимодействия этого вещества с избытком алюминия в растворе соляной кислоты:
CH3-CH2-CH2-NO2 + 2Al + 7HCl → [CH3-CH2-CH2-NH3]+Cl— + 2AlCl3 + 2H2O
Задание №2
Неизвестное органическое соединение содержит 54,24% кислорода, 5,08% водорода и углерод. Определите молекулярную формулу данного соединения и установите его строение, если известно, что при взаимодействии 0,5 моль данного соединения с избытком гидрокарбоната натрия выделяется 22,4 л (н.у.) газа, а в его структуре отсутствуют третичные атомы углерода.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение взаимодействия этого вещества с избытком раствора гидроксида бария (используйте структурные формулы органических веществ).
Решение
Ответ:
1) молекулярная формула органического вещества: С4Н6О4
2) структурная формула вещества, которая однозначно отражает порядок связи атомов в его молекуле:
3) уравнение реакции искомого вещества с избытком раствора гидроксида бария:
Решение:
1) Поскольку в составе вещества присутствуют кислород, водород и углерод, то можно представить его молекулярную формулу в виде CxHyOz.
Пусть масса навески искомого органического вещества CxHyOz составляет 100 г. Вычислим массы и количества кислорода и водорода в его составе:
m(О) = m(CxHyOz) · ω(О)/100% = 100 г · 54,24%/100% = 54,24 г;
ν(О) = m/M = 54,24 г/16 г/моль = 3,39 моль;
m(Н) = m(CxHyOz) · ω(Н)/100% = 100 г · 5,08%/100% = 5,08 г;
ν(Н) = m/M = 5,08 г/1 г/моль = 5,08 моль.
Далее вычислим массу и количество углерода:
m(С) = m(CxHyOz) − m(О) − m(Н) = 100 г − 54,24 г − 5,08 г = 40,68 г;
ν(С) = m/M = 40,68 г/12 г/моль = 3,39 моль.
Запишем соотношение по молям для элементов, составляющих структуру CxHyOz:
x : y : z = ν(C) : ν(H) : ν(O) = 3,39 : 5,08 : 3,39 = 1 : 1,5 : 1 = 2 : 3 : 2; следовательно,
С2Н3О2 – простейшая формула искомого органического соединения.
Предположим, что n = 2, тогда формула вещества имеет состав С4Н6О4. Для данной формулы существует несколько изомеров. Поскольку по описанию вещество реагирует с гидрокарбонатом натрия с образованием газа, то в нем содержатся карбоксильные группы. Исходя из молекулярной формулы, их может быть одна или две. Вычислим количество газа и установим соотношения для моно− и дикарбоновой кислот:
ν(CO2) = V/Vm = 22,4 л/22,4 л/моль = 1 моль.
Реакция гидрокарбоната натрия с монокарбоновой кислотой:
R-COOH + NaHCO3 = R-COONa + CO2 + H2O, тогда
ν(CO2)/ν(R-COOH) = 1/1.
Реакция гидрокарбоната натрия с дикарбоновой кислотой:
HOOC-R-COOH + 2NaHCO3 = NaOOC-R-COONa + 2CO2 + 2H2O, тогда
ν(CO2)/ν(HOOC-R-COOH) = 2/1.
В нашем случае соотношение будет следующим:
ν(CO2)/ν(CxHyOz) = 1/0,5 = 2/1; следовательно, делаем вывод, что искомое органическое вещество − дикарбоновая кислота.
2) Поскольку в ее структуре нет третичных атомов углерода, то она имеет линейное строение.
Структурная формула дикарбоновой кислоты выглядит следующим образом (янтарная кислота):
3) Запишем реакцию искомого вещества с избытком раствора гидроксида бария:
Задание №3
При сжигании 7,375 г неизвестного органического вещества, не содержащего кислород, был получен хлороводород, 0,9 г воды и 6,6 г углекислого газа. Известно, что 1 моль этого вещества может прореагировать с 320 г 50%-ного водного раствора гидроксида натрия.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение взаимодействия этого вещества с избытком раствора гидроксида бария (используйте структурные формулы органических веществ).
Решение
Ответ:
1) молекулярная формула органического вещества: C3H5Cl3
2) структурная формула вещества, которая однозначно отражает порядок связи атомов в его молекуле:
CH3-CH2-CCl3
3) уравнение взаимодействия этого вещества с избытком раствора гидроксида бария:
Пояснение:
1) Поскольку в продуктах сгорания органического вещества содержатся хлороводород, вода и углекислый газ, а кислород отсутствует, то можно представить его молекулярную формулу в виде CxHyClz.
Далее вычислим количества и массы водорода и углерода, присутствующих в составе искомого органического вещества (водород присутствует в молекуле воды (I) и хлороводорода (II)):
ν(H2O) = m/M = 0,9 г/18 г/моль = 0,05 моль;
νl(H) = 2ν(H2O) = 2 · 0,05 моль = 0,1 моль;
ml(H) = M · ν = 1 г/моль · 0,1 моль = 0,1 г;
ν(CO2) = m/M = 6,6 г/44 г/моль = 0,15 моль;
ν(C) = ν(CO2) = 0,15 моль;
m(C) = M · ν = 12 г/моль · 0,15 моль = 1,8 г.
Далее необходимо найти массу и количество в веществе хлора и части водорода, которая связалась с ним при сгорании исходного соединения. Их суммарную массу можно найти по разности:
m(Cl + H) = m(CxHyClz) − m(C) − ml(H) = 7,375 г − 1,8 г − 0,1 г = 5,475 г.
Поскольку соотношение хлора и водорода в HCl равно 1:1, можно обозначить количество элементов за х и решить уравнение:
M(Cl) · ν(Cl) + M(H) · ν(H) = m(Cl + H); следовательно,
35,5х + 1х = 5,475;
36,5х = 5,475;
х = 0,15 моль; следовательно,
ν(Cl) = 0,15 моль;
νll(H) = 0,15 моль.
Вычислим общее количество водорода в составе соединения:
ν(H) = νll(H) + νl(H) = 0,15 моль + 0,1 моль = 0,25 моль.
Запишем соотношение по молям для элементов, составляющих структуру CxHyOz:
x : y : z = ν(C) : ν(H) : ν(Cl) = 0,15 : 0,25 : 0,15 = 3 : 5 : 3; следовательно,
C3H5Cl3 – молекулярная формула искомого органического вещества.
2) Предположим, что n = 1, тогда получаем молекулярную формулу C3H5Cl3.
Существует несколько изомерных трихлорпропанов и все они реагируют с водным раствором щелочи. Рассмотрим возможные варианты:
CH2Cl-CHCl-CH2Cl + 3NaOH = CH2OH-CHOH-CH2OH + 3NaCl;
CH3-CHCl-CHCl2 + 3NaOH = CH3-CHOH-CHO + 3NaCl + H2O;
CH2Cl-CH2-CHCl2 + 3NaOH = CH2OH-CH2-CHO + 3NaCl + H2O;
CH3-CCl2-CH2Cl + 3NaOH = CH3-C(O)-CH2ОН + 3NaCl + H2O;
при этом ν(NaOH)/ν(C3H5Cl3) = 3/1.
CH3-CH2-CCl3 + 4NaOH = CH3-CH2-COONa + 3NaCl + 2H2O;
при этом ν(NaOH)/ν(C3H5Cl3) = 4/1.
Вычислим количество гидроксида натрия по данным условия и определим соотношение количеств вещества и щелочи:
m(NaOH) = m(р-ра NaOH) · ω(NaOH)/100% = 320 г · 50%/100% = 160 г;
ν(NaOH) = m/M = 160 г/40 г/моль = 4 моль;
ν(NaOH)/ν(C3H5Cl3) = 4/1.
Таким образом, приходим к выводу, что искомое органическое вещество − 1,1,1-трихлорпропан.
Структурная формула органического вещества (1,1,1-трихлорпропан):
CH3-CH2-CCl3
3) Запишем уравнение взаимодействия 1,1,1-трихлорпропана с с избытком раствора гидроксида бария:
Задание №4
Неизвестное органическое соединение содержит 18,25% натрия, 50,79% кислорода, 2,38% водорода и углерод. Определите молекулярную формулу данного соединения и установите его строение, если известно, что 1 моль данного соединения может прореагировать с 1 моль хлороводорода или 1 моль гидрокарбоната калия.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение взаимодействия этого вещества с избытком бромэтана (используйте структурные формулы органических веществ).
Решение
Ответ:
1) молекулярная формула органического вещества: С3Н3О4Na
2) структурная формула вещества, которая однозначно отражает порядок связи атомов в его молекуле:
3) уравнение взаимодействия этого вещества с избытком бромэтана:
Пояснение:
1) Поскольку в составе искомого органического вещества присутствуют натрий, кислород, водород и углерод, то можно представить его молекулярную формулу в виде CxHyOzNak. Пусть масса навески неизвестного вещества CxHyOzNak составляет 100 г, тогда вычислим массы и количества натрия, кислорода и водорода в его составе:
m(Na) = m(CxHyOzNak) · ω(Na)/100% = 100 г · 18,25%/100% = 18,25 г;
ν(Na) = m/M = 18,25 г/23 г/моль = 0,7935 моль;
m(О) = m(CxHyOzNak) · ω(О)/100% = 100 г · 50,79%/100% = 50,79 г;
ν(О) = m/M = 50,79 г/16 г/моль = 3,174 моль;
m(Н) = m(CxHyOzNak) · ω(Н)/100% = 100 г · 2,38%/100% = 2,38 г;
ν(Н) = m/M = 2,38 г/1 г/моль = 2,38 моль.
Далее вычислим массу и количество углерода, входящего в состав искомого органического вещества:
m(С) = m(CxHyOzNak) − m(Na) − m(О) − m(Н) = 100 г − 18,25 г − 50,79 г − 2,38 г = 28,58 г;
ν(С) = m/M = 28,58 г/12 г/моль = 2,382 моль.
Запишем соотношение по молям для элементов, составляющих структуру органического вещества:
x : y : z : k = ν(C) : ν(H) : ν(O) : ν(Na) = 2,382 : 2,38 : 3,174 : 0,7935 = 3 : 3 : 4 : 1.
С3Н3О4Na – простейшая формула искомого органического вещества.
2) Пусть n = 1, тогда молекулярная формула органического вещества − С3Н3О4Na. Поскольку данное вещество реагирует с гидрокарбонатом калия в соотношении 1:1, то предположим наличие одной карбоксильной группы в структуре:
R-COOH + KHCO3 = R-COOК + CO2 + H2O,
ν(CO2)/ν(R-COOH) = 1/1.
Тогда остается определить положение в структуре органического вещества 2 атомов кислорода и атома натрия. Поскольку данное вещество реагирует с хлороводородом в соотношении 1:1, то предположим наличие одного карбоксилат-аниона, связанного с катионом натрия:
R-COONa + HCl = R-COOH + NaCl;
ν(R-COONa)/ν(HCl) = 1/1.
Таким образом, в искомой структуре присутствуют одновременно карбоксильная группа и карбоксилат-анион.
Структурная формула органического вещества (мононатриевая соль малоновой кислоты):
3) Запишем уравнение взаимодействия этого вещества с избытком бромэтана:
Задание №5
При сжигании 5,2 г неизвестного органического вещества было получено 1,8 г воды и 3,36 л (н.у.) углекислого газа. Известно, что 1 моль этого вещества может прореагировать с 1 моль гидроксида бария или 0,5 моль порошка магния.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение взаимодействия этого вещества с избытком метанола в присутствии кислоты (используйте структурные формулы органических веществ).
Решение
Ответ:
1) молекулярная формула органического вещества: С3Н4О4
2) структурная формула вещества, которая однозначно отражает порядок связи атомов в его молекуле:3) уравнение реакции этого вещества с избытком метанола в присутствии кислоты:
Пояснение:
1) Поскольку в продуктах сгорания вещества присутствуют вода и углекислый газ, то можно представить его молекулярную формулу в виде CxHyOz. Далее вычислим количества и массы водорода и углерода, входящих в состав искомого органического соединения:
ν(H2O) = m/M = 1,8 г/18 г/моль = 0,1 моль;
ν(H) = 2ν(H2O) = 2 · 0,1 моль = 0,2 моль;
m(H) = M · ν = 1 г/моль · 0,2 моль = 0,2 г;
ν(CO2) = V/Vm = 3,36 л/22,4 л/моль = 0,15 моль;
ν(C) = ν(CO2) = 0,15 моль;
m(C) = M · ν = 12 моль · 0,15 моль = 1,8 г.
Далее по разности проверим наличие в веществе кислорода:
m(O) = m(CxHyOz) − m(H) − m(C) = 5,2 г − 0,2 г − 1,8 г = 3,2 г.
По расчету получилось, что в соединении присутствует кислород. Вычислим его количество:
ν(O) = m/M = 3,2 г/16 г/моль = 0,2 моль.
Запишем соотношение по молям для элементов, составляющих структуру искомого органического вещества:
x : y : z = ν(C) : ν(H) : ν(O) = 0,15 : 0,2 : 0,2 = 1,5 : 2 : 2 = 3 : 4 : 4.
С3Н4О4 – простейшая формула искомого органического вещества.
2) Пусть n = 1, тогда молекулярная формула С3Н4О4. Поскольку данное соединение реагирует с металлическим магнием, то можно предположить наличие в нем карбоксильных групп. Исходя из молекулярной формулы, их может быть одна или две. Установим соотношения моль реагентов для моно− и дикарбоновой кислот:
Для монокарбоновой кислоты:
2R-COOH + Mg = Mg(R-COO)2 + H2;
тогда ν(R-COOH)/ν(Mg) = 2/1.
Для дикарбоновой кислоты:
HOOC-R-COOH + Mg = Mg(OOC-R-COO) + H2;
тогда ν(HOOC-R-COOH)/ν(Mg) = 1/1.
В нашем случае соотношение будет следующим:
ν(CxHyOz)/ν(Mg) = 1/0,5 = 2/1.
Делаем вывод, что искомое вещество содержит только одну карбоксильную группу. Тогда оставшиеся два атома кислорода могут входить в состав сложноэфирной группы. Проверим гипотезу по соотношению моль веществ в реакции с гидроксидом бария:
RlOOC-R-COOH + Ba(OH)2 = Ba(OOC-R-COO) + RlOH + H2O;
тогда ν(RlOOC-R-COOH)/ν(Ba(OH)2) = 1/1.
В нашем случае соотношение по данным задачи будет следующим: ν(CxHyOz)/ν(Ba(OH)2) = 1/1.
Таким образом, в структуре искомого соединения присутствуют и карбоксильная, и сложноэфирная группы.
Структурная формула искомого органического вещества (монометиловый эфир щавелевой кислоты):
3) Запишем уравнение реакции этого вещества с избытком метанола в присутствии кислоты:
[adsp-pro-3]
Определение формулы вещества
(углеводороды)-решение –задание 35
1. В
результате сплавления натриевой соли карбоновой кислоты с гидроксидом
натрия массой 14 г получили карбонат натрия и газообразное
органическое вещество массой 15,4 г. Определите молекулярную формулу
полученного газообразного соединения.
Пояснение.
Составим
уравнение реакции:
Определим
количество моль гидроксида натрия и углеводорода:
Установим
формулу углеводорода:
Молекулярная
формула пропана —
2. Для
полного гидрирования 4,6 г гомолога бензола потребовалось 3,36 л
(н. у.) водорода. Запишите уравнение реакции в общем виде. Определите
молекулярную формулу циклоалкана, образовавшегося при гидрировании.
Пояснение.
Элементы
ответа:
1) Составлено
уравнение реакции в общем виде:
2) Рассчитано
количество вещества водорода и гомолога бензола:
3) Определено
число атомов углерода в составе гомолога бензола, и установлена молекулярная
формула циклоалкана:
Молекулярная
формула циклоалкана —
3. При
сгорании 17,5 г органического вещества получили 28 л (н. у.)
углекислого газа и 22,5 мл воды. Плотность паров этого вещества
(н. у.) составляет 3,125 г/л. Известно также, что это вещество было
получено в результате дегидратации третичного спирта. На основании
данных условия задачи:
1) произведите
вычисления, необходимые для установления молекулярной формулы органического
вещества;
2) запишите
молекулярную формулу органического вещества;
3) составьте
структурную формулу исходного вещества, которая однозначно отражает
порядок связи атомов в его молекуле;
4) напишите
уравнение реакции получения данного вещества дегидратацией соответствующего
третичного спирта.
Пояснение.
1)
Найдено количество вещества продуктов сгорания:
Значит
никаких других элементов в состав вещества не входит, так как его масса равна
сумме масс водорода и углерода.
2)
Установлена молекулярная формула вещества: простейшая
формула —
это алкен или циклоалкан.
Так как
вещество может быть получено при дегидратации спирта, то это алкен.
Для
определения его молекулярной формулы напишем реакцию горения в общем виде
Вспомним,
что плотность паров этого вещества (н.у.) составляет 3,125 г/л.
Значит .
По
уравнению реакции
получаем, что
Молекулярная
формула соединения
3)
Учитывая, что вещество может быть получено из третичного спирта, получаем
структурную формулу вещества:
4)
Составлено уравнение реакции дегидратации:
4. Жидкий
при обычных условиях ацетиленовый углеводород массой 4,51 г может
полностью прореагировать с 440 г бромной воды с массовой долей брома
4 %. Углеводород взаимодействует с аммиачным раствором оксида
серебра, и в его составе есть четвертичный атом углерода. Установите молекулярную
формулу углеводорода, изобразите его структурную формулу и напишите
уравнение реакции с водой.
Пояснение.
1) Напишем
уравнение реакции в общем виде и вычислим количество вещества брома:
2) Установим
молекулярную формулу углеводорода:
Молекулярная
формула углеводорода —
3) Изобразим
структурную формулу.
Углеводород
взаимодействует с аммиачным раствором оксида серебра, следовательно
тройная связь находится на краю цепи. Структурная формула с четвертичным
атомом углерода:
4) Напишем
уравнение реакции с водой:
5. Смесь
цис- и транс-изомеров этиленового углеводорода общим объёмом 1,568 л (н.
у.) пропустили через избыток водного раствора перманганата калия, в результате
образовался двухатомный спирт массой 6,30 г. Установите молекулярную формулу
углеводорода, изобразите структурную формулу транс-изомера и напишите
уравнение его реакции с подкисленным раствором перманганата калия.
Пояснение.
1) Напишем
уравнение реакции в общем виде и вычислим:
общее количество вещества этиленового
углеводорода:
или
2) Установим
молекулярную формулу углеводорода:
Молекулярная
формула углеводорода —
3) Изобразим
структурную формулу.
Цис-транс-изомеры
есть только у бутена-2. Структура транс-изомера:
4) Напишем
уравнение окисления бутена-2 до уксусной кислоты:
6. При
полном сгорании 17,1 г жидкого углеводорода образовалось 26,88 л (н. у.)
углекислого газа. Известно, что при радикальном хлорировании углеводорода
образуется только одно монохлорпроизводное. Установите молекулярную формулу
углеводорода, изобразите его структурную формулу и напишите уравнение
реакции с хлором на свету.
Пояснение.
1) Напишем
уравнение реакции в общем виде:
2) Установим
молекулярную формулу углеводорода:
Молекулярная
формула углеводорода —
3) Изобразим
структурную формулу.
Все атомы
водорода в молекуле эквивалентны. Среди всех изомеров таким
свойством обладает только 2,2,3,3-тетраметилбутан:
4) Напишем
уравнение реакции с хлором на свету:
7. При
бромировании 28,8 г гомолога бензола в присутствии железа получено
35,82 г монобромпроизводного. Выход продукта составил 75 %. Известно, что
при бромировании этого углеводорода на свету образуется единственное
монобромпроизводное. Установите молекулярную формулу углеводорода,
изобразите его структурную формулу и напишите уравнение реакции с
бромом на свету.
Пояснение.
1) Напишем
уравнение реакции в общем виде:
2) Установим
молекулярную формулу углеводорода:
mтеор
Молекулярная
формула —
3) Изображена
структурная формула.
Так как
на свету образуется только одно монобромпроизводное, все атомы водорода
в боковых цепях эквивалентны. Это означает, что в боковых цепях есть только
метильные группы. Среди трёх триметилбензолов наиболее
симметричным является 1,3,5-триметилбензол:
4) Написано
уравнение реакции с бромом на свету:
8. При полной
гидратации 20,5 г ацетиленового углеводорода образовалось органическое
вещество массой 25,0 г. Определите молекулярную формулу углеводорода
и установите его структуру, если известно, что он реагирует с аммиачным
раствором оксида серебра, а в состав молекулы входят три метильные
группы. Напишите уравнение реакции этого углеводорода с избытком
хлороводорода.
Пояснение.
1) Напишем
уравнение с водой в общем виде.
CnH2n−2+H2O
→ CnH2nO
2) Составим
математическое выражение и определим молекулярную формулу углеводорода.
Молекулярная
формула —
3) Изобразим
структурную формулу.
Углеводород
реагирует с аммиачным раствором оксида серебра, следовательно, тройная
связь находится на краю цепи. Три метильные группы есть в молекуле
3,3-диметилбутина-1:
4) Напишем
уравнение реакции с избытком хлороводорода:
9. При действии
избытка водного раствора перманганата калия на 10,5 г этиленового
углеводорода образовалось органическое вещество массой 15,6 г. Определите
молекулярную формулу углеводорода и установите его структуру,
если известно, что в результате реакции с горячим подкисленным раствором
перманганата калия образуются кетон и углекислый газ. Напишите
уравнение гидратации этого углеводорода.
Пояснение.
1) Напишем
уравнение окисления в общем виде:
Допускается
также схема в виде
2) Составим
математическое выражение и определим молекулярную формулу
углеводорода.
Молекулярная
формула —
3) Изобразим
структурную формулу.
При окислении
углеводорода образуются кетон и углекислый газ, следовательно, двойная
связь находится при разветвлении цепи, с одной стороны, и с края цепи, с
другой стороны. Углеводород – 2-метилбутен-1.
4) Напишем
уравнение реакции с водой:
10. При
сгорании 4,48 л (н. у.) газообразного органического вещества получили 35,2
г углекислого газа и 10,8 г воды. Плотность этого вещества составляет 2,41 г/л
(н. у.). Известно также, что это вещество не реагирует с аммиачным
раствором оксида серебра, а при реакции его с избытком бромной воды происходит
присоединение атомов брома только ко вторичным атомам углерода.
На
основании данных условия задачи:
1)
произведите вычисления, необходимые для установления молекулярной формулы
органического вещества;
2)
запишите молекулярную формулу органического вещества;
3)
составьте структурную формулу исходного вещества, которая однозначно отражает
порядок связи атомов в его молекуле;
4) напишите
уравнение реакции этого вещества с избытком бромной воды.
Пояснение.
Общая
формула вещества —
1)
Найдены количество вещества углекислого газа, воды и органического вещества:
= 35,2
/ 44 = 0,8 моль
= 10,8
/ 18 = 0,6 моль
=
2,41 · 22, 4 = 54 г/моль
= 4,48
/ 22,4 = 0,2 моль
2)
Определена молекулярная формула вещества:
=
= 0,8
моль
=
= 1,2
моль
=
/
=
0,8 / 0,2 = 4
=
/
= 1,2
/ 0,2 = 6
4 · 12 +
6 + z · 16 = 54
= 0
Молекулярная
формула —
3)
Составлена структурная формула вещества:
4)
Составлено уравнение реакции этого вещества с избытком бромной воды:
11. При
сгорании 16,2 г органического вещества нециклического строения получили 26,88 л
(н. у.) углекислого газа и 16,2 г воды. Известно, что 1 моль этого
органического вещества в присутствии катализатора присоединяет только 1 моль
воды и данное вещество не реагирует с аммиачным раствором оксида серебра.
На
основании данных условия задачи:
1)
произведите вычисления, необходимые для установления молекулярной формулы
органического вещества;
2)
запишите молекулярную формулу органического вещества;
3)
составьте структурную формулу органического вещества, которая однозначно
отражает порядок связи атомов в его молекуле;
4)
напишите уравнение реакции гидратации органического вещества.
Пояснение.
Искомое
вещество — углеводород
Простейшая
формула
Возможные
молекулярные формулы:,
,
и
т.д. Условию, что 1 моль этого органического вещества в присутствии
катализатора присоединяет только 1 моль воды, соответствует только
формула ,
при условии, что это алкин, а не алкадиен (остальные могут присоединять большее
количество воды)
Молекулярная
формула: —
бутин
Вещество
не реагирует с аммиачным раствором оксида серебра, значит, тройная связь находится
не у крайнего атома углерода − бутин-2
Структурная
формула:
12. При нитровании 26,5 г гомолога бензола получено 30,2 г
мононитропроизводного. Выход продукта составил 80 %, других нитропроизводных
не образовалось. Установите молекулярную формулу углеводорода, изобразите
его структурную формулу и напишите уравнение реакции с хлором на
свету.
Пояснение.
1) Напишем уравнение реакции в общем виде:
2) Установим молекулярную формулу углеводорода:
mтеор
Молекулярная формула —
3) Изобразим структурную формулу.
Так как образуется только одно мононитропроизводное, все
атомы водорода в бензольном кольце эквивалентны. Среди всех изомеров таким
свойством обладает только 1,4-диметилбензол (пара-ксилол):
4) Напишем уравнение реакции с хлором на свету:
13. При сгорании 10,5 г органического вещества получили
16,8 л углекислого газа (н. у.) и 13,5 г воды. Плотность паров этого
вещества (н. у.) составляет 1,875 г/л.
Известно, что в результате присоединения хлороводорода
к этому веществу образуется только одно монохлорпроизводное.
На основании данных условия задания:
1) произведите вычисления, необходимые для установления
молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического
вещества;
3) составьте структурную формулу этого вещества, которая
однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции этого вещества с
хлороводородом.
Пояснение.
1) Найдем количество вещества продуктов сгорания:
кислород отсутствует; вещество — углеводород
2) Установим молекулярную формулу вещества:
простейшая
формула
Значит, молекулярная формула вещества — .
3) Приведем структурную формулу вещества:
—
циклопропан или пропен. Циклопропан образует только одно хлоропроизводное в
реакции с хлороводородом:
4) Составим уравнение реакции вещества с хлороводородом:
14. При сжигании паров углеводорода было получено 20,16 л (н. у.)
углекислого газа и 7,2 г воды. При окислении углеводорода горячим подкисленным
раствором перманганата калия образуется терефталевая (бензол-1,4-дикарбоновая)
кислота. Определите молекулярную формулу углеводорода и установите его
структуру. Напишите уравнение описанной реакции с перманганатом калия.
Пояснение.
Вариант ответа:
1) Найдены количества углекислого газа и воды:
2) Определена молекулярная формула углеводорода.
Из условия следует, что углеводород – ароматический и содержит
одно бензольное кольцо, следовательно простейшая формула совпадает
с молекулярной формулой.
3) Изображена структурная формула.
До терефталевой кислоты окисляется ароматический углеводород,
имеющий две боковые цепи в пара-положении относительно друг друга. Подсчет
атомов водорода приводит к выводу о том, что в одной из цепей – тройная связь.
4) Написано уравнение реакции с перманганатом калия:
15. При гидратации 31,50 г этиленового углеводорода образовалось 23,76
г органического вещества. Выход продукта составил 60 %. Определите молекулярную
формулу углеводорода и установите его структуру, если известно, что при его
жёстком окислении перманганатом калия образуются кетон и кислота. Напишите
уравнение реакции углеводорода с водой, в уравнении изобразите структурные
формулы органических веществ.
Пояснение.
1) Написано уравнение реакции гидратации в общем виде:
2) Определена молекулярная формула углеводорода:
Молекулярная формула углеводорода —
(Возможен и другой способ вывода молекулярной формулы по массам
реагента и продукта)
3) Изображена структурная формула.
При окислении образуются кетон и кислота, следовательно углеродный
скелет разветвлённый, а двойная связь находится в середине цепи:
4) Написано уравнение реакции с водой:
С задачами на вывод химической формулы вещества учащиеся встречаются при прохождении программы химии с 8 по 11 классы. К тому же, данный тип задач довольно часто встречается в олимпиадных заданиях, контрольно – измерительных материалах ЕГЭ (части В и С). Диапазон сложности данных задач достаточно широк. Как показывает опыт, у школьников часто возникают затруднения уже на первых этапах решения при выводе молярной массы вещества.
В данной разработке предлагаются задачи на нахождение формулы вещества, исходя из разных параметров в условиях. В представленных задачах приведены различные способы нахождения молярной массы вещества. Задачи составлены таким образом, чтобы учащиеся могли освоить оптимальные методы и различные варианты решения. Наглядно демонстрируются наиболее общие приёмы решений. Для учащихся предлагаются решённые задачи по принципу нарастания сложности и задачи для самостоятельного решения.
Таблица 1
|
Вывод химической формулы вещества: |
Номер задачи |
Вычисление молярной массы вещества |
Задачи для самостоятельного решения |
|
— на основании массовых долей (%) атомов элементов |
1 |
M |
Определить химическую формулу соединения, имеющего состав: натрий – 27,06%; азот – 16,47 %; кислород – 57,47%. Ответ: NaNO3 |
|
— на основании массовых долей (%) атомов элементов и плотности соединения |
2 |
М (CхНу) = D(Н2) ·М (Н2) |
Относительная плотность паров органического кислородсодержащего соединения по кислороду равна 3, 125. Массовая доля углерода равна 72%, водорода – 12 %. Выведите молекулярную формулу этого соединения. Ответ:C6H12О |
|
— по плотности вещества в газообразном состоянии |
3 |
М (в-ва) = ρ · М (газообр. в-ва) |
Относительная плотность паров предельного альдегида по кислороду равна 1,8125. Выведите молекулярную формулу альдегида. Ответ: C3Н6О |
|
— на основании массовых долей (%) атомов элементов и массе соединения |
4 |
М находится по соотношению, |
Углеводород содержит 81,82 % углерода. Масса 1 л. этого углеводорода (н.у.) составляет 1,964 г. Найдите молекулярную формулу углеводорода. |
|
— по массе или объёму исходного вещества и продуктам горения |
5 |
М (в-ва)=Vm·ρ |
Относительная плотность паров кислородсодержащего органического соединения по гелию равна 25,5. При сжигании 15,3 г. этого вещества образовалось 20,16 л. СО2 и 18,9 г. Н2О. Выведите молекулярную формулу этого вещества.Ответ: C6H14О |
Приводится пример решения задачи № 6 на применение уравнения Менделеева – Клайперона
Задача № 1
Массовая доля кислорода в одноосновной аминокислоте равна 42,67%. Установите молекулярную формулу кислоты.
|
Дано: |
Решение: M кислоты |
|
Вывести формулу соединения |
Вернуться к табл.1
Задача № 2
Относительная плотность углеводорода по водороду, имеющего состав: w(С) = 85,7 %; w (Н) = 14,3 %, равна 21. Выведите молекулярную формулу углеводорода.
|
Дано: |
Решение:
m (Н) = 42г. /100% · 14,3 %= 6 г. Ответ: истинная формула вещества C3Н6. |
|
Вывести формулу соединения |
Вернуться к табл.1
Задача № 3
Определите молекулярную формулу алкана, если известно, что его пары в 2,5 раза тяжелее аргона.
|
Дано: |
Решение: |
|
Вывести формулу алкана |
Вернуться к табл.1
Задача № 4
Массовая доля углерода в соединении равна 39,97 %, водорода 6, 73 %, кислорода 53,30 %. Масса 300 мл. (н.у.) этого соединения равна 2,41 г. Выведите молекулярную формулу этого вещества.
|
Дано: |
Решение: |
|
Вывести формулу соединения |
Вернуться к табл.1
Задача № 5
Какова молекулярная формула углеводорода, имеющего плотность 1,97 г/л, если при сгорании 4,4 г. его в кислороде образовалось 6,72 л. СО2 и 7,2 г. Н2О.
|
Дано: |
Решение: Составляем пропорции: |
|
Вывести формулу |
Вернуться к табл.1
Задача № 6
Соединение содержит 62,8% S и 37,2% F. Масса 118 мл данного соединения при 70 и 98,64 КПа равна 0,51 г. Вывести формулу соединения.
|
Дано: |
Решение:
n(S) : n(F) = 62,80/32 : 37,2/19 = 1,96 : 1,96 = 1 : 1
M
Следовательно, формула соединения S2 F2 Ответ: S2F2 |
|
Вывести формулу соединения |
Вернуться к табл.1