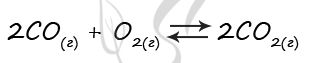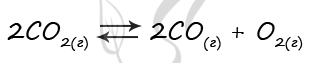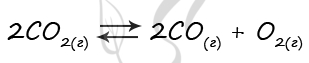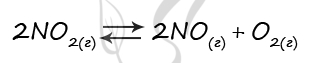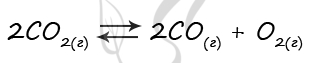Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
В реактор постоянного объёма поместили некоторое количество оксида серы(IV) и кислорода. В результате протекания обратимой реакции
в реакционной системе установилось химическое равновесие. При этом исходная концентрация оксида серы(IV) составила 0,6 моль/л, а равновесная концентрация кислорода и оксида серы(VI) — 0,3 моль/л и 0,4 моль/л соответственно.
Определите равновесную концентрацию и исходную концентрацию
Выберите из списка номера правильных ответов.
1) 0,1 моль/л
2) 0,2 моль/л
3) 0,3 моль/л
4) 0,4 моль/л
5) 0,5 моль/л
6) 0,6 моль/л
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
2
В реактор постоянного объёма поместили некоторое количество азота и водорода. В результате протекания обратимой реакции
в реакционной системе установилось химическое равновесие. При этом исходная концентрация азота составила 1,5 моль/л, а равновесная концентрация водорода и аммиака — 0,2 моль/л и 0,9 моль/л соответственно.
Определите равновесную концентрацию и исходную концентрацию
Выберите из списка номера правильных ответов.
1) 0,1 моль/л
2) 0,15 моль/л
3) 0,55 моль/л
4) 1,05 моль/л
5) 1,55 моль/л
6) 2,4 моль/л
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
3
В реактор постоянного объёма поместили некоторое количество азота и кислорода. В результате протекания обратимой реакции
в реакционной системе установилось химическое равновесие. При этом исходная концентрация азота и кислорода составляет 0,7 моль/л и 0,5 моль/л соответственно, а равновесная концентрация оксида азота(II) — 0,5 моль/л.
Определите равновесную концентрацию и
Выберите из списка номера правильных ответов.
1) 0 моль/л
2) 0,1 моль/л
3) 0,25 моль/л
4) 0,35 моль/л
5) 0,45 моль/л
6) 0,55 моль/л
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
4
В реактор постоянного объёма поместили некоторое количество водорода и кислорода. В результате протекания обратимой реакции
в реакционной системе установилось химическое равновесие. При этом исходная концентрация водорода составила 2,5 моль/л, а равновесная концентрация кислорода и воды — 0,3 моль/л и 0,8 моль/л соответственно.
Определите равновесную концентрацию и исходную концентрацию
Выберите из списка номера правильных ответов.
1) 0 моль/л
2) 0,2 моль/л
3) 0,7 моль/л
4) 1,4 моль/л
5) 1,7 моль/л
6) 3,6 моль/л
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
5
В реактор постоянного объёма поместили некоторое количество оксида азота(II) и кислорода. В результате протекания обратимой реакции
в реакционной системе установилось химическое равновесие. При этом исходная концентрация кислорода составила 0,8 моль/л, а равновесная концентрация оксида азота(II) и оксида азота(IV) — 1,9 моль/л и 0,4 моль/л соответственно.
Определите исходную концентрацию и равновесную концентрацию
Выберите из списка номера правильных ответов.
1) 0,4 моль/л
2) 0,6 моль/л
3) 0,9 моль/л
4) 1,4 моль/л
5) 1,9 моль/л
6) 2,3 моль/л
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Пройти тестирование по этим заданиям
Тренировочные упражнения по теме «Расчетные задачи на химическое равновесие» в формате ЕГЭ по химии (тренажер задания 23 ЕГЭ по химии).
Теория по теме «Расчетные задачи на химическое равновесие» (теория для решения задания 23 ЕГЭ по химии):
«Обратимые и необратимые химические реакции. Химическое равновесие. Расчёты количества вещества, массы вещества или объёма газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ»
Тренировочный тест «Расчетные задачи на химическое равновесие» 10 вопросов, при каждом прохождении новые.
109
Создан на
16 января, 2022 От Admin
Тренажер задания 23
Тренажер задания 23 ЕГЭ по химии
1 / 10
В реактор постоянного объёма поместили некоторое количество оксида азота(IV). В результате протекания обратимой реакции
2NO2(г) ↔ 2NO(г) + O2(г)
в реакционной системе установилось химическое равновесие. При этом равновесные концентрации оксида азота (IV) и кислорода составили 0,4 моль/л и 0,3 моль/л соответственно.
Определите исходную концентрацию NO2 (Х) и равновесную концентрацию NO (Y).
Выберите из списка номера правильных ответов.
1) 0,2 моль/л 3) 0,6 моль/л 5) 1,0 моль/л
2) 0,4 моль/л 4) 0,8 моль/л 6) 1,2 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
2 / 10
В реактор постоянного объёма поместили некоторое количество монооксида азота и озона. В результате протекания обратимой реакции
NO(г) + О3(г) ↔ NO2(г) + О2(г)
в реакционной системе установилось химическое равновесие. При этом исходные концентрации оксида азота (II) и кислорода составили 0,25 моль/л и 0,3 моль/л соответственно, а равновесная концентрации оксида азота (II) составила 0,05 моль/л.
Определите равновесные концентрации О3 (Х) и NO2 (Y).
Выберите из списка номера правильных ответов.
1) 0,05 моль/л 3) 0,15 моль/л 5) 0,25 моль/л
2) 0,10 моль/л 4) 0,20 моль/л 6) 0,30 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
3 / 10
В реактор постоянного объёма поместили некоторое количество вещества А. В результате протекания обратимой реакции
3A(г) ↔ 2В(г) + С(г)
в реакционной системе установилось химическое равновесие. При этом равновесные концентрации А и С составили 0,1 моль/л и 0,3 моль/л соответственно.
Определите исходную концентрацию А (Х) и равновесную концентрацию В (Y).
Выберите из списка номера правильных ответов.
1) 0,2 моль/л 3) 0,6 моль/л 5) 1,0 моль/л
2) 0,4 моль/л 4) 0,8 моль/л 6) 1,2 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
4 / 10
В реактор постоянного объёма поместили оксид углерода(IV) и кислород. В результате протекания обратимой реакции
2SO2(г) + O2(г) ↔ 2SO3(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация SO2 составила 0,6 моль/л, равновесная концентрация O2 составила 0,3 моль/л, а равновесная концентрация SO3 составила 0,4 моль/л
Определите равновесную концентрацию SO2 (Х) и исходную концентрацию O2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
5 / 10
В реактор постоянного объёма поместили некоторое количество трифторида хлора. В результате протекания обратимой реакции
2ClF3(г) ↔ Сl2(г) + 3F2(г)
в реакционной системе установилось химическое равновесие. При этом равновесные концентрации ClF3 и Cl2 составили 0,1 моль/л и 0,2 моль/л соответственно.
Определите исходную концентрацию СlF3 (Х) и равновесную концентрацию F2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
6 / 10
В реактор постоянного объёма поместили пары циклогексана и нагрели в присутствии катализатора. В результате протекания обратимой реакции
C6H12(г) ⇄ C6H6(г) + 3H2(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация C6H12 составила 0,3 моль/л, а равновесная концентрация H2 составила 0,3 моль/л
Определите равновесную концентрацию C6H12 (X) и равновесную концентрацию С6H6 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
7 / 10
В реактор постоянного объёма поместили некоторое количество порошка графита и водяного пара. В результате протекания обратимой реакции
C(тв.) + H2O(г) ↔ H2(г) + СO(г)
в реакционной системе установилось химическое равновесие. При этом равновесные концентрации Н2О и Н2 составили 0,2 моль/л и 0,3 моль/л соответственно.
Определите исходную концентрацию Н2О (Х) и равновесную концентрацию СО (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
8 / 10
В реактор постоянного объёма поместили некоторое количество оксида азота(II) и кислорода. В результате протекания обратимой реакции
2NO(г) + O2(г) ↔ 2NO2(г)
в реакционной системе установилось химическое равновесие. При этом равновесные концентрации оксида азота (II), кислорода и оксида азота (IV) составила 0,2 моль/л, 0,4 моль/л и 0,8 моль/л соответственно.
Определите исходные концентрации NО (X) и O2 (Y).
Выберите из списка номера правильных ответов.
1) 0,2 моль/л 3) 0,6 моль/л 5) 1,0 моль/л
2) 0,4 моль/л 4) 0,8 моль/л 6) 1,2 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
9 / 10
В реактор постоянного объёма поместили некоторое количество оксида серы(VI). В результате протекания обратимой реакции
2SO3(г) ↔ 2SO2(г) + О2(г)
в реакционной системе установилось химическое равновесие. При этом равновесные концентрации оксида серы (VI) и оксида серы (IV) составили 0,05 моль/л и 0,20 моль/л соответственно.
Определите исходную концентрацию SO3 (Х) и равновесную концентрацию О2 (Y).
Выберите из списка номера правильных ответов.
1) 0,05 моль/л 3) 0,15 моль/л 5) 0,25 моль/л
2) 0,10 моль/л 4) 0,20 моль/л 6) 0,30 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
10 / 10
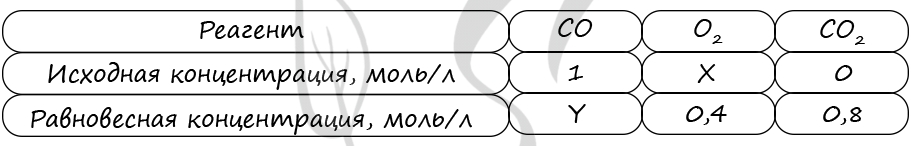
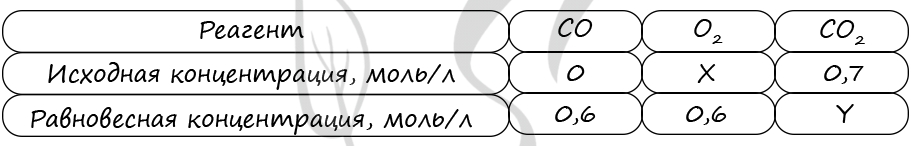
В реактор постоянного объёма поместили оксид серы(IV) и кислород. В результате протекания обратимой реакции
2SO2(г) + O2(г) ↔ 2SO3(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация оксида серы(VI) составила 0,6 моль/л, концентрации кислорода и оксида серы(VI) составили 0,3 моль/л и 0,4 моль/л соответственно.
Определите исходную концентрацию SO2 (X) и исходную концентрацию О2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Ваша оценка
The average score is 21%
Полный тематический тест по теме «Расчетные задачи на химическое равновесие» — полный тест из всех вопросов.
38
Создан на
03 апреля, 2022 От Admin
Полный тематический тест Тренажер задания 23
Тренажер задания 23 ЕГЭ по химии
1 / 43
В реактор постоянного объёма поместили некоторое количество водорода и паров йода. В результате протекания обратимой реакции
H2(г) + I2(г) ↔ 2HI(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация йода составила 0,9 моль/л, а равновесные концентрации водорода и йода – 0,2 моль/л и 0,6 моль/л соответственно.
Определите исходную концентрацию Н2 (Х) и равновесную концентрацию НI (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
2 / 43
В реактор постоянного объёма поместили некоторое количество водорода и углекислого газа. В результате протекания обратимой реакции
H2(г) + СO2(г) ↔ H2O(г) + СO(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация водорода составила 0,9 моль/л, а равновесные концентрации углекислого газа, угарного газа и воды – 0,1 моль/л, 0,6 моль/л и 0,6 моль/л соответственно.
Определите равновесную концентрацию Н2 (X) и исходную концентрацию СО2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,5 моль/л 5) 0,9 моль/л
2) 0,3 моль/л 4) 0,7 моль/л 6) 1,1 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
3 / 43
В реактор постоянного объёма поместили некоторое количество оксида азота(II) и кислорода. В результате протекания обратимой реакции
2NO(г) + O2(г) ↔ 2NO2(г)
в реакционной системе установилось химическое равновесие. При этом равновесные концентрации оксида азота (II), кислорода и оксида азота (IV) составила 0,2 моль/л, 0,4 моль/л и 0,8 моль/л соответственно.
Определите исходные концентрации NО (X) и O2 (Y).
Выберите из списка номера правильных ответов.
1) 0,2 моль/л 3) 0,6 моль/л 5) 1,0 моль/л
2) 0,4 моль/л 4) 0,8 моль/л 6) 1,2 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
4 / 43
В реактор постоянного объёма поместили некоторое количество оксида азота(II) и кислорода. В результате протекания обратимой реакции
2NO(г) + O2(г) ↔ 2NO2(г)
в реакционной системе установилось химическое равновесие. При этом исходные концентрации оксида азота (II) и кислорода составили 0,9 моль/л и 0,5 моль/л соответственно, а равновесная концентрация кислорода – 0,2 моль/л.
Определите равновесные концентрации NO (Х) и NO2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
5 / 43
В реактор постоянного объёма поместили некоторое количество оксида азота(II) и кислорода. В результате протекания обратимой реакции
2NO(г) + О2(г) ↔ 2NO2(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация кислорода составила 0,20 моль/л, а равновесные концентрации оксида азота (II) и оксида азота (IV) – 0,05 моль/л и 0,20 моль/л соответственно.
Определите исходную концентрацию NO (Х) и равновесную концентрацию О2 (Y).
Выберите из списка номера правильных ответов.
1) 0,05 моль/л 2) 0,10 моль/л 3) 0,15 моль/л
4) 0,20 моль/л 5) 0,25 моль/л 6) 0,30 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
6 / 43
В реактор постоянного объёма поместили некоторое количество оксида азота(IV). В результате протекания обратимой реакции
2NO2 ↔ 2NO(г) + O2(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация оксида азота (IV) составила 1,4 моль/л, а равновесная концентрация оксида азота (II) – 0,8 моль/л.
Определите равновесные концентрации NO2 (Х) и O2 (Y).
Выберите из списка номера правильных ответов.
1) 0,2 моль/л 3) 0,6 моль/л 5) 1,0 моль/л
2) 0,4 моль/л 4) 0,8 моль/л 6) 1,2 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
7 / 43
В реактор постоянного объёма поместили некоторое количество оксида азота(IV). В результате протекания обратимой реакции
2NO2(г) ↔ 2NO(г) + O2(г)
в реакционной системе установилось химическое равновесие. При этом равновесные концентрации оксида азота (IV) и кислорода составили 0,4 моль/л и 0,3 моль/л соответственно.
Определите исходную концентрацию NO2 (Х) и равновесную концентрацию NO (Y).
Выберите из списка номера правильных ответов.
1) 0,2 моль/л 3) 0,6 моль/л 5) 1,0 моль/л
2) 0,4 моль/л 4) 0,8 моль/л 6) 1,2 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
8 / 43
В реактор постоянного объёма поместили некоторое количество оксида серы(IV). В результате протекания обратимой реакции
2SO3(г) ↔ 2SO2(г) + О2(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация оксида серы (VI) составила 0,8 моль/л, а равновесная концентрация оксида серы (IV) – 0,6 моль/л.
Определите равновесные концентрации SO3 (Х) и O2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
9 / 43
В реактор постоянного объёма поместили некоторое количество оксида серы(VI). В результате протекания обратимой реакции
2SO3(г) ↔ 2SO2(г) + О2(г)
в реакционной системе установилось химическое равновесие. При этом равновесные концентрации оксида серы (VI) и оксида серы (IV) составили 0,05 моль/л и 0,20 моль/л соответственно.
Определите исходную концентрацию SO3 (Х) и равновесную концентрацию О2 (Y).
Выберите из списка номера правильных ответов.
1) 0,05 моль/л 3) 0,15 моль/л 5) 0,25 моль/л
2) 0,10 моль/л 4) 0,20 моль/л 6) 0,30 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
10 / 43
В реактор постоянного объёма поместили некоторое количество оксида азота(II) и хлора. В результате протекания обратимой реакции
2NO(г) + Cl2(г) ↔ 2NOCl(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация хлора составила 0,15 моль/л, а равновесные концентрации оксида азота (II) и хлора составили 0,05 моль/л и 0,05 моль/л соответственно.
Определите исходную концентрацию NO (Х) и равновесную концентрацию NOCl (Y).
Выберите из списка номера правильных ответов.
1) 0,05 моль/л 3) 0,15 моль/л 5) 0,25 моль/л
2) 0,10 моль/л 4) 0,20 моль/л 6) 0,30 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
11 / 43
В реактор постоянного объёма поместили некоторое количество диоксида серы и озона. В результате протекания обратимой реакции
SO2(г) + О3 ↔ SO3(г) + О2(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация озона составила 0,4 моль/л, а равновесные концентрации оксида серы (IV), оксида серы (VI) и кислорода составили 0,2 моль/л, 0,3 моль/л и 0,3 моль/л соответственно.
Определите исходную концентрацию SO2 (Х) и равновесную концентрацию О3 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
12 / 43
В реактор постоянного объёма поместили некоторое количество диоксида серы и диоксида азота. В результате протекания обратимой реакции
SO2(г) + NO2(г) ↔ SO3(г) + NO(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация оксида серы (IV) составила 0,5 моль/л, а равновесные концентрации оксида азота (IV) и оксида азота (II) составили 0,1 моль/л и 0,3 моль/л соответственно.
Определите равновесную концентрацию SO2 (Х) и исходную концентрацию NO2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
13 / 43
В реактор постоянного объёма поместили некоторое количество монооксида азота и озона. В результате протекания обратимой реакции
NO(г) + О3(г) ↔ NO2(г) + О2(г)
в реакционной системе установилось химическое равновесие. При этом исходные концентрации оксида азота (II) и кислорода составили 0,25 моль/л и 0,3 моль/л соответственно, а равновесная концентрации оксида азота (II) составила 0,05 моль/л.
Определите равновесные концентрации О3 (Х) и NO2 (Y).
Выберите из списка номера правильных ответов.
1) 0,05 моль/л 3) 0,15 моль/л 5) 0,25 моль/л
2) 0,10 моль/л 4) 0,20 моль/л 6) 0,30 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
14 / 43
В реактор постоянного объёма поместили некоторое количество диоксида хлора. В результате протекания обратимой реакции
ClO2(г) ↔ 1/2Cl2(г) + О2(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация ClO2 составила 0,7 моль/л, а равновесная концентрация кислорода – 0,4 моль/л.
Определите равновесные концентрации ClO2 (Х) и Сl2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
15 / 43
В реактор постоянного объёма поместили некоторое количество фторида азота(III). В результате протекания обратимой реакции
2NF3(г) ↔ N2(г) + 3F2(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация NF3 составила 0,8 моль/л, а равновесная концентрация фтора – 0,6 моль/л.
Определите равновесные концентрации NF3 (Х) и N2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
16 / 43
В реактор постоянного объёма поместили некоторое количество азота и фтора. В результате протекания обратимой реакции
N2(г) + 3F2(г) ↔2NF3(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация фтора составила 1,2 моль/л, а равновесные концентрации азота и NF3 составили 0,2 моль/л и 0,4 моль/л соответственно.
Определите исходную концентрацию N2 (Х) и равновесную концентрацию F2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
17 / 43
В реактор постоянного объёма поместили некоторое количество оксида хлора(I). В результате протекания обратимой реакции
4Cl2O(г) ↔ 2Сl2(г) + 2ClO2(г)
в реакционной системе установилось химическое равновесие. При этом равновесные концентрации Cl2O и ClO2 составили 0,05 моль/л и 0,10 моль/л соответственно.
Определите исходную концентрацию Cl2O (Х) и равновесную концентрацию Cl2 (Y).
Выберите из списка номера правильных ответов.
1) 0,05 моль/л 3) 0,15 моль/л 5) 0,25 моль/л
2) 0,10 моль/л 4) 0,20 моль/л 6) 0,30 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
18 / 43
В реактор постоянного объёма поместили некоторое количество фторида хлора(I). В результате протекания обратимой реакции
3ClF(г) ↔ СlF3(г) + Сl2(г)
в реакционной системе установилось химическое равновесие. При этом равновесные концентрации ClF и Cl2 составили 0,2 моль/л и 0,1 моль/л соответственно.
Определите исходную концентрацию СlF (Х) и равновесную концентрацию СlF3 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
19 / 43
В реактор постоянного объёма поместили некоторое количество трифторида хлора. В результате протекания обратимой реакции
2ClF3(г) ↔ Сl2(г) + 3F2(г)
в реакционной системе установилось химическое равновесие. При этом равновесные концентрации ClF3 и Cl2 составили 0,1 моль/л и 0,2 моль/л соответственно.
Определите исходную концентрацию СlF3 (Х) и равновесную концентрацию F2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
20 / 43
В реактор постоянного объёма поместили некоторое количество хлора и трифторида хлора. В результате протекания обратимой реакции
ClF3(г) + Сl2(г) ↔ 3СlF(г)
в реакционной системе установилось химическое равновесие. При этом исходные концентрации ClF3 и Cl2 составили 0,45 моль/л и 0,35 моль/л соответственно, а равновесная концентрация ClF3 составила 0,30 моль/л.
Определите равновесные концентрации Cl2 (Х) и ClF (Y)
Выберите из списка номера правильных ответов.
1) 0,20 моль/л 3) 0,30 моль/л 5) 0,40 моль/л
2) 0,25 моль/л 4) 0,35 моль/л 6) 0,45 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
21 / 43
В реактор постоянного объёма поместили некоторое количество метана и кислорода. В результате протекания обратимой реакции
CH4(г) + 1/2O2(г) ↔ СO(г) + 2H2(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация CH4 составила 0,8 моль/л, а равновесные концентрации кислорода, угарного газа и водорода составили 0,2 моль/л, 0,6 моль/л и 1,2 моль/л соответственно.
Определите равновесную концентрацию СН4 (Х) и исходную концентрацию О2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
22 / 43
В реактор постоянного объёма поместили некоторое количество метана и углекислого газа. В результате протекания обратимой реакции
1/2CH4(г) + 1/2CO2(г) ↔ СO(г) + H2(г)
в реакционной системе установилось химическое равновесие. При этом исходные концентрации метана и углекислого газа составили 0,7 моль/л и 0,5 моль/л соответственно, а равновесная концентрация углекислого газа составила 0,2 моль/л.
Определите равновесные концентрации СН4 (X) и СО (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
23 / 43
В реактор постоянного объёма поместили некоторое количество пропана и водорода. В результате протекания обратимой реакции
C3H8(г) + 2H2(г) ↔ 3CH4(г)
в реакционной системе установилось химическое равновесие. При этом исходные концентрации пропана и водорода составили 0,30 моль/л и 0,50 моль/л соответственно, а равновесная концентрация пропана составила 0,15 моль/л.
Определите равновесные концентрации Н2 (Х) и равновесную концентрацию СН4 (Y).
Выберите из списка номера правильных ответов.
1) 0,20 моль/л 3) 0,30 моль/л 5) 0,40 моль/л
2) 0,25 моль/л 4) 0,35 моль/л 6) 0,45 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
24 / 43
В реактор постоянного объёма поместили некоторое количество оксида углерода(II) и водорода. В результате протекания обратимой реакции
CO(г) + 3H2(г) ↔ СH4(г) + H2O(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация CО составила 0,5 моль/л, а равновесные концентрации Н2, СН4 и Н2О составили 0,1 моль/л, 0,2 моль/л и 0,2 моль/л соответственно.
Определите равновесную концентрацию СО (Х) и исходную концентрацию Н2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,5 моль/л 5) 0,9 моль/л
2) 0,3 моль/л 4) 0,7 моль/л 6) 1,1 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
25 / 43
В реактор постоянного объёма поместили некоторое количество пропана и водяного пара. В результате протекания обратимой реакции
C3H8(г) + 3H2O(г) ↔ 3СO(г) + 7H2(г)
в реакционной системе установилось химическое равновесие. При этом равновесные концентрации С3Н8, Н2О и СО составили 0,2 моль/л, 0,2 моль/л и 0,6 моль/л соответственно.
Определите исходную концентрацию С3Н8 (Х) и равновесную концентрацию Н2 (Y).
Выберите из списка номера правильных ответов.
1) 0,4 моль/л 3) 0,8 моль/л 5) 1,2 моль/л
2) 0,6 моль/л 4) 1,0 моль/л 6) 1,4 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
26 / 43
В реактор постоянного объёма поместили некоторое количество порошка графита и водяного пара. В результате протекания обратимой реакции
C(тв.) + H2O(г) ↔ H2(г) + СO(г)
в реакционной системе установилось химическое равновесие. При этом равновесные концентрации Н2О и Н2 составили 0,2 моль/л и 0,3 моль/л соответственно.
Определите исходную концентрацию Н2О (Х) и равновесную концентрацию СО (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
27 / 43
В реактор постоянного объёма поместили некоторое количество S2Cl2 и водорода. В результате протекания обратимой реакции
S2Cl2(г) + H2(г) ↔ 2HCl(г) + 2S(ж)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация S2Cl2 составила 0,4 моль/л, а равновесные концентрации S2Cl2 и Н2 составили 0,2 моль/л и 0,3 моль/л соответственно.
Определите исходную концентрацию Н2 (Х) и равновесную концентрацию НСl (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
28 / 43
В реактор постоянного объёма поместили некоторое количество серы и водяного пара. В результате протекания обратимой реакции
2S(ж) + 2H2O(г) ↔ 2H2S(г) + SO2(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация Н2О составила 0,8 моль/л, а равновесная концентрация Н2S составила 0,6 моль/л.
Определите равновесные концентрации H2O (Х) и SO2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
29 / 43
В реактор постоянного объёма поместили некоторое количество вещества А. В результате протекания обратимой реакции
3A(г) ↔ 2В(г) + С(г)
в реакционной системе установилось химическое равновесие. При этом равновесные концентрации А и С составили 0,1 моль/л и 0,3 моль/л соответственно.
Определите исходную концентрацию А (Х) и равновесную концентрацию В (Y).
Выберите из списка номера правильных ответов.
1) 0,2 моль/л 3) 0,6 моль/л 5) 1,0 моль/л
2) 0,4 моль/л 4) 0,8 моль/л 6) 1,2 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
30 / 43
В реактор постоянного объёма поместили вещества А и В. В результате протекания обратимой реакции
A(тв.) + 3В(г) ↔ С(г) + 2D(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация В составила 0,9 моль/л, а равновесная концентрация D составила 0,4 моль/л.
Определите равновесные концентрации веществ В (Х) и С (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
31 / 43
В реактор постоянного объёма поместили оксид углерода(II) и водород. В результате протекания обратимой реакции
CO(г) + 2H2(г) = CH3OH(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация CO составила 0,3 моль/л, равновесная концентрация CO составила 0,1 моль/л, а равновесная концентрация H2 составила 0,8 моль/л.
Определите равновесные концентрации веществ Н2 (Х) и СН3ОН (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
32 / 43
В реактор постоянного объёма поместили кислород и азот и подвергли воздействию электрического тока. В результате протекания обратимой реакции
N2(г) + O2(г) ↔ 2NO(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация О2 составила 0,4 моль/л, равновесная концентрация N2 составила 0,3 моль/л, а равновесная концентрация NO составила 0,2 моль/л.
Определите исходную концентрацию N2 (Х) и равновесную концентрацию O2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
33 / 43
В реактор постоянного объёма поместили некоторое количество метана и кислорода. В результате протекания обратимой реакции
2CH4(г) + O2(г) ↔ 2CO(г) + 4H2(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация CH4 составила 0,8 моль/л, равновесная концентрация O2 составила 0,2 моль/л, равновесная концентрация CO составила 0,6 моль/л, а равновесная концентрация H2 составила 1,2 моль/л
Определите равновесную концентрацию CH4 (Х) и исходную концентрацию O2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
34 / 43
В реактор постоянного объёма поместили оксид углерода(IV) и нагрели. В результате протекания обратимой реакции
2CO2(г) ↔ 2CO(г) + O2(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация CO2 составила 0,23 моль/л, а равновесная концентрация CO2 составила 0,15 моль/л
Определите равновесную концентрацию CO (Х) и равновесную концентрацию O2 (Y).
Выберите из списка номера правильных ответов.
1) 0,02 моль/л 3) 0,08 моль/л 5) 0,20 моль/л
2) 0,04 моль/л 4) 0,15 моль/л 6) 0,30 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
35 / 43
В реактор постоянного объёма поместили некоторое количество оксида углерода(II) и водорода. В результате протекания обратимой реакции
CO(г) + 2H2(г) ↔ CH3OH(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация CO составила 0,7 моль/л, исходная концентрация H2 составила 0,8 моль/л, а равновесная концентрация H2 составила 0,4 моль/л
Определите равновесную концентрацию CO (Х) и равновесную концентрацию CH3OH (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
36 / 43
В реактор постоянного объёма поместили некоторое количество метана и кислорода. В результате протекания обратимой реакции
2CH4(г) + O2(г) = 2CO(г) + 4H2(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация O2 составила 0,5 моль/л, равновесная концентрация CH4 составила 0,2 моль/л, равновесная концентрация CO составила 0,4 моль/л, а равновесная концентрация H2 составила 0,8 моль/л
Определите исходную концентрацию CH4 (Х) и равновесную концентрацию О2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
37 / 43
В реактор постоянного объёма поместили оксид серы(VI) и нагрели. В результате протекания обратимой реакции
2SO3(г) ↔ 2SО2(г) + O2(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация SO3 составила 0,28 моль/л, а равновесная концентрация SO3 составила 0,3 моль/л
Определите равновесную концентрацию SO2 (Х) и равновесную концентрацию О2 (Y).
Выберите из списка номера правильных ответов.
1) 0,02 моль/л 3) 0,08 моль/л 5) 0,2 моль/л
2) 0,04 моль/л 4) 0,15 моль/л 6) 0,3 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
38 / 43
В реактор постоянного объёма поместили угарный газ и хлор. В результате протекания обратимой реакции
CO(г) + Cl2(г) ↔ COCl2(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация СО составила 0,4 моль/л, равновесная концентрация Cl2 составила 0,2 моль/л, а равновесная концентрация COCl2 составила 0,3 моль/л
Определите равновесную концентрацию CО (Х) и исходную концентрацию Cl2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
39 / 43
В реактор постоянного объёма поместили оксид серы(IV) и кислород. В результате протекания обратимой реакции
2SO2(г) + O2(г) ↔ 2SO3(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация оксида серы(VI) составила 0,6 моль/л, концентрации кислорода и оксида серы(VI) составили 0,3 моль/л и 0,4 моль/л соответственно.
Определите исходную концентрацию SO2 (X) и исходную концентрацию О2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
40 / 43
В реактор постоянного объёма поместили метан и углекислый газ. В результате протекания обратимой реакции
CH4(г) + CO2(г) ⇄ 2CO(г) + 2H2(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация CO2 составила 0,5 моль/л, равновесная концентрация CH4 составила 0,1 моль/л, а равновесная концентрация CO2 составила 0,2 моль/л
Определите исходную концентрацию CH4 (X) и равновесную концентрацию H2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
41 / 43
В реактор постоянного объёма поместили пары циклогексана и нагрели в присутствии катализатора. В результате протекания обратимой реакции
C6H12(г) ⇄ C6H6(г) + 3H2(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация C6H12 составила 0,3 моль/л, а равновесная концентрация H2 составила 0,3 моль/л
Определите равновесную концентрацию C6H12 (X) и равновесную концентрацию С6H6 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
42 / 43
В реактор постоянного объёма поместили водород и пары брома. В результате протекания обратимой реакции
H2(г) + Br2(г) ⇄ 2HBr(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация H2 составила 0,32 моль/л, равновесная концентрация Br2 составила 0,1 моль/л, а равновесная концентрация HBr составила 0,32 моль/л
Определите равновесную концентрацию H2 (X) и исходную концентрацию Br2 (Y).
Выберите из списка номера правильных ответов.
1) 0,08 моль/л 3) 0,2 моль/л 5) 0,32 моль/л
2) 0,16 моль/л 4) 0,26 моль/л 6) 0,42 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
43 / 43
В реактор постоянного объёма поместили оксид углерода(IV) и кислород. В результате протекания обратимой реакции
2SO2(г) + O2(г) ↔ 2SO3(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация SO2 составила 0,6 моль/л, равновесная концентрация O2 составила 0,3 моль/л, а равновесная концентрация SO3 составила 0,4 моль/л
Определите равновесную концентрацию SO2 (Х) и исходную концентрацию O2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Ваша оценка
The average score is 8%
Задание 1. В реактор постоянного объёма поместили некоторое количество водорода и паров йода. В результате протекания обратимой реакции
H2(г) + I2(г) ↔ 2HI(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация йода составила 0,9 моль/л, а равновесные концентрации водорода и йода – 0,2 моль/л и 0,6 моль/л соответственно.
Определите исходную концентрацию Н2 (Х) и равновесную концентрацию НI (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 2. В реактор постоянного объёма поместили некоторое количество водорода и углекислого газа. В результате протекания обратимой реакции
H2(г) + СO2(г) ↔ H2O(г) + СO(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация водорода составила 0,9 моль/л, а равновесные концентрации углекислого газа, угарного газа и воды – 0,1 моль/л, 0,6 моль/л и 0,6 моль/л соответственно.
Определите равновесную концентрацию Н2 (X) и исходную концентрацию СО2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,5 моль/л 5) 0,9 моль/л
2) 0,3 моль/л 4) 0,7 моль/л 6) 1,1 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 3. В реактор постоянного объёма поместили некоторое количество оксида азота(II) и кислорода. В результате протекания обратимой реакции
2NO(г) + O2(г) ↔ 2NO2(г)
в реакционной системе установилось химическое равновесие. При этом равновесные концентрации оксида азота (II), кислорода и оксида азота (IV) составила 0,2 моль/л, 0,4 моль/л и 0,8 моль/л соответственно.
Определите исходные концентрации NО (X) и O2 (Y).
Выберите из списка номера правильных ответов.
1) 0,2 моль/л 3) 0,6 моль/л 5) 1,0 моль/л
2) 0,4 моль/л 4) 0,8 моль/л 6) 1,2 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 4. В реактор постоянного объёма поместили некоторое количество оксида азота(II) и кислорода. В результате протекания обратимой реакции
2NO(г) + O2(г) ↔ 2NO2(г)
в реакционной системе установилось химическое равновесие. При этом исходные концентрации оксида азота (II) и кислорода составили 0,9 моль/л и 0,5 моль/л соответственно, а равновесная концентрация кислорода – 0,2 моль/л.
Определите равновесные концентрации NO (Х) и NO2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
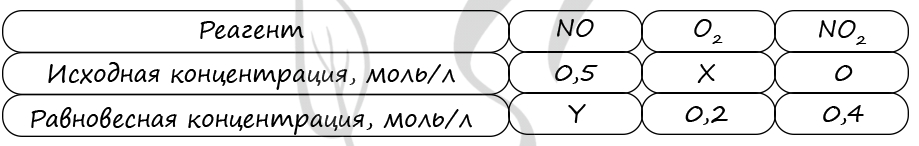
Задание 5. В реактор постоянного объёма поместили некоторое количество оксида азота(II) и кислорода. В результате протекания обратимой реакции
2NO(г) + О2(г) ↔ 2NO2(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация кислорода составила 0,20 моль/л, а равновесные концентрации оксида азота (II) и оксида азота (IV) – 0,05 моль/л и 0,20 моль/л соответственно.
Определите исходную концентрацию NO (Х) и равновесную концентрацию О2 (Y).
Выберите из списка номера правильных ответов.
1) 0,05 моль/л 2) 0,10 моль/л 3) 0,15 моль/л
4) 0,20 моль/л 5) 0,25 моль/л 6) 0,30 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 6. В реактор постоянного объёма поместили некоторое количество оксида азота(IV). В результате протекания обратимой реакции
2NO2 ↔ 2NO(г) + O2(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация оксида азота (IV) составила 1,4 моль/л, а равновесная концентрация оксида азота (II) – 0,8 моль/л.
Определите равновесные концентрации NO2 (Х) и O2 (Y).
Выберите из списка номера правильных ответов.
1) 0,2 моль/л 3) 0,6 моль/л 5) 1,0 моль/л
2) 0,4 моль/л 4) 0,8 моль/л 6) 1,2 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 7. В реактор постоянного объёма поместили некоторое количество оксида азота(IV). В результате протекания обратимой реакции
2NO2(г) ↔ 2NO(г) + O2(г)
в реакционной системе установилось химическое равновесие. При этом равновесные концентрации оксида азота (IV) и кислорода составили 0,4 моль/л и 0,3 моль/л соответственно.
Определите исходную концентрацию NO2 (Х) и равновесную концентрацию NO (Y).
Выберите из списка номера правильных ответов.
1) 0,2 моль/л 3) 0,6 моль/л 5) 1,0 моль/л
2) 0,4 моль/л 4) 0,8 моль/л 6) 1,2 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 8. В реактор постоянного объёма поместили некоторое количество оксида серы(IV). В результате протекания обратимой реакции
2SO3(г) ↔ 2SO2(г) + О2(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация оксида серы (VI) составила 0,8 моль/л, а равновесная концентрация оксида серы (IV) – 0,6 моль/л.
Определите равновесные концентрации SO3 (Х) и O2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 9. В реактор постоянного объёма поместили некоторое количество оксида серы(VI). В результате протекания обратимой реакции
2SO3(г) ↔ 2SO2(г) + О2(г)
в реакционной системе установилось химическое равновесие. При этом равновесные концентрации оксида серы (VI) и оксида серы (IV) составили 0,05 моль/л и 0,20 моль/л соответственно.
Определите исходную концентрацию SO3 (Х) и равновесную концентрацию О2 (Y).
Выберите из списка номера правильных ответов.
1) 0,05 моль/л 3) 0,15 моль/л 5) 0,25 моль/л
2) 0,10 моль/л 4) 0,20 моль/л 6) 0,30 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 10. В реактор постоянного объёма поместили некоторое количество оксида азота(II) и хлора. В результате протекания обратимой реакции
2NO(г) + Cl2(г) ↔ 2NOCl(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация хлора составила 0,15 моль/л, а равновесные концентрации оксида азота (II) и хлора составили 0,05 моль/л и 0,05 моль/л соответственно.
Определите исходную концентрацию NO (Х) и равновесную концентрацию NOCl (Y).
Выберите из списка номера правильных ответов.
1) 0,05 моль/л 3) 0,15 моль/л 5) 0,25 моль/л
2) 0,10 моль/л 4) 0,20 моль/л 6) 0,30 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 11. В реактор постоянного объёма поместили некоторое количество диоксида серы и озона. В результате протекания обратимой реакции
SO2(г) + О3 ↔ SO3(г) + О2(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация озона составила 0,4 моль/л, а равновесные концентрации оксида серы (IV), оксида серы (VI) и кислорода составили 0,2 моль/л, 0,3 моль/л и 0,3 моль/л соответственно.
Определите исходную концентрацию SO2 (Х) и равновесную концентрацию О3 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 12. В реактор постоянного объёма поместили некоторое количество диоксида серы и диоксида азота. В результате протекания обратимой реакции
SO2(г) + NO2(г) ↔ SO3(г) + NO(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация оксида серы (IV) составила 0,5 моль/л, а равновесные концентрации оксида азота (IV) и оксида азота (II) составили 0,1 моль/л и 0,3 моль/л соответственно.
Определите равновесную концентрацию SO2 (Х) и исходную концентрацию NO2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 13. В реактор постоянного объёма поместили некоторое количество монооксида азота и озона. В результате протекания обратимой реакции
NO(г) + О3(г) ↔ NO2(г) + О2(г)
в реакционной системе установилось химическое равновесие. При этом исходные концентрации оксида азота (II) и кислорода составили 0,25 моль/л и 0,3 моль/л соответственно, а равновесная концентрации оксида азота (II) составила 0,05 моль/л.
Определите равновесные концентрации О3 (Х) и NO2 (Y).
Выберите из списка номера правильных ответов.
1) 0,05 моль/л 3) 0,15 моль/л 5) 0,25 моль/л
2) 0,10 моль/л 4) 0,20 моль/л 6) 0,30 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 14. В реактор постоянного объёма поместили некоторое количество диоксида хлора. В результате протекания обратимой реакции
ClO2(г) ↔ 1/2Cl2(г) + О2(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация ClO2 составила 0,7 моль/л, а равновесная концентрация кислорода – 0,4 моль/л.
Определите равновесные концентрации ClO2 (Х) и Сl2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 15. В реактор постоянного объёма поместили некоторое количество фторида азота(III). В результате протекания обратимой реакции
2NF3(г) ↔ N2(г) + 3F2(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация NF3 составила 0,8 моль/л, а равновесная концентрация фтора – 0,6 моль/л.
Определите равновесные концентрации NF3 (Х) и N2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 16. В реактор постоянного объёма поместили некоторое количество азота и фтора. В результате протекания обратимой реакции
N2(г) + 3F2(г) ↔2NF3(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация фтора составила 1,2 моль/л, а равновесные концентрации азота и NF3 составили 0,2 моль/л и 0,4 моль/л соответственно.
Определите исходную концентрацию N2 (Х) и равновесную концентрацию F2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 17. В реактор постоянного объёма поместили некоторое количество оксида хлора(I). В результате протекания обратимой реакции
4Cl2O(г) ↔ 2Сl2(г) + 2ClO2(г)
в реакционной системе установилось химическое равновесие. При этом равновесные концентрации Cl2O и ClO2 составили 0,05 моль/л и 0,10 моль/л соответственно.
Определите исходную концентрацию Cl2O (Х) и равновесную концентрацию Cl2 (Y).
Выберите из списка номера правильных ответов.
1) 0,05 моль/л 3) 0,15 моль/л 5) 0,25 моль/л
2) 0,10 моль/л 4) 0,20 моль/л 6) 0,30 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 18. В реактор постоянного объёма поместили некоторое количество фторида хлора(I). В результате протекания обратимой реакции
3ClF(г) ↔ СlF3(г) + Сl2(г)
в реакционной системе установилось химическое равновесие. При этом равновесные концентрации ClF и Cl2 составили 0,2 моль/л и 0,1 моль/л соответственно.
Определите исходную концентрацию СlF (Х) и равновесную концентрацию СlF3 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 19. В реактор постоянного объёма поместили некоторое количество трифторида хлора. В результате протекания обратимой реакции
2ClF3(г) ↔ Сl2(г) + 3F2(г)
в реакционной системе установилось химическое равновесие. При этом равновесные концентрации ClF3 и Cl2 составили 0,1 моль/л и 0,2 моль/л соответственно.
Определите исходную концентрацию СlF3 (Х) и равновесную концентрацию F2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 20. В реактор постоянного объёма поместили некоторое количество хлора и трифторида хлора. В результате протекания обратимой реакции
ClF3(г) + Сl2(г) ↔ 3СlF(г)
в реакционной системе установилось химическое равновесие. При этом исходные концентрации ClF3 и Cl2 составили 0,45 моль/л и 0,35 моль/л соответственно, а равновесная концентрация ClF3 составила 0,30 моль/л.
Определите равновесные концентрации Cl2 (Х) и ClF (Y)
Выберите из списка номера правильных ответов.
1) 0,20 моль/л 3) 0,30 моль/л 5) 0,40 моль/л
2) 0,25 моль/л 4) 0,35 моль/л 6) 0,45 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 21. В реактор постоянного объёма поместили некоторое количество метана и кислорода. В результате протекания обратимой реакции
CH4(г) + 1/2O2(г) ↔ СO(г) + 2H2(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация CH4 составила 0,8 моль/л, а равновесные концентрации кислорода, угарного газа и водорода составили 0,2 моль/л, 0,6 моль/л и 1,2 моль/л соответственно.
Определите равновесную концентрацию СН4 (Х) и исходную концентрацию О2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 22. В реактор постоянного объёма поместили некоторое количество метана и углекислого газа. В результате протекания обратимой реакции
1/2CH4(г) + 1/2CO2(г) ↔ СO(г) + H2(г)
в реакционной системе установилось химическое равновесие. При этом исходные концентрации метана и углекислого газа составили 0,7 моль/л и 0,5 моль/л соответственно, а равновесная концентрация углекислого газа составила 0,2 моль/л.
Определите равновесные концентрации СН4 (X) и СО (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 23. В реактор постоянного объёма поместили некоторое количество пропана и водорода. В результате протекания обратимой реакции
C3H8(г) + 2H2(г) ↔ 3CH4(г)
в реакционной системе установилось химическое равновесие. При этом исходные концентрации пропана и водорода составили 0,30 моль/л и 0,50 моль/л соответственно, а равновесная концентрация пропана составила 0,15 моль/л.
Определите равновесные концентрации Н2 (Х) и равновесную концентрацию СН4 (Y).
Выберите из списка номера правильных ответов.
1) 0,20 моль/л 3) 0,30 моль/л 5) 0,40 моль/л
2) 0,25 моль/л 4) 0,35 моль/л 6) 0,45 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 24. В реактор постоянного объёма поместили некоторое количество оксида углерода(II) и водорода. В результате протекания обратимой реакции
CO(г) + 3H2(г) ↔ СH4(г) + H2O(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация CО составила 0,5 моль/л, а равновесные концентрации Н2, СН4 и Н2О составили 0,1 моль/л, 0,2 моль/л и 0,2 моль/л соответственно.
Определите равновесную концентрацию СО (Х) и исходную концентрацию Н2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,5 моль/л 5) 0,9 моль/л
2) 0,3 моль/л 4) 0,7 моль/л 6) 1,1 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 25. В реактор постоянного объёма поместили некоторое количество пропана и водяного пара. В результате протекания обратимой реакции
C3H8(г) + 3H2O(г) ↔ 3СO(г) + 7H2(г)
в реакционной системе установилось химическое равновесие. При этом равновесные концентрации С3Н8, Н2О и СО составили 0,2 моль/л, 0,2 моль/л и 0,6 моль/л соответственно.
Определите исходную концентрацию С3Н8 (Х) и равновесную концентрацию Н2 (Y).
Выберите из списка номера правильных ответов.
1) 0,4 моль/л 3) 0,8 моль/л 5) 1,2 моль/л
2) 0,6 моль/л 4) 1,0 моль/л 6) 1,4 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 26. В реактор постоянного объёма поместили некоторое количество порошка графита и водяного пара. В результате протекания обратимой реакции
C(тв.) + H2O(г) ↔ H2(г) + СO(г)
в реакционной системе установилось химическое равновесие. При этом равновесные концентрации Н2О и Н2 составили 0,2 моль/л и 0,3 моль/л соответственно.
Определите исходную концентрацию Н2О (Х) и равновесную концентрацию СО (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 27. В реактор постоянного объёма поместили некоторое количество S2Cl2 и водорода. В результате протекания обратимой реакции
S2Cl2(г) + H2(г) ↔ 2HCl(г) + 2S(ж)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация S2Cl2 составила 0,4 моль/л, а равновесные концентрации S2Cl2 и Н2 составили 0,2 моль/л и 0,3 моль/л соответственно.
Определите исходную концентрацию Н2 (Х) и равновесную концентрацию НСl (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 28. В реактор постоянного объёма поместили некоторое количество серы и водяного пара. В результате протекания обратимой реакции
2S(ж) + 2H2O(г) ↔ 2H2S(г) + SO2(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация Н2О составила 0,8 моль/л, а равновесная концентрация Н2S составила 0,6 моль/л.
Определите равновесные концентрации H2O (Х) и SO2 (Y)
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 29. В реактор постоянного объёма поместили некоторое количество вещества А. В результате протекания обратимой реакции
3A(г) ↔ 2В(г) + С(г)
в реакционной системе установилось химическое равновесие. При этом равновесные концентрации А и С составили 0,1 моль/л и 0,3 моль/л соответственно.
Определите исходную концентрацию А (Х) и равновесную концентрацию В (Y).
Выберите из списка номера правильных ответов.
1) 0,2 моль/л 3) 0,6 моль/л 5) 1,0 моль/л
2) 0,4 моль/л 4) 0,8 моль/л 6) 1,2 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 30. В реактор постоянного объёма поместили вещества А и В. В результате протекания обратимой реакции
A(тв.) + 3В(г) ↔ С(г) + 2D(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация В составила 0,9 моль/л, а равновесная концентрация D составила 0,4 моль/л.
Определите равновесные концентрации веществ В (Х) и С (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 31. В реактор постоянного объёма поместили оксид углерода(II) и водород. В результате протекания обратимой реакции
CO(г) + 2H2(г) = CH3OH(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация CO составила 0,3 моль/л, равновесная концентрация CO составила 0,1 моль/л, а равновесная концентрация H2 составила 0,8 моль/л.
Определите равновесные концентрации веществ Н2 (Х) и СН3ОН (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 32. В реактор постоянного объёма поместили кислород и азот и подвергли воздействию электрического тока. В результате протекания обратимой реакции
N2(г) + O2(г) ↔ 2NO(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация О2 составила 0,4 моль/л, равновесная концентрация N2 составила 0,3 моль/л, а равновесная концентрация NO составила 0,2 моль/л.
Определите исходную концентрацию N2 (Х) и равновесную концентрацию O2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 33. В реактор постоянного объёма поместили некоторое количество метана и кислорода. В результате протекания обратимой реакции
2CH4(г) + O2(г) ↔ 2CO(г) + 4H2(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация CH4 составила 0,8 моль/л, равновесная концентрация O2 составила 0,2 моль/л, равновесная концентрация CO составила 0,6 моль/л, а равновесная концентрация H2 составила 1,2 моль/л
Определите равновесную концентрацию CH4 (Х) и исходную концентрацию O2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 34. В реактор постоянного объёма поместили угарный газ и хлор. В результате протекания обратимой реакции
CO(г) + Cl2(г) ↔ COCl2(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация СО составила 0,4 моль/л, равновесная концентрация Cl2 составила 0,2 моль/л, а равновесная концентрация COCl2 составила 0,3 моль/л
Определите равновесную концентрацию CО (Х) и исходную концентрацию Cl2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 35. В реактор постоянного объёма поместили оксид серы(VI) и нагрели. В результате протекания обратимой реакции
2SO3(г) ↔ 2SО2(г) + O2(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация SO3 составила 0,28 моль/л, а равновесная концентрация SO3 составила 0,3 моль/л
Определите равновесную концентрацию SO2 (Х) и равновесную концентрацию О2 (Y).
Выберите из списка номера правильных ответов.
1) 0,02 моль/л 3) 0,08 моль/л 5) 0,2 моль/л
2) 0,04 моль/л 4) 0,15 моль/л 6) 0,3 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 36. В реактор постоянного объёма поместили некоторое количество метана и кислорода. В результате протекания обратимой реакции
2CH4(г) + O2(г) = 2CO(г) + 4H2(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация O2 составила 0,5 моль/л, равновесная концентрация CH4 составила 0,2 моль/л, равновесная концентрация CO составила 0,4 моль/л, а равновесная концентрация H2 составила 0,8 моль/л
Определите исходную концентрацию CH4 (Х) и равновесную концентрацию О2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 37. В реактор постоянного объёма поместили некоторое количество оксида углерода(II) и водорода. В результате протекания обратимой реакции
CO(г) + 2H2(г) ↔ CH3OH(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация CO составила 0,7 моль/л, исходная концентрация H2 составила 0,8 моль/л, а равновесная концентрация H2 составила 0,4 моль/л
Определите равновесную концентрацию CO (Х) и равновесную концентрацию CH3OH (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 38. В реактор постоянного объёма поместили оксид углерода(IV) и нагрели. В результате протекания обратимой реакции
2CO2(г) ↔ 2CO(г) + O2(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация CO2 составила 0,23 моль/л, а равновесная концентрация CO2 составила 0,15 моль/л
Определите равновесную концентрацию CO (Х) и равновесную концентрацию O2 (Y).
Выберите из списка номера правильных ответов.
1) 0,02 моль/л 3) 0,08 моль/л 5) 0,20 моль/л
2) 0,04 моль/л 4) 0,15 моль/л 6) 0,30 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 39. В реактор постоянного объёма поместили оксид углерода(IV) и кислород. В результате протекания обратимой реакции
2SO2(г) + O2(г) ↔ 2SO3(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация SO2 составила 0,6 моль/л, равновесная концентрация O2 составила 0,3 моль/л, а равновесная концентрация SO3 составила 0,4 моль/л
Определите равновесную концентрацию SO2 (Х) и исходную концентрацию O2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 40. В реактор постоянного объёма поместили водород и пары брома. В результате протекания обратимой реакции
H2(г) + Br2(г) ⇄ 2HBr(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация H2 составила 0,32 моль/л, равновесная концентрация Br2 составила 0,1 моль/л, а равновесная концентрация HBr составила 0,32 моль/л
Определите равновесную концентрацию H2 (X) и исходную концентрацию Br2 (Y).
Выберите из списка номера правильных ответов.
1) 0,08 моль/л 3) 0,2 моль/л 5) 0,32 моль/л
2) 0,16 моль/л 4) 0,26 моль/л 6) 0,42 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 41. В реактор постоянного объёма поместили пары циклогексана и нагрели в присутствии катализатора. В результате протекания обратимой реакции
C6H12(г) ⇄ C6H6(г) + 3H2(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация C6H12 составила 0,3 моль/л, а равновесная концентрация H2 составила 0,3 моль/л
Определите равновесную концентрацию C6H12 (X) и равновесную концентрацию С6H6 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 42. В реактор постоянного объёма поместили метан и углекислый газ. В результате протекания обратимой реакции
CH4(г) + CO2(г) ⇄ 2CO(г) + 2H2(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация CO2 составила 0,5 моль/л, равновесная концентрация CH4 составила 0,1 моль/л, а равновесная концентрация CO2 составила 0,2 моль/л
Определите исходную концентрацию CH4 (X) и равновесную концентрацию H2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Задание 43. В реактор постоянного объёма поместили оксид серы(IV) и кислород. В результате протекания обратимой реакции
2SO2(г) + O2(г) ↔ 2SO3(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация оксида серы(VI) составила 0,6 моль/л, концентрации кислорода и оксида серы(VI) составили 0,3 моль/л и 0,4 моль/л соответственно.
Определите исходную концентрацию SO2 (X) и исходную концентрацию О2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 3) 0,3 моль/л 5) 0,5 моль/л
2) 0,2 моль/л 4) 0,4 моль/л 6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
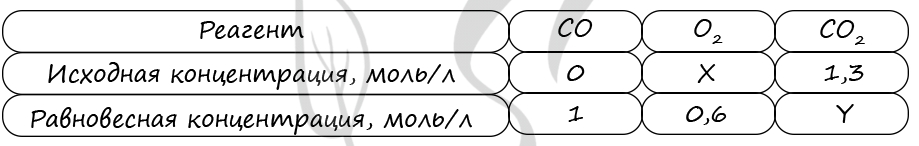
7907. В реактор постоянного объёма поместили некоторое количество угарного газа и кислорода. В результате протекания обратимой реакции в реакционной системе
установилось химическое равновесие.
При этом исходная концентрация оксида углерода(II) составила 0,3 моль/л, а равновесная концентрация кислорода и оксида углерода(II) – 0,6 моль/л и 0,1 моль/л соответственно. Определите исходную концентрацию кислорода (X) и равновесную концентрацию углекислого газа (Y).
Выберите из списка номера правильных ответов:
1) 0,1 моль/л
2) 0,2 моль/л
3) 0,3 моль/л
4) 0,6 моль/л
5) 0,7 моль/л
6) 0,8 моль/л
Запишите в поле ввода номера полученных ответов в последовательности букв XY без запятых и каких-либо других знаков.

Верный ответ: 52
Таблица (по условиям задания) для расчетов:
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7907.
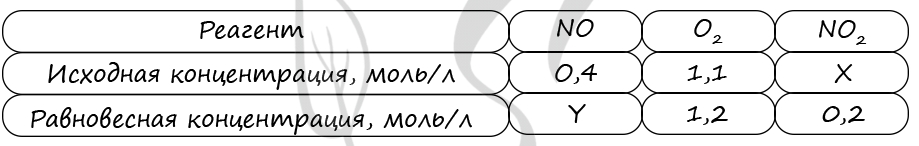
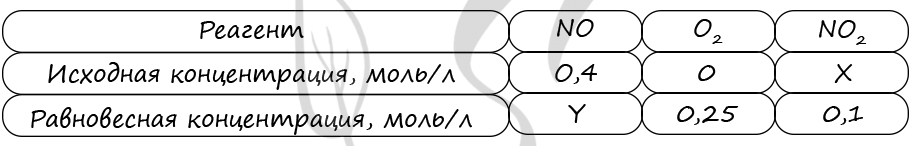
7872. В реактор постоянного объёма поместили некоторое количество оксида азота(IV) и кислорода. В результате протекания обратимой реакции в реакционной системе
установилось химическое равновесие.
При этом исходная концентрация кислорода и оксида азота(II) — 1,1 моль/л и 0,4 моль/л соответственно, а равновесная концентрация оксида азота(IV) и кислорода – 0,2 моль/л и 1,2 моль/л соответственно. Определите исходную концентрацию оксида азота(IV) (X) и равновесную концентрацию оксида азота(II) (Y).
Выберите из списка номера правильных ответов:
1) 0,3 моль/л
2) 0,4 моль/л
3) 0,5 моль/л
4) 0,6 моль/л
5) 0,7 моль/л
6) 0,8 моль/л
Запишите в поле ввода номера полученных ответов в последовательности букв XY без запятых и каких-либо других знаков.

Верный ответ: 24
Таблица (по условиям задания)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7872.
7837. В реактор постоянного объёма поместили некоторое количество угарного газа и кислорода. В результате протекания обратимой реакции в реакционной системе
установилось химическое равновесие.
При этом исходная концентрация оксида углерода (II) и оксида углерода (IV) — 1 моль/л и 0 моль/л соответственно, а равновесная концентрация кислорода и оксида углерода (IV) – 0,4 моль/л и 0,8 моль/л соответственно. Определите исходную концентрацию кислорода (X) и равновесную концентрацию угарного газа (Y).
Выберите из списка номера правильных ответов:
1) 0,1 моль/л
2) 0,2 моль/л
3) 0,3 моль/л
4) 0,6 моль/л
5) 0,7 моль/л
6) 0,8 моль/л
Запишите в поле ввода номера полученных ответов в последовательности букв XY без запятых и каких-либо других знаков.

Верный ответ: 62
Таблица (по условиям задания)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7837.
7802. В реактор постоянного объёма поместили некоторое количество оксида азота(IV) и оксида азота(II). В результате протекания обратимой реакции в реакционной системе
установилось химическое равновесие.
При этом исходная концентрация оксида азота (II) и кислорода — 0,2 моль/л и 0 моль/л соответственно, а равновесная концентрация кислорода и оксида азота (IV) – 0,3 моль/л и 0,2 моль/л соответственно. Определите исходную концентрацию оксида азота(IV) (X) и равновесную концентрацию оксида азота(II) (Y).
Выберите из списка номера правильных ответов:
1) 0,1 моль/л
2) 0,2 моль/л
3) 0,3 моль/л
4) 0,5 моль/л
5) 0,7 моль/л
6) 0,8 моль/л
Запишите в поле ввода номера полученных ответов в последовательности букв XY без запятых и каких-либо других знаков.

Верный ответ: 66
Таблица (по условиям задания)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7802.
7767. В реактор постоянного объёма поместили некоторое количество оксида азота(II) и кислорода. В результате протекания обратимой реакции в реакционной системе
установилось химическое равновесие.
При этом исходная концентрация оксида азота (IV) и оксида азота (II) — 0 моль/л и 0,5 моль/л соответственно, а равновесная концентрация кислорода и оксида азота (IV) – 0,2 моль/л и 0,4 моль/л соответственно. Определите исходную концентрацию кислорода (X) и равновесную концентрацию оксида азота(II) (Y).
Выберите из списка номера правильных ответов:
1) 0,1 моль/л
2) 0,2 моль/л
3) 0,3 моль/л
4) 0,4 моль/л
5) 0,5 моль/л
6) 0,6 моль/л
Запишите в поле ввода номера полученных ответов в последовательности букв XY без запятых и каких-либо других знаков.

Верный ответ: 41
Таблица (по условиям)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7767.
7732. В реактор постоянного объёма поместили некоторое количество угарного газа и кислорода. В результате протекания обратимой реакции в реакционной системе
установилось химическое равновесие.
При этом исходная концентрация оксида углерода (II) и оксида углерода (IV) — 0 моль/л и 1,3 моль/л соответственно, а равновесная концентрация кислорода и оксида углерода (II) – 0,6 моль/л и 1 моль/л соответственно. Определите исходную концентрацию кислорода (X) и равновесную концентрацию углекислого газа (Y).
Выберите из списка номера правильных ответов:
1) 0,1 моль/л
2) 0,2 моль/л
3) 0,3 моль/л
4) 0,4 моль/л
5) 0,5 моль/л
6) 0,6 моль/л
Запишите в поле ввода номера полученных ответов в последовательности букв XY без запятых и каких-либо других знаков.

Верный ответ: 13
Таблица (по условиям)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7732.
7697. В реактор постоянного объёма поместили некоторое количество оксидов азота(II) и (IV) и кислорода. В результате протекания обратимой реакции в реакционной системе
установилось химическое равновесие.
При этом исходная концентрация оксида азота (II) и кислорода — 0,8 моль/л и 1,8 моль/л соответственно, а равновесная концентрация кислорода и оксида азота (IV) – 1,6 моль/л и 0,6 моль/л соответственно. Определите исходную концентрацию оксида азота (IV) (X) и равновесную концентрацию оксида азота (II) (Y).
Выберите из списка номера правильных ответов:
1) 0,1 моль/л
2) 0,2 моль/л
3) 0,3 моль/л
4) 0,4 моль/л
5) 0,5 моль/л
6) 0,7 моль/л
Запишите в поле ввода номера полученных ответов в последовательности букв XY без запятых и каких-либо других знаков.

Верный ответ: 24
Таблица (по условию)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7697.
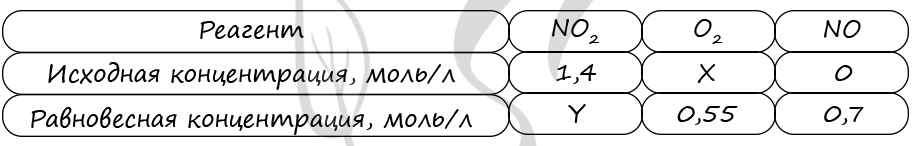
7662. В реактор постоянного объёма поместили некоторое количество оксида азота(IV) и кислорода. В результате протекания обратимой реакции в реакционной системе
установилось химическое равновесие.
При этом исходная концентрация оксида азота (II) и оксида азота (IV) — 0 моль/л и 1,4 моль/л соответственно, а равновесная концентрация оксида азота (II) и кислорода – 0,7 моль/л и 0,55 моль/л соответственно. Определите исходную концентрацию кислорода (X) и равновесную концентрацию оксида азота (IV) (Y).
Выберите из списка номера правильных ответов:
1) 0,1 моль/л
2) 0,2 моль/л
3) 0,4 моль/л
4) 0,5 моль/л
5) 0,7 моль/л
6) 0,8 моль/л
Запишите в поле ввода номера полученных ответов в последовательности букв XY без запятых и каких-либо других знаков.

Верный ответ: 25
Таблица (по условию)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7662.
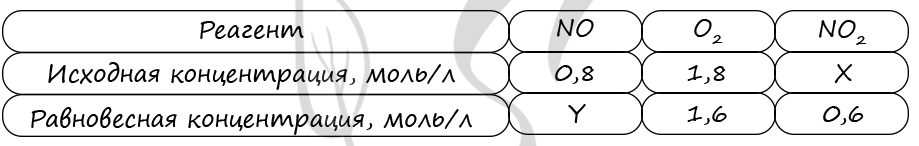
7627. В реактор постоянного объёма поместили некоторое количество угарного газа и кислорода. В результате протекания обратимой реакции в реакционной системе
установилось химическое равновесие.
При этом исходная концентрация оксида углерода (II) и оксида углерода (IV) — 0 моль/л и 0,7 моль/л соответственно, а равновесная концентрация оксида углерода (II) и кислорода – 0,6 моль/л и 0,6 моль/л соответственно. Определите исходную концентрацию кислорода (X) и равновесную концентрацию оксида азота (IV) (Y).
Выберите из списка номера правильных ответов:
1) 0,1 моль/л
2) 0,2 моль/л
3) 0,3 моль/л
4) 0,4 моль/л
5) 0,5 моль/л
6) 0,6 моль/л
Запишите в поле ввода номера полученных ответов в последовательности букв XY без запятых и каких-либо других знаков.

Верный ответ: 31
Таблица (по условию)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7627.
7592. В реактор постоянного объёма поместили некоторое количество оксида азота(IV) и оксида азота(II). В результате протекания обратимой реакции в реакционной системе
установилось химическое равновесие.
При этом исходная концентрация оксида азота (II) и кислорода — 0,4 моль/л и 0 моль/л соответственно, а равновесная концентрация оксида азота (IV) и кислорода – 0,1 моль/л и 0,25 моль/л соответственно. Определите исходную концентрацию оксида азота (IV) (X) и равновесную концентрацию оксида азота (II) (Y).
Выберите из списка номера правильных ответов:
1) 0,4 моль/л
2) 0,5 моль/л
3) 0,6 моль/л
4) 0,8 моль/л
5) 0,9 моль/л
6) 1 моль/л
Запишите в поле ввода номера полученных ответов в последовательности букв XY без запятых и каких-либо других знаков.

Верный ответ: 35
Таблица (по условию)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7592.
Для вас приятно генерировать тесты, создавайте их почаще
Чтобы поделиться, нажимайте
Химическое равновесие. Расчёты концентраций. Часть 1
Предлагаем вам сборку заданий 23 (новое задание ЕГЭ 2022) по теме Химическое равновесие. Расчёты концентраций. Ответы вы найдёте внизу страницы.
- В реактор постоянного объёма поместили некоторое количество оксида серы (IV) и кислорода. В результате протекания обратимой реакции
2SO2 (г) + O2 (г) ↔ 2SO3 (г)
в реакционной системе установилось химическое равновесие.
Используя данные, приведённые в таблице, определите равновесную концентрацию SO2 (Х) и исходную концентрацию O2 (Y).
| Реагент | SO2 | O2 | SO3 |
| Исходная концентрация (моль/л) | 1,2 | ||
| Равновесная концентрация (моль/л) | 0,6 | 0,8 |
Выберите из списка номера правильных ответов.
1) 0,2 моль/л
2) 0,4 моль/л
3) 0,6 моль/л
4) 0,8 моль/л
5) 1,0 моль/л
6) 1,2 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
- В реактор постоянного объёма поместили пары иода и водорода. В результате протекания обратимой реакции
I2 (г) + H2 (г) ↔ 2HI (г)
в реакционной системе установилось химическое равновесие.
Используя данные, приведённые в таблице, определите равновесную концентрацию H2 (Х) и исходную концентрацию I2 (Y).
| Реагент | I2 | H2 | HI |
| Исходная концентрация (моль/л) | 5 | ||
| Равновесная концентрация (моль/л) | 3,5 | 1 |
Выберите из списка номера правильных ответов.
1) 0,5 моль/л
2) 1,0 моль/л
3) 2,5 моль/л
4) 3,0 моль/л
5) 4,0 моль/л
6) 4,5 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
- В реактор постоянного объёма поместили некоторое количество оксида серы (IV) и кислорода и катализатор. В результате протекания обратимой реакции
2SO2 (г) + O2 (г) ↔ 2SO3 (г)
в реакционной системе установилось химическое равновесие.
Используя данные, приведённые в таблице, определите исходную концентрацию SO2 (Х) и равновесную концентрацию O2 (Y).
| Реагент | SO2 | O2 | SO3 |
| Исходная концентрация (моль/л) | 1,2 | ||
| Равновесная концентрация (моль/л) | 0,4 | 0,2 |
Выберите из списка номера правильных ответов.
1) 0,2 моль/л
2) 0,4 моль/л
3) 0,6 моль/л
4) 0,9 моль/л
5) 1,0 моль/л
6) 1,1 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
- В реактор постоянного объёма поместили некоторое количество оксида азота (II) и кислорода. В результате протекания обратимой реакции
2NO (г) + O2 (г) ↔ 2NO2 (г)
в реакционной системе установилось химическое равновесие.
Используя данные, приведённые в таблице, определите равновесные концентрации NO (Х) и O2 (Y).
| Реагент | NO | O2 | NO2 |
| Исходная концентрация (моль/л) | 0,25 | 0,4 | |
| Равновесная концентрация (моль/л) | 0,1 |
Выберите из списка номера правильных ответов.
1) 0,05 моль/л
2) 0,15 моль/л
3) 0,3 моль/л
4) 0,35 моль/л
5) 0,5 моль/л
6) 0,55 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
- В реактор постоянного объёма поместили некоторое количество аммиака с катализатором и нагрели. В результате протекания обратимой реакции
2NH3 (г) ↔ 3H2 (г) + N2 (г)
в реакционной системе установилось химическое равновесие.
Используя данные, приведённые в таблице, определите исходную концентрацию аммиака (Х) и равновесную концентрацию водорода (Y).
| Реагент | NH3 | N2 | H2 |
| Исходная концентрация (моль/л) | |||
| Равновесная концентрация (моль/л) | 7 | 1,5 |
Выберите из списка номера правильных ответов.
1) 1,5 моль/л
2) 3 моль/л
3) 4,5 моль/л
4) 6 моль/л
5) 7,5 моль/л
6) 10 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Ответы:
- 25
- 65
- 36
- 24
- 63
Также предлагаем вам плейлист видео-уроков и видео-объяснений заданий на эту тему:
Также:
- Посмотреть реальные, досрочные и пробные варианты ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки для подготовки к ЕГЭ вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ вы можете здесь, нажав на эту строку
- Все видео-объяснения вы можете найти на YouTube канале, нажав на эту строку
Тематический тренировочный тест на гидролиз солей.
Задание №1
Выберите соли, способные подвергаться гидролизу в водном растворе. Число верных ответов может быть любым
- 1. KCl
- 2. Fe(NO3)3
- 3. BaBr2
- 4. ZnCl2
- 5. NaI
Решение
Ответ: 24
Задание №2
Выберите соли, способные подвергаться гидролизу в водном растворе. Число верных ответов может быть любым
- 1. RbHS
- 2. Ca(NO3)2
- 3. FeSO4
- 4. BeSO4
- 5. SrCl2
Решение
Ответ: 134
Задание №3
Выберите соли, способные подвергаться гидролизу в водном растворе. Число верных ответов может быть любым
- 1. Na2CO3
- 2. LiCl
- 3. KHCO3
- 4. FeI2
- 5. Al2(SO4)3
Решение
Ответ: 1345
Задание №4
Выберите соли, способные подвергаться гидролизу в водном растворе. Число верных ответов может быть любым
- 1. HgCl2
- 2. CsI
- 3. NaF
- 4. CuSO4
- 5. Mg(NO3)2
Решение
Ответ: 1345
Задание №5
Выберите соли, способные подвергаться гидролизу в водном растворе. Число верных ответов может быть любым
- 1. Zn(CH3COO)2
- 2. NH4Cl
- 3. BaSO4
- 4. AlBr3
- 5. Cr(NO3)3
Решение
Ответ: 1245
Задание №6
Выберите соли, способные подвергаться гидролизу в водном растворе. Число верных ответов может быть любым
- 1. NaHSO4
- 2. Fe2(SO4)3
- 3. CrCl3
- 4. Mn(NO3)2
- 5. RbNO3
Решение
Ответ: 234
Задание №7
Выберите соли, способные подвергаться гидролизу в водном растворе. Число верных ответов может быть любым
- 1. Ba(NO3)2
- 2. BeBr2
- 3. KClO3
- 4. CuCl2
- 5. ZnSO4
Решение
Ответ: 245
Задание №8
Выберите соли, способные подвергаться гидролизу в водном растворе. Число верных ответов может быть любым
- 1. Na2HPO4
- 2. CaSO4
- 3. CuCl2
- 4. Cs2SO4
- 5. KI
Решение
Ответ: 13
Задание №9
Выберите соли, способные подвергаться гидролизу в водном растворе. Число верных ответов может быть любым
- 1. KMnO4
- 2. K2SO4
- 3. LiClO3
- 4. NaClO4
- 5. BeCl2
Решение
Ответ: 5
Задание №10
Выберите соли, способные подвергаться гидролизу в водном растворе. Число верных ответов может быть любым
- 1. KF
- 2. KClO
- 3. NaClO2
- 4. RbClO3
- 5. Zn(NO3)2
Решение
Ответ: 1235
[adsp-pro-3]
Задание №11
Выберите соли, способные подвергаться гидролизу в водном растворе. Число верных ответов может быть любым
- 1. MnCl2
- 2. Mg(CH3COO)2
- 3. NH4NO3
- 4. KNO3
- 5. Cr2(SO4)3
Решение
Ответ: 1235
Задание №12
Выберите соли, способные подвергаться гидролизу в водном растворе. Число верных ответов может быть любым
- 1. CuBr2
- 2. Na2S
- 3. KF
- 4. KI
- 5. Sr(NO3)2
Решение
Ответ: 123
Задание №13
Выберите соли, способные подвергаться гидролизу в водном растворе. Число верных ответов может быть любым
- 1. FeSO4
- 2. CrSO4
- 3. MnSO4
- 4. K2SO4
- 5. NaHCO3
Решение
Ответ: 1235
Задание №14
Выберите соли, способные подвергаться гидролизу в водном растворе. Число верных ответов может быть любым
- 1. KCl
- 2. NaClO3
- 3. CsCl
- 4. Sr(NO3)2
- 5. BeSO4
Решение
Ответ: 5
Задание №15
Выберите соли, способные подвергаться гидролизу в водном растворе. Число верных ответов может быть любым
- 1. K2HPO4
- 2. ZnI2
- 3. MgSO4
- 4. Cu(NO3)2
- 5. KF
Решение
Ответ: 12345
Задание №16
Выберите соли, способные подвергаться гидролизу в водном растворе. Число верных ответов может быть любым
- 1. Pb(NO3)2
- 2. BaCO3
- 3. KNO2
- 4. MnSO4
- 5. Hg(NO3)2
Решение
Ответ: 1345
Задание №17
Выберите соли, способные подвергаться гидролизу в водном растворе. Число верных ответов может быть любым
- 1. Na2SiO3
- 2. NaHCO3
- 3. Na2SO4
- 4. Na3PO4
- 5. Na2SO3
Решение
Ответ: 1245
Задание №18
Выберите соли, способные подвергаться гидролизу в водном растворе. Число верных ответов может быть любым
- 1. KClO3
- 2. LiClO4
- 3. NH4ClO4
- 4. BaCl2
- 5. NaClO
Решение
Ответ: 35
Задание №19
Выберите соли, способные подвергаться гидролизу в водном растворе. Число верных ответов может быть любым
- 1. Cr2(SO4)3
- 2. Al(NO3)3
- 3. MnCl2
- 4. SrCl2
- 5. Rb2S
Решение
Ответ: 1235
Задание №20
Выберите соли, способные подвергаться гидролизу в водном растворе. Число верных ответов может быть любым
- 1. NaF
- 2. CaCO3
- 3. KClO2
- 4. FeCl3
- 5. Cr2(SO4)3
Решение
Ответ: 1345
[adsp-pro-3]
Задание №21
Установите соответствие между формулой соли и средой ее водного раствора
| ФОРМУЛА СОЛИ | СРЕДА РАСТВОРА |
|
А) NaF Б) Na3PO4 В) KCl |
1) кислая 2) нейтральная 3) щелочная |
Решение
Ответ: 332
Задание №22
Установите соответствие между формулой соли и средой ее водного раствора
| ФОРМУЛА СОЛИ | СРЕДА РАСТВОРА |
|
А) MgBr2 Б) BeCl2 В) K3PO4 |
1) щелочная 2) кислая 3) нейтральная |
Решение
Ответ: 221
Задание №23
Установите соответствие между формулой соли и средой ее водного раствора
| ФОРМУЛА СОЛИ | СРЕДА РАСТВОРА |
|
А) MnCl2 Б) KClO3 В) Na3PO4 |
1) щелочная 2) кислая 3) нейтральная |
Решение
Ответ: 231
Задание №24
Установите соответствие между формулой соли и средой ее водного раствора
| ФОРМУЛА СОЛИ | СРЕДА РАСТВОРА |
|
А) NH4NO3 Б) Ca(CH3COO)2 В) Cr2(SO4)3 |
1) нейтральная 2) кислая 3) щелочная |
Решение
Ответ: 232
Задание №25
Установите соответствие между формулой соли и средой ее водного раствора
| ФОРМУЛА СОЛИ | СРЕДА РАСТВОРА |
|
А) CsI Б) Cr(NO3)3 В) NH4Cl |
1) кислая 2) нейтральная 3) щелочная |
Решение
Ответ: 211
Задание №26
Установите соответствие между формулой соли и средой ее водного раствора
| ФОРМУЛА СОЛИ | СРЕДА РАСТВОРА |
|
А) Fe(NO3)3 Б) Rb2S В) ZnCl2 |
1) щелочная 2) кислая 3) нейтральная |
Решение
Ответ: 212
Задание №27
Установите соответствие между формулой соли и средой ее водного раствора
| ФОРМУЛА СОЛИ | СРЕДА РАСТВОРА |
|
А) KClO Б) KNO3 В) KF |
1) нейтральная 2) щелочная 3) кислая |
Решение
Ответ: 212
Задание №28
Установите соответствие между формулой соли и средой ее водного раствора
| ФОРМУЛА СОЛИ | СРЕДА РАСТВОРА |
|
А) K3PO4 Б) KNO2 В) Cu(NO3)2 |
1) кислая 2) щелочная 3) нейтральная |
Решение
Ответ: 221
Задание №29
Установите соответствие между формулой соли и средой ее водного раствора
| ФОРМУЛА СОЛИ | СРЕДА РАСТВОРА |
|
А) MnCl2 Б) Cr2(SO4)3 В) NaI |
1) кислая 2) нейтральная 3) щелочная |
Решение
Ответ: 112
Задание №30
Установите соответствие между формулой соли и средой ее водного раствора
| ФОРМУЛА СОЛИ | СРЕДА РАСТВОРА |
|
А) BeBr2 Б) ZnSO4 В) CuCl2 |
1) щелочная 2) нейтральная 3) кислая |
Решение
Ответ: 333
[adsp-pro-3]
Задание №31
Установите соответствие между формулой соли и средой ее водного раствора
| ФОРМУЛА СОЛИ | СРЕДА РАСТВОРА |
|
А) Na2SO4 Б) K2CO3 В) CrCl3 |
1) щелочная 2) кислая 3) нейтральная |
Решение
Ответ: 312
Задание №32
Установите соответствие между формулой соли и средой ее водного раствора
| ФОРМУЛА СОЛИ | СРЕДА РАСТВОРА |
|
А) BeBr2 Б) SnCl2 В) Rb2S |
1) кислая 2) нейтральная 3) щелочная |
Решение
Ответ: 113
Задание №33
Установите соответствие между формулой соли и средой ее водного раствора
| ФОРМУЛА СОЛИ | СРЕДА РАСТВОРА |
|
А) Ca(CH3COO)2 Б) Cu(NO3)2 В) NH4Br |
1) кислая 2) щелочная 3) нейтральная |
Решение
Ответ: 211
Задание №34
Установите соответствие между формулой соли и средой ее водного раствора
| ФОРМУЛА СОЛИ | СРЕДА РАСТВОРА |
|
А) FeSO4 Б) Na2CO3 В) FeBr2 |
1) нейтральная 2) щелочная 3) кислая |
Решение
Ответ: 323
Задание №35
Установите соответствие между формулой соли и средой ее водного раствора
| ФОРМУЛА СОЛИ | СРЕДА РАСТВОРА |
|
А) KCl Б) NH4I В) BaBr2 |
1) щелочная 2) нейтральная 3) кислая |
Решение
Ответ: 232
Задание №36
Установите соответствие между формулой соли и средой ее водного раствора
| ФОРМУЛА СОЛИ | СРЕДА РАСТВОРА |
|
А) FeSO4 Б) K2SO4 В) CsCl |
1) щелочная 2) кислая 3) нейтральная |
Решение
Ответ: 233
Задание №37
Установите соответствие между формулой соли и средой ее водного раствора
| ФОРМУЛА СОЛИ | СРЕДА РАСТВОРА |
|
А) BeI2 Б) Cs2CO3 В) CuCl2 |
1) кислая 2) щелочная 3) нейтральная |
Решение
Ответ: 121
Задание №38
Установите соответствие между формулой соли и средой ее водного раствора
| ФОРМУЛА СОЛИ | СРЕДА РАСТВОРА |
|
А) CuSO4 Б) LiClO4 В) BaCl2 |
1) кислая 2) нейтральная 3) щелочная |
Решение
Ответ: 122
Задание №39
Установите соответствие между формулой соли и средой ее водного раствора
| ФОРМУЛА СОЛИ | СРЕДА РАСТВОРА |
|
А) Ba(NO3)2 Б) CaCl2 В) K3PO4 |
1) нейтральная 2) кислая 3) щелочная |
Решение
Ответ: 113
Задание №40
Установите соответствие между формулой соли и средой ее водного раствора
| ФОРМУЛА СОЛИ | СРЕДА РАСТВОРА |
|
А) Na2SiO3 Б) K2SO4 В) Rb2SO3 |
1) кислая 2) щелочная 3) нейтральная |
Решение
Ответ: 232
[adsp-pro-3]
Задание №41
Установите соответствие между солью и ее способностью к гидролизу
| ФОРМУЛА СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
|
А) NaF Б) Na3PO4 В) KCl |
1) гидролизуется по катиону 2) гидролизуется по аниону 3) гидролизуется и по катиону, и по аниону 4) гидролизу не подвергается |
Решение
Ответ: 224
Задание №42
Установите соответствие между солью и типом ее гидролиза
| ФОРМУЛА СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
|
А) хлорид калия Б) сульфид аммония В) ацетат свинца |
1) гидролизу не подвергается 2) гидролизуется по катиону 3) гидролизуется по аниону 4) гидролизуется и по катиону, и по аниону |
Решение
Ответ: 144
Задание №43
Установите соответствие между солью и типом ее гидролиза
| ФОРМУЛА СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
|
А) MnCl2 Б) KClO3 В) Na3PO4 |
1) гидролизуется и по катиону, и по аниону 2) гидролизу не подвергается 3) гидролизуется по катиону 4) гидролизуется по аниону |
Решение
Ответ: 324
Задание №44
Установите соответствие между солью и типом ее гидролиза
| НАЗВАНИЕ СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
|
А) фторид калия Б) сульфат меди В) нитрат алюминия |
1) гидролизуется по аниону 2) гидролизуется и по катиону, и по аниону 3) гидролизу не подвергается 4) гидролизуется по катиону |
Решение
Ответ: 144
Задание №45
Установите соответствие между солью и типом ее гидролиза
| ФОРМУЛА СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
|
А) CsI Б) Cr(NO3)3 В) NH4Cl |
1) гидролизуется по катиону 2) гидролизуется по аниону 3) по катиону и аниону 4) гидролизу не подвергается |
Решение
Ответ: 411
Задание №46
Установите соответствие между солью и типом ее гидролиза
| НАЗВАНИЕ СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
|
А) бромид лития Б) карбонат цезия В) нитрат стронция |
1) гидролизу не подвергается 2) гидролизуется по катиону 3) гидролизуется по аниону 4) гидролизуется и по катиону, и по аниону |
Решение
Ответ: 131
Задание №47
Установите соответствие между солью и типом ее гидролиза
| ФОРМУЛА СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
|
А) KClO Б) KNO3 В) CsF |
1) гидролизуется и по катиону, и по аниону 2) гидролизу не подвергается 3) гидролизуется по катиону 4) гидролизуется по аниону |
Решение
Ответ: 424
Задание №48
Установите соответствие между солью и типом ее гидролиза
| НАЗВАНИЕ СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
|
А) хлорид магния Б) нитрат аммония В) сульфит натрия |
1) гидролизуется по аниону 2) гидролизуется и по катиону, и по аниону 3) гидролизу не подвергается 4) гидролизуется по катиону |
Решение
Ответ: 441
Задание №49
Установите соответствие между солью и типом ее гидролиза
| ФОРМУЛА СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
|
А) MnCl2 Б) CrCl3 В) NaI |
1) гидролизуется по катиону 2) гидролизуется по аниону 3) гидролизуется и по катиону, и по аниону 4) гидролизу не подвергается |
Решение
Ответ: 114
Задание №50
Установите соответствие между солью и типом ее гидролиза
| НАЗВАНИЕ СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
|
А) нитрат калия Б) бромид аммония В) хлорид рубидия |
1) гидролизу не подвергается 2) гидролизуется по катиону 3) гидролизуется по аниону 4) гидролизуется и по катиону, и по аниону |
Решение
Ответ: 121
[adsp-pro-3]
Задание №51
Установите соответствие между солью и ее отношением к гидролизу
| ФОРМУЛА СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
|
А) CuS Б) K2CO3 В) CrCl3 |
1) гидролизуется и по катиону, и по аниону 2) гидролизу не подвергается 3) гидролизуется по катиону 4) гидролизуется по аниону |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 243
Задание №52
Установите соответствие между солью и ее отношением к гидролизу
| НАЗВАНИЕ СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
|
А) ацетат калия Б) фосфат натрия В) сульфат железа (III) |
1) гидролизуется по аниону 2) гидролизуется и по катиону, и по аниону 3) гидролизу не подвергается 4) гидролизуется по катиону |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 114
Задание №53
Установите соответствие между солью и ее отношением к гидролизу
| ФОРМУЛА СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
|
А) Ca(CH3COO)2 Б) Cu(NO3)2 В) NH4Br |
1) гидролизуется по катиону 2) гидролизуется по аниону 3) гидролизуется и по катиону, и по аниону 4) гидролизу не подвергается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 211
Задание №54
Установите соответствие между солью и ее отношением к гидролизу
| НАЗВАНИЕ СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
|
А) фторид цезия Б) гидрокарбонат кальция В) нитрат цинка |
1) гидролизу не подвергается 2) гидролизуется по катиону 3) гидролизуется по аниону 4) по катиону и аниону |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 332
Задание №55
Установите соответствие между солью и ее отношением к гидролизу
| ФОРМУЛА СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
|
А) KCl Б) NH4I В) BaBr2 |
1) по катиону и аниону 2) гидролизу не подвергается 3) гидролизуется по катиону 4) гидролизуется по аниону |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 232
Задание №56
Установите соответствие между солью и ее отношением к гидролизу
| НАЗВАНИЕ СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
|
А) гидрофосфат калия Б) нитрат меди В) ацетат цинка |
1) гидролизуется по катиону 2) гидролизуется по аниону 3) гидролизуется и по катиону, и по аниону 4) гидролизу не подвергается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 213
Задание №57
Установите соответствие между солью и ее отношением к гидролизу
| ФОРМУЛА СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
|
А) BeI2 Б) Cs2CO3 В) CuCl2 |
1) гидролизуется по катиону 2) гидролизуется по аниону 3) гидролизуется и по катиону, и по аниону 4) гидролизу не подвергается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 121
Задание №58
Установите соответствие между солью и ее отношением к гидролизу
| НАЗВАНИЕ СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
|
А) карбонат калия Б) силикат натрия В) иодид алюминия |
1) гидролизу не подвергается 2) гидролизуется по катиону 3) гидролизуется по аниону 4) по катиону и аниону |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 332
Задание №59
Установите соответствие между солью и ее отношением к гидролизу
| ФОРМУЛА СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
|
А) Ba(NO3)2 Б) CaCl2 В) K3PO4 |
1) по катиону и аниону 2) гидролизу не подвергается 3) гидролизуется по катиону 4) гидролизуется по аниону |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 224
Задание №60
Установите соответствие между солью и ее отношением к гидролизу
| НАЗВАНИЕ СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
|
А) силикат калия Б) поташ В) аммиачная селитра |
1) гидролизуется по аниону 2) по катиону и аниону 3) гидролизу не подвергается 4) гидролизуется по катиону |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 114
[adsp-pro-3]
Задание №61
Установите соответствие между солью и изменением окраски лакмуса в ее растворе
| ФОРМУЛА СОЛИ | ЦВЕТ ИНДИКАТОРА |
|
А) MgBr2 Б) BeCl2 В) K3PO4 |
1) красный 2) синий 3) оранжевый 4) фиолетовый |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 112
Задание №62
Установите соответствие между солью и изменением окраски лакмуса в ее растворе
| НАЗВАНИЕ СОЛИ | ЦВЕТ ИНДИКАТОРА |
|
А) хлорид калия Б) сульфат аммония В) ацетат натрия |
1) фиолетовый 2) красный 3) бесцветный 4) синий |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 124
Задание №63
Установите соответствие между солью и изменением окраски лакмуса в ее растворе
| ФОРМУЛА СОЛИ | ЦВЕТ ИНДИКАТОРА |
|
А) MgCl2 Б) KNO3 В) NH4NO3 |
1) желтый 2) синий 3) фиолетовый 4) красный |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 434
Задание №64
Установите соответствие между солью и изменением окраски лакмуса в ее растворе
| НАЗВАНИЕ СОЛИ | ЦВЕТ ИНДИКАТОРА |
|
А) фторид калия Б) сульфат меди В) нитрат алюминия |
1) фиолетовый 2) красный 3) синий 4) черный |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 322
Задание №65
Установите соответствие между солью и изменением окраски лакмуса в ее растворе
| ФОРМУЛА СОЛИ | ЦВЕТ ИНДИКАТОРА |
|
А) Fe(NO3)3 Б) Rb2S В) ZnCl2 |
1) оранжевый 2) красный 3) фиолетовый 4) синий |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 242
Задание №66
Установите соответствие между солью и изменением окраски лакмуса в ее растворе
| НАЗВАНИЕ СОЛИ | ЦВЕТ ИНДИКАТОРА |
|
А) бромид лития Б) карбонат цезия В) нитрат стронция |
1) красный 2) синий 3) зеленый 4) фиолетовый |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 424
Задание №67
Установите соответствие между солью и изменением окраски лакмуса в ее растворе
| ФОРМУЛА СОЛИ | ЦВЕТ ИНДИКАТОРА |
|
А) K3PO4 Б) KNO2 В) Cu(NO3)2 |
1) синий 2) красный 3) малиновый 4) фиолетовый |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 112
Задание №68
Установите соответствие между солью и изменением окраски лакмуса в ее растворе
| НАЗВАНИЕ СОЛИ | ЦВЕТ ИНДИКАТОРА |
|
А) хлорид магния Б) нитрат аммония В) гидросульфид натрия |
1) белый 2) фиолетовый 3) красный 4) синий |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 334
Задание №69
Установите соответствие между солью и изменением окраски лакмуса в ее растворе
| ФОРМУЛА СОЛИ | ЦВЕТ ИНДИКАТОРА |
|
А) BeBr2 Б) ZnSO4 В) CuCl2 |
1) желтый 2) фиолетовый 3) синий 4) красный |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 444
Задание №70
Установите соответствие между солью и изменением окраски лакмуса в ее растворе
| НАЗВАНИЕ СОЛИ | ЦВЕТ ИНДИКАТОРА |
|
А) нитрат калия Б) бромид аммония В) хлорид рубидия |
1) красный 2) оранжевый 3) фиолетовый 4) синий |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 313
[adsp-pro-3]
Задание №71
Установите соответствие между солью и изменением окраски фенолфталеина в ее растворе
| ФОРМУЛА СОЛИ | ЦВЕТ ИНДИКАТОРА |
|
А) BeBr2 Б) SnCl2 В) Rb2S |
1) бесцветный 2) черный 3) малиновый 4) синий |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 113
Задание №72
Установите соответствие между солью и изменением окраски фенолфталеина в ее растворе
| НАЗВАНИЕ СОЛИ | ЦВЕТ ИНДИКАТОРА |
|
А) ацетат калия Б) фосфат натрия В) сульфат железа (III) |
1) оранжевый 2) малиновый 3) фиолетовый 4) бесцветный |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 224
Задание №73
Установите соответствие между солью и изменением окраски фенолфталеина в ее растворе
| ФОРМУЛА СОЛИ | ЦВЕТ ИНДИКАТОРА |
|
А) FeSO4 Б) Na2CO3 В) FeBr2 |
1) бесцветный 2) оранжевый 3) малиновый 4) желтый |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 131
Задание №74
Установите соответствие между солью и изменением окраски фенолфталеина в ее растворе
| НАЗВАНИЕ СОЛИ | ЦВЕТ ИНДИКАТОРА |
|
А) фторид цезия Б) карбонат калия В) нитрат цинка |
1) малиновый 2) зеленый 3) бесцветный 4) голубой |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 113
Задание №75
Установите соответствие между солью и изменением окраски фенолфталеина в ее растворе
| ФОРМУЛА СОЛИ | ЦВЕТ ИНДИКАТОРА |
|
А) FeSO4 Б) K2SO4 В) CsCl |
1) коричневый 2) синий 3) малиновый 4) бесцветный |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 444
Задание №76
Установите соответствие между солью и изменением окраски метилоранжа в ее растворе
| НАЗВАНИЕ СОЛИ | ЦВЕТ ИНДИКАТОРА |
|
А) гидрофосфат калия Б) нитрат меди В) ацетат калия |
1) красный 2) желтый 3) синий 4) черный |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 212
Задание №77
Установите соответствие между солью и изменением окраски метилоранжа в ее растворе
| ФОРМУЛА СОЛИ | ЦВЕТ ИНДИКАТОРА |
|
А) CuSO4 Б) LiClO3 В) BaCl2 |
1) оранжевый 2) бесцветный 3) красный 4) желтый |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответ: 311 Решение
Задание №78
Установите соответствие между солью и изменением окраски метилоранжа в ее растворе
| НАЗВАНИЕ СОЛИ | ЦВЕТ ИНДИКАТОРА |
|
А) карбонат калия Б) силикат натрия В) иодид алюминия |
1) синий 2) оранжевый 3) желтый 4) красный |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 334
Задание №79
Установите соответствие между солью и изменением окраски метилоранжа в ее растворе
| ФОРМУЛА СОЛИ | ЦВЕТ ИНДИКАТОРА |
|
А) Na2SiO3 Б) K2SO4 В) Rb2SO3 |
1) фиолетовый 2) красный 3) оранжевый 4) желтый |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 434
Задание №80
Установите соответствие между солью и изменением окраски метилоранжа в ее растворе
| НАЗВАНИЕ СОЛИ | ЦВЕТ ИНДИКАТОРА |
|
А) нитрат свинца Б) хлорид олова (II) В) бромид стронция |
1) оранжевый 2) желтый 3) красный 4) фиолетовый |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 331
[adsp-pro-3]
Задание №81
Какие из приведенных солей будут иметь кислую среду раствора. Число верных ответов может быть любым
- 1. KCl
- 2. Fe(NO3)3
- 3. BaBr2
- 4. ZnCl2
- 5. NaI
Решение
Ответ: 24
Задание №82
Какие из приведенных солей будут иметь щелочную среду раствора. Число верных ответов может быть любым
1) карбонат калия
2) силикат натрия
3) иодид алюминия
4) хлорид кальция
5) нитрат марганца (II)
Решение
Ответ: 12
Задание №83
Какие из приведенных солей будут иметь нейтральную среду раствора. Число верных ответов может быть любым
- 1. RbHS
- 2. Ca(NO3)2
- 3. FeSO4
- 4. BeSO4
- 5. SrCl2
Решение
Ответ: 25
Задание №84
Какие из приведенных солей будут иметь кислую среду раствора. Число верных ответов может быть любым
1) силикат калия
2) поташ
3) аммиачная селитра
4) питьевая сода
5) медный купорос
Решение
Ответ: 35
Задание №85
Какие из приведенных солей будут иметь щелочную среду раствора. Число верных ответов может быть любым
- 1. Na2CO3
- 2. LiCl
- 3. KHСO3
- 4. FeI2
- 5. Al2(SO4)3
Решение
Ответ: 13
Задание №86
Какие из приведенных солей будут иметь нейтральную среду раствора. Число верных ответов может быть любым
1) хлорид калия
2) сульфат аммония
3) ацетат лития
4) карбонат калия
5) гидрокарбонат натрия
Решение
Ответ: 1
Задание №87
Какие из приведенных солей будут иметь кислую среду раствора. Число верных ответов может быть любым
- 1. HgCl2
- 2. CsI
- 3. NaF
- 4. CuSO4
- 5. Mg(NO3)2
Решение
Ответ: 145
Задание №88
Какие из приведенных солей будут иметь щелочную среду раствора. Число верных ответов может быть любым
1) фторид калия
2) сульфат меди
3) нитрат алюминия
4) гидросульфид натрия
5) гидрофосфат аммония
Решение
Ответ: 14
Задание №89
Какие из приведенных солей будут иметь нейтральную среду раствора. Число верных ответов может быть любым
- 1. Ba(CH3COO)2
- 2. NaCl
- 3. BeSO4
- 4. AlBr3
- 5. Cr(NO3)3
Решение
Ответ: 2
Задание №90
Какие из приведенных солей будут иметь кислую среду раствора. Число верных ответов может быть любым
1) бромид лития
2) карбонат цезия
3) нитрат стронция
4) нитрат цинка
5) фторид натрия
Решение
Ответ: 4
[adsp-pro-3]
Задание №91
Какие из приведенных солей будут иметь щелочную среду раствора. Число верных ответов может быть любым
- 1. NaHSO4
- 2. Fe2(SO4)3
- 3. CrCl3
- 4. Mn(NO3)2
- 5. RbNO2
Решение
Ответ: 5
Задание №92
Какие из приведенных солей будут иметь нейтральную среду раствора. Число верных ответов может быть любым
1) хлорат калия
2) нитрат аммония
3) карбонат натрия
4) фосфат натрия
5) иодид лития
Решение
Ответ: 15
Задание №93
Какие из приведенных солей будут иметь кислую среду раствора. Число верных ответов может быть любым
- 1. Ba(NO3)2
- 2. BeBr2
- 3. KClO3
- 4. CuCl2
- 5. ZnSO4
Решение
Ответ: 245
Задание №94
Какие из приведенных солей будут иметь щелочную среду раствора. Число верных ответов может быть любым
1) нитрат калия
2) бромид аммония
3) хлорид рубидия
4) сульфид цезия
5) нитрат стронция
Решение
Ответ: 4
Задание №95
Какие из приведенных солей будут иметь нейтральную среду раствора. Число верных ответов может быть любым
- 1. Na2HPO4
- 2. CaSO4
- 3. CuCl2
- 4. Cs2SO4
- 5. KI
Решение
Ответ: 245
Задание №96
Какие из приведенных солей будут иметь кислую среду раствора. Число верных ответов может быть любым
1) ацетат калия
2) фосфат натрия
3) сульфат железа (III)
4) сульфат железа (II)
5) нитрат хрома (III)
Решение
Ответ: 345
Задание №97
Какие из приведенных солей будут иметь щелочную среду раствора. Число верных ответов может быть любым
- 1. KMnO4
- 2. K2SO4
- 3. LiClO
- 4. KClO3
- 5. BeCl2
Решение
Ответ: 3
Задание №98
Какие из приведенных солей будут иметь нейтральную среду раствора. Число верных ответов может быть любым
1) гидрофосфат калия
2) нитрат меди
3) нитрат цинка
4) сульфат натрия
5) сульфат алюминия
Решение
Ответ: 4
Задание №99
Какие из приведенных солей будут иметь кислую среду раствора. Число верных ответов может быть любым
- 1. LiI
- 2. KClO
- 3. NaClO2
- 4. RbClO3
- 5. Zn(NO3)2
Решение
Ответ: 5
Задание №100
Какие из приведенных солей будут иметь щелочную среду раствора. Число верных ответов может быть любым
1) карбонат калия
2) силикат натрия
3) иодид алюминия
4) хлорид кальция
5) нитрат марганца (II)
Решение
Ответ: 12
[adsp-pro-10]
14770. Установите соответствие между названием соли и отношением этой соли к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЛИ
А) хлорид аммония
Б) сульфат калия
В) сульфид алюминия
Г) карбонат натрия
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизуется по катиону
2) гидролизуется по аниону
3) гидролизуется по катиону и аниону
4) гидролизу не подвергается

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке
При обращении указывайте id этого вопроса — 14770.
14769. Установите соответствие между формулой соли и реакцией среды водного раствора этой соли: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ
А) Al2(SO4)3
Б) Cs2SO4
В) K2SO3
Г) Na2S
РЕАКЦИЯ СРЕДЫ
1) кислая
2) нейтральная
3) щелочная

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке
При обращении указывайте id этого вопроса — 14769.
14768. Установите соответствие между названием соли и отношением этой соли к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЛИ
А) сульфид калия
Б) сульфид алюминия
В) бромид. цезия
Г) сульфид натрия
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизу не подвергается
2) гидролизуется по катиону
3) гидролизуется по аниону
4) гидролизуется по катиону и аниону

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке
При обращении указывайте id этого вопроса — 14768.
14767. Установите соответствие между формулой соли и реакцией среды водного раствора этой соли: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ
А) CH3COONa
Б) NaBr
В) ZnSO4
Г) NH4NO3
РЕАКЦИЯ СРЕДЫ
1) щелочная
2) кислая
3) нейтральная

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке
При обращении указывайте id этого вопроса — 14767.
14766. Установите соответствие между названием соли и отношением этой соли к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЛИ
А) нитрат меди
Б) нитрат натрия
В) сульфид калия
Г) хлорид цинка
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизуется по катиону
2) гидролизуется по аниону
3) гидролизуется по катиону и аниону
4) гидролизу не подвергается

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке
При обращении указывайте id этого вопроса — 14766.
Для вас приятно генерировать тесты, создавайте их почаще
Тренировочные упражнения по теме «Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная» в формате ЕГЭ по химии (тренажер задания 23 ЕГЭ по химии).
Теория по теме «Гидролиз» (теория для решения задания 23 ЕГЭ по химии).
| Задание 1 |
Установите соответствие между формулой соли и типом гидролиза. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
| ФОРМУЛА СОЛИ | ТИП ГИДРОЛИЗА |
| А) CH3COONH4
Б) K2SO3 В) Cr2S3 Г) Al(NO3)3 |
1) по катиону
2) по аниону 3) по катиону и аниону 4) гидролизу не подвергается |
| Задание 2 | Установите соответствие между названием соли и ее отношением к гидролизу.
К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
| НАЗВАНИЕ СОЛИ | ТИП ГИДРОЛИЗА |
| А) карбонат аммония
Б) нитрат магния В) карбонат калия Г) сульфат натрия |
1) гидролизуется по катиону
2) гидролизуется по аниону 3) не гидролизуется 4) гидролизуется по катиону и аниону |
| Задание 3 | Установите соответствие между названием соли и отношением её к гидролизу.
К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
| НАЗВАНИЕ СОЛИ | ТИП ГИДРОЛИЗА |
| A) пропионат аммония
Б) сульфид цезия B) сульфид алюминия Г) карбонат натрия |
1) гидролизуется по катиону
2) гидролизуется по аниону 3) не гидролизуется 4) гидролизуется по катиону и аниону |
| Задание 4 | Установите соответствие между формулой соли и средой ее водного раствора.
К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
| ФОРМУЛА СОЛИ | СРЕДА РАСТВОРА |
| A) Fe(NO3)2
Б) Ca(NO2)2 B) CH3COONa Г) Al2(SO4)3 |
1) кислая
2) нейтральная 3) щелочная |
| Задание 5 | Установите соответствие между формулой соли и формулой соли и средой ее водного раствора.
К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
| ФОРМУЛА СОЛИ | СРЕДА РАСТВОРА |
| А) СаВr2
Б) KCN В) MnSO4 Г) K2SiO3 |
1) кислая
2) нейтральная 3) щелочная |
| Задание 6 | Установите соответствие между названием соли и средой ее водного раствора.
К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
|
НАЗВАНИЕ СОЛИ |
СРЕДА РАСТВОРА |
| А) сульфат калия
Б) сульфид натрия В) сульфит лития Г) бромид цинка |
1) кислая
2) нейтральная 3) щелочная |
| Задание 7 | Установите соответствие между формулой соли и реакцией среды ее водного раствора.
К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
|
ФОРМУЛА СОЛИ |
КОНЦЕНТРАЦИЯ [Н+] И [ОН—] |
| А) Fel2
Б) Na2S В) CsCl Г) Be(NО3)2 |
1) [Н+] = [ОН—]
2) [Н+] > [ОН—] 3) [Н+] < [ОН—] |
| Задание 8 | Установите соответствие между формулой соли и окраской индикаторов в ее водном растворе.
К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
|
ФОРМУЛА СОЛИ |
ОКРАСКА ИНДИКАТОРА |
| А) К2S
Б) Аl2(SO4)3 В) C6H5OK Г) Na3PO4 |
1) лакмус красный
2) лакмус фиолетовый 3) лакмус синий |
| Задание 9 | Установите соответствие названием соли и окраской индикаторов в ее водном растворе.
К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
|
НАЗВАНИЕ СОЛИ |
ОКРАСКА ИНДИКАТОРА |
| А) гидросульфат калия
Б) хлорид аммония В) нитрат меди (II) Г) сульфид натрия |
1) фенолфталеин малиновый
2) фенолфталеин бесцветный |
| Задание 10 | Установите соответствие между формулой соли и окраской индикаторов в ее водном растворе.
К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
|
ФОРМУЛА СОЛИ |
ОКРАСКА ИНДИКАТОР |
| А) Na2CO3
Б) Аl2S3 В) BaI2 Г) Mg(NO3)2 |
1) метилоранж красный
2) метилоранж желтый 3) метилоранж оранжевый |
| Задание 11 | Установите соответствие между названием соли и продуктами гидролиза ее водного раствора.
К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
|
НАЗВАНИЕ СОЛИ |
ПРОДУКТЫ ГИДРОЛИЗА |
| А) хлорид алюминия
Б) карбонат калия В) сульфит калия Г) тристеарат |
1) КНСО3 и КОН
2) С17Н35СООН и С3Н5(ОН)3 3) Аl(ОН)3 и НСl 4) KHSО3 и KОH 5) АlОНСl2 и НСl |
| Задание 12 | Установите соответствие между названием вещества и продуктами его гидролиза.
К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
|
НАЗВАНИЕ ВЕЩЕСТВА |
ПРОДУКТЫ ГИДРОЛИЗА |
| А) сульфат цинка
Б) нитрит кальция В) нитрид кальция Г) крахмал |
1) Zn(OH)2 и H2SО4
2) С6Н12О6 3) (ZnОH)2SО4 и H2SО4 4) HNО2 и Са(ОН)2 5) Са(ОН)2 и NH3 6) HNО3 и Са(ОН)2 |
| Задание 13 | Установите соответствие между формулой соли и окраской индикатора в ее водном растворе.
К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
|
ФОРМУЛА СОЛИ |
ОКРАСКА ИНДИКАТОРА |
| А) хлорид лития
Б) нитрит натрия В) йодид цинка Г) гидрокарбонат калия |
1) лакмус красный
2) лакмус фиолетовый 3) лакмус синий |
| Задание 14 | Установите соответствие между формулой соли и окраской индикаторов в ее водном растворе.
К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
|
ФОРМУЛА СОЛИ |
ОКРАСКА ИНДИКАТОРА |
| А) фосфат натрия
Б) гидрокарбонат кальция В) хромат магния Г) йодид стронция |
1) метилоранж красный
2) метилоранж желтый 3) метилоранж оранжевый |
Скачать тренировочные тесты в формате ЕГЭ по теме «Гидролиз» (задание 23 ЕГЭ по химии) ( с ответами)
10 тестов по заданию 23 в ЕГЭ по химии.
Выполнение заданий типовых экзаменационных вариантов предоставляет обучающимся возможность самостоятельно подготовиться к государственной итоговой аттестации в форме ЕГЭ, а также объективно оценить уровень своей подготовки к экзамену.
►Теорию к заданию бесплатно можно найти у нас на сайте:
CHEM-MIND.com
►Таблица Менделеева и таблица растворимости как в ЕГЭ:
http://www.chem-mind.com/2017/03/20/справочный-материал-для-егэ-и-огэ/
Инструкция к тесту
Ответом к заданиям 1-26 является последовательность цифр. Цифры в ответах на задания 5, 10-12, 18, 19, 22-26 могут повторятся.
Ответом в заданиях 27-29 работы, является число. Запишите это число с указанной точностью.
Заполните ваше имя, и тогда репетитор сможет опознать ваши ответы!
Количество вопросов в тесте:
10
Химия. Задания для подготовки
к ЕГЭ. Задание 23. Обратимые и необратимые реакции.
Это задания повышенного уровня сложности,
оцениваемые в 2 балла. На их решение должно уходить не более 5-7 минут.
Пример №1
В
реактор постоянного объёма поместили некоторое количество азота и кислорода. В
результате протекания обратимой реакции
в
реакционной системе установилось химическое равновесие. При этом исходная
концентрация азота и кислорода составляет 0,7 моль/л и 0,5 моль/л
соответственно, а равновесная концентрация оксида азота(II) — 0,5 моль/л.
Определите
равновесную концентрацию и
Выберите
из списка номера правильных ответов.
1) 0 моль/л
2) 0,1 моль/л
3) 0,25 моль/л
4) 0,35 моль/л
5) 0,45 моль/л
6) 0,55 моль/л
Запишите
в ответ цифры, расположив их в порядке, соответствующем буквам:
Решение с помощью таблицы
|
Вещества |
Исходная |
Равновесная |
Концентр. |
|
Азот (N2) |
0,7 |
||
|
Кислород |
0,5 |
По уравнению реакции n(N2):n(NO)=1:2.
По условию n(NO)=0,5,
поэтому n(N2)=
0,25. По аналогии находим концентрацию прореагировавшего водорода и вносим
полученные данные в таблицу:
|
Вещества |
Исходная |
Равновесная |
Концентр. |
|
Азот (N2) |
0,7 |
0,25 |
|
|
Кислород |
0,5 |
0,25 |
Находим равновесную концентрацию как разность
между исходным количеством и количеством прореагировавшего вещества. Данные
вносим в таблицу:
|
Вещества |
Исходная |
Равновесная |
Концентр. |
|
Азот (N2) |
0,7 |
0,7-0,25=0,45 |
0,25 |
|
Кислород |
0,5 |
0,5-0,25=0,25 |
0,25 |
Находим полученные ответы в предложенных
вариантах в КИМе и располагаем цифры в правильной последовательности:
Ответ:53
Пример №2
В
реактор постоянного объёма поместили некоторое количество азота и водорода. В
результате протекания обратимой реакции
в
реакционной системе установилось химическое равновесие. При этом исходная
концентрация азота составила 1,5 моль/л, а равновесная концентрация водорода и аммиака —
0,2 моль/л и 0,9 моль/л соответственно.
Определите равновесную концентрацию и исходную концентрацию
Выберите
из списка номера правильных ответов.
1) 0,1 моль/л
2) 0,15 моль/л
3) 0,55 моль/л
4) 1,05 моль/л
5) 1,55 моль/л
6) 2,4 моль/л
Решение:
|
Вещества |
Исходная |
Равновесная |
Концентр. |
|
Азот (N2) |
1,5 |
||
|
Водород |
0,2 |
Производим
расчет количества веществ по уравнению реакции, если концентрация аммиака 0,9.
Данные вносим в таблицу и заканчиваем расчет:
|
Вещества |
Исходная |
Равновесная |
Концентр. |
|
Азот (N2) |
1,5 |
1,5-0,45=1,05 |
0,45 |
|
Водород |
0,2+1,35=1,55 |
0,2 |
1,35 |
Ответ:45
Задания
для самостоятельного решения:
1. В
реактор постоянного объёма поместили некоторое количество водорода и кислорода.
В результате протекания обратимой реакции
в реакционной
системе установилось химическое равновесие. При этом исходная концентрация
водорода составила 2,5 моль/л, а равновесная концентрация кислорода и воды —
0,3 моль/л и 0,8 моль/л соответственно.
Определите
равновесную концентрацию и исходную концентрацию
Выберите
из списка номера правильных ответов.
1) 0 моль/л
2) 0,2 моль/л
3) 0,7 моль/л
4) 1,4 моль/л
5) 1,7 моль/л
6) 3,6 моль/л
Запишите
в ответ цифры, расположив их в порядке, соответствующем буквам:
2. В
реактор постоянного объёма поместили некоторое количество оксида азота(II) и
кислорода. В результате протекания обратимой реакции
в
реакционной системе установилось химическое равновесие. При этом исходная
концентрация кислорода составила 0,8 моль/л, а равновесная концентрация оксида
азота(II) и оксида азота(IV) — 1,9 моль/л и 0,4 моль/л соответственно.
Определите
исходную концентрацию и равновесную
концентрацию
Выберите
из списка номера правильных ответов.
1) 0,4 моль/л
2) 0,6 моль/л
3) 0,9 моль/л
4) 1,4 моль/л
5) 1,9 моль/л
6) 2,3 моль/л
Запишите
в ответ цифры, расположив их в порядке, соответствующем буквам:
3. В
реактор постоянного объёма поместили некоторое количество оксида серы(IV) и
кислорода. В результате протекания обратимой реакции
в
реакционной системе установилось химическое равновесие. При этом исходная
концентрация оксида серы(IV) составила 0,5 моль/л, а равновесная концентрация
кислорода и оксида серы(VI) — 0,4 моль/л и 0,2 моль/л соответственно.
Определите
равновесную концентрацию и исходную
концентрацию
Выберите
из списка номера правильных ответов.
1) 0,1 моль/л
2) 0,2 моль/л
3) 0,3 моль/л
4) 0,4 моль/л
5) 0,5 моль/л
6) 0,6 моль/л
Запишите
в ответ цифры, расположив их в порядке, соответствующем буквам:
4. В
реактор постоянного объёма поместили некоторое количество оксида серы(VI). В
результате протекания обратимой реакции
в
реакционной системе установилось химическое равновесие. При этом равновесные концентрации
оксида серы(VI) и оксида серы(IV) составили 1 моль/л и 0,3 моль/л
соответственно.
Определите
равновесную концентрацию и исходную
концентрацию
Выберите
из списка номера правильных ответов.
1) 0,15 моль/л
2) 0,25 моль/л
3) 0,9 моль/л
4) 1,3 моль/л
5) 1,6 моль/л
6) 2,6 моль/л
Запишите
в ответ цифры, расположив их в порядке, соответствующем буквам:
5. В
реактор постоянного объёма поместили некоторое количество оксида углерода(II) и
кислорода. В результате протекания обратимой реакции
в
реакционной системе установилось химическое равновесие. При этом исходная
концентрация кислорода составила 0,6 моль/л, а равновесные концентрации
угарного газа и углекислого газа — 1,2 моль/л и 0,4 моль/л соответственно.
Определите
исходную концентрацию и равновесную
концентрацию
Выберите
из списка номера правильных ответов.
1) 0,4 моль/л
2) 0,6 моль/л
3) 0,9 моль/л
4) 1,6 моль/л
5) 1,8 моль/л
6) 2,2 моль/л
Запишите
в ответ цифры, расположив их в порядке, соответствующем буквам: