1.4.1. Классификация химических реакций в неорганической и органической химии.
Классификация химических реакций на основании их признаков.
Классификационный признак |
Тип реакции |
Число и состав реагентов и продуктов |
соединенияв результате таких реакций из двух или более исходных веществ образуется только один продукт, например: С + O2 = CO2 4NO2 + O2 + 2H2O = 4HNO3 |
разложенияв таких реакциях из одного вещества образуется два или больше других веществ: 2KMnO4 = K2MnO4 + MnO2 + O2 CaCO3 = CaO + CO2 |
|
замещенияВсе реакции, в результате которых из простого и сложного веществ образуется другое простое и другое сложное вещества. Например: Zn + CuSO4 = ZnSO4 + Cu
|
|
обменаРеакциями обмена называют такие реакции, в результате которых вещества меняются своими составными частями. Например: 2NaOH + CuCl2 = 2NaCl + Cu(OH)2 Частный случай реакции обмена между кислотой и основанием носит также название реакции нейтрализации: NaOH + HCl = NaCl + H2O
|
|
Изменение степеней окисления химических элементов |
окислительно-восстановительныев результате таких реакций изменяются степени окисления одного или более химических элемента. Например: |
Реакции, протекающие с сохранением степеней окисления атомов всех химических элементов |
|
Обратимость |
обратимыетакие реакции обладают способностью протекать как в прямом, так и обратном направлении. Реакции, про которые обязательно нужно знать, что они обратимые: |
необратимыеТакие реакции протекают только в прямом направлении. Если речь идет о реакциях между электролитами, то необратимой реакция является в том случае, если образуется осадок, газ или малодиссоциирующее вещество. Например: Na2CO3 + 2HCl = 2NaCl + H2O + CO2 В качестве малодиссоциирующих веществ в реакциях ионного обмена могут образоваться вода, слабые кислоты, гидроксид аммония. |
|
Тепловой эффект |
экзотермическиеВ результате таких реакций выделяется энергия в виде теплоты. Обозначают такие реакции, добавляя «+Q» к уравнению реакции, например: |
эндотермическиеПри протекании таких реакций поглощается тепло. Для обозначения таких реакций пишут «-Q» в уравнении реакции. Практически все реакции разложения являются эндотермическими: Исключения: реакции разложения HI и NO являются экзотермическими. |
|
Количество фаз |
гомогенныеГомогенными реакциями называют такие реакции, реагенты в которых находятся в одной фазе. Примерами таких реакций могут быть многие реакции протекающие в растворах, реакции между газообразными веществами: NaOH (р-р) + HCl(р-р) = NaCl + H2O 2CO + O2 = 2CO2 В гомогенных реакциях не наблюдаются границы раздела между реагентами |
гетерогенныегетерогенными реакциями называют такие реакции, в которых реагирующие вещества находятся в разных фазах. Примерами таких реакций являются, взаимодействие цинка с раствором соляной кислоты, взаимодействие углекислого газа с известковой водой, и т.д.: |
|
По участию катализатора |
каталитическиереакции, протекающие в присутствии катализатора:
|
некаталитическиереакции, протекающие без катализатора: |
Классификация химических реакций в органической химии:
Реакции присоединения |
В зависимости от того, какое соединение присоединяется органическим веществом различают:
Гидрирование — присоединение водорода:Гидратация — присоединение воды:Гидрогалогенирование — присоединение галогеноводорода:
|
Реакции замещения |
Под реакциями замещения в органической химии подразумевают такие реакции, в результате протекания которых происходит замена одного заместителя (или атома водорода) непосредственно прикрепленного к углеродному скелету на другой заместитель. Так, например, реакциями замещения являются: Галогенирование алканов:Нитрование углеводородов:Реакция спиртов с галогеноводородными кислотами:C2H5OH + HBr = C2H5Br + H2O и т.д. |
Реакции отщепления (элиминирования) |
Все реакции, в названии которых присутствует приставка «де-«: дегидрирование:дегидратация:дегидрогалогенирование:(от исходной молекулы бромэтана отщепляется бромоводород, который нейтрализуется щелочью) дегалогенирование:Также к реакциям отщепления (элиминирования) относят крекинг — процесс термического превращения углеводородов в соединения с меньшей длинной углеродного скелета. Например, крекинг алканов, уравнение которого в общем виде можно записать как: |
Окислительно-восстановительные реакции |
Реакции, при которых изменяется степень окисления одного или нескольких атомов углерода углеродного скелета. Окисление органического соединенияВ таких реакциях отдельные атомы углерода повышают свою степень окисления. Например: Восстановление органического соединенияЧаще всего под восстановлением органических веществ понимают их взаимодействие с водородом. Например: CH3-CH=O + H2 => CH3-CH2-OH |
Реакции с сохранением качественного и количественного состава веществ |
Изомеризация |
Реакции протекающие по тем или иным механизмам |
Реакции протекающие по ионному механизмуВ таких реакциях активными действующими частицами являются ионы. Следует помнить, что по ионному механизму протекают такие реакции как:
|
Реакции протекающие по радикальному механизмуВ таких реакциях активными действующими частицами являются свободные радикалы:
|
Темы кодификатора ЕГЭ: Классификация химических реакций в органической и неорганической химии.
Химические реакции — это такой вид взаимодействия частиц, когда из одних химических веществ получаются другие, отличающиеся от них по свойствам и строению. Вещества, которые вступают в реакцию — реагенты. Вещества, которые образуются в ходе химической реакции — продукты.
В ходе химической реакции разрушаются химические связи, и образуются новые.
В ходе химических реакций не меняются атомы, участвующие в реакции. Меняется только порядок соединения атомов в молекулах. Таким образов, число атомов одного и того же вещества в ходе химической реакции не меняется.
Химические реакции классифицируют по разным признакам. Рассмотрим основные виды классификации химических реакций.
Классификация по числу и составу реагирующих веществ
По составу и числу реагирующих веществ разделяют реакции, протекающие без изменения состава веществ, и реакции, протекающие с изменением состава веществ:
1. Реакции, протекающие без изменения состава веществ (A → B)
К таким реакциям в неорганической химии можно отнести аллотропные переходы простых веществ из одной модификации в другую:
Sромбическая → Sмоноклинная.
В органической химии к таким реакциям относятся реакции изомериза-ции, когда из одного изомера под действием катализатора и внешних факторов получается другой (как правило, структурный изомер).
Например, изомеризация бутана в 2-метилпропан (изобутан):
CH3-CH2-CH2-CH3 → CH3-CH(CH3)-CH3.
2. Реакции, протекающие с изменением состава
- Реакции соединения (A + B + … → D) — это такие реакции, в которых из двух и более веществ образуется одно новое сложное вещество. В неорганической химии к реакция соединения относятся реакции горения простых веществ, взаимодействие основных оксидов с кислотными и др. В органической химии такие реакции называются реакциями присоединения. Реакции присоединения — это такие реакции, в ходе которых к рассматриваемой органической молекуле присоединяется другая молекула. К реакциям присоединения относятся реакции гидрирования (взаимодействие с водородом), гидратации (присоединение воды), гидрогалогенирования (присоединение галогеноводорода), полимеризация (присоединение молекул друг к другу с образованием длинной цепочки) и др.
Например, гидратация :
CH2=CH2 + H2O → CH3-CH2-OH
- Реакции разложения (A → B + C + …) — это такие реакции, в ходе которых из одной сложной молекулы образуется несколько менее сложных или простых веществ. При этом могут образовываться как простые, так и сложные вещества.
Например, при разложении пероксида водорода:
2H2O2 → 2H2O + O2.
В органической химии разделяют собственно реакции разложения и реакции отщепления. Реакции отщепления (элиминирования) — это такие реакции, в ходе которых происходит отрыв атомов или атомных групп от исходной молекулы при сохранении ее углеродного скелета.
Например, реакция отщепления водорода (дегидрирование) от пропана:
C3H8 → C3H6 + H2
Как правило, в названии таких реакций есть приставка «де». Реакции разложения в органической химии происходят, как правило, с разрывом углеродной цепи.
Например, реакция крекинга бутана (расщепление на более простые молекулы при нагревании или под действием катализатора):
C4H10 → C2H4 + C2H6
- Реакции замещения — это такие реакции, в ходе которых атомы или группы атомов одного вещества замещаются на атомы или группы атомов другого вещества. В неорганической химии эти реакции происходят по схеме:
AB + C = AC + B.
Например, более активные галогены вытесняют менее активные из соединений. Взаимодействие йодида калия с хлором:
2KI + Cl2 → 2KCl + I2.
Замещаться могут как отдельные атомы, так и молекулы.
Например, при сплавлении менее летучие оксиды вытесняют более летучие из солей. Так, нелетучий оксид кремния вытесняет оксид углерода из карбоната натрия при сплавлении:
Na2CO3 + SiO2 → Na2SiO3 + CO2
В органической химии реакции замещения — это такие реакции, в ходе которых часть органической молекулы замещается на другие частицы. При этом замещенная частица, как правило, соединяется с частью молекулы-заместителя.
Например, реакция хлорирования метана:
CH4 + Cl2 → CH3Cl + HCl
По числу частиц и составу продуктов взаимодействия эта реакция больше похожа на реакцию обмена. Тем не менее, по механизму такая реакция является реакцией замещения.
- Реакции обмена — это такие реакции, в ходе которых два сложных вещества обмениваются своими составными частями:
AB + CD = AC + BD
К реакциям обмена относятся реакции ионного обмена, протекающие в растворах; реакции, иллюстрирующие кислотно-основные свойства веществ и другие.
Пример реакции обмена в неорганической химии — нейтрализация соляной кислоты щелочью:
NaOH + HCl = NaCl + H2O
Пример реакции обмена в органической химии — взаимодействие уксусной кислоты с щелочью:
CH3-CООH + KOH = CH3-CООК + H2O
Классификация химических реакций по изменению степени окисления элементов, образующих вещества
По изменению степени окисления элементов химические реакции делят на окислительно-восстановительные реакции, и реакции, идущие без изменения степеней окисления химических элементов.
- Окислительно-восстановительные реакции (ОВР) — это реакции, в ходе которых степени окисления веществ изменяются. При этом происходит обмен электронами.
В неорганической химии к таким реакциям относятся, как правило, реакции разложения, замещения, соединения, и все реакции, идущие с участием простых веществ. Для уравнивания ОВР используют метод электронного баланса (количество отданных электронов должно быть равно количеству полученных) или метод электронно-ионного баланса.
В органической химии разделяют реакции окисления и восстановления, в зависимости от того, что происходит с органической молекулой.
Реакции окисления в органической химии — это реакции, в ходе которых уменьшается число атомов водорода или увеличивается число атомов кислорода в исходной органической молекуле.
Например, окисление этанола под действием оксида меди:
CH3-CH2-OH + CuO → CH3-CH=O + H2O + Cu
Реакции восстановления в органической химии — это реакции, в ходе которых увеличивается число атомов водорода или уменьшается число атомов кислорода в органической молекуле.
Например, восстановление уксусного альдегида водородом:
CH3-CH=O + H2 → CH3-CH2-OH
- Протолитические реакции и реакции обмена — это такие реакции, в ходе которые степени окисления атомов не изменяются.
Например, нейтрализация едкого натра азотной кислотой:
NaOH + HNO3 = H2O + NaNO3
Классификация реакций по тепловому эффекту
По тепловому эффекту реакции разделяют на экзотермические и эндотермические.
Экзотермические реакции — это реакции, сопровождающиеся выделением энергии в форме теплоты (+Q). К таким реакциям относятся почти все реакции соединения.
Исключения — реакция азота с кислородом с образованием оксида азота (II) — эндотермическая:
N2 + O2 = 2NO – Q
Реакция газообразного водорода с твердым йодом также эндотермическая:
H2 + I2 = 2HI – Q
Экзотермические реакции, в ходе которых выделяется свет, называют реакциями горения.
Например, горение метана:
CH4 + O2 = CO2 + H2O
Также экзотермическими являются:
- реакции щелочных металлов с водой;
- реакции, сопровождающиеся взрывом;
- разложение дихромата аммония («вулканчик»);
- образование аммиака: N2 + 3H2 = 2NH3;
- реакции нейтрализации;
- синтез метанола;
- алюмотермия;
- реакции, в которых из менее стабильных веществ образуются более стабильные;
- в органической химии — реакции присоединения, реакции горения, окисления и др.
Эндотермические реакции — это реакции, сопровождающиеся поглощением энергии в форме теплоты (— Q). Как правило, с поглощением теплоты идет большинство реакций разложения (реакции, требующие длительного нагревания).
Например, разложение известняка:
CaCO3 → CaO + CO2 – Q
Также эндотермическими являются:
- реакции гидролиза;
- реакции, идущие только при нагревании;
- реакции, протекающие только при очень высоких температурах или под действием электрического разряда.
Например, превращение кислорода в озон:
3O2 = 2O3 — Q
В органической химии с поглощением теплоты идут реакции разложения. Например, крекинг пентана:
C5H12 → C3H6 + C2H6 – Q
Классификация химических реакций по агрегатному состоянию реагирующих веществ (по фазовому составу)
Вещества могут существовать в трех основных агрегатных состояниях — твердом, жидком и газообразном. По фазовому состоянию разделяют реакции гомогенные и гетерогенные.
- Гомогенные реакции — это такие реакции, в которых реагирующие вещества и продукты находятся в одной фазе, и столкновение реагирующих частиц происходит во всем объеме реакционной смеси. К гомогенным реакциям относят взаимодействия жидкость-жидкость и газ-газ.
Например, окисление сернистого газа:
2SO2(г) + O2(г) = 2SO3(г)
- Гетерогенные реакции — это реакции, в которых реагирующие вещества и продукты находятся в разных фазах. При этом столкновение реагирующих частиц происходит только на границе соприкосновения фаз. К таким реакциям относятся взаимодействия газ-жидкость, газ-твердая фаза, твердая-твердая, и твердая фаза — жидкость.
Например, взаимодействие углекислого газа и гидроксида кальция:
CO2(г) + Ca(OH)2(р-р) = CaCO3(тв) + H2O
Для классификации реакций по фазовому состоянию полезно уметь определять фазовые состояния веществ. Это достаточно легко сделать, используя знания о строении вещества, в частности, о типах кристаллической решетки.
Вещества с ионной, атомной или металлической кристаллической решеткой, как правило твердые при обычных условиях; вещества с молекулярной решеткой, как правило, жидкости или газы при обычных условиях.
Обратите внимание, что при нагревании или охлаждении вещества могут переходить из одного фазового состояния в другое. В таком случае необходимо ориентироваться на условия проведения конкретной реакции и физические свойства вещества.
Например, получение синтез-газа происходит при очень высоких температурах, при которых вода — пар:
CH4(г) + H2O(г) = CO(г) + 3H2(г)
Таким образом, паровая конверсия метана — гомогенная реакция.
Классификация химических реакций по участию катализатора
Катализатор — это такое вещество, которое ускоряет реакцию, но не входит в состав продуктов реакции. Катализатор участвует в реакции, но практически не расходуется в ходе реакции. Условно схему действия катализатора К при взаимодействии веществ A + B можно изобразить так:
A + K = AK;
AK + B = AB + K.
В зависимости от наличия катализатора различают каталитические и некаталитические реакции.
- Каталитические реакции — это реакции, которые идут с участием катализаторов.
Например, разложение бертолетовой соли: 2KClO3 → 2KCl + 3O2. - Некаталитические реакции — это реакции, которые идут без участия катализатора.
Например, горение этана: 2C2H6 + 5O2 = 2CO2 + 6H2O.
Все реакции, протекающие с участием в клетках живых организмов, протекают с участием особых белковых катализаторов — ферментов. Такие реакции называют ферментативными.
Более подробно механизм действия и функции катализаторов рассматриваются в отдельной статье.
Классификация реакций по способности протекать в обратном направлении
Обратимые реакции — это реакции, которые могут протекать и в прямом, и в и обратном направлении, т.е. когда при данных условиях продукты реакции могут взаимодействовать друг с другом.
К обратимым реакциям относятся:
- большинство гомогенных реакций,
- этерификация;
- реакции гидролиза;
- гидрирование-дегидрирование,
- гидратация-дегидратация;
- получение аммиака из простых веществ,
- окисление сернистого газа,
- получение галогеноводородов (кроме фтороводорода) и сероводорода;
- синтез метанола;
- получение и разложение карбонатов и гидрокарбонатов, и т.д.
Необратимые реакции — это реакции, которые протекают преимущественно в одном направлении, т.е. продукты реакции не могут взаимодействовать друг с другом при данных условиях.
Примеры необратимых реакций:
- горение;
- реакции, идущие со взрывом;
- реакции, идущие с образованием газа, осадка или воды в растворах;
- растворение щелочных металлов в воде; и др.
117
Создан на
11 января, 2022 От Admin
Классификация химических реакций
Тренажер задания 17 ЕГЭ по химии
1 / 10
Из предложенного перечня выберите все пары веществ, взаимодействие которых является реакцией соединения.
1) натрий и вода
2) оксид натрия и вода
3) хлорид железа(II) и хлор
4) иодид калия и хлор
5) водород и хлор
2 / 10
Из предложенного перечня выберите два типа реакций, к которым можно отнести взаимодействие гидроксида меди(II) с соляной кислотой.
1) замещения
2) каталитическая
3) окислительно-восстановительная
4) нейтрализация
5) гетерогенная
3 / 10
Из предложенного перечня выберите два вещества, взаимодействие которых с соляной кислотой является окислительно-восстановительной реакцией.
1) алюминий
2) оксид меди(II)
3) нитрат серебра
4) гидроксид натрия
5) перманганат калия
4 / 10
Из предложенного перечня выберите два типа реакций, к которым не относится взаимодействие натрия с водой.
1) гетерогенная
2) обратимая
3) экзотермическая
4) замещения
5) каталитическая
5 / 10
Из предложенного перечня выберите два вещества, разложение которых является окислительно-восстановительной реакцией.
1) нитрат железа(III)
2) гидрокарбонат натрия
3) кремниевая кислота
4) карбонат кальция
5) перманганат калия
6 / 10
Из предложенного перечня выберите два типа реакций, к которым можно отнести взаимодействие хлороводорода с глицином.
1) соединения
2) экзотермическая
3) каталитическая
4) обмена
5) окислительно-восстановительная
7 / 10
Из предложенного перечня выберите все вещества, взаимодействие которых с раствором гидроксида бария является реакцией нейтрализации.
1) оксид серы(IV)
2) бромоводород
3) сульфат магния
4) азотная кислота
5) сульфат натрия
8 / 10
Из предложенного перечня выберите два типа реакций, к которым можно отнести взаимодействие оксида хрома(III) с алюминием.
1) соединения
2) окислительно-восстановительная
3) каталитическая
4) замещения
5) обмена
9 / 10
Из перечисленных типов реакций выберите два типа, которым соответствует взаимодействие цинка с раствором сульфата меди(II).
1) обмена
2) окислительно-восстановительным
3) каталитическим
4) замещения
5) обратимым
10 / 10
Из предложенного перечня выберите все типы реакций, к которым можно отнести взаимодействие водорода с хлором.
1) реакция нейтрализации
2) экзотермическая реакция
3) реакция замещения
4) окислительно-восстановительная реакция
5) гомогенная реакция
Ваша оценка
The average score is 44%
Химические реакции, или химические явления, — это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и (или) строению.
При химических реакциях обязательно происходит изменение веществ, при котором рвутся старые и образуются новые связи между атомами.
Химические реакции следует отличать от ядерных реакций. В результате химической реакции общее число атомов каждого химического элемента и его изотопный состав не меняются. Иное дело ядерные реакции — процессы превращения атомных ядер в результате их взаимодействия с другими ядрами или элементарными частицами, например, превращение алюминия в магний:
$↙{13}↖{27}{Al}+ {}↙{1}↖{1}{H}={}↙{12}↖{24}{Mg}+{}↙{2}↖{4}{He}$
Классификация химических реакций многопланова, т.е. в ее основу могут быть положены различные признаки. Но под любой из таких признаков могут быть отнесены реакции как между неорганическими, так и между органическими веществами.
Рассмотрим классификацию химических реакций по различным признакам.
Классификация химических реакций по числу и составу реагирующих веществ. Реакции, идущие без изменения состава вещества
В неорганической химии к таким реакциям можно отнести процессы получения аллотропных модификаций одного химического элемента, например:
$С_{(графит)}⇄С_{(алмаз)}$
$S_{(ромбическая)}⇄S_{(моноклинная)}$
$Р_{(белый)}⇄Р_{(красный)}$
$Sn_{(белое олово)}⇄Sn_{(серое олово)}$
$3О_{2(кислород)}⇄2О_{3(озон)}$.
В органической химии к этому типу реакций могут быть отнесены реакции изомеризации, которые идут без изменения не только качественного, но и количественного состава молекул веществ, например:
1. Изомеризация алканов.
Реакция изомеризации алканов имеет большое практическое значение, т.к. углеводороды изостроения обладают меньшей способностью к детонации.
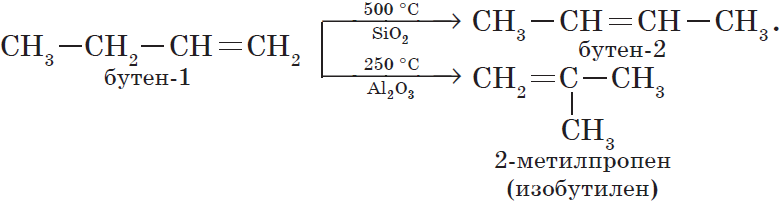
2. Изомеризация алкенов.
3. Изомеризация алкинов (реакция А. Е. Фаворского).
4. Изомеризация галогеналканов (А. Е. Фаворский).
5. Изомеризация цианата аммония при нагревании.
Впервые мочевина была синтезирована Ф. Велером в 1882 г. изомеризацией цианата аммония при нагревании.
Реакции, идущие с изменением состава вещества
Можно выделить четыре типа таких реакций: соединения, разложения, замещения и обмена.
1. Реакции соединения — это такие реакции, при которых из двух и более веществ образуется одно сложное вещество.
В неорганической химии все многообразие реакций соединения можно рассмотреть на примере реакций получения серной кислоты из серы:
1) получение оксида серы (IV):
$S+O_2=SO_2$ — из двух простых веществ образуется одно сложное;
2) получение оксида серы (VI):
$2SO_2+O_2{⇄}↖{t,p,кат.}2SO_3$ — из простого и сложного веществ образуется одно сложное;
3) получение серной кислоты:
$SO_3+H_2O=H_2SO_4$ — из двух сложных веществ образуется одно сложное.
Примером реакции соединения, при которой одно сложное вещество образуется из более чем двух исходных, может служить заключительная стадия получения азотной кислоты:
$4NO_2+O_2+2H_2O=4HNO_3$.
В органической химии реакции соединения принято называть реакциями присоединения. Все многообразие таких реакций можно рассмотреть на примере блока реакций, характеризующих свойства непредельных веществ, например этилена:
1) реакция гидрирования — присоединение водорода:
$CH_2{=}↙{этен}CH_2+H_2{→}↖{Ni,t°}CH_3{-}↙{этан}CH_3;$
2) реакция гидратации — присоединение воды:
$CH_2{=}↙{этен}CH_2+H_2O{→}↖{H_3PO_4,t°}{C_2H_5OH}↙{этанол};$
3) реакция полимеризации:
${nCH_2=CH_2}↙{этилен}{→}↖{p,кат.,t°}{(-CH_2-CH_2-)_n}↙{полиэтилен}$
2. Реакции разложения — это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ.
В неорганической химии все многообразие таких реакций можно рассмотреть на примере блока реакций получения кислорода лабораторными способами:
1) разложение оксида ртути (II):
$2HgO{→}↖{t°}2Hg+O_2↑$ — из одного сложного вещества образуются два простых;
2) разложение нитрата калия:
$2KNO_3{→}↖{t°}2KNO_2+O_2↑$ — из одного сложного вещества образуются одно простое и одно сложное;
3) разложение перманганата калия:
$2KMnO_4{→}↖{t°}K_2MnO_4+MnO_2+O_2↑$ — из одного сложного вещества образуются два сложных и одно простое, т.е. три новых вещества.
В органической химии реакции разложения можно рассмотреть на примере блока реакций получения этилена в лаборатории и промышленности:
1) реакция дегидратации (отщепления воды) этанола:
$C_2H_5OH{→}↖{H_2SO_4,t°}CH_2=CH_2+H_2O;$
2) реакция дегидрирования (отщепления водорода) этана:
$CH_3—CH_3{→}↖{Cr_2O_3,500°C}CH_2=CH_2+H_2↑;$
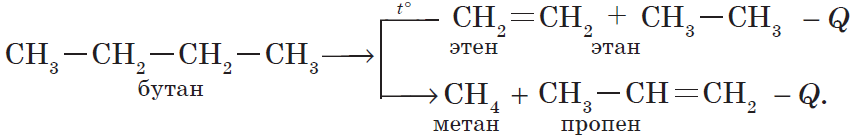
3) реакция крекинга (расщепления) пропана:
$CH_3-CH_2CH_3{→}↖{t°}CH_2=CH_2+CH_4↑.$
3. Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы какого-либо элемента в сложном веществе.
В неорганической химии примером таких процессов может служить блок реакций, характеризующих свойства, например, металлов:
1) взаимодействие щелочных и щелочноземельных металлов с водой:
$2Na+2H_2O=2NaOH+H_2↑$
2) взаимодействие металлов с кислотами в растворе:
$Zn+2HCl=ZnCl_2+H_2↑$;
3) взаимодействие металлов с солями в растворе:
$Fe+CuSO_4=FeSO_4+Cu;$
4) металлотермия:
$2Al+Cr_2O_3{→}↖{t°}Al_2O_3+2Cr$.
Предметом изучения органической химии являются не простые вещества, а только соединения. Поэтому как пример реакции замещения приведем наиболее характерное свойство предельных соединений, в частности метана, — способность его атомов водорода замещаться на атомы галогена:
$CH_4+Cl_2{→}↖{hν}{CH_3Cl}↙{хлорметан}+HCl$,
$CH_3Cl+Cl_2→{CH_2Cl_2}↙{дихлорметан}+HCl$,
$CH_2Cl_2+Cl_2→{CHCl_3}↙{трихлорметан}+HCl$,
$CHCl_3+Cl_2→{CCl_4}↙{тетрахлорметан}+HCl$.
Другой пример — бромирование ароматического соединения (бензола, толуола, анилина):
$C_6H_6Br_2{→}↖{FeBr_3}{C_6H_5Br}↙{бромбензол}+HBr$.
Обратим внимание на особенность реакций замещения у органических веществ: в результате таких реакций образуются не простое и сложное вещества, как в неорганической химии, а два сложных вещества.
В органической химии к реакциям замещения относят и некоторые реакции между двумя сложными веществами, например, нитрование бензола:
$C_6H_6+{HNO_3}↙{бензол}{→}↖{H_2SO_4(конц.),t°}{C_6H_5NO_2}↙{нитробензол}+H_2O$
Она формально является реакцией обмена. То, что это реакция замещения, становится понятным только при рассмотрении ее механизма.
4. Реакции обмена — это такие реакции, при которых два сложных вещества обмениваются своими составными частями.
Эти реакции характеризуют свойства электролитов и в растворах протекают по правилу Бертолле, т.е. только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (например, $Н_2О$).
В неорганической химии это может быть блок реакций, характеризующих, например, свойства щелочей:
1) реакция нейтрализации, идущая с образованием соли и воды:
$NaOH+HNO_3=NaNO_3+H_2O$
или в ионном виде:
$OH^{–}+H^{+}=H_2O$;
2) реакция между щелочью и солью, идущая с образованием газа:
$2NH_4Cl+Ca(OH)_2=CaCl_2+2NH_3↑+2H_2O$
или в ионном виде:
$NH_4^{+}+OH^{–}=NH_3↑+H_2O$;
3) реакция между щелочью и солью, идущая с образованием осадка:
$CuSO_4+2KOH=Cu(OH)_2↓+K_2SO_4$
или в ионном виде:
$Cu^{2+}+2OH^{-}=Cu(OH)_2↓$
В органической химии можно рассмотреть блок реакций, характеризующих, например, свойства уксусной кислоты:
1) реакция, идущая с образованием слабого электролита — $H_2O$:
$CH_3COOH+NaOH⇄NaCH_3COO+H_2O$
или
$CH_3COOH+OH^{-}⇄CH_3COO^{-}+H_2O$;
2) реакция, идущая с образованием газа:
$2CH_3COOH+CaCO_3=2CH_3COO^{–}+Ca^{2+}+CO_2↑+H_2O$;
3) реакция, идущая с образованием осадка:
$2CH_3COOH+K_2SiO_3=2KCH_3COO+H_2SiO_3↓$
или
$2CH_3COOH+SiO_3^{−}=2CH_3COO^{−}+H_2SiO_3↓$.
Классификация химических реакций по изменению степеней окисления химических элементов, образующих вещества
Реакции, идущие с изменением степеней окисления элементов, или окислительно-восстановительные реакции.
К ним относится множество реакций, в том числе все реакции замещения, а также те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество, например:
1.${Mg}↖{0}+{2H}↖{+1}+SO_4^{-2}={Mg}↖{+2}SO_4+{H_2}↖{0}↑$
${{Mg}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Mg}↖{+2}$
${{2H}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{H_2}↖{0}$
2.${2Mg}↖{0}+{O_2}↖{0}={2Mg}↖{+2}{O}↖{-2}$
${{Mg}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Mg}↖{+2}|4|2$
${{O_2}↖{0}+4{e}↖{-}}↙{окислитель}{→}↖{восстановление}{2O}↖{-2}|2|1$
Как вы помните, сложные окислительно-восстановительные реакции составляются с помощью метода электронного баланса:
${2Fe}↖{0}+6H_2{S}↖{+6}O_{4(k)}={Fe_2}↖{+3}(SO_4)_3+3{S}↖{+4}O_2+6H_2O$
${{Fe}↖{0}-3{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Fe}↖{+3}|2$
${{S}↖{+6}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{S}↖{+4}|3$
В органической химии ярким примером окислительно-восстановительных реакций могут служить свойства альдегидов:
1. Альдегиды восстанавливаются в соответствующие спирты:
${CH_3-{C}↖{+1} {}↖{O↖{-2}}↙{H↖{+1}}+{H_2}↖{0}}↙{text»уксусный альдегид»}{→}↖{Ni,t°}{CH_3-{C}↖{-1}{H_2}↖{+1}{O}↖{-2}{H}↖{+1}}↙{text»этиловый спирт»}$
${{C}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{C}↖{-1}|1$
${{H_2}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}2{H}↖{+1}|1$
2. Альдегиды окисляются в соответствующие кислоты:
${CH_3-{C}↖{+1} {}↖{O↖{-2}}↙{H↖{+1}}+{Ag_2}↖{+1}{O}↖{-2}}↙{text»уксусный альдегид»}{→}↖{t°}{CH_3-{Ag}↖{0}{C}↖{+3}{O}↖{-2}{OH}↖{-2+1}+2{Ag}↖{0}↓}↙{text»этиловый спирт»}$
${{C}↖{+1}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{C}↖{+3}|1$
${2{Ag}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}2{Ag}↖{0}|1$
Реакции, идущие без изменения степеней окисления химических элементов.
К ним, например, относятся все реакции ионного обмена, а также:
- многие реакции соединения:
$Li_2O+H_2O=2LiOH;$
- многие реакции разложения:
$2Fe(OH)_3{→}↖{t°}Fe_2O_3+3H_2O;$
- реакции этерификации:
$HCOOH+CH_3OH⇄HCOOCH_3+H_2O$.
Классификация химических реакций по тепловому эффекту
По тепловому эффекту реакции делят на экзотермические и эндотермические.
Экзотермические реакции.
Эти реакции протекают с выделением энергии.
К ним относятся почти все реакции соединения. Редкое исключение составляют эндотермические реакции синтеза оксида азота (II) из азота и кислорода и реакция газообразного водорода с твердым иодом:
$N_2+O_2=2NO – Q$,
$H_{2(г)}+I{2(т)}=2HI – Q$.
Экзотермические реакции, которые протекают с выделением света, относят к реакциям горения, например:
$4P+5O_2=2P_2O_5+Q,$
$CH_4+2O_2=CO_2+2H_2O+Q$.
Гидрирование этилена — пример экзотермической реакции:
$CH_2=CH_2+H_2{→}↖{Pt}CH_3-CH_3+Q$
Она идет при комнатной температуре.
Эндотермические реакции
Эти реакции протекают с поглощением энергии.
Очевидно, что к ним относятся почти все реакции разложения, например:
а) обжиг известняка:
$CaCO_3{→}↖{t°}CaO+CO_2↑-Q;$
б) крекинг бутана:
Количество выделенной или поглощенной в результате реакции энергии называют тепловым эффектом реакции, а уравнение химической реакции с указанием этого эффекта называют термохимическим уравнением, например:
$H_{2(г)}+Cl_{2(г)}=2HCl_{(г)}+92.3 кДж,$
$N_{2(г)}+О_{2(г)}=2NO_{(г)} – 90.4 кДж$.
Классификация химических реакций по агрегатному состоянию реагирующих веществ (фазовому составу)
Гетерогенные реакции.
Это реакции, в которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях (в разных фазах):
$2Al_{(т)}+3CuCl_{2(р-р)}=3Cu_{(т)}+2AlCl_{3(р-р)}$,
$СаС_{2(т)}+2Н_2О_{(ж)}=С_2Н_2↑+Са(ОН)_{2(р-р)}$.
Гомогенные реакции.
Это реакции, в которых реагирующие вещества и продукты реакции находятся в одном агрегатном состоянии (в одной фазе):
Классификация химических реакций по участию катализатора
Некаталитические реакции.
Некаталитические реакции идут без участия катализатора:
$2HgO{→}↖{t°}2Hg+O_2↑$,
$C_2H_4+3O_2{→}↖{t°}2CO_2+2H_2O$.
Каталитические реакции.
Каталитические реакции идут с участием катализатора:
$2KClO_3{→}↖{MnO_2,t°}2KCl+3O_2↑,$
${C_2H_5OH}↙{этанол}{→}↖{H_2SO-4,t°}{CH_2=CH_2}↙{этен}↑+H_2O$
Так как все биологические реакции, протекающие в клетках живых организмов, идут с участием особых биологических катализаторов белковой природы — ферментов, все они относятся к каталитическим или, точнее, ферментативным.
Следует отметить, что более $70%$ химических производств используют катализаторы.
Классификация химических реакций по направлению
Необратимые реакции.
Необратимые реакции протекают в данных условиях только в од ном направлении.
К ним можно отнести все реакции обмена, сопровождающиеся образованием осадка, газа или малодиссоциирующего вещества (воды), и все реакции горения.
Обратимые реакции.
Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях.
Таких реакций подавляющее большинство.
В органической химии признак обратимости отражают названия-антонимы процессов:
- гедрирование — дегидрирование;
- гидратация — дегидратация;
- полимеризация — деполимеризация.
Обратимы все реакции этерификации (противоположный процесс, как вы знаете, носит название гидролиза) и гидролиза белков, сложных эфиров, углеводов, полинуклеотидов. Обратимость лежит в основе важнейшего процесса в живом организме — обмена веществ.
Всего: 49 1–20 | 21–40 | 41–49
Добавить в вариант
Хлорирование метана
1) приводит к образованию различных хлоропроизводных метана
2) начинается с процесса образования ионов хлора
3) относится к радикальным реакциям
4) является реакцией присоединения
5) является типичным каталитическим процессом
6) относится к экзотермическим процессам
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 5
Из предложенного перечня выберите все типы реакций, к которым можно отнести взаимодействие водорода с хлором.
1) гомогенная реакция
2) реакция замещения
3) экзотермическая реакция
4) реакция нейтрализации
5) окислительно-восстановительная реакция
Запишите номера выбранных ответов в порядке возрастания.
Источник: ЕГЭ по химии 2022. Досрочная волна
Из предложенного перечня выберите все реакции, которые соответствуют взаимодействию между углеродом и кислородом.
1) замещения
2) соединения
3) обмена
4) экзотермическая
5) эндотермическая
Запишите в поле ответа номера выбранных реакций.
Источник: РЕШУ ЕГЭ
Взаимодействие оксида фосфора(V) с водой относится к реакциям
1) соединения, эндотермическим
2) соединения, экзотермическим
3) обмена, экзотермическим
4) замещения, экзотермическим
Верны ли следующие суждения о реакции окисления оксида серы(IV)?
А. Реакция окисления оксида серы(IV) является обратимой, каталитической.
Б. Окисление и
относится к эндотермическим процессам.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Взаимодействие раствора гидроксида натрия с азотной кислотой относится к реакциям:
1) каталитическим
2) гомогенным
3) экзотермическим
4) окислительно-восстановительным
5) замещения
Запишите номера выбранных типов реакций.
Из предложенного перечня выберите все реакции, которые соответствуют взаимодействию между оксидом серы(IV) и кислородом.
1) соединения
2) обмена
3) замещения
4) эндотермическая
5) экзотермическая
Запишите в поле ответа номера выбранных реакций.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите все реакции, которые соответствуют взаимодействию между водородом и хлором.
1) разложения
2) соединения
3) обмена
4) эндотермическая
5) экзотермическая
Запишите в поле ответа номера выбранных реакций.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите все реакции, которые соответствуют взаимодействию между раствором гидроксида калия и азотной кислотой.
1) гомогенная
2) каталитическая
3) окислительно-восстановительная
4) экзотермическая
5) замещения
Запишите в поле ответа номера выбранных реакций.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите все реакции, которые соответствуют взаимодействию между пропеном и хлором.
1) каталитическая
2) экзотермическая
3) обратимая
4) замещения
5) окислительно-восстановительная
Запишите в поле ответа номера выбранных реакций.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите все реакции, которые соответствуют взаимодействию между разбавленной серной кислотой и железом.
1) каталитическая
2) замещения
3) эндотермическая
4) экзотермическая
5) обмена
Запишите в поле ответа номера выбранных реакций.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите все реакции, которые соответствуют взаимодействию между кислородом и оксидом серы(IV).
1) соединения
2) обмена
3) обратимая
4) эндотермическая
5) замещения
Запишите в поле ответа номера выбранных реакций.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите все реакции, к которым относится реакция, уравнение которой:
.
1) замещения
2) экзотермическая
3) эндотермическая
4) соединения
5) каталитическая
Запишите в поле ответа номера выбранных реакций.
Источник: РЕШУ ЕГЭ
Укажите все факторы, от которых зависит скорость реакции нейтрализации в водном растворе.
1) температура
2) объём раствора
3) давление над раствором
4) концентрация кислоты
5) концентрация щёлочи
Запишите номера выбранных ответов.
Источник: СтатГрад: Тренировочная работа 06.02.2023. Вариант ХИ2210301.
Задания Д6 № 539
Верны ли следующие суждения о свойствах углерода?
А. Взаимодействие углерода с кислородом относится к экзотермическим реакциям.
Б. При полном сгорании углерода образуется оксид углерода (IV).
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Марганец растворили в разбавленной азотной кислоте. Полученный раствор выпарили и прокалили, при этом выделился бурый газ и образовался тёмно-коричневый порошок. К порошку добавили концентрированную соляную кислоту, при нагревании выделился зеленоватый газ, который собрали в колбу. При добавлении в эту колбу нагретого красного фосфора происходит бурная экзотермическая реакция с образованием белого дыма. Напишите уравнения четырёх описанных реакций.
Установите соответствие между уравнением химической реакции и изменением условий, которое приводит к смещению равновесия в сторону продуктов: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РАВНОВЕСИЕСМЕЩАЕТСЯ В СТОРОНУ ПРОДУКТОВ ПРИ
1) охлаждении
2) повышении давления
3) понижении давления
Запишите в ответ цифры, расположив их в порядке, соответствующим буквам:
Установите соответствие между уравнением обратимой химической реакции и факторами, способствующими смещению равновесия в сторону продуктов: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФАКТОРЫ, СПОСОБСТВУЮЩИЕ
СМЕЩЕНИЮ РАВНОВЕСИЯ В СТОРОНУ ПРОДУКТОВ
1) нагревание, уменьшение давления
2) охлаждение, увеличение давления
3) нагревание, увеличение давления
Запишите в ответ цифры, расположив их в порядке, соответствующим буквам:
Установите соответствие между уравнением обратимой химической реакции и факторами, способствующими смещению равновесия в сторону реагентов: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФАКТОРЫ, СПОСОБСТВУЮЩИЕ СМЕЩЕНИЮ
РАВНОВЕСИЯ В СТОРОНУ РЕАГЕНТОВ
1) нагревание, уменьшение давления
2) охлаждение, уменьшение давления
3) охлаждение, увеличение давления
Запишите в ответ цифры, расположив их в порядке, соответствующим буквам:
Установите соответствие между уравнением обратимой химической реакции и направлением смещения химического равновесия при нагревании: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) положение равновесия не зависит от температуры
Запишите в ответ цифры, расположив их в порядке, соответствующим буквам:
Всего: 49 1–20 | 21–40 | 41–49
Химические реакции сопровождаются изменением запаса энергии веществ.
Тепловой эффект (Q) — количество теплоты, выделяющееся или поглощающееся в ходе реакции.
Значение теплового эффекта может быть положительным (теплота выделяется) или отрицательным (теплота поглощается). Оно указывается в термохимических уравнениях реакций:
H2(г)+F2(г)=2HF(г)+537кДж;
3O2(г)=2O3(г)−285кДж.
Обрати внимание!
1. В термохимических уравнениях тепловой эффект указан на количества веществ, соответствующие коэффициентам перед их формулами.
2. В термохимических уравнениях указываются агрегатные состояния веществ.
Тепловой эффект реакции зависит от агрегатного состояния веществ. Например, образование газообразной и жидкой воды происходит с выделением разного количества теплоты:
2H2(г)+O2(г)=2H2O(г)+484кДж;
2H2(г)+O2(г)=2H2O(ж)+572кДж.
Тепловой эффект реакции (Q) равен разности внутренней энергии исходных и образующих веществ. Если продукты реакции имеют меньший запас энергии по сравнению с реагентами, то в ходе реакции теплота будет выделяться. Такие реакции называются экзотермическими.
Рис. (1). Изменение энергии в экзотермической реакции (Ea — энергия активации, (Q) — тепловой эффект)
Экзотермическими реакциями являются:
- реакции горения;
- большинство реакций соединения (кроме взаимодействия азота с кислородом и некоторых других процессов);
- реакции нейтрализации между щелочами и сильными кислотами;
- реакции активных металлов и их оксидов с водой, а также реакции металлов с кислотами.
Примеры экзотермических реакций:
- N2(г)+3H2(г)=2NH3(г)+92кДж;
- 2SO2(г)+O2(г)=2SO3(г)+284кДж;
- CaO(тв)+H2O(ж)=Ca(OH)2(тв)+65кДж;
- CH4(г)+2O2(г)=CO2(г)+2H2O(г)+891кДж.
Для протекания термохимических реакций нагревание не требуется или оно необходимо только для начала процесса. Например, для разложения дихромата аммония вещество надо нагреть, а затем реакция идёт с выделением тепла.
Если запас внутренней энергии продуктов реакции больше энергии исходных веществ, то для протекания реакции требуется поступление энергии извне. Такие реакции называются эндотермическими.

Рис. (2). Изменение энергии в эндотермической реакции
Эндотермическими реакциями являются:
- большинство реакций разложения;
- реакция фотосинтеза.
Примеры эндотермических реакций:
- CaCO3(тв)=CaO(тв)+CO2(г)−157кДж;
- 2HgO(тв)=2Hg(тв)+O2(г)−180кДж;
- 6CO2(г)+6H2O(ж)=C6H12O6(тв)+6O2(г)−2920кДж;
- N2(г)+O2(г)=2NO(г)−175кДж.
Для осуществления эндотермических реакций энергия должна поступать постоянно. Вещества нужно нагревать, или используется другой вид энергии (световая энергия при фотосинтезе, электрическая — при электролизе).
Источники:
Рис. 1. Изменение энергии в экзотермической реакции. © ЯКласс.
Рис. 2. Изменение энергии в эндотермической реакции. © ЯКласс.
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
ХИМИЧЕСКИЕ РЕАКЦИИ — процессы превращения исходных веществ (реагентов) в конечные вещества (продукты).
Записываются химическим уравнением и схемой, содержащих формулы исходных веществ и продуктов реакции.
В химических уравнениях, в отличие от схем, число атомов каждого элемента одинаково в левой и правой частях.
Например:
Химическая схема: Р + О2 —> Р2О5
Химическое уравнение: 4Р + 5О2 = 2Р2О5
Химические уравнения могут содержать дополнительные сведения об особенностях протекания реакции: (температура, катализатор, проведение реакции в растворе или в расплаве).
4Р + 5О2 = 2Р2О5 + Q (термохимическое уравнение)
1.КЛАССИФИКАЦИЯ ПО ЧИСЛУ И СОСТАВУ ИСХОДНЫХ ВЕЩЕСТВ И ПРОДУКТОВ РЕАКЦИИ
1) РЕАКЦИИ СОЕДИНЕНИЯ
Из нескольких реагирующих веществ получается одно:
A+ B + C = D
Могут происходить без изменения валентности:
СаСО3 + СО2 + Н2О = Са (НСО3)2,
bnи относиться к числу окислительно-восстановительных: 2Fе + 3Сl2 = 2FеСl3
В органической химии РЕАКЦИИ ПРИСОЕДИНЕНИЯ:
С2Н4 + Н2 —> С2Н6 (гидрирование)
СН2=СН2 —> (-CH2-CH2-)n (полимеризация)
2) РЕАКЦИИ РАЗЛОЖЕНИЯ
Происходит образование нескольких веществ из одного сложного вещества:
А =В +С + D
Продуктами разложения могут быть как простые, так и сложные вещества.
В ОРГАНИЧЕСКОЙ ХИМИИ – это реакции:
крекинга: дегидрирования: дегидратации: дегидрогалогенирования и т.п.
С18H38 -(t)—> С9H18 + С9H20
C4H10 -(кат,t)—> C4H6 + 2H2
С2Н5ОН -(H2SO4конц,t) — >C2H4+H2O
3) РЕАКЦИИ ЗАМЕЩЕНИЯ
Обычно простое вещество заменяет часть сложного, образуя другое простое вещество и другое сложное:
А + ВС = АВ + С
Чаще принадлежат к окислительно-восстановительным:
2Аl + Fe2O3 = 2Fе + Аl2О3 ,
Zn + 2НСl = ZnСl2 + Н2
Изредка не сопровождаются изменением степени окисления.
СаСО3+ SiO2 —> СаSiO3 + СО2
В ОРГАНИЧЕСКОЙ ХИМИИ – галогенирование, гидролиз
СН4 + Сl2 –(свет) —> СН3Сl + НСl – хлорирование – Н заменяется в метане на хлор.
СН3Сl + КОН(р-р) —> CH3OH + KCl – гидролиз галогеналкана – замещение хлора на ОН-группу.
4) РЕАКЦИИ ОБМЕНА
Реакции между двумя соединениями, которые обмениваются между собой своими составными частями:
АВ + СD = АD + СВ
Всегда происходят без изменения валентного состояния атомов.
Реакции обмена между кислотами и основаниями называются реакциями нейтрализации.
ZnO + Н2SО4 = ZnSО4 + Н2О
СrСl3 + 3NаОН = Сr(ОН)3 + 3NаСl.
2. КЛАССИФИКАЦИЯ ПО НАЛИЧИЮ КАТАЛИЗАТОРА
Катализа́тор — химическое вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции.
Ингибитор — химическое вещество, замедляющее реакцию, но не входящее в состав продуктов реакции.
1.КАТАЛИТИЧЕСКИЕ реакции, для протекания которых требуется применение катализатора.
2. НЕКАТАЛИТИЧЕСКИЕ – реакции, которые протекают самопроизвольно без катализаторов.
3. КЛАССИФИКАЦИЯ ПО ЧИСЛУ ФАЗ, В КОТОРЫХ НАХОДЯТСЯ УЧАСТНИКИ РЕАКЦИИ.
1. ГОМОГЕННЫЕ (ОДНОФАЗНЫЕ) РЕАКЦИИ.
Реакции, протекающие в газовой фазе, и целый ряд реакций,протекающих в растворах.
H2(г)+ Cl2(г) = 2HCl(г)
NaОН(р-р) + НСl(p-p) = NaСl(p-p) + Н2О(ж)
2. ГЕТЕРОГЕННЫЕ (МНОГОФАЗНЫЕ) РЕАКЦИИ.
Относятся реакции, в которых реагенты и продукты реакции находятся в разных фазах.
Например:
CO2(г) + NaOH(p-p) = NaHCO3(p-p)
СO2(г) + СаО(тв) = СаСO3(тв).
4. КЛАССИФИКАЦИЯ РЕАКЦИЙ ПО ТИПУ ПЕРЕНОСИМЫХ ЧАСТИЦ
1. ПРОТОЛИТИЧЕСКИЕ РЕАКЦИИ И РЕАКЦИИ ОБМЕНА
это реакции, в которых не происходит изменения степеней окисления атомов элементов, входящих в состав реагирующих веществ.
Это реакции обмена и гидролиза:
ZnO + Н2SО4 = ZnSО4 + Н2О,
Са3Р2 + 6Н2О = 3Са(ОН)2 + 2РН3
2. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
меняются степени окисления элементов в составе реагирующих веществ.
Например:
8HNO3 + 3Cu = 3Cu(NO3)2 + 2NO + 4H2O
РЕАКЦИЯМИ ОКИСЛЕНИЯ В ОРГАНИЧЕСКОЙ ХИМИИ — в молекуле происходит увеличение числа атомов кислорода или уменьшение числа атомов водорода:
СН3ОН + СuO —> HCOH + Cu + H2O – окисление спирта (метанола) в альдегид (метаналь).
РЕАКЦИЯМИ ВОССТАНОВЛЕНИЯ В ОРГАНИЧЕСКОЙ ХИМИИ – В молекуле происходит увеличение числа атомов водорода или уменьшение числа атомов кислорода:
HCOH + H2 —> СН3ОН – восстановление альдегида в спирт (гидрирование альдегида).
5. КЛАССИФИКАЦИЯ ПО ВОЗМОЖНОСТИ ПРОТЕКАНИЯ РЕАКЦИИ В ПРЯМОМ И ОБРАТНОМ НАПРАВЛЕНИИ.
1) ОБРАТИМЫЕ РЕАКЦИИ.
Продукты способны реагировать друг с другом в тех же условиях, в которых они получены, с образованием исходных веществ, т.е. реакция может протекать как в прямом, так и в обратном направлении.
Примеры:
Реакция этерификации;
реакции гидролиза;
гидрирование- дегидрирование,
гидратация-дегидратация;
получение аммиака из простых веществ и т.д.
2) НЕОБРАТИМЫЕ РЕАКЦИИ.
Химические процессы, продукты которых не способны реагировать друг с другом с образованием исходных веществ.
Это все реакции горения;
реакции щелочных металлов в водных растворах;
обменные реакции, идущие с выделением осадка и газа и др.
6. КЛАССИФИКАЦИЯ ПО ЗНАКУ ТЕПЛОВОГО ЭФФЕКТА РЕАКЦИИ.
Химическая реакция протекает либо с выделением, либо с поглощением теплоты.
Выделение теплоты (Q>0) — реакция ЭКЗОТЕРМИЧЕСКАЯ.
Поглощение теплоты (Q<0) – ЭНДОТЕРМИЧЕСКАЯ .
Количество теплоты обозначают буквой Q, называется тепловым эффектом химической реакции, измеряют в кДж (килоджоулях).
Термохимические уравнения – уравнения с указанием количества теплоты.
Теплота образования вещества – количество теплоты, выделяющееся при образовании 1 моль данного вещества из простых веществ.
Теплота сгорания – количество теплоты, выделяющееся при горении 1 моль данного вещества.
1) ЭКЗОТЕРМИЧЕСКИЕ РЕАКЦИИ.
Реакции, протекающие с выделением энергии в форме теплоты (Q>0, ∆H <0):
С +О2 = СО2 + Q
К ним относятся: реакции горения;
реакция нейтрализации;
реакции щелочных металлов в растворах;
образование аммиака;
nокисление SO2 в SO3 и др.
2) ЭНДОТЕРМИЧЕСКИЕ РЕАКЦИИ.
Протекающие с поглощением энергии в форме теплоты (Q<0, ∆H >0): N2 +О2 = 2NО – Q
К ним относятся: реакции разложения;
процессы, идущие только при нагревании;
реакция гидролиза и др.
18(Б) Тесты ЕГЭ ФИПИ 2015 Классификация химических реакций в неорганической и органической химии









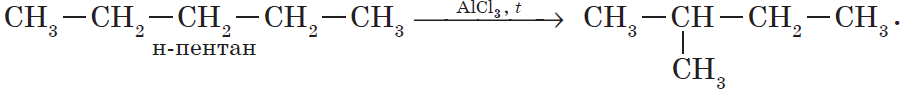
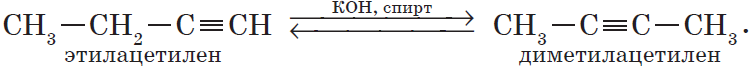
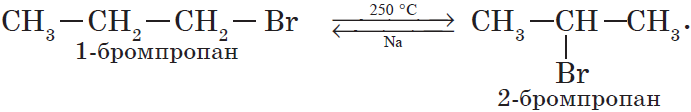
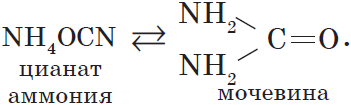
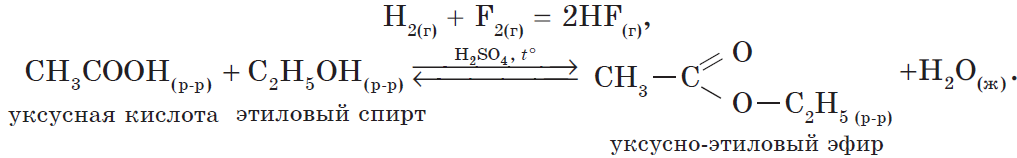


![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)
