Темы кодификатора ЕГЭ: Электролитическая диссоциация электролитов вводных растворах. Сильные и слабые электролиты.
Электролиты – это вещества, растворы и расплавы которых проводят электрический ток.
Электрический ток – это упорядоченное движение заряженных частиц под действием электрического поля. Таким образом, в растворах или расплавах электролитов есть заряженные частицы. В растворах электролитов, как правило, электрическая проводимость обусловлена наличием ионов.
Ионы – это заряженные частицы (атомы или группы атомов). Разделяют положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы).
Электролитическая диссоциация — это процесс распада электролита на ионы при его растворении или плавлении.
Разделяют вещества — электролиты и неэлектролиты. К неэлектролитам относятся вещества с прочной ковалентной неполярной связью (простые вещества), все оксиды (которые химически не взаимодействуют с водой), большинство органических веществ (кроме полярных соединений — карбоновых кислот, их солей, фенолов) — альдегиды, кетоны, углеводороды, углеводы.
К электролитам относят некоторые вещества с ковалентной полярной связью и вещества с ионной кристаллической решеткой.
В чем же суть процесса электролитической диссоциации?
Поместим в пробирку несколько кристаллов хлорида натрия и добавим воду. Через некоторое время кристаллы растворятся. Что произошло?
Хлорид натрия – вещество с ионной кристаллической решеткой. Кристалл NaCl состоит из ионов Na+ и Cl—. В воде этот кристалл распадается на структурные единицы-ионы. При этом распадаются ионные химические связи и некоторые водородные связи между молекулами воды. Попавшие в воду ионы Na+ и Cl— вступают во взаимодействие с молекулами воды. В случае хлорид-ионов можно говорить про электростатическое притяжение дипольных (полярных) молекул воды к аниону хлора, а в случае катионов натрия оно приближается по своей природе к донорно-акцепторному (когда электронная пара атома кислорода помещается на вакантные орбитали иона натрия). Окруженные молекулами воды ионы покрываются гидратной оболочкой. Диссоциация хлорида натрия описывается уравнением:
NaCl = Na+ + Cl–
При растворении в воде соединений с ковалентной полярной связью, молекулы воды, окружив полярную молекулу, сначала растягивают связь в ней, увеличивая её полярность, затем разрывают её на ионы, которые гидратируются и равномерно распределяются в растворе. Например, соляная ксилота диссоциирует на ионы так: HCl = H+ + Cl—.
При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
Процесс электролитической диссоциации характеризуется величиной степени диссоциации молекул вещества:
Степень диссоциации — это отношение числа продиссоциировавших (распавшихся) молекул к общему числу молекул электролита. Т.е., какая доля молекул исходного вещества распадается в растворе или расплаве на ионы.
α=Nпродисс/Nисх, где:
Nпродисс — это число продиссоциировавших молекул,
Nисх — это исходное число молекул.
По степени диссоциации электролиты делят на делят на сильные и слабые.
Сильные электролиты (α≈1):
1. Все растворимые соли (в том числе соли органических кислот — ацетат калия CH3COOK, формиат натрия HCOONa и др.)
2. Сильные кислоты: HCl, HI, HBr, HNO3, H2SO4 (по первой ступени), HClO4 и др.;
3. Щелочи: NaOH, KOH, LiOH, RbOH, CsOH; Ca(OH)2, Sr(OH)2, Ba(OH)2.
Сильные электролиты распадаются на ионы практически полностью в водных растворах, но только в ненасыщенных. В насыщенных растворах даже сильные электролиты могут распадаться только частично. Т.е. степень диссоциации сильных электролитов α приблизительно равна 1 только для ненасыщенных растворов веществ. В насыщенных или концентрированны растворах степень диссоциации сильных электролитов может быть меньше или равна 1: α≤1.
Слабые электролиты (α<1):
1. Слабые кислоты, в т.ч. органические;
2. Нерастворимые основания и гидроксид аммония NH4OH;
3. Нерастворимые и некоторые малорастворимые соли (в зависимости от растворимости).
Неэлектролиты:
1. Оксиды, не взаимодействующие с водой (взаимодействующие с водой оксиды при растворении в воде вступают в химическую реакцию с образованием гидроксидов);
2. Простые вещества;
3. Большинство органических веществ со слабополярными или неполярными связями (альдегиды, кетоны, углеводороды и т.д.).
Как диссоциируют вещества? По степени диссоциации различают сильные и слабые электролиты.
Сильные электролиты диссоциируют полностью (в насыщенных растворах), в одну ступень, все молекулы распадаются на ионы, практически необратимо. Обратите внимание — при диссоциации в растворе образуются только устойчивые ионы. Самые распространенные ионы можно найти в таблице растворимости — это ваша официальная шпаргалка на любом экзамене. Степень диссоциации сильных электролитов примерно равна 1. Например, при диссоциации фосфата натрия образуются ионы Na+ и PO43–:
Na3PO4 → 3Na+ +PO43-
NH4Cr(SO4)2 → NH4+ + Cr3+ + 2SO42–
Диссоциация слабых электролитов: многоосновных кислот и многокислотных оснований происходит ступенчато и обратимо. Т.е. при диссоциации слабых электролитов распадается на ионы только очень небольшая часть исходных частиц. Например, угольная кислота:
H2CO3 ↔ H+ + HCO3–
HCO3– ↔ H+ + CO32–
Гидроксид магния диссоциирует также в 2 ступени:
Mg(OH)2 ⇄ Mg(OH) + OH–
Mg(OH)+ ⇄ Mg2+ + OH–
Кислые соли диссоциируют также ступенчато, сначала разрываются ионные связи, затем — ковалентные полярные. Например, гидрокабонат калия и гидроксохлорид магния:
KHCO3 ⇄ K+ + HCO3– (α=1)
HCO3– ⇄ H+ + CO32– (α < 1)
Mg(OH)Cl ⇄ MgOH+ + Cl– (α=1)
MgOH+ ⇄ Mg2+ + OH– (α<< 1)
Степень диссоциации слабых электролитов намного меньше 1: α<<1.
Основные положения теории электролитической диссоциации, таким образом:
1. При растворении в воде электролиты диссоциируют (распадаются) на ионы.
2. Причина диссоциации электролиты в воде – это его гидратация, т.е. взаимодействие с молекулами воды и разрыв химической связи в нем.
3. Под действием внешнего электрического поля положительно заряженные ионы двигаюися к положительно заряженному электроду — катоду, их называют катионами. Отрицательно заряженные электроны двигаются к отрицательному электроду – аноду. Их называют анионами.
4. Электролитическая диссоциация происходит обратимо для слабых электролитов, и практически необратимо для сильных электролитов.
5. Электролиты могут в разной степени диссоциировать на ионы — в зависимости от внешних условий, концентрации и природы электролита.
6. Химические свойства ионов отличаются от свойств простых веществ. Химические свойства растворов электролитов определяются свойствами тех ионов, которые из него образуются при диссоциации.
Примеры.
1. При неполной диссоциации 1 моль соли общее количество положительных и отрицательных ионов в растворе составило 3,4 моль. Формула соли – а) K2S б) Ba(ClO3)2 в) NH4NO3 г) Fe(NO3)3
Решение: для начала определим силу электролитов. Это легко можно сделать по таблице растворимости. Все соли, приведенные в ответах — растворимые, т.е. сильные электролиты. Далее, запишем уравнения электролитической диссоциации и по уравнению определим максимально число ионов в каждом растворе:
а) K2S ⇄ 2K+ + S2–, при полном распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не получится никак;
б) Ba(ClO3)2 ⇄ Ba2+ + 2ClO3–, опять при распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не образуется никак;
в) NH4NO3 ⇄ NH4++ NO3–, при распаде 1 моль нитрата аммония образуется 2 моль ионов максимально, больше 2 моль ионов не образуется никак;
г) Fe(NO3)3 ⇄ Fe3+ + 3NO3–, при полном распаде 1 моль нитрата железа (III) образуется 4 моль ионов. Следовательно, при неполном распаде 1 моль нитрата железа возможно образование меньшего числа ионов (неполный распад возможен в насыщенном растворе соли). Следовательно, вариант 4 нам подходит.
Ответ г).
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества
распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем
лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K+ (катион) + A— (анион)
NaCl ⇄ Na+ + Cl—

Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы
и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4,
H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:

Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы.
Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:

Для средних солей диссоциация чаще всего происходит в одну ступень:
Na3PO4 ⇄ 3Na+ + PO43-
Из одной молекулы ортофосфата натрия образовалось 4 иона.
K2SO4 ⇄ 2K+ + SO42-
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности,
вещества делятся на электролиты и неэлектролиты.

Электролиты — жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический
ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.

Неэлектролиты — вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят
электрический ток.

Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми
наиболее часто пользуемся. Примеры молекулярных уравнений:

Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы

Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике — остается только то,
что сократить нельзя.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Электролиты и неэлектролиты
Из уроков физики известно, что растворы одних веществ способны проводить электрический ток, а других — нет.
Вещества, растворы которых проводят электрический ток, называются электролитами.
Растворы сахара, спирта, глюкозы и некоторых других веществ не проводят электрический ток.
Вещества, растворы которых не проводят электрический ток, называются неэлектролитами.
Электролитические диссоциация и ассоциация
Почему же растворы электролитов проводят электрический ток?
Шведский ученый Сванте Аррениус, изучая электропроводность различных веществ, пришел в 1877 г. к выводу, что причиной электропроводности является наличие в растворе ионов, которые образуются при растворении электролита в воде.
Процесс распада электролита на ионы называется электролитической диссоциацией.
С. Аррениус, который придерживался физической теории растворов, не учитывал взаимодействия электролита с водой и считал, что в растворах находятся свободные ионы. В отличие от него, русские химики И. А. Каблуков и В. А. Кистяковский применили к объяснению электролитической диссоциации химическую теорию Д. И. Менделеева и доказали, что при растворении электролита происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы. Они считали, что в растворах находятся не свободные, не «голые» ионы, а гидратированные, т.е. «одетые в шубку» из молекул воды.
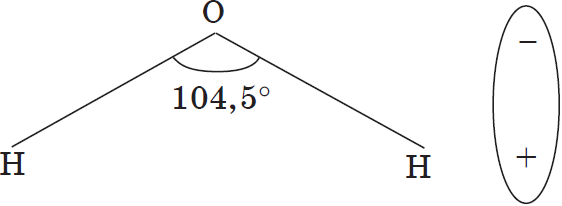
Молекулы воды представляют собой диполи (два полюса), так как атомы водорода расположены под углом $104.5°$, благодаря чему молекула имеет угловую форму. Молекула воды схематически представлена ниже.
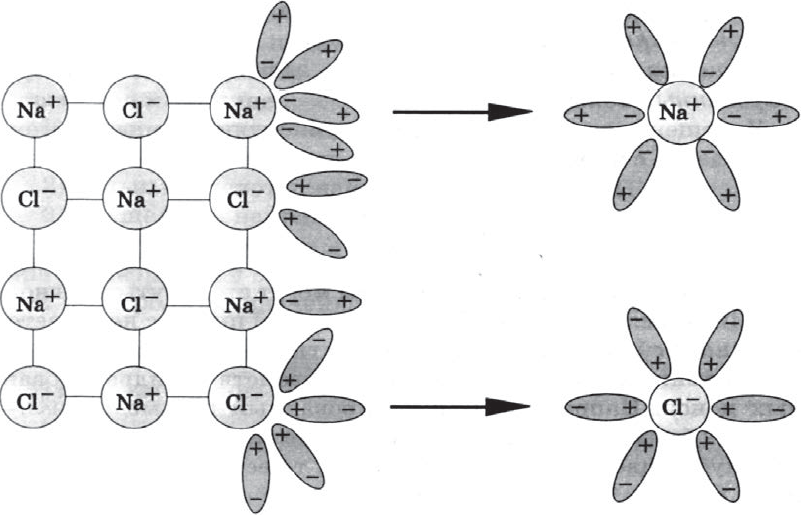
Как правило, легче всего диссоциируют вещества с ионной связью и соответственно с ионной кристаллической решеткой, так как они уже состоят из готовых ионов. При их растворении диполи воды ориентируются противоположно заряженными концами вокруг положительных и отрицательных ионов электролита.
Между ионами электролита и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, и происходит переход ионов из кристалла в раствор. Очевидно, что последовательность процессов, происходящих при диссоциации веществ с ионной связью (солей и щелочей), такова:
а) ориентация молекул (диполей) воды около ионов кристалла;
б) гидратация (взаимодействие) молекул воды с ионами поверхностного слоя кристалла;
в) диссоциация (распад) кристалла электролита на гидратированные ионы.
Упрощенно происходящие процессы можно отразить с по мощью следующего уравнения:
$NaCl=Na^{+}+Cl^{–}$.
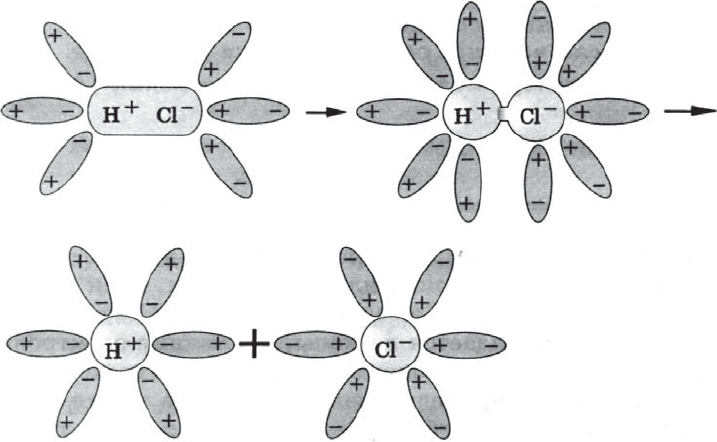
Аналогично диссоциируют и электролиты, в молекулах которых — ковалентная связь (например, молекулы хлороводорода $HCl$); только в этом случае под влиянием диполей воды происходит превращение ковалентной полярной связи в ионную и последовательность процессов, происходящих при этом, такова:
а) ориентация молекул воды вокруг полюсов молекул электролита;
б) гидратация (взаимодействие) молекул воды с молекулами электролита;
в) ионизация молекул электролита (превращение ковалентной полярной связи в ионную);
г) диссоциация (распад) молекул электролита на гидратированные ионы.
Упрощенно уравнение диссоциации соляной кислоты можно отразить с помощью следующего уравнения:
$HCl=H^{+}+Cl^{–}$.
Следует учитывать, что в растворах электролитов хаотически движущиеся гидратированные ионы могут столкнуться и вновь объединиться между собой. Этот обратный процесс называется ассоциацией. Свойства гидратированных ионов отличаются от свойств негидратированных. Например, негидратированный ион меди $Cu^{2+}$ — белый в безводных кристаллах сульфата меди (II) и имеет голубой цвет, когда гидратирован, т.е. связан с молекулами воды $Cu^{2+}·nH_2O$. Гидратированные ионы имеют как постоянное, так и переменное число молекул воды.
Степень электролитической диссоциации
В растворах электролитов наряду с ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации, которая обозначается греческой буквой $α$ (альфа).
Степень диссоциации — это отношение числа частиц, распавшихся на ионы ($N_g$), к общему числу растворенных частиц ($N_р$):
$α={N_g}/{N_p}$.
Степень диссоциации электролита определяется опытным путем и выражается в долях или процентах. Если $α=0$, то диссоциация отсутствует, а если $α=1$, или $100%$, то электролит полностью распадается на ионы. Различные электролиты имеют различную степень диссоциации, т.е. степень диссоциации зависит от природы электролита. Она также зависит и от концентрации: с разбавлением раствора степень диссоциации увеличивается.
По степени электролитической диссоциации электролиты делятся на сильные и слабые.
Сильные и слабые электролиты
Сильные электролиты — это электролиты, которые при растворении в воде практически полностью диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к единице.
К сильным электролитам относятся:
1) все растворимые соли;
2) сильные кислоты, например: $H_2SO_4, HCl, HNO_3$;
3) все щелочи, например: $NaOH, KOH$.
Слабые электролиты — это такие электролиты, которые при растворении в воде почти не диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к нулю.
К слабым электролитам относятся:
1) слабые кислоты — $H_2S, H_2CO_3, HNO_2$;
2) водный раствор аммиака $NH_3·H_2O$;
3) вода;
4) некоторые соли.
Константа диссоциации
В растворах слабых электролитов вследствие их неполной диссоциации устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. Например, для уксусной кислоты:
$CH_3COOH⇄H^{+}+CH_3COO^{–}$,
Можно применить к этому равновесию закон действующих масс и записать выражение константы равновесия:
$K_{равн.}={[H^{+}]·[CH_3COO^{-}]}/{[CH_3COOH]}$
Константу равновесия, характеризующую процесс диссоциации слабого электролита, называют константой диссоциации.
Константа диссоциации характеризует способность электролита (кислоты, основания, воды) диссоциировать на ионы. Чем больше константа, тем легче электролит распадается на ионы, следовательно, тем он сильнее. Значения констант диссоциации для слабых электролитов приводятся в справочниках.
Основные положения теории электролитической диссоциации
1. При растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные ионы.
Ионы — это одна из форм существования химического элемента. Например, атомы металла натрия $Na0$ энергично взаимодействуют с водой, образуя при этом щелочь ($NaOH$) и водород $Н_2$, в то время как ионы натрия $Na^{+}$ таких продуктов не образуют. Хлор $Cl_2$ имеет желто-зеленый цвет и резкий запах, ядовит, а ионы хлора $Cl^{–}$ бесцветны, не ядовиты, лишены запаха.
Ионы — это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов одного или нескольких химических элементов в результате отдачи или присоединения электронов.
В растворах ионы беспорядочно передвигаются в различных направлениях.
По составу ионы делятся на простые — $Cl^{–}, Na^{+}$ и сложные — $NH_4^{+}, SO_4^{2−}$.
2. Причиной диссоциации электролита в водных растворах является его гидратация, т.е. взаимодействие электролита с молекулами воды и разрыв химической связи в нем.
В результате такого взаимодействия образуются гидратированные, т.е. связанные с молекулами воды, ионы.
Следовательно, по наличию водной оболочки ионы делятся на гидратированные (в растворах и кристаллогидратах) и негидратированные (в безводных солях).
3. Под действием электрического тока положительно заряженные ионы движутся к отрицательному полюсу источника тока — катоду и поэтому называются катионами, а отрицательно заряженные ионы движутся к положительному полюсу источника тока — аноду и поэтому называются анионами.
Следовательно, существует еще одна классификация ионов — по знаку их заряда. Сумма зарядов катионов ($Н^{+}, Na^{+}, NH_4^{+}, Cu^{2+}$) равна сумме зарядов анионов ($Cl^{–}, OH^{–}, SO_4^{2−}$), вследствие чего растворы электролитов ($HCl, (NH_4)_2SO_4, NaOH, CuSO_4$) остаются электронейтральными.
4. Электролитическая диссоциация — процесс обратимый для слабых электролитов.
Наряду с процессом диссоциации (распад электролита на ионы) протекает и обратный процесс — ассоциация (соединение ионов). Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости, например:
$HNO_2⇄H^{+}+NO_2^{-}$
5. Не все электролиты в одинаковой мере диссоциируют на ионы. Степень диссоциации зависит от природы электролита и его концентрации.
6. Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
Реакции ионного обмена
Свойства растворов слабых электролитов обусловлены молекулами и ионами, образовавшимися в процессе диссоциации, которые находятся в динамическом равновесии друг с другом.
Запах уксусной кислоты обусловлен наличием молекул $CH_3COOH$, кислый вкус и изменение окраски индикаторов связаны с наличием в растворе ионов $H^{+}$.
Свойства растворов сильных электролитов определяются свойствами ионов, которые образуются при их диссоциации.
При растворении в воде кислоты диссоциируют с образованием катионов водорода $Н^{+}$ (точнее, ионов оксония $Н_3О^{–}$), которые определяют общие свойства кислот, такие как кислый вкус, изменение окраски индикатора и др., и отрицательно заряженных ионов, соответствующих кислотным остаткам. При ионной необратимой диссоциации, когда в растворе молекул нет, кислота называется сильной. При обратимой диссоциации, когда в растворе кислоты, наряду с соответствующими ионами, остаются и молекулы, кислота называется слабой. К сильным кислотам относятся азотная, серная, соляная и некоторые другие. Слабые кислоты — фтороводородная (плавиковая), угольная, сероводородная, фосфорная, органические кислоты и др.
Свойства кислот можно разделить на три группы.
Первая группа объединяет общие свойства кислот, определяемые наличием в их растворах ионов водорода. Это вкус, окраска индикаторов, взаимодействие с металлами, основными оксидами, щелочами, основаниями. Приведем соответствующие сокращенные ионные уравнения:
— с металлами, стоящими в ряду напряжений металлов левее водорода:
$Zn + 2H^{+} = Zn^{2+} + H_2↑;$
— с основными оксидами:
$CuO + 2H^{+} = Cu^{2+} + H_2O;$
— с щелочами:
$H^{+} + OH^{–} = H_2O;$
— с нерастворимыми основаниями:
$Fe(OH)_3 + 2H^{+} + 2H_2O$.
Ко второй группе относятся реакции, определяемые свойствами кислотных остатков. Это специфические для каждой кислоты реакции: образование малорастворимых, иногда окрашенных солей.
Для серной кислоты $H_2SO_4$:
$Ba^{2+} + SO_4^{2–}={BaSO_4↓}↙{белый}$,
для угольной кислоты $H_2CO_3$:
$Ca+CO_3^{2-}={CaCO_3↓}↙{белый}$,
Третью группу составляют реакции, протекание которых обусловлено такими свойствами кислот, как сила кислоты, ее растворимость в воде, прочность молекулы, летучесть. Сильная кислота вытесняет слабую:
${3H_2SO_4}↙{сильная}+Ca_3(PO_4)_2={2H_3PO_4}↙{слабая}+3CaSO_4$
При растворении в воде основания образуют гидроксид-ионы ОН– и положительно заряженные ионы аммония $NH_4^{+}$). Растворимые в воде щелочи являются сильными электролитами, в их растворах молекул гидроксидов нет. Нерастворимые основания — слабые электролиты. Слабым электролитом является и гидроксид аммония $NH_4OH$, который представляет собой соединение молекулы аммиака с молекулой воды $NH_3·H_2O$. Специфические свойства оснований определяются свойствами иона металла.
Соли при растворении в воде диссоциируют с образованием положительно заряженных ионов металла (или аммония $NH_4^{+}$) и отрицательно заряженных кислотных остатков. Эти молекулы определяют поведение солей в растворах.
Например, общие свойства кислот, такие как кислый вкус, изменение окраски инди
1.4.5. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты.
Как известно из курса физики, электрическим током называют упорядоченное движение заряженных частиц. В случае металлов, электропроводность обеспечивается подвижными электронами в кристалле, слабо связанными c ядрами атомов, что позволяет им направленно двигаться под действием разности потенциалов.
Кроме металлов, существуют также вещества растворы или расплавы которых проводят электрический ток. Такие вещества называют электролитами.
Электролиты — вещества, расплавы или водные растворы которых проводят электрический ток.
Но за счет чего обеспечивается электрическая проводимость расплавов и растворов электролитов?
Рассмотрим такое соединение как хлорида натрия. Это вещество характеризуется ионным строением. В узлах его структурной решетки находятся попеременно в шахматном порядке катионы натрия и анионы хлора:
Как можно видеть, заряженные частицы, которые могли бы быть обеспечивать электрическую проводимость присутствуют, но статичны, т.е. неподвижны в узлах решетки. Поэтому, чтобы электрический ток смог протекать через хлорид натрия, нужно еще и обеспечить «подвижность» ионов, из которых он состоит.
Как известно, для одного и того же вещества наиболее подвижны составляющие его частицы в том случае, когда он находится в жидком, а не в твердом агрегатном состоянии. Поэтому для того, чтобы хлорид натрия смог проводить электрический ток, его необходимо расплавить, т.е. превратить в жидкость. В результате сообщения энергии кристаллу хлорида натрия в виде большого количества теплоты частично разрушаются ионные связи Na+Cl− , т.е. происходит диссоциация на свободные подвижные ионы:
Na+Cl− ↔ Na+ + Cl−
Однако, добиться диссоциации хлорида натрия можно не только его плавлением, но также и его растворением в воде. Но каким образом, это становится возможным? Ведь для того чтобы произошло разрушение кристаллической решетки требуется сообщить ей энергию, что и происходило при расплавлении. Откуда же берется энергия на разрушение решетки в случае растворения?
При помещении кристалла NaCl в воду его поверхность подвергается «облепливанию» молекулами воды или гидратации, в результате которой, ионам в структурной решетке сообщается энергия, достаточная для выделения из структурной решетки и «отправления в свободное плавание» в «оболочке» из молекул воды:
или более упрощенно:
NaCl ↔ Na+ + Cl−(участвующие в гидратации кристалла NaCl и ионов молекулы воды не записываются)
Если энергия, выделяющаяся при гидратации кристалла, меньше энергии кристаллической решетки, то его растворение и диссоциация становятся невозможными. Например, поверхность кристалла сульфата бария, помещенного в водную среду, также покрывается молекулами воды, но выделяющаяся в результате этого энергия недостаточна отрыва ионов Ba2+ и SO42- из кристаллической решетки и, как следствие, становится невозможно его растворение (на самом деле возможно, но в крайне малой степени, т.к. абсолютно нерастворимых веществ не бывает).
Аналогичным образом диссоциация осуществляется также гидроксидами металлов. Например:
NaOH = Na+ + OH−
Помимо веществ ионного строения, электролитически диссоциировать способны также и некоторые вещества молекулярного строения с ковалентным полярным типом связи, а именно кислоты. Как и в случае ионных соединений, причина образования ионов из электронейтральных молекул кроется в их гидратации. Существование гидратированных ионов энергетически более выгодно, чем существование гидратированных молекул. Например, диссоциация молекулы соляной кислоты выглядит примерно следующим образом:
Гидратация катионов водорода настолько сильна, что можно говорить не просто о катионе водорода, окружённом молекулами воды (как это было с катионами натрия), а о полноценной частице – ионе гидроксония H3O+, содержащей три полноценные ковалентные связи H-О, одна из которых образована по донорно-акцепторному механизму. Таким образом, уравнение диссоциации соляной кислоты правильнее записывать так:
H2O + HCl = H3O+ + Cl−
Тем не менее, даже в этом случае, чаще всего, уравнение диссоциации соляной кислоты, впрочем, как и любой другой, записывают, игнорируя явное участие в диссоциации кислот молекул воды.
HCl = H+ + Cl−
Диссоциация многоосновных кислот протекает ступенчато, например:
H3PO4 ↔ H+ + H2PO4−
H2PO4− ↔ HPO42- + H+
HPO42- ↔ PO43- + H+
Таким образом, как мы уже выяснили, к электролитам относят: соли, кислоты и основания.
Для описания способности электролитов к электролитической диссоциации используют величину, которая называется степенью диссоциации (α).
Степень диссоциации – отношение числа продиссоциировавших частиц, к общему числу растворенных частиц.
По степени диссоциации электролиты делят на сильные (α>30%), средней силы (30%> α>3%) и слабые (α<3%):
| Электролиты | ||
| Сильные (α>30%) | средней силы (30%> α>3%) | слабые (α<3%) |
|
1) почти все соли 2) некоторые кислоты: HCl, HBr, HI, HNO3, HClO4, H2SO4(разб.) 3) гидроксиды ЩМ и ЩЗМ (NaOH, KOH, Ca(OH)2 и т.д.) |
Mg(OH)2 HNO2 H2SO3 по первой ступени H3PO4 |
1) все гидроксиды металлов кроме гидроксидов ЩМ и ЩЗМ 2) H2CO3, H2SiO3, H2S, H2O 3) NH3∙H2O (или NH4OH) 4) CH3COOH и др. карбоновые кислоты |
Вещества, которые не являются ни кислотами, ни солями, ни гидроксидами, считаются неэлектролитами. К неэлектролитам, например, относятся простые вещества, оксиды, органические вещества (спирты, углеводороды, углеводы, хлорпроизводные углеводородов и т.д.).
Сильные электролиты диссоциируют практически необратимо и в их водных растворах содержание исходных молекул крайне мало:
KOH → K+ + OH−
Na2SO4 → 2Na+ + SO42-.
Электролитическая диссоциация. Электролиты
Автор статьи — профессиональный репетитор И. Давыдова (Юдина).
Электрический ток – направленное движение заряженных частиц – электронов или ионов.
Электролиты – это вещества, растворы или расплавы (в ЕГЭ чаще речь о растворах) которых проводят электрический ток, то есть содержат заряженные частицы. Свободных электронов в растворе не бывает, носителями заряда являются ионы. Электрический ток проводят расплавы веществ с ионной кристаллической решеткой.
К электролитам относятся:
- Соли
- Кислоты
- Основания
Чем больше в растворе заряженных частиц, тем лучше он проводит электрический ток, т.е. чем больше молекул вещества диссоциирует, тем более сильным электролитом оно является.
Список сильных и слабых электролитов нужно знать наизусть!
Сильные электролиты (в растворах): 11
- Растворимые соли
FeCl3, CuSO4, K2CO3 и т.д.
- Щелочи
8 растворимых гидроксидов: LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2, Sr(OH)2, Ca(OH)2.
- Сильные кислоты
HI, HBr, HCl, H2SO4(разб), HNO3, HClO4, HClO3, HMnO4, H2CrO4
Слабые электролиты:
- Слабые основания
нерастворимые гидроксиды, NH3∙H2O, растворы аминов
- Слабые кислоты и кислоты средней силы
H3PO4, HF, H2SO3, H2CO3, H2S, H2SiO3, органические кислоты.
- Вода
H2O – очень слабый электролит, диссоциирует ничтожно мало. Чистая дистиллированная вода не проводит ток.
Неэлектролиты: большинство органических соединений, оксиды, вещества, в молекулах которых имеются только ковалентные неполярные или малополярные связи и т.д.
Сила электролита определяется степенью диссоциации. Рассмотрим соль А2В и кислоту Н3Х:
Диссоциация — всегда обратимый процесс.
Соли диссоциируют (обратимо распадаются на ионы) почти на 100%:
А2В ⇄ 2А+ + В2-. Так как все молекулы распались на ионы, из 1 моль АВ получилось 1 моль В2- и 2 моль А+, то есть три моль ионов.
Многоосновные кислоты и основания диссоциируют ступенчато:
Н3Х ⇄ H+ + H2X—
H2X— ⇄ HX2- + H+
HX2-⇄X3- + H+
При этом каждая следующая ступень диссоциации протекает хуже предыдущей, т.к. присутсвует конкурирующий процесс — обратная реакция. Порядок примерно такой: Из 1 моль молекул слабой кислоты по первой ступени диссоциировало 0,05 моль, по второй — 0,0002 моль и по третьей – 0,00000001 моль. Итого образовалось чуть больше 0,1 моль ионов.
Очевидно, этот раствор этой кислоты проводит ток хуже, чем раствор соли.
Пара вопросов для тренировки:
1) Какие частицы образутся при диссоциации нитрата натрия
а) Na+, N+5, O-2; б) Na+, NO3— в) Na, NO2, O2 г) NaNO2, O2
Решение: нитрат натрия образован остатком азотной кислоты и катионом натрия. Уравнение его диссоциации: NaNO3 ⇄ Na+ + NO3—. Ответ б).
2) В четырех пробирках находятся одномолярные растворы следующих веществ:
а) H3PO4 б) Na2SO4 в) NaCl г) HBr
В какой пробирке больше всего ионов?
Решение: a) ортофосфорная кислота – средней силы, диссоциирует слабо, большая часть молекул останутся в растворе молекулами.
б) сульфат натрия – соль, диссоциирует полностью, из одного моль соли олучается три моль ионов: Na2SO4 ⇄ 2Na+ + SO42-.
в) хлорид натрия – соль, диссоциирует полностью, из одного моль соли образуется два моль ионов: NaCl ⇄ Na+ + Cl—.
г) бромоводородная кислота – сильная, но диссоциирует не полностью (в отличие от солей). В реакции HBr ⇄ H+ + Br- из одного моль HBr образуется меньше двух моль ионов.
Ответ б).
Спасибо за то, что пользуйтесь нашими материалами.
Информация на странице «Электролитическая диссоциация. Электролиты» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать необходимые и поступить в ВУЗ или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из разделов нашего сайта.
Публикация обновлена:
08.03.2023
Основные положения теории электролитической диссоциации
- Химические вещества делятся на электролиты: вещества, проводящие электричество, и неэлектролиты. К электролитам относятся сложнейшие неорганические вещества: кислоты, основания, соли.
К неэлектролитам — большинство органических веществ. - В воде электролиты распадаются на ионы: положительно заряженные катионы и отрицательно заряженные анионы. Ионы бывают простые и сложные. В растворе ионы находятся в хаотическом движении.
- Под действием электрического тока движение ионов упорядочивается, и катионы перемещаются к отрицательному полюсу — катоду, анионы — к положительному аноду.
- На степень электролитической диссоциации влияют несколько факторов: природа растворенного вещества и его количество, свойства растворителя и температура раствора.
Химия. Восьмой класс. Учебник
Учебник написан профессорами химического факультета Московского государственного университета им. М. В. Ломоносова. Отличительными чертами книги являются простота и ясность изложения материала, высокий научный уровень, большое количество иллюстраций, опытов и занимательных задач, что позволяет использовать ее на уроках и в школах с углубленным изучением естественных наук.
История вопроса
Изучение растворов занимало умы исследователей с древних времен. В начале 19 века М. Фарадей открыл способность некоторых растворов проводить электрический ток. Геймгольц, немецкий физик, предположил, что электролиты в растворе полностью распадаются на ионы, т. е. происходит электролитическая диссоциация. Однако объяснить увеличение электропроводности при уменьшении концентрации раствора не удалось.
Ученые заметили, что растворы замерзают при более низкой температуре, чем чистые растворители. Именно этим свойством растворов и сегодня пользуются дворники, обильно посыпая солью обледеневшие тротуары. Однако температура замерзания электролитов не соответствовала расчетным данным.
Необходимо было объяснить научные противоречия. А молодой шведский ученый С. Аррениус, 29 лет, в 1887 г., исследуя проводимость электрического тока в растворах различных веществ, выдвинул теорию, которая могла объяснить эти факты.
Виды электролитов
Электролитическая диссоциация характеризуется степенью диссоциации. Это величина, отражающая отношение числа расщепленных молекул к общему числу молекул вещества. Степень диссоциации показывает долю молекул вещества, расщепленных на ионы. Выражается формулой
а = n/N,
где n — количество разложившихся молекул, N — общее количество молекул.
В зависимости от степени диссоциации выделяют две группы электролитов:
- крепкий – почти полностью разлагается в ненасыщенных растворах (сильные кислоты, соли, щелочи);
- слабые: частично разлагается или не разлагается (слабые кислоты, труднорастворимые соли, нерастворимые основания, гидроксид аммония).
Рис. 3. Сильные и слабые электролиты.
Ненасыщенный раствор содержит небольшую концентрацию растворенного вещества. Это означает, что в раствор можно добавить еще какое-то вещество.
Кажущаяся степень диссоциации.
Степень диссоциации зависит не только от природы растворителя и растворенного вещества, но также от концентрации раствора и температуры.
Уравнение диссоциации можно представить следующим образом:
АК ⇄ А- + К+.
А степень диссоциации можно выразить следующим образом:
С увеличением концентрации раствора степень диссоциации электролита уменьшается. Эти градусные значения для конкретного электролита не являются постоянной величиной.
Поскольку диссоциация является обратимым процессом, уравнения скорости реакции можно записать следующим образом:
Если диссоциация равновесная, то скорости равны и в результате получаем константу равновесия (константу диссоциации):
К зависит от природы растворителя и температуры, но не зависит от концентрации растворов. Из уравнения видно, что чем больше недиссоциированных молекул, тем ниже значение константы диссоциации электролита.
Многоосновные кислоты диссоциируют ступенчато, и каждая ступень имеет свою константу диссоциации.
Если диссоциирует многоосновная кислота, то первый протон отделяется легче, а по мере увеличения заряда аниона увеличивается притяжение, и поэтому протон отделяется значительно труднее. Например,
Константы диссоциации фосфорной кислоты на каждой стадии должны сильно различаться:
I — этап:
II — этап:
III — этап:
На первом этапе фосфорная кислота является кислотой средней силы, на втором этапе — слабой, на третьем этапе — очень слабой.
Примеры констант равновесия для некоторых растворов электролитов.
Рассмотрим пример:
Если к раствору, содержащему ионы серебра, добавить металлическую медь, то при равновесии концентрация ионов меди должна быть больше концентрации серебра.
Но константа имеет низкое значение:
AgCl⇄Ag++Cl-.
Это говорит о том, что, когда было достигнуто равновесие, растворилось очень мало хлорида серебра.
Концентрации металлической меди и серебра вводятся в константу равновесия.
Электролиты и неэлектролиты
Хотя электролитическая диссоциация происходит независимо от действия электрического тока, между этими явлениями существует связь. Чем больше способность вещества распадаться на ионы при взаимодействии с растворителем, тем лучше оно будет проводить электричество. По этому критерию известный физико-химик М. Фарадей выделял электролиты и неэлектролиты.
Электролиты – это вещества, которые после диссоциации на ионы в растворах и плавления проводят электрический ток. Обычно в их молекулах имеются ионные или полярные ковалентные связи.
Неэлектролиты – это вещества, которые в растворах не распадаются на ионы и не плавятся, поэтому в растворенном виде не обладают проводимостью. Для них характерны неполярные или слабополярные ковалентные связи.
Степень диссоциации
В зависимости от того, сколько молекул диссоциировало на ионы, вещество может быть сильным или слабым электролитом. Этот показатель называется степенью диссоциации, он измеряется от 0 до 1 или в процентах.
Степень диссоциации – это отношение числа молей вещества, распавшегося на ионы, к исходному числу молей.
либо,
если в растворе все 100 % электролита распадается на ионы.
По силе действия электролиты делятся на следующие группы:
- слабый — ;
- в среднем — ;
- сильный — .
Важно! Молекулы сильного электролита необратимо распадаются на ионы, поэтому в уравнениях необходимо поставить знак =. Реакции со слабыми электролитами обратимы, поэтому добавляется знак ⇄.
Ступенчатая диссоциация
В некоторых случаях вещества распадаются на ионы в несколько стадий или шагов. Например, такая реакция характерна для основных и кислых солей, многоосновных кислот. Ступенчатая диссоциация может включать две и более стадий, при этом концентрация ионов на первой стадии всегда выше, чем на последующих стадиях.
Пример 1
Ортофосфорная кислота диссоциирует в 3 стадии. В первом из них наблюдается максимальная концентрация ионов дигидрофосфата, а в последнем остается минимальное количество ионов фосфата (диссоциация практически не происходит). Эта кислота не является сильным электролитом, поэтому реакция обратима.
- H3PO4 ⇄ H+ + H2PO4-
- H2PO4- ⇄ H+ + HPO42-
- HPO42- ⇄ H+ + PO43-
Итоговое уравнение: H3PO4 ⇄ 3H+ + PO43-.
Пример 2
Кислая соль Ca(HCO3)2 диссоциирует в 3 стадии. Поскольку это сильный электролит, реакция на первой стадии необратима. На второй стадии слабый кислотный остаток HCO3- и слабый электролит разлагаются на ионы, поэтому реакция обратима.
- Са(НСО3)2 = Са2+ + 2НСО3-
- HCO3- ⇄ H+ + CO32-
- Н+ + Н2О = Н3О+
Итоговое уравнение: Ca(HCO3)2 + 2H2O = Ca2+ + 2H3O+ + 2CO32-.
Сильные и слабые электролиты
Сильные электролиты при растворении быстро и полностью ионизируются, и в растворе не образуются нейтральные молекулы. Примеры сильных электролитов:
- NaCl (хлорид натрия),
- HNO3 (азотная кислота),
- HClO3 (соляная кислота),
- CaCl2 (хлорид кальция) и др.
В слабых электролитах при растворении в воде ионизируются лишь небольшие доли молекул, т е в их растворах находится определенное количество нейтральных молекул. Примеры слабых электролитов:
- большинство органических кислот и оснований
- NH4OH (аммиак),
- H2CO3 (угольная кислота),
- CH3COOH (уксусная кислота) и т.д.
Как определить сильный и слабый электролит?
Сильные электролиты полностью ионизируются, т.к. основными компонентами раствора сильного электролита являются ионы, а степень диссоциации указанного электролита стремится к 1 (т. е. степень диссоциации α ≈ 1). Слабые электролиты ионизируются лишь частично; степень диссоциации такого электролита стремится к 0 (или α < 1).
В таблице растворимости можно увидеть степень диссоциации электролита.
Сильные электролиты:
- растворимые соли,
- многие неорганические кислоты
- основания щелочных и щелочноземельных металлов.
Слабые электролиты:
- почти все органические кислоты и вода,
- некоторые неорганические кислоты,
- нерастворимые гидроксиды металлов.
Уравнение диссоциации
Уравнение электролитической диссоциации используется для записи процессов, происходящих в растворе.
Диссоциация сильного электролита происходит практически необратимо, что показано стрелкой →.
NaCl → Na+ + Cl-
CaCl2 → Ca2+ + 2Cl-
Диссоциация слабого электролита – обратимый процесс, он протекает не полностью и не до конца, что указано стрелкой ⇄
СH3COOH ⇄ СH3COO- + H+
Умение писать уравнения диссоциации будет большим подспорьем при разборе темы «§ 13. Ионообменные реакции и условия их протекания» в учебнике под редакцией В. В. Еремина и при решении ионных уравнений.
Противостояние титанов
Теория электролитической диссоциации Аррениуса вызвала бурные споры среди ученых.
Химический мир разделился на два лагеря. Сторонники «физической» теории Аррениуса считали, что разложение на ионы происходит без всякого влияния сил внешней среды, и что раствор представляет собой механическую взвесь ионов и молекул воды.
Но эта теория не могла объяснить тепловые эффекты растворения. Например, нагревание колбы при разведении серной кислоты в воде или покрытие емкости инеем при растворении аммиачной селитры или аммиачной селитры в воде.
Сторонники «химической», или гидратной, теории, автором которой был Д. И. Менделеев, считали, что взаимодействие растворенного вещества и растворителя происходит в растворе.
Многие экземпляры были разбиты в этом бою. Выявились худшие человеческие качества. Так, Аррениус, пользуясь своим служебным положением (в 1905 г он был назначен директором Нобелевского физико-химического института в Стокгольме), приложил немало усилий для того, чтобы, несмотря на трехкратное выдвижение на Нобелевскую премию в 1905, 1906 и 1907 г. Д. И. Менделеев ее так и не получил.
Но истина, как всегда, оказалась посередине: в ходе дальнейших экспериментов ученые обнаружили, что растворитель и растворенное вещество, взаимодействуя друг с другом, дают энергию, необходимую для разрушения кристаллической решетки электролитов. В споре великих умов родилась новая протолитная, или протонно-кислотно-основная теория.
Определение сильных и слабых, как распознать
Аррениус является автором теории электролитической диссоциации. Это понятие относится к процессу, при котором вещество распадается на отдельные ионы. Степень диссоциации зависит от природы электролита и рассчитывается по формуле:
α=(N дис)/(N всего)×100 %
Краткая форма формулы:
α=(N дис)/(N всего)
Если этот показатель превышает 30% (или 0,3), электролит считается крепким. В уравнении его разложения ставится знак «→», так как процесс необратим. Это включает:
- соли: NaHCO3 → Na+ + HCO3-
- сильные кислоты: H2SO4 → H+ + HSO4-
- сильные основания (щелочи): KOH → K+ + OH-
Если степень диссоциации меньше 3% (или 0,03), такие электролиты называются слабыми. Реакции с ними обратимы, поэтому используется знак «⇄» или «↔». Это включает:
- вода: H2O ↔ H+ + OH-
- слабые и органические кислоты: H3PO4 ↔ H+ + H2PO4-
- нерастворимые основания: Fe(OH)2 ↔ FeOH+ + OH-
Свойства растворов электролитов
- электропроводность – основная характеристика растворов электролитов;
- степень разложения на ионы увеличивается с уменьшением концентрации раствора (разбавлением);
- степень диссоциации увеличивается при нагревании раствора.