Скачать материал

Скачать материал


- Сейчас обучается 111 человек из 49 регионов


- Курс добавлен 13.12.2022


- Курс добавлен 13.12.2022


Описание презентации по отдельным слайдам:
-
-
2 слайд
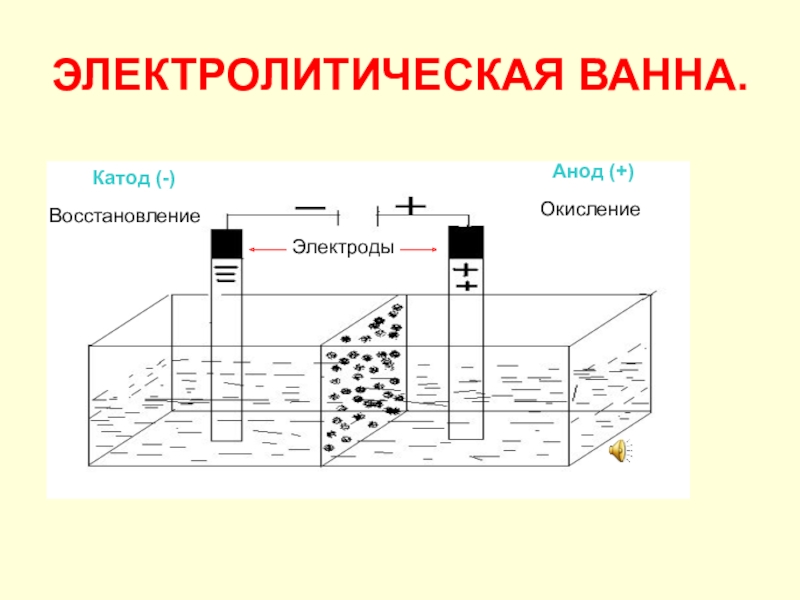
ЭЛЕКТРОЛИТИЧЕСКАЯ ВАННА.
Катод (-)
Анод (+)
Восстановление
Окисление
Электроды -
3 слайд
Электролиз.
Электролиз – окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплав или раствор электролита.
Электролиты: соли, щёлочи, кислоты. -
4 слайд
Электролиз расплавов
Расплав KOH = K+ + OH–
(–) Катод: K+ + 1ē = Ko 4
(+) Анод: 4OH– – 4ē = O2↑+ 2H2O 1
4K++ 4OH– = O2↑ + 2H2O↑+ 4K
электролиз
4KOH → 4K + O2↑ + 2H2O↑
Электролиз расплавов -
5 слайд
Электролиз расплавов
Расплав KCl = K+ + Cl–
(–) Катод: K+ + 1ē = Ko 2
(+) Анод: 2Cl– – 2ē = Cl2↑ 1
электролиз
2KCl → 2K + Cl2↑
Электролиз расплавов -
6 слайд
Электролиз Al2O3
Расплав Al2O3 в Na3AlF6 (криолит)
(–) Катод ← Al3+ AlO33- → (+) Анод(–) Катод: Al3+ + 3ē = Al0
(+) Анод: 4AlO33-– 12ē = 2Al2O3 + 3O2↑
2Al2O3 = 4Al +3O2 -
7 слайд
Процессы на катоде
Катионы активных металлов:
Li+, Cs+, Rb+, K+, Ba2+, Ca2+, Na+, Mg2+, Al3+, NH4+
Металлы не восстанавливаются, а восстанавливаются молекулы H2O:
2H2O + 2ē = H2↑ + 2OH– -
8 слайд
Процессы на катоде
Катионы металлов средней активности
Mn2+, Zn2+, Cr3+, Fe2+, Co2+, Ni2+,Sn2+,Pb2+
Катионы металлов восстанавливаются совместно с молекулами воды:
Men++ nē = Meo
2H2O + 2ē = H2↑+ 2OH– -
9 слайд
Процессы на катоде
Катионы водородаH+
Ионы H+ восстанавливаются только при электролизе растворов кислот:
2H++ 2ē = H2↑ -
10 слайд
Процессы на катоде
Катионы малоактивных металлов:
Cu2+, Hg2+, Ag+, Pt2+, Au3+
Восстанавливаются только катионы металлов:
Men++nē = Meo -
11 слайд
Процессы на аноде
1) Анионы бескислородных кислот:
I–, Br–, S2–, Cl–
Окисляются кислотные остатки
Am– – mē = Ao
2) Анионы OH–
Окисляются только при электролизе растворов щёлочей
4OH– – 4ē = O2↑+ 2H2O -
12 слайд
Процессы на аноде
3) Анионы кислородсодержащих кислот:
SO42–, NO3–, CO32–, PO43–
Окисляются молекулы воды:
2H2O – 4ē =O2↑+ 4H+
4) Анионы F–
Окисляются только молекулы воды
2H2O – 4ē = O2↑ + 4H+ -
13 слайд
Если анод растворимый
Анод растворимый (активный), изготовлен из Cu, Ag, Zn, Ni, Fe и др. металлы. Анионы не окисляются. Окисляется сам анод:
Мео – nē = Men+
Катионы Men+ переходят в раствор. Масса анода уменьшается. -
14 слайд
Электролиз раствора NaCl
Раствор NaCl
(–) Катод ← Na+ Cl– → (+) Анод
H2O H2O
(–) Катод: 2H2O + 2ē = H2↑+ 2OH–
(+) Анод: 2Cl– – 2ē = Cl2↑
2H2O + 2Cl– = H2↑ + Cl2↑ + 2OH–
2H2O+2NaCl=H2↑+Cl2↑+ 2NaOH -
15 слайд
Электролиз раствора ZnSO4
Раствор ZnSO4
(–) Катод ← Zn2+ SO42- → (+) Анод
H2O H2O
(–) Катод: 2H2O + 2ē = H2↑+ 2OH–
Zn2+ + 2ē = Zn0
(+) Анод: 2H2O — 4ē = O2↑+ 4H+
Zn2+ + 2H2O = Zn0 +H2↑ + O2↑ + 2H+
ZnSO4 + 2H2O = Zn+H2↑+O2↑+ H2SO4 -
16 слайд
Электролиз раствора CuSO4
Раствор CuSO4
(–) Катод ← Cu2+ SO42- → (+) Анод
H2O H2O
(–) Катод: Cu2+ + 2ē = Cu0
(+) Анод: 2H2O — 4ē = O2↑+ 4H+
Cu2+ + 2H2O = 2Cu0 + O2↑+ 4H+
2CuSO4 + 2H2O = 2Cu+ O2↑+ 2H2SO4 -
17 слайд
Электролиз раствора NaOH
Раствор NaOH
(–) Катод ← Na+ OH– → (+) Анод
H2O H2O
(–) Катод: 2H2O + 2ē = H2↑+ 2OH–
(+) Анод: 4OH- — 4ē = 2H2O↑+ O2↑
4H2O + 4OH– = 2H2↑ + O2↑ + 4OH– + 2H2O
2H2O = 2H2↑+O2↑ -
18 слайд
Если анод растворимый
Анод растворимый.
Электролиз раствора AgNO3
(анод растворимый – из Ag)
(–) Катод: Ag+ + 1ē = Ago
(+) Анод: Ago – 1ē = Ag+
Ago + Ag+ = Ag+ + Ago
Электролиз сводится к переносу серебра с анода на катод. -
-
20 слайд
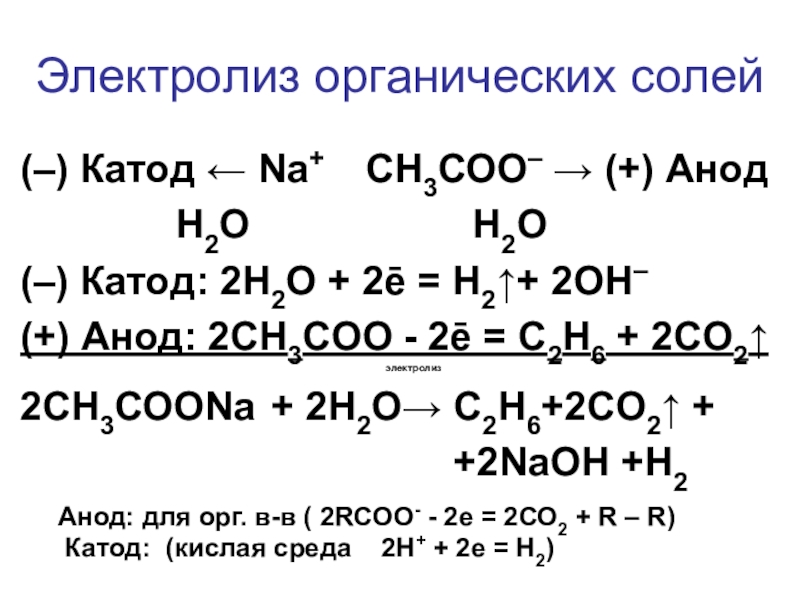
Электролиз органических солей
(–) Катод ← Na+ СН3СОO– → (+) Анод
H2O H2O
(–) Катод: 2H2O + 2ē = H2↑+ 2OH–
(+) Анод: 2СН3СОO — 2ē = С2Н6 + 2СO2↑
электролиз
2СН3СОONa + 2H2O→ C2H6+2CO2↑ +
+2NaOH +H2Анод: для орг. в-в ( 2RСОО- — 2е = 2СО2 + R – R)
Катод: (кислая среда 2Н+ + 2е = Н2) -
21 слайд
Применение электролиза.
Для получения щёлочных, щёлочноземельных металлов, алюминия, лантаноидов
Для получения точных металлических копий, что называется гальванопластикой
Для защиты металлических изделий от коррозии и для придания декоративного вида. Отрасль прикладной электрохимии, которая занимается покрытием металлических изделий другими металлами называется ГАЛЬВАНОСТЕГИЕЙ. -
22 слайд
Законы электролиза.
Законы Фарадея.
Масса веществ, выделившегося на электроде при электролизе, пропорциональна количеству электричества, прошедшее через электролит:
где , m–масса веществ продуктов электролиза, гр.
Э – эквивалентная масса вещества, гр.
I – сила тока, А.
F – постоянная Фарадея = 96500 Кл.
t – время электролиза, сек. -
23 слайд
Эквивалентная масса (молярная масса эквивалента вещества) mэкв является одной из важнейших характеристик вещества.
По определению эквивалент вещества — это такое количество химического вещества, которая реагирует с 1 г водорода или вытесняет такое же количество водорода из его соединений.
Величина mэкв определяется или экспериментально, или, чаще всего, исходя из химической формулы вещества и его принадлежности к тому или иному классу химических соединений -
24 слайд
mэкв(оксида) = Моксида/(число атомов кислорода·2);
mэкв(основания) = Моснования/кислотность основания;
mэкв(кислоты) = Мкислоты/основность кислоты;
mэкв(соли) = Мсоли/(число атомов металла·валентность металла).
кислотность основания равна числу гидроксильных групп в формуле основания, а основность кислоты равна числу атомов водорода в формуле кислоты.
Например:
mэкв(Fe2O3) = М(Fe2O3)/(3·2) = 160/6 = 26,7 г/моль;
mэкв(H2SO4) = M(H2SO4)/2 = 98/2 = 49 г/моль;
mэкв(Ca(OH)2) = M(Ca(OH)2)/2 = 74/2 = 37 г/моль;
mэкв(Al2(SO4)3) = M(Al2(SO4)3) = 342/2 = 171 г/моль; -
25 слайд
При электролизе раствора хлорида натрия получили раствор, содержащий 20г гидроксида натрия. Газ, выделившийся на аноде в ходе электролиза, пропустили через 665мл 10%-ного водного раствора иодида калия (ρ=1,1 г/мл). Какова масса образовавшегося при этом осадка?
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
6 157 098 материалов в базе
- Выберите категорию:
- Выберите учебник и тему
- Выберите класс:
-
Тип материала:
-
Все материалы
-
Статьи
-
Научные работы
-
Видеоуроки
-
Презентации
-
Конспекты
-
Тесты
-
Рабочие программы
-
Другие методич. материалы
-
Найти материалы
Другие материалы
- 19.09.2016
- 959
- 5
Рейтинг:
4 из 5
- 19.09.2016
- 1413
- 3
- 19.09.2016
- 2599
- 8
Рейтинг:
4 из 5
- 19.09.2016
- 4901
- 141


Рейтинг:
4 из 5
- 19.09.2016
- 5074
- 190

- 19.09.2016
- 456
- 0
Вам будут интересны эти курсы:
-
Курс повышения квалификации «Химия окружающей среды»
-
Курс профессиональной переподготовки «Химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Нанотехнологии и наноматериалы в биологии. Нанобиотехнологическая продукция»
-
Курс повышения квалификации «Введение в сетевые технологии»
-
Курс повышения квалификации «Организация практики студентов в соответствии с требованиями ФГОС педагогических направлений подготовки»
-
Курс повышения квалификации «Применение MS Word, Excel в финансовых расчетах»
-
Курс повышения квалификации «Особенности подготовки к сдаче ОГЭ по химии в условиях реализации ФГОС ООО»
-
Курс профессиональной переподготовки «Биология и химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Основы менеджмента в туризме»
-
Курс повышения квалификации «Современные образовательные технологии в преподавании химии с учетом ФГОС»
-
Курс профессиональной переподготовки «Уголовно-правовые дисциплины: теория и методика преподавания в образовательной организации»
-
Курс профессиональной переподготовки «Техническое сопровождение технологических процессов переработки нефти и газа»
-
Курс профессиональной переподготовки «Организация системы учета и мониторинга обращения с отходами производства и потребления»
Слайд 1
Различные варианты заданий егэ по теме «Электролиз » Зоткова Юлия Анатольевна учитель химии МБОУ СОШ №23 г.Новороссийска
Слайд 2
1.Установите соответствие между формулой соли и уравнением процесса, протекающего на аноде при электролизе её водного раствора. ФОРМУЛА СОЛИ А) NaCL Б) Zn Br 3 В)CuSO 4 Г)AgNO 3 УРАВНЕНИЕ АНОДНОГО ПРОЦЕССА 1) 2H 2 O – 4e → O 2 + 4H + 2) 2H 2 O + 2e → H 2 + 2OH 3) 2Cl — -2e → Cl 2 0 4) 2Br — — 2e → Br 2 0 5) 2SO 4 2- -2e → S 2 O 8 2- 6) 2NO 3 — -2e → 2NO 2 +O 2
Слайд 3
2. Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе её водного раствора. ФОРМУЛА СОЛИ А) Cs SO 4 Б) CH 3 COO Na В) BaBr 2 Г) CuSO 4 ПРОДУКТ,ОБРАЗУЮЩИЙСЯ НА АНОДЕ 1) метан 2) сернистый газ 3) кислород 4) водород 5) бром 6) этан и углекислый газ
Слайд 4
3. Установите соответствие между формулой соли и уравнением процесса, протекающего на катоде при электролизе её водного раствора. ФОРМУЛА СОЛИ А) Al ( S O 3 ) 3 Б) Cu Br 2 В)SbCl 3 Г) Cu (NO 3 ) 2 УРАВНЕНИЕ КАТОДНОГО ПРОЦЕССА 1) 2H 2 O – 4e → O 2 + 4H+ 2) 2H 2 O + 2e → H 2 + 2OH — 3) Cu 2+ + 2e → Cu 0 4) Cu 2+ + 1e → Cu + 5) Sb 3+ +3e→ Sb 0
Слайд 5
4. Установите соответствие между названием вещества и способом его получения. НАЗВАНИЕ ВЕЩЕСТВА А)литий Б)фтор В)серебро Г) магний ПОЛУЧЕНИЕ ЭЛЕКТРОЛИЗОМ 1) раствора LiF 2) расплава LiF 3) раствора MgCl 2 4) раствора AgNO 3 5) расплава Ag 2 O 6) расплава MgCl 2
Слайд 6
5. Установите соответствие между названием вещества и продуктами электролиза его водного раствора НАЗВАНИЕ ВЕЩЕСТВА А) бромид рубидия Б) сульфат меди(II) В) бромид меди(II) ПРОДУКТЫ ЭЛЕКТРОЛИЗА 1) водород, бром, гидроксид рубидия 2) натрий, углекислый газ 3) медь, оксид серы (IV) 4) медь, кислород, серная кислота 5) медь, бром
Слайд 7
6. Установите соответствие между названием вещества и основными газообразными продуктами электролиза его водного раствора. НАЗВАНИЕ ВЕЩЕСТВА А) хлорид бария Б) нитрат кальция В) фторид серебра Г) нитрат меди ГАЗООБРАЗНЫЕ ПРОДУКТЫ ЭЛЕКТРОЛИЗА 1) кислород, водород 2) водород, хлор 3) оксид азота (IV) 4) кислород 5) водород 6) хлор 7) фтор
Слайд 8
7. Установите соответствие между названиями вещества и электролитическим способом его получения. НАЗВАНИЕ ВЕЩЕСТВА А) хлор Б) этан В) натрий Г)бром ЭЛЕКТРОЛИЗ 1) водного раствора хлорида меди 2) водного раствора бромида натрия 3) водного раствора ацетата калия 4) расплава фторида натрия 5) водного раствора перхлората калия 6) водного раствора уксусной кислоты
Слайд 9
8. Установите соответствие между формулой вещества и продуктами электролиза его водного раствора на инертных электродах. ФОРМУЛА ВЕЩЕСТВА А)натрий Б) алюминий В)серебро Г)медь ПРОДУКТЫ ЭЛЕКТРОЛИЗА 1) водного раствора солей 2) водного раствора гидроксида 3) расплава поваренной соли 4) расплавленного оксида 5) раствора оксида в расплавленном криолите
Слайд 10
9. Установите соответствие между формулой вещества и продуктами электролиза его водного раствора на инертных электродах. ФОРМУЛА ВЕЩЕСТВА А) AlCl 3 Б) Na OH В) Hg (NO 3 ) 2 Г) Au Br 3 ПРОДУКТЫ ЭЛЕКТРОЛИЗА 1) металл, галоген 2) гидроксид металла, хлор, водород 3) металл, кислород 4) металл, кислота, кислород 5) водород, кислород 6) водород, галоген
Слайд 11
10. Установите соответствие между формулой соли и реакцией ее водного раствора ФОРМУЛА СОЛИ А) Na 2 SO 4 Б) C u (NO 3 ) 2 В) ZnBr 2 Г) C a Cl 2 ПРОДУКТ ЭЛЕКТРОЛИЗА 1) SO 2 2) O 2 3) NO 2 4) Br 2 5) Cl 2 6) H 2
Слайд 12
Ответы: 1 — 3411 2 — 3653 3 — 2353 4 — 2246 5 — 145 6 — 6444 7 — 1342 8 — 3511 9 — 2541 10-2245
Ильичева Оксана Анатольевна учитель химии муниципального общеобразовательного учреждения «Кораблинская средняя школа №1»
[email protected]
Номинация 4 «Учебная презентация по теме (11 класс)» №Р 4.25
Электролиз
Электролиз —
совокупность окислительно-восстановительных процессов, протекающих на поверхности электродов при пропускании электрического тока через расплав или раствор электролитов
Электролиз
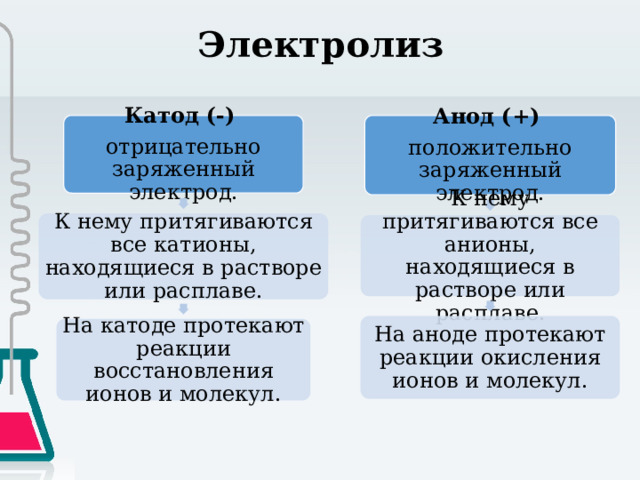
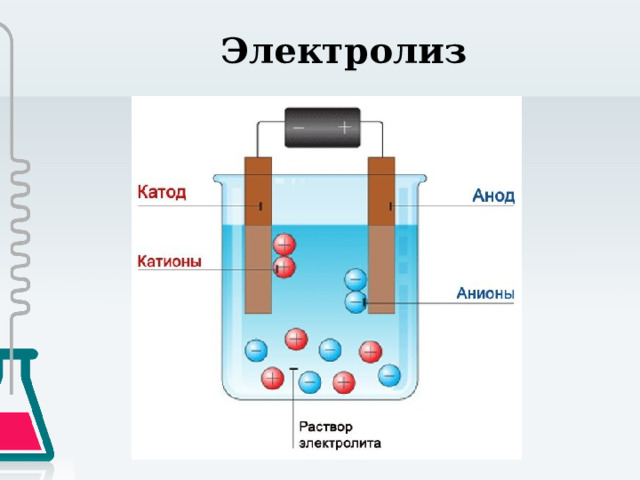
Катод (-)
Анод (+)
отрицательно заряженный электрод.
положительно заряженный электрод.
К нему притягиваются все катионы, находящиеся в растворе или расплаве.
К нему притягиваются все анионы, находящиеся в растворе или расплаве.
На аноде протекают реакции окисления ионов и молекул.
На катоде протекают реакции восстановления ионов и молекул.
Электролиз
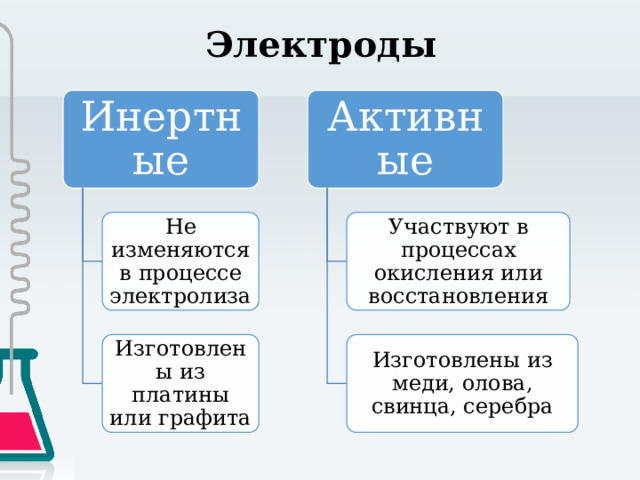
Электроды
Инертные
Активные
Не изменяются в процессе электролиза
Участвуют в процессах окисления или восстановления
Изготовлены из платины или графита
Изготовлены из меди, олова, свинца, серебра
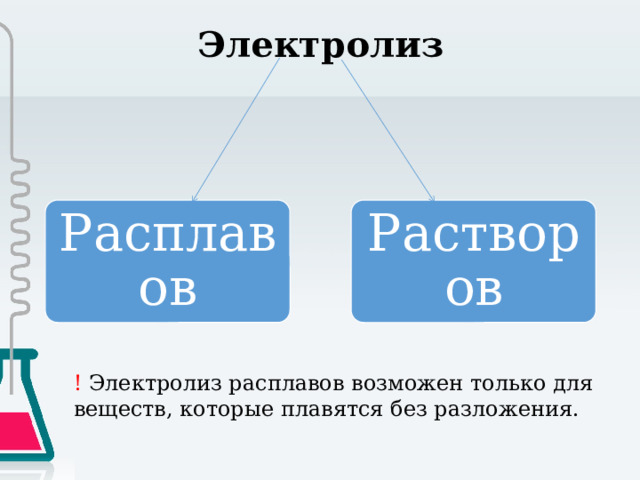
Электролиз
Расплавов
Растворов
! Электролиз расплавов возможен только для веществ, которые плавятся без разложения.
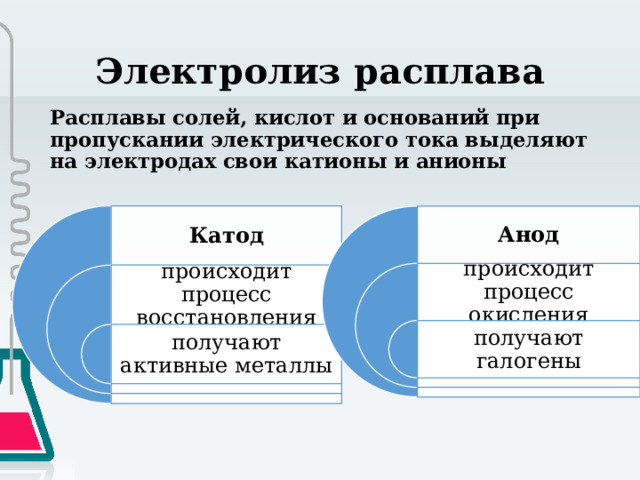
Электролиз расплава
Расплавы солей, кислот и оснований при пропускании электрического тока выделяют на электродах свои катионы и анионы
Катод
Анод
происходит процесс окисления
происходит процесс восстановления
получают галогены
получают активные металлы
Электролиз расплава
NaCl Na + + Cl —
При пропускании электрического тока на катоде протекает восстановление ионов натрия до металлического натрия, а на аноде – окисление хлорид-ионов:
Катод (-): Na + + ē → Na 0
Анод (+): 2Cl — — 2ē → Cl 2 0
Складывая полуреакции окисления и восстановления, получаем суммарное уравнение электролиза:
2NaCl электролиз 2Na + Cl 2
Электролиз расплава
Na 2 SO 4 2Na + + SO 4 2-
Катод (-): 2Na + + 2ē → 2Na 0
Анод (+): SO 4 2- — 2ē → SO 2 + O 2 0
Na 2 SO 4 электролиз 2Na + SO 2 + O 2
NaOH Na + + OH —
Катод (-): Na + + ē → Na 0
Анод (+): 4OH — — 4ē → 2H 2 O + O 2 0
4NaOH электролиз 4Na + 2H 2 O + O 2
Электролиз воды
Приводит к выделению молекул водорода H 2 0 на катоде и молекул O 2 0 на аноде. Водорода всегда выделяется в 2 раза больше, чем кислорода
H 2 O H + + OH —
Катод (-): 2H + + 2ē → H 2 0
Анод (+): 4OH — — 4ē → 2H 2 O + O 2 0
2H 2 O электролиз 2H 2 + O 2
Электролиз растворов
Правила электролиза строго определяют продукты, образующиеся на катоде или аноде в результате электролиза раствора того или иного вещества. Эти правила подразделяются на катодные – определяющие состав продуктов на катоде, и анодные – определяющие состав продуктов на аноде.
Катодные правила
- Если на катоде находятся катионы H + (из воды) и катионы активного металла (расположены в ряду напряжений левее марганца) (из вещества), то происходит восстановление молекул воды и выделяется водород:
2H 2 O + 2ē = H 2 0 ↑ + 2OH —
2) Если на катоде находятся катионы H + (из воды) и катионы неактивного металла (расположены в ряду напряжений правее водорода) (из вещества), то выделяется только металл:
Cu 2+ +2ē = Cu 0
Катодные правила
3) Если на катоде находятся катионы водорода и катионы металла средней активности (металлы от марганца включительно и до свинца), то возможно одновременное восстановление и молекул воды и катионов металла.
Если на катоде находятся катионы Fe 3+ ; Ni 2+ ; Pb 2+ ; Sn 2+ и H + , то возможно преимущественное восстановление катионов металла. (Обычно даётся по условию задачи).
Анодные правила
- Если на аноде находятся анионы бескислородной кислоты (Cl — , Br — , I — , S 2- ) и гидроксид-анионы, то окисляется сам анион:
2 Br — — 2ē = Br — 2 0
Исключением является ион F — : при электролизе растворов фтороводорода и фторидов на аноде выделяется кислород.
2) Если на аноде находятся анионы кислородсодержащей кислоты (а также фторид-ионы), то на аноде происходит окисление воды с выделением кислорода:
2H 2 O — 4ē = 4H + + O 2 0 ↑
Анодные правила
3) Если на аноде находятся гидроксид-анионы, то они подвергаются окислению с образованием молекул O 2 .
4OH — — 4ē → O 2 0 + 2H 2 O
4) При электролизе солей карбоновых кислот на аноде протекает окисление аниона по схеме:
2RCOO — — 2ē → R-R↑ + 2CO 2 ↑
Электролиз раствора NaCl
NaCl Na + + Cl —
H 2 O H + + OH —
Катод (-): 2H 2 O + 2ē = H 2 0 ↑ + 2OH —
Анод (+): 2Cl — — 2ē → Cl 2 0
2NaCl + 2H 2 O электролиз H 2 0 + Cl 2 + 2NaOH
В растворе останутся молекулы NaOH. При этом анионы OH — концентрируются на аноде, где создаётся щелочная среда.
Электролиз раствора CuSO 4
CuSO 4 Cu 2+ + SO 4 2-
H 2 O H + + OH —
Катод (-): Cu 2+ + 2ē = Cu 0
Анод (+): 2H 2 O — 4ē = 4H + + O 2 0 ↑
2CuSO 4 + 2H 2 O электролиз 2Cu 0 + O 2 0 + 2H 2 SO 4
На катоде концентрируются катионы H + и создаётся кислая среда.
Суммарную реакцию электролиза записывают таким образом, что первым среди продуктов реакции записывают продукт, выделяющийся на катоде, затем – продукт, выделяющийся на аноде, а после этого то вещество, которое остаётся в растворе.
Электролиз раствора AgCl
AgCl Ag + + Cl —
H 2 O H + + OH —
Катод (-): Ag + + 1ē = Ag 0
Анод (+): 2Cl — — 2ē → Cl 2 0
2 AgCl электролиз 2Ag + Cl 2
Электролиз этого вещества сводится к электролизу самой соли, катион и анион которой выделяются в виде молекул на электродах. Среда остаётся нейтральной.
Получение:
- щелочных и щелочноземельных металлов гидроксидов натрия и калия хлора фтора водорода алюминия
- щелочных и щелочноземельных металлов
- гидроксидов натрия и калия
- хлора
- фтора
- водорода
- алюминия
Электролитическое нанесение металлических покрытий
Электролитическая очистка металлов
Применение электролиза
Задания для подготовки к ЕГЭ (задание 22)
Пример 1. Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе её водного раствора.
ФОРМУЛА СОЛИ
А) CuBr 2
ПРОДУКТ НА КАТОДЕ
Б) CuSO 4
1) H 2
2) Cu
В) NaNO 3
Г) Ba(NO 3 ) 2
3) Na
4) Ba
5) NO 2
6) Br 2
Задания для подготовки к ЕГЭ (задание 22)
Решение.
Напомним, что на катоде протекает процесс восстановления (присоединения электронов). Следовательно, при электролизе растворов солей на катоде могут выделяться только металлы или водород. Поэтому два последних варианта ответа можно сразу исключить из рассмотрения как заведомо неверные. Далее руководствуемся правилами определения катодных продуктов электролиза. Медь расположена в ряду напряжений металлов правее водорода, значит, при электролизе и раствора CuBr 2 , и раствора CuSO 4 на катоде будет выделяться медь (ответ 2). Барий и натрий расположены левее марганца, следовательно, при электролизе водных растворов их солей на катоде выделяется водород из воды (ответ 1).
Задания для подготовки к ЕГЭ (задание 22)
Ответ:
А
Б
2
В
2
Г
1
1
Задания для подготовки к ЕГЭ (задание 22)
Пример 2. Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе её водного раствора.
ФОРМУЛА СОЛИ
А) CuSO 4
ПРОДУКТ НА КАТОДЕ
Б) K 2 S
1) водород
2) кислород
В) BaCl 2
Г) Pb(NO 3 ) 2
3) металл
4) хлор
5) сера
6) азот
Задания для подготовки к ЕГЭ (задание 22)
Решение.
Воспользуемся приведёнными выше правилами для определения анодных продуктов электролиза. Поскольку CuSO 4 и Pb(NO 3 ) 2 содержат кислородсодержащие анионы, при электролизе водных растворов этих солей на аноде окисляются молекулы воды с образованием кислорода (ответ 2). Так как сульфид калия является солью бескислородной кислоты, анодным продуктом электролиза его раствора будет сера (ответ 5). Аналогично, при электролизе раствора BaCl 2 на аноде выделится хлор (ответ 4).
Задания для подготовки к ЕГЭ (задание 22)
Ответ:
А
Б
2
В
5
Г
4
2
Задания для самостоятельного решения
Задание 1. В результате электролиза водного раствора какой соли среда в приэлектродном пространстве станет: а) щелочной; б) кислой, если даны следующие соли: KCl; CuCl 2 ; Cu(NO 3 ) 2 ?
Задание 2. Составьте реакции электролиза водных растворов: NaOH; HCl; HNO 3 .
Задания для самостоятельного решения
Задание 3. Установите соответствие между формулой вещества и продуктами электролиза водного раствора этого вещества, выделившимися на инертных электродах.
ФОРМУЛА ВЕЩЕСТВА
ПРОДУКТЫ ЭЛЕКТРОЛИЗА
А) KClO 4
1) водород, углекислый газ и этан
Б) KI
2) водород и кислород
В) AgNO 3
3) водород и галоген
Г) (CH 3 COO) 2 Ca
4) металл и кислород
5) металл и галоген
6) металл и углекислый газ
Задания для самостоятельного решения
Задание 4. Установите соответствие между формулой вещества и продуктами электролиза водного раствора этого вещества, выделившимися на инертных электродах.
ФОРМУЛА ВЕЩЕСТВА
ПРОДУКТЫ ЭЛЕКТРОЛИЗА
А) MgBr 2
1) водород и сернистый газ
Б) Ba(OH) 2
2) металл и сероводород
В) CuSO 4
3) водород и кислород
Г) H 2 SO 4
4) водород и галоген
5) металл и кислород
6) металл и галоген
Список используемой литературы и ресурсов
Сычев И. А. Окислительно-восстановительные
реакции: Методические рекомендации по подготовке к единому государственному экзамену по химии. – Рязань: РИО РязГМУ, 2008. – 23 с.
1
Неорганическая химия. Весь школьный курс в таблицах/ сост. Н. В. Манкевич. – Минск: Современная школа: Кузьма, 2018. – 213 с.
2
Химия. Курс самоподготовки. Технология решения заданий./ А. А. Каверина, Ю. Н. Медведев, Г. Н. Молчанова и др. – М.: Просвещение, 2018. – 56 с .
3
4
5
1. Министерство образования и науки Республики Татарстан МБОУ « Средняя общеобразовательная школа № 171 с углубленным изучением
Конкурс цифровых образовательных ресурсов по
химии для учащихся 8– 11 классов
общеобразовательных школ
Направление: Электронные приложения и демонстрационные
материалы
«Электролиз: опыты к заданиям ЕГЭ»
Работу выполнил
Гафиятуллин Рияз, 11 А класс
Руководитель
Рахимова Розалия Хамидовна
Казань – 2014
2. Электролиз
Электролиз-это окислительновосстановительные реакции, протекающие
на электродах, если через раствор или
расплав электролита пропускают
постоянный электрический ток.
3. Что такое электролиз?
Движение ионов в расплаве или в растворе
электролита является беспорядочным,
хаотическим. Но если в раствор или расплав
электролита опустить электроды и пропустить
постоянный электрический ток, то ионы будут
двигаться упорядоченно – к электродам: катионык катоду, анионы – к аноду. На катоде идет процесс
восстановления, катионы принимают электроны.
На аноде – процесс окисления, анионы отдают
электроны. Это явление называется электролизом.
4. Схема электролиза расплава и раствора хлорида натрия
5.
Мнемонические правила
КАТОД
АНОД
5 букв
4 буквы
МИНУС
ПЛЮС
Катод
Катионы
Восстановление
Принимают электроны
Первые буквы – согласные
Анод
Анионы
Окисление
Отдают электроны
Первые буквы – гласные
6. Процесс на катоде
-процесс на катоде не зависит от материала катода, а
зависит от положения металла в электрохимическом ряду
напряжений.
-если катион электролита находится в начале ряда
напряжений ( по Al включительно), то на катоде идет
процесс восстановления воды (выделяется Н 2 ).
-если катион электролита находится в ряду напряжений
между Al иH 2 , то на катоде восстанавливаются
одновременно ионы металла и молекулы воды.
-если катион электролита находится в ряду напряжений
после Н 2 , то на катоде идет только процесс восстановления
ионов металла.
-если в растворе находится смесь катионов разных
металлов, то первым восстанавливается катион того
металла, который имеет наибольшее значение
электродного потенциала.
7. Катодные процессы в водных растворах солей
Электрохимический ряд напряжений металлов
Li K Ca Na Mg Al
Mn Zn Fe
Ni Sn Pb
H2 Cu Hg Ag
Pt Au
Me ne- не
восстанавливается
Мen+ + ne-=
Me0
Mene +ne-=
Me0
2 H2O+ 2e- = H2 + 2OH-
2 H2O+ 2e- =
H2 + 2OH-
8. Процесс на аноде
зависит от материала анода. Аноды
могут быть двух видов растворимые и нерастворимые.
Нерастворимые изготовляют из угля, графита,
платины, иридия. Растворимые – из меди, серебра,
цинка, кадмия, никеля и других металлов.
На нерастворимом аноде в процессе электролиза
происходит окисление анионов или молекул воды .При
этом анионы бескислородных кислот легко
окисляются. Если же раствор содержит анионы
кислородных кислот, то на аноде окисляются не эти
ионы, а молекулы воды.
9. Процесс на аноде
Анод
Кислотный остаток AcmБескислородный
кислородсодержащий
Растворимый
Окисление металла анода
Me0 – ne- = MeneАнод
раствор
Нерастворимый
Окисление аниона В щелочной среде
( кроме фторидов) 4OH -– 4e = 2 H2O + O2
Acm- — me- =Ас
В кислой, нейтральной средах
2 H2O- 4e- =4 H+ + O2
10. Электролиз карбоновых кислот (реакция Кольбе)
Анион карбоновой кислоты окисляется на аноде,
образуя СО2 и свободный алкильный радикал.
Алкильные радикалы димеризуются на
поверхности анода, например:
2CH3COONa + 2H2O →
2NaOH + H2 + 2CO2 + CH3–CH3
или
2CH3COONa + 2H2O →
2NaHCO3 + H2 + CH3–CH3.
11. Количественная характеристика процессов электролиза
Законы Фарадея: масса электролита, подвергшаяся
превращению при электролизе, а также массы,
образующихся на электродах веществ, прямо
пропорциональны
1) количеству электричества, прошедшего через
раствор или расплав электролита;
2) эквивалентны массам соответствующих веществ:
m- масса прореагировавшего вещества, г
I- сила тока, А
τ- время протекания процесса, сек.
F- постоянная Фарадея (96 484 56 Кл/моль)
Э- эквивалентная масса вещества
12. Применение электролиза
Электролиз широко используется в
промышленности для выделения и очистки
металлов, получения щелочей, хлора, водорода.
Алюминий, магний, натрий, кадмий получают
только электролизом.
Важной отраслью применения электролиза
является защита металлов от коррозии: на
поверхность металлических изделий
электрохимическим методом наносят тонкий слой
другого металла, устойчивого к коррозии
13. Проведение электролиза в условиях школьного кабинета химии
При изучении темы «Электролитическая
диссоциация» по заданию учителя были изготовлены
несколько приборов для проверки
электропроводности. Одни из них были использованы
для демонстрации электропроводности обычной
водопроводной воды, а другие — для проведения
электролиза. Оказалось, что очень удобно использовать
такие приборы: можно обойтись минимумом
реактивов, они безопасны, дают возможность показать
процессы электролиза. В качестве графитовых
электродов были использованы стержни карандашей.
14.
Электропроводность
воды мы обнаружили с
помощью более
чувствительного
прибора.
15.
Электролиз раствора
гидроксида натрия.
16.
Электролиз раствора
серной кислоты.
17.
Щелочи, кислородосодержащих кислоты, соли
кислородосодержащих кислот и активных металлов. (K, Na, Ca)
Электролиз раствора NaOH.
NaOH Na +
H2O
+
OHOH-
H+
Анод:
Катод:
2H2O +2e H2↑
4OH— -4e 2H2O +O2
+2OH-
Электролиз раствора H2SO4
H2SO4
H2O
2H +
H+
+
+
SO42OH-
Анод:
Катод:
2H2O +2e H2↑ +2OH-
2H2O -4e O2↑ +4H+
18.
Электролиз раствора
сульфата алюминия .
19.
Электролиз раствора
соляной кислоты.
20.
Электролиз раствора Al2(S04)3
Al2(S04)3 2AL 3+
H2O
2H +
+
3SO42-
+
OH-
Анод:
Катод:
2H2O +2e H2↑ +2OH-
2H2O -4e O2↑ +4H+
2H2O эл.ток 2H2↑+ O2
Электролиз раствор HCl
HCL
H2O
H+
H+
CL
+
+
OHАнод:
Катод:
2H2O +2e H2↑ +2OH2HCL H2↑+CL2↑
2CL- -2e 2CL0
21.
Электролиз раствора
хлорида меди (II)
22.
Выделение меди на
катоде.
23.
Электролиз раствора
сульфата никеля.
24.
Электролиз раствора
сульфата кобальта (III)
25.
Электролиз раствора
сульфата меди (II)
26.
Выделение меди на
катоде.
27.
Электролиз раствора KI
KI
H2O
K+
+
I-
2H +
+
OH-
Анод:
Катод:
2H2O +2e H2↑ +2OH-
2I- -2e I2
2KI+2H2O эл.ток H2↑+ I2 ↑ +2KOH
CuCL2
Cu 2+
H2O
H+
+
+
CLOH-
Катод:
Cu 2+ +2e Cu 0
CuCl2 Cu + Cl2 ↑
Анод:
2CL — -2e CL2
28.
Продукты электролиза водных растворов
электролитов
№
Электролиты
Продукты
электролиза
1.
Щелочи, кислородосодержащих кислоты,
соли кислородосодержащих кислот и
активных металлов. (K, Na, Ca)
H2 и O2 так как
разлагается вода.
2.
Бескислородные кислоты и соли
бескислородных кислот и активных
металлов. . (K, Na, Ca)
H2 и S, галогены и др.
3.
Соли бескислородных кислот и
малоактивных металлов, а также металлов
со средней активностью.(Cu, Hg, Ag, Pt,
Au)
Металлы и галогены, а
при большой
концентрации ионов H
может выделяться и H2
4.
Соли кислородосодержащих кислот и
Металлы и O2, а при
малоактивных металлов, а также металлов большой концентрации
со средней активностью. (Co, Ni, Cr, Sn)
ионов H может
выделяться и H2
29.
Заключение
Теория проверяется практикой
В результате проведенной работы мы убедились в том, что
1. При электролизе растворов щелочей, кислородсодержащих
кислот, солей активных металлов кислородсодержащих кислот
всегда происходит разложение воды и выделение газов: водорода и
кислорода.
2. При электролизе растворов бескислородных кислот на аноде
выделялся галоген ( хлор), а на аноде — водород или металл, если
использовали соль, образованную неактивным металлом, стоящим
после водорода.
3. Электрохимический ряд напряжений металлов, который мы
всегда использовали только теоретически, теперь мы проверили
экспериментально.
4. Для подготовки к сдаче ЕГЭ по химии очень удобно
использовать наш прибор для демонстрации процессов
электролиза
30.
ПРИМЕРЫ ЗАДАНИЯ ЕГЭ, ЧАСТЬ В
Установите соответствие между формулой соли
и продуктом, образующимся на катоде при электролизе её
водного раствора.
ФОРМУЛА СОЛИ
А) Al(NO3)3
Б) KF
В) Cu(NO3)2
Г) FeBr2
ПРОДУКТ НА КАТОДЕ
1) Медь
2) Железо, водород
3) Железо, кислород
4) Водород
5) Калий
6) Алюминий
Ответ. 4412
31.
ПРИМЕРЫ ЗАДАНИЯ ЕГЭ, ЧАСТЬ В
Установите соответствие между названием соли
и продуктом, образующимся на инертном аноде при
электролизе её водного раствора.
НАЗВАНИЕ СОЛИ
А) Бромид алюминия
Б) Сульфат рубидия
В) Нитрат ртути(II)
Г) Хлорид золота
ПРОДУКТ НА АНОДЕ
1) Сl2
2) O2
3) H2
4) Br2
5) SO2
6) NO2
Ответ. 4221
32.
ПРИМЕР ЗАДАНИЯ ЕГЭ, ЧАСТЬ С
С-2. При взаимодействии оксида алюминия с азотной
кислотой образовалась соль, которую высушили и
прокалили. Образовавшийся при прокаливании твердый
остаток подвергли электролизу в расплавленном
криолите. Полученный при электролизе металл нагрели
с концентрированным раствором, содержащим нитрат
калия и гидроксид калия, при этом выделился газ с
резким запахом. Составьте уравнения четырех описанных
реакций.
33.
ОТВЕТ
1. При взаимодействии оксида алюминия с азотной кислотой
образовалась соль:
Al2O3 + 6HNO3 = 2Al(NO3)3 + 3H2O.
2. Соль высушили и прокалили:
4Al(NO3)3 = 2Al2O3 + 12NO2 + 3O2.
3. Образовавшийся при прокаливании твердый остаток
подвергли электролизу в расплавленном криолите:
2Al2O3 ==========
4Al + 3O2.
электролиз
4. Полученный при электролизе металл нагрели с
концентрированным раствором, содержащим нитрат калия и
гидроксид калия, при этом выделился газ с резким запахом
8Al + 3KNO3 + 5KOH + 18H2O = 8K[Al(OH)4] + 3NH3.
34.
ПРИМЕР ЗАДАНИЯ ЕГЭ, ЧАСТЬ С
С-2. Вещество, полученное на аноде при электролизе
раствора йодида натрия с инертными электродами,
прореагировало с сероводородом. Образовавшееся
твердое вещество сплавили с алюминием и продукт
растворили в воде. Составьте уравнения четырех
описанных реакций.
35.
ОТВЕТ
1. Вещество получено на аноде при электролизе раствора йодида
натрия с инертными электродами:
электролиз
2NaI + 2H2O ======== 2NaOH + H2 + I2.
2. Полученное вещество прореагировало с сероводородом:
I2 + H2S = S + 2HI.
3. Образовавшееся твердое вещество сплавили с алюминием:
3S + 2Al = Al2S3.
4. Продукт растворили в воде:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S.
36.
ПРИМЕР ЗАДАНИЯ ЕГЭ, ЧАСТЬ С
С-3. Раствор хлорида железа(III) подвергли электролизу с
графитовыми электродами. Осадок бурого цвета,
образовавшийся в качестве побочного продукта
электролиза, отфильтровали и прокалили. Вещество,
образовавшееся на катоде, растворили в
концентрированной азотной кислоте при нагревании.
Продукт, выделившийся на аноде, пропустили через
горячий раствор гидроксида калия. Составьте уравнения
четырех описанных реакций.
37.
ОТВЕТ
1. Раствор хлорида железа (III) подвергли электролизу
с графитовыми электродами:
электролиз
4FeCl3 + 6H2O ======== 2Fe + 3H2 + 6Cl2 + 2Fe(OH)3.
2. Осадок бурого цвета, образовавшийся в качестве побочного
продукта электролиза, отфильтровали и прокалили:
2Fe(OH)3 = Fe2O3 + 3H2O.
3. Вещество, образовавшееся на катоде, растворили в
концентрированной азотной кислоте при нагревании:
Fe + 6HNO3= Fe(NO3)3 + 3NO2 + 3H2O.
4. Продукт, выделившийся на аноде, пропустили через горячий
раствор гидроксида калия:
3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O.
38.
ПРИМЕР ЗАДАНИЯ ЕГЭ, ЧАСТЬ С
С-3. Осуществите цепочку превращений:
O
CH3 C
NaMnO4 , NaOH
X1
электролиз
раствора
C2 H6
Сl2, hn
H
X2
KOH, H2O
X3
H2SO4 (конц.)
(С2H5)2O
39.
ЗАДАЧИ ХИМИЧЕСКИХ
ОЛИМПИАД
1. При электролизе 16г. расплава некоторого соединения
водорода с одновалентным элементом на аноде
выделился водород количеством вещества 1 моль.
Установите формулу вещества, взятого для электролиза.
40. Решение задач № 1
Решение
II
m(Эл Н)=16г
(H2) = 1моль
Эл Н — ?
По условию, водород выделяется на аноде, значит, его ионы имеют отрицательный заряд,
а искомый элемент имеет положительный заряд. Ясно, что ЭЛН – гидрид.
расплав
1) Mr(ЭлН) = (х + 1) а.е.м
Эл+ +1
H– — 2
Эл0
Н20
2)
2Эл+ + 2Н – 2Эл0 + Н20
3)
Эл Н= Эл1++Н 1–
на катоде : Эл1+
на аноде : H 1–
m=16г ί
=1моль
2ЭлН = 2Эл↓ + Н2↑
расплав 1 моль
2 моль
4)
5) х+1=8
х =7, Аr(Эл)=7, значит Эл – литий
Ответ: ЭлН – LiH, гидрид лития
41. Использованная литература
Г.Е. Рудзитис, Ф.Г. Фельдман «Химия-9», Москва, Просвещение, 2001
Г.Е. Рудзитис, Ф.Г. Фельдман «Химия-11», Москва, Просвещение, 2009
А.К. Ризванов «Химические опыты в познании основ наук» «Химия в
школе», 2007 № 1
Е.Г. Морозова «К изучению электрохимических систем», «Химия в
школе», 2008 №5
Г.И. Штремплер «Химия на досуге», Москва, Просвещение, 1996
В.Н. Алексинский «Занимательные опыты по химии», Москва,
Просвещение, 1995
Г.П. Хомченко «Неорганическая химия», Москва, «Высшая школа», 1987
И.В. Тригубчак «Содержание и методика преподавания темы
«Электролиз», учебно-методический журнал для учителей химии и
естествознания № 7-8(849) him.1september.ru
Результаты ЕГЭ показывают, что задания по теме “Электролиз”
для выпускников остаются сложными. В школьной программе на изучение этой темы
отводится недостаточное количество часов. Поэтому при подготовке школьников к
ЕГЭ необходимо изучить этот вопрос очень подробно. Знание основ электрохимии
поможет выпускнику успешно сдать экзамен и продолжить обучение в высшем учебном
заведении.
Для изучения темы “Электролиз” на достаточном уровне
необходимо провести подготовительную работу с выпускниками, сдающими ЕГЭ:
— рассмотреть определения основных понятий в теме
“Электролиз”;
— анализа процесса электролиза расплавов и растворов
электролитов;
— закрепить правила восстановления катионов на катоде и
окисления анионов на аноде (роль молекул воды во время электролиза растворов);
— формирование умений составлять уравнения процесса
электролиза (катодный и анодный процессы);
— научить учащихся выполнять типовые задания базового уровня
(задачи), повышенного и высокого уровня сложности.
Электролиз – окислительно-восстановительный процесс,
протекающий в растворах и расплавах электролитов при прохождении постоянного
электрического тока. В растворе или расплаве электролита происходит его
диссоциация на ионы. При включении электрического тока ионы приобретают
направленное движение и на поверхности электродов могут происходить
окислительно-восстановительные процессы.
Анод – положительный электрод, на нём идут процессы
окисления.
Катод – отрицательный электрод, на нём идут процессы восстановления.
Электролиз расплавов применяется для получения активных металлов,
расположенных в ряду напряжений до алюминия (включительно).
Электролиз расплава хлорида натрия
К(-) Na+ + 1e —> Na0
A(+) 2Cl— — 2e —> Cl20
2NaCl(эл.ток) —> 2Na + Cl2 (только при электролизе расплава).
Алюминий получают электролизом раствора оксида алюминия в расплавленном
криолите (Na3AlF6).
2Al2O3(эл.ток) —>4Al +3O2
K(-)Al3++3e‾ —>Al
A(+)2O2‾-2e‾ —>O2
Электролиз расплава гидроксида калия .
KOH—>K+ +OH‾
К(-) K+ + 1e —> K0
A(+) 4OH— — 4e —> O20 +2Н2О
4KOH(эл.ток) —> 4K0 + O20 +2Н2О
Электролиз водных растворов протекает сложнее, так как на электродах в этом
случае могут восстанавливаться или окисляться молекулы воды.
Электролиз водных растворов солей более сложен из-за возможного
участия в электродных процессах молекул воды на катоде и на аноде.
Правила электролиза в водных растворах.
На катоде:
1. Катионы, расположенные в ряду напряжений металлов от лития до алюминия
(включительно), а также катионы NН4+ не
восстанавливаются, вместо них восстанавливаются молекулы воды:
2Н2О + 2е —> Н2 + 2ОН—
2. Катионы, расположенные в ряду напряжений после алюминия до водорода, могут
восстанавливаться вместе с молекулами воды:
2Н2О + 2е —> Н2 + 2ОН—
Zn2+ + 2e —> Zn0
3. Катионы, расположенные в ряду напряжений после водорода, полностью
восстанавливаются: Аg+ + 1е —> Аg 0
4. В растворах кислот восстанавливаются ионы водорода: 2Н+ + 2е
—> Н2
На аноде:
1. Кислородосодержащие анионы и F— – не окисляются, вместо
них окисляются молекулы воды:
2Н2О – 4е —> О2 + 4Н+
2.Анионы серы, иода, брома, хлора (в этой последовательности) окисляются
до простых веществ:
2Сl— – 2е —> Сl20 S2-
— 2е —> S 0
3. В растворах щелочей окисляются гидроксид-ионы:
4ОН— — 4е —> О2 + 2Н2О
4. В растворах солей карбоновых кислот окисляются анионы:
2 R — СОО— — 2е —> R — R + 2СО2
5. При использовании растворимых анодов электроны во внешнюю цепь посылает сам
анод за счёт окисления атомов металла, из которого сделан анод:
Сu0 — 2е —> Сu2+
Примеры процессам электролиза в водных растворах электролитов
Пример 1. K2 SO4—> 2K+ + SO42-
K(-)2H2O + 2e‾ —> H2 + 2OH—
A(+)2H2O – 4e‾ —> O2 + 4H+
Общее уравнение электролиза: 2H2O(эл.ток) —>2 H2 + O2
Пример 2. NaCl —>Na+ +Cl‾
K(-)2H2O + 2e‾ —> H2 + 2OH—
A(+) 2Cl— — 2e —> Cl20
2NaCl +2H2O(эл.ток ) —> H2 + 2NaOH + Cl2
Пример 3. Cu SO4 —> Cu2+ + SO42-
K(-) Cu2+ + 2e‾ —> Cu
A(+)2H2O – 4e‾ —> O2 + 4H+
Общее уравнение электролиза: 2 Cu SO4+ 2H2O(эл. ток )
—>2Cu + O2 + 2H2 SO4
Пример 4. CH3COONa—>CH3COO‾ +Na+
K(-)2H2O + 2e‾ —> H2 + 2OH—
A(+)2CH3COO‾– 2e‾ —>C2H6 +2CO2
Общее уравнение электролиза:
CH3COONa+2H2O(эл.ток) —> H2 + 2NaHCO3+C2H6
Задания базового уровня сложности
Тест по теме “Электролиз расплавов и растворов солей. Ряд
напряжений металлов”.
1. Щёлочь – один из продуктов электролиза в водном растворе:
1) KCI 2) CuSO4 3) FeCI2 4) AgNO3
2. При электролизе водного раствора нитрата калия на аноде выделяется:
1) О2 2) NO2 3) N2 4) Н2
3. Водород образуется при электролизе водного раствора:
1) CaCI2 2) CuSO4 3)Hg(NO3)2
4) AgNO3
4. Реакция возможна между:
1) Ag и K2SO4 (р-р) 2) Zn и KCI(р-р) 3) Mg и SnCI2(р-р)
4) Ag и CuSO4(р-р)
5. При электролизе раствора иодида натрия у катода окраска лакмуса в растворе:
1) красная 2) синяя 3) фиолетовая 4) жёлтая
6. При электролизе водного раствора фторида калия на катоде выделяется:
1) водород 2) фтороводород 3) фтор 4) кислород
Задачи по теме “Электролиз”
1. Электролиз 400 г 20 %-ого раствора поваренной соли был остановлен, когда
на катоде выделилось 11,2 л (н.у.) газа. Степень разложения исходной соли (в %)
составляет:
1) 73 2) 54,8 3) 36,8 4) 18
Решение задачи.
Составляем уравнение реакции электролиза:
2NaCl + 2H2O→H2↑ +Cl2↑
+2NaOH
m(NaCl)=400∙0,2=80 г соли было в растворе.
ν(H2)=11,2/22,4=0,5 моль ν(NaCl)=0,5∙2=1 моль
m(NaCl)= 1∙58,5=58,5 г соли было разложено во время
электролиза.
Степень разложения соли 58,5/80=0,73 или 73%.
Ответ: 73% соли разложилось.
2. Провели электролиз 200 г 10 %-ого раствора сульфата хрома (III) до полного
расходования соли (на катоде выделяется металл). Масса (в граммах)
израсходованной воды составляет:
1) 0,92 2) 1,38 3) 2,76 4) 5,52
Решение задачи.
Составляем уравнение реакции электролиза:
2Cr2(SO4)3 +6H2O→4Cr
+3O2↑ +6H2SO4
m(Cr2(SO4)3)=200∙0,1=20г
ν(Cr2(SO4)3)=20/392=0,051моль
ν(H2O)=0,051∙3=0,153 моль
m(H2O)= 0,153∙18=2,76 г
Задания повышенного уровня сложности В3
1. Установите соответствие между формулой соли и уравнением процесса,
протекающего на аноде при электролизе её водного раствора.
| ФОРМУЛА СОЛИ
А) KCl Б) AlBr3 В) CuSO4 Г) AgNO3 |
УРАВНЕНИЕ АНОДНОГО ПРОЦЕССА 1) 2H2O – 4e → O2 + 4H+ 2) 2H2O + 2e → H2 + 2OH— 3) 2Cl— -2e → Cl20 4) 2Br— — 2e → Br20 5) 2SO42- -2e → S2O82- 6) 2NO3— -2e → 2NO2 + O2 |
2. Установите соответствие между формулой соли и продуктом, образующимся на
инертном аноде при электролизе её водного раствора.
| ФОРМУЛА СОЛИ
А) RbSO4 Б) CH3COOK В) BaBr2 Г) CuSO4 |
ПРОДУКТ, ОБРАЗУЮЩИЙСЯ НА АНОДЕ
1) метан 2) сернистый газ 3) кислород 4) водород 5) бром 6) этан и углекислый газ |
3. Установите соответствие между формулой соли и уравнением процесса,
протекающего на катоде при электролизе её водного раствора.
| ФОРМУЛА СОЛИ
А) Al(NO3)3 Б) CuCl2 В) Г) Cu(NO3)2 |
УРАВНЕНИЕ КАТОДНОГО ПРОЦЕССА
1) 2 ) 2H2O + 2e → H2 + 2OH— 3) Cu2+ + 2e → Cu0 4) Cu2+ + 1e → Cu+ 5) Sb3+ +3e→ Sb0 |
4. Установите соответствие между названием вещества и способом его
получения.
| НАЗВАНИЕ ВЕЩЕСТВА А) литий Б) фтор В) серебро Г) магний |
ПОЛУЧЕНИЕ ЭЛЕКТРОЛИЗОМ
1) 2) расплава LiF 3) раствора MgCl2 4) раствора AgNO3 5) расплава Ag2O 6) расплава MgCl2 |
5. Установите соответствие между названием вещества и продуктами
электролиза его водного раствора.
| НАЗВАНИЕ ВЕЩЕСТВА
А) бромид Б) сульфат меди (II) В) бромид меди (II) |
ПРОДУКТЫ ЭЛЕКТРОЛИЗА
1) водород, бром, гидроксид калия 2) натрий, углекислый газ 3) медь, оксид серы (IV) 4) медь, кислород, серная кислота 5) медь, бром |
Ответы: 1 — 3411, 2 — 3653, 3 — 2353, 4 — 2246,
5 — 145 .
Таким образом, изучая тему электролиза, выпускники хорошо
усваивают этот раздел и показывают хорошие результаты на экзамене. Изучение
материала сопровождается презентацией по данной теме.
Электролиз расплавов и растворов
Подготовил:
Учитель химии МБОУ Некрасовской СОШ
Вялова А.А.
Электролиз – это окислительно — восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплав или раствор электролита.
Электроды
Катод К(-)
Анод А(+)
окисление анионов и гидроксид-ионов
восстановление катионов и
ионов водорода
Катод -это отрицательно — заряженный электрод
Анод – это положительно- заряженный электрод
Процесс на катоде
- Если в растворе ионы Н+ — они разряжаются до Н2
Металлы правее Н:
Разряжаются на катоде — Ме
Металлы от Al до Н:
Восстанавливаются молекулы воды – Н2
Металлы левее Al :
Идет 2 параллельных процесса:
А) разрядка металла – Мe
Б) разрядка воды – Н2
2H2O + 2e- → H20↑+ 2OH-
Men+ + ne- → Me0
2H2O + 2e- → H20↑+ 2OH-
Men+ + ne- → Me0
Процесс на аноде
если анод растворяется (железо, цинк, медь, серебро и все металлы, которые окисляются в процессе электролиза), то окисляется металл анода, несмотря на природу аниона;
Анионы бескислородных кислот (кроме F-)
Разряжаются до простого вещества: S2-, I-, Br-, СI-
Анионы кислородсодержащих кислот и F-
Не разряжаются,
идет разрядка воды – О2
2 H2O — 4e- → О20↑ + 4H+
2Hal- -2e- → Cl02↑
4ОН- — 4e- → О20↑ + 2Н2О
Если анод не растворяется (его называют инертным — графит, золото, платина)
Анионы карбоновых кислот – реакция Кольбе
Происходит процесс декарбоксилирования и выделяется алкан
2СН3СОО- — 2е- → 2 СО2 + СН3-СН3
1. Анод нерастворимый (например, графитовый)
Суммарное уравнение:
Учитывая присутствие ионов Na в растворе:
Пример №1.
Суммарное ионное уравнение:
Суммарное молекулярное уравнение:
Пример №2.
2. Анод растворимый (например, медный)
Если анод растворимый, то металл анода будет окисляться:
Катионы Cu2+ в ряду напряжений стоят после (Н+), поэтому они и будут восстанавливаться на катоде.
Проверь себя…
Задания на электролиз
При электролизе водного раствора хлорида лития (LiCL) на аноде в результате электролиза образуется:
1) хлор
2) литий
3) кислород
4) водород
Задание 1
|
ФОРМУЛА СОЛИ |
ПРОДУКТ НА КАТОДЕ |
|
|
А) CuCl2 Б) AgNO3 В) K2S Г) NaBr |
1) водород 2) кислород 3) металл 4) галоген 5) сера 6) азот |
Установите соответствие между формулой соли и продуктом,
образующимся на катоде при электролизе её водного раствора:
к каждой позиции, обозначенной буквой, подберите
соответствующую позицию, обозначенную цифрой.
Ответ: 3311
При электролизе водного раствора хлорида лития (LiCL) на аноде в результате электролиза образуется:
1) хлор
2) литий
3) кислород
4) водород
Задание 2
|
ФОРМУЛА СОЛИ |
ПРОДУКТ НА АНОДЕ |
|
|
A) Na2SO4 Б) Ca(NO3)2 B) ZnBr2 Г) CuCl2 |
1) SO2 2) O2 3) NO2 4) Br2 5) Cl2 6) H2 |
Установите соответствие между формулой соли и продуктом,
который образуется на инертном аноде в результате электролиза
её водного раствора: к каждой позиции, обозначенной буквой,
подберите соответствующую позицию, обозначенную цифрой.
Ответ: 2245
Задание 3
|
ФОРМУЛА СОЛИ |
ПРОДУКТ НА КАТОДЕ |
|
|
А) RbCl Б) K2CO3 В) BaBr2 Г) Cu(NO3)2 |
1) хлороводород 2) оксид азота(IV) 3) кислород 4) хлор 5) бром 6) углекислый газ |
Установите соответствие между формулой соли и продуктом,
образующимся на катоде при электролизе её водного раствора:
к каждой позиции, обозначенной буквой, подберите
соответствующую позицию, обозначенную цифрой.
Ответ: 4353
Задание 4
|
ФОРМУЛА СОЛИ |
ПРОДУКТ НА КАТОДЕ |
|
|
А) Б) В) Al2(SO4)3 Г) AgNO3 |
1) серебро 2) алюминий 3) медь 4) кальций 5) водород 6) кислород |
Установите соответствие между формулой соли и продуктом,
образующимся на катоде при электролизе её водного раствора:
к каждой позиции, обозначенной буквой, подберите
соответствующую позицию, обозначенную цифрой.
Ca(NO3)2
CuSO4
Ответ: 5351
Задание 5
Ответ: 3154
|
ВЕЩЕСТВО |
ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
|
|
А) Б) NaCl (расплав) В) KNO3(водный раствор) Г) Cu(NO3)2 (водный раствор) |
1) 2) K , NO2, O2 3) H2, Cl2, KOH 4) Cu, O2, HNO3 5) H2, O2 6) Cu, NO2, H2 |
Установите соответствие между веществом и продуктами
его электролиза в растворе или расплаве: к каждой позиции,
обозначенной буквой, подберите соответствующую позицию,
обозначенную цифрой.
KCl (водный раствор) Na, Cl2
Задание 6
Вычислите объём в литрах газа, выделяющегося на аноде при электролизе водного раствора гидроксида кальция с инертными электродами, если на катоде выделился газ объемом 67,2 л (при н.у.).
1) 16,8; 2) 11,2; 3) 33,6; 4) 5,6.
Решение:
Электролиз водного раствора гидроксида кальция с инертными электродами:
Катодный процесс К(-) будет: 2Н+ + 2е— → Н2;
Анодный процесс A(+) будет: 2H2O — 4 е— → O2 + 4Н+;
Процесс электролиза сводится к разложению воды:
2H2O(электролиз) → 2H2↑ + O2↑.
n(H2) = 67,2/22,4 = 3 моль;
n(O2) = n(H2)/2 = 3/2 = 1,5 моль;
V(O2) = 22,4 ⃰1,5 = 33,6 л.
Задание 7
Какая масса (в граммах) гидроксида лития образуется в растворе при электролизе водного раствора хлорида лития с инертными электродами с инертными электродами, если на аноде выделяется 10,08 л газа (н.у.)?
1) 24; 2) 46; 3) 19; 4) 21,6.
Решение:
Электролиз водного раствора хлорида лития с инертными электродами:
Катодный процесс К(-) будет: 2Н+ + 2е— → Н2;
Анодный процесс A(+) будет: 2Cl— — 2е— → Cl2;
Cуммарный процесс электролиза:
2LiCl + 2H2O (электролиз) → H2↑ + Cl2↑ + 2LiOH.
n(Cl2) = 10,08/22,4 = 0,45 моль;
n(LiOH) = 2n(Cl2) = 0,45 ⃰0,45 = 0,9 моль;
М(LiOH) = 24 г/моль;
m(LiOH) = 24 ⃰0,9 = 21,6 г.
Задание 8
Какая масса газа выделится на аноде (в граммах) при полном электролизе 320 г 10 %-го водного раствора сульфата меди?
1) 3,2; 2) 12,8; 3) 19,2; 4) 25,6.
Решение:
Электролиз водного раствора сульфата меди с инертными электродами:
Катодный процесс К(-) будет: Cu2+ + 2е— → Cu;
Анодный процесс A(+) будет: 2H2O — 4 е— → O2 + 4Н+;
Cуммарный процесс электролиза:
2CuSO4 + 2H2O (электролиз) → 2Cu + O2↑ + 2H2SO4.
m(CuSO4) = 320 ⃰10/100 = 32 г;
М(CuSO4) = 160 г/моль;
n(CuSO4) = 32/160 = 0,2 моль;
n(O2) = n(CuSO4)/2 = 0,1 моль;
М(O2) = 32 г/моль;
m(O2) = 0,1 ⃰32 = 3,2 г.
Слайд 2ЭЛЕКТРОЛИТИЧЕСКАЯ ВАННА.
Катод (-)
Анод (+)
Восстановление
Окисление
Электроды
Слайд 3Электролиз.
Электролиз – окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного
электрического тока через расплав или раствор электролита.
Электролиты: соли, щёлочи, кислоты.

Слайд 4Электролиз расплавов
Расплав KOH = K+ + OH–
(–) Катод: K+ + 1ē
= Ko 4
(+) Анод: 4OH– – 4ē = O2↑+ 2H2O 1
4K++ 4OH– = O2↑ + 2H2O↑+ 4K
электролиз
4KOH → 4K + O2↑ + 2H2O↑
Электролиз расплавов

Слайд 5Электролиз расплавов
Расплав KCl = K+ + Cl–
(–) Катод: K+ + 1ē
= Ko 2
(+) Анод: 2Cl– – 2ē = Cl2↑ 1
электролиз
2KCl → 2K + Cl2↑
Электролиз расплавов

Слайд 6Электролиз Al2O3
Расплав Al2O3 в Na3AlF6 (криолит)
(–) Катод ← Al3+
AlO33- → (+) Анод
(–) Катод: Al3+ + 3ē = Al0
(+) Анод: 4AlO33-– 12ē = 2Al2O3 + 3O2↑
2Al2O3 = 4Al +3O2

Слайд 7Процессы на катоде
Катионы активных металлов:
Li+, Cs+, Rb+, K+, Ba2+, Ca2+, Na+,
Mg2+, Al3+, NH4+
Металлы не восстанавливаются, а восстанавливаются молекулы H2O:
2H2O + 2ē = H2↑ + 2OH–

Слайд 8Процессы на катоде
Катионы металлов средней активности
Mn2+, Zn2+, Cr3+, Fe2+, Co2+, Ni2+,Sn2+,Pb2+
Катионы
металлов восстанавливаются совместно с молекулами воды:
Men++ nē = Meo
2H2O + 2ē = H2↑+ 2OH–

Слайд 9Процессы на катоде
Катионы водородаH+
Ионы H+ восстанавливаются только при
электролизе растворов кислот:
2H++ 2ē = H2↑

Слайд 10Процессы на катоде
Катионы малоактивных металлов:
Cu2+, Hg2+, Ag+, Pt2+, Au3+
Восстанавливаются
только катионы металлов:
Men++nē = Meo

Слайд 11Процессы на аноде
1) Анионы бескислородных кислот:
I–, Br–, S2–, Cl–
Окисляются кислотные
остатки
Am– – mē = Ao
2) Анионы OH–
Окисляются только при электролизе растворов щёлочей
4OH– – 4ē = O2↑+ 2H2O

Слайд 12Процессы на аноде
3) Анионы кислородсодержащих кислот:
SO42–, NO3–, CO32–, PO43–
Окисляются молекулы воды:
2H2O – 4ē =O2↑+ 4H+
4) Анионы F–
Окисляются только молекулы воды
2H2O – 4ē = O2↑ + 4H+

Слайд 13Если анод растворимый
Анод растворимый (активный), изготовлен из Cu, Ag, Zn, Ni,
Fe и др. металлы. Анионы не окисляются. Окисляется сам анод:
Мео – nē = Men+
Катионы Men+ переходят в раствор. Масса анода уменьшается.

Слайд 14Электролиз раствора NaCl
Раствор NaCl
(–) Катод ← Na+ Cl– →
(+) Анод
H2O H2O
(–) Катод: 2H2O + 2ē = H2↑+ 2OH–
(+) Анод: 2Cl– – 2ē = Cl2↑
2H2O + 2Cl– = H2↑ + Cl2↑ + 2OH–
2H2O+2NaCl=H2↑+Cl2↑+ 2NaOH

Слайд 15Электролиз раствора ZnSO4
Раствор ZnSO4
(–) Катод ← Zn2+ SO42- → (+)
Анод
H2O H2O
(–) Катод: 2H2O + 2ē = H2↑+ 2OH–
Zn2+ + 2ē = Zn0
(+) Анод: 2H2O — 4ē = O2↑+ 4H+
Zn2+ + 2H2O = Zn0 +H2↑ + O2↑ + 2H+
ZnSO4 + 2H2O = Zn+H2↑+O2↑+ H2SO4

Слайд 16Электролиз раствора CuSO4
Раствор CuSO4
(–) Катод ← Cu2+ SO42- → (+)
Анод
H2O H2O
(–) Катод: Cu2+ + 2ē = Cu0
(+) Анод: 2H2O — 4ē = O2↑+ 4H+
Cu2+ + 2H2O = 2Cu0 + O2↑+ 4H+
2CuSO4 + 2H2O = 2Cu+ O2↑+ 2H2SO4

Слайд 17Электролиз раствора NaOH
Раствор NaOH
(–) Катод ← Na+ OH– →
(+) Анод
H2O H2O
(–) Катод: 2H2O + 2ē = H2↑+ 2OH–
(+) Анод: 4OH- — 4ē = 2H2O↑+ O2↑
4H2O + 4OH– = 2H2↑ + O2↑ + 4OH– + 2H2O
2H2O = 2H2↑+O2↑

Слайд 18Если анод растворимый
Анод растворимый.
Электролиз раствора AgNO3
(анод растворимый – из Ag)
(–)
Катод: Ag+ + 1ē = Ago
(+) Анод: Ago – 1ē = Ag+
Ago + Ag+ = Ag+ + Ago
Электролиз сводится к переносу серебра с анода на катод.

Слайд 20Электролиз органических солей
(–) Катод ← Na+ СН3СОO– → (+) Анод
H2O H2O
(–) Катод: 2H2O + 2ē = H2↑+ 2OH–
(+) Анод: 2СН3СОO — 2ē = С2Н6 + 2СO2↑
электролиз
2СН3СОONa + 2H2O→ C2H6+2CO2↑ +
+2NaOH +H2
Анод: для орг. в-в ( 2RСОО- — 2е = 2СО2 + R – R)
Катод: (кислая среда 2Н+ + 2е = Н2)
Слайд 21Применение электролиза.
Для получения щёлочных, щёлочноземельных металлов, алюминия, лантаноидов
Для получения точных металлических
копий, что называется гальванопластикой
Для защиты металлических изделий от коррозии и для придания декоративного вида. Отрасль прикладной электрохимии, которая занимается покрытием металлических изделий другими металлами называется ГАЛЬВАНОСТЕГИЕЙ.

Слайд 22Законы электролиза.
Законы Фарадея.
Масса веществ, выделившегося на электроде при электролизе, пропорциональна количеству
электричества, прошедшее через электролит:
где , m–масса веществ продуктов электролиза, гр.
Э – эквивалентная масса вещества, гр.
I – сила тока, А.
F – постоянная Фарадея = 96500 Кл.
t – время электролиза, сек.

Слайд 23Эквивалентная масса (молярная масса эквивалента вещества) mэкв является одной из важнейших характеристик
вещества.
По определению эквивалент вещества — это такое количество химического вещества, которая реагирует с 1 г водорода или вытесняет такое же количество водорода из его соединений.
Величина mэкв определяется или экспериментально, или, чаще всего, исходя из химической формулы вещества и его принадлежности к тому или иному классу химических соединений

Слайд 24mэкв(оксида) = Моксида/(число атомов кислорода·2);
mэкв(основания) = Моснования/кислотность основания;
mэкв(кислоты) = Мкислоты/основность кислоты;
mэкв(соли)
= Мсоли/(число атомов металла·валентность металла).
кислотность основания равна числу гидроксильных групп в формуле основания, а основность кислоты равна числу атомов водорода в формуле кислоты.
Например:
mэкв(Fe2O3) = М(Fe2O3)/(3·2) = 160/6 = 26,7 г/моль;
mэкв(H2SO4) = M(H2SO4)/2 = 98/2 = 49 г/моль;
mэкв(Ca(OH)2) = M(Ca(OH)2)/2 = 74/2 = 37 г/моль;
mэкв(Al2(SO4)3) = M(Al2(SO4)3) = 342/2 = 171 г/моль;

Слайд 25При электролизе раствора хлорида натрия получили раствор, содержащий 20г гидроксида натрия.
Газ, выделившийся на аноде в ходе электролиза, пропустили через 665мл 10%-ного водного раствора иодида калия (ρ=1,1 г/мл). Какова масса образовавшегося при этом осадка?