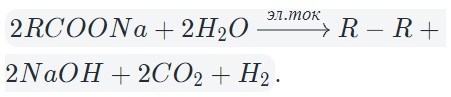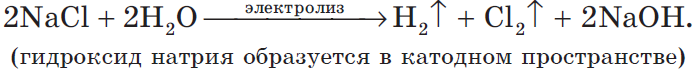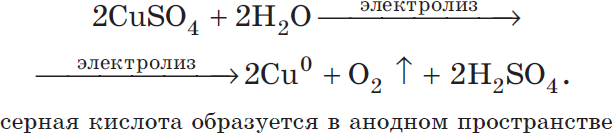Электролиз (греч. elektron — янтарь + lysis — разложение) — химическая реакция, происходящая при прохождении постоянного тока через
электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно
заряженных ионов (анионов) к аноду (заряжен положительно).

Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания
по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
К катоду притягиваются катионы — положительно заряженные ионы: Na+, K+, Cu2+, Fe3+,
Ag+ и т.д.
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом
ряду напряжений металлов.

Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней
активности (Cr, Fe, Cd) — на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы
до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды — выделяется водород.
В случае, если на катод поступают ионы водорода — H+ (например при электролизе кислот HCl, H2SO4) восстанавливается
водород из молекул кислоты: 2H+ — 2e = H2
Анод
К аноду притягиваются анионы — отрицательно заряженные ионы: SO42-, PO43-, Cl—, Br—,
I—, F—, S2-, CH3COO—.

При электролизе кислородсодержащих анионов: SO42-, PO43- — на аноде окисляются не анионы, а молекулы
воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор — если он
попадает анод, то разряжается молекула воды и выделяется кислород. Фтор — самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO)
превращается в углекислый газ — CO2.
Примеры решения
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом
активности металлов.

Теперь вы точно будете знать, что выделяется на катоде 
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3,
NaF, FeI2, CH3COOLi.

Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде,
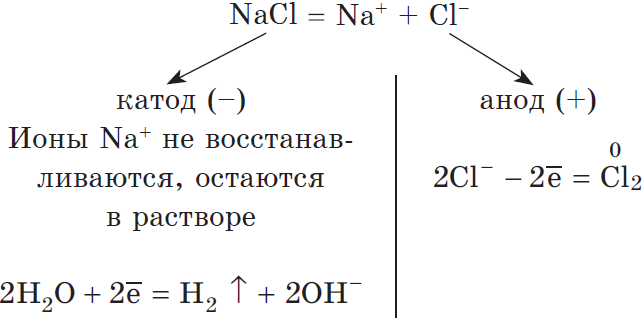
то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H2O → H2 + Cl2 + NaOH (обычно в продуктах оставляют именно запись «NaOH», не подвергая его дальнейшему электролизу)
Натрий — активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген — хлор. Мы пишем уравнение, так
что не можем заставить натрий испариться бесследно 
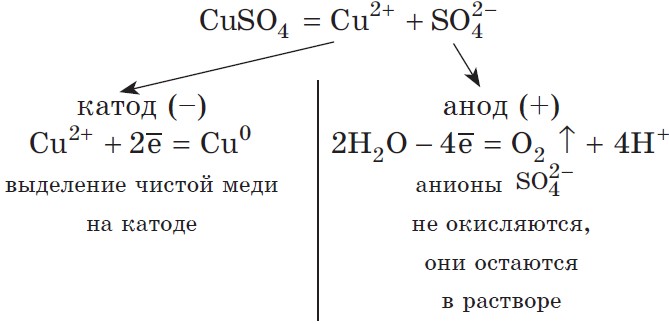
Запишем реакцию электролиза для CuSO4:
CuSO4 + H2O → Cu + O2 + H2SO4
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется
кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача — получить металлы (вещества) в чистом виде. Малоактивные металлы (Ag, Cu) можно легко получать
методом электролиза растворов.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются
молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.

В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
AlCl3 → Al + Cl2
LiBr → Li + Br2
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Тренировочные тесты в формате ЕГЭ по теме «Электролиз» (задание 20 ЕГЭ по химии) ( с ответами)
Электролиз
Химические реакции, сопровождающиеся переносом электронов (окислительно-восстановительные реакции) делятся на два типа: реакции, протекающие самопроизвольно и реакции, протекающие при прохождении тока через раствор или расплав электролита.
Раствор или расплав электролита помещают в специальную емкость — электролитическую ванну.
Электрический ток — это упорядоченное движение заряженных частиц — ионов, электронов и др. под действием внешнего электрического поля. Электрическое поле в растворе или расплаве электролита создают электроды.
Электроды — это, как правило, стержни из материала, проводящего электрический ток. Их помещают в раствор или расплав электролита, и подключают к электрической цепи с источником питания.
При этом отрицательно заряженный электрод катод — притягивает положительно заряженные ионы — катионы. Положительно заряженный электрод (анод) притягивает отрицательно заряженные частицы (анионы). Катод выступает в качестве восстановителя, а анод — в качестве окислителя.
Различают электролиз с активными и инертными электродами. Активные (растворимые) электроды подвергаются химическим превращениям в процессе электролиза. Обычно их изготавливают из меди, никеля и других металлов. Инертные (нерастворимые) электроды химическим превращениям не подвергаются. Их изготавливают из неактивных металлов, например, платины, или графита.
Электролиз растворов
Различают электролиз раствора или расплава химического вещества. В растворе присутствует дополнительное химическое вещество — вода, которая может принимать участие в окислительно-восстановительных реакциях.
Катодные процессы
В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей. Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электро-химический ряд напряжений:
Каждый металл характеризуется значением электрохимического потен-циала. Чем меньше потенциал, тем больше восстановительные свойства металла и тем меньше окислительные свойства соответствующего иона этого металла. Разным ионам соответствуют разные значения этого потенциала. Электрохимический потенциал — относительная величина. Электрохимический потенциал водорода принят равным нулю.
Также около катода находятся молекулы воды Н2О. В составе воды есть окислитель — ион H+.
При электролизе растворов солей на катоде наблюдаются следующие закономерности:
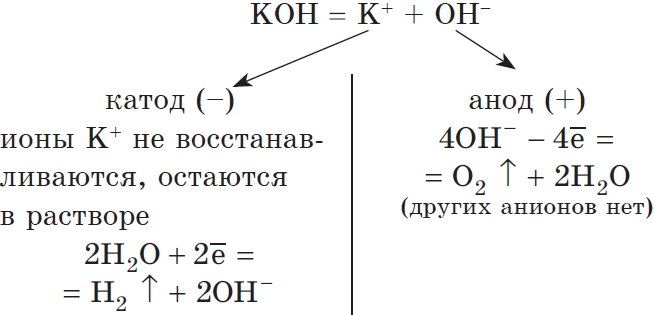
1. Если металл в соли — активный (до Al3+ включительно в ряду напряжений), то вместо металла на катоде восстанавливается (разряжается) водород, т.к. потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы OH—, среда возле катода — щелочная:
2H2O +2ē → H2 + 2OH—
Например, при электролизе раствора хлорида натрия на катоде будет вос-станавливаться только водород из воды.
2. Если металл в соли – средней активности (между Al3+ и Н+), то на катоде восстанавливается (разряжается) и металл, и водород, так как потенциал таких металлов сравним с потенциалом водорода:
Men+ + nē → Me0
2H+2O +2ē → H20 + 2OH—
Например, при электролизе раствора сульфата железа (II) на катоде будет восстанавливаться (разряжаться) и железо, и водород:
Fe2+ + 2ē → Fe0
2H+2O +2ē → H20 + 2OH—
3. Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов), то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только металл:
Men+ + nē → Me0
Например, при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь:
Cu2+ + 2ē → Cu0
4. Если на катод попадают катионы водорода H+, то они и восстанавливаются до молекулярного водорода:
2H+ + 2ē → H20
Анодные процессы
Положительно заряженный анод притягивает анионы и молекулы воды. Анод – окислитель. В качестве восстановителей выступаю либо анионы кислотных остаток, либо молекулы воды (за счет кислорода в степени окисления -2: H2O-2).
При электролизе растворов солей на аноде наблюдаются следующие закономерности:
1. Если на анод попадает бескислородный кислотный остаток, то он окисляется до свободного состояния (до степени окисления 0):
неМеn- – nē = неМе0
Например: при электролизе раствора хлорида натрия на аноде окисляют-ся хлорид-ионы:
2Cl— – 2ē = Cl20
Действительно, если вспомнить Периодический закон: при увеличении электроотрицательности неметалла его восстановительные свойства уменьшаются. А кислород – второй по величине электроотрицательности элемент. Таким образом, проще окислить практически любой неметалл, а не кислород. Правда, есть одно исключение. Наверное, вы уже догадались. Конечно же, это фтор. Ведь электроотрицательность фтора больше, чем у кислорода. Таким образом, при электролизе растворов фторидов окисляться будут именно молекулы воды, а не фторид-ионы:
2H2O-2 – 4ē → O20+ 4H+
2. Если на анод попадает кислородсодержащий кислотный остаток, либо фторид-ион, то окислению подвергается вода с выделением молекулярно-го кислорода:
2H2O-2 – 4ē → O20 + 4H+
3. Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного кислорода:
4O-2H– – 4ē → O20 + 2H2O
4. При электролизе растворов солей карбоновых кислот окислению под-вергается атом углерода карбоксильной группы, выделяется углекислый газ и соответствующий алкан.
Например, при электролизе растворов ацетатов выделяется углекислый газ и этан:
2CH3C+3OO– –2ē → 2C+4O2+ CH3-CH3
Суммарные процессы электролиза
Рассмотрим электролиз растворов различных солей.
Например, электролиз раствора сульфата меди. На катоде восстанавливаются ионы меди:
Катод (–): Cu2+ + 2ē → Cu0
На аноде окисляются молекулы воды:
Анод (+): 2H2O-2 – 4ē → O2 + 4H+
Сульфат-ионы в процессе не участвуют. Мы их запишем в итоговом уравнении с ионами водорода в виде серной кислоты:
2Cu2+SO4 + 2H2O-2 → 2Cu0 + 2H2SO4 + O20
Электролиз раствора хлорида натрия выглядит так:
На катоде восстанавливается водород:
Катод (–): 2H+2O +2ē → H20 + 2OH–
На аноде окисляются хлорид-ионы:
Анод (+): 2Cl– – 2ē → Cl20
Ионы натрия в процессе электролиза не участвуют. Мы записываем их с гидроксид-анионами в суммарном уравнении электролиза раствора хлорида натрия:
2H+2O +2NaCl– → H20 + 2NaOH + Cl20
Следующий пример: электролиз водного раствора карбоната калия.
На катоде восстанавливается водород из воды:
Катод (–): 2H+2O +2ē → H20 + 2OH–
На аноде окисляются молекулы воды до молекулярного кислорода:
Анод (+): 2H2O-2 – 4ē → O20 + 4H+
Таким образом, при электролизе раствора карбоната калия ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
2H2+O-2 → 2H20 + O20
Еще один пример: электролиз водного раствора хлорида меди (II).
На катоде восстанавливается медь:
Катод (–): Cu2+ + 2ē → Cu0
На аноде окисляются хлорид-ионы до молекулярного хлора:
Анод (+): 2Cl– – 2ē → Cl20
Таким образом, при электролизе раствора карбоната калия происходит электролиз воды:
Cu2+Cl2– → Cu0 + Cl20
Еще несколько примеров: электролиз раствора гидроксида натрия.
На катоде восстанавливается водород из воды:
Катод (–): 2H+2O +2ē → H20 + 2OH–
На аноде окисляются гидроксид-ионы до молекулярного кислорода:
Анод (+): 4O-2H– – 4ē → O20 + 2H2O
Таким образом, при электролизе раствора гидроксида натрия происходит разложение воды, катионы натрия в процессе не участвуют:
2H2+O-2 → 2H20 + O20
Электролиз расплавов
При электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет.
Например: электролиз расплава хлорида натрия. На катоде восстанавливаются катионы натрия:
Катод (–): Na+ + ē → Na0
На аноде окисляются анионы хлора:
Анод (+): 2Cl– – 2ē → Cl20
Суммарное уравнение электролиза расплава хлорида натрия:
2Na+Cl– → 2Na0 + Cl20
Еще один пример: электролиз расплава гидроксида натрия. На катоде восстанавливаются катионы натрия:
Катод (–): Na+ + ē → Na0
На аноде окисляются гидроксид-ионы:
Анод (+): 4OH– – 4ē → O20 + 2H2O
Суммарное уравнение электролиза расплава гидроксида натрия:
4Na+OH– → 4Na0 + O20 + 2H2O
Многие металлы получают в промышленности электролизом расплавов.
Например, алюминий получают электролизом раствора оксида алюминия в расплаве криолита. Криолит – Na3[AlF6] плавится при более низкой температуре (1100оС), чем оксид алюминия (2050оС). А оксид алюминия отлично растворяется в расплавленном криолите.
В растворе криолите оксид алюминия диссоциирует на ионы:
Al2O3 = Al3+ + AlO33-
На катоде восстанавливаются катионы алюминия:
Катод (–): Al3+ + 3ē → Al0
На аноде окисляются алюминат-ионы:
Анод (+): 4AlO33– – 12ē → 2Al2O3 + 3O20
Общее уравнение электролиза раствора оксида алюминия в расплаве криолита:
2Al2О3 = 4Al0 + 3О20
В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
C0 + О20 = C+4O2-2
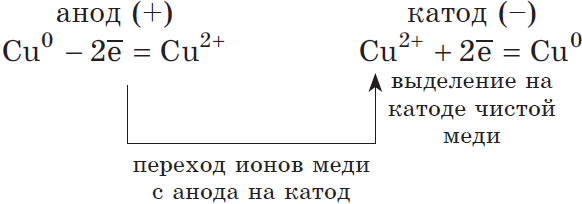
Электролиз с растворимыми электродами
Если материал электродов выполнен из того же металла, который присутствует в растворе в виде соли, или из более активного металла, то на аноде разряжаются не молекулы воды или анионы, а окисляются частицы самого металла в составе электрода.
Например, рассмотрим электролиз раствора сульфата меди (II) с медными электродами.
На катоде разряжаются ионы меди из раствора:
Катод (–): Cu2+ + 2ē → Cu0
На аноде окисляются частицы меди из электрода:
Анод (+): Cu0 – 2ē → Cu2+
Тренировочные тесты в формате ЕГЭ по теме «Электролиз» (задание 20 ЕГЭ по химии) ( с ответами)
201
Создан на
11 января, 2022 От Admin
Электролиз
Тренажер задания 20 ЕГЭ по химии
1 / 10
Установите соответствие между формулой вещества и продуктами электролиза водного раствора этого вещества, которые образовались на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
|
А) Na2S Б) К2SO4 В) СuSO4 Г) Cu(NO3)2 |
1) Н2, O2 2) Сu, O2 3) Н2, S 4) Сu, S 5) Н2, NO2 |
2 / 10
Установите соответствие между веществом и способом его электролитического получения.
К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ВЕЩЕСТВО |
ПОЛУЧЕНИЕ ЭЛЕКТРОЛИЗОМ |
|
А) калий Б) фтор В) алюминий Г) водород |
1) расплава KF 2) водного раствора AgF 3) водного раствора Al2(SO4)3 4) водного раствора CuCl2 5) раствора Al2O3 в расплавленном криолите 6) водного раствора AgNO3 |
3 / 10
Установите соответствие между металлом и способом его электролитического получения.
К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
НАЗВАНИЕ МЕТАЛЛА |
СПОСОБ ПОЛУЧЕНИЯ МЕТАЛЛА |
|
А) натрий Б) алюминий В) серебро Г) медь |
1) электролиз водного раствора солей 2) электролиз водного раствора гидроксида 3) электролиз расплава поваренной соли 4) электролиз расплавленного оксида 5) электролиз раствора оксида в расплавленном криолите 6) электролиз расплавленного нитрата |
4 / 10
Установите соответствие между названием вещества и электролитическим способом получения этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | ЭЛЕКТРОЛИЗ |
|
А) водород Б) алюминий В) калий Г) фтор |
1) расплава КF 2) водного раствора СuCl2 3) раствора Аl2O3 в расплавленном криолите 4) водного раствора Аl2(SO4)3 5) водного раствора АgF |
5 / 10
Установите соответствие между формулой вещества и продуктами электролиза водного раствора этого вещества на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
|
А) KI Б) Сu(NO3)2 В) Li2S Г) Li2SO4 |
1) металл и кислород 2) водород и кислород 3) металл и галоген 4) металл и сера 5) водород и сера 6) водород и галоген |
6 / 10
Установите соответствие между солью и продуктами электролиза водного раствора этого вещества, которые образовались на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СОЛЬ | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| A) Nal
Б) Ca(NO3)2 B) K2SO4 |
1) металл, галоген
2) металл, кислород 3) водород, галоген 4) водород, кислород |
7 / 10
Установите соответствие между формулой вещества и продуктами электролиза водного раствора этого вещества на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
|
А) K3РО4 Б) Са(NО3)2 В) RbBr Г) CuCl2 |
1) металл и азот 2) металл и кислород 3) металл и галоген 4) водород и сера 5) водород и галоген 6) водород и кислород |
8 / 10
Установите соответствие между названием вещества и электролитическим способом получения этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | ЭЛЕКТРОЛИЗ |
|
А) кислород Б) хлор В) водород Г) бром |
1) расплава КI 2) водного раствора КСlO3 3) расплава NaF 4) водного раствора СuBr2 5) расплава SiO2 6) водного раствора СuCl2 |
9 / 10
Установите соответствие между формулой вещества и продуктами электролиза водного раствора этого вещества на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
|
А) КI Б) НgCl2 В) СuSO4 Г) Са(NO3)2 |
1) металл и кислород 2) водород и кислород 3) металл и галоген 4) водород и галоген 5) металл и азот 6) водород и сера |
10 / 10
Установите соответствие между названием простого вещества и способом его электролитического получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | ПОЛУЧЕНИЕ ЭЛЕКТРОЛИЗОМ |
|
А) натрий Б) алюминий В) сера Г) фтор |
1) водного раствора АgF 2) водного раствора Аl2(SО4)3 3) расплава NаСl 4) расплава КF 5) раствора Аl2О3 в расплавленном криолите 6) водного раствора Na2S |
Ваша оценка
The average score is 45%
Электролиз — это окислительно-восстановительная реакция, которая протекает на электродах и основана на пропускании электрического тока через раствор или расплав.
Не менее важными участниками электролиза являются электроды: катод и анод. Если вы вдруг забыли, что такое катод и анод в химии, напомним.
Катод — это отрицательно заряженный электрод, который притягивает положительно заряженные ионы (катионы). А анод — это положительно заряженный электрод, который притягивает к себе отрицательно заряженные ионы (анионы). Таким образом, на катоде всегда происходит процесс восстановления, а на аноде всегда происходит процесс окисления.
Электроды бывают растворимые и инертные. Растворимые изготавливаются из металлов, например, меди и подвергаются химическим превращениям в ходе электролиза. А вот инертные или нерастворимые электроды не подвергаются химическим превращениям и остаются в неизменном виде как до реакции, так и после нее. Как правило, такие электроды изготавливают из графита или платины.
Виды электролиза
Различают два вида электролиза:
-
Электролиз расплава.
-
Электролиз водного раствора.
Прежде чем мы рассмотрим каждый процесс отдельно, давай познакомимся с общими для двух видов процессами на электродах.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
Электролиз расплава
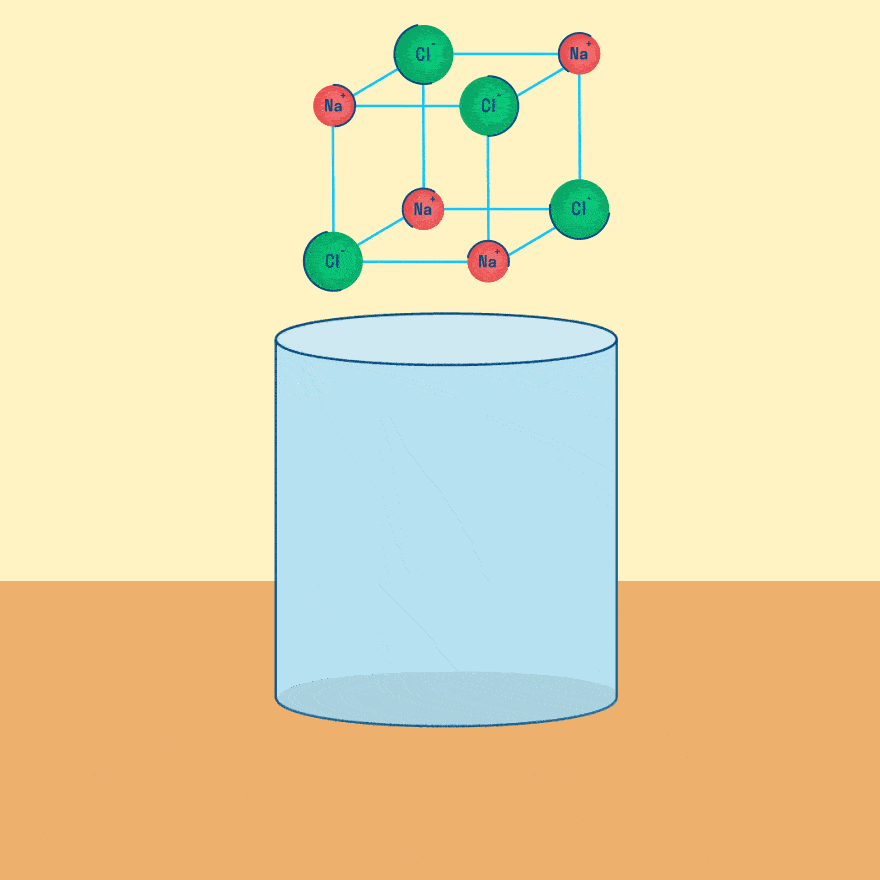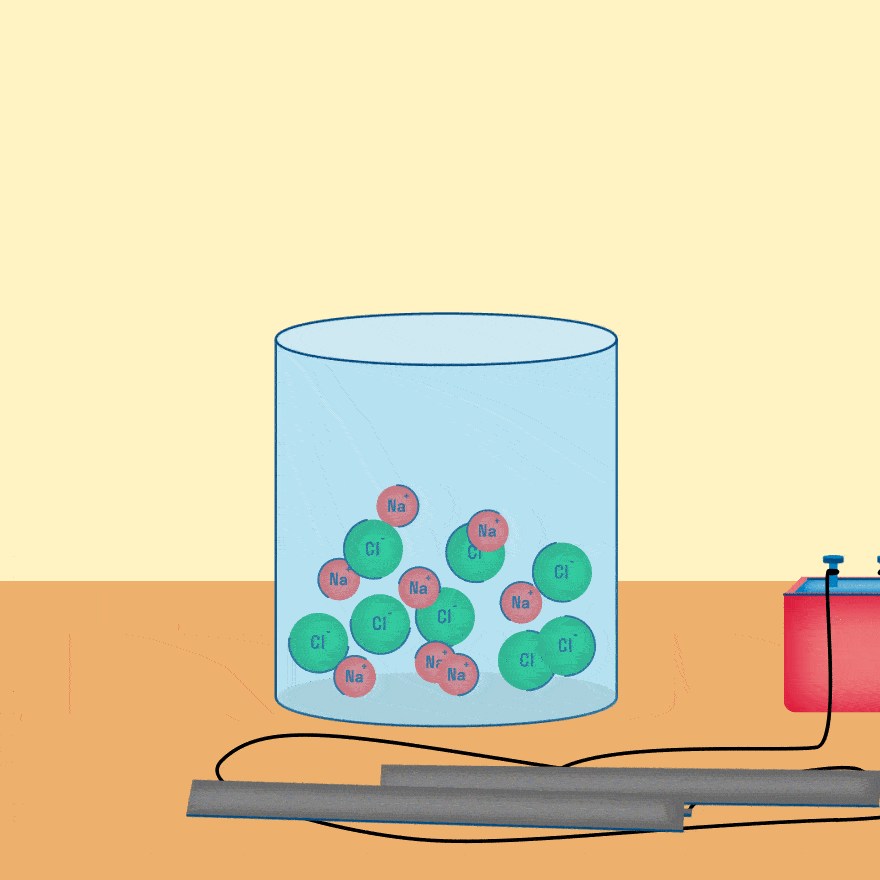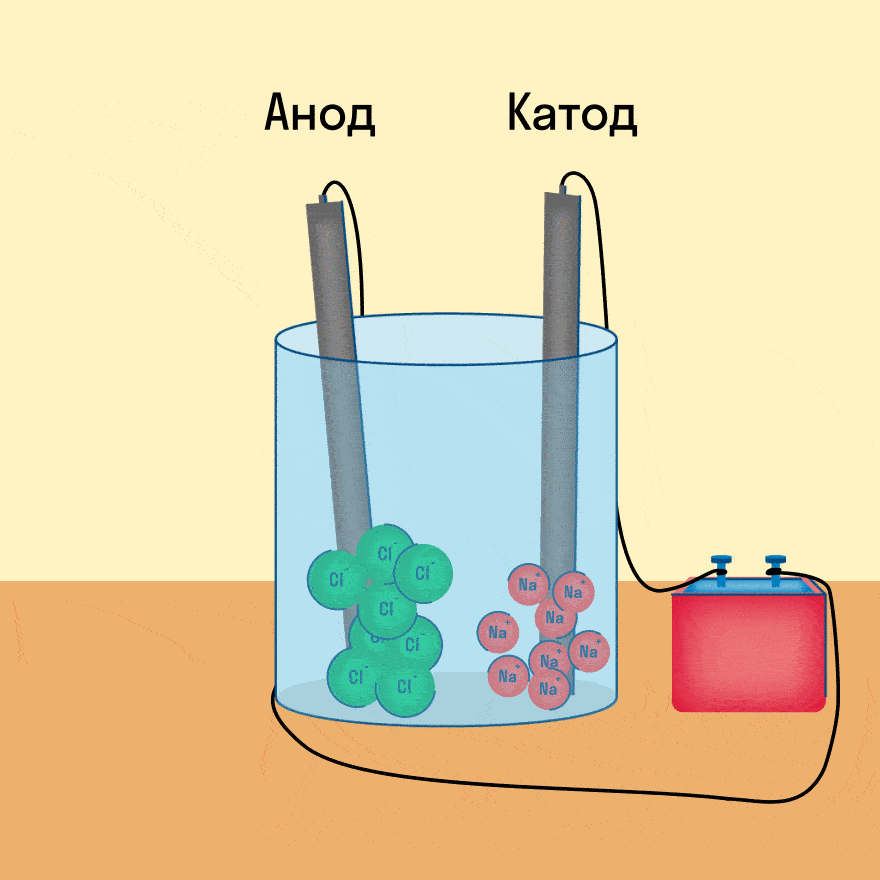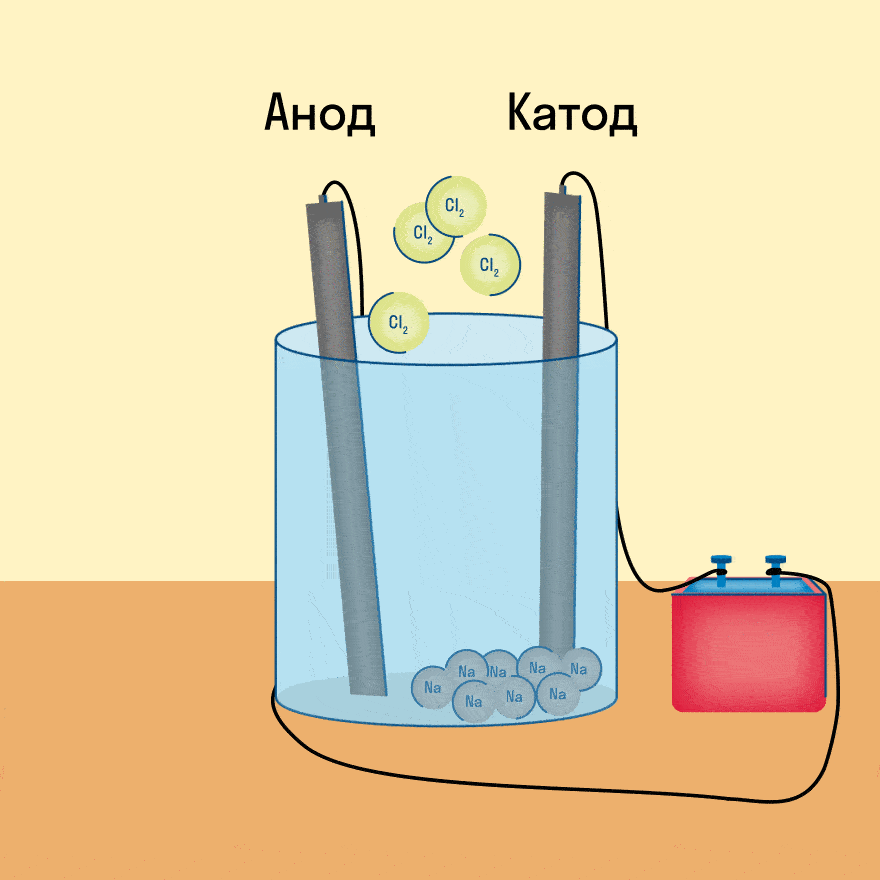
Рассмотрим электролиз расплава пищевой соли — хлорида натрия. При сильном нагревании кристаллический твердый хлорид натрия плавится. Полученный расплав содержит подвижные ионы хлора и натрия, освободившиеся из кристаллической решетки, и проводит электрический ток.
К−: 2Na+ + 2e− = 2Na0
А+: 2Cl− − 2e− = Cl2
Суммарное уравнение электролиза:
При опускании в расплав угольных (инертных) электродов, присоединенных к источнику тока, ионы приобретают направленное движение: катионы движутся к отрицательно заряженному электроду (катоду), анионы — к положительно заряженному электроду (аноду) и отдают электроны.
Теперь давайте рассмотрим электролиз расплава гидроксида калия.
На катоде происходит восстановление калия за счет принятия электронов. А на аноде протекает более сложная реакция. Гидроксогруппы отдают свой электрон и становятся нейтральными, но такое состояние для них крайне невыгодно, так как неустойчиво, и они объединяются в группы, чтобы потом разложиться с выделением газообразного кислорода и воды
Итог электролиза расплава — металлический калий на катоде, газообразный кислород и пары воды на аноде.
Электролиз раствора
Основным отличием водного раствора от расплава является присутствие молекул воды и ионов H+ и OH— как продуктов диссоциации воды. В связи с этим возле катода и анода скапливаются ионы, которые конкурируют как друг с другом, так и с молекулами воды. Рассмотрим электролиз на примере водного раствора KF:
К−: 4H2O + 4e− = 2H20 + 4OH−
А+: 2H2O − 4e− = O2 + 4H+
Суммарное уравнение электролиза:
Как видно, ни калий, ни фтор не фигурируют в продуктах электролиза. Почему так происходит?
Наиболее активные металлы — сильные восстановители. Калий — как раз такой металл, поэтому обратный процесс восстановления активных металлов из соединений осуществить сложно. При электролизе водных растворов солей активных металлов на катоде протекает восстановление не катионов этих металлов, а воды с образованием водорода.
Разберем порядок восстановления катионов металлов на катоде в зависимости от их активности.
Последовательность разрядки катионов зависит от положения металла в электрохимическом ряду напряжения.
-
Если у катода накапливаются молекулы воды и катионы металла, который находится в ряду напряжения после водорода, то восстанавливаются ионы металла.
-
Если у катода накапливаются молекулы воды и катионы металла, который стоит в начале ряда напряжения от лития до алюминия включительно, то восстанавливаются ионы водорода из молекул воды. Катионы металла не восстанавливаются, остаются в растворе.
-
Если у катода накапливаются молекулы воды и катионы металла, который расположен в ряду напряжения между алюминием и водородом, то восстанавливаются и ионы металла, и частично ионы водорода из молекул воды.
-
Если в растворе находится смесь катионов разных металлов, то сначала восстанавливаются катионы менее активного металла.
-
При электролизе раствора кислоты на катоде восстанавливаются катионы водорода до газообразного водорода.
Для удобства мы собрали информацию об электролизе в таблице:
Теперь разберемся, что происходит с анионами в водных растворах при электролизе. Для начала познакомимся с последовательностью восстановления анионов на аноде:
Чем меньше выражена восстановительная активность, тем хуже анионы могут окисляться на аноде. К тому же процесс на аноде зависит от материала анода и от природы аниона.
Если анод инертный или нерастворимый, то на нем протекают следующие реакции:
-
При электролизе растворов солей бескислородных кислот (кроме фторидов!), на аноде происходит процесс окисления аниона.
-
При электролизе растворов солей кислородсодержащих кислот и фторидов на аноде выделяется газообразный кислород вследствие окисления молекул воды. Анион при этом не окисляется, оставаясь в растворе.
-
При электролизе растворов щелочей происходит окисление гидроксид-ионов.
Если анод растворимый, то на нем всегда происходит окисление металла анода — независимо от природы аниона.
Исключением является электролиз солей карбоновых кислот. Таблица выше не описывает происходящее на аноде. Давайте рассмотрим, что же там происходит.
В результате электролиза водных растворов солей щелочных металлов карбоновых кислот происходит образование углеводородов вследствие рекомбинации углеводородных радикалов.
В общем виде электролиз солей карбоновых кислот можно записать так:
На катоде образуется газообразный водород, а на аноде — углекислый газ, углеводород, полученный удвоением радикала. В катодном пространстве накапливается щелочь.
В случае разделения катодного и анодного пространства углекислый газ реагирует со щелочью с образованием гидрокарбоната.
Применение электролиза
А теперь самое главное: зачем вообще нужен электролиз? Рассмотрим применение этого вида ОВР:
-
С помощью электролиза расплавов природных соединений в металлургической промышленности получают активные металлы (калий, натрий, бериллий, кальций, барий). С помощью электролиза растворов солей — цинк, кадмий, кобальт и другие.
-
В химической промышленности электролиз используют для получения фтора, хлора, водорода, кислорода, щелочей, бертолетовой соли и других веществ.
-
Электролиз с растворимым анодом используют для нанесения металлических покрытий (из хрома, золота, никеля, серебра), что предохраняет металлические изделия от коррозии и придает им декоративный вид.
Вопросы для самопроверки
1. Выберите верное продолжение фразы «катод — это…»:
-
Положительно заряженный электрод, к которому притягиваются положительно заряженные ионы.
-
Положительно заряженный электрод, к которому притягиваются отрицательно заряженные ионы.
-
Отрицательно заряженный электрод, к которому притягиваются положительно заряженные ионы.
-
Отрицательно заряженный электрод, к которому притягиваются отрицательно заряженные ионы.
2. Продолжите фразу «электролиз — это…»:
-
ОВР с применением тока.
-
Реакция без изменения степеней окисления с применением тока.
-
ОВР с применением катализаторов.
-
Обменная реакция.
3. Как заряжен анион?
-
Положительно.
-
Отрицательно.
-
Нейтрально.
-
Не имеет заряда.
4. Чем отличается электролиз раствора от электролиза расплава?
-
Ничем.
-
В расплаве плавится твердое.
-
Присутствием молекул воды и продуктов ее диссоциации.
5. Если металл стоит в ряду активности металлов между алюминием и водородом, что выделится на катоде?
-
Этот металл.
-
Водород.
-
Металл и водород.
-
Оксид металла.
При электролиза водного раствора фторида лития что на аноде выделится?
-
Фтор.
-
Водород.
-
Кислород.
-
Вода.
Ответы
-
c
-
a
-
b
-
c
-
c
-
с
Электролиз расплавов и растворов (солей, щелочей)
Если в раствор или расплав электролита опустить электроды и пропустить постоянный электрический ток, то ионы будут двигаться направленно: катионы к катоду (отрицательно заряженному электроду), анионы к аноду (положительно заряженному электроду).
На катоде катионы принимают электроны и восстанавливаются, на аноде анионы отдают электроны и окисляются. Этот процесс называют электролизом.
Электролиз — это окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока через расплав или раствор электролита.
Электролиз расплавленных солей
Рассмотрим процесс электролиза расплава хлорида натрия. В расплаве идет процесс термической диссоциации:
$NaCl→Na^{+}+Cl^{-}.$
Под действием электрического тока катионы $Na^{+}$ движутся к катоду и принимают от него электроны:
$Na^{+}+ē→{Na}↖{0}$ (восстановление).
Анионы $Cl^{-}$ движутся к аноду и отдают электроны:
$2Cl^{-}-2ē→{Cl_2}↖{0}↑$ (окисление).
Суммарное уравнение процессов:
$Na^{+}+ē→{Na}↖{0}|2$
$2Cl^{-}-2ē→{Cl_2}↖{0}↑|1$
$2Na^{+}+2Cl^{-}=2{Na}↖{0}+{Cl_2}↖{0}↑$
или
$2NaCl{→}↖{text»электролиз»}2Na+Cl_2↑$
На катоде образуется металлический натрий, на аноде — газообразный хлор.
Главное, что вы должны помнить: в процессе электролиза за счет электрической энергии осуществляется химическая реакция, которая самопроизвольно идти не может.
Электролиз водных растворов электролитов
Более сложный случай — электролиз растворов электролитов.
В растворе соли, кроме ионов металла и кислотного остатка, присутствуют молекулы воды. Поэтому при рассмотрении процессов на электродах необходимо учитывать их участие в электролизе.
Для определения продуктов электролиза водных растворов электролитов существуют следующие правила:
1. Процесс на катоде зависит не от материала, из которого сделан катод, а от положения металла (катиона электролита) в электрохимическом ряду напряжений, при этом если:
1.1. Катион электролита расположен в ряду напряжений в начале ряда по $Al$ включительно, то на катоде идет процесс восстановления воды (выделяется водород $Н_2↑$). Катионы металла не восстанавливаются, они остаются в растворе.
1.2. Катион электролита находится в ряду напряжений между алюминием и водородом, то на катоде восстанавливаются одновременно и ионы металла, и молекулы воды.
1.3. Катион электролита находится в ряду напряжений после водорода, то на катоде восстанавливаются катионы металла.
1.4. В растворе содержатся катионы разных металлов, то сначала восстанавливается катион металла, стоящий в ряду напряжений правее.
Катодные процессы
| $Li K Ca Na Mg Al$ $Li^{+} K^{+} Ca^{2+} Na^{+} Mg^{2+} Al^{3+}$ |
$Mn Zn Fe Ni Sn Pb$ $Mn^{2+} Zn^{2+} Fe^{2+} Ni^{2+} Sn^{2+} Pb^{2+}$ |
$H_2$ $2H^{+}$ |
$Cu Hg Ag Pt Au$ $Cu^{2+} Hg_2^{2+} Ag^{+} Pt^{2+} Au^{3+}$ |
| Восстанавливается вода: $2H_2O+2ē=H_2↑+2OH^{−};$ $M^{n+}$ не восстанавливается |
Восстанавливаются катионы металла и вода: $M^{n+}+nē=M^0$ $2H_2O+2ē=H_2↑+2OH^{−}$ |
Восстанавливаются катионы металла: $M^{n+}+nē=M^0$ | |
| $nē→$ Усиление окислительных свойств катионов (способности принимать электроны) |
2. Процесс на аноде зависит от материала анода и от природы аниона.
Анодные процессы
| Кислотный остаток $Ас^{m–}$ | Анод | |
| Растворимый | Нерастворимый | |
| Бескислородный | Окисление металла анода $M^{−}−nē=M^{n+}$ анод раствор |
Окисление аниона (кроме $F^{–}$) $Ac^{m−}−mē=Ac^0$ |
| Кислородсодержащий | В кислотной и нейтральной средах: $2H_2O−4ē=O_2↑+4H^{+}$ В щелочной среде: $4OH^{−}−4ē=O_2↑+4H^{+}$ |
2.1. Если анод растворяется (железо, цинк, медь, серебро и все металлы, которые окисляются в процессе электролиза), то окисляется металл анода, несмотря на природу аниона.
2.2. Если анод не растворяется (его называют инертным — графит, золото, платина), то:
а) при электролизе растворов солей бескислородных кислот (кроме фторидов) на аноде идет процесс окисления аниона;
б) при электролизе растворов солей кислородсодержащих кислот и фторидов на аноде идет процесс окисления воды (выделяется $О_2↑$). Анионы не окисляются, они остаются в растворе;
в) анионы по их способности окисляться располагаются в следующем порядке:
Попробуем применить эти правила в конкретных ситуациях.
Рассмотрим электролиз раствора хлорида натрия в случае, если анод нерастворимый и если анод растворимый.
1) Анод нерастворимый (например, графитовый).
В растворе идет процесс электролитической диссоциации:
Суммарное уравнение:
$2H_2O+2Cl^{-}=H_2↑+Cl_2↑+2OH^{-}$.
Учитывая присутствие ионов $Na^{+}$ в растворе, составляем молекулярное уравнение:
2) Анод растворимый (например, медный):
$NaCl=Na^{+}+Cl^{-}$.
Если анод растворимый, то металл анода будет окисляться:
$Cu^{0}-2ē=Cu^{2+}$.
Катионы $Cu^{2+}$ в ряду напряжений стоят после ($Н^{+}$), по этому они и будут восстанавливаться на катоде.
Концентрация $NaCl$ в растворе не меняется.
Рассмотрим электролиз раствора сульфата меди (II) на нерастворимом аноде:
$Cu^{2+}+2ē=Cu^{0}|2$
$2H_2O-4ē=O_2↑+4H^{+}|1$
Суммарное ионное уравнение:
$2Cu^{2+}+2H_2O=2Cu^{0}+O_2↑+4H^{+}$
Суммарное молекулярное уравнение с учетом присутствия анионов $SO_4^{2-}$ в растворе:
Рассмотрим электролиз раствора гидроксида калия на нерастворимом аноде:
$2H_2O+2ē=H_2↑+2OH^{-}|2$
$4OH^{-}-4ē=O_2↑+2H_2O|1$
Суммарное ионное уравнение:
$4H_2O+4OH^{-}=2H_2↑+4OH^{-}+O_2↑+2H_2O$
Суммарное молекулярное уравнение:
$2H_2O{→}↖{text»электролиз»}2H_2↑+O_2↑$
В данном случае, оказывается, идет только электролиз воды. Аналогичный результат получим и в случае электролиза растворов $H_2SO_4, NaNO_3, K_2SO_4$ и др.
Электролиз расплавов и растворов веществ широко используется в промышленности:
- Для получения металлов (алюминий, магний, натрий, кадмий получают только электролизом).
- Для получения водорода, галогенов, щелочей.
- Для очистки металлов — рафинирования (очистку меди, никеля, свинца проводят электрохимическим методом).
- Для защиты металлов от коррозии (хрома, никеля, меди, серебра, золота) — гальваностегия.
- Для получения металлических копий, пластинок — гальванопластика.
1.4.9. Электролиз расплавов и растворов (солей, щелочей, кислот).
Что такое электролиз? Для более простого понимания ответа на этот вопрос давайте представим себе любой источник постоянного тока. У каждого источника постоянного тока всегда можно найти положительный и отрицательный полюс:
Подсоединим к нему две химически стойких электропроводящих пластины, которые назовем электродами. Пластину, присоединенную к положительному полюсу назовем анодом, а к отрицательному катодом:
Далее, представьте, что у вас есть возможность опустить эти два электрода в расплав хлорида натрия:
Хлорид натрия является электролитом, при его расплавлении происходит диссоциация на катионы натрия и хлорид-ионы:
NaCl = Na+ + Cl−
Очевидно, что заряженные отрицательно анионы хлора направятся к положительно заряженному электроду – аноду, а положительно заряженные катионы Na+ направятся к отрицательно заряженному электроду – катоду. В результате этого и катионы Na+ и анионы Cl− разрядятся, то есть станут нейтральными атомами. Разрядка происходит посредством приобретения электронов в случае ионов Na+ и потери электронов в случае ионов Cl−. То есть на катоде протекает процесс:
Na+ + 1e− = Na0,
А на аноде:
Cl− − 1e− = Cl
Поскольку каждый атом хлора имеет по неспаренному электрону, одиночное существование их невыгодно и атомы хлора объединяются в молекулу из двух атомов хлора:
Сl∙ + ∙Cl = Cl2
Таким образом, суммарно, процесс, протекающий на аноде, правильнее записать так:
2Cl− − 2e− = Cl2
То есть мы имеем:
Катод: Na+ + 1e− = Na0
Анод: 2Cl− − 2e− = Cl2
Подведем электронный баланс:
Na+ + 1e− = Na0 |∙2
2Cl− − 2e− = Cl2 |∙1<
Сложим левые и правые части обоих уравнений полуреакций, получим:
2Na+ + 2e− + 2Cl− − 2e−= 2Na0 + Cl2
Сократим два электрона аналогично тому, как это делается в алгебре получим ионное уравнение электролиза:
2Na++ 2Cl− = 2Na0 + Cl2
далее, объединив ионы Na+ и Cl− получим, уравнение электролиза расплава хлорида натрия:
2NaCl(ж.) => 2Na + Cl2
Рассмотренный выше случай является с теоретической точки зрения наиболее простым, поскольку в расплаве хлорида натрия из положительно заряженных ионов были только ионы натрия, а из отрицательных – только анионы хлора.
Другими словами, ни у катионов Na+, ни у анионов Cl− не было «конкурентов» за катод и анод.
А, что будет, например, если вместо расплава хлорида натрия ток пропустить через его водный раствор? Диссоциация хлорида натрия наблюдается и в этом случае, но становится невозможным образование металлического натрия в водном растворе. Ведь мы знаем, что натрий – представитель щелочных металлов – крайне активный металл, реагирующий с водой очень бурно. Если натрий не способен восстановиться в таких условиях, что же тогда будет восстанавливаться на катоде?
Давайте вспомним строение молекулы воды. Она представляет собой диполь, то есть у нее есть отрицательный и положительный полюсы:
Именно благодаря этому свойству, она способна «облеплять» как поверхность катода, так и поверхность анода:
При этом могут происходить процессы:
Катод:
2H2O + 2e− = 2OH− + H2
Анод:
2H2O – 4e− = O2 + 4H+
Таким образом, получается, что если мы рассмотрим раствор любого электролита, то мы увидим, что катионы и анионы, образующиеся при диссоциации электролита, конкурируют с молекулами воды за восстановление на катоде и окисление на аноде.
Так какие же процессы будут происходить на катоде и на аноде? Разрядка ионов, образовавшихся при диссоциации электролита или окисление/восстановление молекул воды? Или, возможно, будут происходить все указанные процессы одновременно?
В зависимости от типа электролита при электролизе его водного раствора возможны самые разные ситуации. Например, катионы щелочных, щелочноземельных металлов, алюминия и магния просто не способны восстановиться в водной среде, так как при их восстановлении должны были бы получаться соответственно щелочные, щелочноземельные металлы, алюминий или магний т.е. металлы, реагирующие с водой.
В таком случае является возможным только восстановление молекул воды на катоде.
Запомнить то, какой процесс будет протекать на катоде при электролизе раствора какого-либо электролита можно, следуя следующим принципам:
1) Если электролит состоит из катиона металла, который в свободном состоянии в обычных условиях реагирует с водой, на катоде идет процесс:
2H2O + 2e− = 2OH− + H2
Это касается металлов, находящихся в начале ряда активности по Al включительно.
2) Если электролит состоит из катиона металла, который в свободном виде не реагирует с водой, но реагирует с кислотами неокислителями, идут сразу два процесса, как восстановления катионов металла, так и молекул воды:
2H2O + 2e− = 2OH− + H2
Men+ + ne = Me0
К таким металлам относятся металлы, находящиеся между Al и Н в ряду активности.
3) Если электролит состоит из катионов водорода (кислота) или катионов металлов, не реагирующих с кислотами неокислителями — восстанавливаются только катионы электролита:
2Н+ + 2е− = Н2 – в случае кислоты
Men+ + ne = Me0 – в случае соли
На аноде тем временем ситуация следующая:
1) Если электролит содержит анионы бескислородных кислотных остатков (кроме F−), то на аноде идет процесс их окисления, молекулы воды не окисляются. Например:
2Сl− − 2e = Cl2
S2- − 2e = So
Фторид-ионы не окисляются на аноде поскольку фтор не способен образоваться в водном растворе (реагирует с водой)
2) Если в состав электролита входят гидроксид-ионы (щелочи) они окисляются вместо молекул воды:
4ОН− − 4е− = 2H2O + O2
3) В случае того, если электролит содержит кислородсодержащий кислотный остаток (кроме остатков органических кислот) или фторид-ион (F−) на аноде идет процесс окисления молекул воды:
2H2O – 4e− = O2 + 4H+
4) В случае кислотного остатка карбоновой кислоты на аноде идет процесс:
2RCOO− − 2e− = R-R + 2CO2
Давайте потренируемся записывать уравнения электролиза для различных ситуаций:
Пример №1
Напишите уравнения процессов протекающих на катоде и аноде при электролизе расплава хлорида цинка, а также общее уравнение электролиза.
Решение
При расплавлении хлорида цинка происходит его диссоциация:
ZnCl2 = Zn2+ + 2Cl−
Далее следует обратить внимание на то, что электролизу подвергается именно расплав хлорида цинка, а не водный раствор. Другими словами, без вариантов, на катоде может происходить только восстановление катионов цинка, а на аноде окисление хлорид-ионов т.к. отсутствуют молекулы воды:
Катод: Zn2+ + 2e− = Zn0 |∙1
Анод: 2Cl− − 2e− = Cl2 |∙1
ZnCl2 = Zn + Cl2
Пример №2
Напишите уравнения процессов протекающих на катоде и аноде при электролизе водного раствора хлорида цинка, а также общее уравнение электролиза.
Так как в данном случае, электролизу подвергается водный раствор, то в электролизе, теоретически, могут принимать участие молекулы воды. Так как цинк расположен в ряду активности между Al и Н то это значит, что на катоде будет происходить как восстановление катионов цинка, так и молекул воды.
Катод:
2H2O + 2e− = 2OH− + H2
Zn2+ + 2e− = Zn0
Хлорид-ион является кислотным остатком бескислородной кислоты HCl, поэтому в конкуренции за окисление на аноде хлорид-ионы «выигрывают» у молекул воды:
Анод:
2Cl− − 2e− = Cl2
В данном конкретном случае нельзя записать суммарное уравнение электролиза, поскольку неизвестно соотношение между выделяющимися на катоде водородом и цинком.
Пример №3
Напишите уравнения процессов протекающих на катоде и аноде при электролизе водного раствора нитрата меди, а также общее уравнение электролиза.
Нитрат меди в растворе находится в продиссоциированном состоянии:
Cu(NO3)2 = Cu2+ + 2NO3−
Медь находится в ряду активности правее водорода, то есть на катоде восстанавливаться будут катионы меди:
Катод:
Cu2+ + 2e− = Cu0
Нитрат-ион NO3− — кислородсодержащий кислотный остаток, это значит, что в окислении на аноде нитрат ионы «проигрывают» в конкуренции молекулам воды:
Анод:
2H2O – 4e− = O2 + 4H+
Таким образом:
Катод: Cu2+ + 2e− = Cu0 |∙2
Анод: 2H2O – 4e− = O2 + 4H+ |∙1
2Cu2+ + 2H2O = 2Cu0 + O2 + 4H+
Полученное в результате сложения уравнение является ионным уравнением электролиза. Чтобы получить полное молекулярное уравнение электролиза нужно добавить по 4 нитрат иона в левую и правую часть полученного ионного уравнения в качестве противоионов. Тогда мы получим:
2Cu(NO3)2 + 2H2O = 2Cu0 + O2 + 4HNO3
Пример №4
Напишите уравнения процессов, протекающих на катоде и аноде при электролизе водного раствора ацетата калия, а также общее уравнение электролиза.
Решение:
Ацетат калия в водном растворе диссоциирует на катионы калия и ацетат-ионы:
СН3СООК = СН3СОО− + К+
Калий является щелочным металлом, т.е. находится в ряду электрохимическом ряду напряжений в самом начале. Это значит, что его катионы не способны разряжаться на катоде. Вместо них восстанавливаться будут молекулы воды:
Катод:
2H2O + 2e− = 2OH− + H2
Как уже было сказано выше, кислотные остатки карбоновых кислот «выигрывают» в конкуренции за окисление у молекул воды на аноде:
Анод:
2СН3СОО− − 2e− = CH3−CH3 + 2CO2
Таким образом, подведя электронный баланс и сложив два уравнения полуреакций на катоде и аноде получаем:
Катод: 2H2O + 2e− = 2OH− + H2 |∙1
Анод: 2СН3СОО− − 2e− = CH3−CH3 + 2CO2 |∙1
2H2O + 2СН3СОО− = 2OH− + Н2+ CH3−CH3 + 2CO2
Мы получили полное уравнение электролиза в ионном виде. Добавив по два иона калия в левую и правую часть уравнения и сложив с противоионами мы получаем полное уравнение электролиза в молекулярном виде:
2H2O + 2СН3СООK = 2KOH + Н2+ CH3−CH3 + 2CO2
Пример №5
Напишите уравнения процессов, протекающих на катоде и аноде при электролизе водного раствора серной кислоты, а также общее уравнение электролиза.
Серная кислота диссоциирует на катионы водорода и сульфат-ионы:
H2SO4 = 2H+ + SO42-
На катоде будет происходить восстановление катионов водорода H+ , а на аноде окисление молекул воды, поскольку сульфат-ионы являются кислородсодержащими кислотными остатками:
Катод: 2Н+ + 2e− = H2 |∙2
Анод: 2H2O – 4e− = O2 + 4H+ |∙1
4Н+ + 2H2O = 2H2 + O2 + 4H+
Сократив ионы водорода в левой и правой и левой части уравнения получим уравнение электролиза водного раствора серной кислоты:
2H2O = 2H2 + O2
Как можно видеть, электролиз водного раствора серной кислоты сводится к электролизу воды.
Пример №6
Напишите уравнения процессов, протекающих на катоде и аноде при электролизе водного раствора гидроксида натрия, а также общее уравнение электролиза.
Диссоциация гидроксида натрия:
NaOH = Na+ + OH−
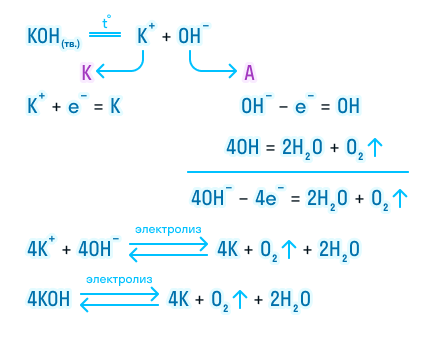
На катоде будут восстанавливаться только молекулы воды, так как натрий – высокоактивный металл, на аноде только гидроксид-ионы:
Катод: 2H2O + 2e− = 2OH− + H2 |∙2
Анод: 4OH− − 4e− = O2 + 2H2O |∙1
4H2O + 4OH− = 4OH− + 2H2 + O2 + 2H2O
Сократим две молекулы воды слева и справа и 4 гидроксид-иона и приходим к тому, что, как и в случае серной кислоты электролиз водного раствора гидроксида натрия сводится к электролизу воды:
2H2O = 2H2 + O2
Электролиз растворов электролитов с инертными электродами
Напомним, что на катоде протекают процессы восстановления, на аноде — процессы окисления.
Процессы, протекающие на катоде:
В растворе имеются несколько видов положительно заряженных частиц, способных восстанавливаться на катоде:
1) Катионы металла восстанавливаются до простого вещества, если металл находится в ряду напряжений правее алюминия (не включая сам Al). Например:
Zn2+ +2e → Zn0.
2) В случае раствора соли или щелочи: катионы водорода восстанавливаются до простого вещества, если металл находится в ряду напряжений металлов до H2:
2H2O + 2e → H20 + 2OH–.
Например, в случае электролиза растворов NaNO3 или KOH.
3) В случае электролиза раствора кислоты: катионы водорода восстанавливаются до простого вещества:
2H+ +2e → H2.
Например, в случае электролиза раствора H2SO4.
Процессы, протекающие на аноде:
На аноде легко окисляются кислотные остатки не содержащие кислород. Например, галогенид-ионы (кроме F–), сульфид-анионы, гидроксид-анионы и молекулы воды:
1) Галогенид-анионы окисляются до простых веществ:
2Cl– – 2e → Cl2.
2) В случае электролиза раствора щелочи в гидроксид-анионах кислород окисляется до простого вещества. Водород уже имеет степень окисления +1 и не может быть окислен дальше. Также будет выделение воды — почему? Потому что больше ничего написать и не получится: 1) H+ написать не можем, так как OH– и H+ не могут стоять по разные стороны одного уравнения; 2) H2 написать также не можем, так как это был бы процесс восстановления водорода (2H+ +2e → H2), а на аноде протекают только процессы окисления.
4OH– – 4e → O2 + 2H2O.
3) Если в растворе есть анионы фтора или любые кислородсодержащие анионы, то окислению будет подвергаться вода с подкислением прианодного пространства согласно следующему уравнению:
2H2O – 4e → O2 + 4H+.
Такая реакция идет в случае электролиза растворов кислородсодержащих солей или кислородсодержащих кислот. В случае электролиза раствора щелочи окисляться будут гидроксид-анионы согласно правилу 2) выше.
4) В случае электролиза раствора соли органической кислоты на аноде всегда происходит выделение CO2 и удвоение остатка углеродной цепи:
2R-COO– – 2e → R-R + 2CO2.
Примеры:
1. Раствор NaCl
Расписываем диссоциацию на ионы:
NaCl → Na+ + Cl–
Металл Na стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается водород. Хлорид-анионы будут окисляться на аноде до простого вещества:
К: 2Na+ (в растворе)
2H2O + 2e → H20 + 2OH–
А: 2Cl– – 2e → Cl2
Коэффициент 2 перед Na+ появился из-за наличия аналогичного коэффициента перед хлорид-ионами, так как в соли NaCl их соотношение 1:1.
Проверяем, что количество принимаемых и отдаваемых электронов одинаковое, и суммируем левые и правые части катодных и анодных процессов:
2Na+ + 2Cl– + 2H2O → H20 + 2Na+ + 2OH– + Cl2. Соединяем катионы и анионы:
2NaCl + 2H2O → H20 + 2NaOH + Cl2.
2. Раствор Na2SO4
Расписываем диссоциацию на ионы:
Na2SO4 → 2Na+ + SO42–
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается только водород. Сульфат-анионы содержат кислород, поэтому окисляться не будут, также оставаясь в растворе. Согласно правилу выше, в этом случае окисляются молекулы воды:
К: 2H2O + 2e → H20 + 2OH–
А: 2H2O – 4e → O20 + 4H+.
Уравниваем число принимаемых и отдаваемых электронов на катоде и аноде. Для этого необходимо умножить все коэффициенты катодного процесса на 2:
К: 4H2O + 4e → 2H20 + 4OH–
А: 2H2O – 4e → O20 + 4H+.
Складываем левые и правые части катодных и анодных процессов:
6H2O → 2H20 + 4OH– + 4H+ + O20.
4OH- и 4H+ соединяем в 4 молекулы H2O:
6H2O → 2H20 + 4H2O + O20.
Сокращаем молекулы воды, находящиеся по обе стороны уравнения, т.е. вычитаем из каждой части уравнения 4H2O и получаем итоговое уравнение гидролиза:
2H2O → 2H20 + O20.
Таким образом, гидролиз растворов кислородсодержащих солей активных металлов (до Al включительно) сводится к гидролизу воды, так как ни катионы металлов, ни анионы кислотных остатков не принимают участие в окислительно-восстановительных процессах, протекающих на электродах.
3. Раствор CuCl2
Расписываем диссоциацию на ионы:
CuCl2 → Cu2+ + 2Cl–
Медь находится в ряду напряжений металлов после водорода, следовательно, только она будет восстанавливаться на катоде. На аноде будут окисляться только хлорид-анионы.
К: Cu2+ + 2e → Cu0
A: 2Cl– – 2e → Cl2
Записываем суммарное уравнение:
CuCl2 → Cu0 + Cl2.
4. Раствор CuSO4
Расписываем диссоциацию на ионы:
CuSO4 → Cu2+ + SO42–
Медь находится в ряду напряжений металлов после водорода, следовательно, только она будет восстанавливаться на катоде. На аноде будут окисляться молекулы воды, так как кислородсодержащие кислотные остатки в растворах на аноде не окисляются.
К: Cu2+ + 2e → Cu0
A: SO42– (в растворе)
2H2O – 4e → O2 + 4H+.
Уравниваем количество электронов на катоде и аноде. Для это умножим все коэффициенты катодного уравнения на 2. Количество сульфат-ионов также необходимо удвоить, так как в сульфате меди соотношение Cu2+ и SO42– 1:1.
К: 2Cu2+ + 4e → 2Cu0
A: 2SO42– (в растворе)
2H2O – 4e → O2 + 4H+.
Записываем суммарное уравнение:
2Cu2+ + 2SO42– + 2H2O → 2Cu0 + O2 + 4H+ + 2SO42–.
Соединив катионы и анионы, получаем итоговое уравнение электролиза:
2CuSO4 + 2H2O → 2Cu0 + O2 + 2H2SO4.
5. Раствор NiCl2
Расписываем диссоциацию на ионы:
NiCl2 → Ni2+ + 2Cl–
Никель находится в ряду напряжений металлов после алюминия и до водорода, следовательно, на катоде будут восстанавливаться и металл, и водород. На аноде будут окисляться только хлорид-анионы.
К: Ni2+ + 2e → Ni0
2H2O + 2e → H20 + 2OH–
A: 2Cl– – 2e → Cl2
Уравниваем количество электронов, принимаемых и отдаваемых на катоде и аноде. Для этого умножаем все коэффициенты анодного уравнения на 2:
К: Ni2+ + 2e → Ni0
2H2O + 2e → H20 + 2OH–
Ni2+ (в растворе)
A: 4Cl– – 4e → 2Cl2
Замечаем, что согласно формуле NiCl2, соотношение атомов никеля и хлора 1:2, следовательно, в раствор необходимо добавить Ni2+ для получения общего количества 2NiCl2. Также это необходимо сделать, так как в растворе должны присутствовать противоионы для гидроксид-анионов.
Складываем левые и правые части катодных и анодных процессов:
Ni2+ + Ni2+ + 4Cl– + 2H2O → Ni0 + H20 + 2OH– + Ni2+ + 2Cl2.
Соединяем катионы и анионы для получения итогового уравнения электролиза:
2NiCl2 + 2H2O → Ni0 + H20 + Ni(OH)2 + 2Cl2.
6. Раствор NiSO4
Расписываем диссоциацию на ионы:
NiSO4 → Ni2+ + SO42–
Никель находится в ряду напряжений металлов после алюминия и до водорода, следовательно, на катоде будут восстанавливаться и металл, и водород. На аноде будут окисляться молекулы воды, так как кислородсодержащие кислотные остатки в растворах на аноде не окисляются.
К: Ni2+ + 2e → Ni0
2H2O + 2e → H20 + 2OH–
A: SO42– (в растворе)
2H2O – 4e → O2 + 4H+.
Проверяем, что количество принятых и отданных электронов совпадает. Также замечаем, что в растворе есть гидроксид-ионы, но в записи электродных процессов для них нет противоионов. Следовательно, нужно добавить в раствор Ni2+. Так как удвоилось количество ионов никеля, необходимо удвоить и количество сульфат-ионов:
К: Ni2+ + 2e → Ni0
2H2O + 2e → H20 + 2OH–
Ni2+ (в растворе)
A: 2SO42– (в растворе)
2H2O – 4e → O2 + 4H+.
Складываем левые и правые части катодных и анодных процессов:
Ni2+ + Ni2+ + 2SO42– + 2H2O + 2H2O → Ni0 + Ni2+ + 2OH– + H20 + O20 + 2SO42– + 4H+.
Соединяем катионы и анионы и записываем итоговое уравнение электролиза:
2NiSO4 + 4H2O → Ni0 + Ni(OH)2 + H20 + O20 + 2H2SO4.
В других источниках литературы также говорится об альтернативном протекании электролиза кислородсодержащих солей металлов средней активности. Разница состоит в том, что после сложения левых и правых частей процессов электролиза необходимо соединить H+ и OH– с образованием двух молекул воды. Оставшиеся 2H+ расходуются на образование серной кислоты. В этом случае не нужно прибавлять дополнительные ионы никеля и сульфат-ионы:
Ni2+ + SO42– + 2H2O + 2H2O → Ni0 + 2OH– + H20 + O20 + SO42– + 4H+.
Ni2+ + SO42– + 4H2O → Ni0 + H20 + O20 + SO42– + 2H+ + 2H2O.
Итоговое уравнение:
NiSO4 + 2H2O → Ni0 + H20 + O20 + H2SO4.
7. Раствор CH3COONa
Расписываем диссоциацию на ионы:
CH3COONa → CH3COO– + Na+
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается только водород. На аноде будет происходит окисление ацетат-ионов с образованием углекислого газа и удвоением остатка углеродной цепи:
К: 2Na+ (в растворе)
2H2O + 2e → H20 + 2OH–
А: 2CH3COO– – 2e → CH3-CH3 + CO2
Так как количества электронов в процессах окисления и восстановления совпадают, составляем суммарное уравнение:
2Na+ + 2CH3COO– + 2H2O → 2Na+ + 2OH– + H20 + CH3-CH3 + CO2
Соединяем катионы и анионы:
2CH3COONa + 2H2O → 2NaOH + H20 + CH3-CH3 + CO2.
8. Раствор H2SO4
Расписываем диссоциацию на ионы:
H2SO4 → 2H+ + SO42–
Из катионов в растворе присутствуют только катионы H+, они и будут восстанавливаться до простого вещества. На аноде будет протекать окисление воды, так как кислород содержащие кислотные остатки в растворах на аноде не окисляются.
К: 2H+ +2e → H2
A: 2H2O – 4e → O2 + 4H+
Уравниваем число электронов. Для этого удваиваем каждый коэффициент в уравнении катодного процесса:
К: 4H+ +4e → 2H2
A: 2H2O – 4e → O2 + 4H+
Суммируем левые и правые части уравнений:
4H+ + 2H2O → 2H2 + O2 + 4H+
Катионы H+ находятся в обеих частях реакции, следовательно, их нужно сократить. Получаем, что в случае растворов кислот, электролизу подвергаются только молекулы H2O:
2H2O → 2H2 + O2.
9. Раствор NaOH
Расписываем диссоциацию на ионы:
NaOH → Na+ + OH–
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу, на катоде восстанавливается только водород. На аноде будут окисляться гидроксид-анионы с образованием кислорода и воды:
К: Na+ (в растворе)
2H2O + 2e → H20 + 2OH–
А: 4OH– – 4e → O2 + 2H2O
Уравниваем число электронов, принимаемых и отдаваемых на электродах:
К: Na+ (в растворе)
4H2O + 4e → 2H20 + 4OH–
А: 4OH– – 4e → O2 + 2H2O
Суммируем левые и правые части процессов:
4H2O + 4OH– → 2H20 + 4OH– + O20 + 2H2O
Сокращая 2H2O и ионы OH–, получаем итоговое уравнение электролиза:
2H2O → 2H2 + O2.
Вывод:
При электролизе растворов 1) кислородсодержащих кислот;
2) щелочей;
3) солей активных металлов и кислородсодержащих кислот
на электродах протекает электролиз воды:
2H2O → 2H2 + O2.
Электролиз водных растворов солей
Тема электролиза довольна большая, формул в ней много и, как мне кажется, больше ее изучают на уроках физики… Я хочу рассмотреть ту часть, которая касается химии, и при этом только формат ЕГЭ — электролиз водных растворов солей.
Электролиз водных растворов солей
Для начала давайте представим себе систему, в которой происходит электролиз.
Электролиз — физико-химический процесс, состоящий в выделении наэлектродах составных частей растворённых веществ или других веществ, который возникает при прохождении электрического тока через раствор либо расплав электролита.
Электроды — это такие пластинки или стержни, опущенные в раствор, они подключены к источнику тока.
- Анод — положительно заряженный электрод
- Катод — отрицательно заряженный электрод
Мы будем рассматривать случай инертных электродов — т.е. они не будут вступать ни в какие химические реакции.
При пропускании электрического тока, вещество раствора будет претерпевать химические изменения, т.е. буду образовываться новые химические вещества. Они будут притягиваться к электродам следующим образом:
- Неметаллы и их производны, анионы — к аноду
- Металлы и их производный, катионы — к катоду
Теперь рассмотрим электролиз водных растворов различных солей
Для этого нам понадобится ряд активности металлов электрохимический ряд напряжений:
Разберем сначала катионы:
- Если металл стоит до Н, то вместо него электролизу подвергается вода:
2H2O + 2е = H2 + 2OH– Образовавшийся водород H2 идет к катоду - Если металл стоит после Н, то он сам восстанавливается:Cu2+ + 2е = Cu0 Медь осаждается на катоде
- Катионы металлов, стоящие в ряду напряжений после алюминия до водорода, могут восстанавливаться вместе с молекулами воды:
2Н2О + 2е = Н2 + 2ОН—Zn2+ + 2e = Zn0
Теперь анионы-кислотные остатки:
- Кислородсодержащие кислотные остатки — вместо них электролизу подвергается вода:
2H2O — 4e = O2 + 4H+ Образовавшийся O2 выделяется на аноде - Бескислородные кислотные остатки — окисляются до простого вещества:
Cl− — 1e = Cl20 Хлор выделяется на аноде - Исключение: F− — вместо него будет выделяться кислород.
Примеры:
1.1. Катион стоит в ряду до Н, кислотный остаток содержит кислород О:
K2SO4↔2K++SO42−
K(-): 2H2O + 2e = H2 + 2OH−
A(+): 2H2O — 4e = O2 + 4H+
2H2O (электролиз) → 2H2 + O2
1.2. Катион стоит в ряду до Н, кислотный остаток беcкислородный:
LiCl ↔ Li+ + Cl−
катод (-): 2H2O + 2e = H2 + 2OH−
анод (+): Cl− — 1e = Cl0; Cl0+Cl0=Cl2
2LiCl + 2H2O(электролиз) → H2 + Cl2 +2LiOH
2.1. Катион стоит в ряду после Н, кислотный остаток содержит кислород О:
СuSO4 ↔ Cu2++SO42−
K(-): Cu2+ + 2e = Cu0
A(+): 2H2O — 4e = O2 + 4Н+
2CuSO4 + 2H2O(электролиз) → 2Cu + 2H2SO4 + O2
2.2. Катион стоит в ряду после Н, кислотный остаток беcкислородный:
катод (-): Cu2+ + 2e = Cu0
анод (+): 2Cl− — 2e = 2Cl0
CuCl2 (электролиз) →Cu + Cl2