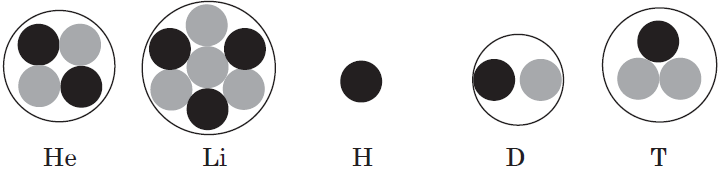
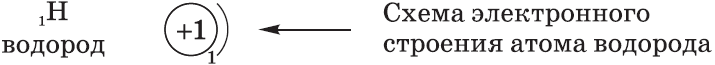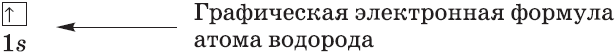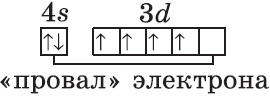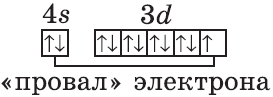Всего: 291 1–20 | 21–40 | 41–60 | 61–80 …
Добавить в вариант
Электронная конфигурация соответствует частице
1)
2)
3)
4)
Определите два элемента, электронные конфигурации ионов которых соответствуют электронной конфигурации атома криптона. Запишите в поле ответа номера выбранных элементов.
Показать
1
Из указанных в ряду химических элементов выберите три р−элемента. Расположите выбранные элементы в порядке уменьшения их валентности в летучих водородных соединениях. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Источник: ЕГЭ по химии 2020. Основная волна. Вариант 2
2
Из числа указанных в ряду элементов выберите два элемента, степень окисления которых в кислородсодержащих анионах может быть одинаковой. Запишите в поле ответа номера выбранных элементов.
Источник: ЕГЭ по химии 2020. Основная волна. Вариант 2
Источник: ЕГЭ по химии 2020. Основная волна. Вариант 2
Задания Д1 № 833
Электронная конфигурациясоответствует иону
1)
2)
3)
4)
Электронная конфигурация соответствует иону
1)
2)
3)
4)
Электронную конфигурацию ls22s22p6 имеет ион
1) Mg2+
2) К+
3) Fe2+
4) С −
Задания Д1 № 188
Электронную конфигурацию инертного газа имеет ион
1)
2)
3)
4)
Задания Д1 № 876
Электронная конфигурация соответствует иону
1)
2)
3)
4)
Электронная конфигурация 1s22s22p6 соответствует
1) атому
2) иону
3) иону
4) иону
Определите, двум атомам каких из указанных элементов до завершения внешнего уровня не хватает двух электронов. Запишите в поле ответа номера выбранных элементов.
Показать
1
Выберите три элемента, которые в периодической системе находятся в одном периоде, и расположите эти элементы в порядке уменьшения радиуса атома. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
2
Выберите два элемента, высшая степень окисления которых равна +4. Запишите в поле ответа номера выбранных элементов.
Задания Д1 № 446
Электронная конфигурация соответствует частице
1)
2)
3)
4)
Электронная конфигурация 1s22s22p63s23p6 соответствует частице
1) N3-
2) Ca2+
3) F—
4) Al3+
Электронную конфигурацию 1s22s22p63s23p6 имеет ион
1) Cl−
2) Al3+
3) O2−
4) Mn2+
Электронная конфигурация 1s22s22p63s23p4 соответствует
1) атому
2) иону
3) иону
4) атому
Одинаковую электронную конфигурацию имеют
1) атомы и
2) ионы и
3) ион и атом
4) ионы и
Электронная конфигурация соответствует частице
1)
2)
3)
4)
Определите, атомы каких двух из указанных элементов имеют в основном состоянии один неспаренный электрон. Запишите в поле ответа номера выбранных элементов.
Показать
1
Выберите три элемента, которые в Периодической системе находятся в одном периоде, и расположите эти элементы в порядке уменьшения элекроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
2
Выберите два элемента, которые в соединениях могут иметь степень окисления –1. Запишите в поле ответа номера выбранных элементов.
Задания Д1 № 360
Атому аргона в основном состоянии соответствует электронная конфигурация частицы
1)
2)
3)
4)
Восьмиэлектронную внешнюю оболочку имеет ион
1)
2)
3)
4)
Электронную конфигурацию инертного газа имеет ион
1)
2)
3)
4)
Одинаковую электронную конфигурацию имеют
1) ионы и
2) ионы и
3) ион и атом
4) атомы и
Всего: 291 1–20 | 21–40 | 41–60 | 61–80 …
Понятие атом возникло еще в античном мире для обо значения частиц вещества. В переводе с греческого атом означает «неделимый».
Электроны
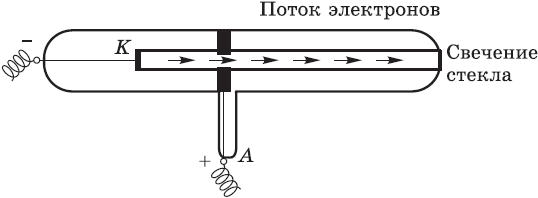
Ирландский физик Стони на основании опытов пришел к выводу, что электричество переносится мельчайшими частицами, существующими в атомах всех химических элементов. В $1891$ г. Стони предложил эти частицы назвать электронами, что по-гречески означает «янтарь».
Через несколько лет после того, как электрон получил свое название, английский физик Джозеф Томсон и французский физик Жан Перрен доказали, что электроны несут на себе отрицательный заряд. Это наименьший отрицательный заряд, который в химии принят за единицу $(–1)$. Томсон даже сумел определить скорость движения электрона (она равна скорости света — $300 000$ км/с) и массу электрона (она в $1836$ раз меньше массы атома водорода).
Томсон и Перрен соединяли полюса источника тока с двумя металлическими пластинами — катодом и анодом, впаянными в стеклянную трубку, из которой был откачан воздух. При подаче на пластины-электроды напряжения около 10 тысяч вольт в трубке вспыхивал светящийся разряд, а от катода (отрицательного полюса) к аноду (положительному полюсу) летели частицы, которые ученые сначала назвали катодными лучами, а затем выяснили, что это был поток электронов. Электроны, ударяясь об особые вещества, нанесенные, например, на экран телевизора, вызывают свечение.
Был сделан вывод: электроны вырываются из атомов материала, из которого сделан катод.
Свободные электроны или поток их можно получить и другими способами, например, при накаливании металлической проволоки или при падении света на металлы, образованные элементами главной подгруппы I группы таблицы Менделеева (например, цезий).
Состояние электронов в атоме
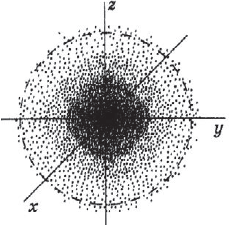
Под состоянием электрона в атоме понимают совокупность информации об энергии определенного электрона в пространстве, в котором он находится. Мы уже знаем, что электрон в атоме не имеет траектории движения, т.е. можно говорить лишь о вероятности нахождения его в пространстве вокруг ядра. Он может находиться в любой части этого пространства, окружающего ядро, и совокупность различных положений его рассматривают как электронное облако с определенной плотностью отрицательного заряда. Образно это можно представить себе так: если бы удалось через сотые или миллионные доли секунды сфотографировать положение электрона в атоме, как при фотофинише, то электрон на таких фотографиях был бы представлен в виде точки. При наложении бесчисленного множества таких фотографий получилась бы картина электронного облака с наибольшей плотностью там, где этих точек больше всего.
На рисунке показан «разрез» такой электронной плотности в атоме водорода, проходящей через ядро, а штриховой линией ограничена сфера, внутри которой вероятность обнаружения электрона составляет $90%$. Ближайший к ядру контур охватывает область пространства, в которой вероятность обнаружения электрона — $10%$, вероятность обнаружения электрона внутри второго от ядра контура составляет $20%$, внутри третьего — $≈30%$ и т.д. В состоянии электрона есть некая неопределенность. Чтобы охарактеризовать это особое состояние, немецкий физик В. Гейзенберг ввел понятие о принципе неопределенности, т.е. показал, что невозможно определить одновременно и точно энергию и местоположение электрона. Чем точнее определена энергия электрона, тем неопределеннее его положение, и наоборот, определив положение, нельзя определить энергию электрона. Область вероятности обнаружения электрона не имеет четких границ. Однако можно выделить пространство, где вероятность нахождения электрона максимальна.
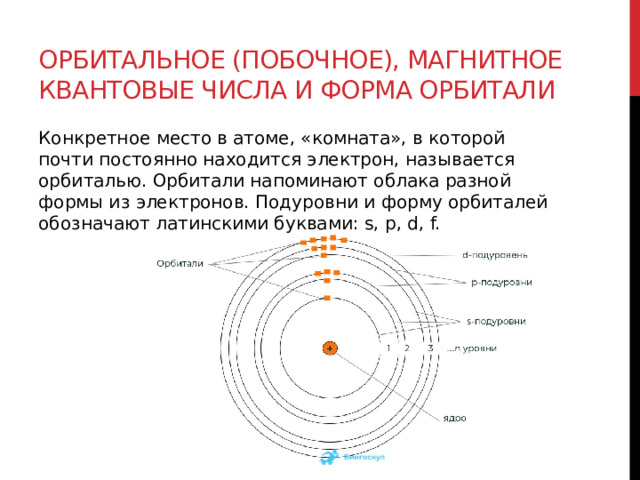
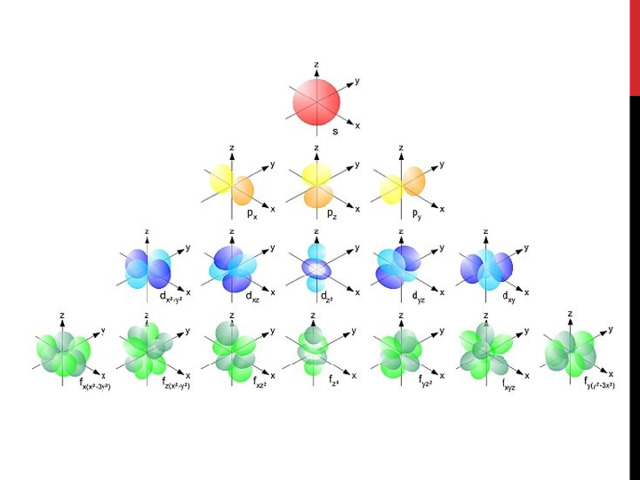
Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью.
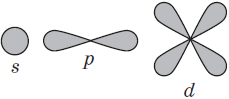
В нем заключено приблизительно $90%$ электронного облака, и это означает, что около $90%$ времени электрон находится в этой части пространства. По форме различают $4$ известных ныне типа орбиталей, которые обозначаются латинскими буквами $s, p, d$ и $f$. Графическое изображение некоторых форм электронных орбиталей представлено на рисунке.
Важнейшей характеристикой движения электрона на определенной орбитали является энергия его связи с ядром. Электроны, обладающие близкими значениями энергии, образуют единый электронный слой, или энергетический уровень. Энергетические уровни нумеруют, начиная от ядра: $1, 2, 3, 4, 5, 6$ и $7$.
Целое число $n$, обозначающее номер энергетического уровня, называют главным квантовым числом.
Оно характеризует энергию электронов, занимающих данный энергетический уровень. Наименьшей энергией обладают электроны первого энергетического уровня, наиболее близкого к ядру. По сравнению с электронами первого уровня электроны последующих уровней характеризуются большим запасом энергии. Следовательно, наименее прочно связаны с ядром атома электроны внеш него уровня.
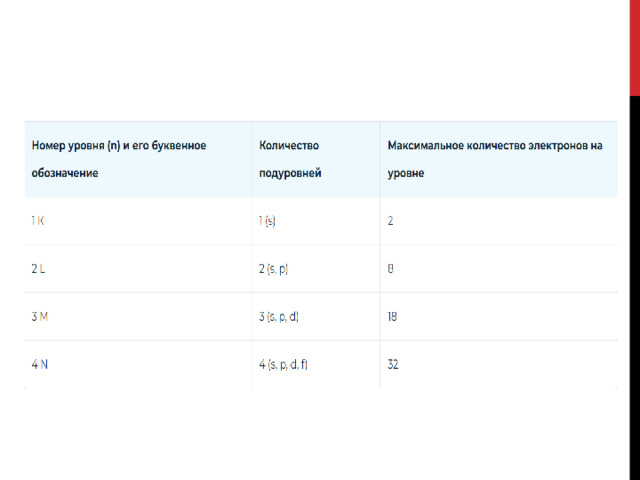
Число энергетических уровней (электронных слоев) в атоме равно номеру периода в системе Д. И. Менделеева, к которому принадлежит химический элемент: у атомов элементов первого периода один энергетический уровень; второго периода — два; седьмого периода — семь.
Наибольшее число электронов на энергетическом уровне определяется по формуле:
$N=2n^2,$
где $N$ — максимальное число электронов; $n$ — номер уровня, или главное квантовое число. Следовательно: на первом, ближайшем к ядру энергетическом уровне может находиться не более двух электронов; на втором — не более $8$; на третьем — не более $18$; на четвертом — не более $32$. А как, в свою очередь, устроены энергетические уровни (электронные слои)?
Начиная со второго энергетического уровня $(n = 2)$, каждый из уровней подразделяется на подуровни (подслои), несколько отличающиеся друг от друга энергией связи с ядром.
Число подуровней равно значению главного квантового числа: первый энергетический уровень имеет один под уровень; второй — два; третий — три; четвертый — четыре. Подуровни, в свою очередь, образованы орбиталями.
Каждому значению $n$ соответствует число орбиталей, равное $n^2$. По данным, представленным в таблице, можно проследить связь главного квантового числа $n$ с числом подуровней, типом и числом орбиталей и максимальным числом электронов на подуровне и уровне.
Главное квантовое число, типы и число орбиталей, максимальное число электронов на подуровнях и уровнях.
| Энергетический уровень $(n)$ | Число подуровней, равное $n$ | Тип орбитали | Число орбиталей | Максимальное число электронов | ||
| в подуровне | в уровне, равное $n^2$ | в подуровне | на уровне, равное $n^2$ | |||
| $K(n=1)$ | $1$ | $1s$ | $1$ | $1$ | $2$ | $2$ |
| $L(n=2)$ | $2$ | $2s$ | $1$ | $4$ | $2$ | $8$ |
| $2p$ | $3$ | $6$ | ||||
| $M(n=3)$ | $3$ | $3s$ | $1$ | $9$ | $2$ | $18$ |
| $3p$ | $3$ | $6$ | ||||
| $3d$ | $5$ | $10$ | ||||
| $N(n=4)$ | $4$ | $4s$ | $1$ | $16$ | $2$ | $32$ |
| $4p$ | $3$ | $6$ | ||||
| $4d$ | $5$ | $10$ | ||||
| $4f$ | $7$ | $14$ |
Подуровни принято обозначать латинскими буквами, равно как и форму орбиталей, из которых они состоят: $s, p, d, f$. Так:
- $s$-подуровень — первый, ближайший к ядру атома подуровень каждого энергетического уровня, состоит из одной $s$-орбитали;
- $р$-подуровень — второй подуровень каждого, кроме первого, энергетического уровня, состоит из трех $р$-орбиталей;
- $d$-подуровень — третий подуровень каждого, начиная с третьего, энергетического уровня, состоит из пяти $d$-орбиталей;
- $f$-подуровень каждого, начиная с четвертого, энергетического уровня, состоит из семи $f$-орбиталей.
Ядро атома
Но не только электроны входят в состав атомов. Физик Анри Беккерель обнаружил, что природный минерал, содержащий соль урана, тоже испускает неведомое излучение, засвечивая фотопленки, закрытые от света. Это явление было названо радиоактивностью.
Различают три вида радиоактивных лучей:
- $α$-лучи, которые состоят из $α$-частиц, имеющих заряд в $2$ раза больше заряда электрона, но с положительным знаком, и массу в $4$ раза больше массы атома водорода;
- $β$-лучи представляют собой поток электронов;
- $γ$-лучи — электромагнитные волны с ничтожно малой массой, не несущие электрического заряда.
Следовательно, атом имеет сложное строение — состоит из положительно заряженного ядра и электронов.
Как же устроен атом?
В 1910 г. в Кембридже, близ Лондона, Эрнест Резерфорд со своими учениками и коллегами изучал рассеяние $α$-частиц, проходящих через тоненькую золотую фольгу и падаюших на экран. Альфа-частицы обычно отклонялись от первоначального направления всего на один градус, подтверждая, казалось бы, равномерность и однородность свойств атомов золота. И вдруг исследователи заметили, что некоторые $α$-частицы резко меняли направление своего пути, будто наталкиваясь на какую-то преграду.
Разместив экран перед фольгой, Резерфорд сумел обнаружить даже те редчайшие случаи, когда $α$-частицы, отразившись от атомов золота, летели в противоположном направлении.
Расчеты показали, что наблюдаемые явления могли произойти, если бы вся масса атома и весь его положительный заряд были сосредоточены в крохотном центральном ядре. Радиус ядра, как выяснилось, в 100 000 раз меньше радиуса всего атома, той его области, в которой находятся электроны, имеющие отрицательный заряд. Если применить образное сравнение, то весь объем атома можно уподобить стадиону в Лужниках, а ядро — футбольному мячу, расположенному в центре поля.
Атом любого химического элемента сравним с крохотной Солнечной системой. Поэтому такую модель атома, предложенную Резерфордом, называют планетарной.
Протоны и нейтроны
Оказывается, и крошечное атомное ядро, в котором сосредоточена вся масса атома, состоит из частиц двух видов — протонов и нейтронов.
Протоны имеют заряд, равный заряду электронов, но противоположный по знаку $(+1)$, и массу, равную массе атома водорода (она принята в химии за единицу). Обо значаются протоны знаком $↙{1}↖{1}p$ (или $р+$). Нейтроны не несут заряда, они нейтральны и имеют массу, равную массе протона, т.е. $1$. Обозначают нейтроны знаком $↙{0}↖{1}n$ (или $n^0$).
Протоны и нейтроны вместе называют нуклонами (от лат. nucleus — ядро).
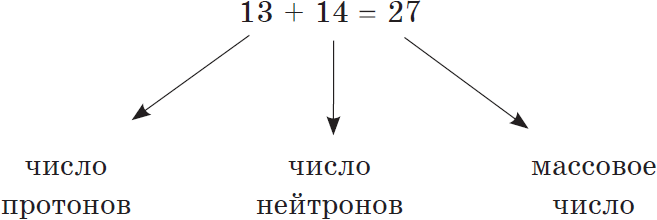
Сумма числа протонов и нейтронов в атоме называется массовым числом. Например, массовое число атома алюминия:
Так как массой электрона, ничтожно малой, можно пренебречь, то очевидно, что в ядре сосредоточена вся масса атома. Электроны обозначают так: $e↖{-}$.
Поскольку атом электронейтрален, также очевидно, что число протонов и электронов в атоме одинаково. Оно равно порядковому номеру химического элемента, присвоенному ему в Периодической системе. Например, в ядре атома железа содержится $26$ протонов, а вокруг ядра вращается $26$ электронов. А как определить число ней тронов?
Как известно, масса атома складывается из массы протонов и нейтронов. Зная порядковый номер элемента $(Z)$, т.е. число протонов, и массовое число $(А)$, равное сумме чисел протонов и нейтронов, можно найти число нейтронов $(N)$ по формуле:
$N=A-Z$
Например, число нейтронов в атоме железа равно:
$56 – 26 = 30$.
В таблице представлены основные характеристики элементарных частиц.
Основные характеристики элементарных частиц.
| Частица и ее обозначение | Масса | Заряд | Примечание |
| Протон — $p^+$ | $1$ | $+1$ | Число протонов равно порядковому номеру элемента |
| Нейтрон — $n^0$ | $1$ | $0$ | Число нейтронов находят по формуле: $N=A-Z$ |
| Электрон — $e↖{-}$ | ${1}/{1837}$ | $-1$ | Число электронов равно порядковому номеру элемента |
Изотопы
Разновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разное массовое число, называются изотопами.
Слово изотоп состоит из двух греческих слов: isos — одинаковый и topos — место, обозначает «занимающий одно место» (клетку) в Периодической системе элементов.
Химические элементы, встречающиеся в природе, являются смесью изотопов. Так, углерод имеет три изотопа с массой $12, 13, 14$; кислород — три изотопа с массой $16, 17, 18$ и т. д.
Обычно приводимая в Периодической системе относительная атомная масса химического элемента является средним значением атомных масс природной смеси изотопов данного элемента с учетом их относительного содержания в природе, поэтому значения атомных масс довольно часто являются дробными. Например, атомы природного хлора представляют собой смесь двух изотопов — $35$ (их в природе $75%$) и $37$ (их $25%$); следовательно, относительная атомная масса хлора равна $35.5$. Изотопы хлора записываются так:
$↖{35}↙{17}{Cl}$ и $↖{37}↙{17}{Cl}$
Химические свойства изотопов хлора совершенно одинаковы, как и изотопов большинства химических элементов, например калия, аргона:
$↖{39}↙{19}{K}$ и $↖{40}↙{19}{K}$, $↖{39}↙{18}{Ar}$ и $↖{40}↙{18}{Ar}$
Однако изотопы водорода сильно различаются по свойствам из-за резкого кратного увеличения их относительной атомной массы; им даже присвоены индивидуальные названия и химические знаки: протий — $↖{1}↙{1}{H}$; дейтерий — $↖{2}↙{1}{H}$, или $↖{2}↙{1}{D}$; тритий — $↖{3}↙{1}{H}$, или $↖{3}↙{1}{T}$.
Теперь можно дать современное, более строгое и научное определение химическому элементу.
Химический элемент — это совокупность атомов с одинаковым зарядом ядра.
Строение электронных оболочек атомов элементов первых четырех периодов
Рассмотрим отображение электронных конфигураций атомов элементов по периодам системы Д. И. Менделеева.
Элементы первого периода.
Схемы электронного строения атомов показывают распределение электронов по электронным слоям (энергетическим уровням).
Электронные формулы атомов показывают распределение электронов по энергетическим уровням и под уровням.
Графические электронные формулы атомов показывают распределение электронов не только по уровням и под уровням, но и по орбиталям.
В атоме гелия первый электронный слой завершен — в нем $2$ электрона.
Водород и гелий — $s$-элементы, у этих атомов заполняется электронами $s$-орбиталь.
Элементы второго периода.
У всех элементов второго периода первый электронный слой заполнен, и электроны заполняют $s-$ и $р$-орбитали второго электронного слоя в соответствии с принципом наименьшей энергии (сначала $s$, а затем $р$) и правилами Паули и Хунда.
В атоме неона второй электронный слой завершен — в нем $8$ электронов.
Элементы третьего периода.
У атомов элементов третьего периода первый и второй электронные слои завершены, поэтому заполняется третий электронный слой, в котором электроны могут занимать 3s-, 3р- и 3d-под уровни.
Строение электронных оболочек атомов элементов третьего периода.
У атома магния достраивается $3,5$-электронная орбиталь. $Na$ и $Mg$ — $s$-элементы.
У алюминия и последующих элементов заполняется электронами $3d$-подуровень.
В атоме аргона на внешнем слое (третьем электронном слое) $8$ электронов. Как внешний слой завершен, но всего в третьем электронном слое, как вы уже знаете, может быть 18 электронов, а это значит, что у элементов третьего периода остаются незаполненными $3d$-орбитали.
Все элементы от $Al$ до $Ar$ — $р$-элементы.
$s-$ и $р$-элементы образуют главные подгруппы в Периодической системе.
Элементы четвертого периода.
У атомов калия и кальция появляется четвертый электронный слой, заполняется $4s$-подуровень, т.к. он имеет меньшую энергию, чем $3d$-подуровень. Для упрощения графических электронных формул атомов элементов четвертого периода:
- обозначим условно графическую электронную формулу аргона так: $Ar$;
- не будем изображать подуровни, которые у этих атомов не заполняются.
$К, Са$ — $s$-элементы, входящие в главные подгруппы. У атомов от $Sc$ до $Zn$ заполняется электронами 3d-подуровень. Это $3d$-элементы. Они входят в побочные подгруппы, у них заполняется предвнешний электронный слой, их относят к переходным элементам.
Обратите внимание на строение электронных оболочек атомов хрома и меди. В них происходит «провал» одного электрона с $4s-$ на $3d$-подуровень, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций $3d^5$ и $3d^{10}$:
$↙{24}{Cr}$ $1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{4} 4s^{2}…$
$↙{29}{Cu}$ $1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{9}4s^{2}…$
| Символ элемента, порядковый номер, название | Схема электронного строения | Электронная формула | Графическая электронная формула |
| $↙{19}{K}$ Калий | 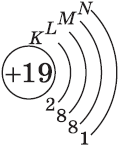 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^1$ | 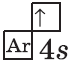 |
| $↙{20}{C}$ Кальций | 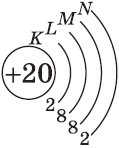 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2$ | 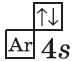 |
| $↙{21}{Sc}$ Скандий | 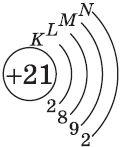 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^1{3}d^1$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^1{4}s^1$ | 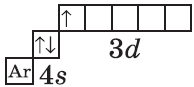 |
| $↙{22}{Ti}$ Титан |  |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2{3}d^2$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^2{4}s^2$ | 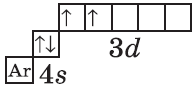 |
| $↙{23}{V}$ Ванадий |  |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2{3}d^3$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^3{4}s^2$ | 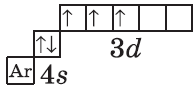 |
| $↙{24}{Сr}$ Хром | 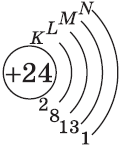 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^1{3}d^5$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^5{4}s^1$ | 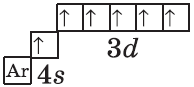 |
| $↙{29}{Сu}$ Хром | 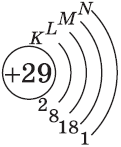 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^1{3}d^{10}$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^{10}{4}s^1$ | 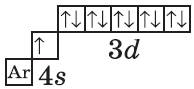 |
| $↙{30}{Zn}$ Цинк | 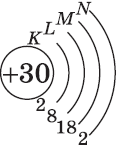 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2{3}d^{10}$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^{10}{4}s^2$ | 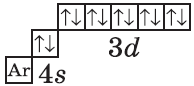 |
| $↙{31}{Ga}$ Галлий | 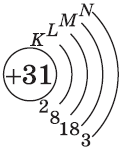 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2{3}d^{10}4p^{1}$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^{10}{4}s^{2}4p^{1}$ | 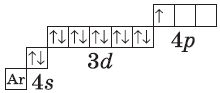 |
| $↙{36}{Kr}$ Криптон | 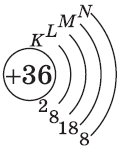 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2{3}d^{10}4p^6$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^{10}{4}s^{2}4p^6$ | 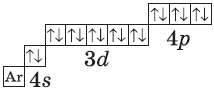 |
В атоме цинка третий электронный слой завершен — в нем заполнены все подуровни $3s, 3р$ и $3d$, всего на них $18$ электронов.
У следующих за цинком элементов продолжает заполняться четвертый электронный слой, $4р$-подуровень. Элементы от $Ga$ до $Кr$ — $р$-элементы.
У атома криптона внешний (четвертый) слой завершен, имеет $8$ электронов. Но всего в четвертом электронном слое, как вы знаете, может быть $32$ электрона; у атома криптона пока остаются незаполненными $4d-$ и $4f$-подуровни.
У элементов пятого периода идет заполнение подуровней в следующем порядке: $5s → 4d → 5р$. И также встречаются исключения, связанные с «провалом» электронов, у $↙{41}Nb$, $↙{42}Мо$, $↙{44}Ru$, $↙{45}Rh$, $↙{46}Pd$, $↙{47}Ag$. В шестом и седьмом периодах появляются $f$-элементы, т.е. элементы, у которых идет заполнение соответственно $4f-$ и $5f$-подуровней третьего снаружи электронного слоя.
$4f$-элементы называют лантаноидами.
$5f$-элементы называют актиноидами.
Порядок заполнения электронных подуровней в атомах элементов шестого периода: $↙{55}Cs$ и $↙{56}Ва$ — $6s$-элементы; $↙{57}La … 6s^{2}5d^{1}$ — $5d$-элемент; $↙{58}Се$ – $↙{71}Lu — 4f$-элементы; $↙{72}Hf$ – $↙{80}Hg — 5d$-элементы; $↙{81}Т1$ – $↙{86}Rn — 6d$-элементы. Но и здесь встречаются элементы, у которых нарушается порядок заполнения электронных орбиталей, что, например, связано с большей энергетической устойчивостью наполовину и полностью заполненных $f$-подуровней, т.е. $nf^7$ и $nf^{14}$.
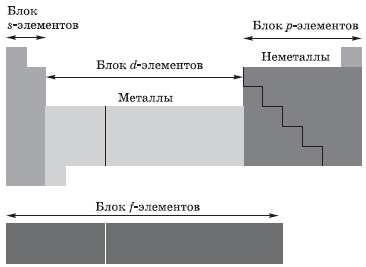
В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы, как вы уже поняли, делят на четыре электронных семейства, или блока:
- $s$-элементы; электронами заполняется $s$-подуровень внешнего уровня атома; к $s$-элементам относятся водород, гелий и элементы главных подгрупп I и II групп;
- $р$-элементы; электронами заполняется $р$-подуровень внешнего уровня атома; к $р$-элементам относятся элементы главных подгрупп III–VIII групп;
- $d$-элементы; электронами заполняется $d$-подуровень предвнешнего уровня атома; к $d$-элементам относятся элементы побочных подгрупп I–VIII групп, т.е. элементы вставных декад больших периодов, расположенных между $s-$ и $р-$элементами. Их также называют переходными элементами;
- $f$-элементы; электронами заполняется $f-$подуровень третьего снаружи уровня атома; к ним относятся лантаноиды и актиноиды.
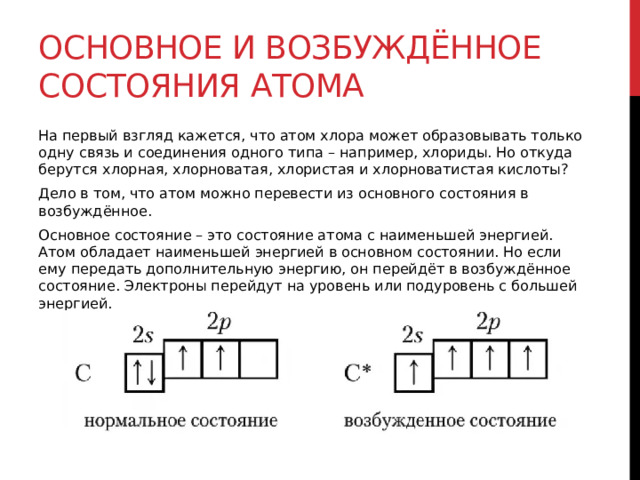
Электронная конфигурация атома. Основное и возбужденное состояние атомов
Швейцарский физик В. Паули в $1925$ г. установил, что в атоме на одной орбитали может находиться не более двух электронов, имеющих противоположные (антипараллельные) спины (в переводе с английского — веретено), т.е. обладающих такими свойствами, которые условно можно представить себе как вращение электрона вокруг своей воображаемый оси по часовой стрелке или против. Этот принцип носит название принципа Паули.
Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны, т.е. электроны с противоположными спинами.
На рисунке показана схема деления энергетических уровней на подуровни.
$s-$Орбиталь, как вы уже знаете, имеет сферическую форму. Электрон атома водорода $(n = 1)$ располагается на этой орбитали и неспарен. По этому его электронная формула, или электронная конфигурация, записывается так: $1s^1$. В электронных формулах номер энергетического уровня обозначается цифрой, стоящей перед буквой $(1…)$, латинской буквой обозначают подуровень (тип орбитали), а цифра, которая записывается справа сверху от буквы (как показатель степени), показывает число электронов на подуровне.
Для атома гелия Не, имеющего два спаренных электрона на одной $s-$орбитали, эта формула: $1s^2$. Электронная оболочка атома гелия завершена и очень устойчива. Гелий — это благородный газ. На втором энергетическом уровне $(n = 2)$ имеются четыре орбитали, одна $s$ и три $р$. Электроны $s$-орбитали второго уровня ($2s$-орбитали) обладают более высокой энергией, т.к. находятся на большем расстоянии от ядра, чем электроны $1s$-орбитали $(n = 2)$. Вообще для каждого значения $n$ существует одна $s-$орбиталь, но с соответствующим запасом энергии электронов на нем и, следовательно, с соответствующим диаметром, растущим по мере увеличения значения $n$.$s-$Орбиталь, как вы уже знаете, имеет сферическую форму. Электрон атома водорода $(n = 1)$ располагается на этой орбитали и неспарен. По этому его электронная формула, или электронная конфигурация, записывается так: $1s^1$. В электронных формулах номер энергетического уровня обозначается цифрой, стоящей перед буквой $(1…)$, латинской буквой обозначают подуровень (тип орбитали), а цифра, которая записывается справа сверху от буквы (как показатель степени), показывает число электронов на подуровне.
Для атома гелия $Не$, имеющего два спаренных электрона на одной $s-$орбитали, эта формула: $1s^2$. Электронная оболочка атома гелия завершена и очень устойчива. Гелий — это благородный газ. На втором энергетическом уровне $(n = 2)$ имеются четыре орбитали, одна $s$ и три $р$. Электроны $s-$орбитали второго уровня ($2s$-орбитали) обладают более высокой энергией, т.к. находятся на большем расстоянии от ядра, чем электроны $1s$-орбитали $(n = 2)$. Вообще для каждого значения $n$ существует одна $s-$орбиталь, но с соответствующим запасом энергии электронов на нем и, следовательно, с соответствующим диаметром, растущим по мере увеличения значения $n$.
$р-$Орбиталь имеет форму гантели, или объемной восьмерки. Все три $р$-орбитали расположены в атоме взаимно перпендикулярно вдоль пространственных координат, проведенных через ядро атома. Следует подчеркнуть еще раз, что каждый энергетический уровень (электронный слой), начиная с $n= 2$, имеет три $р$-орбитали. С увеличением значения $n$ электроны занимают $р$-орбитали, расположенные на больших расстояниях от ядра и направленные по осям $x, y, z$.
У элементов второго периода $(n = 2)$ заполняется сначала одна $s$-орбиталь, а затем три $р$-орбитали; электронная формула $Li: 1s^{2}2s^{1}$. Электрон $2s^1$ слабее связан с ядром атома, поэтому атом лития может легко отдавать его (как вы, очевидно, помните, этот процесс называется окислением), превращаясь в ион лития $Li^+$.
В атоме бериллия Be четвертый электрон также размещается на $2s$-орбитали: $1s^{2}2s^{2}$. Два внешних электрона атома бериллия легко отрываются — $В^0$ при этом окисляется в катион $Ве^{2+}$.
У атома бора пятый электрон занимает $2р$-орбиталь: $1s^{2}2s^{2}2p^{1}$. Далее у атомов $C, N, O, F$ идет заполнение $2р$-орбиталей, которое заканчивается у благородного газа неона: $1s^{2}2s^{2}2p^{6}$.
У элементов третьего периода заполняются соответственно $3s-$ и $3р$-орбитали. Пять $d$-орбиталей третьего уровня при этом остаются свободными:
$↙{11}Na 1s^{2}2s^{2}2p^{6}3s^{1}$,
$↙{17}Cl 1s^{2}2s^{2}2p^{6}3s^{2}3p^{5}$,
$↙{18}Ar 1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}$.
Иногда в схемах, изображающих распределение электронов в атомах, указывают только число электронов на каждом энергетическом уровне, т.е. записывают сокращенные электронные формулы атомов химических элементов, в отличие от приведенных выше полных электронных формул, например:
$↙{11}Na 2, 8, 1;$ $↙{17}Cl 2, 8, 7;$ $↙{18}Ar 2, 8, 8$.
У элементов больших периодов (четвертого и пятого) первые два электрона занимают соответственно $4s-$ и $5s$-орбитали: $↙{19}K 2, 8, 8, 1;$ $↙{38}Sr 2, 8, 18, 8, 2$. Начиная с третьего элемента каждого большого периода, последующие десять электронов поступят на предыдущие $3d-$ и $4d-$орбитали соответственно (у элементов побочных подгрупп): $↙{23}V 2, 8, 11, 2;$ $↙{26}Fr 2, 8, 14, 2;$ $↙{40}Zr 2, 8, 18, 10, 2;$ $↙{43}Tc 2, 8, 18, 13, 2$. Как правило, когда будет заполнен предыдущий $d$-подуровень, начнет заполняться внешний (соответственно $4р-$ и $5р-$) $р-$подуровень: $↙{33}As 2, 8, 18, 5;$ $↙{52}Te 2, 8, 18, 18, 6$.
У элементов больших периодов — шестого и незавершенного седьмого — электронные уровни и подуровни заполняются электронами, как правило, так: первые два электрона поступают на внешний $s-$подуровень: $↙{56}Ba 2, 8, 18, 18, 8, 2;$ $↙{87}Fr 2, 8, 18, 32, 18, 8, 1$; следующий один электрон (у $La$ и $Са$) на предыдущий $d$-подуровень: $↙{57}La 2, 8, 18, 18, 9, 2$ и $↙{89}Ac 2, 8, 18, 32, 18, 9, 2$.
Затем последующие $14$ электронов поступят на третий снаружи энергетический уровень, на $4f$ и $5f$-орбитали соответственно лантоноидов и актиноидов: $↙{64}Gd 2, 8, 18, 25, 9, 2;$ $↙{92}U 2, 8, 18, 32, 21, 9, 2$.
Затем снова начнет застраиваться второй снаружи энергетический уровень ($d$-подуровень) у элементов побочных подгрупп: $↙{73}Ta 2, 8, 18, 32, 11, 2;$ $↙{104}Rf 2, 8, 18, 32, 32, 10, 2$. И, наконец, только после полного заполнения десятью электронами $d$-подуровня будет снова заполняться $р$-под уровень: $↙{86}Rn 2, 8, 18, 32, 18, 8$.
Очень часто строение электронных оболочек атомов изображают с помощью энергетических, или квантовых ячеек — записывают так называемые графические электронные формулы. Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электрон обозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули, согласно которому в ячейке (орбитали) может быть не более двух электронов, но с антипараллельными спинами, и правило Ф. Хунда, согласно которому электроны занимают свободные ячейки сначала по одному и имеют при этом одинаковое значение спина, и лишь затем спариваются, но спины при этом, по принципу Паули, будут уже противоположно направленными.
Тест на строение атома и электронные конфигурации.
Задание №1
Четыре электрона на внешнем энергетическом уровне имеют атомы химических элементов:
- 1. Na
- 2. K
- 3. Si
- 4. Mg
- 5. C
Решение
Ответ: 35
Задание №2
Одинаковое число валентных электронов имеют атомы:
- 1. Cr
- 2. V
- 3. As
- 4. Al
- 5. Li
Решение
Ответ: 23
Задание №3
Одинаковое число валентных электронов имеют атомы:
- 1. Ca
- 2. Se
- 3. Fe
- 4. S
- 5. Al
Решение
Ответ: 24
Задание №4
Одинаковое число валентных электронов имеют атомы:
- 1. Ca
- 2. Al
- 3. Cl
- 4. Fe
- 5. Mn
Решение
Ответ: 35
Задание №5
Одинаковую электронную конфигурацию внешнего энергетического уровня имеют атомы:
- 1. Cr
- 2. Al
- 3. K
- 4. N
- 5. Cl
Решение
Ответ: 13
Задание №6
Одинаковое число неспаренных электронов в основном состоянии имеют атомы:
- 1. Al
- 2. N
- 3. Ca
- 4. P
- 5. O
Решение
Ответ: 24
Задание №7
Одинаковое число неспаренных электронов в основном состоянии имеют атомы:
- 1. Na
- 2. Ca
- 3. As
- 4. Cr
- 5. Al
Решение
Ответ: 15
Задание №8
Три неспаренных электрона в основном состоянии имеют атомы:
- 1. B
- 2. V
- 3. O
- 4. As
- 5. Ne
Решение
Ответ: 24
Задание №9
Одинаковое число неспаренных электронов в основном состоянии содержат атомы:
- 1. Ti
- 2. Al
- 3. C
- 4. Ba
- 5. N
Решение
Ответ: 13
Задание №10
Один неспаренный электрон в основном состоянии имеют атомы:
- 1. Ba
- 2. Al
- 3. N
- 4. Cl
- 5. Ca
Решение
Ответ: 24
[adsp-pro-3]
Задание №11
В основном состоянии все валентные электроны расположены только на s-подуровне у атомов:
- 1. Sb
- 2. Ra
- 3. Fe
- 4. B
- 5. Na
Решение
Ответ: 25
Задание №12
Валентные электроны, расположенные на s- и d-подуровнях, содержат атомы:
- 1. Rb
- 2. Cr
- 3. Sr
- 4. V
- 5. P
Решение
Ответ: 24
Задание №13
Все валентные электроны расположены на третьем энергетическом уровне у атомов:
- 1. Cl
- 2. N
- 3. C
- 4. Be
- 5. P
Решение
Ответ: 15
Задание №14
К s-элементам относятся:
- 1. Cu
- 2. Rb
- 3. Sc
- 4. Al
- 5. Ra
Решение
Ответ: 25
Задание №15
К s-элементам относятся:
- 1. He
- 2. P
- 3. Al
- 4. Cl
- 5. Li
Решение
Ответ: 15
Задание №16
К p-элементам относятся:
- 1. Cu
- 2. B
- 3. Cr
- 4. Ba
- 5. Sb
Решение
Ответ: 25
Задание №17
К d-элементам относятся:
- 1. Cs
- 2. Zn
- 3. Cl
- 4. Te
- 5. Mn
Решение
Ответ: 25
Задание №18
Химические элементы, атомы которых не содержат электронов на d-подуровне:
- 1. K
- 2. Sr
- 3. Mn
- 4. Ca
- 5. Br
Решение
Ответ: 14
Задание №19
Химические элементы, атомы которых не содержат электронов на d-подуровне:
- 1. Cl
- 2. F
- 3. Br
- 4. Cu
- 5. Fe
Решение
Ответ: 12
Задание №20
Валентных электронов на d-подуровне не содержат атомы химических элементов:
- 1. Ti
- 2. Br
- 3. Se
- 4. Sc
- 5. Ni
Решение
Ответ: 23
[adsp-pro-3]
Задание №21
Одинаковое число нейтронов и протонов содержат атомы наиболее распространенных изотопов:
- 1. S
- 2. Al
- 3. K
- 4. Ca
- 5. Na
Решение
Ответ: 14
Задание №22
Число нейтронов большее, чем число протонов содержат ядра наиболее распространенных изотопов:
- 1. Ar
- 2. Si
- 3. K
- 4. Mg
- 5. O
Решение
Ответ: 13
Задание №23
Не могут переходить в возбужденное состояние атомы:
- 1. N
- 2. Ca
- 3. F
- 4. Sr
- 5. Se
Решение
Ответ: 13
Задание №24
Не могут переходить в возбужденное состояние атомы:
- 1. O
- 2. S
- 3. He
- 4. As
- 5. P
Решение
Ответ: 13
Задание №25
Не могут переходить в возбужденное состояние атомы:
- 1. Cl
- 2. F
- 3. B
- 4. Ne
- 5. C
Решение
Ответ: 24
Задание №26
Не могут переходить в возбужденное состояние атомы:
- 1. P
- 2. Br
- 3. Be
- 4. O
- 5. N
Решение
Ответ: 45
Задание №27
Не могут переходить в возбужденное состояние атомы:
- 1. Ca
- 2. P
- 3. O
- 4. F
- 5. S
Решение
Ответ: 34
Задание №28
Возможен переход в возбужденное состояние для атомов:
- 1. Cs
- 2. C
- 3. Al
- 4. Rb
- 5. N
Решение
Ответ: 23
Задание №29
Один неспаренный электрон в основном состоянии содержат атомы:
- 1. Ba
- 2. Al
- 3. N
- 4. Cl
- 5. Ca
Решение
Ответ: 24
Задание №30
Из предложенного перечня химических элементов выберите два таких, наиболее устойчивые катионы которых имеют одинаковые электронные конфигурации:
- 1. Al
- 2. Ca
- 3. Ba
- 4. Na
- 5. I
Решение
Ответ: 14
[adsp-pro-3]
Задание №31
Три неспаренных электрона в основном состоянии содержат атомы:
- 1. B
- 2. N
- 3. Al
- 4. Se
- 5. P
Решение
Ответ: 25
Задание №32
В возбужденном состоянии электронную форму внешнего электронного уровня ns1np2 имеют атомы:
- 1. B
- 2. Al
- 3. F
- 4. Fe
- 5. N
Решение
Ответ: 12
Задание №33
Электронную формулу внешнего энергетического уровня ns1 в основном состоянии имеют атомы:
- 1. Cr
- 2. Ca
- 3. Cs
- 4. Cl
- 5. Br
Решение
Ответ: 13
Задание №34
Три неспаренных электрона в возбужденном состоянии содержат атомы:
- 1. As
- 2. B
- 3. P
- 4. F
- 5. Al
Решение
Ответ: 25
Задание №35
Определите элементы, катионы которых имеют электронную формулу внешнего энергетического уровня 4s24p6
- 1. Sr
- 2. Br
- 3. Rb
- 4. As
- 5. Se
Решение
Ответ: 13
Задание №36
Определите элементы, катионы которых имеют электронную формулу внешнего энергетического уровня 2s22p6
- 1. Na
- 2. Al
- 3. Br
- 4. Cu
- 5. Se
Решение
Ответ: 12
Задание №37
Электронную конфигурацию внешнего энергетического уровня в основном состоянии ns2np3 имеют атомы:
- 1. Cu
- 2. N
- 3. P
- 4. Cr
- 5. Fe
Решение
Ответ: 23
Задание №38
Схожую электронную конфигурацию внешнего энергетического уровня имеют атомы:
- 1. Al
- 2. Mg
- 3. Br
- 4. F
- 5. Na
Решение
Ответ: 34
Задание №39
Полностью завершенный второй энергетический уровень имеют атомы:
- 1. Ne
- 2. He
- 3. Na
- 4. F
- 5. O
Решение
Ответ: 13
Задание №40
Двух электронов до завершения внешнего энергетического уровня не хватает атомам:
- 1. Cr
- 2. Zn
- 3. O
- 4. S
- 5. Fe
Решение
Ответ: 34
[adsp-pro-3]
Задание №41
Одного электрона до завершения внешнего энергетического уровня не хватает атому:
- 1. Na
- 2. Br
- 3. K
- 4. Ca
- 5. Cl
Решение
Ответ: 25
Задание №42
В основном состоянии электронную формулу внешнего энергетического уровня ns2np4 имеют атомы:
- 1. P
- 2. Se
- 3. Si
- 4. Cr
- 5. S
Решение
Ответ: 25
Задание №43
Атомы каких из указанных в ряду элементов в основном состоянии имеют только один неспаренный электрон:
- 1. P
- 2. Cu
- 3. Zn
- 4. Si
- 5. Cl
Решение
Ответ: 25
Задание №44
Не содержат неспаренных электронов в основном состоянии атомы:
- 1. C
- 2. N
- 3. F
- 4. Be
- 5. Ne
Решение
Ответ: 45
Задание №45
Электронную конфигурацию ns1 имеют атомы:
- 1. Na
- 2. S
- 3. Se
- 4. K
- 5. O
Решение
Ответ: 14
Задание №46
Валентные электроны и на s- и на d-подуровнях содержат атомы:
- 1. Cr
- 2. C
- 3. Ge
- 4. Fe
- 5. Pb
Решение
Ответ: 14
Задание №47
До полного заполнения внешнего энергетического уровня не хватает одного электрона атомам:
- 1. N
- 2. Li
- 3. H
- 4. F
- 5. O
Решение
Ответ: 34
Задание №48
В основном состоянии во внешнем слое содержат один неспаренный электрон атомы:
- 1. Al
- 2. S
- 3. Cr
- 4. P
- 5. Si
Решение
Ответ: 13
Задание №49
Одинаковое число валентных электронов содержат атомы:
- 1. Na
- 2. Cl
- 3. Si
- 4. Mn
- 5. Cr
Решение
Ответ: 24
Задание №50
Электронную конфигурацию ns1np3 в возбужденном состоянии имеют атомы:
- 1. Al
- 2. Si
- 3. Mg
- 4. C
- 5. N
Решение
Ответ: 24
[adsp-pro-3]
Задание №51
Электронную конфигурацию ns1np2 в возбужденном состоянии имеют атомы:
- 1. B
- 2. Al
- 3. F
- 4. Fe
- 5. N
Решение
Ответ: 12
Задание №52
Электронную конфигурацию внешнего энергетического уровня ns2 в основном состоянии имеют атомы:
- 1. Na
- 2. Al
- 3. Fe
- 4. Ba
- 5. P
Решение
Ответ: 34
Задание №53
Из предложенного перечня химических элементов, выберите такие, устойчивые катионы которых имеют электронную конфигурацию, как у атома неона:
- 1. Mg
- 2. Ca
- 3. Al
- 4. Li
- 5. Be
Решение
Ответ: 13
Задание №54
Из предложенного перечня химических элементов, выберите такие, устойчивые анионы которых имеют электронную конфигурацию, как у атома неона:
- 1. Cl
- 2. О
- 3. Br
- 4. F
- 5. S
Решение
Ответ: 24
Задание №55
Из предложенного перечня химических элементов, выберите такие, устойчивые анионы которых имеют электронную конфигурацию, как у атома аргона:
- 1. Cl
- 2. S
- 3. F
- 4. Br
- 5. O
Решение
Ответ: 12
Задание №56
Из предложенного перечня химических элементов, выберите такие, устойчивые катионы которых имеют электронную конфигурацию, как у атома аргона:
- 1. S
- 2. Ca
- 3. Cl
- 4. K
- 5. Br
Решение
Ответ: 24
Задание №57
Содержат один неспаренный электрон в основном состоянии атомы:
- 1. S
- 2. Na
- 3. Al
- 4. Si
- 5. Mg
Решение
Ответ: 23
Задание №58
Шесть валентных электронов имеют атомы:
- 1. P
- 2. C
- 3. Si
- 4. Cr
- 5. S
Решение
Ответ: 45
Задание №59
Неспаренных электронов не содержат атомы:
- 1. C
- 2. N
- 3. F
- 4. Be
- 5. Ne
Решение
Ответ: 45
Задание №60
Как на s-, так и на d-подуровне расположены валентные электроны атомов:
- 1. Si
- 2. Cr
- 3. Mn
- 4. Br
- 5. C
Решение
Ответ: 23
[adsp-pro-3]
Задание №61
Одинаковое число неспаренных электронов на внешнем энергетическом уровне в основном состоянии содержат атомы:
- 1. Cr
- 2. P
- 3. Mg
- 4. O
- 5. H
Решение
Ответ: 15
Задание №62
До завершения внешнего электронного слоя одного электрона не хватает атомам:
- 1. Ba
- 2. O
- 3. K
- 4. Cl
- 5. H
Решение
Ответ: 45
Задание №63
В основном состоянии один неспаренный электрон имеют атомы:
- 1. B
- 2. Mg
- 3. C
- 4. S
- 5. Rb
Решение
Ответ: 15
Задание №64
Электронную формулу внешнего энергетического уровня ns1np2 в возбужденном состоянии имеют атомы:
- 1. Al
- 2. P
- 3. Cl
- 4. Cr
- 5. B
Решение
Ответ: 15
Задание №65
Одинаковое число неспаренных электронов на внешнем энергетическом уровне в основном состоянии содержат атомы:
- 1. C
- 2. As
- 3. B
- 4. H
- 5. Ne
Решение
Ответ: 34
Задание №66
Одинаковое число d-электронов в основном состоянии содержат атомы:
- 1. Cr
- 2. V
- 3. Cu
- 4. Mn
- 5. Na
Решение
Ответ: 14
Задание №67
Одинаковое число валентных электронов имеют атомы:
- 1. O
- 2. Ba
- 3. P
- 4. Sr
- 5. C
Решение
Ответ: 24
Задание №68
Одинаковое число энергетических уровней, содержащих электроны, имеют атомы:
- 1. Ag
- 2. Rb
- 3. Li
- 4. Na
- 5. Cu
Решение
Ответ: 12
Задание №69
Определите химические элементы, анионы которых имеют конфигурацию внешнего электронного слоя 2s22p6:
- 1. Na
- 2. Cl
- 3. Mg
- 4. F
- 5. O
Решение
Ответ: 45
Задание №70
Одинаковую электронную конфигурацию внешнего энергетического уровня имеют атомы:
- 1. Cr
- 2. Sb
- 3. Ne
- 4. Cu
- 5. Fe
Решение
Ответ: 14
[adsp-pro-3]
Задание №71
Из предложенного перечня выберите p-элементы:
- 1. Sc
- 2. Fe
- 3. Li
- 4. Sb
- 5. Sn
Решение
Ответ: 45
Задание №72
Одинаковое число неспаренных электронов на внешнем энергетическом уровне в основном состоянии содержат атомы:
- 1. Si
- 2. Be
- 3. N
- 4. Rb
- 5. K
Решение
Ответ: 45
Задание №73
Из предложенного перечня выберите d-элементы:
- 1. Cs
- 2. As
- 3. Mn
- 4. Te
- 5. Zn
Решение
Ответ: 35
Задание №74
Одинаковое количество неспаренных электронов в основном состоянии содержат атомы:
- 1. S
- 2. Br
- 3. P
- 4. B
- 5. Zn
Решение
Ответ: 24
Задание №75
В наиболее распространенных изотопах атомов каких элементов число нейтронов больше, чем число электронов:
- 1. O
- 2. Se
- 3. S
- 4. Ar
- 5. Ca
Решение
Ответ: 24
Задание №76
На внешнем энергетическом уровне только два электрона содержат атомы:
- 1. Ca
- 2. Br
- 3. N
- 4. Cr
- 5. He
Решение
Ответ: 15
Задание №77
Атомам каких элементов для приобретения электронной конфигурации как у благородного газа не хватает двух электронов:
- 1. Cl
- 2. P
- 3. N
- 4. Se
- 5. S
Решение
Ответ: 45
Задание №78
Одного электрона до завершения внешнего электронного слоя не хватает атомам:
- 1. Al
- 2. Na
- 3. Cl
- 4. H
- 5. O
Решение
Ответ: 34
Задание №79
В возбужденном состоянии электронную конфигурацию внешнего энергетического уровня ns1np3 имеют атомы:
- 1. Al
- 2. Si
- 3. Mg
- 4. C
- 5. N
Решение
Ответ: 24
Задание №80
Одинаковое число валентных электронов имеют атомы:
- 1. Cr
- 2. Si
- 3. Li
- 4. Ti
- 5. B
Решение
Ответ: 24
[adsp-pro-3]
Задание №81
Одинаковое число спаренных электронов на внешнем энергетическом уровне в основном состоянии содержат атомы:
- 1. Ca
- 2. F
- 3. Al
- 4. S
- 5. Na
Решение
Ответ: 13
Задание №82
К d-элементам относятся:
- 1. Ge
- 2. Te
- 3. S
- 4. Ni
- 5. Zn
Решение
Ответ: 45
Задание №83
К p-элементам относятся:
- 1. Ge
- 2. Sr
- 3. Se
- 4. Ni
- 5. Cu
Решение
Ответ: 13
Задание №84
d-Электроны содержат атомы:
- 1. Ca
- 2. P
- 3. Cu
- 4. Cl
- 5. Rb
Решение
Ответ: 35
Задание №85
Аналогичную электронную конфигурацию внешнего энергетического уровня в основном состоянии имеют наиболее распространенные изотопы элементов:
- 1. Li
- 2. Na
- 3. Al
- 4. N
- 5. С
Решение
Ответ: 12
Задание №86
Один электрон на s-подуровне внешнего энергетического уровня имеют в основном состоянии атомы:
- 1. V
- 2. Cr
- 3. Fe
- 4. Mn
- 5. Cu
Решение
Ответ: 25
Задание №87
Одинаковое число нейтронов содержат наиболее распространенные изотопы элементов:
- 1. O
- 2. S
- 3. Na
- 4. Mg
- 5. F
Решение
Ответ: 34
Задание №88
Одинаковое число нейтронов содержат наиболее распространенные изотопы элементов:
- 1. Ti
- 2. Mg
- 3. Si
- 4. Al
- 5. V
Решение
Ответ: 34
Задание №89
Одинаковое число нейтронов содержат наиболее распространенные изотопы элементов:
- 1. Ti
- 2. Mg
- 3. F
- 4. Ne
- 5. V
Решение
Ответ: 34
Задание №90
Одинаковое число нейтронов содержат наиболее распространенные изотопы элементов:
- 1. Cu
- 2. V
- 3. Mg
- 4. Li
- 5. Cr
Решение
Ответ: 25
[adsp-pro-3]
Задание №91
Электронную конфигурацию внешнего энергетического уровня в основном состоянии ns2np2 имеют атомы:
- 1. Se
- 2. Sn
- 3. S
- 4. Sb
- 5. Si
Решение
Ответ: 25
Задание №92
Не содержат неспаренных электронов в основном состоянии атомы:
- 1. Zn
- 2. Ti
- 3. Sr
- 4. Cs
- 5. V
Решение
Ответ: 13
Задание №93
Три неспаренных электрона в возбужденном состоянии содержат атомы:
- 1. P
- 2. Ti
- 3. As
- 4. Al
- 5. B
Решение
Ответ: 45
Задание №94
Четыре неспаренных электрона в возбужденном состоянии содержат атомы:
- 1. С
- 2. P
- 3. Al
- 4. V
- 5. Si
Решение
Ответ: 15
Задание №95
Одинаковое число валентных электронов содержат атомы:
- 1. As
- 2. V
- 3. Cl
- 4. Se
- 5. Na
Решение
Ответ: 12
Задание №96
Десять электронов на 3d-подуровне содержат атомы:
- 1. Cu
- 2. Mn
- 3. Ni
- 4. Co
- 5. Se
Решение
Ответ: 15
Задание №97
Пять электронов на 3d-подуровне содержат атомы:
- 1. Ga
- 2. Cr
- 3. As
- 4. Mn
- 5. V
Решение
Ответ: 24
Задание №98
Атомы каких химических элементов при потере двух электронов приобретают электронную конфигурацию как у благородного газа:
- 1. Ba
- 2. Al
- 3. Fe
- 4. Co
- 5. Be
Решение
Ответ: 15
Задание №99
Атомы каких химических элементов при потере одного электрона приобретают электронную конфигурацию как у благородного газа:
- 1. H
- 2. Rb
- 3. Cr
- 4. Mn
- 5. Cs
Решение
Ответ: 25
Задание №100
Наиболее стабильные анионы вида Э2- образуют химические элементы:
- 1. Ca
- 2. Zn
- 3. Se
- 4. Br
- 5. S
Решение
Ответ: 35
[adsp-pro-3]
Задание №101
Наиболее стабильные катионы вида Э2+ образуют химические элементы:
- 1. Cl
- 2. S
- 3. Ca
- 4. Br
- 5. Zn
Решение
Ответ: 35
[adsp-pro-10]
За это задание ты можешь получить 1 балл. На решение дается около 3 минут. Уровень сложности: базовый.
Средний процент выполнения: 79.2%
Ответом к заданию 1 по химии может быть последовательность цифр, чисел или слов. Порядок записи имеет значение.
Задача 1
1) N 2) S 3) P 4) Se 5) As
Определите, атомы каких из указанных в ряду элементов имеют в возбуждённом состоянии электронную конфигурацию внешнего энергетического уровня ns1np3nd1. Запишите в поле ответа номера выбранных элементов.
Решение
Электронная конфигурация ns1np3nd1 в возбужденном состоянии показывает, что на внешнем слое у атома будет расположено 5 электронов, значит нужны элементы из пятой группы главной подгруппы, таких три: азот, фосфор и мышьяк. Однако атом азота не может переходить в возбужденное состояние, так как на втором энергетическом уровне нет d — подуровня, следовательно, ответ: фосфор и мышьяк.
Ответ: 35
Задача 2
1) Te 2) I 3) O 4) S 5) Sr
Определите, анионы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня 5s25p6. Запишите в поле ответа номера выбранных элементов.
Решение
Анионы образуются из нейтральных атомов неметаллов при присоединении электронов:
$Э^0 + nē = Э^{n–}$
Электронную конфигурацию внешнего энергетического уровня $5s^{2}5p^{6}$ имеет ксенон Xe, который находится в главной подгруппе VIII группы пятого периода, следовательно, анионы с такой электронной конфигурацией могут образовывать атомы неметаллов, находящихся в пятом периоде, т. е. теллур (ответ — 1) и йод (ответ — 2).
Вывод: правильные ответы — 1, 2.
Ответ: 12
Задача 3
1) Al 2) S 3) P 4) Cr 5) Si
Определите, атомы каких из указанных в ряду элементов в основном состоянии во внешнем слое содержат один неспаренный электрон. Запишите в поле ответа номера выбранных элементов.
Решение
Здесь лучше всего расписать конфигурации атомов, но можно и запомнить, что 1 неспаренный электрон на внешнем уровне имеют атомы элементов 1,3 и 7 групп или атомы элементы с провалом электрона. В 3 группе находится алюминий (3s2 3p1), а у хрома имеется провал электрона (3d5 4s1)
Ответ: 14
Задача 4
1) Mg 2) Bi 3) Ba 4) Sr 5) Al
Определите, катионы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня 3s0. Запишите в поле ответа номера выбранных элементов.
Решение
Электронная конфигурация $3s^0$ описывает строение внешнего энергетического уровня, следовательно, элемент имеет три энергетических уровня, то есть находится в третьем периоде. Из предложенных элементов в третьем периоде находятся магний(Mg) и алюминий(Al). Обрати внимание, что речь идет про катионы!
Ответ: 15
Задача 5
1) I 2) N 3) Br 4) P 5) Cl
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns2np3. Запишите в поле ответа номера выбранных элементов.
Решение
Конфигурация внешнего энергетического уровня $ns^{2}np^{3}$ означает, что на внешнем энергетическом уровне атома находится 5 электронов, следовательно, это атом элемента, стоящего в главной подгруппе V группы таблицы Менделеева. Из предложенных элементов в главной подгруппе V группы находятся N и P.
Ответ: 24
Задача 6
1) Bi 2) N 3) Br 4) P 5) Cl
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns2np5. Запишите в поле ответа номера выбранных элементов.
Решение
Электронную конфигурацию $ns^{2}np^{5}$ имеют элементы, которые находятся в 7 группе главной подгруппы, такими элементами являются бром и хлор.
Ответ: 35
Задача 7
1) K 2) S 3) Na 4) Si 5) Se
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns2np4. Запишите в поле ответа номера выбранных элементов.
Решение
Конфигурация внешнего энергетического уровня $ns^{2}np^{4}$ означает, что на внешнем энергетическом уровне атома находится 6 электронов, а заполнение только s и p подуровней указывает на элементы главной подгруппы. Следовательно, это атомы элементов, стоящих в главной подгруппе VI группы таблицы Менделеева. Из предложенных элементов в главной подгруппе VI группы находятся S и Se.
Ответ: 25
Задача 8
1) S 2) Na 3) He 4) Cl 5) Se
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns2np4. Запишите в поле ответа номера выбранных элементов.
Решение
Электронную конфигурацию $ns^{2}np^{4}$ имеют элементы, которые находятся в 6 группе главной подгруппы, такими элементами являются сера и селен.
Ответ: 15
Задача 9
1) Mg 2) Al 3) Sb 4) N 5) Bi
Определите, катионы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня 3s0. Запишите в поле ответа номера выбранных элементов.
Решение
Конфигурация внешнего энергетического уровня КАТИОНА $3s^0$ означает, что данный элемент, образующий такой катион, имеет три энергетических уровня, следовательно, в таблице Менделеева находится в III периоде. Из представленных элементов в III периоде находятся Mg и Al.
Ответ: 12
Задача 10
1) Cu 2) Te 3) Se 4) Ag 5) O
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns1(n–1)d10. Запишите в поле ответа номера выбранных элементов.
Решение
Элементы с такой конфигурацией должны находиться в побочной подгруппе, поскольку заполняется d подуровень ( произошел перескок электрона в связи с устойчивостью полностью заполненного d подуровня), поскольку внешних электронов 1, то группа первая. Ищем элементы I группы побочной подгруппы.
Ответ: 14
Задача 11
1) Ti 2) Cl 3) Zr 4) I 5) F
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию энергетического уровня ns2(n–1)d2. Запишите в поле ответа номера выбранных элементов.
Решение
Электронная конфигурация $ns^{2}(n–1)d^2$ указывает на то, что перед нами d-элемент, а значит, находится в побочной подгруппе. Галогены Cl, I и F находятся в главной подгруппе VII группы, а титан Ti и цирконий Zr — в побочной подгруппе IV группы, имеют 2 электрона на внешнем энергетическом слое.
Ответ: 13
Задача 12
1) S 2) K 3) O 4) Te 5) Na
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns1. Запишите в поле ответа номера выбранных элементов.
Решение
Электронную конфигурацию внешнего энергетического уровня $ns^1$ имеют элементы главной подгруппы I группы. Из представленных к ним относятся калий К и натрий Na.
Ответ: 25
Задача 13
1) N 2) S 3) P 4) Se 5) As
Определите, атомы каких из указанных в ряду элементов имеют в возбуждённом состоянии электронную конфигурацию внешнего энергетического уровня ns1np3nd1. Запишите в поле ответа номера выбранных элементов.
Решение
Электронная конфигурация внешнего энергетического уровня $ns^1np^3nd^1$ означает, что на нём находится 5 электронов (в возбуждённом состоянии количество электронов не отличается от основного состояния), следовательно, элемент находится в V группе Периодической таблицы. Из предложенных элементов в главной подгруппе V группы находятся N, P и As, но азот не имеет d- подуровня, поэтому не может иметь такую конфигурацию внешнего энергетического уровня.
Ответ: 35
Задача 14
1) Mg 2) Cl 3) S 4) Br 5) Ca
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns2np5. Запишите в поле ответа номера выбранных элементов.
Решение
Электронная конфигурация внешнего энергетического уровня $ns^{2}np^{5}$ свидетельствует о наличии на внешнем энергетическом слое 7 электронов, следовательно, искать нужно элементы VII группы, к ним относятся Cl и Br.
Ответ: 24
Задача 15
1) Te 2) Be 3) I 4) Ba 5) Sr
Определите, катионы каких из указанных в ряду элементов могут иметь электронную конфигурацию внешнего энергетического уровня 5s2. Запишите в поле ответа номера выбранных элементов.
Решение
Электронная конфигурация $5s^2$ у катиона(!) показывает, что на внешнем слое было как минимум 3 электрона (часть от отдал, чтобы стать катионом), при этом внешний слой – пятый. Поэтому из всех элементов выбираем те, которые находятся в 5 периоде и в группах от третьей и дальше. Таких элементов два: теллур и иод, которые в степени окисления +4 и +5, соответственно, будут иметь конфигурацию $5s^2$.
Ответ: 13
Задача 16
1) Li 2) Se 3) K 4) S 5) Cs
Определите, атомы каких из указанных в ряду элементов в возбуждённом состоянии могут иметь электронную конфигурацию ns2np3nd1. Запишите в поле ответа номера выбранных элементов.
Решение
Электронная конфигурация $ns^{2}np^{3}nd^{1}$ говорит о наличии шести электронов на последнем энергетическом слое атома. В возбуждённом состоянии электроны переходят на другой энергетический подуровень, но количество их не меняется, поэтому оно равно номеру группы, следовательно, подходят элементы шестой группы — селен и сера.
Ответ: 24
Задача 17
1) O 2) S 3) N 4) Te 5) P
Определите, анионы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня 3s23p6. Запишите в поле ответа номера выбранных элементов.
Решение
Электронная конфигурация $3s^{2}3p^6$ описывает строение внешнего энергетического уровня, следовательно, элемент имеет 3 энергетических уровня, то есть находится в третьем периоде. Из предложенных элементов в третьем периоде находятся фосфор (P) и сера (S). Фосфор принимает 3 электрона, чтобы образовать анион P$^{3-}$, а сера принимает 2 электрона, чтобы образовать анион S$^{2-}$
Ответ: 25
Задача 18
1) Ga 2) S 3) B 4) In 5) Se
Определите, атомы каких из указанных в ряду элементов в возбуждённом состоянии имеют электронную конфигурацию внешнего энергетического уровня ns1np3nd2. Запишите в поле ответа номера выбранных элементов.
Решение
Электронная конфигурация $ns^1np^3nd^2$ в возбужденном состоянии показывает, что на внешнем слое у атома будет расположено 6 электронов, значит нужны элементы из шестой группы главной подгруппы, таких два: сера и селен.
Ответ: 25
Задача 19
1) As 2) Cr 3) Na 4) V 5) Sc
Определите, атомы каких из указанных в ряду элементов имеют 1 неспаренный электрон во внешнем слое в основном состоянии. Запишите в поле ответа номера выбранных элементов.
Решение
Для определения количества неспаренных электронов на внешнем слое нужно представить электронную конфигурацию атома. Атом натрия находится в 3 периоде, поэтому имеет 3 слоя. Всего он имеет 11 электронов, поэтому на последнем слое атом натрия имеет один неспаренный электрон. Атом хрома находится в 4 периоде, он имеет 4 слоя, 3d подуровень заполняется после 4s, но у хрома происходит провал электрона, один электрон с 4s падает на 3d, чтобы быть более энергетически устойчивым, так как в таком случае атом не будет иметь пустых орбиталей на 3d. У мышьяка 3 неспаренных электрона на внешнем слое. У скандия и ванадия их нет.
Ответ: 23
Атомно-молекулярное учение
Мы приступаем к изучению химии — мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными
формулами элементов.
Атом (греч. а — отриц. частица + tomos — отдел, греч. atomos — неделимый) — электронейтральная частица вещества микроскопических
размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом

Протон (греч. protos — первый) — положительно заряженная (+1) элементарная частица, вместе с нейтронами образует ядра атомов
элементов. Нейтрон (лат. neuter — ни тот, ни другой) — нейтральная (0) элементарная частица, присутствующая в ядрах всех
химических элементов, кроме водорода.
Электрон (греч. elektron — янтарь) — стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома —
порядковый номер в таблице Менделеева — равен числу электронов (и, соответственно, протонов).
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20)
в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.

Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило:
порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим
электроны занимают различные энергетические уровни.
Энергетические уровни подразделяются на несколько подуровней:
- Первый уровень
- Второй уровень
- Третий уровень
- Четвертый уровень
Состоит из s-подуровня: одной «1s» ячейки, в которой помещаются 2 электрона (заполненный электронами — 1s2)
Состоит из s-подуровня: одной «s» ячейки (2s2) и p-подуровня: трех «p» ячеек (2p6), на которых
помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s2), p-подуровня: трех «p» ячеек (3p6) и d-подуровня:
пяти «d» ячеек (3d10), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s2), p-подуровня: трех «p» ячеек (4p6), d-подуровня:
пяти «d» ячеек (4d10) и f-подуровня: семи «f» ячеек (4f14), на которых помещается 14
электронов

Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число
электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а
также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или
атомным орбиталям, движутся электроны, создавая определенный «рисунок».
S-орбиталь похожа на сферу, p-орбиталь напоминает песочные часы, d-орбиталь — клеверный лист.

Правила заполнения электронных орбиталей и примеры
Существует ряд правил, которые применяют при составлении электронных конфигураций атомов:
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной «ячейке») не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются
еще одним электроном с противоположным направлением - Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было
бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Без практики теория мертва, так что приступает к тренировке. Нам нужно составить электронную конфигурацию атомов углерода и
серы. Для начала определим их порядковый номер, который подскажет нам число их электронов. У углерода — 6, у серы — 16.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.

Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил.
А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся
одним электроном дополнили первую ячейку.
Таким образом, электронные конфигурации наших элементов:
- Углерод — 1s22s22p2
- Серы — 1s22s22p63s23p4
Внешний уровень и валентные электроны
Количество электронов на внешнем (валентном) уровне — это число электронов на наивысшем энергетическом уровне, которого достигает элемент. Такие электроны называются валентными: они могут быть спаренными или неспаренными. Иногда
для наглядного представления конфигурацию внешнего уровня записывают отдельно:
- Углерод — 2s22p2 (4 валентных электрона)
- Сера -3s23p4 (6 валентных электронов)
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью — способностью атомов образовывать определенное число химических связей.

- Углерод — 2s22p2 (2 неспаренных валентных электрона)
- Сера -3s23p4 (2 неспаренных валентных электрона)
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных
электронов. Ниже будет дано наглядное объяснение этой задаче.

Запишем получившиеся электронные конфигурации магния и скандия:
- Магний — 1s22s22p63s2
- Скандий — 1s22s22p63s23p64s23d1
В целом несложная и интересная тема электронных конфигураций отягощена небольшим исключением — провалом электрона, которое только подтверждает общее
правило: любая система стремится занять наименее энергозатратное состояние.
Провал электрона
Провалом электрона называют переход электрона с внешнего, более высокого энергетического уровня, на предвнешний, энергетически более
низкий. Это связано с большей энергетической устойчивостью получающихся при этом электронных конфигураций.
Подобное явление характерно лишь для некоторых элементов: медь, хром, серебро, золото, молибден. Для примера выберем хром, и рассмотрим
две электронных конфигурации: первую «неправильную» (сделаем вид, будто мы не знаем про провал электрона) и вторую правильную, написанную
с учетом провала электрона.
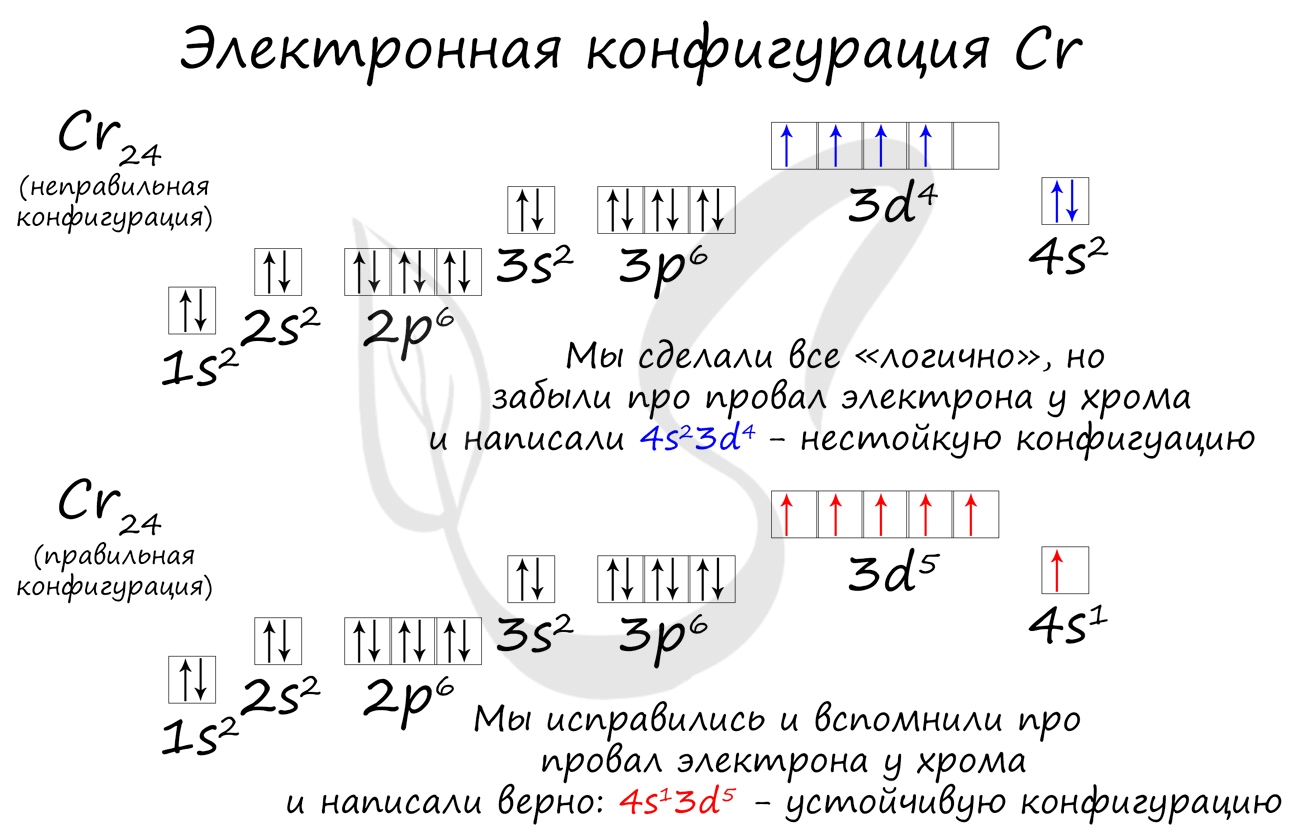
Теперь вы понимаете, что кроется под явлением провала электрона. Запишите электронные конфигурации хрома и меди самостоятельно еще раз и
сверьте с представленными ниже.

Основное и возбужденное состояние атома
Основное и возбужденное состояние атома отражаются на электронных конфигурациях. Возбужденное состояние связано с движением электронов
относительно атомных ядер. Говоря проще: при возбуждении пары электронов распариваются и занимают новые ячейки.
Возбужденное состояние является для атома нестабильным, поэтому долгое время в нем он пребывать не может. У некоторых атомов: азота,
кислорода , фтора — возбужденное состояние невозможно, так как отсутствуют свободные орбитали («ячейки») — электронам некуда перескакивать, к тому
же d-орбиталь у них отсутствует (они во втором периоде).
У серы возможно возбужденное состояние, так как она имеет свободную d-орбиталь, куда могут перескочить электроны. Четвертый энергетический
уровень отсутствует, поэтому, минуя 4s-подуровень, заполняем распаренными электронами 3d-подуровень.
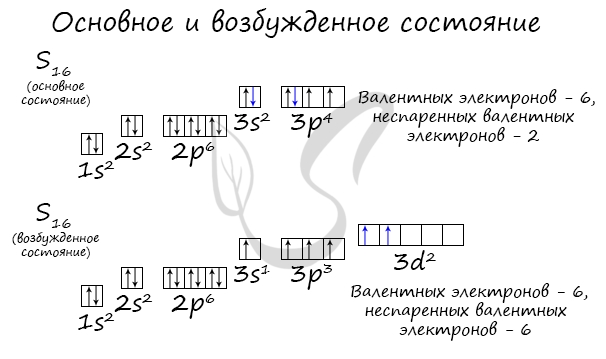
По мере изучения основ общей химии мы еще не раз вернемся к этой теме, однако хорошо, если вы уже сейчас запомните, что возбужденное состояние
связано с распаривание электронных пар.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
ЕГЭ по химии задание 1
План
- Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы.
- Электронная конфигурация атомов и ионов. Основное и возбужденное состояние атомов
Главное квантовое число и энергетический уровень
Квантовые числа — это своеобразный код записи положения электрона в атоме. Если сравнить атом с домом, то квантовые числа – это адрес электрона: этаж, квартира, комната.
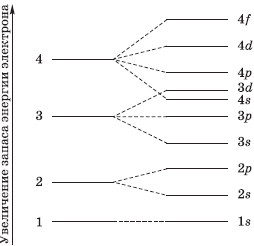
Электроны в атоме сосредоточены на энергетических уровнях – «этажах». Их нумеруют числами 1, 2, 3, … или буквами K, L, M, N, O, P, Q. Главное квантовое число n – это и есть номер энергетического уровня.
С удалением от ядра число электронов возрастает. Чем выше энергетический уровень, тем больше электронов на нём находится. Их максимальное число для каждого уровня определяется по формуле:
N = 2n 2
N – максимальное число электронов
n – номер уровня (главное квантовое число)
На внешнем энергетическом уровне не может находиться больше 8 электронов.
В энергетических уровнях также выделяют подуровни. Их количество также соответствует главному квантовому числу. Это напоминает расположение квартир в доме: на первом этаже располагается одна квартира, на втором – две, на третьем – три и т.д.
Орбитальное (побочное), магнитное квантовые числа и форма орбитали
Конкретное место в атоме, «комната», в которой почти постоянно находится электрон, называется орбиталью. Орбитали напоминают облака разной формы из электронов. Подуровни и форму орбиталей обозначают латинскими буквами: s, p, d, f.
Эту схему предложил Бор, она помогает разобраться в строении атома, но не отражает реальной картины. Наши представления об атоме расходятся с реальностью. И выглядит это примерно так:
Магнитное квантовое число ml показывает, какие проекции есть у орбитали. Количество таких вариантов определяется по формуле 2l+1.
Для s-орбитали l = 0 и ml = 0, так и получается, что сфера принимает только одно положение в пространстве.
Для p-орбитали l = 1, ml принимает три значения -l, 0, +l. При l = 3, магнитный момент принимает семь (2l + 1 = 7) значений: -3, -2, -1, 0, +1, +2, +3.
Спин электрона
Еще два квантовых числа – спиновое и проекция спина – характеризуют уникальное квантовое свойство электрона. Спин не имеет аналогов в классической механике. Можно представить, что электрон вращается вокруг своей оси в одну или другую сторону.
В атомах первого периода таблицы Менделеева есть один энергетический уровень. В нём один или два электрона движутся по s-единственной орбитали.
В атомах второго периода появляется второй уровень. Он состоит из s-и p-подуровней. Второй s-подуровень – это тоже s-орбиталь, на p-подуровне есть три орбитали, которые по-разному расположены в пространстве. Каждая p-орбиталь вмещает 1 или 2 электрона, поэтому максимально на p-подуровне их может быть 6.
В атомах третьего периода появляется d-подуровень с пятью d-орбиталями, в атомах четвёртого периода – f-подуровень с семью f-орбиталями.
Как заполняются орбитали?
Принцип минимума энергии . Электрон «стремится» занять положени в атоме с наименьшей энергией. То есть электроны сначала «заселяют» низкоэнергетические орбитали. Рейтинг желаемых орбиталей выглядит так: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5р 6 6s 2 5d 1 4f 14 … Как будто электроны сначала выбирают малозаселённые этажи с небольшим количеством квартир. Принцип Паули . В атоме не может быть двух электронов с одинаковыми свойствами. То есть на каждой орбитали может находиться либо один неспаренный электрон, либо два электрона с разными спинами. Это похоже на дорогу с двусторонним движением: либо едет один автомобиль, либо два, но навстречу друг другу. Правило Хунда . Наиболее устойчивое (основное) состояние атома достигается тогда, когда на одном уровне находится как можно больше неспаренных электронов. Можно провести такую аналогию: электроны сначала селятся по одному, а потом ищут себе пару.
Электронная конфигурация атомов и ионов. Основное и возбужденное состояние атомов
Электронная конфигурация атомов
Запись по электронным оболочкам (схема электронного строения)
Показывает заряд ядра и количество электронов на каждом энергетическом уровне.
Легче всего начинать с неё, потому что она показывает структуру атома «крупным планом».
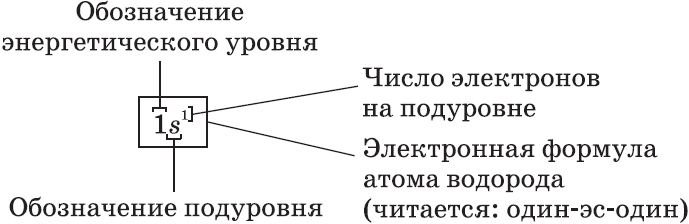
Запись с обозначением энергетических уровней и подуровней
Каждая орбиталь обозначается квадратной ячейкой. Электрон обозначается стрелкой. Различное направление стрелок указывает на противоположные спины.Под ячейкой подписывают номер энергетического уровня, буквенное обозначение орбитали и количество электронов на ней.
Буквенно-числовое обозначение такого «адреса» электрона – это электронная формула . Электронная конфигурация – это электронная формула, которая показывает распределение электронов по энергетическим уровням.
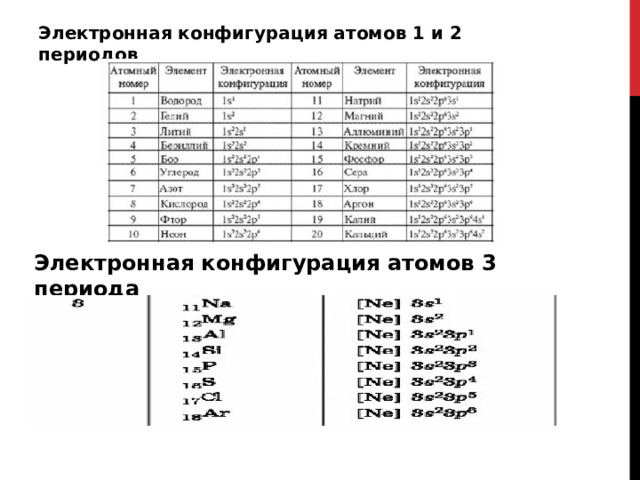
Электронная конфигурация атомов 1 и 2 периодов
Электронная конфигурация атомов 3 периода
Электронная конфигурация атомов 4 периода
Заполнение орбиталей атомов 4 периода имеет свои особенности.
На движение электрона влияют поле ядра и поле других электронов. Поэтому в атомах с большим количеством электронов энергия электрона определяется главным и орбитальным квантовыми числами.
Здесь уже надо смотреть на сумму обоих квантовых чисел (n+l). Если для двух подуровней эта сумма равна: 3d, 4p, 5s (n+l=5), то сначала заполняются уровни с меньшими значениями n. То есть последовательность заполнения будет следующей: 3d – 4p – 5s.
Поэтому в 4 периоде сначала заполняется подуровень 4s, а потом подуровень 3d.
Есть ещё одна особенность, которая появляется в 4 периоде. Хром и медь имеют на 4s-орбитали по одному электрону. Всё дело в заполнении d-оболочек. Полузаполненные или заполненные d-оболочки устойчивее частично заполненных. В атоме хрома на каждой из 5 3d-орбиталей есть по одному электрону. В атоме меди на каждой на каждой 3d-орбитали есть по два электрона.
Алгоритм записи электронной конфигурации атома
- По порядковому номеру химического элемента в таблице Менделеева определяем количество электронов в атоме.
- Распределяем электроны по энергетическим уровням, то есть составляем схему электронного строения.
- Выписываем s-, p-, d-подуровни в каждом энергетическом уровне.
- Заполняем подуровни электронами: сначала по одному электрону на орбиталь, потом достраиваем электронные пары.
Электронная конфигурация ионов
Электронная конфигурация ионов составляется по тем же принципам. Нужно учитывать изменения количества электронов на внешнем энергетическом уровне.
Атом электронейтрален, то есть сколько протонов ядре, столько же электронов в атоме. Если атом принимает электроны, он становится отрицательно заряженным ионом (анионом), если отдаёт электроны – положительно заряженным ионом (катионом).
Атому легче всего отдать электроны внешнего энергетического уровня, «чужие» электроны он тоже примет на внешний энергетический уровень. На внешнем энергетическом уровне не может находиться более 8 электронов. Теория «октета» была предложена в 1916 году Гилбертом Ньютоном Льюисом и Вальтером Косселем
Атом «стремится» добрать электроны на внешний уровень или избавиться от них, поэтому и становится ионом. Полное заполнение s- и p-подуровней внешнего уровня придаёт атому стабильность. Только атом гелия имеет на единственном внешнем энергетическом уровне 2 электрона, а не 8, потому что первый энергетический уровень состоит только из одной s-орбитали.
Запись по электронным оболочкам (схема электронного строения)
Основное и возбуждённое состояния атома
На первый взгляд кажется, что атом хлора может образовывать только одну связь и соединения одного типа – например, хлориды. Но откуда берутся хлорная, хлорноватая, хлористая и хлорноватистая кислоты?
Дело в том, что атом можно перевести из основного состояния в возбуждённое.
Основное состояние – это состояние атома с наименьшей энергией. Атом обладает наименьшей энергией в основном состоянии. Но если ему передать дополнительную энергию, он перейдёт в возбуждённое состояние. Электроны перейдут на уровень или подуровень с большей энергией.
Сначала разрываются электронные пары на 3p-подуровне, электроны переходят на 3d-подуровень. Если атом хлора получит ещё больше энергии, спаренный электрон покинет даже 3s-орбиталь и перейдёт на 3d-подуровень.
Благодаря этому атом хлора может образовывать больше химических связей. Затраты энергии, потраченные на распаривание электронов, окупаются при образовании новых химических связей.
Но в возбуждённое состояние могут перейти атомы, у которых есть неспаренные электроны и свободные орбитали. Длится возбуждённое состояние недолго: атом отдаст энергию и вернётся в основное состояние. Хотя если сообщить атому слишком много энергии, электрон покинет его и атом станет ионом.
Электронная конфигурация атомов
1. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне четыре электрона.
Ответ: 35
2. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне один электрон.
Ответ: 12
Электронная конфигурация ионов
1. Определите, какие два из указанных элементов образуют устойчивый отрицательный ион, содержащий 18 электронов.
Ответ: 23
2. Определите, какие из указанных элементов образуют устойчивый положительный ион, содержащий 10 электронов.
Ответ: 15
Домашняя работа
Вариант № 5508754
Ссылка — https:// chem-ege.sdamgia.ru/test?id=5508754
Задание №1 ЕГЭ химия. Теория и практика
Первое задание в ЕГЭ по химии посвящено электронной конфигурации атома. Для его выполнения дается ряд химических элементов, среди которых нужно выбрать два с одинаковым свойством:
— одинаковое число валентных электронов;
— одинаковое количество неспаренных электронов в основном или возбужденном состоянии;
— одна и та же общая электронная конфигурация валентного уровня.
Для правильного выполнения этого задания полезно помнить последовательность заполнения электронами атомных орбиталей, которую можно легко понять и усвоить благодаря данному рисунку:
Рис.1 Порядок заполнения электронами атомных орбиталей.
Атом — электро нейтральная частицей. Положительный заряд ядра уравновешивается числом отрицательно заряженных электронов, которые движутся в его поле. Заряд ядра атома химического элемента равен его порядковому номеру в периодической системе Д.И. Менделеева. При переходе от одного элемента к следующему заряд ядра увеличивается на единицу. И на единицу возрастает число электронов в атоме. Каждый следующий добавляемый электрон занимает низшую свободную атомную орбиталь.
Рассмотрим электронную конфигурацию на примере атома водорода. Заряд ядра атома водорода +1. Значит, в поле ядра движется 1 электрон, и он занимает самую первую по энергии атомную орбиталь — 1s. Электронная формула атома водорода записывается 1s1

У атома гелия (заряд ядра +2) следующий электрон займет ту же самую s-орбиталь, однако спин у него будет противоположный (стрелка, изображающая электрон, направлена в другую сторону):
Рис.2.Конфигурация атома гелия в основном состоянии.
На этом ёмкость 1 энергетического уровня становится полностью заполненной. Поэтому следующий электрон, который появляется у атома лития и бериллия, займёт s- орбиталь второго энергетического уровня (2s-орбиталь):
Рис. 3. Конфигурации атома лития и бериллия в основном состоянии.
Правило Хунда: электроны заполняют атомную орбиталь таким образом, чтобы её суммарный спин был максимальным.
Иными словами, при заполнении p, d, f-орбиталей электроны сначала будут занимать квантовые ячейки орбитали по одному, и только потом будут спариваться. По этому поводу можно привести хорошую аналогию: при размещении пассажиров в изначально пустом автобусе, если все люди незнакомы, сначала они будут занимать места по одному, и только когда мест станет не достаточно, незнакомые люди станут занимать места рядом с теми, кто зашел в автобус раньше. На этом основании запишем электронную конфигурацию атома серы и изобразим распределение электронов по квантовым ячейкам:
Рис. 4. Конфигурация атома серы в основном состоянии. Красным цветом показаны электроны валентного уровня.
В образовании химических связей участвуют только электроны внешнего (валентного) энергетического уровня. В атоме серы таким уровнем является третий. На нём расположено шесть электронов, два из которых не спарены.
Число валентных электронов в атоме равно номеру группы (исключения: атомы кобальта и никеля, у них число валентных электронов равно 9 и 10, соответственно).
Особой энергетической устойчивостью обладают наполовину и полностью заполненные орбитали.
Запишем электронную конфигурацию атома хрома. Найдем хром в таблице Менделеева. Его порядковый номер — 24. Это означает, что заряд ядра атома Cr +24, следовательно, в поле ядра движется 24 электрона.
Распределим 24 электрона по орбиталям, пользуясь уже известными нам правилами. Помним, что между 4s и 4p-орбиталями заполняется 3d-орбиталь:
Однако, на d-орбитали не хватает одного электрона до наполовину заполненного состояния. А наполовину заполненные орбитали отличаются пониженной энергией. Всё в мире стремится к минимуму энергии; и атом тоже. Поэтому один электрон с 4s-орбитали перескакивает на 3d-орбиталь, благодаря близости энергий этих орбиталей.
Символом в квадратных скобках (у нас это — [Ar]) принято сокращать электронную конфигурацию полностью заполненных невалентных нижних энергетических уровней. У всех благородных газов, которые находятся в 18 группе длиннопериодного варианта периодической системы или в 8 группе краткопериодного, орбитали заполнены полностью, и чтобы не переписывать каждый раз одно и то же пользуются таким способом сокращения записи.
Таким же исключением из правил является атом меди. Ему не хватает одного электрона для полного заполнения 3d-орбитали. И он, как и хром, берет этот электрон с 4-s -орбитали
Именно на тех же основаниях электронная конфигурация молибдена — [Kr] 4d55s1, серебра — [Kr] 4d105s1.
Пользуясь информацией, изложенной выше, можно легко вычислить число валентных, внешних и неспаренных электронов в атоме и безошибочно выполнить первое задание ЕГЭ, за которое можно получить 1 первичный балл.
Задание 1
1) N 2) S 3) P 4) Se 5) As
Определите, атомы каких из указанных в ряду элементов имеют в возбуждённом состоянии электронную конфигурацию внешнего энергетического уровня ns1np3nd1. Запишите в поле ответа номера выбранных элементов.
Задание 2
1) Te 2) I 3) O 4) S 5) Sr
Определите, анионы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня 5s25p6. Запишите в поле ответа номера выбранных элементов.
Задание 3
1) Al 2) S 3) P 4) Cr 5) Si
Определите, атомы каких из указанных в ряду элементов в основном состоянии во внешнем слое содержат один неспаренный электрон. Запишите в поле ответа номера выбранных элементов.
Задание 4
1) Mg 2) Bi 3) Ba 4) Sr 5) Al
Определите, катионы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня 3s0. Запишите в поле ответа номера выбранных элементов.
Задание 4
1) I 2) N 3) Br 4) P 5) Cl
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns2np3. Запишите в поле ответа номера выбранных элементов.