…
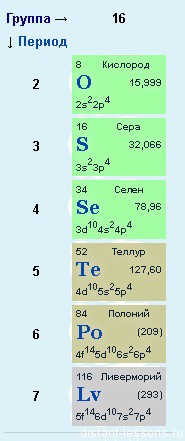
К элементам главной подгруппы VI группы периодической таблицы Менделеева относятся:
- Кислород O
- Сера S
- Селен Se
- Теллур Te
- Полоний Po
Общая характеристика элементов 6 группы главной подгруппы
От O к Po (сверху вниз в
периодической таблице)
Увеличивается
- атомного радиуса,
- металлических, основных,
восстановительных свойств,
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.
Электронные конфигурации
у данных элементов схожи, все они содержат 6 электронов на внешнем слое ns2np4:
O – 2s2 2p4;
S – 3s23p4;
Se – 4s2 4p4;
Te – 5s2 5p4;
Po – 6s2 6p4
Электронное строение кислорода и серы
Нахождение в природе кислорода и серы
Кислород занимает первое место среди элементов по
распространенности в земной коре. Содержится
он главным образом в силикатах и составляет около 47 % массы твёрдой земной
коры. В больших количествах связанного кислорода содержится в воде — 85,82 % по
массе. Также кислород содержится более, чем в 1500 соединений земной коры. В атмосфере доля свободного кислорода
составляет 20,95 % по объёму и 23,10 % по массе.
Сера встречается в виде самородной серы, сульфатов (CaSO4∙2H2O, CaSO4∙H2O, Na2SO4∙10H2O, MgSO4∙7H2O), сульфидов (FeS2, CuS, CuFeS2, PbS, ZnS, HgS) и в промышленных газах.
Самородная сера встречается в местах
вулканической активности совместно с сернистыми фумаролами и сернистыми водами
(с содержанием > 25 %).
Аллотропные модификации серы
Кислород
Способы получения кислорода
В
природе
Кислород образуется в процессе фотосинтеза:
mCО2 + nH2O → mO2 + Сm(H2O)n
Промышленный способ
- Разделение жидкого воздуха на О2 и N2 (ректификация);
- электролиз воды:
2H2O → 2Н2↑ + О2↑
Лабораторный
способ
- термическое окислительно-восстановительное разложение солей:
2КСlO3 = 3О2↑ + 2KCI
2КМпO4 = О2↑ + МпО2 + К2МпО4↑
2KNO3 = О2↑ + 2KNО2
2Cu(NO3)O2 = О2↑ + 4NО2↑ + 2CuO
2AgNO3 = О2↑ + 2NО2↑ +2Ag
2H2O2 = 2H2O + O2 (kt — MnO2)
2HgO = 2Hg + O2
- Для автономного дыхания кислород получают в герметически замкнутых помещениях и в аппаратах при помощи реакции:
2Na2O2 + 2СO2 = О2↑ + 2Na2CO3
Физические свойства кислорода
При обычных условиях молекулярный кислород O2 – это малорастворимый в воде газ без цвета, запаха
и вкуса.
При сильном охлаждении под давлением переходит в бледно — голубую жидкость с Ткип = — 183°С. При Т = -219°С образует сине — голубые кристаллы.
Химические свойства кислорода
Кислород — сильный окислитель, уступающий по химической активности только фтору.
Вступает во
взаимодействия со всеми элементами, кроме инертных газов (Не, Ne и Аг). Со
многими простыми веществами реагирует непосредственно при обычных условиях или
при нагревании или в присутствии катализаторов (кроме Au, Pt, Hal2, благородные газы).
Большинство реакций с участием О2 экзотермичны, часто часто сопровождаются горением, иногда — взрывом.
Взаимодействие с простыми веществами
С металлами
- Кислород взаимодействует с металлами, с образованием оксидов металлов:
Me + О2 = МеxOy оксиды
- С щелочными металлами в результате реакций образуются различные кислородсодержащие продукты:
4Li + О2 = 2Li2O оксид лития
2Na + О2 = Na2О2 пероксид натрия
К + О2 = КО2 супероксид калия
- С железом образуется смесь оксидов:
3Fe + 2O2 =
Fe3O4 (Fe2O3*FeO)
- С марганцем образуется диоксид марганца:
Mn + O2 = MnO2
С неметаллами
При
взаимодействии с неметаллами (кроме фтора и инертных газов) образуются оксиды,
со степенью окисления кислорода – 2:
Si + O2 = SiO2 (t=400-5000С)
С + О2(изб) = СО2; С + О2(нед) =
СО
N2 +О2 = 2NO — Q
S + О2 = SО2;
4Р + 5О2 = 2Р2О5
Окисление сложных веществ
Горение сульфидов
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Горение водородных соединений
4HI + О2 = 2I2 + 2Н2O
2H2S + 3O2 = 2SO2 +
2H2O
CH4 +
2O2 = CO2 + 2H2O
Окисление
оксидов
Кислород окисляет
входящие в оксид элементы до более высокой степени окисления:
4FeO + О2 = 2Fe2О3
2SО2 + О2 = 2SО3
4NО2 + О2 + 2H2O = 4HNО3
Окисление гидроксидов и солей
Окисление гидроксидов и солей в водных растворах происходит, если исходное вещество неустойчиво на воздухе:
2HNO2 + O2 = 2HNO3
4Fe(OH)2 + O2 + 2H2O
= 4Fe(OH)3
Окисление аммиака
В отсутствие катализатора при окислении аммиака кислородом образуется азот, а в присутствии катализатора — оксида азота(II):
4NH3 + 3О2 =2N2 + 6Н2O
4NH3 + 5О2 = 4NO + 6Н2O
Окисление
фосфина
На
воздухе самопроизвольно воспламеняется:
2PH3 + 4О2 = P2О5 + 3Н2O
Окисление
силана
На воздухе он самовоспламеняется (часто
со взрывом) с образованием SiO2 и H2O:
SiH4 + 2О2 = SiО2 + 2Н2O
Окисление органических веществ
- Все органические соединения горят, окисляясь кислородом воздуха полностью:
CxHy + О2 = CО2 + Н2O
Продукты
окисления различных элементов, входящих в молекулы органических соединений:
С → CO2
Н → Н2O
Hal → Hal2
N → N2
P → P2O5
S → SO2
Например:
2C2H5 + 4О2 = 4CО2 + 5Н2O
C2H5Сl + 3О2 = 2CО2 + 2Н2O + HCl
2C2H5NH2 + 8,5О2 = 4CО2 + 7Н2O + N2
Кроме горения возможны также реакции неполного окисления:
- каталитическое окисление алканов, с образованием спиртов или кислот:
СН3-СН2-СН2-СН3 + 3O2 → 2СН3-СOOH + 2H2O
- каталитическое окисление алкенов, с образованием окиси этилена:
- окисление первичных спиртов до альдегидов, вторичных – до кетонов:
- окисление альдегидов до кислот:
Сера
Способы получения серы
Промышленный способ
- Извлечение самородной серы из ее месторождений или
вулканов - Получение серы из серной руды с помощью пароводяного,
фильтрационного, термического, центрифугального и экстракционного методов. - Переработка природных газов, содержащих H2S и их окисление при недостатке О2.
Лабораторный
способ
- Взаимодействие SО2 и H2S в водном растворе:
SО2 + 2H2S = 3S↓ + 2H2О
- Неполное окисление сероводорода:
2H2S + SO2 → 3S + 2H2O
Физические свойства серы
Сера — твердое хрупкое
вещество желтого цвета. Не смачивается водой и практически нерастворимо в ней.
Имеет несколько аллотропных модификаций. См. аллотропные модификации серы.
Химические свойства серы
При
обычных температуре и давлении химическая активность серы небольшая. При
нагревании сера довольно активна, и проявляет свойства как окислителя, так и восстановителя.
Свойства окислителя сера проявляет при взаимодействии с элементами, расположенными ниже и левее в Периодической системе, а свойства восстановителя — с элементами, расположенными выше и правее в Периодической системе.
Непосредственно сера не взаимодействует с азотом и йодом.
Взаимодействие с простыми веществами
С
кислородом
Горение серы на воздухе с образованием оксида серы (IV):
S + O2 → SO2
В присутствии
катализаторов:
2S + 3O2 = 2SO3
С водородом
С водородом сера вступает
в реакцию при нагревании, образуя сероводород:
S + H2 → H2S
С
галогенами
При
взаимодействии со всеми галогенами, кроме йода образуются галогениды:
S + Cl2 → SCl2 (S2Cl2)
S + 3F2 → SF6
С
фосфором
Взаимодействие серы с фосфором приводит к образованию сульфидов фосфора
2P + 3S → P2S3
2P + 5S → P2S5
С углеродом
В реакции серы с углеродом образуется сероуглерод:
2S + C → CS2
С металлами
При
взаимодействии с металлами сера выступает
в качестве окислителя, образуя сульфиды.
Щелочные металлы реагируют с серой без нагревания, остальные металлы (кроме золота Au и платины Pt) –при нагревании:
S + Fe → FeS
S + Hg → HgS
3S + 2Al → Al2S3
S + Сu = CuS
S + 2Ag = Ag2S
Взаимодействие со сложными веществами
С водой
Сера вступает в реакцию диспропорционирования
с перегретым паром:
S + H2O (пар) → 2H2S + SO2
С окислителями
В реакциях с окислителями сера окисляется до оксида серы (IV) SO2 или до серной кислоты H2SO4 при протекании реакции в растворе:
S + 2HNO3(разб.) = H2SO4 + 2NO↑
S + 6HNO3(конц.) → H2SO4 + 6NO2↑ + 2H2O
S + 2H2SO4(конц.)→ 3SO2↑ + 2H2O
S + 2KClO3 → 3SO2↑ + 2KCl
S + К2Сr2O7 = Сr2O3 + K2SO4
S + Na2SO3 → Na2S2O3
С щелочами
При взаимодействии с щелочами сера диспропорционирует до сульфита и сульфида:
S + NaOH → Na2SO3 + Na2S + H2O
Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими
соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением
периодического закона.

В периодической таблице элементы расположены в порядке увеличения атомного заряда, группируются в «строки и столбцы» — периоды и группы.
Период — ряд горизонтально расположенных химических элементов. 1, 2 и 3 периоды называются малыми, они состоят из одного ряда элементов.
4, 5, 6 — называются большими периодами, они состоят из двух рядов химических элементов.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в
высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете
предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.

Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая
говорит о наиболее вероятном месте нахождения электрона.
В периоде радиус атома уменьшается с увеличением порядкового номера элементов («→» слева направо). Это связано с тем, что с увеличением номера группы
увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде «←» справа налево.

В группе радиус атома увеличивается с увеличением заряда атомных ядер — сверху вниз «↓». Чем больше период, тем больше электронных орбиталей вокруг атома,
соответственно, и больше его радиус.
С уменьшением заряда атома в группе радиус атома уменьшается — снизу вверх «↑». Это связано с уменьшением количества электронных орбиталей вокруг
атома. Для примера возьмем атомы бора и алюминия, элементов, расположенных в одной группе.

Период, группа и электронная конфигурация
Обратите внимание еще раз на важную деталь: элементы, находящиеся в одной группе (главной подгруппе!), имеют сходную конфигурацию внешнего уровня.
Так у бора на внешнем уровне расположены 3 электрона, у алюминия — тоже 3. Оба они в III группе.
Такая закономерность иногда может сильно облегчить жизнь, однако у элементов побочных подгрупп она отсутствует — там нужно считать электроны
«вручную», располагая их на электронных орбиталях.
Раз уж мы повели речь об электронных конфигурациях, давайте запишем их для бора и алюминия, чтобы лучше представлять их внешний уровень и увидеть
то самое «сходство»:
- B5 — 1s22s22p1
- Al13 — 1s22s22p63s23p1
Общую электронную конфигурацию для элементов III группы главной подгруппы можно записать ns2np1. Это будет работать для
бора, внешний уровень которого 2s22p1, алюминия — 3s23p1, галия — 4s24p1,
индия — 5s25p1 и таллия — 6s26p1. За «n» мы принимаем номер периода.
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы,
то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Вам остается только распределить известное число электронов по s и p ячейкам, а затем подставить номер периода — и вот быстро получена
конфигурация внешнего уровня. Предлагаю посмотреть на примере ниже 

Очень надеюсь, что теперь вы знаете: только глядя на положение элемента в периодической таблице, на группу и период, в которых он расположен,
вы уже можете составить конфигурацию его внешнего уровня. Безусловно, это для элементов главных подгрупп. Повторюсь: у побочных — только «вручную».
Длина связи
Длина связи — расстояние между атомами химически связанных элементов. Очевидно, что понятия длины связи и атомного радиуса взаимосвязаны напрямую.
Чем больше радиус атома, тем больше длина связи.
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.

Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех
веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
В периоде с увеличением заряда атома металлические свойства ослабевают, неметаллические — усиливаются (слева направо «→»). В группе с увеличением
заряда атома металлические свойства усиливаются, а неметаллические — ослабевают (сверху вниз «↓»).

Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают
S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Таким образом, самые сильные металлические свойства проявляет рубидий, но с другой стороны — у него самые слабые неметаллические свойства. Сера
обладает самыми слабыми металлическими свойствами, но, если посмотреть по-другому, сера — самый сильный неметалл.
Распределение металлов и неметаллов в периодической таблице также является наглядным отображением этого правила. Если провести условную
линию, проходящую от бора до астата, то справа окажутся неметаллы, а слева — металлы.

Основные и кислотные свойства
Основные свойства в периоде с увеличением заряда атома уменьшаются, кислотные — возрастают. В группе с увеличением заряда атома основные
свойства усиливаются, а кислотные — ослабевают.
Кислотные и основные свойства противопоставлены друг другу, как противопоставлены металлические и неметаллические. Где первые усиливаются,
вторые — убывают. Все аналогично, поэтому смело ассоциируйте одни с другими, так будет гораздо легче запомнить.

Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных
кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Это можно объяснить в темах диссоциации и химических связей. Когда мы дойдем до соответствующей темы, я напомню про HF и водородные связи между
молекулами, которые делают эту кислоту самой слабой. Сейчас воспринимайте это как исключение: HF — самая слабая из этих кислот, а
HI — самая сильная.

Восстановительные и окислительные свойства
Восстановительные свойства в периоде с увеличением заряда атома ослабевают, окислительные — усиливаются. В группе с увеличением заряда
атома восстановительные свойства усиливаются, а окислительные — ослабевают.
Ассоциируйте восстановительные свойства с металлическими и основными, а окислительные — с неметаллическими и кислотными. Так гораздо проще
запомнить 

Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Электроотрицательность — способность атома, связанного с другими, приобретать отрицательный заряд (притягивать к себе электроны).
Мы уже касались ее в статье, посвященной степени окисления. Это важное свойство, ведь более ЭО-ый атом притягивает
к себе электроны и уходит в отрицательную степень окисления со знаком минус «-«.
Все перечисленные в подзаголовке свойства вместе с ЭО усиливаются в периоде с увеличением заряда атома, в группе с увеличением заряда атома
они ослабевают. Таким образом, самый электроотрицательный элемент расположен справа вверху таблицы Д.И. Менделеева — это фтор.

Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий
расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе
выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на
себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Понятию ЭО-ости «синонимичны» также понятия сродства к электрону — энергии, выделяющейся при присоединении электрона к атому, и энергии ионизации —
количеству энергии, которое необходимо для отщепления электрона от атома. И то, и другое возрастают с увеличением электроотрицательности.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.

Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды,
ниже строка с летучими водородными соединениями.

Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру,
для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
В таблице видно, что для VIa группы формула высшего оксида RO3, а, к примеру, для IIIa группы — R2O3. Напишем
высшие оксиды для веществ из VIa : SO3, SeO3, TeO3 и IIIa группы: B2O3, Al2O3,
Ga2O3.
На экзамене строка с готовыми «высшими» оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим,
что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.

С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене.
Я расскажу вам, как легко их запомнить.
ЛВС характерны для IV, V, VI и VII группы. Элементы этих групп более электроотрицательны, чем водород, поэтому ходят в «-» отрицательную СО.
Минимальная степень окисления для элементов главных подгрупп, начиная с IV группы, может быть рассчитана так: номер группы — 8.
Например, для углерода минимальная СО = 4-8 = -4; для азота 5-8 = -3; для кислорода 6-8 = -2; для фтора 7-8 = -1. Для того, чтобы запомнить
ЛВС, вы должны ассоциировать IV, V, VI и VII группы с хорошо известными вам веществами: метаном, аммиаком, водой и фтороводородом.

Так как общее строение ЛВС в пределах одной группы сходно, то, вспомнив например H2O для кислорода в VI группе, вы легко
найдете формулы других ЛВС VI группы: серы — H2S, H2Se, H2Te, H2Po.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
2. Элементы
подгруппы кислорода.
§ 2.1. Общая
характеристика элементов подгруппы кислорода
К элементам
главной подгруппы VI группы относятся кислород O, сера S, селен
Se, теллур Te и радиоактивный полоний Po. Электронная
конфигурация внешнего электронного слоя атомов этих элементов (иногда
называемых халькогенами) — ns2np4,
для приобретения конфигурации инертного газа атомам не хватает только двух
электронов, что объясняет их склонность проявлять окислительные свойства. При
переходе от кислорода к полонию окислительные свойства простых веществ
ослабляются. Наибольшей окислительной способностью обладают кислород и сера,
являющиеся типичными неметаллами. Селен и теллур занимают промежуточное
положение между неметаллами и металлами, а полоний — типичный металл.
Для всех
элементов подгруппы (кроме полония) характерна степень окисления –2. Все
элементы, за исключением кислорода, образуют также соединения, где их степень
окисления равна +4 или +6; это связано с наличием свободной d — орбитали
в электронной оболочке атома.
Первый
представитель группы кислород по электроотрицательности уступает только фтору,
поэтому для него почти всегда характерна степень окисления –2. В соединениях со
фтором степень окисления кислорода +2, в пероксидах — (–1).
Кислород
имеет три стабильных изотопа: 16O, 17O и 18O.
В свободном состоянии находится в виде двух аллотропных модификаций — кислорода
O2 (газ без цвета и запаха) и озона O3 (газ с
характерным запахом).
Кислород —
самый распространенный элемент на Земле, он составляет 49,13% от общей массы
Земной коры, а также около 90% массы Мирового океана. В воздухе его содержание
по объему составляет 21%. Кроме того воздух содержит 78% азота и 1% других
газов. Сера встречается в природе в виде залежей самородной серы, сульфидов (в
минералах и нефти) и сульфатов (в минералах, морской и речной воде). Основные сульфидные
полезные ископаемые: железный колчедан FeS2, цинковая
обманка ZnS и галенит PbS; сульфатные — гипс CaSO4
и барит BaSO4. Соединения серы содержатся также в природном
газе (в виде примесей сероводорода). Всего в земной коре около 0,03% серы;
морская вода содержит примерно 0,1% серы.
Сера имеет
четыре стабильных изотопа: 32S, 33S, 34S и 36S.
Как и для кислорода, для серы характерно наличие аллотропных модификаций. В
обычных условиях устойчива ромбическая сера — твердое вещество желтого
цвета, кроме нее существуют сера моноклинная, состоящая из циклических
молекул S8, и пластическая сера. Наиболее устойчива из них
ромбическая сера, в нее самопроизвольно через некоторое время превращаются
другие модификации. Важнейшие свойства элементов подгруппы кислорода и
образованных ими простых веществ представлены в табл.2.1.
Таблица 2.1
Свойства
элементов
подгруппы кислорода и простых веществ
Атомный
|
Название,
|
Потенциал
|
ЭО
|
Степени
|
r ,
|
tпл,
|
tкип,
|
8
|
Кислород O
|
13,6
|
3,44
|
–2, –1, 0,
|
1,27 ( ж
|
–219
|
–183
|
16
|
Сера S
|
10,4
|
2,58
|
–2, 0, +2,
|
2,07
|
119
|
445
|
34
|
Селен Se
|
9,8
|
2,55
|
–2, 0, +4,
|
4,79
|
217
|
685
|
52
|
Теллур Te
|
9,0
|
2,10
|
–2, 0, +4,
|
6,25
|
450
|
990
|
84
|
Полоний Po
|
8,4
|
2,0
|
0, +2, +4
|
9,32
|
282
|
962
|
С
увеличением атомной массы от кислорода к теллуру возрастают температуры
плавления и кипения, а также плотность простых веществ, образуемых элементами.
В той же последовательности темнеет окраска неметаллических модификаций: O2
— бесцветный, S — желтая, Se — красный, Te — коричневый.
§ 2.2.
Кислород и озон
КИСЛОРОД O2 впервые был получен
К. Шееле в 1770 г. при нагревании селитры. В 1774 г. Дж. Пристли получил его
разложением оксида ртути. Кислород — бесцветный газ без запаха, плохо растворим
в воде; жидкий кислород имеет светло-голубой цвет, tпл = –219
° C, tкип = –183 ° C.
Химические
свойства. 1. В силу
высокой окислительной способности кислород реагирует с большинством металлов
уже при комнатной температуре, образуя основные оксиды.
При
окислении кислородом щелочных металлов только для лития характерно образование
оксида Li2O. Остальные щелочные металлы и барий при взаимодействии с
кислородом образуют пероксиды и надпероксиды. Так, наиболее
устойчивыми продуктами, образующимися при сгорании натрия и бария в атмосфере
кислорода, являются пероксиды:
2Na + O2 = Na2O2;
Ba + O2 = BaO2 .
При сгорании
остальных щелочных металлов в атмосфере с повышенным давлением кислорода
образуются надпероксиды, содержащие ион :
K + O2
= KO2.
2. При
нагревании кислород активно взаимодействует и с неметаллами (за
исключением гелия, неона, аргона). В атмосфере кислорода с ослепительно ярким
пламенем сгорает фосфор; интенсивно, ярко-синим пламенем горит сера; без
пламени, постепенно раскаляясь, сгорает древесный уголь:
4P + 5O2 = 2P2O5;
S + O2 = SO2;
C + O2 = CO2.
Реакция
кислорода с азотом происходит при 1200 ° C или в электрическом разряде, это
обусловлено высокой прочностью тройной связи в молекуле N2:
N2
+ O2 ↔ 2NO.
3. Кислород
реагирует не только с простыми, но и со многими сложными веществами —
сульфидами, селенидами, низшими оксидами и т. д.:
4NH3 + 3O2 = 2N2 + 6H2O;
2NO + O2 = 2NO2.
Сероводород,
реагируя с кислородом при нагревании, дает серу или оксид серы(IV) в
зависимости от количества кислорода:
2H2S + O2 = 2S + 2H2O;
2H2S + 3O2 = 2SO2 + 2H2O.
4. Особое
свойство кислорода — способность обратимо взаимодействовать с некоторыми
веществами, образуя при этом оксигенильные комплексы, в которых
кислород находится в молекулярном виде. Пример такого комплекса —
оксигемоглобин (продукт взаимодействия гемоглобина с кислородом), выполняющий в
организмах человека и животных функцию переноса кислорода. Химики научились
искусственно создавать комплексы, близкие к природным переносчикам кислорода.
Центральными атомами этих комплексов являются металлы первого ряда переходных
металлов в низших степенях окисления: Mn(II), Fe(II), Co(II), Cu(I).
Получение
кислорода. Основные промышленные
способы получения кислорода:
1)
фракционная перегонка жидкого воздуха (азот, обладающий более низкой
температурой кипения, испаряется, а жидкий кислород остается);
2)
электролиз воды.
В
лаборатории кислород
получают разложением некоторых солей кислородсодержащих кислот, оксидов и пероксидов:
2KMnO4 K2MnO4 + MnO2 + O2
;
4K2Cr2O7 4K2CrO4 +
2Cr2O3 + 3O2 ;
2KNO3 2KNO2 + O2 ;
2KClO3 2KCl + 3O2 ;
2Pb3O4 6PbO + O2 ;
2HgO 2Hg + O2 ;
2BaO2 2BaO + O2 ;
2H2O2 2H2O + O2 .
Применение
кислорода. Кислород и
его соединения играют важнейшую роль в процессах обмена веществ и дыхания.
Кислород необходим для производства стали из чугуна, осуществления
высокотемпературной сварки металлов, сжигания горючих и топливных материалов,
таких, как водород, метан, нефть, уголь и т. п.
ОЗОН O3 —аллотропная
модификация кислорода, являющаяся более сильным окислителем, чем кислород.
Название «озон» произошло от греческих слов «озо» (пахнуть) или «озин»
(пахнущий). Действительно, при небольшой концентрации в воздухе он пахнет
свежестью. Озон образуется в атмосфере при грозовых разрядах. В лаборатории
его получают пропусканием газообразного кислорода через озонатор (реакция
эндотермическая и обратимая; выход озона около 5%):
3O2
↔ 2O3 — 284 кДж .
Качественной
реакцией для
обнаружения озона служит взаимодействие с раствором иодида калия. В результате
этой реакции образуется иод, который вызывает посинение раствора, содержащего
крахмал, за счет образования иод-крахмального комплекса:
2KI + O3 + H2 S O4 = I2 + O2
+ K2SO4 + H2O.
С кислородом
эта реакция не идет.
При
пропускании озона над металлическим серебром, которое обычно устойчиво на
воздухе, образуется пероксид серебра черного цвета и выделяется кислород:
2O3
+ 2Ag = Ag2O2 + 2O2.
Озон
способен окислять сульфиды металлов до сульфатов. Очень наглядна реакция
окисления сульфида свинца, имеющего черный цвет, в сульфат, являющийся
веществом белого цвета:
3PbS + 4O3
= 3PbSO4.
Озон
взаимодействует со щелочными металлами и их гидроксидами с образованием
соответствующих озонидов:
4O3
+ 4KOH = 4KO3 + 2H2O + O2 .
В эти
реакции, как и в реакции получения пероксидов и надпероксидов, могут вступать
щелочные металлы K, Rb и Cs. Для этих ионов характерны большие радиусы и малые
заряды, что и приводит к устойчивости пероксидов M2O2,
надпероксидов MO2 и озонидов MO3. Эти вещества широко
используют в качестве окислителей, а также применяют на подводных лодках в
качестве источника кислорода для дыхания экипажа:
4KO2
+ 2CO2 = 2K2CO3 + 3O2 .
§ 2.3. Сера
Получение и
применение серы. Промышленный
метод получения серы основан на получении ее из самородной серы путем
плавления.
В
лаборатории для
получения серы используют неполное окисление сероводорода:
2H2S + O2 = 2S + 2H2O ( недостаток O2)
или реакцию
Вакенродера:
2H2S
+ SO2 = 3S + 2H2O.
Полученная в
результате этих реакций сера легко кристаллизуется на холодной поверхности.
Серуявляется
ценным продуктом в химическом синтезе для получения сернистого газа, серной
кислоты, сероводорода и сероуглерода, а также для вулканизации резины, в
производстве пороха, инсектицидов и фунгицидов.
Химические
свойства. 1. Восстановительные
свойства. На воздухе сера горит, образуя оксид серы(IV) SO2. В
сравнительно мягких условиях при комнатной температуре сера реагирует со
фтором, хлором и концентрированными кислотами — окислителями (HNO3,
H2SO4):
S + 3F2 = SF6;
S + 6 HNO3 ( конц .) = H2SO4 + 6NO2 + 2H2O;
S + 2 H2SO4 ( конц .) = 3SO2 + 2H2O.
При
взаимодействии серы с хлором получается смесь хлоридов серы SCl2 и S2Cl2,
так как для серы характерно образование связи S–S.
Только при
взаимодействии со фтором сера образует высший галогенид SF6. Это
обусловлено небольшими размерами атома фтора. Молекула SF6 имеет
форму октаэдра с атомом серы в центре. Это термически и химически устойчивое
вещество (не реагирует с водой, кислотами, щелочами). Низкая реакционная
способность SF6 обусловлена валентным и координационным насыщением
серы.
Все
остальные галогениды серы сильно гидролизуются водой с образованием различных
продуктов, содержащих серу, основным из которых является оксид серы(IV), и
галогеноводородной кислоты:
SF4 + 2H2O = SO2 + 4HF;
S2Cl2 + 2H2O = SO2 + H2S
+ 2HCl.
2. Окислительные
свойства. Со многими менее электроотрицательными неметаллами неметаллами
сера активно реагирует при нагревании. Так, при пропускании паров серы над
углем образуется сероуглерод, используемый в качестве растворителя для многих
органических соединений:
2S + C = CS2.
Сера активно
взаимодействует с фосфором и водородом:
2P + 3S = P2S3;
H2
+ S = H2S.
Сера
реагирует со многими металлами, образуя сульфиды:
Cu + S =
CuS.
Для
взаимодействия с большинством металлов серу необходимо предварительно
расплавлять и проводить реакции при повышенной температуре. Ртуть —
единственный металл, с которым сера взаимодействует уже при комнатной
температуре. Это свойство используют в лабораториях для удаления разлитой
ртути, пары которой очень токсичны. Порошок серы активно прилипает к
поверхности ртути, тем самым предотвращая ее испарение и образуя сульфид ртути
( II ):
Hg + S =
HgS.
3. Подобно
галогенам, сера при нагревании растворяется в щелочах, при этом происходит реакция
диспропорционирования:
3S + 6NaOH = Na2SO3 + 2Na2S + 3H2O.
4. Необычным
свойством серы является ее способность растворяться в концентрированном водном
растворе сульфита натрия с образованием тиосульфата натрия:
S + Na2SO3
= Na2S2O3.
Тиосульфат
натрия используется в аналитической химии для количественного определения иода
по реакции:
2Na2S2O3 + I2 = 2NaI + Na2S4O6
§ 2.4. Сероводород. Сульфиды
Все
водородные соединения элементов подгруппы серы имеют молекулярную структуру и
ковалентную полярную связь. С увеличением атомного номера элемента
увеличивается его радиус, что способствует уменьшению устойчивости водородных
соединений и усилению кислотных и восстановительных свойств от серы к теллуру.
СЕРОВОДОРОД H2S — бесцветный очень
токсичный газ с запахом тухлых яиц, tпл = –86 ° C, tкип
= –60 ° C.
Молекула H2S
подобно молекуле воды имеет угловую форму, Ð HSH = 92o. Из-за
меньшей электроотрицательности серы молекулы сероводорода, в отличие от воды,
не образуют между собой водородных связей, поэтому сероводород имеет более
низкую температуру кипения, чем вода, и плохо растворим в воде (один объем воды
растворяет 3 объема сероводорода).
Получение. 1. При пропускании тока водорода над
расплавленной серой происходит обратимая реакция с очень малым выходом
сероводорода, поэтому обычно в лаборатории его получают действием
разбавленных кислот на сульфиды:
FeS + 2HCl =
FeCl2 + H2S .
2. Для
получения более чистого сероводорода твердый сульфид алюминия гидролизуют
холодной водой:
Al2S3 + 6H2O = 2Al(OH)3 ¯ + 3H2S
.
Прямой
синтез селеноводорода и теллуроводорода невозможен, их получают только по
реакциям обмена.
Химические
свойства. 1.
Сероводород ¾ типичный восстановитель. Кроме кислорода, он легко
окисляется галогенами:
H2S + Br2 = S ¯ + 2HBr;
H2S + 4Cl2 + 4H2O = H2SO4
+ 8HCl.
При
нагревании красно-оранжевого оксида свинца PbO2 с сероводородом
образуется белое вещество PbO:
4PbO2
+ H2S = 4PbO + H2SO4.
В
зависимости от силы окислителя, температуры и реакции среды сероводород может
превращаться в вещества, в которых сера имеет степени окисления 0, +4, +6:
H2S + 2FeCl3 = 2FeCl2 + S + 2HCl;
H2S + 3 H2SO4 ( конц .) 4SO2
+ 4H2O ;
H2S + 8 HNO3 ( конц .) = H2SO4
+ 8NO2 + 4H2O .
2. Необычным
свойством сероводорода и сульфидов является способность взаимодействовать с
серой с образованием полисульфанов H2Sn и полисульфидов:
Na2S
+ (n – 1)S = Na2Sn.
В этих
соединениях проявляется склонность к катенации, т.е. к образованию цепей – S –
S –.
СЕРОВОДОРОДНАЯ
КИСЛОТА — раствор
сероводорода в воде. Это слабая двухосновная кислота, которая диссоциирует
ступенчато:
H2S ↔ H+ + HS–, K1 = 6 ×
10–8;
HS– ↔ H+ + S2–, K2 = 10–14.
Сероводородная
кислота так же, как и сероводород, ¾ типичный восстановитель и вступает во
многие реакции, характерные для сероводорода. Она реагирует с хлором, с солями
трехвалентного железа, сернистой кислотой. Например :
2H2S
+ H2SO3 = 3S ¯ + 3H2O.
Сероводородная
кислота образует два ряда солей: средние ¾ сульфиды, кислые ¾ гидросульфиды.
Большинство из них (за исключением сульфидов аммония, щелочных и
щелочно-земельных металлов) плохо растворимы в воде, многие осадки сульфидов
окрашены. Это используют в аналитической химии при определении металлов.
Например, при пропускании сероводорода через раствор, содержащий ионы свинца Pb2+,
образуется черный осадок сульфида свинца:
H2S + Pb(NO3)2 = PbS ¯ + 2HNO3.
Эту реакцию
также используют для обнаружения сероводорода или сульфид-ионов.
Сульфиды
можно получить нагреванием металла с серой, действием сероводорода на щелочи
(растворимые сульфиды) и по реакциям обмена (нерастворимые сульфиды). Все
растворимые сульфиды сильно гидролизованы:
Na2S
+ H2O ↔ NaHS + NaOH.
Сульфиды Al2S3,
Cr2S3, Fe2S3 не удается получить в
присутствии воды из-за необратимого гидролиза с образованием гидроксида
соответствующего металла и сероводорода.
Сульфиды
металлов, стоящих в ряду напряжений левее железа (включительно), растворимы в
сильных кислотах:
ZnS + H2SO4 = ZnSO4 + H2S ;
CuS + H 2 SO 4 .
Для
растворения нерастворимых сульфидов используют концентрированную HNO3:
FeS2 + 18HNO3 = Fe(NO3)3 + 2H2SO4
+ 15NO2 + 7H2O.
§ 2 .5. Оксид серы (IV). Сернистая кислота
ОКСИД
СЕРЫ(IV) SO2
— бесцветный газ с резким запахом, tпл = –75,5 ° C, tкип
= –10,1 ° C.
Молекула SO2
имеет угловую форму, Ð OSO = 119,5o. Связи S=O двойные.
Получение. 1. Оксид серы(IV) SO2
образуется при сгорании серы и сероводорода на воздухе.
2. В
лаборатории диоксид серы получают взаимодействием металлов (чаще всего
меди) с концентрированной серной кислотой:
Cu + 2 H2SO4 ( конц .) = CuSO4 + SO2
+ 2H2O.
или при
обжиге сульфидных минералов, например сульфида цинка (цинковой обманки) или
дисульфида железа (называемого также пиритом или железным колчеданом):
2ZnS + 3O2 = 2ZnO + 2SO2 ;
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
.
3. Сернистый
газ можно получить реакцией обмена между солями сернистой кислоты и сильной
неокисляющей кислотой:
Na2SO3 + 2HCl = 2NaCl + SO2 + H2O.
Оксид
серы(IV) хорошо растворяется в воде (40 объемов в 1 объеме воды при 20 ° С),
при этом кроме физического растворения происходит и химическая реакция:
SO2
+ H2O ↔ H2SO3.
СЕРНИСТАЯ
КИСЛОТА H2SO3
— слабая малоустойчивая кислота. В водном растворе сернистой кислоты существуют
следующие равновесия:
H2O
+ SO2 ↔ H2SO3 ↔ H+ + ↔ 2H+
+ .
Константа
диссоциации H2SO3 по первой ступени K1
= 1,6 × 10–2, по второй ¾ K2 = 6,3 × 10–8.
Из-за сильного различия в значениях ступенчатых констант диссоциации сернистая
кислота образует два вида солей: средние ¾ сульфиты, и кислые ¾ гидросульфиты.
Химические
свойства соединений S(IV). Химические реакции, характерные для диоксида серы, сернистой кислоты и ее
солей, можно разделить на две группы.
1. Реакции,
протекающие без изменения степени окисления, например:
Ca(OH)2 + SO2 = CaSO3 + H2O.
2. Окислительно-восстановительные
реакции, в которых производные S(IV) могут проявлять свойства как
окислителя, так и восстановителя, например:
5SO2 + 2KMnO4 + 2H2O = K2SO4
+ 2MnSO4 + 2H2SO4;
в — ль
Na2SO3 + Cl2 + H2O = Na2SO4
+ 2HCl;
в — ль
В ряду SO2
— SeO2 — TeO2 происходит ослабление кислотных свойств,
растворимость оксидов в воде падает. Наиболее сильные окислительные свойства в
этом ряду проявляют соединения Se(IV). Очень показательна в этом смысле реакция
оксидов серы(IV) и селена(IV) в водном растворе:
SeO2 + 2SO2 + 2H2O = Se + 2H2SO4.
ок-ль в-ль
Оксид TeO 2
в аналогичных реакции с диоксидом серы ведет себя подобно SeO 2 .
§ 2.6. Оксид
серы(VI). Серная кислота. Сульфаты
ОКСИД
СЕРЫ(VI) SO3
— ангидрид серной кислоты — при комнатной температуре представляет собой
бесцветную жидкость, которая затвердевает уже при 17 ° C, tкип
= 44,8 ° C. Твердый SO3 существует в виде трех модификаций.
Оксид SO3
получают окислением SO2 только в присутствии катализатора
(мелкораздробленная Pt или V2O5) и при высоком давлении:
2SO2
+ O2 = 2SO3.
Данная
реакция похожа на реакцию синтеза аммиака, она является экзотермической, но
понижать температуру нецелесообразно, так как при этом сильно падает скорость
реакции. На практике этот процесс проводят при температуре 400–450 ° C. Для
смещения равновесия вправо повышают давление.
В
лаборатории для получения SO3 проводят термическое разложение
сульфатов:
Fe2(SO4)3
Fe2O3 + 3SO3 .
Оксид
серы(VI) — гигроскопическое вещество, при растворении его воде получается
серная кислота:
SO3
+ H2O = H2SO4.
При
растворении SO3 в воде из-за выделения большого количества теплоты
образуется туман, поэтому в сернокислотном производстве оксид серы(VI)
растворяют в 100%-ной серной кислоте. Полученный раствор называется олеум.
СЕРНАЯ
КИСЛОТА —
маслянистая жидкость с tпл = 10,3 ° C, tкип
= 296 ° C. Это сильная двухосновная кислота. В воде она диссоциирует
ступенчато, образуя гидросульфат— и сульфат-ионы:
H2SO4
↔ H+ + , K1 = 103;
↔ H+
+ , K2 = 1,1 · 10–2.
Химические
свойства. 1. Окислительные
свойства серной кислоты зависят от ее концентрации и природы металла, с
которым она взаимодействует.
Разбавленная
серная
кислота окисляет за счет ионов H+ только металлы, стоящие в
электрохимическом ряду напряжений до водорода:
Zn + H2SO4 ( разб .) = ZnSO4 + H2
.
При
взаимодействии концентрированной серной кислоты с различными металлами и
со многими неметаллами происходит ее восстановление до SO2:
Zn + 2 H2SO4 ( конц .) = ZnSO4 + SO2
+ 2H2O;
2Ag + 2 H2SO4 ( конц .) = Ag2SO4
+ SO2 + 2H2O;
2P + 5 H2SO4 (конц.) = 2H3PO4
+ 5SO2 + 2H2O.
Необходимо
помнить, что при разбавлении серной кислоты водой выделяется большое количество
теплоты, поэтому для разбавления серной кислоты надо наливать кислоту в
воду, а не наоборот.
2.
Концентрированная серная кислота обладает дегидратирующими свойствами,
т. е. способностью поглощать влагу. При этом она может не только поглощать
несвязанную воду, но и удалять ее из химических соединений, например из
углеводов и спиртов. Так, концентрированная серная кислота обугливает бумагу и
сахарозу:
12С (тв.) +
11Н2О.
Этанол при
нагревании с серной кислотой превращается в этилен:
С2Н5ОН
(ж.)
Получение и
применение. Серную
кислоту получают контактным способом. Он включает три этапа:
1) получение
SO2 сжиганием серы или обжигом сульфидных руд;
2) каталитическое
окисление SO2 до SO3;
3)
поглощение SO3 96%-ной серной кислотой с образованием 100%-ной
кислоты; получение олеума растворением SO3 в 100%-ной серной
кислоте.
Серную
кислоту широко используют в химической промышленности для производства
синтетических моющих средств, пластмасс, удобрений и лекарственных препаратов.
В ряду
высших кислородсодержащих кислот элементов шестой группы наблюдается монотонное
ослабление кислотных свойства от серной кислоты к теллуровой и немонотонное
изменение окислительной способности. Самым сильным окислителем является
селеновая кислота. Она способна выделять хлор из концентрированной HCl :
H 2 SeO 4 + 2 HCl = Cl 2 ↑ + H 2 SeO
3 + H 2 O
b растворять золото:
2Au + 6H2SeO4 = Au2(SeO4)3
+ 3 H2SeO3 + 3H2O
Соли серной
кислоты. Серная
кислота, как все кислоты, реагирует с основаниями и оксидами с образованием сульфатов
и гидросульфатов. Наименьшей растворимостью обладает сульфат бария,
именно поэтому его образование в виде белого осадка используют как качественную
реакцию на сульфат-ион:
Ba2+
+ = BaSO4 ¯ .
Как правило,
все гидросульфаты хорошо растворимы в воде.
Термическая
устойчивость сульфатов
зависит от природы металла.
u Сульфаты щелочных металлов плавятся без разложения.
u При
разложении сульфатов металлов средней активности образуются оксиды:
2CuSO4
= 2CuO + 2SO2 + O2 .
u При
разложении сульфатов переходных металлов в низких степенях окисления
образуются оксиды, в которых металлы проявляют более высокие степени окисления:
4FeSO4
= 2Fe2O3 + 4SO2 + O2 .
u Сульфаты
наиболее тяжелых металлов (Ag, Hg) разлагаются до металла:
Ag2SO4
= 2Ag ¯ + SO2 + O2 .
При
прокаливании с углем сульфаты металлов восстанавливаются до сульфидов:
BaSO4
+ 4C = BaS + 4CO .
§ 2.7.
Примеры решения задач
Задача 1.
[1]
Продукты
полного взаимодействия 0,69 г натрия и 0,80 г серы осторожно внесли в воду и
образовавшийся прозрачный раствор разбавили до объема 50 мл. Определите
молярные концентрации соединений в образовавшемся растворе. Вычислите
максимальную массу брома, который может прореагировать с полученным раствором.
Решение.
Найдем
количества вещества натрия и серы: ν ( Na ) = 0,69 (г)/ 23 (г/моль) = 0,03
моль, ν ( S ) = 0,80 (г)/ 32 (г/моль) = 0,025 моль.
Вначале
образуется сульфид натрия согласно следующей реакции:
2 Na + S =
Na 2 S в количестве 0,03/2 = 0,015 моль. В результате этого процесса
остается непрореагировавшая сера в количестве 0,025 – 0,015 = 0,01 моль,
которая вступает во взаимодействие с 0,01 моль сульфида натрия с образованием
дисульфида Na 2 S 2 :
Na 2 S
+ S = Na 2 S 2 .
Очевидно,
что после всех химических превращений образовались Na 2 S и Na 2
S 2 в количестве, 0,005 моль и 0,01 моль, соответственно.
При
разбавлении образовавшегося раствора до 50 мл, молярные концентрации веществ в
растворе составили C ( Na 2 S ) = 0,005/0,05 = 0,1 моль/л и C ( Na 2
S 2 ) = 0,01/0,05 = 0,2 моль/л.
С бромом
реагируют оба вещества, находящтеся в растворе согласно следующим уравнениям:
Na2S + Br2 = 2NaBr + S↓
Na2S2 + Br2 = 2NaBr + 2S↓
Количество
брома равно суммарному количеству веществ сульфида и дисульфида натрия и
составляет 0,005 + 0,01 = 0,015 моль, а его масса равна 160 г/моль * 0,015 моль
= 2,4 г.
Задача 2.
[1]
Какую массу
воды следует добавить к 300 г олеума, содержащего 40% серного ангидрида, чтобы
получить водный раствор с массовой долей серной кислоты 70%?
Решение.
Из условия
задачи следует, что масса серного ангидрида, содержащегося в олеуме,
составляет: 300*0,4 = 120 г. Его количество вещества, соответственно, равно: ν(
SO 3 ) = 120г / 80 г/моль = 1,5 моль.
Проведя
аналогичные вычисления для серной кислоты, получаем, что m ( H 2 SO 4
) = 300*0,6 = 180 г. Количество вещества ν( H 2 SO 4) = 180г /
98 г/моль = 1,837 моль.
Пусть для
получения водного раствора с массовой долей серной кислоты 70% необходимо
добавить x грамм воды. Тогда масса образовавшегося раствора составит (300 + x )
грамм. Очевидно, что в образовавшемся растворе весь серный ангидрид превратился
в серную кислоту, ее суммарное количество при этом составило 1,5 + 1,837 =
3,337 моль, а масса равна 3,337 моль * 98 г/моль = 327 г.
Учитывая,
что w ( H 2 SO 4 ) = 0,7 = 327 / (300 + x )., получаем,
что x = 167,14 г.
Задача 3.
[1]
Вычислите
объемные доли газов в смеси, образовавшейся при действии горячей серной кислоты
на хлорид серы S 2 Cl 2 .
Решение.
Составим
уравнение химической реакции, происходящей при действии горячей серной кислоты
на хлорид серы S 2 Cl 2 :
S2Cl2 + 3H2SO4 = 5SO2↑
+ 2HCl↑ +2 H2O
S2Cl2 + 4H2O -6e = 2SO2 + 2Cl—
+ 8H+ x1
SO42-
+4H+ + 2e = SO2 + 2H2O x3
Для газов
значение объемной доли совпадает со значением мольной, поэтому из приведенного
уравнения очевидно, что φ ( SO 2 ) = 5/7, а φ ( HCl ) составляет
2/7.
Задача 4.
(Задания теоретического тура заключительного этапа 2000г., задача 9.2.) Дракон в крови. Герой в луче. – Так
надо (М.Цветаева)
При
нагревании двух простых веществ (одно из них – жидкость) в достаточно
концентрированном
растворе едкого кали образуется осадок красного цвета, нерастворимый в воде и в
концентрированных растворах кислот (соляной, серной и азотной).
- Какие простые вещества могли
быть взяты? - В каком весовом соотношении
могли быть взяты простые вещества, чтобы в результате синтеза в осадке мог
находиться только красный продукт? - Какие вещества могут находиться
в растворе по окончанию синтеза? - Какую окраску может иметь
водный раствор после завершения реакции? - Что может образоваться при
подкислении (в избытке) водного раствора после реакции? - Каков состав красного осадка?
- Как называется природный
минерал, соответствующий по составу красному осадку? Что означает его
название (по-русски)? - Для чего мог использоваться
этот минерал в древности? - Что образуется при нагревании
красного осадка (минерала) на воздухе (уравнения химических реакций)? - В чем можно растворить красный
осадок (уравнения химических реакций)? - Попробуйте написать
последовательность химических реакций, протекающих в процессе синтеза.
Решение
(автор А.И.Жиров)
- Жидких простых веществ два:
бром и ртуть. Бром диспропорционирует в водном растворе щелочи, образуя
малоактивные в щелочной среде бромиды и броматы. Индивидуальных минералов,
содержащих бром ( к тому же красного цвета) в природе не встречается.
Таким образом, наиболее вероятно, что одно из исходных веществ – ртуть. Ее
основной минерал красного цвета – HgS (киноварь). Тогда второе простое
вещество – сера. - При нагревании в водном
щелочном растворе сера (подобно хлору или белому фосфору) способна
диспропорционировать:
3 S + 6 KOH → 2 K 2 S + K 2 SO 3 + 3 H 2
O
Продукты
диспропорционирования способны взаимодействовать с избытком серы:
K 2 S
+ xS → K 2 Sx +1 (полисульфид калия)
K 2 SO 3 + S → K 2 S 2 O 3
(тиосульфат калия)
Полисульфид
калия будет взаимодействовать с ртутью, образуя сульфид ртути:
K 2 Sx +1 + xHg → K 2 S + xHgS
(Черный
сульфид ртути (вторая кристаллическая модификация HgS ), который может
образовываться в этих условиях, имеет меньшую энергию кристаллической решетки и
способен растворяться в растворе сульфида калия).
Для
получения чистого сульфида ртути (красного цвета) необходим избыток серы.
Весовое соотношение S : Hg > 32:200,6 > 0,155 (верхняя граница избытка
определяется объемом и концентрацией раствора гидроксида калия в синтезе).
- По окончанию синтеза в водном
растворе могут присутствовать (помимо воды и гидроксида калия) тиосульфат
калия и полисульфид калия. - От желтой до красно-коричневой
из-за присутствия полисульфид-ионов. - При подкислении раствора может
выпадать сера (продукт сопропорционирования полисульфид- и
тиосульфат-ионов):
2 S 2− x
+1 + S 2 O 3 2− + 6 H + → (2
x +4) S ↓ + 3 H 2 O
Или
образовываться продукты диспропорционирования тиосульфат-иона в кислой среде:
S2O3
2− + 2 H+ → S + SO2↑ + H2O
- HgS
- киноварь (кровь дракона).
- Красный пигмент (краситель).
Использовался во фресковой живописи. Может быть, и во Владимире есть
фрески с использованием киновари. - HgS + O2 → Hg + SO2
2Hg + O2
→ 2HgO
- В царской водке (азотная
кислота – окислитель, хлорид-ионы – комплексообразователи для ионов ртути
( II ):
3HgS + 8HNO3 + 12HCl = 3H2[HgCl4] + 3H2SO4
+ 8NO↑ + 4 H2O
- 3S + 6KOH → 2K2S + K2SO3
+ 3H2O
K 2 S
+ xS → K 2 Sx +1
K2SO3
+ S → K2S2O3
K 2 Sx +1 + xHg → K 2 S + xHgS
Задача 5.
(Задания областного этапа 2000г., задача 9.2.)
На схеме
приведены превращения X .
X + O 2
→
X + Br 2
→
X + KOH →
X + FeCl 3
→
X + SO 2
→ S + H 2 O
Предложите X
и запишите уравнения осуществленных превращений.
Решение ( стр .302)
X − H2S
2 H2S + 3 O2 = 2H2O + 2 SO2
H2S + Br2 = 2HBr + S
H2S + 2KOH = K2S + 2H2O (H2S +
KOH = KHS + H2O)
H2S + 2FeCl3 = 2 FeCl2 + 2HCl + S
2H2S + SO2 = 3S + 2H2O
Халькогены

4.3
Средняя оценка: 4.3
Всего получено оценок: 717.
4.3
Средняя оценка: 4.3
Всего получено оценок: 717.
Элементы VI группы главной подгруппы называются халькогенами. К ним относятся кислород, сера, селен, теллур и полоний. Слово «халькоген» состоит из двух греческих слов, означающих «медь» или «руда» и «рождённый».
Описание
Халькогены в природе встречаются чаще всего в составе руды – сульфидов, пиритов, оксидов, селенидов. К халькогенам относятся неметаллы и металлы. В группе сверху вниз свойства меняются следующим образом:
- металлические свойства усиливаются;
- свойства окислителя ослабевают;
- электроотрицательность уменьшается;
- термическая устойчивость ослабевает.
Общая характеристика группы халькогенов:
- неметаллы – кислород, сера, селен;
- металлы – теллур, полоний;
- валентность: II – О; IV и VI – S; II, IV, VI – Se, Te, Po;
- электронная конфигурация – ns2np4;
- гидриды – H2R;
- оксиды – RO2, RO3;
- кислородные кислоты – H2RO3, H2RO4.
По электронному строению халькогены относятся к р-элементам. На внешнем энергетическом уровне находится шесть электронов. До завершения р-орбитали не хватает двух электронов, поэтому в соединениях халькогены проявляют свойства окислителя. С увеличением в группе количества энергетических уровней связь с внешними электронами ослабевает, поэтому теллур и полоний являются восстановителями.
Находясь на границе металлов и неметаллов, теллур относится к металлоидам или полуметаллам. Является аналогом серы и селена, но менее активен.
Свойства
Наиболее активным элементом группы халькогенов является кислород. Это мощный окислитель, который проявляет четыре степени окисления – -2, -1, +1, +2.
Основные свойства халькогенов представлены в таблице.
|
Элемент |
Физические свойства |
Химические свойства |
|
Кислород (О) |
Газ. Образует две модификации – О2 и О3 (озон). О2 не имеет запаха и вкуса, плохо растворим в воде. Озон – голубоватый газ с запахом, хорошо растворимый в воде |
Реагирует с металлами, неметаллами |
|
Сера (S) |
Типичный неметалл. Твёрдое вещество с температурой плавления 115°С. Нерастворима в воде. Встречается три модификации – ромбическая, моноклинная, пластическая. Степень окисления – -2, -1, 0, +1, +2, +4, +6 |
Реагирует с кислородом, галогенами, неметаллами, металлами |
|
Селен (Se) |
Хрупкое твёрдое вещество. Полупроводник. Имеет три модификации – серый, красный, чёрный селен. Степень окисления – -2, +2, +4, +6 |
Реагирует со щелочными металлами, кислородом, водой |
|
Теллур (Te) |
Внешне похож на металл. Полупроводник. Степень окисления – -2, +2, +4, +6 |
Реагирует с кислородом, щелочами, кислотами, водой, металлами, неметаллами, галогенами |
|
Полоний (Po) |
Радиоактивный металл серебристого цвета. Степень окисления – +2, +4, +6 |
Реагирует с кислородом, галогенами, кислотами |
К халькогенам также причисляют искусственно созданный ливерморий (Lv) или унунгексий (Uuh). Это 116 элемент периодической таблицы. Проявляет сильные металлические свойства.
Что мы узнали?
Халькогены – элементы шестой группы периодической таблицы Менделеева. В группе находятся три неметалла (кислород, сера, селен), металл (полоний) и полуметалл (теллур). Поэтому халькогены являются как окислителями, так и восстановителями. Металлические свойства усиливаются в группе сверху вниз: кислород – газ, полоний – твёрдый металл. К халькогенам также относится искусственно синтезированный ливерморий с сильными металлическими свойствами.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
София Белова
4/5
-
Ники Коноваленкова
5/5
-
Сергей Ефремов
1/5
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 717.
А какая ваша оценка?
Элементы VI группы главной подгруппы называются халькогенами. К ним относятся кислород, сера, селен, теллур и полоний. Слово «халькоген» состоит из двух греческих слов, означающих «медь» или «руда» и «рождённый».
Описание
Халькогены в природе встречаются чаще всего в составе руды – сульфидов, пиритов, оксидов, селенидов. К халькогенам относятся неметаллы и металлы. В группе сверху вниз свойства меняются следующим образом:
- металлические свойства усиливаются;
- свойства окислителя ослабевают;
- электроотрицательность уменьшается;
- термическая устойчивость ослабевает.
Общая характеристика группы халькогенов:
- неметаллы – кислород, сера, селен;
- металлы – теллур, полоний;
- валентность: II – О; IV и VI – S; II, IV, VI – Se, Te, Po;
- электронная конфигурация – ns2np4;
- гидриды – H2R;
- оксиды – RO2, RO3;
- кислородные кислоты – H2RO3, H2RO4.
Рис. 1. Халькогены.
По электронному строению халькогены относятся к р-элементам. На внешнем энергетическом уровне находится шесть электронов. До завершения р-орбитали не хватает двух электронов, поэтому в соединениях халькогены проявляют свойства окислителя. С увеличением в группе количества энергетических уровней связь с внешними электронами ослабевает, поэтому теллур и полоний являются восстановителями.
Находясь на границе металлов и неметаллов, теллур относится к металлоидам или полуметаллам. Является аналогом серы и селена, но менее активен.
Рис. 2. Теллур.
Свойства
Наиболее активным элементом группы халькогенов является кислород. Это мощный окислитель, который проявляет четыре степени окисления – -2, -1, +1, +2.
Основные свойства халькогенов представлены в таблице.
|
Элемент |
Физические свойства |
Химические свойства |
|
Кислород (О) |
Газ. Образует две модификации – О2 и О3 (озон). О2 не имеет запаха и вкуса, плохо растворим в воде. Озон – голубоватый газ с запахом, хорошо растворимый в воде |
Реагирует с металлами, неметаллами |
|
Сера (S) |
Типичный неметалл. Твёрдое вещество с температурой плавления 115°С. Нерастворима в воде. Встречается три модификации – ромбическая, моноклинная, пластическая. Степень окисления – -2, -1, 0, +1, +2, +4, +6 |
Реагирует с кислородом, галогенами, неметаллами, металлами |
|
Селен (Se) |
Хрупкое твёрдое вещество. Полупроводник. Имеет три модификации – серый, красный, чёрный селен. Степень окисления – -2, +2, +4, +6 |
Реагирует со щелочными металлами, кислородом, водой |
|
Теллур (Te) |
Внешне похож на металл. Полупроводник. Степень окисления – -2, +2, +4, +6 |
Реагирует с кислородом, щелочами, кислотами, водой, металлами, неметаллами, галогенами |
|
Полоний (Po) |
Радиоактивный металл серебристого цвета. Степень окисления – +2, +4, +6 |
Реагирует с кислородом, галогенами, кислотами |
К халькогенам также причисляют искусственно созданный ливерморий (Lv) или унунгексий (Uuh). Это 116 элемент периодической таблицы. Проявляет сильные металлические свойства.
Рис. 3. Ливерморий.
Что мы узнали?
Халькогены – элементы шестой группы периодической таблицы Менделеева. В группе находятся три неметалла (кислород, сера, селен), металл (полоний) и полуметалл (теллур). Поэтому халькогены являются как окислителями, так и восстановителями. Металлические свойства усиливаются в группе сверху вниз: кислород – газ, полоний – твёрдый металл. К халькогенам также относится искусственно синтезированный ливерморий с сильными металлическими свойствами.
Предыдущая
ХимияТеория электролитической диссоциации – основные положения, сущность (9 класс, химия)
Следующая
ХимияХимическое равновесие – признаки, смещение в реакциях (9 класс, химия)
Подгруппа кислорода
22-Окт-2012 | комментария 2 | Лолита Окольнова
Подгруппа кислорода
Элементы 6-й группы главной подгруппы. Очень часто употребляемое название — ХАЛЬКОГЕНЫ — «руду рождающие». Думаю, этим названием они в большей степени обязаны сере, чем кислороду 🙂
В формате подготовки к ЕГЭ мы рассмотрим физические и химические свойства двух элементов — кислорода O и серы S.
Электронное строение
nS2 np4
Но тут не все так просто.
К кислороду претензий нет — у него электронное строение соответствует общей формуле, а вот у серы и остальных элементов есть и другие варианты… Если детально рассмотреть строение p-элементов по периодам, то нужно обратить внимание, что с 3-го периода у p- элементов появляется свободная d-орбиталь, на которую могут переходить электроны.
Именно поэтому степень окисления серы может быть не только -2.
Итак, выводы:
- Валентность элементов:
- валентность кислорода = 2,
- валентность серы — 2,4,6
- Степени окисления:
- степень окисления кислорода = -2 — типичный неметалл, сильный окислитель;
- степень окисления серы = -2(минимальная степень окисления), +2 (редко), +4, +6 (максимальная степень окисления) в минимальной с.о. S будет проявлять восстановительные свойства, в максимальной — окислительные.
- Сверху вниз в подгруппе радиус атома увеличивается, следовательно, электроны все слабее притягиваются к ядру атома, следовательно, сверху вниз металлические свойства увеличиваются.
- Как следствие этого сверху вниз в подгруппе усиливаются восстановительные свойства.
Физические свойства

Сера — S — твердое вещество, хотя мы пишем формулу этого вещества как S , но обычно образуются кристаллы состава S4 и S8. Обычно сера — пластичное вещество коричневого или желтого цвета.
На воздухе сера горит: S + O2 = SO2 (бесцветный газ с резким запахом)
Химические свойства
Свойства кислорода
| Окислительные свойства |
Восстановительные свойства |
|
Кислород может проявлять восстановительные свойства только к элементу, у которого больше электроотрицательность, т.е., он должен стоять в периодической системе элементов правее кислорода. Это КОРОЛЬ НЕМЕТАЛЛОВ — F:
|
Свойства серы:
| Окислительные свойства |
Восстановительные свойства |
|
|
Cернистая кислота — H2SO3 (степень окисления серы= +4). Соли — сульфиты
Серная кислота — H2SO4 (cтепень окисления серы=+6). Соли — сульфаты
Их свойства мы рассмотрим отдельно.
[TESTME 32]
Категории:
|
Обсуждение: «Подгруппа кислорода»
(Правила комментирования)