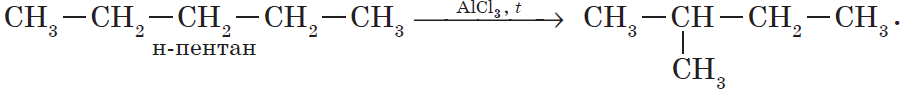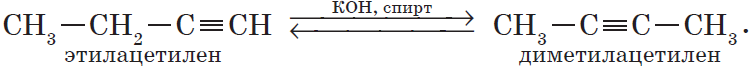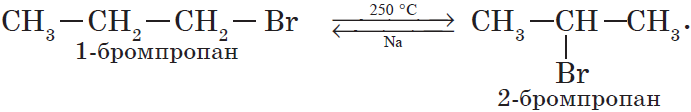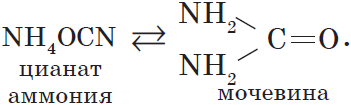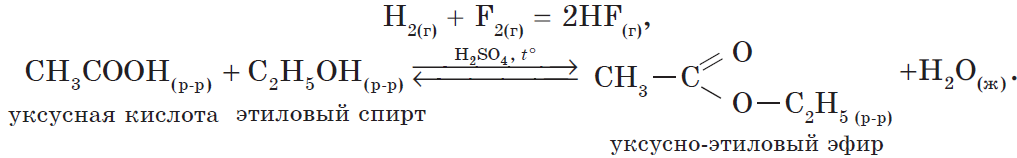Темы кодификатора ЕГЭ: Классификация химических реакций в органической и неорганической химии.
Химические реакции — это такой вид взаимодействия частиц, когда из одних химических веществ получаются другие, отличающиеся от них по свойствам и строению. Вещества, которые вступают в реакцию — реагенты. Вещества, которые образуются в ходе химической реакции — продукты.
В ходе химической реакции разрушаются химические связи, и образуются новые.
В ходе химических реакций не меняются атомы, участвующие в реакции. Меняется только порядок соединения атомов в молекулах. Таким образов, число атомов одного и того же вещества в ходе химической реакции не меняется.
Химические реакции классифицируют по разным признакам. Рассмотрим основные виды классификации химических реакций.
Классификация по числу и составу реагирующих веществ
По составу и числу реагирующих веществ разделяют реакции, протекающие без изменения состава веществ, и реакции, протекающие с изменением состава веществ:
1. Реакции, протекающие без изменения состава веществ (A → B)
К таким реакциям в неорганической химии можно отнести аллотропные переходы простых веществ из одной модификации в другую:
Sромбическая → Sмоноклинная.
В органической химии к таким реакциям относятся реакции изомериза-ции, когда из одного изомера под действием катализатора и внешних факторов получается другой (как правило, структурный изомер).
Например, изомеризация бутана в 2-метилпропан (изобутан):
CH3-CH2-CH2-CH3 → CH3-CH(CH3)-CH3.
2. Реакции, протекающие с изменением состава
- Реакции соединения (A + B + … → D) — это такие реакции, в которых из двух и более веществ образуется одно новое сложное вещество. В неорганической химии к реакция соединения относятся реакции горения простых веществ, взаимодействие основных оксидов с кислотными и др. В органической химии такие реакции называются реакциями присоединения. Реакции присоединения — это такие реакции, в ходе которых к рассматриваемой органической молекуле присоединяется другая молекула. К реакциям присоединения относятся реакции гидрирования (взаимодействие с водородом), гидратации (присоединение воды), гидрогалогенирования (присоединение галогеноводорода), полимеризация (присоединение молекул друг к другу с образованием длинной цепочки) и др.
Например, гидратация :
CH2=CH2 + H2O → CH3-CH2-OH
- Реакции разложения (A → B + C + …) — это такие реакции, в ходе которых из одной сложной молекулы образуется несколько менее сложных или простых веществ. При этом могут образовываться как простые, так и сложные вещества.
Например, при разложении пероксида водорода:
2H2O2 → 2H2O + O2.
В органической химии разделяют собственно реакции разложения и реакции отщепления. Реакции отщепления (элиминирования) — это такие реакции, в ходе которых происходит отрыв атомов или атомных групп от исходной молекулы при сохранении ее углеродного скелета.
Например, реакция отщепления водорода (дегидрирование) от пропана:
C3H8 → C3H6 + H2
Как правило, в названии таких реакций есть приставка «де». Реакции разложения в органической химии происходят, как правило, с разрывом углеродной цепи.
Например, реакция крекинга бутана (расщепление на более простые молекулы при нагревании или под действием катализатора):
C4H10 → C2H4 + C2H6
- Реакции замещения — это такие реакции, в ходе которых атомы или группы атомов одного вещества замещаются на атомы или группы атомов другого вещества. В неорганической химии эти реакции происходят по схеме:
AB + C = AC + B.
Например, более активные галогены вытесняют менее активные из соединений. Взаимодействие йодида калия с хлором:
2KI + Cl2 → 2KCl + I2.
Замещаться могут как отдельные атомы, так и молекулы.
Например, при сплавлении менее летучие оксиды вытесняют более летучие из солей. Так, нелетучий оксид кремния вытесняет оксид углерода из карбоната натрия при сплавлении:
Na2CO3 + SiO2 → Na2SiO3 + CO2
В органической химии реакции замещения — это такие реакции, в ходе которых часть органической молекулы замещается на другие частицы. При этом замещенная частица, как правило, соединяется с частью молекулы-заместителя.
Например, реакция хлорирования метана:
CH4 + Cl2 → CH3Cl + HCl
По числу частиц и составу продуктов взаимодействия эта реакция больше похожа на реакцию обмена. Тем не менее, по механизму такая реакция является реакцией замещения.
- Реакции обмена — это такие реакции, в ходе которых два сложных вещества обмениваются своими составными частями:
AB + CD = AC + BD
К реакциям обмена относятся реакции ионного обмена, протекающие в растворах; реакции, иллюстрирующие кислотно-основные свойства веществ и другие.
Пример реакции обмена в неорганической химии — нейтрализация соляной кислоты щелочью:
NaOH + HCl = NaCl + H2O
Пример реакции обмена в органической химии — взаимодействие уксусной кислоты с щелочью:
CH3-CООH + KOH = CH3-CООК + H2O
Классификация химических реакций по изменению степени окисления элементов, образующих вещества
По изменению степени окисления элементов химические реакции делят на окислительно-восстановительные реакции, и реакции, идущие без изменения степеней окисления химических элементов.
- Окислительно-восстановительные реакции (ОВР) — это реакции, в ходе которых степени окисления веществ изменяются. При этом происходит обмен электронами.
В неорганической химии к таким реакциям относятся, как правило, реакции разложения, замещения, соединения, и все реакции, идущие с участием простых веществ. Для уравнивания ОВР используют метод электронного баланса (количество отданных электронов должно быть равно количеству полученных) или метод электронно-ионного баланса.
В органической химии разделяют реакции окисления и восстановления, в зависимости от того, что происходит с органической молекулой.
Реакции окисления в органической химии — это реакции, в ходе которых уменьшается число атомов водорода или увеличивается число атомов кислорода в исходной органической молекуле.
Например, окисление этанола под действием оксида меди:
CH3-CH2-OH + CuO → CH3-CH=O + H2O + Cu
Реакции восстановления в органической химии — это реакции, в ходе которых увеличивается число атомов водорода или уменьшается число атомов кислорода в органической молекуле.
Например, восстановление уксусного альдегида водородом:
CH3-CH=O + H2 → CH3-CH2-OH
- Протолитические реакции и реакции обмена — это такие реакции, в ходе которые степени окисления атомов не изменяются.
Например, нейтрализация едкого натра азотной кислотой:
NaOH + HNO3 = H2O + NaNO3
Классификация реакций по тепловому эффекту
По тепловому эффекту реакции разделяют на экзотермические и эндотермические.
Экзотермические реакции — это реакции, сопровождающиеся выделением энергии в форме теплоты (+Q). К таким реакциям относятся почти все реакции соединения.
Исключения — реакция азота с кислородом с образованием оксида азота (II) — эндотермическая:
N2 + O2 = 2NO – Q
Реакция газообразного водорода с твердым йодом также эндотермическая:
H2 + I2 = 2HI – Q
Экзотермические реакции, в ходе которых выделяется свет, называют реакциями горения.
Например, горение метана:
CH4 + O2 = CO2 + H2O
Также экзотермическими являются:
- реакции щелочных металлов с водой;
- реакции, сопровождающиеся взрывом;
- разложение дихромата аммония («вулканчик»);
- образование аммиака: N2 + 3H2 = 2NH3;
- реакции нейтрализации;
- синтез метанола;
- алюмотермия;
- реакции, в которых из менее стабильных веществ образуются более стабильные;
- в органической химии — реакции присоединения, реакции горения, окисления и др.
Эндотермические реакции — это реакции, сопровождающиеся поглощением энергии в форме теплоты (— Q). Как правило, с поглощением теплоты идет большинство реакций разложения (реакции, требующие длительного нагревания).
Например, разложение известняка:
CaCO3 → CaO + CO2 – Q
Также эндотермическими являются:
- реакции гидролиза;
- реакции, идущие только при нагревании;
- реакции, протекающие только при очень высоких температурах или под действием электрического разряда.
Например, превращение кислорода в озон:
3O2 = 2O3 — Q
В органической химии с поглощением теплоты идут реакции разложения. Например, крекинг пентана:
C5H12 → C3H6 + C2H6 – Q
Классификация химических реакций по агрегатному состоянию реагирующих веществ (по фазовому составу)
Вещества могут существовать в трех основных агрегатных состояниях — твердом, жидком и газообразном. По фазовому состоянию разделяют реакции гомогенные и гетерогенные.
- Гомогенные реакции — это такие реакции, в которых реагирующие вещества и продукты находятся в одной фазе, и столкновение реагирующих частиц происходит во всем объеме реакционной смеси. К гомогенным реакциям относят взаимодействия жидкость-жидкость и газ-газ.
Например, окисление сернистого газа:
2SO2(г) + O2(г) = 2SO3(г)
- Гетерогенные реакции — это реакции, в которых реагирующие вещества и продукты находятся в разных фазах. При этом столкновение реагирующих частиц происходит только на границе соприкосновения фаз. К таким реакциям относятся взаимодействия газ-жидкость, газ-твердая фаза, твердая-твердая, и твердая фаза — жидкость.
Например, взаимодействие углекислого газа и гидроксида кальция:
CO2(г) + Ca(OH)2(р-р) = CaCO3(тв) + H2O
Для классификации реакций по фазовому состоянию полезно уметь определять фазовые состояния веществ. Это достаточно легко сделать, используя знания о строении вещества, в частности, о типах кристаллической решетки.
Вещества с ионной, атомной или металлической кристаллической решеткой, как правило твердые при обычных условиях; вещества с молекулярной решеткой, как правило, жидкости или газы при обычных условиях.
Обратите внимание, что при нагревании или охлаждении вещества могут переходить из одного фазового состояния в другое. В таком случае необходимо ориентироваться на условия проведения конкретной реакции и физические свойства вещества.
Например, получение синтез-газа происходит при очень высоких температурах, при которых вода — пар:
CH4(г) + H2O(г) = CO(г) + 3H2(г)
Таким образом, паровая конверсия метана — гомогенная реакция.
Классификация химических реакций по участию катализатора
Катализатор — это такое вещество, которое ускоряет реакцию, но не входит в состав продуктов реакции. Катализатор участвует в реакции, но практически не расходуется в ходе реакции. Условно схему действия катализатора К при взаимодействии веществ A + B можно изобразить так:
A + K = AK;
AK + B = AB + K.
В зависимости от наличия катализатора различают каталитические и некаталитические реакции.
- Каталитические реакции — это реакции, которые идут с участием катализаторов.
Например, разложение бертолетовой соли: 2KClO3 → 2KCl + 3O2. - Некаталитические реакции — это реакции, которые идут без участия катализатора.
Например, горение этана: 2C2H6 + 5O2 = 2CO2 + 6H2O.
Все реакции, протекающие с участием в клетках живых организмов, протекают с участием особых белковых катализаторов — ферментов. Такие реакции называют ферментативными.
Более подробно механизм действия и функции катализаторов рассматриваются в отдельной статье.
Классификация реакций по способности протекать в обратном направлении
Обратимые реакции — это реакции, которые могут протекать и в прямом, и в и обратном направлении, т.е. когда при данных условиях продукты реакции могут взаимодействовать друг с другом.
К обратимым реакциям относятся:
- большинство гомогенных реакций,
- этерификация;
- реакции гидролиза;
- гидрирование-дегидрирование,
- гидратация-дегидратация;
- получение аммиака из простых веществ,
- окисление сернистого газа,
- получение галогеноводородов (кроме фтороводорода) и сероводорода;
- синтез метанола;
- получение и разложение карбонатов и гидрокарбонатов, и т.д.
Необратимые реакции — это реакции, которые протекают преимущественно в одном направлении, т.е. продукты реакции не могут взаимодействовать друг с другом при данных условиях.
Примеры необратимых реакций:
- горение;
- реакции, идущие со взрывом;
- реакции, идущие с образованием газа, осадка или воды в растворах;
- растворение щелочных металлов в воде; и др.
117
Создан на
11 января, 2022 От Admin
Классификация химических реакций
Тренажер задания 17 ЕГЭ по химии
1 / 10
Из предложенного перечня выберите все пары веществ, взаимодействие которых является реакцией соединения.
1) натрий и вода
2) оксид натрия и вода
3) хлорид железа(II) и хлор
4) иодид калия и хлор
5) водород и хлор
2 / 10
Из предложенного перечня выберите два типа реакций, к которым можно отнести взаимодействие гидроксида меди(II) с соляной кислотой.
1) замещения
2) каталитическая
3) окислительно-восстановительная
4) нейтрализация
5) гетерогенная
3 / 10
Из предложенного перечня выберите два вещества, взаимодействие которых с соляной кислотой является окислительно-восстановительной реакцией.
1) алюминий
2) оксид меди(II)
3) нитрат серебра
4) гидроксид натрия
5) перманганат калия
4 / 10
Из предложенного перечня выберите два типа реакций, к которым не относится взаимодействие натрия с водой.
1) гетерогенная
2) обратимая
3) экзотермическая
4) замещения
5) каталитическая
5 / 10
Из предложенного перечня выберите два вещества, разложение которых является окислительно-восстановительной реакцией.
1) нитрат железа(III)
2) гидрокарбонат натрия
3) кремниевая кислота
4) карбонат кальция
5) перманганат калия
6 / 10
Из предложенного перечня выберите два типа реакций, к которым можно отнести взаимодействие хлороводорода с глицином.
1) соединения
2) экзотермическая
3) каталитическая
4) обмена
5) окислительно-восстановительная
7 / 10
Из предложенного перечня выберите все вещества, взаимодействие которых с раствором гидроксида бария является реакцией нейтрализации.
1) оксид серы(IV)
2) бромоводород
3) сульфат магния
4) азотная кислота
5) сульфат натрия
8 / 10
Из предложенного перечня выберите два типа реакций, к которым можно отнести взаимодействие оксида хрома(III) с алюминием.
1) соединения
2) окислительно-восстановительная
3) каталитическая
4) замещения
5) обмена
9 / 10
Из перечисленных типов реакций выберите два типа, которым соответствует взаимодействие цинка с раствором сульфата меди(II).
1) обмена
2) окислительно-восстановительным
3) каталитическим
4) замещения
5) обратимым
10 / 10
Из предложенного перечня выберите все типы реакций, к которым можно отнести взаимодействие водорода с хлором.
1) реакция нейтрализации
2) экзотермическая реакция
3) реакция замещения
4) окислительно-восстановительная реакция
5) гомогенная реакция
Ваша оценка
The average score is 44%
Классификация химических реакций в неорганической и органической химии
Химические реакции, или химические явления, — это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и (или) строению.
При химических реакциях обязательно происходит изменение веществ, при котором рвутся старые и образуются новые связи между атомами.
Химические реакции следует отличать от ядерных реакций. В результате химической реакции общее число атомов каждого химического элемента и его изотопный состав не меняются. Иное дело ядерные реакции — процессы превращения атомных ядер в результате их взаимодействия с другими ядрами или элементарными частицами, например, превращение алюминия в магний:
$↙{13}↖{27}{Al}+ {}↙{1}↖{1}{H}={}↙{12}↖{24}{Mg}+{}↙{2}↖{4}{He}$
Классификация химических реакций многопланова, т.е. в ее основу могут быть положены различные признаки. Но под любой из таких признаков могут быть отнесены реакции как между неорганическими, так и между органическими веществами.
Рассмотрим классификацию химических реакций по различным признакам.
Классификация химических реакций по числу и составу реагирующих веществ. Реакции, идущие без изменения состава вещества
В неорганической химии к таким реакциям можно отнести процессы получения аллотропных модификаций одного химического элемента, например:
$С_{(графит)}⇄С_{(алмаз)}$
$S_{(ромбическая)}⇄S_{(моноклинная)}$
$Р_{(белый)}⇄Р_{(красный)}$
$Sn_{(белое олово)}⇄Sn_{(серое олово)}$
$3О_{2(кислород)}⇄2О_{3(озон)}$.
В органической химии к этому типу реакций могут быть отнесены реакции изомеризации, которые идут без изменения не только качественного, но и количественного состава молекул веществ, например:
1. Изомеризация алканов.
Реакция изомеризации алканов имеет большое практическое значение, т.к. углеводороды изостроения обладают меньшей способностью к детонации.
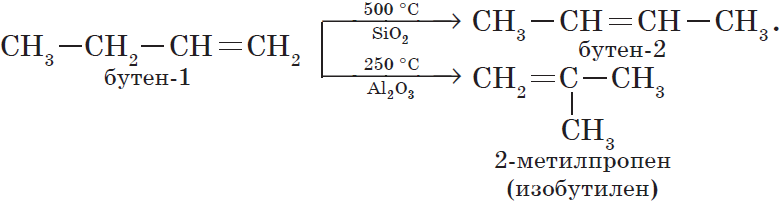
2. Изомеризация алкенов.
3. Изомеризация алкинов (реакция А. Е. Фаворского).
4. Изомеризация галогеналканов (А. Е. Фаворский).
5. Изомеризация цианата аммония при нагревании.
Впервые мочевина была синтезирована Ф. Велером в 1882 г. изомеризацией цианата аммония при нагревании.
Реакции, идущие с изменением состава вещества
Можно выделить четыре типа таких реакций: соединения, разложения, замещения и обмена.
1. Реакции соединения — это такие реакции, при которых из двух и более веществ образуется одно сложное вещество.
В неорганической химии все многообразие реакций соединения можно рассмотреть на примере реакций получения серной кислоты из серы:
1) получение оксида серы (IV):
$S+O_2=SO_2$ — из двух простых веществ образуется одно сложное;
2) получение оксида серы (VI):
$2SO_2+O_2{⇄}↖{t,p,кат.}2SO_3$ — из простого и сложного веществ образуется одно сложное;
3) получение серной кислоты:
$SO_3+H_2O=H_2SO_4$ — из двух сложных веществ образуется одно сложное.
Примером реакции соединения, при которой одно сложное вещество образуется из более чем двух исходных, может служить заключительная стадия получения азотной кислоты:
$4NO_2+O_2+2H_2O=4HNO_3$.
В органической химии реакции соединения принято называть реакциями присоединения. Все многообразие таких реакций можно рассмотреть на примере блока реакций, характеризующих свойства непредельных веществ, например этилена:
1) реакция гидрирования — присоединение водорода:
$CH_2{=}↙{этен}CH_2+H_2{→}↖{Ni,t°}CH_3{-}↙{этан}CH_3;$
2) реакция гидратации — присоединение воды:
$CH_2{=}↙{этен}CH_2+H_2O{→}↖{H_3PO_4,t°}{C_2H_5OH}↙{этанол};$
3) реакция полимеризации:
${nCH_2=CH_2}↙{этилен}{→}↖{p,кат.,t°}{(-CH_2-CH_2-)_n}↙{полиэтилен}$
2. Реакции разложения — это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ.
В неорганической химии все многообразие таких реакций можно рассмотреть на примере блока реакций получения кислорода лабораторными способами:
1) разложение оксида ртути (II):
$2HgO{→}↖{t°}2Hg+O_2↑$ — из одного сложного вещества образуются два простых;
2) разложение нитрата калия:
$2KNO_3{→}↖{t°}2KNO_2+O_2↑$ — из одного сложного вещества образуются одно простое и одно сложное;
3) разложение перманганата калия:
$2KMnO_4{→}↖{t°}K_2MnO_4+MnO_2+O_2↑$ — из одного сложного вещества образуются два сложных и одно простое, т.е. три новых вещества.
В органической химии реакции разложения можно рассмотреть на примере блока реакций получения этилена в лаборатории и промышленности:
1) реакция дегидратации (отщепления воды) этанола:
$C_2H_5OH{→}↖{H_2SO_4,t°}CH_2=CH_2+H_2O;$
2) реакция дегидрирования (отщепления водорода) этана:
$CH_3—CH_3{→}↖{Cr_2O_3,500°C}CH_2=CH_2+H_2↑;$
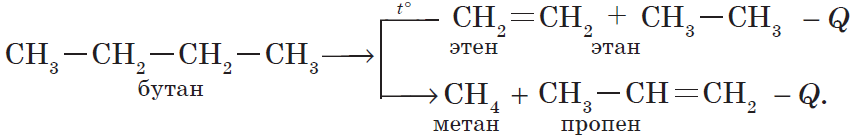
3) реакция крекинга (расщепления) пропана:
$CH_3-CH_2CH_3{→}↖{t°}CH_2=CH_2+CH_4↑.$
3. Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы какого-либо элемента в сложном веществе.
В неорганической химии примером таких процессов может служить блок реакций, характеризующих свойства, например, металлов:
1) взаимодействие щелочных и щелочноземельных металлов с водой:
$2Na+2H_2O=2NaOH+H_2↑$
2) взаимодействие металлов с кислотами в растворе:
$Zn+2HCl=ZnCl_2+H_2↑$;
3) взаимодействие металлов с солями в растворе:
$Fe+CuSO_4=FeSO_4+Cu;$
4) металлотермия:
$2Al+Cr_2O_3{→}↖{t°}Al_2O_3+2Cr$.
Предметом изучения органической химии являются не простые вещества, а только соединения. Поэтому как пример реакции замещения приведем наиболее характерное свойство предельных соединений, в частности метана, — способность его атомов водорода замещаться на атомы галогена:
$CH_4+Cl_2{→}↖{hν}{CH_3Cl}↙{хлорметан}+HCl$,
$CH_3Cl+Cl_2→{CH_2Cl_2}↙{дихлорметан}+HCl$,
$CH_2Cl_2+Cl_2→{CHCl_3}↙{трихлорметан}+HCl$,
$CHCl_3+Cl_2→{CCl_4}↙{тетрахлорметан}+HCl$.
Другой пример — бромирование ароматического соединения (бензола, толуола, анилина):
$C_6H_6Br_2{→}↖{FeBr_3}{C_6H_5Br}↙{бромбензол}+HBr$.
Обратим внимание на особенность реакций замещения у органических веществ: в результате таких реакций образуются не простое и сложное вещества, как в неорганической химии, а два сложных вещества.
В органической химии к реакциям замещения относят и некоторые реакции между двумя сложными веществами, например, нитрование бензола:
$C_6H_6+{HNO_3}↙{бензол}{→}↖{H_2SO_4(конц.),t°}{C_6H_5NO_2}↙{нитробензол}+H_2O$
Она формально является реакцией обмена. То, что это реакция замещения, становится понятным только при рассмотрении ее механизма.
4. Реакции обмена — это такие реакции, при которых два сложных вещества обмениваются своими составными частями.
Эти реакции характеризуют свойства электролитов и в растворах протекают по правилу Бертолле, т.е. только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (например, $Н_2О$).
В неорганической химии это может быть блок реакций, характеризующих, например, свойства щелочей:
1) реакция нейтрализации, идущая с образованием соли и воды:
$NaOH+HNO_3=NaNO_3+H_2O$
или в ионном виде:
$OH^{–}+H^{+}=H_2O$;
2) реакция между щелочью и солью, идущая с образованием газа:
$2NH_4Cl+Ca(OH)_2=CaCl_2+2NH_3↑+2H_2O$
или в ионном виде:
$NH_4^{+}+OH^{–}=NH_3↑+H_2O$;
3) реакция между щелочью и солью, идущая с образованием осадка:
$CuSO_4+2KOH=Cu(OH)_2↓+K_2SO_4$
или в ионном виде:
$Cu^{2+}+2OH^{-}=Cu(OH)_2↓$
В органической химии можно рассмотреть блок реакций, характеризующих, например, свойства уксусной кислоты:
1) реакция, идущая с образованием слабого электролита — $H_2O$:
$CH_3COOH+NaOH⇄NaCH_3COO+H_2O$
или
$CH_3COOH+OH^{-}⇄CH_3COO^{-}+H_2O$;
2) реакция, идущая с образованием газа:
$2CH_3COOH+CaCO_3=2CH_3COO^{–}+Ca^{2+}+CO_2↑+H_2O$;
3) реакция, идущая с образованием осадка:
$2CH_3COOH+K_2SiO_3=2KCH_3COO+H_2SiO_3↓$
или
$2CH_3COOH+SiO_3^{−}=2CH_3COO^{−}+H_2SiO_3↓$.
Классификация химических реакций по изменению степеней окисления химических элементов, образующих вещества
Реакции, идущие с изменением степеней окисления элементов, или окислительно-восстановительные реакции.
К ним относится множество реакций, в том числе все реакции замещения, а также те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество, например:
1.${Mg}↖{0}+{2H}↖{+1}+SO_4^{-2}={Mg}↖{+2}SO_4+{H_2}↖{0}↑$
${{Mg}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Mg}↖{+2}$
${{2H}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{H_2}↖{0}$
2.${2Mg}↖{0}+{O_2}↖{0}={2Mg}↖{+2}{O}↖{-2}$
${{Mg}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Mg}↖{+2}|4|2$
${{O_2}↖{0}+4{e}↖{-}}↙{окислитель}{→}↖{восстановление}{2O}↖{-2}|2|1$
Как вы помните, сложные окислительно-восстановительные реакции составляются с помощью метода электронного баланса:
${2Fe}↖{0}+6H_2{S}↖{+6}O_{4(k)}={Fe_2}↖{+3}(SO_4)_3+3{S}↖{+4}O_2+6H_2O$
${{Fe}↖{0}-3{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Fe}↖{+3}|2$
${{S}↖{+6}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{S}↖{+4}|3$
В органической химии ярким примером окислительно-восстановительных реакций могут служить свойства альдегидов:
1. Альдегиды восстанавливаются в соответствующие спирты:
${CH_3-{C}↖{+1} {}↖{O↖{-2}}↙{H↖{+1}}+{H_2}↖{0}}↙{text»уксусный альдегид»}{→}↖{Ni,t°}{CH_3-{C}↖{-1}{H_2}↖{+1}{O}↖{-2}{H}↖{+1}}↙{text»этиловый спирт»}$
${{C}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{C}↖{-1}|1$
${{H_2}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}2{H}↖{+1}|1$
2. Альдегиды окисляются в соответствующие кислоты:
${CH_3-{C}↖{+1} {}↖{O↖{-2}}↙{H↖{+1}}+{Ag_2}↖{+1}{O}↖{-2}}↙{text»уксусный альдегид»}{→}↖{t°}{CH_3-{Ag}↖{0}{C}↖{+3}{O}↖{-2}{OH}↖{-2+1}+2{Ag}↖{0}↓}↙{text»этиловый спирт»}$
${{C}↖{+1}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{C}↖{+3}|1$
${2{Ag}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}2{Ag}↖{0}|1$
Реакции, идущие без изменения степеней окисления химических элементов.
К ним, например, относятся все реакции ионного обмена, а также:
- многие реакции соединения:
$Li_2O+H_2O=2LiOH;$
- многие реакции разложения:
$2Fe(OH)_3{→}↖{t°}Fe_2O_3+3H_2O;$
- реакции этерификации:
$HCOOH+CH_3OH⇄HCOOCH_3+H_2O$.
Классификация химических реакций по тепловому эффекту
По тепловому эффекту реакции делят на экзотермические и эндотермические.
Экзотермические реакции.
Эти реакции протекают с выделением энергии.
К ним относятся почти все реакции соединения. Редкое исключение составляют эндотермические реакции синтеза оксида азота (II) из азота и кислорода и реакция газообразного водорода с твердым иодом:
$N_2+O_2=2NO – Q$,
$H_{2(г)}+I{2(т)}=2HI – Q$.
Экзотермические реакции, которые протекают с выделением света, относят к реакциям горения, например:
$4P+5O_2=2P_2O_5+Q,$
$CH_4+2O_2=CO_2+2H_2O+Q$.
Гидрирование этилена — пример экзотермической реакции:
$CH_2=CH_2+H_2{→}↖{Pt}CH_3-CH_3+Q$
Она идет при комнатной температуре.
Эндотермические реакции
Эти реакции протекают с поглощением энергии.
Очевидно, что к ним относятся почти все реакции разложения, например:
а) обжиг известняка:
$CaCO_3{→}↖{t°}CaO+CO_2↑-Q;$
б) крекинг бутана:
Количество выделенной или поглощенной в результате реакции энергии называют тепловым эффектом реакции, а уравнение химической реакции с указанием этого эффекта называют термохимическим уравнением, например:
$H_{2(г)}+Cl_{2(г)}=2HCl_{(г)}+92.3 кДж,$
$N_{2(г)}+О_{2(г)}=2NO_{(г)} – 90.4 кДж$.
Классификация химических реакций по агрегатному состоянию реагирующих веществ (фазовому составу)
Гетерогенные реакции.
Это реакции, в которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях (в разных фазах):
$2Al_{(т)}+3CuCl_{2(р-р)}=3Cu_{(т)}+2AlCl_{3(р-р)}$,
$СаС_{2(т)}+2Н_2О_{(ж)}=С_2Н_2↑+Са(ОН)_{2(р-р)}$.
Гомогенные реакции.
Это реакции, в которых реагирующие вещества и продукты реакции находятся в одном агрегатном состоянии (в одной фазе):
Классификация химических реакций по участию катализатора
Некаталитические реакции.
Некаталитические реакции идут без участия катализатора:
$2HgO{→}↖{t°}2Hg+O_2↑$,
$C_2H_4+3O_2{→}↖{t°}2CO_2+2H_2O$.
Каталитические реакции.
Каталитические реакции идут с участием катализатора:
$2KClO_3{→}↖{MnO_2,t°}2KCl+3O_2↑,$
${C_2H_5OH}↙{этанол}{→}↖{H_2SO-4,t°}{CH_2=CH_2}↙{этен}↑+H_2O$
Так как все биологические реакции, протекающие в клетках живых организмов, идут с участием особых биологических катализаторов белковой природы — ферментов, все они относятся к каталитическим или, точнее, ферментативным.
Следует отметить, что более $70%$ химических производств используют катализаторы.
Классификация химических реакций по направлению
Необратимые реакции.
Необратимые реакции протекают в данных условиях только в од ном направлении.
К ним можно отнести все реакции обмена, сопровождающиеся образованием осадка, газа или малодиссоциирующего вещества (воды), и все реакции горения.
Обратимые реакции.
Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях.
Таких реакций подавляющее большинство.
В органической химии признак обратимости отражают названия-антонимы процессов:
- гедрирование — дегидрирование;
- гидратация — дегидратация;
- полимеризация — деполимеризация.
Обратимы все реакции этерификации (противоположный процесс, как вы знаете, носит название гидролиза) и гидролиза белков, сложных эфиров, углеводов, полинуклеотидов. Обратимость лежит в основе важнейшего процесса в живом организме — обмена веществ.
1.4.1. Классификация химических реакций в неорганической и органической химии.
Классификация химических реакций на основании их признаков.
Классификационный признак |
Тип реакции |
Число и состав реагентов и продуктов |
соединенияв результате таких реакций из двух или более исходных веществ образуется только один продукт, например: С + O2 = CO2 4NO2 + O2 + 2H2O = 4HNO3 |
разложенияв таких реакциях из одного вещества образуется два или больше других веществ: 2KMnO4 = K2MnO4 + MnO2 + O2 CaCO3 = CaO + CO2 |
|
замещенияВсе реакции, в результате которых из простого и сложного веществ образуется другое простое и другое сложное вещества. Например: Zn + CuSO4 = ZnSO4 + Cu
|
|
обменаРеакциями обмена называют такие реакции, в результате которых вещества меняются своими составными частями. Например: 2NaOH + CuCl2 = 2NaCl + Cu(OH)2 Частный случай реакции обмена между кислотой и основанием носит также название реакции нейтрализации: NaOH + HCl = NaCl + H2O
|
|
Изменение степеней окисления химических элементов |
окислительно-восстановительныев результате таких реакций изменяются степени окисления одного или более химических элемента. Например: |
Реакции, протекающие с сохранением степеней окисления атомов всех химических элементов |
|
Обратимость |
обратимыетакие реакции обладают способностью протекать как в прямом, так и обратном направлении. Реакции, про которые обязательно нужно знать, что они обратимые: |
необратимыеТакие реакции протекают только в прямом направлении. Если речь идет о реакциях между электролитами, то необратимой реакция является в том случае, если образуется осадок, газ или малодиссоциирующее вещество. Например: Na2CO3 + 2HCl = 2NaCl + H2O + CO2 В качестве малодиссоциирующих веществ в реакциях ионного обмена могут образоваться вода, слабые кислоты, гидроксид аммония. |
|
Тепловой эффект |
экзотермическиеВ результате таких реакций выделяется энергия в виде теплоты. Обозначают такие реакции, добавляя «+Q» к уравнению реакции, например: |
эндотермическиеПри протекании таких реакций поглощается тепло. Для обозначения таких реакций пишут «-Q» в уравнении реакции. Практически все реакции разложения являются эндотермическими: Исключения: реакции разложения HI и NO являются экзотермическими. |
|
Количество фаз |
гомогенныеГомогенными реакциями называют такие реакции, реагенты в которых находятся в одной фазе. Примерами таких реакций могут быть многие реакции протекающие в растворах, реакции между газообразными веществами: NaOH (р-р) + HCl(р-р) = NaCl + H2O 2CO + O2 = 2CO2 В гомогенных реакциях не наблюдаются границы раздела между реагентами |
гетерогенныегетерогенными реакциями называют такие реакции, в которых реагирующие вещества находятся в разных фазах. Примерами таких реакций являются, взаимодействие цинка с раствором соляной кислоты, взаимодействие углекислого газа с известковой водой, и т.д.: |
|
По участию катализатора |
каталитическиереакции, протекающие в присутствии катализатора:
|
некаталитическиереакции, протекающие без катализатора: |
Классификация химических реакций в органической химии:
Реакции присоединения |
В зависимости от того, какое соединение присоединяется органическим веществом различают:
Гидрирование — присоединение водорода:Гидратация — присоединение воды:Гидрогалогенирование — присоединение галогеноводорода:
|
Реакции замещения |
Под реакциями замещения в органической химии подразумевают такие реакции, в результате протекания которых происходит замена одного заместителя (или атома водорода) непосредственно прикрепленного к углеродному скелету на другой заместитель. Так, например, реакциями замещения являются: Галогенирование алканов:Нитрование углеводородов:Реакция спиртов с галогеноводородными кислотами:C2H5OH + HBr = C2H5Br + H2O и т.д. |
Реакции отщепления (элиминирования) |
Все реакции, в названии которых присутствует приставка «де-«: дегидрирование:дегидратация:дегидрогалогенирование:(от исходной молекулы бромэтана отщепляется бромоводород, который нейтрализуется щелочью) дегалогенирование:Также к реакциям отщепления (элиминирования) относят крекинг — процесс термического превращения углеводородов в соединения с меньшей длинной углеродного скелета. Например, крекинг алканов, уравнение которого в общем виде можно записать как: |
Окислительно-восстановительные реакции |
Реакции, при которых изменяется степень окисления одного или нескольких атомов углерода углеродного скелета. Окисление органического соединенияВ таких реакциях отдельные атомы углерода повышают свою степень окисления. Например: Восстановление органического соединенияЧаще всего под восстановлением органических веществ понимают их взаимодействие с водородом. Например: CH3-CH=O + H2 => CH3-CH2-OH |
Реакции с сохранением качественного и количественного состава веществ |
Изомеризация |
Реакции протекающие по тем или иным механизмам |
Реакции протекающие по ионному механизмуВ таких реакциях активными действующими частицами являются ионы. Следует помнить, что по ионному механизму протекают такие реакции как:
|
Реакции протекающие по радикальному механизмуВ таких реакциях активными действующими частицами являются свободные радикалы:
|
Чтобы поделиться, нажимайте
1) Первый признак классификации – по изменению степени окисления элементов, образующих реагенты и продукты.
а) окислительно-восстановительные
+2 +5 +3 +6 +4
FeS2 + 18HNO3 = Fe(NO3) 3 + 2H2SO4 + 15NO2 + 7H2O
б) без изменения степени окисления
CaO + 2HCl = CaCl2 + H2O
Окислительно-восстановительными называют реакции, сопровождающиеся изменением степеней окисления химических элементов, входящих в состав реагентов. К окислительно-восстановительным в неорганической химии относятся все реакции замещения и те реакции разложения и соединения, в которых участвует хотя бы одно простое вещество. К реакциям, идущим без изменения степеней окисления элементов, образующих реагенты и продукты реакции, относятся все реакции обмена.
2) Химические реакции классифицируются по характеру процесса, т.е по числу и составу реагентов и продуктов.
-реакции соединения или присоединения в органической химии.
Для того чтобы вступить в реакцию присоединения, органическая молекула должна иметь кратную связь (или цикл), эта молекула будет главной (субстрат). Молекула попроще (часто неорганическое вещество, реагент) присоединяется по месту разрыва кратной связи или раскрытия цикла.
NH3 + HCl = NH4Cl
CaO + CO2 = CaCO3
-реакции разложения.
Реакции разложения можно рассматривать как процессы, обратные соединению.
C2H5Br = C2H4 + HBr
Hg(NO3)2 = Hg + 2NO2 + O2
– реакции замещения.
Их отличительный признак — взаимодействие простого вещества со сложным. Такие реакции есть и в органической химии.
Однако понятие «замещение» в органике шире, чем в неорганической химии. Если в молекуле исходного вещества какой-либо атом или функциональная группа заменяются на другой атом или группу, это тоже реакции замещения, хотя с точки зрения неорганической химии процесс выглядит как реакция обмена.
Zn + CuSO4 = Cu + ZnSO4
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
– обмена (в том числе и нейтрализации).
CaO + 2HCl = CaCl2 + H2O
KCl + AgNO3 = AgCl¯ + KNO3
3) По возможности протекать в обратном направлении – обратимые и необратимые.
4) По типу разрыва связей – гомолитические (равный разрыв, каждый атом по 1 электрону получает) и гетеролитический (неравный разрыв – одному достается пара электронов)
5) По тепловому эффекту
экзотермические (выделение тепла) и эндотермические (поглощение тепла). Реакции соединения как правило будут реакциями экзотермическими, а реакции разложения — эндотермическими. Редкое исключение — реакция азота с кислородом — эндотермическая:
N2 + О2 → 2NO – Q
6) По фазе
а) Гомогенные (однородные вещества, в одной фазе, например г-г, реакции в растворах)
б) Гетерогенные (г-ж, г-тв, ж-тв, реакции между несмешивающимися жидкостями)
7) По использованию катализатора. Катализатор – вещество ускоряющее химическую реакцию.
а) каталитические (в том числе и ферментативные) – без использование катализатора практически не идут.
б) некаталитические.
Классификацию химических реакций в неорганической и органической химии осуществляют на основании различных классифицирующих признаков, сведения о которых приведены в таблице ниже.
Необратимыми называют реакции, протекающие только в прямом направлении, в результате которых образуются продукты, не взаимодействующие между собой. К необратимым относят химические реакции, в результате которых образуются малодиссоциированные соединения, происходит выделение большого количества энергии, а также те, в которых конечные продукты уходят из сферы реакции в газообразном виде или в виде осадка, например:
HCl + NaOH = NaCl + H2O
2Ca + O2 = 2CaO
BaBr2 + Na2SO 4 = BaSO4↓ + 2NaBr
Обратимыми называют химические реакции, протекающие при данной температуре одновременно в двух противоположных направлениях с соизмеримыми скоростями. При записи уравнений таких реакций знак равенства заменяют противоположно направленными стрелками. Простейшим примером обратимой реакции является синтез аммиака взаимодействием азота и водорода:
N2 +3H2↔2NH3
По типу разрыва химической связи в исходной молекуле различают гомолитические и гетеролитические реакции.
Гомолитическими называются реакции, при которых в результате разрыва связей образуются частицы, имеющие неспаренный электрон — свободные радикалы.
Гетеролитическими называют реакции, протекающие через образование ионных частиц — катионов и анионов.
Радикальными (цепными) называют химические реакции с участием радикалов, например:
CH4 + Cl2 hv →CH3Cl + HCl
Ионными называют химические реакции, протекающие с участием ионов, например:
KCl + AgNO3 = KNO3 + AgCl↓
Электрофильными называют гетеролитические реакции органических соединений с электрофилами — частицами, несущими целый или дробный положительный заряд. Они подразделяются на реакции электрофильного замещения и электрофильного присоединения, например:
C6H6 + Cl2 FeCl3→ C 6 H 5 Cl + HCl
H2C =CH2 + Br2 → BrCH2 –CH2Br
Нуклеофильными называют гетеролитические реакции органических соединений с нуклеофилами — частицами, несущими целый или дробный отрицательный заряд. Они подразделяются на реакции нуклеофильного замещения и нуклеофильного присоединения, например:
CH3Br + NaOH → CH3OH + NaBr
CH3C(O)H + C2H5OH → CH3CH(OC2H5)2 + H2O
Экзотермическими называют химические реакции, идущие с выделением теплоты. Условное обозначение изменения энтальпии (теплосодержания) ΔH, а теплового эффекта реакции Q. Для экзотермических реакций Q > 0, а ΔH < 0.
Эндотермическими называют химические реакции, идущие с поглощением теплоты. Для эндотермических реакций Q < 0, а ΔH > 0.
Гомогенными называют реакции, протекающие в однородной среде.
Гетерогенными называют реакции, протекающие в неоднородной среде, на поверхности соприкосновения реагирующих веществ, находящихся в разных фазах, например, твердой и газообразной, жидкой и газообразной, в двух несмешивающихся жидкостях.
Каталитические реакции протекают только в присутствии катализатора. Некаталитические реакции идут в отсутствие катализатора.
Классификация органических реакций приведена в таблице:
Также вы можете посмотреть ВИДЕО-уроки на эту тему:
И выполнить задания из ЦТ и ЕГЭ на эту тему вы можете здесь
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ, ЦТ и РТ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув здесь «Получить все материалы сайта»
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
Экзо-
и эндотермические реакции.
—
Экзотермическая реакция (от
экзо… вне и греч. thérmó
— тепло, жар) , химическая реакция,
сопровождающаяся выделением теплоты.
Экзотермическая реакция являются,
например, горение, нейтрализация,
большинство реакций образования
химических соединений из простых
веществ. Количество выделяющейся при
экзотермическая реакция теплоты зависит
от массы реагентов и их природы,
агрегатного состояния исходных веществ
и продуктов взаимодействия, типа реакции
и условий её осуществления (температуры,
давления и др.) .
По тепловому эффекту экзотермическая
реакция противоположны эндотермическим
реакциям.
—
Эндотермическая реакция (от
эндо… внутри и греч. thérme
— тепло, жар) , химическая реакция,
сопровождающаяся поглощением теплоты.
К эндотермическим реакциям относятся
диссоциация (в частности, разложение
молекул на свободные атомы) , восстановление
металлов из руд, фотосинтез в растениях,
образование некоторых соединений из
простых веществ.
Реакции
и их тепловой эффект
Все
реакции можно разделить на те, в ходе
которых тепло поглощается, или, наоборот,
тепло выделяется. Представьте пробирку,
охлаждающуюся или нагревающуюся в вашей
руке — это и есть тот самый тепловой
эффект. Иногда тепла выделяется так
много, что реакции сопровождаются
воспламенением или взрывом (натрий с
водой).
-
Экзотермические
реакции
Экзотермические
реакции
(греч. exo
— вне) — химические реакции, сопровождающиеся
потерей энергии системой и выделением
тепла (той самой энергии) во внешнюю
среду. При написании химических реакций
в конце экзотермических ставят «+ Q»
(Q
— тепло), иногда бывает указано точное
количество выделяющегося тепла. Например:
2Mg
+ O2 =
2MgO
+ Q
NaOH
+ HCl
= NaCl
+ H2O
+ 56 кДж
К
экзотермическим реакциям часто относятся
реакции горения, соединения. Исключением
является взаимодействие азота и
кислорода, при котором тепло поглощается:
N2 +
O2 ⇄
2NO
— Q
Как
уже было отмечено выше, если тепло
выделяется во внешнюю среду, значит,
система реагирующих веществ потеряло
это тепло. Поэтому не должно казаться
противоречием, что внутренняя энергия
веществ в результате экзотермической
реакции уменьшается.
Энтальпией
называют
(обозначение Н), количество термодинамической
(тепловой) энергии, содержащееся в
веществе. Иногда с целью «запутывания»
в реакции вместо явного +Q
при экзотермической реакции могут
написать
ΔH
<0.
Например:
2Na
+ 2H2O
= 2NaOH
+ H2;
ΔH
< 0 (это значит, что тепло выделяется —
реакция экзотермическая)
-
Эндотермические
реакции
Эндотермические
реакции
(греч. ἔνδον
— внутри) — химические реакции,
сопровождающиеся поглощением тепла, в
результате которых образуются вещества
с более высоким энергетическим уровнем
(их внутренняя энергия увеличивается).
К
таким реакциям наиболее часто относятся
реакции разложения. При написании
эндотермических реакций в конце ставят
«-Q»,
либо указывают точное количество
поглощенной энергии. Примеры таких
реакций:
2HgO
= Hg
+ O2 —
Q
4NH3 +
5O2 =
4NO
+ 6H2O
— Q
CaCO3 =
CaO
+ CO2↑
— Q
С
целью «запутывания» может быть
дана энтальпия, она при таких реакциях
всегда: ΔH
> 0, так как внутренняя энергия веществ
увеличивается.
Например:
CaCO3 =
CaO
+ CO2↑
; ΔH
> 0 (значит реакция эндотермическая,
так как внутренняя энергия увеличивается)
-Как
понять, что химическое уравнение
экзотермическое или эндотермическое?
—
Берете
справочник, находите
стандартные энтальпии образования
продуктов, складываете с учетом
стехиометрических коэффициентов. Там
же находите энтальпии продуктов, их
тоже складываете с учетом стехиометрических
коэффициентов.
Находите разницу.
Если
разница положительная,
значит, теплота
выделяется.
Реакция экзотермическая.
Если
отрицательная — то эндотермическая.
Пример.
C
+ O2
= CO2
Стандартная
энтальпия образования углекислого газа
−393,51 кДж/моль (минус, не тире). Энтальпия
образования графита и кислорода — 0.
0-393,51
< 0 , реакция экзотермическая
Соседние файлы в предмете Химия
- #
- #
- #
- #
- #
- #
- #
- #
- #
Всего: 80 1–20 | 21–40 | 41–60 | 61–80
Добавить в вариант
Укажите эндотермическую реакцию соединения
1)
2)
3)
4)
Из предложенного перечня выберите все реакции, к которым относится реакция, уравнение которой:
.
1) замещения
2) экзотермическая
3) эндотермическая
4) соединения
5) каталитическая
Запишите в поле ответа номера выбранных реакций.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите все эндотермические реакции.
1) реакция водорода с хлором при освещении
2) термическое разложение гидроксида алюминия
3) термический крекинг метана
4) реакция оксида серы(VI) с водой
5) синтез оксида азота(II) из простых веществ
Запишите номера выбранных ответов в порядке возрастания.
Взаимодействие оксида фосфора(V) с водой относится к реакциям
1) соединения, эндотермическим
2) соединения, экзотермическим
3) обмена, экзотермическим
4) замещения, экзотермическим
Хлорирование метана
1) протекает по ионному механизму
2) относится к радикальным реакциям
3) начинается с разрыва связи в молекуле хлора
4) протекает через промежуточную реакцию
5) относится к эндотермическим процессам
6) приводит к образованию нескольких хлорпроизводных
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Урал. Вариант 1
Верны ли следующие суждения о реакции окисления оксида серы(IV)?
А. Реакция окисления оксида серы(IV) является обратимой, каталитической.
Б. Окисление и
относится к эндотермическим процессам.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Взаимодействие железа с серой относится к реакциям:
1) каталитическим
2) гетерогенным
3) эндотермическим
4) окислительно-восстановительным
5) обмена
Запишите номера выбранных типов реакций.
Взаимодействие серной кислоты с железом относится к реакциям:
1) замещения
2) каталитическим
3) эндотермическим
4) окислительно-восстановительным
5) обмена
Запишите номера выбранных типов реакций.
Из предложенного перечня выберите все реакции, которые соответствуют взаимодействию лития с водой.
1) каталитическая
2) экзотермическая
3) обратимая
4) эндотермическая
5) замещения
Запишите в поле ответа номера выбранных реакций.
Источник: РЕШУ ЕГЭ, Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 1.
Из предложенного перечня выберите все реакции, которые соответствуют взаимодействию натрия и воды.
1) экзотермическая
2) каталитическая
3) необратиая
4) обратимая
5) эндотермическая
Запишите в поле ответа номера выбранных реакций.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите все реакции, которые соответствуют взаимодействию кислорода с оксидом серы(IV).
1) эндотермическая
2) обмена
3) экзотермическая
4) соединения
5) замещения
Запишите в поле ответа номера выбранных реакций.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите все реакции, которые соответствуют взаимодействию оксида кальция с водой.
1) экзотермическая
2) замещения
3) эндотермическая
4) обмена
5) соединения
Запишите в поле ответа номера выбранных реакций.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите все реакции, которые соответствуют взаимодействию между водородом и кислородом.
1) соединения
2) обмена
3) экзотермическая
4) эндотермическая
5) разложения
Запишите в поле ответа номера выбранных реакций.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите все реакции, которые соответствуют взаимодействию между углеродом и кислородом.
1) замещения
2) соединения
3) обмена
4) экзотермическая
5) эндотермическая
Запишите в поле ответа номера выбранных реакций.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите все реакции, которые соответствуют взаимодействию между оксидом серы(IV) и кислородом.
1) соединения
2) обмена
3) замещения
4) эндотермическая
5) экзотермическая
Запишите в поле ответа номера выбранных реакций.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите все реакции, которые соответствуют взаимодействию между оксидом кальция и водой.
1) эндотермическая
2) каталитическая
3) обратимая
4) экзотермическая
5) необратимая
Запишите в поле ответа номера выбранных реакций.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите все реакции, которые соответствуют взаимодействию между кислородом и литием.
1) эндотермическая
2) соединения
3) экзотермическая
4) замещения
5) обмена
Запишите в поле ответа номера выбранных реакций.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите все реакции, которые соответствуют взаимодействию между кислородом и оксидом серы(IV).
1) соединения
2) обмена
3) обратимая
4) эндотермическая
5) замещения
Запишите в поле ответа номера выбранных реакций.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите все реакции, которые соответствуют взаимодействию между водородом и хлором.
1) разложения
2) соединения
3) обмена
4) эндотермическая
5) экзотермическая
Запишите в поле ответа номера выбранных реакций.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите все характеристики реакции, которые соответствуют взаимодействию между кальцием и серой.
1) каталитическая
2) обмена
3) гетерогенная
4) эндотермическая
5) окислительно-восстановительная
Запишите в поле ответа номера выбранных реакций.
Источник: РЕШУ ЕГЭ
Всего: 80 1–20 | 21–40 | 41–60 | 61–80