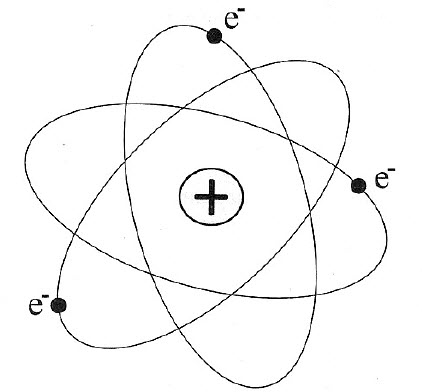
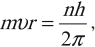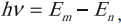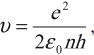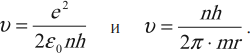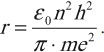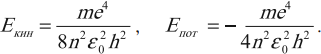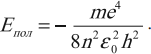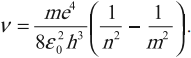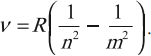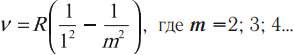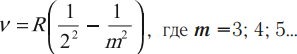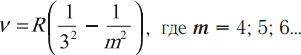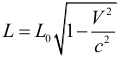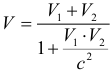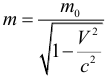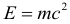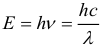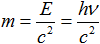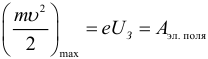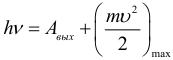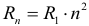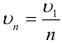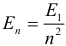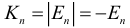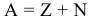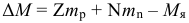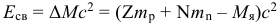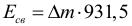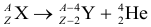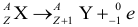Атом Бора.
Автор — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев.
Темы кодификатора ЕГЭ: постулаты Бора.
Планетарная модель атома, успешно истолковав результаты опытов по рассеянию -частиц, в свою очередь столкнулась с очень серьёзными трудностями.
Как мы знаем, любой заряд, движущийся с ускорением, излучает электромагнитные волны. Это — неоспоримый факт классической электродинамики Максвелла, подтверждаемый многочисленными наблюдениями.
Нам также хорошо известно, что электромагнитные волны несут энергию. Стало быть, ускоренно движущийся заряд, излучая, теряет энергию, которая этим излучением уносится.
А теперь давайте возьмём произвольный электрон в планетарной модели. Он двигается вокруг ядра по замкнутой орбите, так что направление его скорости постоянно меняется. Следовательно, электрон всё время имеет некоторое ускорение (например, при равномерном движении по окружности это будет центростремительное ускорение), и поэтому должен непрерывно излучать электромагнитные волны. Расходуя свою энергию на излучение, электрон будет постепенно приближаться к ядру; в конце концов, исчерпав запас своей энергии полностью, электрон упадёт на ядро.
Если исходить из того, что механика Ньютона и электродинамика Максвелла работают внутри атома, и провести соответствующие вычисления, то получается весьма озадачивающий результат: расход энергии электрона на излучение (с последующим падением электрона на ядро) потребует совсем малого времени — порядка секунды. За это время атом должен полностью «коллапсировать» и прекратить своё существование.
Таким образом, классическая физика предрекает неустойчивость атомов, устроенных согласно планетарной модели. Этот вывод находится в глубоком противоречии с опытом: ведь на самом деле ничего такого не наблюдается. Предметы нашего мира вполне устойчивы и не коллапсируют на глазах! Атом может сколь угодно долго пребывать в невозбуждённом состоянии, не излучая при этом электромагнитные волны.
Постулаты Бора.
Оставалось признать, что внутри атомов перестают действовать известные законы классической физики. Микромир подчиняется совсем другим законам.
Первый прорыв в познании законов микромира принадлежит великому датскому физику Нильсу Бору. Он предложил три постулата, резко расходящиеся с механикой и электродинамикой, но тем не менее позволяющих правильно описать простейший из атомов — атом водорода.
Классическая физика хорошо описывает непрерывные процессы — движение материальной точки, изменение состояния идеального газа, распространение электромагнитных волн… Энергия объекта, подчиняющегося механике или электродинамике, в принципе может принимать любые значения. Однако линейчатые спектры указывают на дискретность процессов, происходящих внутри атомов. Эта дискретность должна фигурировать в законах новой теории.
Первый постулат Бора. Всякий атом (и вообще, всякая атомная система) может находиться не во всех состояниях с любым, наперёд заданным значением энергии. Возможен лишь дискретный набор избранных состояний, называемых стационарными, в которых энергия атома принимает значения Находясь в стационарном состоянии, атом не излучает электромагнитные волны.
Как видим, первый постулат Бора вопиющим образом противоречит классической физике: налагается запрет на любые значения энергии, кроме избранного прерывистого набора, и признаётся, что электроны, вроде бы движущиеся ускоренно, на самом деле не излучают.
Выглядит фантастически, не правда ли? Однако в том же 1913 году, когда Бор предложил свои постулаты, существование стационарных состояний было подтверждено экспериментально — в специально поставленном опыте немецких физиков Франка и Герца. Таким образом, стационарные состояния — это не выдумка, а объективная реальность.
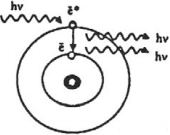
Значения разрешённого набора называются уровнями энергии атома. Что происходит при переходе с одного уровня энергии на другой?
Второй постулат Бора. Если атом переходит из стационарного состояния с большей энергией в стационарное состояние с меньшей энергией
, то разность этих энергий может высвободиться в виде излучения. В таком случае излучается фотон с энергией
. (1)
Эта же формула работает и при поглощении света: в результате столкновения с фотоном атом переходит из состояния в состояние с большей энергией
, а фотон при этом исчезает.
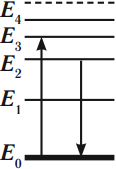
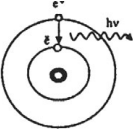
Для примера на рис. 1 показано излучение фотона при переходе атома с энергетического уровня на уровень
. Переход заключается в том, что электрон «соскакивает» с одной орбиты на другую, расположенную ближе к ядру.
Рис. 1. Излучение фотона атомом
Формула (1) даёт качественное представление о том, почему атомные спектры испускания и поглощения являются линейчатыми.
В самом деле, атом может излучать волны лишь тех частот, которые соответствуют разностям значений энергии разрешённого дискретного набора ; соответственно, набор этих частот также получается дискретным. Вот почему спектр излучения атомов состоит из отдельно расположенных резких ярких линий.
Вместе с тем, атом может поглотить не любой фотон, а только тот, энергия которого в точности равна разности
каких-то двух разрешённых значений энергии
и
. Переходя в состояние с более высокой энергией
, атомы поглощают ровно те самые фотоны, которые способны излучить при обратном переходе в исходное состояние
. Попросту говоря, атомы забирают из непрерывного спектра те линии, которые сами же и излучают; вот почему тёмные линии спектра поглощения холодного атомарного газа находятся как раз в тех местах, где расположены яркие линии спектра испускания этого же газа в нагретом состоянии.
Качественного объяснения характера атомных спектров, однако, недостаточно. Хотелось бы иметь теорию, позволяющую вычислить частоты наблюдаемых спектров. Бору удалось это сделать в самом простом случае — для атома водорода.
Атом водорода.
Атом водорода состоит из ядра с зарядом , которое называется протоном, и одного электрона с зарядом
(через
обозначена абсолютная величина заряда электрона). При построении своей теории атома водорода Бор сделал три дополнительных предположения.
1. Прежде всего, мы ограничиваемся рассмотрением только круговых орбит электрона. Таким образом, электрон движется вокруг протона по окружности радиуса с постоянной по модулю скоростью
(рис. 2).
Рис. 2. Модель атома водорода
2. Величина , равная произведению импульса электрона
на радиус орбиты
, называется моментом импульса электрона. В каких единицах измеряется момент импульса?
Смотрим:
=кг*м/с*м=(кг*м/
)*м*с=Н*м*с=Дж*с.
Это в точности размерность постоянной Планка! Именно здесь Бор увидел появление дискретности, необходимой для квантового описания атома водорода.
Правило квантования (третий постулат Бора). Момент импульса электрона может принимать лишь дискретный набор значений, кратных «перечёркнутой» постоянной Планка:
, (2)
3. Выше мы говорили, что классическая физика перестаёт работать внутри атома. Так оно в действительности и есть, но вопреки этому мы предполагаем, что электрон притягивается к протону с силой, вычисляемой по закону Кулона, а движение электрона подчиняется второму закону Ньютона:
. (3)
Эти три предположения позволяют довольно просто получить формулы для уровней энергии атома водорода. Переписываем соотношение (3) в виде:
. (4)
Из правила квантования (2) выражаем :
,
и подставляем это в (4):
.
Отсюда получаем формулу для допустимых радиусов орбит электрона:
. (5)
Теперь перейдём к нахождению энергии электрона. Потенциальная энергия кулоновского взаимодействия электрона с ядром равна:
(Она отрицательна, так как отсчитывается от бесконечно удалённой точки, в которой достигает максимального значения.)
Полная энергия электрона равна сумме его кинетической и потенциальной энергий:
.
Вместо подставим правую часть выражения (4):
. (6)
Полная энергия, как видим, отрицательна. Если на радиус орбиты никаких ограничений не накладывается, как это имеет место в классической физике, то энергия может принимать любые по модулю значения. Но согласно (5) существует лишь дискретный набор возможных значений радиуса; подставляя их в (6), получаем соответствующий набор допустимых значений энергии атома водорода:
. (7)
Основное состояние атома водорода — это состояние с наименьшей энергией . В основном состоянии атом может находиться неограниченно долго. Вычисление даёт:
Дж
эВ:
Мы видим, что если атом находится в основном состоянии, то для выбивания электрона нужно сообщить атому энергию, равную как минимум 13,6 эВ. Эта величина носит название энергии ионизации атома водорода.
По формуле (5) легко вычислить радиус орбиты основного состояния:
см.
То есть, диаметр атома оказывается равным как раз см — величине, известной из опыта. Таким образом, теория Бора впервые смогла объяснить размер атома!
Кроме того, в рамках теории Бора удаётся получить формулы для вычисления частот (или длин волн) спектра атома водорода. Так, согласно второму постулату Бора и формуле (7) имеем:
. (8)
На практике чаще имеют дело с длинами волн. Учитывая, что , формулу (8) можно переписать так:
. (9)
Константа м
называется постоянной Ридберга. Теория Бора даёт значение этой постоянной, очень хорошо согласующееся с экспериментом.
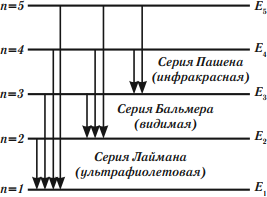
Длины волн спектра атома водорода образуют серии, характеризующиеся фиксированным значением в формуле (9). Все длины волн данной серии излучаются при переходах на уровень
с вышележащих энергетических уровней
.
Переходы в основное состояние:
образуют серию Лаймана. Длины волн этой серии описываются формулой (9) при :
.
Линии серии Лаймана лежат в ультрафиолетовом диапазоне.
Переходы на второй уровень:
образуют серию Бальмера. Длины волн этой серии подчиняются формуле (9) при :
.
Первые четыре линии серии Бальмера лежат в видимом диапазоне (рис. 3), остальные — в ультрафиолетовом.
Рис. 3. Видимый спектр атома водорода (серия Бальмера)
Переходы на третий уровень:
образуют серию Пашена. Длины волн этой серии описываются формулой (9) при :
.
Все линии серии Пашена лежат в инфракрасном диапазоне.
Имеются ещё три «именованных» серии: это серия Брэккета (переходы на уровень), серия Пфунда (переходы на уровень
) и серия Хэмпфри (переходы на уровень
). Все линии этих серий лежат в далёкой инфракрасной области.
Достоинства и недостатки теории Бора.
О достоинствах модели атома водорода, предложенной Бором, мы так или иначе уже сказали. Резюмируем их.
— Теория Бора продемонстрировала, что для описания атомных объектов принципиально недостаточно представлений классической физики. В микромире работают другие, совершенно новые законы.
Для микромира характерно квантование — дискретность изменения величин, описывающих состояние объекта. В качестве меры квантования, как показала теория Бора, может выступать постоянная Планка , которая является универсальной константой и играет фундаментальную роль во всей физике микромира (а не только в явлениях излучения и поглощения света).
— Теория Бора впервые и совершенно точно указала на факт наличия стационарных энергетических состояний атома, образующих дискретный набор. Этот факт оказался общим свойством объектов микромира.
— В рамках модели Бора удалось получить формулы для вычисления частот спектра атома водорода и объяснить размер атома. Классическая физика была не в состоянии решить эти проблемы.
Однако теория Бора, разумеется, не могла претендовать на роль общей теории, описывающей микромир. Модель Бора обладала рядом существенных недостатков.
— Теория Бора непоследовательна. С одной стороны, она отвергает описание атома на основе классической физики, так как постулирует наличие стационарных состояний и правила квантования, непонятных с точки зрения механики и электродинамики. С другой стороны, классические законы — второй закон Ньютона и закон Кулона — используются для записи уравнения движения электрона по круговой орбите.
— Теория Бора не смогла дать адекватное описание самого простого после водорода атома гелия. Подавно не могло быть и речи о распространении теории Бора на более сложные атомы.
— Даже в самом атоме водорода теория Бора смогла описать не всё. Например, дав выражения для частот спектральных линий, модель Бора не объясняла различие в их интенсивностях. Кроме того, неясен оставался механизм образования молекулы водорода из двух атомов.
Несмотря на свои недостатки, теория Бора стала важнейшим этапом развития физики микромира. Полуклассическая-полуквантовая модель Бора послужила промежуточным звеном между классической физикой и последовательной квантовой механикой , построенной десятилетием позже — в 1920-х годах.
Разберем задачи ЕГЭ на темы: «Строение атома», «Модель Резерфорда-Бора», «Энергетические уровни», «Излучение фотона».
Задача 1.
На рисунке изображена схема низших энергетических уровней атома. В начальный момент времени атом находится в состоянии с энергией Е(2). Согласно постулатам Бора, с какой энергией данный атом может излучать фотоны? (Ответ дать в 10−19 Дж.)
Решение:
Согласно постулатам Бора, атом, находящийся в стационарных состояниях, не излучает энергии. Излучение энергии возможно при переходе атома с уровня с большим значением энергии на уровень с меньшим значением энергии. Поглощение энергии, наоборот, возможно при переходе атома с меньшим уровнем энергии на больший.
С учетом представленной диаграммы, излучение атома возможно при переходе с уровня Е(2) на уровень Е(1), так как Е(2)> Е(1). Поэтому, энергия излучаемых фотонов (hv) может быть определена, как разность энергий
Подставив численные значения, рассчитаем энергию излучаемых фотонов.
(Дж).
Ответ: 3.
Задача 2.
Электрон в атоме водорода находится в основном (самом низком, с номером n = 1) энергетическом состоянии. Атом поглощает фотон с импульсом 6,8 · 10–27 кг·м/с. Найдите номер энергетического уровня, на который в результате этого перейдёт электрон.
Дано:
n1=1;
p = 6,8·10–27 кг·м/с.
Найти:
n-?
Решение:
Уровни энергии в атоме водорода определяются формулой:
(эВ), где n=1, 2, 3… и т. д. (1)
Следовательно, атом на уровне n1=1 обладает энергией, которую можно рассчитать по формуле (1).
(эВ).
Найдем связь между импульсом фотона и его энергией:
(2)
Таким образом, энергия фотона может быть определена по формуле (2).
(Дж).
С учетом, что 1 эВ, получим
(эВ).
Атом, получив энергию от фотона, переходит в стационарное состояние с большим уровнем энергии.
(эВ).
Из формулы (1) необходимо вывести номер энергетического уровня.
Ответ: 4.
Задача 3.
На рисунке изображена упрощенная диаграмма нижних энергетических уровней атома. Нумерованными стрелками отмечены некоторые возможные переходы атома между этими уровнями. Какой из этих четырех переходов связан с поглощением света наибольшей энергии, а какой — с излучением света с наибольшей длиной волны?
Установите соответствие между процессами поглощения и испускания света и стрелками, указывающими энергетические переходы атома.
К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
ПРОЦЕССЫ
А) поглощение света наибольшей энергии;
Б) излучение света с наибольшей длиной волны.
ЭНЕРГЕТИЧЕСКИЕ ПЕРЕХОДЫ
1) 1
2) 2
3) 3
4) 4
Ответ:
Решение:
По указанной диаграмме необходимо определить переходы, соответствующие поглощению и излучению света.
Переходы, указанные стрелками 1 и 2, соответствуют излучению энергии, так как атом переходит с большего уровня энергии на меньший.
Здесь надо учесть, что
и
Так как , то, согласно формуле Планка
, меньшая длина волны соответствует большему значению энергии излучения. Поэтому при переходе
будет излучаться большее количество энергии. Вторая стрелка будет соответствовать излучению света с наименьшей длиной волны.
Стрелки 3 и 4 соответствуют поглощению энергии, так как в этих случаях атом переходит на уровни, соответствующие большему значению энергии. Рассуждения, аналогичные первому случаю, приводят к следующему выводу:
и
Так как , то четвертая стрелка будет соответствовать поглощению света наибольшей энергии.
Ответ:
Задача 4.
Значения энергии электрона в атоме водорода задаются формулой: (эВ), где n=1, 2, 3… и т. д.
При переходах с верхних уровней энергии на нижние атом излучает фотон. Переходы с верхних уровней на уровень c n = 1 образуют серию Лаймана, на уровень c n = 2 – серию Бальмера и т. д. Найдите отношение γ максимальной длины волны фотона в серии Бальмера к максимальной длине волны фотона в серии Лаймана.
Решение:
Согласно формуле Планка , максимальная длина волны соответствует излучению света с наименьшим значением энергии. Поэтому для серии Лаймана это переход с уровня 2 на уровень 1 (см. рис. 1). Рассчитаем значение энергии, которая излучается в этом случае.
(эВ).
(эВ).
Длина волны, соответствующая этому переходу, может быть определена из формулы:
(1)
Аналогично для серии Бальмера, излучение с наибольшей длиной волны (наименьшей энергии излучения), соответствует переходу с уровня 3 на уровень 2 (см. рис. 2).
(эВ).
(эВ).
Длина волны, соответствующая этому переходу, может быть определена из формулы:
(2)
Тогда, для нахождения соотношения для длин волн
Разделим уравнение (2) на уравнение (1):
В расчетах значения энергий можно оставить в эВ, так как перевод в систему «СИ» ответа не изменит.
С учетом системы «СИ»:
(1 эВ Дж).
Ответ: 5,4.
Благодарим за то, что пользуйтесь нашими статьями.
Информация на странице «Атом Бора.» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать необходимые и поступить в ВУЗ или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из разделов нашего сайта.
Публикация обновлена:
08.03.2023
Физика атома
Для изучения атома и атомного ядра используются специальные методы наблюдения и регистрации элементарных частиц.
Принцип действия приборов для регистрации элементарных частиц
В основе методов обнаружения и изучения характеристик частиц – ионизирующее и фотохимическое действия частиц, отклонение частиц в магнитном поле. Регистрирующий прибор — это сложная макроскопическая система, которая находится в неустойчивом состоянии. При движении частицы в ней начинается процесс перехода в устойчивое состояние. Этот процесс позволяет регистрировать частицу.
Выбор регистрирующего устройства определяется целью эксперимента и условиями его проведения.
Метод сцинтилляций (сцинтилляционные счетчики частиц). В основе метода – способность частиц вызывать вспышки на экране, покрытом слоем специального вещества. Этот метод дает возможность счета частиц и позволяет фиксировать их распределение по энергиям.
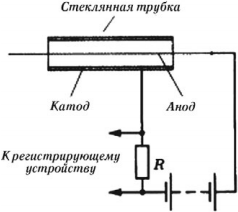
Газоразрядный счетчик Гейгера
Счетчик Гейгера применяется для регистрации электронов и ( gamma )-квантов.
Счетчик состоит из стеклянной трубки, покрытой изнутри металлическим слоем (катод), и тонкой металлической нити, идущей вдоль оси трубки (анод). Трубка заполняется инертным газом, аргоном. Действие счетчика основано на ударной ионизации. Заряженная частица, влетая в счетчик, ионизирует молекулы газа, создавая положительные ионы и электроны. Электрическое поле между анодом и катодом ускоряет электроны до энергий, при которых начинается ударная ионизация. Скорость электронов, движущихся к аноду, возрастает, и они, взаимодействуя с молекулами газа, создают лавину ионов. Ток через счетчик резко возрастает. На нагрузочном резисторе ( R ) образуется импульс напряжения, который подается в регистрирующее устройство.
Для того чтобы счетчик мог регистрировать частицу, лавинный разряд необходимо погасить. Это происходит автоматически: в момент появления импульса тока падение напряжения на нагрузочном резисторе ( R ) велико, напряжение между анодом и катодом резко уменьшается, и разряд прекращается.
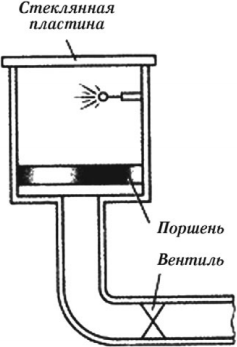
Камера Вильсона
Принцип действия камеры Вильсона основан на конденсации перенасыщенного пара на ионах с образованием капелек жидкости. Эти ионы создает вдоль своей траектории движущаяся заряженная частица. Видимый след из капелек жидкости, который оставляет заряженная частица, называется трек.
Камера Вильсона представляет собой герметически закрытый сосуд, заполненный парами воды или спирта, близкими к насыщению. При резком опускании поршня, вызванном уменьшением давления под ним, пар в камере адиабатно расширяется, охлаждается и становится перенасыщенным. Это — неустойчивое состояние пара: он легко конденсируется, если в сосуде появляются центры конденсации. Центрами конденсации становятся ионы, которые образует в рабочем пространстве камеры пролетевшая частица.
Затем камера возвращается в исходное состояние, и ионы удаляются электрическим полем. Если поместить камеру Вильсона в однородное магнитное поле, то в результате действия силы Лоренца треки частиц искривляются. Это позволяет определить удельный заряд частицы (по радиусу кривизны трека и скорости частицы). Если удельный заряд частицы известен, то по радиусу кривизны трека можно определить энергию и скорость частицы.
Пузырьковая камера
В 1952 г. американский ученый Д. Глейзер предложил использовать для обнаружения треков частиц перегретую жидкость. В такой жидкости на ионах (центрах парообразования), образующихся при движении быстрой заряженной частицы, появляются пузырьки пара, дающие видимый трек. Это устройство получило название «пузырьковая камера».
В исходном состоянии жидкость в камере находится под высоким давлением при температуре выше температуры кипения при атмосферном давлении. При резком понижении давления жидкость оказывается перегретой и будет находиться в неустойчивом состоянии. Заряженные частицы, пролетающие в это время, вызывают появление треков, состоящих из пузырьков пара. В качестве жидкости используются жидкий водород и пропан.
Преимущество пузырьковой камеры перед камерой Вильсона – большая плотность рабочего вещества. Пробеги частиц вследствие этого оказываются достаточно короткими. Это позволяет регистрировать частицы с большой энергией и наблюдать серию последовательных превращений частицы и вызываемые ею реакции.
Метод толстослойных фотоэмульсий основан на фотохимическом действии быстрых заряженных частиц, проходящих через фотоэмульсию. Толщина слоя фотоэмульсии составляет от 0,5 до 1 мм. Быстрая заряженная частица ионизирует атомы фотоэмульсии и оставляет скрытое изображение. После обработки это изображение становится видимым и может изучаться.
Содержание
- Планетарная модель атома
- Постулаты Бора
- Линейчатые спектры
- Лазер
- Основные формулы по теме «Физика атома»
Планетарная модель атома
Английский ученый Томсон в 1903 году предложил первую модель атома.
Положительный заряд атома занимает весь объем атома и распределен в этом атоме с постоянной плотностью, а внутри него находятся электроны.
Модель атома Томсона сравнивают с «булочкой с изюмом», в которой роль изюминок играют электроны.
Атом водорода, согласно этой модели, представляет собой положительно заряженный шар радиусом 10-8 м, внутри которого находится электрон. У более сложных атомов внутри положительно заряженного шара находятся несколько электронов.
Модель атома Томсона не получила экспериментального подтверждения.
Опыт Резерфорда по рассеянию ( alpha )-частиц
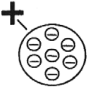
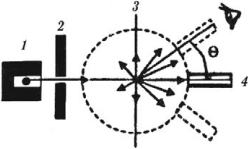
В начале ХХ века английский ученый Э. Резерфорд исследовал прохождение узкого пучка ( alpha )-частиц через золотую фольгу толщиной около 4 · 10-7 м.
Для изучения строения атома Резерфорд предложил зондирование атома с помощью ( alpha )-частиц, которые испускались радиоактивным элементом 1, помещенным внутри свинцового цилиндра, поглощающего все ( alpha )-частицы, кроме тех, которые проходили через узкий канал 2. Узкий пучок ( alpha )-частиц попадал на фольгу из золота 3. Рассеянные после взаимодействия с золотом ( alpha )-частицы регистрировались визуально с помощью светочувствительного экрана и микроскопа 4.
В результате опыта было обнаружено, что, хотя большая часть ( alpha )-частиц проходила сквозь тонкий слой вещества, почти не отклоняясь от первоначального направления, очень небольшая доля этих частиц отклонялась на большие углы. Это возможно только под действием большой кулоновской силы, которая является результатом лобового столкновения положительно заряженной ( alpha )-частицы с положительным зарядом в атоме. Размеры этого заряда очень малы. Резерфорд назвал его «ядро атома» и в 1911 году предложил планетарную модель атома.
Планетарная модель атома
Резерфорд предположил, что атом представляет собой миниатюрную планетарную систему, в которой действуют электрические силы притяжения. В центре каждого атома находится положительно заряженное ядро. Вокруг ядра по эллиптическим орбитам вращаются отрицательно заряженные электроны.
В ядре сосредоточена практически вся масса атома, но оно занимает ничтожно малую часть его объема. Электронная оболочка занимает большую часть объема атома, но ее масса мала.
В целом атом нейтрален, т. к. суммарный отрицательный заряд электронов равен положительному заряду атомного ядра.
Планетарная модель атома Резерфорда не смогла объяснить ряд важнейших свойств атомов. В частности, атом, согласно классической механике, должен излучать электромагнитные волны, т. к. электроны движутся с ускорением (центростремительным). Это должно приводить к уменьшению энергии атома, а следовательно, к падению электрона на ядро. Однако атомы обычно не излучают электромагнитные волны и устойчивы.
Постулаты Бора
Датский ученый Н. Бор, развивая идеи Резерфорда, в 1913 году утверждал, что законы движения микрочастиц сильно отличаются от законов движения в макромире. По его мнению, законы микромира – квантовые законы, которые в то время еще не были установлены наукой. Н. Бор положил в основу своей теории следующие постулаты.
Постулаты Бора
Постулат стационарных состояний:
атом может находиться лишь в определенных стационарных состояниях, каждому из которых соответствует определенная энергия. В стационарных состояниях атом не излучает энергию.
Условие квантования круговых орбит:
каждому стационарному состоянию соответствует строго определенная энергия. Двигаясь по круговым орбитам, электроны обладают квантованными значениями момента импульса:
где ( n ) = 1; 2; 3… – номер стационарной орбиты, ( r ) – радиус стационарной орбиты, ( h ) – постоянная Планка.
Правило частот:
излучение или поглощение энергии атомом происходит при переходе электрона из одного стационарного состояния в другое. Энергия излученного или поглощенного кванта электромагнитного излучения при переходе атома из одного стационарного состояния с энергией ( E_m ) в другое стационарное состояние с энергией ( E_n ) равна разности энергий атома в этих состояниях:
где ( m ) и ( n ) – номера стационарных состояний.
Говорят, что энергия атома квантуется, а при переходе с одной стационарной орбиты на другую атом теряет или поглощает квант энергии. Поэтому теория атома Бора была названа квантовой теорией.
Стационарное состояние с минимальным запасом энергии называется основным состоянием, а все остальные стационарные состояния называются возбужденными состояниями.
Стационарные состояния представляют с помощью энергетической диаграммы. На ней состояния атома обозначаются горизонтальными линиями – энергетическими уровнями.
Переход атома из стационарного состояния с меньшей энергией в состояние с большей энергией сопровождается поглощением энергии и обозначается стрелкой, направленной вверх. Переход атома из стационарного состояния с большей энергией в состояние с меньшей энергией сопровождается выделением энергии и обозначается стрелкой, направленной вниз.
Используя постулаты и планетарную модель атома, Бор разработал количественную теорию атома водорода.
Применяя классические представления о движении электрона по круговой орбите под действием кулоновской силы притяжения между ядром и электроном, он получил выражение для радиусов орбит, соответствующих стационарным состояниям атома водорода, и для энергетических уровней.
При движении по круговой орбите кулоновская сила обеспечивает электрону центростремительное ускорение:
Для водорода ( Z ) = 1; ( frac{e^2}{4piepsilon_0r}=mv^2 ) или ( frac{e^2}{4piepsilon_0v}=mvr,,mvr=frac{nh}{2pi}. )
Скорость электрона на стационарных круговых орбитах:
где ( n ) = 1; 2; 3 … – номер стационарной круговой орбиты,
Радиус стационарных круговых орбит:
Радиус первой боровской орбиты: ( r_1 ) = 0,528·10-10 м.
Двигаясь по каждой из разрешенных стационарных круговых орбит, электрон обладает определенным запасом кинетической и потенциальной энергий:
Полная энергия электрона на стационарной орбите равна сумме кинетической и потенциальной энергий:
Согласно постулату Бора энергия излучения: ( hnu=E_m-E_n ),
( R=frac{me^4}{8varepsilon_0^2h^3}= )3,29 · 1015 с-1 – постоянная Ридберга,
Серии спектральных линий излучения, возникающих при переходе атома водорода из возбужденных состояний, принято объединять в группы.
Спектральные серии атома водорода
- Серия Лаймана
Если атом водорода перейдет с возбужденных стационарных уровней в основное состояние, то он излучит невидимые ультрафиолетовые лучи с набором соответствующих частот:
- Серия Бальмера
Если атом водорода перейдет с возбужденных стационарных уровней на второй уровень, то он излучит видимый свет с набором соответствующих частот:
- Серия Пашена
Если атом водорода перейдет с возбужденных стационарных уровней на третий уровень, то он излучит невидимые инфракрасные лучи c набором соответствующих частот:
Линейчатые спектры
Спектр – это набор частот, излучаемых нагретым телом.
Виды спектров
- Непрерывные (сплошные) спектры дают нагретые тела в твердом и жидком состоянии, а также в сжатом газообразном.
- Линейчатые спектры дают раскаленные газы в атомарном состоянии под сравнительно небольшим давлением.
- Полосатые спектры дают газы в молекулярном состоянии.
Различают линейчатые спектры испускания и поглощения.
Спектры испускания дают нагретые до высокой температуры тела. Эти спектры состоят из узких линий разного цвета.
Для получения линейчатого спектра излучения вещества, находящегося в обычных условиях в твердом состоянии, его надо нагреть до высокой температуры, при которой оно перейдет в атомарное газообразное состояние.
Спектры поглощения возникают при пропускании лучей сплошного спектра через менее нагретый газ. На фоне сплошного спектра обнаруживаются узкие темные полосы.
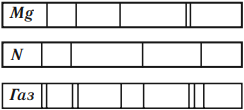
Линейчатый спектр у каждого химического элемента свой, не совпадающий со спектром другого химического элемента.
Зная линейчатые спектры различных химических элементов, можно определить химический состав неизвестного газа. Для этого необходимо сравнить линейчатый спектр данного газа со спектрами известных элементов.
По рисунку видно, что газ состоит из магния и азота, т. к. в его спектре присутствуют только линии, принадлежащие этим газам.
Линии спектра поглощения расположены в тех местах спектра, в которых находятся линии спектра излучения того же газа.
Спектральный анализ – метод определения химического состава тел по их спектру испускания или поглощения.
Спектральный анализ основывается на двух положениях:
- каждый химический элемент или химическое соединение характеризуется определенным спектром;
- интенсивность линий и полос в спектре зависит от концентрации того или иного элемента в веществе.
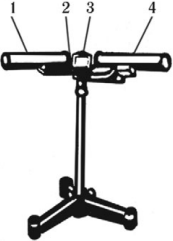
Спектроскоп – прибор для разложения сложного света и наблюдения спектров.
Спектроскоп состоит из двух труб – коллиматорной (1) и зрительной (4), укрепленных на подставке (2), и стеклянной призмы под крышкой (3).
Параллельный пучок света, выходящий из коллиматора, попадает на грань стеклянной призмы. Так как показатель преломления зависит от длины волны, то пучок света, состоящий из волн с разной длиной волны, разлагается на параллельные пучки света разного цвета. Линза зрительной трубы фиксирует каждый пучок и дает разноцветные изображения щели, образуя разноцветную полоску – спектр.
Лазер
Лазер – это оптический квантовый генератор, создающий мощные, узконаправленные, когерентные пучки монохроматического излучения.
Излучение может быть спонтанным (самопроизвольным) или индуцированным (вынужденным).
Спонтанное излучение – испускание атомом фотона в результате самопроизвольного перехода электрона из возбужденного состояния в основное.
Индуцированное излучение – переход электрона из возбужденного состояния в основное под действием электромагнитного излучения.
Фотон-«катализатор» попадает в возбужденный электрон и, стимулируя его переход в основное состояние, не теряет своей энергии. В результате из атома испускаются два фотона.
Основные компоненты лазера:
- активная среда – среда, в которой создаются состояния с инверсной заселенностью, т. е. заселенностью, при которой число атомов в возбужденных состояниях больше, чем их число в основном состоянии;
- система накачки – устройство для создания инверсной заселенности уровней в активной среде;
- оптический резонатор – устройство, выделяющее в пространство избирательно направленный поток фотонов и формирующее выходящий световой пучок.
Классификация лазеров
- По типу активной среды – твердотельные, газовые, полупроводниковые, жидкостные.
- По методу накачки – оптические, тепловые, химические, электроионизационные и др.
- По режиму генерации – непрерывного действия, импульсного действия.
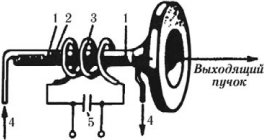
Устройство рубинового лазера
1 – система зеркал; состоит из двух строго параллельных друг другу плоских зеркал, расположенных возле торцов рубинового стержня. Используется для того, чтобы заставить световой пучок многократно проходить через рубиновый стержень. Одно из зеркал полностью отражает свет, а другое полупрозрачно, т. е. частично отражает, а частично пропускает свет;
2 – рубиновый стержень; представляет собой цилиндр, длина которого в 8–10 раз превышает его диаметр;
3 – газоразрядная лампа; имеет вид спирали и охватывает рубиновый стержень. Ее используют для возбуждения ионов хрома в рубине;
4 – система охлаждения; охлаждает рубиновый стержень при работе лазера;
5 – батарея конденсаторов.
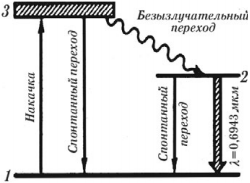
Принцип работы рубинового лазера
При облучении рубина сине-зеленым светом ионы хрома возбуждаются и из основного состояния (уровень 1) переходят в возбужденное состояние (уровень 3). Через короткий промежуток времени (≈10-8 с) большинство ионов хрома спонтанно переходят с уровня 3 на метастабильный энергетический уровень 2, в котором они могут находиться ≈10-3 с, т. е. в 100 тысяч раз дольше, чем на обычном возбужденном уровне. Таким образом, создается «перенаселение» уровня 2, т. е. число возбужденных электронов больше числа невозбужденных электронов. Переход ионов с энергетического уровня 3 на метастабильный уровень 2 происходит без излучения света. Высвобождающаяся при таком переходе энергия передается кристаллической решетке рубина.
Под действием электромагнитных волн, облучающих рубин, или под действием фотонов, появляющихся в самом веществе при спонтанных переходах атомов на уровень 2, происходит переход ионов хрома с метастабильного уровня 2 на уровень 1, и возникает вынужденное излучение света.
Свойства лазерного излучения:
- временная и пространственная когерентность;
- строгая монохроматичность;
- большая плотность потока энергии;
- очень малое угловое расхождение в пучке.
Применение лазеров:
- передача информации; связь (особенно в космосе);
- точное определение расстояний;
- трассировка туннелей; геологические измерения;
- определение курса и скорости кораблей, самолетов, ракет;
- в голографии для получения объемных изображений предметов;
- точечная сварка при изготовлении микросхем;
- осуществление управления термоядерными реакциями;
- в хирургии для разрезания, сшивания, стерилизации живых тканей, для приваривания отслоившейся сетчатки глаза.
Основные формулы по теме «Физика атома»
Физика атома
2.9 (58.75%) 16 votes
1. Вспоминай формулы по каждой теме
2. Решай новые задачи каждый день
3. Вдумчиво разбирай решения
Атомные спектры. Энергетические уровни
Электрон в атоме водорода перешёл с энергетического уровня с номером m в основное энергетическое состояние с номером (n = 1). При этом был испущен фотон с импульсом (6,45cdot10^{-27}) кг(cdot)м/с. Чему равен номер (m)?
Найдем энергию испущенного фотона: [E=pc=6,45cdot 10^{-27}text{ кг·м/с}cdot 3cdot 10^{8}text{кг·м/с}=19,5cdot 10^{-19}approx 12,09text{ эВ}]
Энергетические уровни водорода находятся по формуле: [E_n=-dfrac{13,6text{ эВ}}{n^2}]
Второй постулат Бора: [E=E_M-E_n]
Подставим значения: [12,09text{ эВ}=-13,6cdot text{ эВ}left(dfrac{1}{m^2}-dfrac{1}{n^2}right)] [12,09=-13,6cdotleft(dfrac{1}{m^2}-dfrac{1}{4}right)] [12,09=-13,6cdotleft(dfrac{1}{m^2}-dfrac{1}{4}right)]
Таким образом, (m=3).
Ответ: 3
Электрон в атоме водорода переходит с энергетического уровня с номером (n = 2) на энергетический уровень с (n = 1). Чему равен модуль импульса испущенного при этом фотона? Ответ выразите в кг(cdot)м/с, умножив на (10^{-27}).
Энергетические уровни водорода находятся по формуле: [E_n=-dfrac{13,6text{ эВ}}{n^2}]
Второй постулат Бора: [E=E_2-E_1]
Получим: [E=-13,6cdotleft(1-dfrac{1}{4}right)=10,2text{ эВ}]
Импульс энергии фотона: [p=dfrac{E}{c}=dfrac{10,2cdot1,6cdot10^{-19}}{3cdot10^{8}}=5,44cdot10^{27} text{ кг $cdot$ м/с}]
Ответ: 5,44
Атомные ядра с одинаковым массовым числом, но разным количеством протонов и нейтронов, принято называть изобарами. Примером изобар могут служить ядро аргона (_{18}^{40}Ar) и ядро одного из изотопов калия (_{19}K). Сколько нейтронов содержится в указанном ядре калия? ?
Количество нейтронов равно разности атомной массы и зарядового числа, тогда в указанном ядре калия: [40-19=21]
Ответ: 21
Атомные ядра с одинаковым массовым числом, но разным количеством протонов и нейтронов, принято называть изобарами. Примером изобар могут служить ядро кадмия (_{48}^{122}Cd) и ядро одного из изотопов олова (_{50}Sn). Сколько нейтронов содержится в указанном ядре олова? ?
Количество нейтронов равно разности атомной массы и зарядового числа, тогда в указанном ядре олова: [122-50=72]
Ответ: 72
Электрон в атоме водорода находится в основном (самом низком, с номером n = 1) энергетическом состоянии. Атом поглощает фотон с импульсом 6,8(cdot)10(^{-27}) кг(cdot)м/с. Найдите номер энергетического уровня, на который в результате этого перейдёт электрон.
Энергия фотона: [E_text{фот}=hnu=pc=12,75text{ эВ}] Второй постулат Бора: [hnu=E_m-E_n Rightarrow pc = dfrac{-13,6}{n^2}+13,6 Rightarrow n=4]
Ответ: 4
В таблице приведены значения энергии для второго и четвёртого энергетических уровней атома водорода. [begin{array}{|c|c|} hline text{Номер уровня
} & text{Энергия 10$^{-19}$ Дж}\ hline text{2} & text{-
5,45} \ hline text{4} & text{-1,36} \ hline end{array}]
Какой должна быть энергия фотона, при поглощении которого атом переходит со второго уровня на четвёртый? (Ответ дать в 10(^{-19}) Дж.)
Для того, чтобы электрон перешёл со второго уровня на четвёртый под действием фотона, энергия фотона должна быть равна разности энергий четвёртого и второго энергетических уровней: [(-1,36-(-5,45))10^{-19}text{ Дж}=4,09cdot 10^{-19}text{ Дж}]
Ответ: 4,09

Курс Глицин. Любовь, друзья, спорт и подготовка к ЕГЭ
Курс Глицин. Любовь, друзья, спорт и подготовка к ЕГЭ
Атомная физика (физика атома)
Ключевые слова конспекта «Атомная физика (физика атома)»: планетарная модель атома Резерфорда, постулаты Бора, постоянная Планка, формула Бальмера, серия Бальмера, Лаймана, Пашена.
Раздел ЕГЭ по физике: 5.2. Физика атома.
Планетарная модель атома Резерфорда
Резерфорд, изучая рассеяние быстрых альфа-частиц при прохождении их через тонкую золотую фольгу, обнаружил, что все альфа-частицы рассеиваются на всевозможные углы, вплоть до углов, близких к 180°.
Ядерная модель атома (по Резерфорду): тяжелое положительное ядро, содержащее почти всю массу атома и заряд Z•e, е — заряд электрона, имеет радиус порядка 10–15 м. Вокруг него движутся электроны в пределах объема радиусом 10–10 м. Заряд ядра равен суммарному заряду электронов в электронной оболочке атома, следовательно, атом электрически нейтрален.
Противоречия модели атома (по Резерфорду)
- Обращающиеся вокруг ядра электроны обладают центростремительным ускорением, а значит, должны излучать. За счет кулоновских сил расстояние между электроном и ядром непрерывно уменьшается, а частота непрерывно растет и в рамках классической физики спектр излучения атома — непрерывный, что противоречит эксперименту.
- Атом с изменяющимися параметрами — неустойчив (электрон должен «упасть» на ядро), в действительности атомы устойчивы и в состоянии с минимальной энергией могут существовать неограниченно долго.
Оставаясь в рамках классической механики, Резерфорд не смог разрешить данные противоречия.
Постулаты Бора
- В атоме существуют устойчивые (стационарные) орбиты, движение электрона по которым не сопровождается излучением или поглощением энергии.
- При переходе атома из одного стационарного состояния в другое происходит излучение или поглощение кванта энергии:
h • vmn = Еm – Еn.
- Момент импульса электрона, находящегося на стационарной орбите, квантуется:
m • υn • rn = n • ħ,
где n — номер стационарной орбиты, ħ = h/2p = 1,05 • 10–34 Дж•с — постоянная Планка (аш (h) с чертой).
Боровская модель атома водорода. Серия Бальмера.
Спектры испускания и спектры поглощения
Атом с одним вращающимся вокруг ядра электроном называется водородоподобным атомом.
Боровская модель атома водорода описывает атом водорода и водородоподобные атомы.
Энергетический уровень — энергия, которой обладает электрон в атоме, находящемся в определенном стационарном состоянии.
Основное состояние атома — состояние с минимальной энергией.
Атом водорода имеет определенный спектр энергий. Состояние атома с n = 1 называют основным состоянием. Энергия основного состояния электрона в атоме водорода:
где k = 9•109 Н•м2/Кл2; m = 9,1 • 10–31 кг — масса электрона; е = –1,6 • 10–19 Кл — заряд электрона; h = 6,62 • 10–34 (Дж•с) — постоянная Планка.
Возбужденные состояния атома водорода — это состояния с номером п > 1, где п — главное квантовое число. Чем больше квантовое число п, тем дальше от ядра находится электрон, тем выше его энергетический уровень. Энергетический спектр атома водорода можно рассчитать:
Энергетический спектр водородоподобного атома рассчитывают с учетом Z —зарядового числа химического элемента:
Линейчатый спектр — спектр излучения, состоящий из отдельных узких спектральных линий различной интенсивности. Излучение, которое испускают атомы, образует линейчатый спектр.
Линейчатый спектр включает в себя резко очерченные цветные линии, которые обязательно отделяются друг от друга широкими темными промежутками. Расположение спектральных линий строго упорядочено и индивидуально для каждого вещества.
Формула, позволяющая найти частоты или длины волн, соответствующие линиям водородного спектра:
Атом испускает квант энергии, если m > n — все возможные частоты, вычисленные по данной формуле, дают спектр излучения атома водорода.
Атом поглощает квант энергии, если m < n. Спектр поглощения вещества получают, пропуская свет от источника, дающего сплошной спектр, через вещество, атомы и молекулы которого находятся в невозбужденном состоянии. Атом или молекула вещества поглощает излучение той же частоты, что и излучает, т. е. линии поглощения соответствуют линиям испускания — это закон обратимости спектральных линий Кирхгофа.
Энергетические уровни в атоме водорода принято обозначать горизонтальными линиями.
При n = 1 переходы с верхних уровней в основное состояние образуют серию Лаймана — ультрафиолетовая область спектра.
При n = 2 переходы с верхних уровней в первое возбужденное состояние образуют серию Бальмера — видимая часть спектра.
При n = 3 переходы с верхних уровней во второе возбужденное состояние образуют серию Пашена — инфракрасная часть спектра и т. д.
Формула Бальмера
Конспект урока по физике для класса «Атомная физика (физика атома)». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по физике для 7-11 классов
- Найти конспект через Кодификатор ОГЭ по физике
- Найти конспект через Кодификатор ЕГЭ по физике
Всего: 46 1–20 | 21–40 | 41–46
Добавить в вариант
На рисунке изображена упрощённая диаграмма нижних энергетических уровней атома водорода (Е0 = 13,6 эВ). Стрелками отмечены некоторые возможные переходы атома между этими уровнями.
Установите соответствие между показанными на рисунке процессами поглощения фотона наибольшей частоты и излучения фотона наименьшей длины волны и энергией соответствующего фотона. К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
ПРОЦЕСС
А) поглощение фотона наименьшей длины волны
Б) излучение фотона наибольшей частоты
Установите соответствие между названиями постулатов и их формулировками. К каждой позиции первого столбца подберите нужную позицию второго и запишите в таблицу выбранные цифры под соответствующими буквами.
ИХ ФОРМУЛИРОВКИ
1) переходя из одного состояния в другое, атом излучает (поглощает) половину раз-ности энергий в начальном и конечном состояниях
2) переходя из одного состояния в другое, атом излучает (поглощает) квант энергии, равный разности энергий в начальном и конечном состояниях
3) атом может находиться только в одном из двух возможных состояний
4) атом может находиться только в одном из состояний с определенным значением энергии
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
В атоме водорода уровни энергии описываются формулой Наибольшая длина волны излучаемого фотона при переходе на второй уровень энергии равна 650 нм. Чему будет равна наибольшая длина волны излучаемого фотона при переходе на уровень энергии 4.
Источник: ЕГЭ по физике 01.04.2019. Досрочная волна. (Часть С)
На рисунке изображена упрощённая диаграмма нижних энергетических уровней атома. Нумерованными стрелками отмечены некоторые возможные переходы атома между этими уровнями. Какие из этих переходов связаны с поглощением кванта света наибольшей длины волны и излучением кванта света с наименьшей энергией? Установите соответствие между процессами поглощения и испускания света и стрелками, обозначающими энергетические переходы атома. К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
ПРОЦЕССЫ
А) поглощение кванта света наибольшей длины волны
Б) излучение кванта света с наименьшей энергией
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Демонстрационная версия ЕГЭ—2021 по физике
В атоме водорода уровни энергии описываются формулой Наибольшая длина волны излучаемого фотона при переходе на второй уровень энергии равна 655 нм. Найдите E0.
Источник: ЕГЭ по физике 01.04.2019. Досрочная волна. Вариант 1
На рисунке изображена схема низших энергетических уровней атома. В начальный момент времени атом находится в состоянии с энергией
Согласно постулатам Бора с какой энергией данный атом может излучать фотоны? (Ответ дать в 10−19 Дж.)
Источник: ЕГЭ по физике 06.06.2013. Основная волна. Дальний Восток. Вариант 1.
В первом эксперименте атомы водорода облучают потоком фотонов такой частоты, что электроны в атомах переходят с энергетического уровня с номером n > 1 на энергетический уровень с номером n + 1. При постановке второго эксперимента частоту фотонов подбирают такой, что электроны в атомах переходят с энергетического уровня с номером n − 1 на энергетический уровень с номером n. Определите, как изменяются во втором эксперименте по сравнению с первым длина волны падающего на атом фотона и приращение энергии атома в результате поглощения фотона.
Для каждой величины определите соответствующий характер изменения:
1) увеличивается
2) уменьшается
3) не изменяется
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
| Длина волны падающего
на атом фотона |
Приращение энергии атома в результате поглощения фотона |
В первом эксперименте атомы водорода облучают потоком фотонов такой частоты, что электроны в атомах переходят с энергетического уровня с номером n > 1 на энергетический уровень с номером n + 1. При постановке второго эксперимента частоту фотонов подбирают такой, что электроны в атомах переходят с энергетического уровня с номером n + 2 на энергетический уровень с номером n + 1. Определите, как изменяются во втором эксперименте по сравнению с первым длина волны падающего на атом фотона и приращение энергии атома в результате поглощения фотона.
Для каждой величины определите соответствующий характер изменения:
1) увеличивается
2) уменьшается
3) не изменяется
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
| Длина волны падающего
на атом фотона |
Приращение энергии атома в результате поглощения фотона |
На рисунке изображена упрощённая диаграмма нижних энергетических уровней атома. Нумерованными стрелками отмечены некоторые возможные переходы атома между этими уровнями. Какие из этих четырёх переходов связаны с излучением света с наибольшей длиной волны и поглощением света с наименьшей энергией?
Установите соответствие между процессами поглощения и излучения света и энергетическими переходами атома, указанными стрелками.
К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
ПРОЦЕССЫ
А) излучение света с наибольшей длиной волны
Б) поглощение света с наименьшей энергией
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Демонстрационная версия ЕГЭ—2023 по физике
Источник: Демонстрационная версия ЕГЭ—2014 по физике.
На рисунке изображена упрощённая диаграмма энергетических уровней атома. Нумерованными стрелками отмечены некоторые возможные переходы атома между этими уровнями. Какие из этих переходов связаны с поглощением света наименьшей длины волны и излучением кванта света с наибольшей энергией?
Установите соответствие между процессами поглощения и испускания света и стрелками, указывающими энергетические переходы атома.
К каждой позиции первого столбца подберите соответствующую позицию второго и запишите в таблицу выбранные цифры под соответствующими буквами.
ПРОЦЕСС
А) поглощение света наименьшей длины волны
Б) излучение кванта света с наибольшей энергией
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Атом водорода переходит из возбужденного состояния в основное. При этом испускается фотон, который уносит энергию. Установите соответствие между уносимой фотоном энергией и номером энергетического уровня, с которого осуществляется переход электрона. К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
ЭНЕРГИЯ, УНОСИМАЯ ФОТОНОМ
НОМЕР N УРОВНЯ, С КОТОРОГО
ОСУЩЕСТВЛЯЕТСЯ ПЕРЕХОД ЭЛЕКТРОНА
1) n = 2
2) n = 3
3) n = 4
4) n = 5
Атом водорода переходит из возбужденного состояния в основное. При этом испускается фотон, который уносит энергию. Установите соответствие между уносимой фотоном энергией и номером энергетического уровня, с которого осуществляется переход электрона. К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
ЭНЕРГИЯ, УНОСИМАЯ ФОТОНОМ
НОМЕР N УРОВНЯ, С КОТОРОГО
ОСУЩЕСТВЛЯЕТСЯ ПЕРЕХОД ЭЛЕКТРОНА
1) n = 2
2) n = 3
3) n = 4
4) n = 5
Задания Д32 C3 № 3059
На рисунке изображены несколько энергетических уровней атома и указаны длины волн фотонов, излучаемых и поглощаемых при переходах с одного уровня на другой.
Экспериментально установлено, что минимальная длина волны для фотонов, излучаемых при переходах между этими уровнями, равна Какова величина
если
?
На рисунке изображена упрощённая диаграмма энергетических уровней атома. Нумерованными стрелками отмечены некоторые возможные переходы атома между этими уровнями. Установите соответствие между процессами поглощения света наибольшей длины волны и испускания света наибольшей длины волны и стрелками, указывающими энергетические переходы атома. К каждой позиции первого столбца подберите соответствующую позицию второго и запишите в таблицу выбранные цифры под соответствующими буквами.
ПРОЦЕСС
А) поглощение света наибольшей длины волны
Б) излучение света наибольшей длины волны
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Демонстрационная версия ЕГЭ—2013 по физике.
Источник: ЕГЭ по физике 06.06.2013. Основная волна. Сибирь. Вариант 1.
Источник: ЕГЭ по физике 06.06.2013. Основная волна. Сибирь. Вариант 3.
Задания Д32 C3 № 4898
Источник: ЕГЭ по физике 06.06.2013. Основная волна. Сибирь. Вариант 5., ЕГЭ по физике 06.06.2013. Основная волна. Сибирь. Вариант 6.
Всего: 46 1–20 | 21–40 | 41–46
Оглавление:
- Основные теоретические сведения
- Основы специальной теории относительности
- Фотон и его свойства
- Внешний фотоэффект
- Постулаты Бора
- Атомное ядро
- Радиоактивность. Закон радиоактивного распада
- Ядерные реакции
Основные теоретические сведения
Основы специальной теории относительности
К оглавлению…
Специальная теория относительности (СТО) базируется на двух постулатах:
- Принцип относительности: в любых инерциальных системах отсчета все физические явления при одних и тех же исходных условиях протекают одинаково, т.е. никакими опытами, проведенными в замкнутой системе тел, нельзя обнаружить покоится ли тело или движется равномерно и прямолинейно.
- Принцип постоянства скорости света: во всех инерциальных системах отсчета скорость света в вакууме одинакова и не зависит от скорости движущегося источника света.
Равное с постулатами СТО имеет значение положение СТО о предельном характере скорости света в вакууме: скорость любого сигнала в природе не может превосходить скорость света в вакууме: c = 3∙108 м/с. При движении объектов со скоростью сопоставимой со скоростью света, наблюдаются различные эффекты, описанные далее.
1. Релятивистское сокращение длины.
Длина тела в системе отсчета, где оно покоится, называется собственной длиной L0. Тогда длина тела движущегося со скоростью V в инерциальной системе отсчета уменьшается в направлении движения до длины:
где: c – скорость света в вакууме, L0 – длина тела в неподвижной системе отсчета (длина покоящегося тела), L – длина тела в системе отсчета, движущейся со скоростью V (длина тела, движущегося со скоростью V). Таким образом, длина тела является относительной. Сокращение тел заметно, только при скоростях, сопоставимых со скоростью света.
2. Релятивистское удлинение времени события.
Длительность явления, происходящего в некоторой точке пространства, будет наименьшей в той инерциальной системе отсчета, относительно которой эта точка неподвижна. Это означает, что часы, движущиеся относительно инерциальной системы отсчета, идут медленнее неподвижных часов и показывают больший промежуток времени между событиями. Релятивистское замедление времени становится заметным лишь при скоростях сопоставимых со скоростью света, и выражается формулой:
Время τ0, замеренное по часам, покоящимся относительно тела, называется собственным временем события.
3. Релятивистский закон сложения скоростей.
Закон сложения скоростей в механике Ньютона противоречит постулатам СТО и заменяется новым релятивистским законом сложения скоростей. Если два тела движутся навстречу друг другу, то их скорость сближения выражается формулой:
где: V1 и V2 – скорости движения тел относительно неподвижной системы отсчета. Если же тела движутся в одном направлении, то их относительная скорость:
4. Релятивистское увеличение массы.
Масса движущегося тела m больше, чем масса покоя тела m0:
5. Связь энергии и массы тела.
С точки зрения теории относительности масса тела и энергия тела – это практически одно и то же. Таким образом, только факт существования тела означает, что у тела есть энергия. Наименьшей энергией Е0 тело обладает в инерциальной системе отсчета относительно которой оно покоится и называется собственной энергией тела (энергия покоя тела):
Любое изменение энергии тела означает изменение массы тела и наоборот:
где: ∆E – изменение энергии тела, ∆m – соответствующее изменение массы. Полная энергия тела:
где: m – масса тела. Полная энергия тела Е пропорциональна релятивистской массе и зависит от скорости движущегося тела, в этом смысле важны следующие соотношения:
Кстати кинетическую энергию тела, движущегося с релятивистской скоростью, можно считать только по формуле:
С точки зрения теории относительности закон сохранения масс покоя несправедлив. Например, масса покоя атомного ядра меньше суммы масс покоя частиц, входящих в ядро. Однако, масса покоя частицы способной к самопроизвольному распаду больше суммы собственных масс составляющих ее.
Это не означает нарушения закона сохранения массы. В теории относительности справедлив закон сохранения релятивистской массы, так как в изолированной системе тел сохраняется полная энергия, а значит и релятивистская масса, что следует из формулы Эйнштейна, таким образом можно говорить о едином законе сохранения массы и энергии. Это не означает возможность перехода массы в энергию и наоборот.
Между полной энергией тела, энергией покоя и импульсом существует зависимость:
Фотон и его свойства
К оглавлению…
Свет – это поток квантов электромагнитного излучения, называемых фотонами. Фотон – это частица, переносящая энергию света. Он не может находиться в покое, а всегда движется со скоростью, равной скорости света. Фотон обладает следующими характеристиками:
1. Энергия фотонов равна:
где: h = 6,63∙10–34 Дж∙с = 4,14∙10–15 эВ∙с – постоянная Планка, ν – частота света, λ – длина волны света, c – скорость света в вакууме. Энергия фотона в Джоулях очень мала, поэтому для математического удобства ее часто измеряют во внесистемной единице – электрон-вольтах:
1 эВ = 1,6∙10–19 Дж.
2. Фотон движется в вакууме со скоростью света c.
3. Фотон обладает импульсом:
4. Фотон не обладает массой в привычном для нас смысле (той массой, которую можно измерить на весах, рассчитать по второму закону Ньютона и так далее), но в соответствии с теорией относительности Эйнштейна, обладает массой как мерой энергии (E = mc2). Действительно, любое тело, имеющее некоторую энергию, имеет и массу. Если учесть, что фотон обладает энергией, то он обладает и массой, которую можно найти как:
5. Фотон не обладает электрическим зарядом.
Свет обладает двойственной природой. При распространении света проявляются его волновые свойства (интерференция, дифракция, поляризация), а при взаимодействии с веществом – корпускулярные (фотоэффект). Эта двойственная природа света получила название корпускулярно-волнового дуализма.
Внешний фотоэффект
К оглавлению…
Фотоэлектрический эффект – явление, заключающееся в появлении фототока в вакуумном баллоне при освещении катода монохроматическим светом некоторой длины волны λ.
Когда напряжение на аноде отрицательно, электрическое поле между катодом и анодом тормозит электроны. Измеряя данное задерживающее напряжение при котором исчезает фототок, можно определить максимальную кинетическую энергию фотоэлектронов вырываемых из катода:
Многочисленными экспериментаторами были установлены следующие основные закономерности фотоэффекта:
- Фотоэффект безынерционен. Это значит, что электроны начинают вылетать из металла сразу же после начала облучения светом.
- Максимальная кинетическая энергия фотоэлектронов линейно возрастает с увеличением частоты света ν и не зависит от его интенсивности.
- Для каждого вещества существует так называемая красная граница фотоэффекта, то есть наименьшая частота νmin (или наибольшая длина волны λmax) при которой еще возможен внешний фотоэффект.
- Число фотоэлектронов, вырываемых светом из катода за 1 с, прямо пропорционально интенсивности света.
При взаимодействии с веществом фотон целиком передает всю свою энергию E = hν одному электрону. Часть этой энергии электрон может рассеять при столкновениях с атомами вещества. Кроме того, часть энергии электрона затрачивается на преодоление потенциального барьера на границе металл–вакуум. Для этого электрон должен совершить работу выхода Aвых, зависящую от свойств материала катода. Наибольшая кинетическая энергия, которую может иметь вылетевший из катода фотоэлектрон, в таком случае, определяется законом сохранения энергии:
Эту формулу принято называть уравнением Эйнштейна для внешнего фотоэффекта. С помощью уравнения Эйнштейна можно объяснить все закономерности внешнего фотоэффекта. Для красной границы фотоэффекта, согласно формуле Эйнштейна, можно получить выражение:
Постулаты Бора
К оглавлению…
Первый постулат Бора (постулат стационарных состояний): атомная система может находится только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная номер n и энергия En. В стационарных состояниях атом не излучает и не поглощает энергию.
Состоянию с наименьшей энергией присваивается номер «1». Оно называется основным. Всем остальным состояниям присваиваются последовательные номера «2», «3» и так далее. Они называются возбужденными. В основном состоянии атом может находиться бесконечно долго. В возбужденном состоянии атом живет некоторое время (порядка 10 нс) и переходит в основное состояние.
Согласно первому постулату Бора, атом характеризуется системой энергетических уровней, каждый из которых соответствует определенному стационарному состоянию. Механическая энергия электрона, движущегося по замкнутой траектории вокруг положительно заряженного ядра, отрицательна. Поэтому всем стационарным состояниям соответствуют значения энергии En < 0. При En ≥ 0 электрон удаляется от ядра (происходит ионизация). Величина |E1| называется энергией ионизации. Состояние с энергией E1 называется основным состоянием атома.
Второй постулат Бора (правило частот): при переходе атома из одного стационарного состояния с энергией En в другое стационарное состояние с энергией Em излучается или поглощается квант, энергия которого равна разности энергий стационарных состояний:
Атом водорода
Простейший из атомов – атом водорода. Он содержит единственный электрон. Ядром атома является протон – положительно заряженная частица, заряд которой равен по модулю заряду электрона. Обычно электрон находится на первом (основном, невозбужденном) энергетическом уровне (электрон, как и любая другая система, стремится к состоянию с минимумом энергии). В этом состоянии его энергия равна E1 = –13,6 эВ. В атоме водорода выполняются следующие соотношения, связывающие радиус траектории вращающегося вокруг ядра электрона, его скорость и энергию на первой орбите с аналогичными характеристиками на остальных орбитах:
На любой орбите в атоме водорода кинетическая (К) и потенциальная (П) энергии электрона связаны с полной энергией (Е) следующими формулами:
Атомное ядро
К оглавлению…
В настоящее время твердо установлено, что атомные ядра различных элементов состоят из двух частиц – протонов и нейтронов, которые принято называть нуклонами. Для характеристики атомных ядер вводится ряд обозначений. Число протонов, входящих в состав атомного ядра, обозначают символом Z и называют зарядовым числом или атомным номером (это порядковый номер в периодической таблице Менделеева). Число нейтронов обозначают символом N. Общее число нуклонов (то есть протонов и нейтронов) называют массовым числом A, для которого можно записать следующую формулу:
Энергия связи. Дефект массы
Важнейшую роль в ядерной физике играет понятие энергии связи ядра. Энергия связи ядра равна минимальной энергии, которую необходимо затратить для полного расщепления ядра на отдельные частицы. Из закона сохранения энергии следует, что энергия связи равна той энергии, которая выделяется при образовании ядра из отдельных частиц.
Энергию связи любого ядра можно определить с помощью точного измерения его массы. Такие измерения показывают, что масса любого ядра Mя всегда меньше суммы масс входящих в его состав протонов и нейтронов: Mя < Zmp + Nmn. При этом разность этих масс называется дефектом масс, и вычисляется по формуле:
По дефекту массы можно определить с помощью формулы Эйнштейна E = mc2 энергию, выделившуюся при образовании данного ядра, то есть энергию связи ядра Eсв:
Но удобнее рассчитывать энергию связи по другой формуле (здесь массы берутся в атомных единицах, а энергия связи получается в МэВ):
Радиоактивность. Закон радиоактивного распада
К оглавлению…
Почти 90% из известных атомных ядер нестабильны. Нестабильное ядро самопроизвольно превращается в другие ядра с испусканием частиц. Это свойство ядер называется радиоактивностью.
Альфа-распад. Альфа-распадом называется самопроизвольное превращение атомного ядра с числом протонов Z и нейтронов N в другое (дочернее) ядро, содержащее число протонов Z – 2 и нейтронов N – 2. При этом испускается α-частица – ядро атома гелия 42He. Общая схема альфа-распада:
Бета-распад. При бета-распаде из ядра вылетает электрон (0–1e). Схема бета-распада:
Гамма-распад. В отличие от α— и β-радиоактивности γ-радиоактивность ядер не связана с изменением внутренней структуры ядра и не сопровождается изменением зарядового или массового чисел. Как при α-, так и при β-распаде дочернее ядро может оказаться в некотором возбужденном состоянии и иметь избыток энергии. Переход ядра из возбужденного состояния в основное сопровождается испусканием одного или нескольких γ-квантов, энергия которых может достигать нескольких МэВ.
Закон радиоактивного распада. В любом образце радиоактивного вещества содержится огромное число радиоактивных атомов. Так как радиоактивный распад имеет случайный характер и не зависит от внешних условий, то закон убывания количества N(t) нераспавшихся к данному моменту времени t ядер может служить важной статистической характеристикой процесса радиоактивного распада. Закон радиоактивного распада имеет вид:
Величина T называется периодом полураспада, N0 – начальное число радиоактивных ядер при t = 0. Период полураспада – основная величина, характеризующая скорость радиоактивного распада. Чем меньше период полураспада, тем интенсивнее протекает распад.
При α— и β-радиоактивном распаде дочернее ядро также может оказаться нестабильным. Поэтому возможны серии последовательных радиоактивных распадов, которые заканчиваются образованием стабильных ядер.
Ядерные реакции
К оглавлению…
Ядерная реакция – это процесс взаимодействия атомного ядра с другим ядром или элементарной частицей, сопровождающийся изменением состава и структуры ядра и выделением вторичных частиц или γ-квантов. В результате ядерных реакций могут образовываться новые радиоактивные изотопы, которых нет на Земле в естественных условиях.
При ядерных реакциях выполняется несколько законов сохранения: импульса, энергии, момента импульса, заряда. В дополнение к этим классическим законам сохранения при ядерных реакциях выполняется закон сохранения так называемого барионного заряда (то есть числа нуклонов – протонов и нейтронов). Например, в реакции общего вида:
Выполняются следующие условия (общее число нуклонов до и после реакции остается неизменным):
Энергетический выход ядерной реакции
Ядерные реакции сопровождаются энергетическими превращениями. Энергетическим выходом ядерной реакции называется величина:
где: MA и MB – массы исходных продуктов, MC и MD – массы конечных продуктов реакции. Величина ΔM называется дефектом масс. Ядерные реакции могут протекать с выделением (Q > 0) или с поглощением энергии (Q < 0). Во втором случае первоначальная кинетическая энергия исходных продуктов должна превышать величину |Q|, которая называется порогом реакции.
Для того чтобы ядерная реакция имела положительный энергетический выход, удельная энергия связи нуклонов в ядрах исходных продуктов должна быть меньше удельной энергии связи нуклонов в ядрах конечных продуктов. Это означает, что величина ΔM должна быть положительной.
Инфоурок
›
Физика
›Презентации›Подготовка к ЕГЭ «Квантовая физика»
Подготовка к ЕГЭ «Квантовая физика»
Скачать материал

Скачать материал


- Сейчас обучается 30 человек из 19 регионов


- Сейчас обучается 104 человека из 46 регионов


- Сейчас обучается 140 человек из 50 регионов


Описание презентации по отдельным слайдам:
-
1 слайд
Квантовая физика.
-
-
3 слайд
Интенсивность излучения с фиксированной частотой изменяется только за счет плотности фотонов, а от плотности фотонов зависит число их соударений с электронами. Вот почему сила фототока изменяется пропорционально интенсивности излучения (второй закон внешнего фотоэффекта).
-
-
5 слайд
Используя установку, изображенную на (рис. 8.6) можно получить вольтамперную характеристику фотоэффекта – зависимость фототокаI, который создается выбитыми под действием света из катода электронами, от напряжения, представленную
-
-
-
-
-
-
-
-
13 слайд
Фотон — материальная, электрически нейтральная частица, квант электромагнитного поля (переносчик электромагнитного взаимодействия).
-
14 слайд
Основные свойства фотона
Является частицей электромагнитного поля.
Движется со скоростью света.
Существует только в движении.
Остановить фотон нельзя: он либо движется со скоростью, равной скорости света, либо не существует; следовательно, масса покоя фотона равна нулю. -
-
16 слайд
k= 2π/λ
(h=6,6•1034 Дж•с). -
-
18 слайд
Первый постулат Бора (постулат стационарных состояний) гласит: атомная система может находится только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не излучает.
Этот постулат находится в явном противоречии с классической механикой, согласно которой энергия движущегося электрона может быть любой. Он находится в противоречии и с электродинамикой, так как допускает возможность ускоренного движения электронов без излучения электромагнитных волн. -
19 слайд
Согласно первому постулату Бора, атом характеризуется системой энергетических уровней, каждый из которых соответствует определенному стационарному состоянию (рис. 6.2.2). Механическая энергия электрона, движущегося по замкнутой траектории вокруг положительно заряженного ядра, отрицательна. Поэтому всем стационарным состояниям соответствуют значения энергии En < 0. При En ≥ 0 электрон удаляется от ядра, т. е. происходит ионизация. Величина |E1| называется энергией ионизации. Состояние с энергией E1 называется основным состоянием атома.
-
20 слайд
Энергетические уровни атома и условное изображение процессов поглощения и испускания фотонов
-
21 слайд
Теория Бора при описании поведения атомных систем не отвергла полностью законы классической физики. В ней сохранились представления об орбитальном движении электронов в кулоновском поле ядра. Классическая ядерная модель атома Резерфорда в теории Бора была дополнена идеей о квантовании электронных орбит. Поэтому теорию Бора иногда называют полуклассической.
-
-
23 слайд
Несмотря на несомненный успех концепции Бора применительно к атому водорода, для которого оказалось возможным построить количественную теорию спектра, создать подобную теорию для следующего за водородом атома гелия на основе представлений Бора не удалось.
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
46 слайд
Экспериментальные методы регистрации заряженных частиц
-
-
48 слайд
Радиоактивность
Явление самопроизвольного испускания химическими элементами излучения, обладающего значительной проникающей способностью и ионизирующими свойствами, получило название естественной радиоактивности. Элементы, испускающие такое излучение называются радиоактивными.
Радиоактивными являются все элементы с порядковым номером более 83 в таблице Менделеева.(Z >83). -
-
-
-
52 слайд
Энергия связи атомного ядра:
Eсв = Δmc2;
Δm = Zmp + Nmn – mя.
Закон радиоактивного распада: -
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
6 157 108 материалов в базе
- Выберите категорию:
- Выберите учебник и тему
- Выберите класс:
-
Тип материала:
-
Все материалы
-
Статьи
-
Научные работы
-
Видеоуроки
-
Презентации
-
Конспекты
-
Тесты
-
Рабочие программы
-
Другие методич. материалы
-
Найти материалы
Другие материалы

- 24.05.2018
- 2421
- 3


- 24.05.2018
- 460
- 1
- 24.05.2018
- 3580
- 41
Рейтинг:
4 из 5
- 24.05.2018
- 1468
- 6


Вам будут интересны эти курсы:
-
Курс повышения квалификации «Информационные технологии в деятельности учителя физики»
-
Курс профессиональной переподготовки «Маркетинг: теория и методика обучения в образовательной организации»
-
Курс повышения квалификации «Методика написания учебной и научно-исследовательской работы в школе (доклад, реферат, эссе, статья) в процессе реализации метапредметных задач ФГОС ОО»
-
Курс повышения квалификации «Основы управления проектами в условиях реализации ФГОС»
-
Курс профессиональной переподготовки «Экскурсоведение: основы организации экскурсионной деятельности»
-
Курс повышения квалификации «Введение в сетевые технологии»
-
Курс повышения квалификации «Организация практики студентов в соответствии с требованиями ФГОС педагогических направлений подготовки»
-
Курс повышения квалификации «Экономика: инструменты контроллинга»
-
Курс повышения квалификации «Финансы: управление структурой капитала»
-
Курс повышения квалификации «ЕГЭ по физике: методика решения задач»
-
Курс повышения квалификации «Методы и инструменты современного моделирования»
-
Курс профессиональной переподготовки «Организация деятельности секретаря руководителя со знанием английского языка»
-
Курс профессиональной переподготовки «Организация технической поддержки клиентов при установке и эксплуатации информационно-коммуникационных систем»
-
Курс профессиональной переподготовки «Стратегическое управление деятельностью по дистанционному информационно-справочному обслуживанию»
-
Скачать материал
-
24.05.2018
2381
-
PPTX
2.1 мбайт -
86
скачиваний -
Рейтинг:
5 из 5 -
Оцените материал:
-
-
Настоящий материал опубликован пользователем Голованова Оксана Сергеевна. Инфоурок является
информационным посредником и предоставляет пользователям возможность размещать на сайте
методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них
сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайтЕсли Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с
сайта, Вы можете оставить жалобу на материал.Удалить материал
-
- На сайте: 5 лет и 5 месяцев
- Подписчики: 2
- Всего просмотров: 57444
-
Всего материалов:
46