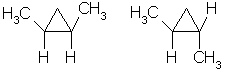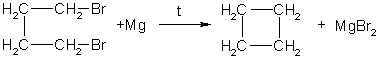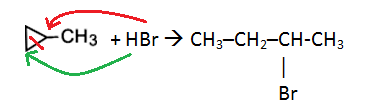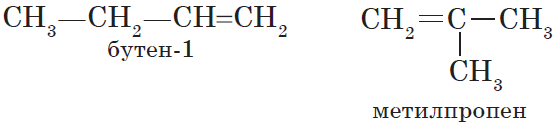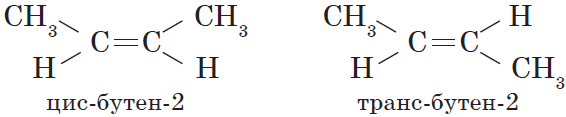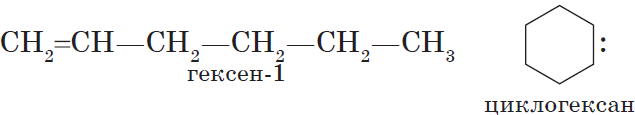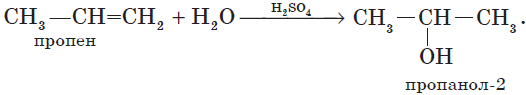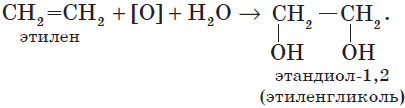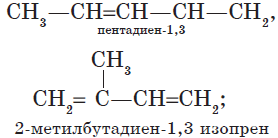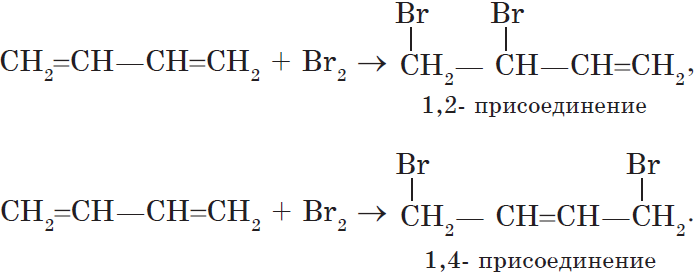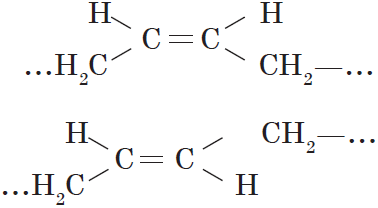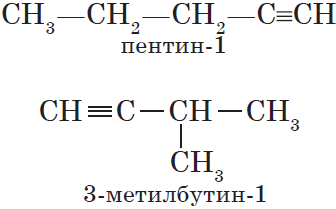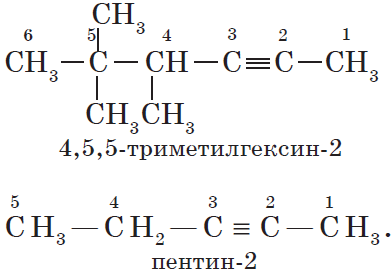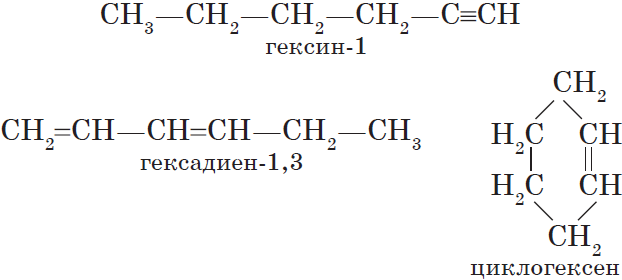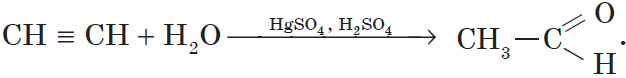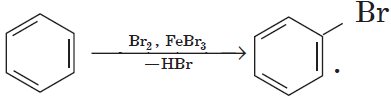Циклоалканы (циклопарафины, нафтены) — циклические насыщенные углеводороды, по химическому строению близкие к алканам. Содержат только
простые одинарные сигма связи (σ-связи), не содержат ароматических связей.
Циклоалканы имеют большую плотность и более высокие температуры плавления, кипения, чем соответствующие алканы. Общая формула их
гомологического ряда — CnH2n.
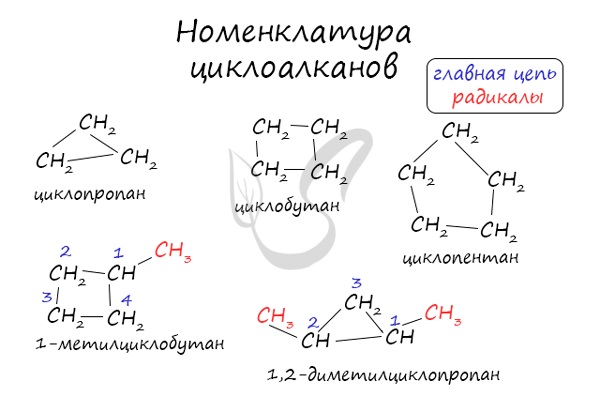
Номенклатура и изомерия циклоалканов
Названия циклоалканов формируются путем добавления приставки «цикло-» к названию алкана с соответствующим числом:
циклопропан, циклобутан и т.д.
Как и у алканов, атомы углерода циклоалканов находятся в sp3 гибридизации.
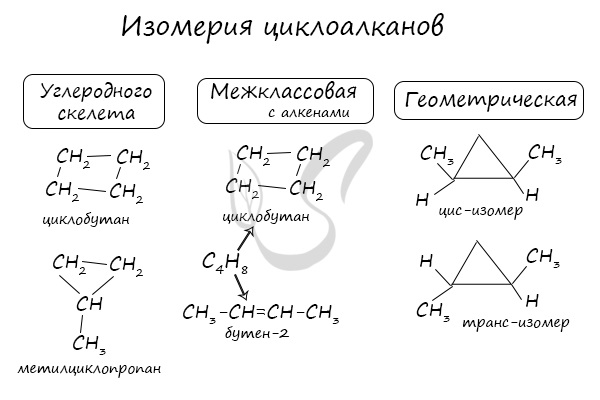
Помимо изомерии углеродного скелета, для циклоалканов характерна межклассовая изомерия с алкенами и пространственная геометрическая изомерия в виде
существования цис- и транс-изомеров.
Получение циклоалканов
В промышленности циклоалканы получают несколькими способами:
- Из ароматических углеводородов
- Циклизация алканов
Циклоалканы можно получить гидрированием (присоединением водорода) бензола и его гомологов.

При наличии катализатора и повышенной температуры алканы способны образовывать цикл, отщепляя при этом водород.
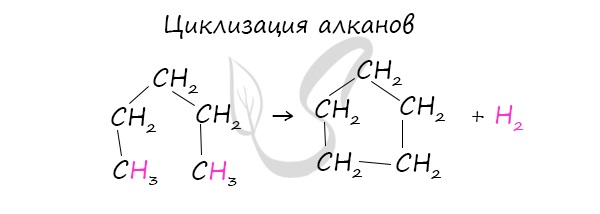
В лабораторных условиях циклоалканы можно получить реакцией дегалогенирования дигалогеналканов.
- Дегалогенирование дигалогеналканов (внутримолекулярная реакция Вюрца)

Химические свойства циклоалканов
Важно заметить, что циклопропан и циклобутан вступают в реакции присоединения, проявляя свойства ненасыщенных соединений. Для циклопентана и циклогексана
реакции присоединения не характерны, они преимущественно вступают в реакции замещения.
- Гидрирование
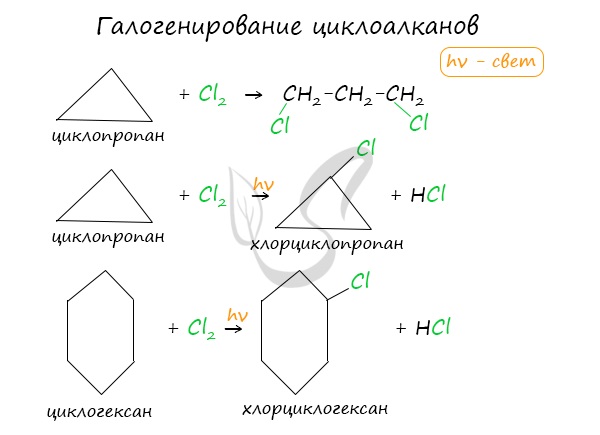
- Галогенирование
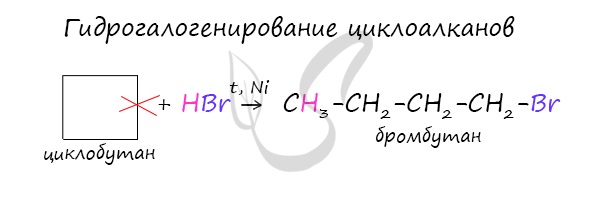
- Гидрогалогенирование
- Дегидрирование
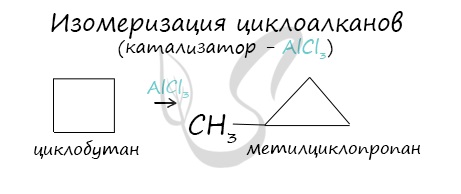
- Изомеризация
Наиболее легко в реакции гидрирования вступают циклопропан и циклобутан. Циклопентан и циклогексан не вступают в реакции гидрирования (в рамках вопросов ЕГЭ — не вступают, но на самом деле эти реакции идут, просто крайне затруднены).

Без освещения реакция циклопропана и циклобутана с хлором идет по типу присоединения. При освещении хлор образует свободные радикалы, реакция
идет, как и у алканов, по механизму замещения.
У циклопентана и циклогексана реакция идет только путем замещения.
В реакции гидрогалогенирования, протекающие по типу присоединения, вступают циклопропан и циклобутан.
При отщеплении водорода от циклогексана образуется бензол, при наличии радикалов — гомологи бензола.

В ходе нагревания с катализатором — AlCl3 циклоалканы образуют изомеры.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Циклоалканы – это предельные (насыщенные) углеводороды, которые содержат замкнутый углеродный цикл.
Общая формула циклоалканов CnH2n, где n≥3.
Строение, номенклатура и изомерия циклоалканов
Химические свойства циклоалканов
Получение циклоалканов
Строение циклоалканов
Атомы углерода в молекулах циклоалканов находятся в состоянии sp3-гибридизации и образует четыре σ-связи С–С и С–Н. В зависимости от размеров цикла меняются валентные углы.
В малых циклах (циклопропан и циклобутан) валентные углы между связями С–С сильно отличаются от валентных углов между связями С–С в алканах (109о35′). Поэтому в малых циклах возникает напряжение, которое приводит к высокой реакционной способности таких циклоалканов.
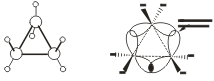
Самый простой циклоалкан — циклопропан, представляет, по сути, плоский треугольник.
σ-Связи в циклопропане называют «банановыми». Они не лежат вдоль оси, соединяющей ядра атомов, а отклоняются от неё, уменьшая напряжение в молекуле циклопропана.
По свойствам «банановые» связи напоминают π-связи. Они легко разрываются.
Поэтому циклопропан очень легко вступает в реакции присоединения с разрывом углеродного цикла.
Остальные циклоалканы имеют неплоское строение. Молекула циклобутана имеет перегиб по линии, соединяющей первый и третий атомы углерода в кольце:
Циклобутан также вступает в реакции присоединения, но угловое напряжение в циклобутане меньше, чем в циклопропане, поэтому реакции присоединения к циклобутану протекают сложнее.
Большие циклы имеют более сложное, неплоское строение, вследствие чего угловое напряжение в молекулах больших циклоалканов почти отсутствует.
Циклоалканы с большим циклом не вступают в реакции присоединения. Для них характерны реакции замещения.
Строение циклопентана также неплоское, молекула представляет собой так называемый «конверт».
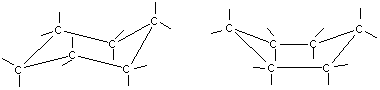
Молекула циклогексана не является плоским многоугольником и принимает различные конформации, имеющие названия «кресло» и «ванна»:
«кресло» «ванна»
Изомерия циклоалканов
Структурная изомерия
Для циклоалканов характерна структурная изомерия, связанная с разным числом углеродных атомов в кольце, разным числом углеродных атомов в заместителях и с положением заместителей в цикле.
- Изомеры с разным числом атомов углерода в цикле отличаются размерами углеродного цикла.
Изомеры с разным числом углеродных атомов в цикле – это этилциклопропан и метилциклобутан с общей формулой С5Н10
- Изомеры с разным числом атомов углерода в заместителях отличаются строением заместителей у одинакового углеродного цикла.
Структурные изомеры с различным числом углеродных атомов в заместителях – 1-метил-2-пропилциклопентан и 1,2-диэтилциклопентан
- Изомеры с разным положением одинаковых заместителей в углеродном цикле.
- Межклассовая изомерия: циклоалканы изомерны алкенам.
Формуле С3Н6 соответствуют циклопропан и пропен.
Геометрическая (цис-транс-) изомерия
У циклоалканов с двумя заместителями, расположенными у соседних атомов углерода в цикле цис-транс-изомерия обусловлена различным взаимным расположением в пространстве заместителей относительно плоскости цикла.
В цис-изомерах заместители находятся по одну сторону от плоскости цикла, в транс-изомерах – заместители расположены по разные стороны.
В молекуле 1,2-диметилциклопропана две группы СН3 могут находиться по одну сторону от плоскости цикла (цис-изомер) или по разные стороны (транс-изомер):
Для 1,1-диметилциклопропана цис-транс-изомерия не характерна.
Номенклатура циклоалканов
В названиях циклоалканов используется префикс -ЦИКЛО.
Название циклоалканов строится по следующим правилам:
1. Цикл принимают за главную углеродную цепь. При этом считают, что углеводородные радикалы, которые не входят в главной цепь, являются в ней заместителями.
2. Нумеруют атомы углерода в цикле так, чтобы атомы углерода, которые соединены с заместителями, получили минимальные возможные номера. Причем нумерацию следует начинать с более близкого к старшей группе конца цепи.
3. Называют все радикалы, указывая впереди цифры, которые обозначают их расположение в главной цепи.
Для одинаковых заместителей эти цифры указывают через запятую, при этом количество одинаковых заместителей обозначается приставками ди- (два), три- (три), тетра- (четыре), пента- (пять) и т.д.
Например, 1,1-диметилциклопропан или 1,1,3-триметилциклопентан.
4. Названия заместителей со всеми приставками и цифрами располагают в алфавитном порядке.
Например: 1,1-диметил-3-этилциклопентан.
5. Называют углеродный цикл.
Химические свойства циклоалканов
Циклоалканы с малым циклом (циклопропан, циклобутан и их замещенные гомологи) из-за большой напряженности в кольце могут вступать в реакции присоединения.
1. Реакции присоединения к циклоалканам
Чем меньше цикл и чем больше угловое напряжение в цикле, тем легче протекают реакции присоединения. Способность вступать в реакции присоединения уменьшается в ряду: циклопропан > циклобутан > циклопентан.
1.1. Гидрирование циклоалканов
С водородом могут реагировать малые циклы, а также (в жестких условиях) циклопентан. При этом происходит разрыв кольца и образование алкана.
Циклопропан и циклобутан довольно легко присоединяют водород при нагревании в присутствии катализатора:
Циклопентан присоединяет водород в жестких условиях:
Бромирование протекает более медленно и избирательно.
Циклогексан и циклоалканы с большим число атомов углерода в цикле с водородом не реагируют.
1.2. Галогенирование циклоалканов
Циклопропан и циклобутан реагируют с галогенами, при этом тоже происходит присоединение галогенов к молекуле, сопровождающееся разрывом кольца.
Например. Циклопропан присоединяет бром с образованием 1,3-дибромпропана:
1.3. Гидрогалогенирование
Циклопропан и его гомологи с алкильными заместителями у трехчленного цикла вступают с галогеноводородами в реакции присоединения с разрывом цикла.
Например, циклопропан присоединяет йодоводород.
Присоединение галогеноводородов к гомологам циклопропана с заместителями у трехатомного цикла (метилциклопропан и др.) происходит по правилу Марковникова.
Например, при присоединении бромоводорода к метилциклопропану преимущественно образуется 2-бромбутан
2. Реакции замещения
Поэтому большие циклы гораздо более устойчивы, чем малые, и реакции присоединения с разрывом связей С-С для них не характерны. В химических реакциях они ведут себя подобно алканам, вступая в реакции замещения без разрыва кольца.
2.1. Галогенирование
Галогенирование циклопентана, циклогексана и циклоалканов с большим количеством атомов углерода в цикле протекает по механизму радикального замещения.
Например, при хлорировании циклопентана на свету или при нагревании образуется хлорциклопентан
При хлорировании метилциклопентана замещение преимущественно протекает у третичного атома углерода:
2.2. Нитрование циклоалканов
При взаимодействии циклоалканов с разбавленной азотной кислотой при нагревании образуются нитроциклоалканы.
Например, нитрование циклопентана.
2.3. Дегидрирование
При нагревании циклоалканов в присутствии катализаторов протекает дегидрирование – отщепление водорода.
Циклогексан и его производные дегидрируются при нагревании и под действием катализатора до бензола и его производных.
Например, бензол образуется при дегидрировании циклогексана.
Например, при отщеплении водорода от метилциклогексана образуется толуол.
3. Окисление циклоалканов
3.1. Горение
Как и все углеводороды, алканы горят до углекислого газа и воды. Уравнение сгорания циклоалканов в общем виде:
CnH2n + 3n/2O2 → nCO2 + nH2O + Q
Например, горение циклопентана.
2C5H10 + 15O2 → 10CO2 + 10H2O + Q
3.2. Окисление
При окислении циклогексана азотной кислотой или в присутствии катализатора образуется адипиновая (гександиовая) кислота:
Получение циклоалканов
1. Дегидрирование алканов
Алканы с длинным углеродным скелетом, содержащие 5 и более атомов углерода в главной цепи, при нагревании в присутствии металлических катализаторов образуют циклические соединения.
При этом протекает дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла.
Пентан и его гомологи, содержащие пять атомов углерода в главной цепи, при нагревании над платиновым катализатором образуют циклопентан и его гомологи:
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
Дегидроциклизация алканов — важный промышленный способ получения циклоалканов.
2. Гидрирование бензола и его гомологов
При гидрировании бензола при нагревании и в присутствии катализатора образуется циклогексан:
При гидрировании толуола образуется метилциклогексан:
Этим способом можно получить только циклогексан и его гомологи с шестичленным кольцом.
3. Дегалогенирование дигалогеналканов
При действии активных металлов на дигалогеналканы, в которых между атомами галогенов находится три и более атомов углерода.
Например, 1,4-дибромбутан реагирует с цинком с образованием циклобутана
Таким образом можно синтезировать циклоалканы заданного строения, в том числе циклоалканы с малыми циклами (С3 и С4).
Циклоалканы — предельные циклические углеводороды.
Общая формула гомологического ряда CnH2n.
|
|
|
|
|
|
Циклопропан |
Циклобутан |
Циклопентан |
Циклогексан |
|
Малые циклы |
Большие циклы |
Строение циклоалканов.
Каждый атом углерода в циклоалканах находится в состоянии sp3-гибридизации и образует четыре σ-связи С-С и С-Н.
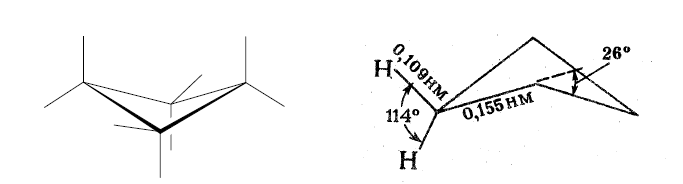
Углы между связями зависят от размера цикла. В малых циклах С3 и С4 углы между связями С-С сильно отличаются от тетраэдрического угла 109,5°, что создает в молекулах напряжение и обеспечивает их высокую реакционную способность.
σ-связи в циклопропане называют «банановыми». По свойствам они напоминают ПИ-связи. Поэтому молекулу циклопропана очень легко разорвать и поэтому он способен вступать в реакции присоединения (с разрывом цикла).
Циклобутан в пространстве имеет перегиб по линии, соединяющей 1 и 3 атом С в кольце:
Циклопентан имеет форму, которую называют «конверт»:
Большие циклы очень устойчивы и не склонны к разрыву. Так, молекула циклогексана не является плоским многоугольником и принимает различные конформации, имеющие названия «кресло» и «ванна»:
а — кресло б — ванна.
И в конформации кресла, и в конформации ванны связи вокруг каждого атома углерода имеют тетраэдрическое расположение. Отсюда — несравнимо большая устойчивость обычных циклов по сравнению с малыми циклами, отсюда — их возможность вступать в реакции замещения, но не присоединения.
Изомерия:
1. Структурная изомерия, связанная:
a) с числом углеродных атомов в кольце:
 (этилциклопропан),
(этилциклопропан),  (метилциклобутан);
(метилциклобутан);
b) с числом углеродных атомов в заместителях:
 (1-метил-2-пропилциклопентан),
(1-метил-2-пропилциклопентан),  (1,2-диэтилциклопентан)
(1,2-диэтилциклопентан)
c) с положением заместителя в кольце:
 (1,1-диметилциклогексан),
(1,1-диметилциклогексан),  (1,2-диметилциклогексан)
(1,2-диметилциклогексан)
2. Межклассовая изомерия: циклоалканы изомерны алкенам.
3. Геометрическая цис-транс-изомерия:
Например, в молекуле 1,2-диметилциклопропана две группы СН3 могут находиться по одну сторону от плоскости цикла (цис-изомер) или по разные стороны (транс-изомер):
цис-изомер транс-изомер
Получение.
1. Отщепление двух атомов галогена от дигалогеналканов:
2. При каталитическом гидрировании ароматических углеводородов образуются циклогексан или его производные: C6H6 + 3H2 -t°,р,Ni→ C6H12.
Химические свойства.
1. Малые циклы (циклопропан и циклобутан) из-за большой напряженности кольца (малые углы) легко разрываются, вступая в реакции присоединения.
1) Гидрирование. При каталитическом гидрировании трех-, четырех- и даже пятичленные циклы разрываются с образованием алканов.
(циклопропан) + H2 —120ºC,Ni🡪 CH3–CH2–CH3
(циклопентан)+ H2—300ºC,Pd🡪CH3–CH2–CH2–CH2–CH3
Пятичленный цикл разрывается только при высоких температурах.
2) Галогенирование. Циклопропан и циклобутан разрываются, присоединяя атомы галогена.
+ Br2 🡪 BrCH2–CH2–CH2Br (1,3- дибромпропан)
3)Гидрогалогенирование. Циклопропан и замещенные циклопропаны взаимодействуют с галогеноводородами с разрывом цикла.
В случае замещенных циклопропанов реакция идёт в соответствии с правилом Марковникова.
Другие циклоалканы с галогеноводородами не реагируют.
2. Большие циклы – циклопентан и циклогексан – гораздо более устойчивы, цикл в них не разрывается. Они ведут себя подобно алканам, вступая в реакции замещения: галогенирование на свету, нитрование.
1) Галогенирование: циклопентан и циклопентан реагируют с галогенами на свету, вступая в реакцию замещения.
+ Cl2-(свет)🡪
(хлорциклопентан) + HCl
2) Нитрование.
Циклопентан + HNO3 –(t,p)🡪 нитроциклопентан + вода.
3. Дегидрирование. Производные циклогексана дегидрируются в производные бензола:
|
|
––300°C,Pd🡪 |
|
+ 3H2 |
4. Горение. Как и любые органические вещества, циклоалканы горят с образованием углекислого газа и воды.
Подготовка к егэ по химии циклоалканы
Циклоалканы
Циклоалканы (циклопарафины, нафтены) — циклические насыщенные углеводороды, по химическому строению близкие к алканам. Содержат только простые одинарные сигма связи (σ-связи), не содержат ароматических связей.
Циклоалканы имеют большую плотность и более высокие температуры плавления, кипения, чем соответствующие алканы. Общая формула их гомологического ряда — CnH2n.
Номенклатура и изомерия циклоалканов
Названия циклоалканов формируются путем добавления приставки «цикло-» к названию алкана с соответствующим числом: циклопропан, циклобутан и т. д.
Как и у алканов, атомы углерода циклоалканов находятся в sp 3 гибридизации.
Помимо изомерии углеродного скелета, для циклоалканов характерна межклассовая изомерия с алкенами и пространственная геометрическая изомерия в виде существования цис — и транс-изомеров.
Получение циклоалканов
- Из ароматических углеводородов
Циклоалканы можно получить гидрированием (присоединением водорода) бензола и его гомологов.
При наличии катализатора и повышенной температуры алканы способны образовывать цикл, отщепляя при этом водород.
- Дегалогенирование дигалогеналканов (внутримолекулярная реакция Вюрца)
Химические свойства циклоалканов
Важно заметить, что циклопропан и циклобутан вступают в реакции присоединения, проявляя свойства ненасыщенных соединений. Для циклопентана и циклогексана реакции присоединения не характерны, они преимущественно вступают в реакции замещения.
Наиболее легко в реакции гидрирования вступают циклопропан и циклобутан. Циклопентан и циклогексан не вступают в реакции гидрирования (в рамках вопросов ЕГЭ — не вступают, но на самом деле эти реакции идут, просто крайне затруднены).
Без освещения реакция циклопропана и циклобутана с хлором идет по типу присоединения. При освещении хлор образует свободные радикалы, реакция идет, как и у алканов, по механизму замещения.
У циклопентана и циклогексана реакция идет только путем замещения.
В реакции гидрогалогенирования, протекающие по типу присоединения, вступают циклопропан и циклобутан.
При отщеплении водорода от циклогексана образуется бензол, при наличии радикалов — гомологи бензола.
В ходе нагревания с катализатором — AlCl3 циклоалканы образуют изомеры.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
- Из ароматических углеводородов
- Дегалогенирование дигалогеналканов (внутримолекулярная реакция Вюрца)
В реакции гидрогалогенирования, протекающие по типу присоединения, вступают циклопропан и циклобутан.
Studarium. ru
10.11.2020 8:32:30
2020-11-10 08:32:30
Источники:
Http://studarium. ru/article/182
Подготовка к ЕГЭ по химии. ЦИКЛОАЛКАНЫ. » /> » /> .keyword { color: red; } Подготовка к егэ по химии циклоалканы
Подготовка к ЕГЭ по химии. ЦИКЛОАЛКАНЫ
Подготовка к ЕГЭ по химии. ЦИКЛОАЛКАНЫ
Циклоалканы — предельные циклические углеводороды. Общая формула гомологического ряда CnH2n. Строение циклоалканов. Каждый атом углерода в циклоалканах находится в состоянии sp3-гибридизации и образует четыре σ-связи С-С и С-Н. Углы между связями зависят от размера цикла. В малых циклах С3 и С4 углы между связями С-С сильно отличаются от тетраэдрического угла 109,5°, что создает в молекулах напряжение и обеспечивает их высокую реакционную способность. σ-связи в циклопропане называют «банановыми».По свойствам они напоминают ПИ-связи. Поэтому молекулу циклопропана очень легко разорвать и.
| Раздел | Химия |
| Класс | — |
| Тип | Конспекты |
| Автор | Кисакова О. А. |
| Дата | 26.11.2014 |
| Формат | Docx |
| Изображения | Есть |
Циклоалканы — предельные циклические углеводороды.
Общая формула гомологического ряда CNH2n.
Малые циклы
Большие циклы
Каждый атом углерода в циклоалканах находится в состоянии sp 3 — гибридизации и образует четыре σ-связи С-С и С-Н.
Углы между связями зависят от размера цикла. В малых циклах С3 и С4 углы между связями С-С сильно отличаются от тетраэдрического угла 109,5°, что создает в молекулах напряжение и обеспечивает их высокую реакционную способность.
Σ-связи в циклопропане называют «банановыми». По свойствам они напоминают ПИ-связи. Поэтому молекулу циклопропана очень легко разорвать и поэтому он способен вступать в реакции присоединения (с разрывом цикла).
Циклобутан в пространстве имеет перегиб по линии, соединяющей 1 и 3 атом С в кольце:
Циклопентан имеет форму, которую называют «конверт»:
Большие циклы очень устойчивы и не склонны к разрыву. Так, молекула циклогексана не является плоским многоугольником и принимает различные конформации, имеющие названия «кресло» и «ванна»:
А — кресло б — ванна.
И в конформации кресла, и в конформации ванны связи вокруг каждого атома углерода имеют тетраэдрическое расположение. Отсюда — несравнимо большая устойчивость обычных циклов по сравнению с малыми циклами, отсюда — их возможность вступать в реакции замещения, но не присоединения.
Изомерия:
1. Структурная изомерия, связанная:
A) с числом углеродных атомов в кольце:
 (этилциклопропан),
(этилциклопропан),  (метилциклобутан);
(метилциклобутан);
B) с числом углеродных атомов в заместителях:
(1-метил-2-пропилциклопентан),  (1,2-диэтилциклопентан)
(1,2-диэтилциклопентан)
C) с положением заместителя в кольце:
 (1,1-диметилциклогексан),
(1,1-диметилциклогексан),  (1,2-диметилциклогексан)
(1,2-диметилциклогексан)
2. Межклассовая изомерия: циклоалканы изомерны Алкенам.
3. Геометрическая цис-транс-изомерия:
Например, в молекуле 1,2-диметилциклопропана две группы СН3 могут находиться по одну сторону от плоскости цикла (цис-изомер) или по разные стороны (транс-изомер):
1. Отщепление двух атомов галогена от дигалогеналканов:
2. При Каталитическом гидрировании ароматических углеводородов образуются циклогексан или его производные: C6H6 + 3H2 — t°,р, Ni→ C6H12.
Химические свойства.
1. Малые циклы (циклопропан и циклобутан) из-за большой напряженности кольца (малые углы) легко разрываются, вступая в реакции присоединения.
1) Гидрирование. При каталитическом гидрировании трех-, четырех — и даже пятичленные циклы разрываются с образованием алканов.
(циклопропан) + H2 — 120ºC, Ni CH3-CH2-CH3
(циклопентан)+ H2- 300ºC, Pd CH3-CH2-CH2-CH2-CH3
Пятичленный цикл разрывается только при высоких температурах.
2) Галогенирование. Циклопропан и циклобутан разрываются, присоединяя атомы галогена.
+ Br2 BrCH2-CH2-CH2Br (1,3- дибромпропан)
3)Гидрогалогенирование. Циклопропан и замещенные циклопропаны взаимодействуют с галогеноводородами с разрывом цикла.
В случае замещенных циклопропанов реакция идёт в соответствии с правилом Марковникова.
Другие циклоалканы с галогеноводородами не реагируют.
2. Большие циклы — циклопентан и циклогексан — гораздо более устойчивы, цикл в них не разрывается. Они ведут себя подобно алканам, вступая в реакции замещения: галогенирование на свету, нитрование.
1) Галогенирование: циклопентан и циклопентан реагируют с галогенами на свету, вступая в реакцию замещения.
+ Cl2-(свет) (хлорциклопентан) + HCl
2) Нитрование.
Циклопентан + HNO3 -(t, p) нитроциклопентан + вода.
3. Дегидрирование. Производные циклогексана дегидрируются в производные бензола:
4. Горение. Как и любые органические вещества, циклоалканы горят с образованием углекислого газа и воды.
(циклопропан) + H2 — 120ºC, Ni CH3-CH2-CH3
Изомерия:
2. Межклассовая изомерия: циклоалканы изомерны Алкенам.
3. Геометрическая цис-транс-изомерия:
Например, в молекуле 1,2-диметилциклопропана две группы СН3 могут находиться по одну сторону от плоскости цикла (цис-изомер) или по разные стороны (транс-изомер):
1. Отщепление двух атомов галогена от дигалогеналканов:
2. При Каталитическом гидрировании ароматических углеводородов образуются циклогексан или его производные: C6H6 + 3H2 — t°,р, Ni→ C6H12.
Химические свойства.
1. Малые циклы (циклопропан и циклобутан) из-за большой напряженности кольца (малые углы) легко разрываются, вступая в реакции присоединения.
1) Гидрирование. При каталитическом гидрировании трех-, четырех — и даже пятичленные циклы разрываются с образованием алканов.
(циклопропан) + H2 — 120ºC, Ni CH3-CH2-CH3
(циклопентан)+ H2- 300ºC, Pd CH3-CH2-CH2-CH2-CH3
Пятичленный цикл разрывается только при высоких температурах.
2) Галогенирование. Циклопропан и циклобутан разрываются, присоединяя атомы галогена.
+ Br2 BrCH2-CH2-CH2Br (1,3- дибромпропан)
3)Гидрогалогенирование. Циклопропан и замещенные циклопропаны взаимодействуют с галогеноводородами с разрывом цикла.
В случае замещенных циклопропанов реакция идёт в соответствии с правилом Марковникова.
Другие циклоалканы с галогеноводородами не реагируют.
2. Большие циклы — циклопентан и циклогексан — гораздо более устойчивы, цикл в них не разрывается. Они ведут себя подобно алканам, вступая в реакции замещения: галогенирование на свету, нитрование.
1) Галогенирование: циклопентан и циклопентан реагируют с галогенами на свету, вступая в реакцию замещения.
+ Cl2-(свет) (хлорциклопентан) + HCl
2) Нитрование.
Циклопентан + HNO3 -(t, p) нитроциклопентан + вода.
3. Дегидрирование. Производные циклогексана дегидрируются в производные бензола:
4. Горение. Как и любые органические вещества, циклоалканы горят с образованием углекислого газа и воды.
σ-связи в циклопропане называют «банановыми». По свойствам они напоминают ПИ-связи. Поэтому молекулу циклопропана очень легко разорвать и поэтому он способен вступать в реакции присоединения (с разрывом цикла).
(1-метил-2-пропилциклопентан), (1,2-диэтилциклопентан)
Каждый атом углерода в циклоалканах находится в состоянии sp 3 — гибридизации и образует четыре σ-связи С-С и С-Н.
For-teacher. ru
09.02.2018 12:27:03
2018-02-09 12:27:03
Источники:
Http://for-teacher. ru/edu/himiya/doc-ni5ji2s. html
Подготовка к ЕГЭ по химии. Циклоалканы. | Материал для подготовки к ЕГЭ (ГИА) по химии: | Образовательная социальная сеть » /> » /> .keyword { color: red; } Подготовка к егэ по химии циклоалканы
Подготовка к ЕГЭ по химии. иал для подготовки к егэ (гиа) по химии
Подготовка к ЕГЭ по химии. Циклоалканы.
Материал для подготовки к егэ (гиа) по химии
Каждый атом углерода в циклоалканах находится в состоянии sp 3 — гибридизации и образует четыре σ-связи С-С и С-Н.
Углы между связями зависят от размера цикла. В малых циклах С 3 и С 4 углы между связями С-С сильно отличаются от тетраэдрического угла 109,5°, что создает в молекулах напряжение и обеспечивает их высокую реакционную способность.
Σ-связи в циклопропане называют «банановыми». По свойствам они напоминают ПИ-связи. Поэтому молекулу циклопропана очень легко разорвать и поэтому он способен вступать в реакции присоединения (с разрывом цикла).
Циклобутан в пространстве имеет перегиб по линии, соединяющей 1 и 3 атом С в кольце:
Циклопентан имеет форму, которую называют «конверт»:
Большие циклы очень устойчивы и не склонны к разрыву. Так, молекула циклогексана не является плоским многоугольником и принимает различные конформации, имеющие названия «кресло» и «ванна»:
А — кресло б — ванна.
И в конформации кресла, и в конформации ванны связи вокруг каждого атома углерода имеют тетраэдрическое расположение. Отсюда — несравнимо большая устойчивость обычных циклов по сравнению с малыми циклами, отсюда — их возможность вступать в реакции замещения, но не присоединения.
Изомерия:
1 . Структурная изомерия, связанная:
A) с числом углеродных атомов в кольце:
(этилциклопропан), (метилциклобутан);
B) с числом углеродных атомов в заместителях:
(1-метил-2-пропилциклопентан), (1,2-диэтилциклопентан)
C) с положением заместителя в кольце:
(1,1-диметилциклогексан), (1,2-диметилциклогексан)
2. Межклассовая изомерия: циклоалканы изомерны алкенам.
3. Геометрическая цис-транс-изомерия:
Например, в молекуле 1,2-диметилциклопропана две группы СН 3 могут находиться по одну сторону от плоскости цикла (цис-изомер) или по разные стороны (транс-изомер):
1. Отщепление двух атомов галогена от дигалогеналканов:
2. При каталитическом гидрировании ароматических углеводородов образуются циклогексан или его производные: C 6 H 6 + 3H 2 — t°,р, Ni→ C 6 H 12 .
1. Малые циклы (циклопропан и циклобутан) из-за большой напряженности кольца (малые углы) легко разрываются, вступая в реакции присоединения.
1) Гидрирование. При каталитическом гидрировании трех-, четырех — и даже пятичленные циклы разрываются с образованием алканов.
(циклопропан) + H 2 — 120ºC, Ni 🡪 CH 3 –CH 2 –CH 3
(циклопентан)+ H 2 — 300ºC, Pd 🡪CH 3 –CH 2 –CH 2 –CH 2 –CH 3
Пятичленный цикл разрывается только при высоких температурах.
2) Галогенирование. Циклопропан и циклобутан разрываются, присоединяя атомы галогена.
+ Br 2 🡪 BrCH 2 –CH 2 –CH 2 Br (1,3- дибромпропан)
3) Гидрогалогенирование. Циклопропан и замещенные циклопропаны взаимодействуют с галогеноводородами с разрывом цикла.
В случае замещенных циклопропанов реакция идёт в соответствии с правилом Марковникова.
Другие циклоалканы с галогеноводородами не реагируют.
2. Большие циклы – циклопентан и циклогексан – гораздо более устойчивы, цикл в них не разрывается. Они ведут себя подобно алканам, вступая в реакции замещения: галогенирование на свету, нитрование.
1) Галогенирование: циклопентан и циклопентан реагируют с галогенами на свету, вступая в реакцию замещения.
+ Cl 2 -(свет)🡪 (хлорциклопентан) + HCl
Циклопентан + HNO 3 –(t, p)🡪 нитроциклопентан + вода.
3. Дегидрирование. Производные циклогексана дегидрируются в производные бензола:
4. Горение. Как и любые органические вещества, циклоалканы горят с образованием углекислого газа и воды.
+ Cl 2 -(свет)🡪 (хлорциклопентан) + HCl
Изомерия:
2. Межклассовая изомерия: циклоалканы изомерны алкенам.
3. Геометрическая цис-транс-изомерия:
Например, в молекуле 1,2-диметилциклопропана две группы СН 3 могут находиться по одну сторону от плоскости цикла (цис-изомер) или по разные стороны (транс-изомер):
1. Отщепление двух атомов галогена от дигалогеналканов:
2. При каталитическом гидрировании ароматических углеводородов образуются циклогексан или его производные: C 6 H 6 + 3H 2 — t°,р, Ni→ C 6 H 12 .
1. Малые циклы (циклопропан и циклобутан) из-за большой напряженности кольца (малые углы) легко разрываются, вступая в реакции присоединения.
1) Гидрирование. При каталитическом гидрировании трех-, четырех — и даже пятичленные циклы разрываются с образованием алканов.
(циклопропан) + H 2 — 120ºC, Ni 🡪 CH 3 –CH 2 –CH 3
(циклопентан)+ H 2 — 300ºC, Pd 🡪CH 3 –CH 2 –CH 2 –CH 2 –CH 3
Пятичленный цикл разрывается только при высоких температурах.
2) Галогенирование. Циклопропан и циклобутан разрываются, присоединяя атомы галогена.
+ Br 2 🡪 BrCH 2 –CH 2 –CH 2 Br (1,3- дибромпропан)
3) Гидрогалогенирование. Циклопропан и замещенные циклопропаны взаимодействуют с галогеноводородами с разрывом цикла.
В случае замещенных циклопропанов реакция идёт в соответствии с правилом Марковникова.
Другие циклоалканы с галогеноводородами не реагируют.
2. Большие циклы – циклопентан и циклогексан – гораздо более устойчивы, цикл в них не разрывается. Они ведут себя подобно алканам, вступая в реакции замещения: галогенирование на свету, нитрование.
1) Галогенирование: циклопентан и циклопентан реагируют с галогенами на свету, вступая в реакцию замещения.
+ Cl 2 -(свет)🡪 (хлорциклопентан) + HCl
Циклопентан + HNO 3 –(t, p)🡪 нитроциклопентан + вода.
3. Дегидрирование. Производные циклогексана дегидрируются в производные бензола:
4. Горение. Как и любые органические вещества, циклоалканы горят с образованием углекислого газа и воды.
1 . Структурная изомерия, связанная:a) с числом углеродных атомов в кольце:
При каталитическом гидрировании ароматических углеводородов образуются циклогексан или его производные C 6 H 6 3H 2 — t, р,Ni C 6 H 12.
Nsportal. ru
22.04.2019 16:21:36
2019-04-22 16:21:36
Источники:
Http://nsportal. ru/shkola/khimiya/library/2020/06/18/podgotovka-k-ege-po-himii-tsikloalkany
Всего: 93 1–20 | 21–40 | 41–60 | 61–80 | 81–93
Добавить в вариант
Из предложенного перечня выберите все вещества, при взаимодействии которых с раствором перманганата калия будет наблюдаться изменение окраски раствора.
1) циклогексан
2) бензол
3) толуол
4) пропан
5) пропилен
Запишите в поле ответа номера выбранных веществ.
Источник: Демонстрационная версия ЕГЭ—2017 по химии
Установите соответствие между названием соединения и общей формулой гомологического ряда, к которому оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЕДИНЕНИЯ
А) бутан
Б) бутин-1
В) циклогексан
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, которые имеют пространственные цис-транс-изомеры.
1) З-метилгексен-2
2) 2,2-диметилпентан
3) циклогексан
4) пентен-2
5) бутин-2
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите две пары веществ, в каждой из которых вещества являются изомерами.
1) циклопропан и циклогексан
2) бутен-1 и бутен-2
3) метан и пропан
4) метилциклопропан и бутен-1
5) гексен-1 и гептен-2
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите две пары веществ, в каждой из которых вещества являются изомерами.
1) диметилпропан и пентан
2) циклопентан и циклогексан
3) бутан и изобутан
4) пропан и пропен
5) этан и пропан
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите две пары веществ, в каждой из которых вещества являются изомерами.
1) бензол и циклогексан
2) этанол и этандиол
3) циклопентан и пентен-2
4) бутен-2 и бутадиен
5) этанол и диметиловый эфир
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, у которых все атомы углерода находятся в sp2-гибридизации.
1) циклогексан
2) бутен-2
3) бутадиен-1,3
4) бензол
5) винилацетилен
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите две пары веществ, которые реагируют с бромной водой при обычных условиях.
1) бензол и толуол
2) циклогексан и пропен
3) бутен-2 и аминобензол
4) фенол и ацетилен
5) бензол и этилен
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите две пары углеводородов, которые в определённых условиях могут присоединить воду.
1) этилен и пентадиен-1,4
2) пропен и ацетилен
3) пропан и циклопропан
4) бензол и циклогексан
5) пентан и пентен-2
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите все вещества, которые склонны вступать в реакцию присоединения.
1) пропан
2) циклопропан
3) пентан
4) циклогексан
5) этилен
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите две пары углеводородов, с которыми в кислой среде реагирует перманганат калия.
1) метан и этан
2) бензол и толуол
3) пропен и циклогексан
4) гексен и бутадиен
5) этилен и ацетилен
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите две пары углеводородов, которые реагируют с бромной водой.
1) пропен и циклопропан
2) бензол и толуол
3) ацетилен и этилен
4) бутан и бутен-1
5) циклогексан и гексен-1
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите две пары веществ, каждый из которых обесцвечивает бромную воду.
1) гексен-1 и пентадиен-1,3
2) бензол и толуол
3) этан и этилен
4) этилен и ацетилен
5) циклопропан и циклогексан
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите две пары веществ, каждый из которых обесцвечивает подкисленный раствор перманганата калия.
1) толуол и стирол (винилбензол)
2) бензол и гексан
3) этан и этилен
4) циклопропан и циклогексан
5) ацетилен и гексен-1
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, с которыми взаимодействует .
1) толуол
2) гидроксид калия
3) аминоуксусная кислота
4) циклогексан
5) оксид кремния(IV)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, с которыми взаимодействует .
1) фенол
2) гидроксид бария
3) аминоуксусная кислота
4) циклогексан
5) оксид кремния(IV)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Установите соответствие между названием вещества и классом (группой) органических соединений, к которому(-ой) оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
A) циклогексан
Б) лактоза
B) фенилаланин
КЛАСС (ГРУППА) ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1) карбоновые кислоты
2) аминокислоты
3) углеводороды
4) углеводы
5) фенолы
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, с которыми взаимодействует .
1) бензол
2) гидроксид натрия
3) циклогексан
4) азотная кислота
5) оксид кремния (IV)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите две пары веществ, в каждой из которых вещества являются изомерами.
1) гексин-1 и циклогексан
2) диэтиловый эфир и бутанол-1
3) этанол и диэтиловый эфир
4) пропионовая кислота и метилацетат
5) анилин и нитробензол
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите две пары веществ, в каждой из которых вещества являются структурными изомерами.
1) бутанол-2 и диметиловый эфир
2) изопропанол и пропанол-1
3) циклогексан и гексин-1
4) уксусная кислота и метилацетат
5) гексан и 2,3-диметилбутан
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
Всего: 93 1–20 | 21–40 | 41–60 | 61–80 | 81–93
Характерные химические свойства углеводородов: алканов, алкенов, диенов, алкинов, ароматических углеводородов
Алканы
Алканы — углеводороды, в молекулах которых атомы связаны одинарными связями и которые соответствуют общей формуле $С_{n}Н_{2n+2}$.
Гомологический ряд метана
Как вы уже знаете, гомологи — это вещества, сходные по строению и свойствам и отличающиеся на одну или более групп $СН_2$.
Предельные углеводороды составляют гомологический ряд метана.
Изомерия и номенклатура
Для алканов характерна так называемая структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Как вам уже известно, простейший алкан, для которого характерны структурные изомеры, — это бутан:
Рассмотрим подробнее для алканов основы номенклатуры ИЮПАК:
1. Выбор главной цепи.
Формирование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле, которая является как бы ее основой.
2. Нумерация атомов главной цепи.
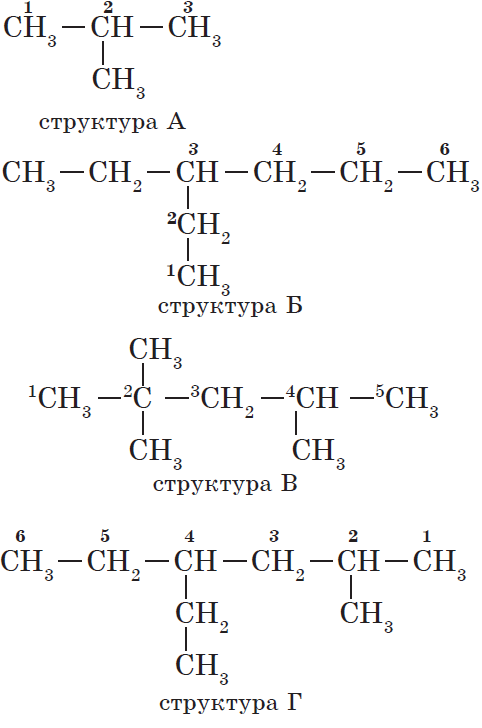
Атомам главной цепи присваивают номера. Нумерация атомов главной цепи начинается с того конца, к которому ближе стоит заместитель (структуры А, Б). Если заместители находятся на равном удалении от конца цепи, то нумерация начинается от того конца, при котором их больше (структура В). Если различные заместители находятся на равном удалении от концов цепи, то нумерация начинается с того конца, к которому ближе старший (структура Г). Старшинство углеводородных заместителей определяется по тому, в каком порядке следует в алфавите буква, с которой начинается их название: метил (—$СН_3$), затем пропил ($—СН_2—СН_2—СН_3$), этил ($—СН_2—СН_3$) и т. д.
Обратите внимание на то, что название заместителя формируется заменой суффикса -ан на суффикс -ил в названии соответствующего алкана.
3. Формирование названия.
В начале названия указывают цифры — номера атомов углерода, при которых находятся заместители. Если при данном атоме находятся несколько заместителей, то соответствующий номер в названии повторяется дважды через запятую ($2.2-$). После номера через дефис указывают количество заместителей (ди — два, три — три, тетра — четыре, пента — пять) и название заместителя (метил, этил, пропил). Затем без пробелов и дефисов — название главной цепи. Главная цепь называется как углеводород — член гомологического ряда метана (метан, этан, пропан и т. д.).
Названия веществ, структурные формулы которых приведены выше, следующие:
— структура А: $2$-метилпропан;
— структура Б: $3$-этилгексан;
— структура В: $2,2,4$-триметилпентан;
— структура Г: $2$-метил $4$-этилгексан.
Физические и химические свойства алканов
Физические свойства. Первые четыре представителя гомологического ряда метана — газы. Простейший из них — метан — газ без цвета, вкуса и запаха (запах газа, почувствовав который, надо звонить $104$, определяется запахом меркаптанов — серосодержащих соединений, специально добавляемых к метану, используемому в бытовых и промышленных газовых приборах, для того, чтобы люди, находящиеся рядом с ними, могли по запаху определить утечку).
Углеводороды состава от $С_5Н_{12}$ до $С_{15}Н_{32}$ — жидкости; более тяжелые углеводороды — твердые вещества.
Температуры кипения и плавления алканов постепенно увеличиваются с возрастанием длины углеродной цепи. Все углеводороды плохо растворяются в воде, жидкие углеводороды являются распространенными органическими растворителями.
Химические свойства.
1. Реакции замещения. Наиболее характерными для алканов являются реакции свободнорадикального замещения, в ходе которого атом водорода замещается на атом галогена или какую-либо группу.
Приведем уравнения наиболее характерных реакций.
Галогенирование:
$CH_4+Cl_2→CH_3Cl+HCl$.
В случае избытка галогена хлорирование может пойти дальше, вплоть до полного замещения всех атомов водорода на хлор:
$CH_3Cl+Cl_2→HCl+{CH_2Cl_2}↙{text»дихлорметан(хлористый метилен)»}$,
$CH_2Cl_2+Cl_2→HCl+{CHСl_3}↙{text»трихлорметан(хлороформ)»}$,
$CHCl_3+Cl_2→HCl+{CCl_4}↙{text»тетрахлорметан(четыреххлористый углерод)»}$.
Полученные вещества широко используются как растворители и исходные вещества в органических синтезах.
2. Дегидрирование (отщепление водорода). В ходе пропускания алканов над катализатором ($Pt, Ni, Al_2O_3, Cr_2O_3$) при высокой температуре ($400–600°С$) происходит отщепление молекулы водорода и образование алкена:
$CH_3—CН_3→СH_2=CH_2+Н_2↑$
3. Реакции, сопровождающиеся разрушением углеродной цепи. Все предельные углеводороды горят с образованием углекислого газа и воды. Газообразные углеводороды, смешанные с воздухом в определенных соотношениях, могут взрываться. Горение предельных углеводородов — это свободнорадикальная экзотермическая реакция, которая имеет очень большое значение при использовании алканов в качестве топлива:
$СН_4+2О_2→СО_2+2Н_2O+880 кДж.$
В общем виде реакцию горения алканов можно записать следующим образом:
$C_{n}H_{2n+2}+({3n+1}/{2})O_2→nCO_2+(n+1)H_2O$
Термическое расщепление углеводородов:
$C_{n}H_{2n+2}{→}↖{400-500°C}C_{n-k}H_{2(n-k)+2}+C_{k}H_{2k}$
Процесс протекает по свободнорадикальному механизму. Повышение температуры приводит к гомолитическому разрыву углерод-углеродной связи и образованию свободных радикалов:
$R—CH_2CH_2:CH_2—R→R—CH_2CH_2·+·CH_2—R$.
Эти радикалы взаимодействуют между собой, обмениваясь атомом водорода, с образованием молекулы алкана и молекулы алкена:
$R—CH_2CH_2·+·CH_2—R→R—CH=CH_2+CH_3—R$.
Реакции термического расщепления лежат в основе промышленного процесса — крекинга углеводородов. Этот процесс является важнейшей стадией переработки нефти.
При нагревании метана до температуры $1000°С$ начинается пиролиз метана — разложение на простые вещества:
$CH_4{→}↖{1000°C}C+2H_2↑$
При нагревании до температуры $1500°С$ возможно образование ацетилена:
$2CH_4{→}↖{1500°C}CH=CH+3H_2↑$
4. Изомеризация. При нагревании линейных углеводородов с катализатором изомеризации (хлоридом алюминия) происходит образование веществ с разветвленным углеродным скелетом:
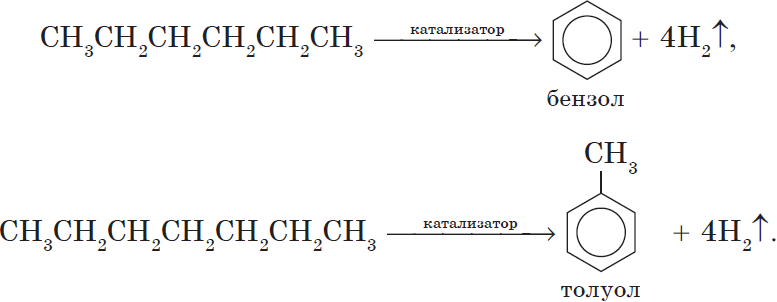
5. Ароматизация. Алканы с шестью и более углеродными атомами в цепи в присутствии катализатора циклизируются с образованием бензола и его производных:
В чем причина того, что алканы вступают в реакции, протекающие по свободнорадикальному механизму? Все атомы углерода в молекулах алканов находятся в состоянии $sp^3$-гибридизации. Молекулы этих веществ построены при помощи ковалентных неполярных $С—С$ (углерод — углерод) связей и слабополярных $С—Н$ (углерод — водород) связей. В них нет участков с повышенной и с пониженной электронной плотностью, легко поляризуемых связей, т.е. таких связей, электронная плотность в которых может смещаться под действием внешних факторов (электростатических полей ионов). Следовательно, алканы не будут реагировать с заряженными частицами, т.к. связи в молекулах алканов не разрываются по гетеролитическому механизму.
Алкены
К непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода. Непредельными являются алкены, алкадиены (полиены), алкины. Непредельным характером обладают также циклические углеводороды, содержащие двойную связь в цикле (циклоалкены), а также циклоалканы с небольшим числом атомов углерода в цикле (три или четыре атома). Свойство непредельности связано со способностью этих веществ вступать в реакции присоединения, прежде всего водорода, с образованием предельных, или насыщенных, углеводородов — алканов.
Алкены — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, одну двойную связь между атомами углерода и соответствующие общей формуле $С_{n}Н_{2n}$.
Свое второе название — олефины — алкены получили по аналогии с жирными непредельными кислотами (олеиновая, линолевая), остатки которых входят в состав жидких жиров — масел (от лат. oleum — масло).
Гомологический ряд этена
Неразветвленные алкены составляют гомологический ряд этена (этилена):
$С_2Н_4$ — этен, $С_3Н_6$ — пропен, $С_4Н_8$ — бутен, $С_5Н_{10}$ — пентен, $С_6Н_{12}$ — гексен и т. д.
Изомерия и номенклатура
Для алкенов, так же, как и для алканов, характерна структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Простейший алкен, для которого характерны структурные изомеры, — это бутен:
Особым видом структурной изомерии является изомерия положения двойной связи:
$СН_3—{СН_2}↙{бутен-1}—СН=СН_2$ $СН_3—{СН=СН}↙{бутен-2}—СН_3$
Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение атомов углерода, поэтому молекулы алканов могут приобретать самую разнообразную форму. Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов еще одного вида изомерии — геометрической, или цис-транс изомерии.
Цис-изомеры отличаются от транс-изомеров пространственным расположением фрагментов молекулы (в данном случае метильных групп) относительно плоскости $π$-связи, а следовательно, и свойствами.
Алкены изомерны циклоалканам (межклассовая изомерия), например:
Номенклатура алкенов, разработанная ИЮПАК, схожа с номенклатурой алканов.
1. Выбор главной цепи.
Образование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле. В случае алкенов главная цепь должна содержать двойную связь.
2. Нумерация атомов главной цепи.
Нумерация атомов главной цепи начинается с того конца, к которому ближе находится двойная связь. Например, правильное название соединения:
$5$-метилгексен-$2$, а не $2$-метилгексен-$4$, как можно было бы предположить.
Если по положению двойной связи нельзя определить начало нумерации атомов в цепи, то его определяет положение заместителей, так же, как для предельных углеводородов.
3. Формирование названия.
Названия алкенов формируются так же, как и названия алканов. В конце названия указывают номер атома углерода, у которого начинается двойная связь, и суффикс, обозначающий принадлежность соединения к классу алкенов, — -ен.
Например:
Физические и химические свойства алкенов
Физические свойства. Первые три представителя гомологического ряда алкенов — газы; вещества состава $С_5Н_{10}$ – $С_{16}Н_{32}$ — жидкости; высшие алкены — твердые вещества.
Температуры кипения и плавления закономерно повышаются при увеличении молекулярной массы соединений.
Химические свойства.
Реакции присоединения. Напомним, что отличительной чертой представителей непредельных углеводородов — алкенов является способность вступать в реакции присоединения. Большинство этих реакций протекает по механизму электрофильного присоединения.
1. Гидрирование алкенов. Алкены способны присоединять водород в присутствии катализаторов гидрирования, металлов — платины, палладия, никеля:
$CH_3—CH_2—CH=CH_2+H_2{→}↖{Pt}CH_3—CH_2—CH_2—CH_3$.
Эта реакция протекает при атмосферном и повышенном давлении и не требует высокой температуры, т.к. является экзотермической. При повышении температуры на тех же катализаторах может пойти обратная реакция — дегидрирование.
2. Галогенирование (присоединение галогенов). Взаимодействие алкена с бромной водой или раствором брома в органическом растворителе ($CCl_4$) приводит к быстрому обесцвечиванию этих растворов в результате присоединения молекулы галогена к алкену и образования дигалоген алканов:
$СН_2=СН_2+Br_2→CH_2Br—CH_2Br$.
3. Гидрогалогенирование (присоединение галогеноводорода).
$CH_3-{CH}↙{пропен}=CH_2+HBr→CH_3-{CHBr}↙{2-бромпропен}-CH_3$
Эта реакция подчиняется правилу Марковникова:
При присоединении галогеноводорода к алкену водород присоединяется к более гидрированному атому углерода, т.е. атому, при котором находится больше атомов водорода, а галоген — к менее гидрированному.
4. Гидратация (присоединение воды).
Гидратация алкенов приводит к образованию спиртов. Например, присоединение воды к этену лежит в основе одного из промышленных способов получения этилового спирта:
${CH_2}↙{этен}=CH_2+H_2O{→}↖{t,H_3PO_4}CH_3-{CH_2OH}↙{этанол}$
Обратите внимание на то, что первичный спирт (с гидроксогруппой при первичном углероде) образуется только при гидратации этена. При гидратации пропена или других алкенов образуются вторичные спирты.
Эта реакция протекает также в соответствии с правилом Марковникова — катион водорода присоединяется к более гидрированному атому углерода, а гидроксогруппа — к менее гидрированному.
5. Полимеризация. Особым случаем присоединения является реакция полимеризации алкенов:
$nCH_2{=}↙{этен}CH_2{→}↖{УФ-свет,R}(…{-CH_2-CH_2-}↙{полиэтилен}…)_n$
Эта реакция присоединения протекает по свободнорадикальному механизму.
6. Реакция окисления.
Как и любые органические соединения, алкены горят в кислороде с образованием $СО_2$ и $Н_2О$:
$СН_2=СН_2+3О_2→2СО_2↑+2Н_2О$.
В общем виде:
$C_{n}H_{2n}+{3n}/{2}O_2→nCO_2↑+nH_2O$
В отличие от алканов, которые устойчивы к окислению в растворах, алкены легко окисляются под действием растворов перманганата калия. В нейтральных или щелочных растворах происходит окисление алкенов до диолов (двухатомных спиртов), причем гидроксильные группы присоединяются к тем атомам, между которыми до окисления существовала двойная связь:
Алкадиены (диеновые углеводороды)
Алкадиены — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, две двойные связи между атомами углерода и соответствующие общей формуле $С_{n}Н_{2n-2}$.
В зависимости от взаимного расположения двойных связей различают три вида диенов:
— алкадиены с кумулированным расположением двойных связей:
$CH_2=C=CH_2$;
— алкадиены с сопряженными двойными связями;
$CH_2=CH—CH=CH_2$;
— алкадиены с изолированными двойными связями
$CH_2=CH—CH_2—CH=CH_2$.
Эти все три вида алкадиенов существенно отличаются друг от друга по строению и свойствам. Центральный атом углерода (атом, образующий две двойные связи) в алкадиенах с кумулированными связями находится в состоянии $sp$-гибридизации. Он образует две $σ$-связи, лежащие на одной прямой и направленные в противоположные стороны, и две $π$-связи, лежащие в перпендикулярных плоскостях. $π$-Связи образуются за счет негибридизированных р-орбиталей каждого атома углерода. Свойства алкадиенов с изолированными двойными связями весьма специфичны, т.к. сопряженные $π$-связи существенно влияют друг на друга.
р-Орбитали, образующие сопряженные $π$-связи, составляют практически единую систему (ее называют $π$-системой), т.к. р-орбитали соседних $π$-связей частично перекрываются.
Изомерия и номенклатура
Для алкадиенов характерна как структурная изомерия, так и цис-, транс-изомерия.
Структурная изомерия.
— изомерия углеродного скелета:
— изомерия положения кратных связей:
${CH_2=CH—CH=CH_2}↙{бутадиен-1,3}$ ${CH_2=C=CH—CH_3}↙{бутадиен-1,2}$
Цис-, транс-изомерия (пространственная и геометрическая)
Например:
Алкадиены изомерны соединениям классов алкинов и циклоалкенов.
При формировании названия алкадиена указывают номера двойных связей. Главная цепь должна обязательно содержать две кратные связи.
Например:
Физические и химические свойства алкадиенов
Физические свойства.
В обычных условиях пропандиен-1,2, бутадиен-1,3 — газы, 2-метилбутадиен-1,3 — летучая жидкость. Алкадиены с изолированными двойными связями (простейший из них — пентадиен-1,4) — жидкости. Высшие диены — твердые вещества.
Химические свойства.
Химические свойства алкадиенов с изолированными двойными связями мало отличаются от свойств алкенов. Алкадиены с сопряженными связями обладают некоторыми особенностями.
1. Реакции присоединения. Алкадиены способны присоединять водород, галогены, галогеноводороды.
Особенностью присоединения к алкадиенам с сопряженными связями является способность присоединять молекулы как в положениях 1 и 2, так и в положениях 1 и 4.
Соотношение продуктов зависит от условий и способа проведения соответствующих реакций.
2. Реакция полимеризации. Важнейшим свойством диенов является способность полимеризоваться под воздействием катионов или свободных радикалов. Полимеризация этих соединений является основой синтетических каучуков:
$nCH_2={CH—CH=CH_2}↙{бутадиен-1,3}→{(… —CH_2—CH=CH—CH_2— …)_n}↙{text»синтетический бутадиеновый каучук»}$.
Полимеризация сопряженных диенов протекает как 1,4-присоединение.
В этом случае двойная связь оказывается центральной в звене, а элементарное звено, в свою очередь, может принимать как цис-, так и транс-конфигурацию.
Алкины
Алкины — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, одну тройную связь между атомами углерода и соответствующие общей формуле $С_{n}Н_{2n-2}$.
Гомологический ряд этина
Неразветвленные алкины составляют гомологический ряд этина (ацетилена):
$С_2Н_2$ — этин, $С_3Н_4$ — пропин, $С_4Н_6$ — бутин, $С_5Н_8$ — пентин, $С_6Н_{10}$ — гексин и т. д.
Изомерия и номенклатура
Для алкинов, так же как и для алкенов, характерна структурная изомерия: изомерия углеродного скелета и изомерия положения кратной связи. Простейший алкин, для которого характерны структурные изомеры положения кратной связи класса алкинов, — это бутин:
$СН_3—{СН_2}↙{бутин-1}—С≡СН$ $СН_3—{С≡С}↙{бутин-2}—СН_3$
Изомерия углеродного скелета у алкинов возможна, начиная с пентина:
Так как тройная связь предполагает линейное строение углеродной цепи, геометрическая (цис-, транс-) изомерия для алкинов невозможна.
Наличие тройной связи в молекулах углеводородов этого класса отражается суффиксом -ин, а ее положение в цепи — номером атома углерода.
Например:
Алкинам изомерны соединения некоторых других классов. Так, химическую формулу $С_6Н_{10}$ имеют гексин (алкин), гексадиен (алкадиен) и циклогексен (циклоалкен):
Физические и химические свойства алкинов
Физические свойства. Температуры кипения и плавления алкинов, так же, как и алкенов, закономерно повышаются при увеличении молекулярной массы соединений.
Алкины имеют специфический запах. Они лучше растворяются в воде, чем алканы и алкены.
Химические свойства.
Реакции присоединения. Алкины относятся к непредельным соединениям и вступают в реакции присоединения. В основном это реакции электрофильного присоединения.
1. Галогенирование (присоединение молекулы галогена). Алкин способен присоединить две молекулы галогена (хлора, брома):
$CH≡CH+Br_2→{CHBr=CHBr}↙{1,2-дибромэтан},$
$CHBr=CHBr+Br_2→{CHBr_2-CHBr_2}↙{1,1,2,2-тетрабромэтан}$
2. Гидрогалогенирование (присоединение галогеноводорода). Реакция присоединения галогеноводорода, протекающая по электрофильному механизму, также идет в две стадии, причем на обеих стадиях выполняется правило Марковникова:
$CH_3-C≡CH+Br→{CH_3-CBr=CH_2}↙{2-бромпропен},$
$CH_3-CBr=CH_2+HBr→{CH_3-CHBr_2-CH_3}↙{2,2-дибромпропан}$
3. Гидратация (присоединение воды). Боль шое значение для промышленного синтеза кетонов и альдегидов имеет реакция присоединения воды (гидратация), которую называют реакцией Кучерова:
4. Гидрирование алкинов. Алкины присоединяют водород в присутствии металлических катализаторов ($Pt, Pd, Ni$):
$R-C≡C-R+H_2{→}↖{Pt}R-CH=CH-R,$
$R-CH=CH-R+H_2{→}↖{Pt}R-CH_2-CH_2-R$
Так как тройная связь содержит две реакционноспособные $π$-связи, алканы присоединяют водород ступенчато:
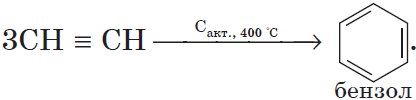
1) тримеризация.
При пропускании этина над активированным углем образуется смесь продуктов, одним из которых является бензол:
2) димеризация.
Помимо тримеризации ацетилена, возможна его димеризация. Под действием солей одновалентной меди образуется винилацетилен:
$2HC≡CH→{HC≡C-CH=CH_2}↙{text»бутен-1-ин-3(винилацетилен)»}$
Это вещество используется для получения хлоропрена:
$HC≡C-CH=CH_2+HCl{→}↖{CaCl}H_2C={CCl-CH}↙{хлоропрен}=CH_2$
полимеризацией которого получают хлоропреновый каучук:
$nH_2C=CCl-CH=CH_2→(…-H_2C-CCl=CH-CH_2-…)_n$
Окисление алкинов.
Этин (ацетилен) горит в кислороде с выделением очень большого количества теплоты:
$2C_2H_2+5O_2→4CO_2↑+2H_2O+2600кДж$ На этой реакции основано действие кислородно-ацетиленовой горелки, пламя которой имеет очень высокую температуру (более $3000°С$), что позволяет использовать ее для резки и сварки металлов.
На воздухе ацетилен горит коптящим пламенем, т.к. содержание углерода в его молекуле выше, чем в молекулах этана и этена.
Алкины, как и алкены, обесцвечивают подкисленные растворы перманганата калия; при этом происходит разрушение кратной связи.
Ионный (правило В. В. Марковникова) и радикальный механизмы реакции в органической химии
Типы химических реакций в органической химии
Реакции органических веществ можно формально разделить на четыре основных типа: замещения, присоединения, отщепления (элиминирования) и перегруппировки (изомеризации). Очевидно, что все многообразие реакций органических соединений невозможно свести к предложенной классификации (например, реакции горения). Однако такая классификация поможет установить аналогии с уже знакомыми вам из курса неорганической химии реакциями, протекающими между неорганическими веществами.
Как правило, основное органическое соединение, участвующее в реакции, называют субстратом, а другой компонент реакции условно рассматривают как реагент.
Реакции замещения
Реакции, в результате которых осуществляется замена одного атома или группы атомов в исходной молекуле (субстрате) на другие атомы или группы атомов, называются реакциями замещения.
В реакции замещения вступают предельные и ароматические соединения, такие как алканы, циклоалканы или арены.
Приведем примеры таких реакций.
Под действием света атомы водорода в молекуле метана способны замещаться на атомы галогена, например, на атомы хлора:
$CH_4+Cl_2→CH_3Cl+HCl$
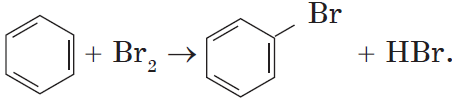
Другим примером замещения водорода на галоген является превращение бензола в бромбензол:
Уравнение этой реакции может быть записано иначе:
При этой форме записи реагенты, катализатор, условия проведения реакции записывают над стрелкой, а неорганические продукты реакции — под ней.
Реакции присоединения
Реакции, в результате которых две или более молекул реагирующих веществ соединяются в одну, называют реакциями присоединения.
В реакции присоединения вступают ненасыщенные соединения, такие как алкены или алкины.
В зависимости от того, какая молекула выступает в качестве реагента, различают гидрирование (или восстановление), галогенирование, гидрогалогенирование, гидратацию и другие реакции присоединения. Каждая из них требует определенных условий.
1. Гидрирование — реакция присоединения молекулы водорода по кратной связи:
$CH_3{-CH=}↙{text»пропен»}CH_2+H_2{→}↖{Pt}CH_3{-CH_2-}↙{text»пропан»}-CH_3$
2. Гидрогалогенирование — реакция присоединения галогеноводорода (гидрохлорирование):
${CH_2=}↙{text»этен»}CH_2+HCl→CH_3{-CH_2-}↙{text»хлорэтан»}-Cl$
3. Галогенирование — реакция присоединения галогена:
${CH_2=}↙{text»этен»}CH_2+Cl_2→{CH_2Cl-CH_2Cl}↙{text»1.2-дихлорэтан»}$
4. Полимеризация — особый тип реакций присоединения, в ходе которых молекулы вещества с небольшой молекулярной массой соединяются друг с другом с образованием молекул вещества с очень высокой молекулярной массой — макромолекул.
Реакции полимеризации — это процессы соединения множества молекул низкомолекулярного вещества (мономера) в крупные молекулы (макромолекулы) полимера.
Примером реакции полимеризации может служить получение полиэтилена из этилена (этена) под действием ультрафиолетового излучения и радикального инициатора полимеризации $R:$
${nCH_2=}↙{text»этен»}CH_2{→}↖{text»УФ-свет,R»}{(…-CH_2-CH_2-…)_n}↙{text»полиэтилен»}$
Наиболее характерная для органических соединений ковалентная связь образуется при перекрывании атомных орбиталей и образовании общих электронных пар. В результате этого образуется общая для двух атомов орбиталь, на которой находится общая электронная пара. При разрыве связи судьба этих общих электронов может быть разной.
Типы реакционноспособных частиц в органической химии
Орбиталь с неспаренным электроном, принадлежащая одному атому, может перекрываться с орбиталью другого атома, на которой также находится неспаренный электрон. При этом происходит образование ковалентной связи по обменному механизму:
$H•+•H→H:H,$ или $H-H$
Обменный механизм образования ковалентной связи реализуется в том случае, если общая электронная пара образуется из неспаренных электронов, принадлежащих разным атомам.
Процессом, противоположным образованию ковалентной связи по обменному механизму, является разрыв связи, при котором к каждому атому отходит по одному электрону. В результате этого образуются две незаряженные частицы, имеющие неспаренные электроны:
$R:R=R•+R•$
Такие частицы называются свободными радикалами.
Свободные радикалы — атомы или группы атомов, имеющие неспаренные электроны.
Реакции, которые протекают под действием и при участии свободных радикалов, называются свободнорадикальными реакциями.
В курсе неорганической химии это реакции взаимодействия водорода с кислородом, галогенами, реакции горения. Обратите внимание, что реакции этого типа отличаются высокой скоростью, выделением большого количества тепла.
Ковалентная связь может образоваться и по донорно-акцепторному механизму. Одна из орбиталей атома (или аниона), на которой находится неподеленная электронная пара, перекрывается незаполненной орбиталью другого атома (или катиона), имеющего незаполненную орбиталь, при этом формируется ковалентная связь, например:
$H^{+}+{:O-H^{-}}↙{text»акцептор»}→{H-O-H}↙{text»донор»}$
Разрыв ковалентной связи приводит к образованию положительно и отрицательно заряженных частиц; так как в данном случае оба электрона из общей электронной пары остаются при одном из атомов, у второго атома получается незаполненная орбиталь:
$R:|R=R:^{-}+R^{+}$
Рассмотрим электролитическую диссоциацию кислот:
$H:|Cl=H^{+}+Cl^{-}$
Можно легко догадаться, что частица, имеющая неподеленную электронную пару $R:^{-}$, т. е. отрицательно заряженный ион, будет притягиваться к положительно заряженным атомам или к атомам, на которых существует по крайней мере частичный или эффективный положительный заряд. Частицы с неподеленными электронными парами называют нуклеофильными агентами (nucleus — ядро, положительно заряженная часть атома), т. е. «друзьями» ядра, положительного заряда.
Нуклеофилы ($Nu$) — анионы или молекулы, имеющие неподеленную пару электронов, взаимодействующие с участками молекул, на которых сосредоточен эффективный положительный заряд.
Примеры нуклеофилов: $Cl^{-}$ (хлорид-ион), $ОН^{-}$ (гидроксид-анион), $СН_3О^{-}$ (метоксид-анион), $СН_3СОО^{-}$ (ацетат-анион).
Частицы, имеющие незаполненную орбиталь, напротив, будут стремиться заполнить ее и, следовательно, будут притягиваться к участкам молекул, на которых присутствует повышенная электронная плотность, отрицательный заряд, неподеленная электронная пара. Они являются электрофилами, «друзьями» электрона, отрицательного заряда или частиц с повышенной электронной плотностью.
Электрофилы — катионы или молекулы, имеющие незаполненную эле к трон ную орбиталь, стремящиеся к заполнению ее электронами, так как это приводит к более выгодной электронной конфигурации атома.
Примеры электрофилов: $NO_2$ (нитрогруппа), —$СООН$ (карбоксил), —$СN$ (нитрильная группа), —$СОН$ (альдегидная группа).
Не любая частица с незаполненной орбиталью является электрофилом. Так, например, катионы щелочных металлов имеют конфигурацию инертных газов и не стремятся к приобретению электронов, так как имеют низкое сродство к электрону. Из этого можно сделать вывод, что, несмотря на наличие у них незаполненной орбитали, подобные частицы не будут являться электрофилами.
Основные механизмы протекания реакций
Мы выделили три основных типа реагирующих частиц — свободные радикалы, электрофилы, нуклеофилы — и три соответствующих им типа механизма реакций:
— свободнорадикальные;
— электрофильные;
— нуклеофильные.
Кроме классификации реакций по типу реагирующих частиц, в органической химии различают четыре вида реакций по принципу изменения состава молекул: присоединения, замещения, отщепления, или элиминирования (от лат. eliminaue — удалять, отщеплять) и перегруппировки. Так как присоединение и замещение могут происходить под действием всех трех типов реакционноспособных частиц, можно выделить несколько основных механизмов протекания реакций.
1. Свободнорадикальное замещение:
${CH_4}↙{text»метан»}+Br_2{→}↖{text»УФ-свет»}{CH_3Br}↙{text»бромметан»}+HBr$
2. Свободнорадикальное присоединение:
$nCH_2=CH_2{→}↖{text»УФ-свет,R»}(…-CH_2-CH_2-…)_n$
3. Электрофильное замещение:
4. Электрофильное присоединение:
$CH_3-{CH=}↙{text»пропен»}CH_2+HBr{→}↖{text»раствор»}{CH_3-CHBr-CH_3}↙{text»2-бромпропан»}$
$СH_3{-C≡}↙{text»пропин»}CH+Cl_2{→}↖{text»раствор»}{CH_3-CCl=CHCl}↙{text»1,2-дихлорпропен»}$
5. Нуклеофильное присоединение:
Кроме того, мы рассмотрим реакции отщепления, или элиминирования, которые идут под воздействием нуклеофильных частиц — оснований.
6. Элиминирование:
$СH_3-CHBr-CH_3+NaOH{→}↖{text»спиртовой раствор»}CH_3-CH=CH_2+NaBr+H_2O$
Можно считать, что в этой реакции происходит отщепление молекулы бромводорода от молекулы 2-бромпропана. В присутствии щелочи образуются бромид натрия и вода.
Правило В. В. Марковникова
Отличительной чертой алкенов (непредельных углеводородов) является способность вступать в реакции присоединения. Большинство этих реакций протекает по механизму электрофильного присоединения.
Гидрогалогенирование (присоединение галогеноводо рода):
$СH_3{-CH-}↙{text»пропен»}CH_2+HBr→CH_3{-CHBr-CH_3}↙{text»2-бромпропан»}$
Эта реакция подчиняется правилу В. В. Марковникова: при присоединении галогенводорода к алкену водород присоединяется к более гидрированному атому углерода, т.е. атому, при котором находится больше атомов водорода, а галоген — к менее гидрированному.

























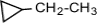 (этилциклопропан),
(этилциклопропан), 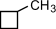 (метилциклобутан);
(метилциклобутан);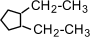 (1,2-диэтилциклопентан)
(1,2-диэтилциклопентан)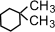 (1,1-диметилциклогексан),
(1,1-диметилциклогексан), 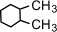 (1,2-диметилциклогексан)
(1,2-диметилциклогексан)