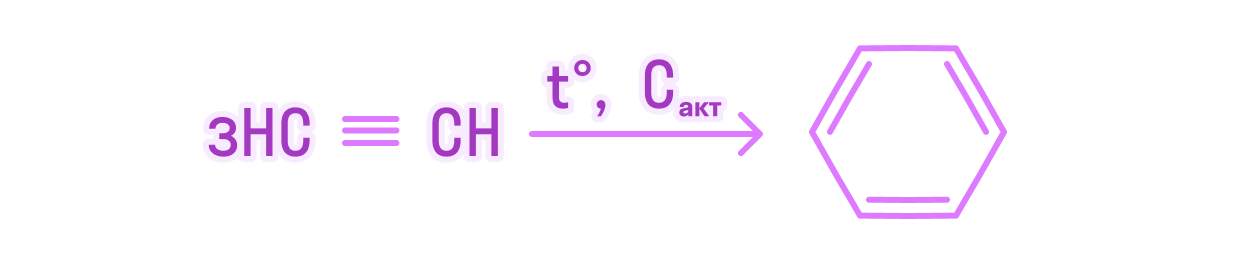О том, что добавлять эксперименты в задания ЕГЭ по физике и химии пока не планируют, рассказала заместитель директора ФИПИ Ольга Котова в интервью “Российской газете”.
Работу с реальными приборами и пробирками включает в себя экзамен по химии и физике для выпускников 9 классов. Но делать такие же нововведения в ЕГЭ организаторы пока не собираются. Ольга Котова считает, что для этого сначала нужно провести ОГЭ в новом формате и проанализировать, оснащены ли российские школы нужным для проведения реальных экспериментов оборудованием и готовы ли педагоги с ним работать.
Она напомнила, что профильные экзамены для девятиклассников в прошлом и в этом учебных годах провести не удалось, поэтому новые задания так и не были опробованы на практике. Без этого решать вопрос о введении реальных экспериментов в ЕГЭ нельзя.
Ранее сайт “Учительская газета” сообщал о трудностях, с которыми одиннадцатиклассники чаще всего сталкиваются при написании ЕГЭ.
Фото: pixabay.com
Директор ФИПИ Оксана Решетникова на встрече в РАН со стобалльниками, которые уже учатся на технических и естественно-научных специальностях в вузах, рассказала о том, что в ближайшие годы появится практическая составляющая на реальном оборудовании на ЕГЭ по физике и химии.
На этой встрече один из выпускников из Ивановской области, который сейчас поступил в МИФИ, пожаловался, что в его школе было закуплено новое современное оборудование для опытов и экспериментов, но оно так и простояло нераспакованным — не было специалистов по эксплуатации и переводчиков технической документации. «Будет задание — будут и специалисты», — заверила директор ФИПИ.
Президент РАН поддержал введение в ЕГЭ креативной, творческой части, но заметил: «Надо подумать, как сделать такой творческий экзамен объективным».
Напомним, в последние годы ЕГЭ по физике становится все более и более популярным, его выбирают больше 20 процентов выпускников. Химию сдают меньше, но, как правило, очень хорошо. Эксперты объясняют это тем, что на ЕГЭ по химии приходят только высокомотивированные ученики, случайно «на авось» химию на выбирают.
Между тем
Экспериментальная часть есть на экзаменах в 9 классе, но регион сам решает, будет она на аттестации или нет. В Москве есть. Как пояснила директор ФИПИ Оксана Решетникова, требуется нехитрый набор оборудования. Если эксперимент будет на ЕГЭ, встанет важный вопрос оценивания. Иногда итоги эксперимента могут не зависеть от того, кто и как его выполняет. «Ведется точечная работа, чтобы эксперимент не вошел в противоречие с заданием, учебником. У нас есть два года на введение любых изменений в ЕГЭ, чтобы апробировать, посмотреть, а в ФИПИ работают профессионалы».
Фотографии: АГН «Москва» / Pixabay. Иллюстрация: Юлия Замжицкая
О нововведениях и нюансах подготовки рассказывает руководитель комиссии по разработке контрольно-измерительных материалов ЕГЭ по химии, кандидат педагогических наук Дмитрий Добротин.
Основные изменения
В этом году изменения минимальные. В целом структура работы осталась практически без корректировок.
Изменилось условие задания 23
Скриншот задания 23 из демоверсии ЕГЭ-2023 по химии
Из условия убрали таблицу, в которые были представлены концентрации, характерные для веществ, находящихся в данном состоянии равновесия.
Эксперты предполагают, что такую таблицу экзаменуемый может составить сам. Для этого не требуется каких-то специальных навыков: это классическая таблица, где заложены и концентрации исходных вещественных продуктов реакции, и, соответственно, их значения.
Изменения в задании 32 на «цепочки превращений»
Скриншот задания 32 из демоверсии ЕГЭ-2023 по химии
Если традиционная цепочка предполагает, что превращения идут слева направо, то в этом году появилось новшество, которое предполагает, что стрелочки к веществу или обозначению, который заменяет вещество (имеется в виду x1, x2 и т. д.) могут стоять как в направлении к веществу, так и от вещества.
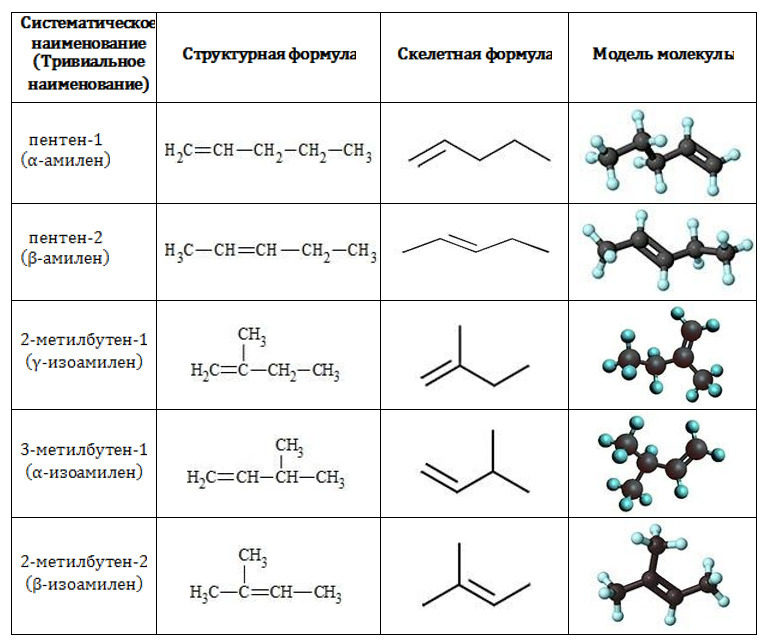
Появились «скелетные формулы»
«Скелетная формула» — это когда отдельные атомы обозначаются только в виде ломанной линии.
Примеры «скелетных формул»
К такой форме записи органических веществ многие уже привыкли, но для некоторых это может стать неожиданностью. Но такие формулы записи молекул могут быть. На это обращает внимание и примечание, которое идет после критериев оценивания.
Кому-то такая форма записи органических веществ будет удобна, и это можно использовать и в рамках записи своих уравнений, реакций. Но и в целом можно переводить и в привычный формат так называемых свернутых формул — в этом тоже нет никаких нарушений.
Задания 33 и 34 поменяли местами
Это сделали, чтобы после того, как учащиеся выполнят цепочку превращений с использованием знания в органических веществах, им будет удобнее сразу перейти именно к расчетной задаче, в которой нужно вывести молекулярную формулу органического вещества.
Завершающая задача 34 действительно самая сложная. На последнем месте ее разместили затем, чтобы экзаменуемый мог спокойно сосредоточиться на ней и уделить ей столько времени, сколько потребуется.
На что обратить внимание и как готовиться
-
Внимательно читать задание и инструкции
Например, в расчетных задачах 27 и 28 в качестве относительной атомной массы хлора используют значение 35,5. Это принципиальный момент, потому что в этих задачах нужно записать ответ с конкретной точностью, тоже указанной в условии задания.
Совет от эксперта:
«Машина не распознает никакое другое значение, кроме того, которое было заложено. Поэтому в данном случае очень важно следовать инструкциям и округлять с той заданной точностью, которая указана в условии задания».
Бывают случаи, когда экзаменуемый прорешал много вариантов и у него сложился стереотип, что значения PH, как правило, выстраиваются в порядке возрастания. Однако встречаются и задания, в которых их надо выстроить в порядке убывания.
-
Выделить достаточно времени на проверку работы
За 20 минут до окончания экзамена стоит начать проверку: все ли решено, все ли инструкции учтены. В тех заданиях, где это играет принципиальную роль, стоит быть максимально внимательным к деталям, которые могут привести к серьезной потере баллов.
-
При подготовке обратить особое внимание на самые сложные задания
Как показывает практика, это задания 33, 34, а также 24 и 25, которое связано с промышленным производством, способами получения веществ и их применением.
Совет от эксперта:
«Для того, чтобы лучше справиться с заданиями 24 и 25, ведите таблицы, которые помогают фиксировать внешние наблюдения за химическим экспериментом. Стоит вести их в течение всего периода обучения химии, а уж когда выпускник определился с выбором предметов, это точно пригодится».
Отдельное внимание стоит обратить на задание 25, которое предполагает проверку знаний и умения определять, какой аппарат требуется для получения того или иного вещества, в какой области его применяют. Нередко в школе педагоги отдают этот вопрос на самостоятельное изучение. Поэтому полезно до экзамена собрать и систематизировать эту информацию, как по органической химии, так и по неорганической.
-
Не ограничиваться подготовкой только по моделям ЕГЭ
Практика показывает, что если старшеклассник идет по пути подготовки к конкретным моделям экзамена, то как только встречаются нюансы в условии, отличные от того, к чему он готовился, он испытывает стресс. А если экзаменуемый в целом владеет необходимым теоретическим материалом, то не будет принципиальным, как его о нем спрашивают.
Самый оптимальный вариант — интенсифицировать процесс подготовки с опорой на классические учебники, либо пособия для подготовки абитуриентов, либо школьные учебники углубленного уровня, либо на материалы, которые размещены на сайте ФИПИ. В навигаторе ФИПИ приведены задания, которые соответствуют тем позициям, которые встречаются в экзаменационном варианте. Кроме того, там есть ссылки учебники, которые могут выступать в качестве помощников при подготовке.
Посмотреть полную версию консультации Дмитрия Добротина в эфире Рособрнадзора можно здесь.
Материалы по теме:
- Что изменится в ЕГЭ по русскому языку в 2023 году
- Что изменится в ЕГЭ по английскому языку в 2023 году
- Что изменится в ЕГЭ по истории в 2023 году
Если вам нравятся материалы на Педсовете, подпишитесь на наш канал в Телеграме, чтобы быть в курсе событий раньше всех.
Подписаться
Подготовка к ЕГЭ по химии
Как проходит ЕГЭ по химии в 2023 году
На ЕГЭ по химии, как и в случае с большинством других предметов, ученик 11 класса должен будет справиться с 2 частями экзамена:
-
1-я часть: 28 заданий с кратким ответом;
-
2-я часть: 6 заданий с развернутым ответом.
Чтобы решить все 34 задания единого государственного экзамена, у ученика будет 210 минут. За это время нужно будет успеть ответить на вопросы обеих частей, подготовить полное решение для задач 2-й части и перенести ответы в бланк.
Кстати, в отличие от ОГЭ, на ЕГЭ по химии не будет задания-эксперимента. Только обычные химические задания разной сложности. В таблице ниже можно посмотреть, сколько будет легких, средних и сложных вопросов.
| Уровень сложности заданий на ЕГЭ по химии | |
|---|---|
| Базовая | 17 |
| Повышенная | 11 |
| Высокая | 6 |
Если вы хотите больше узнать об особенностях экзамена и подготовки к нему, советуем заглянуть в раздел «Демоверсии, спецификации, кодификаторы» сайта ФИПИ. Там вы найдете всю актуальную информацию о ЕГЭ по химии и методические рекомендации. Все это поможет распланировать подготовку к экзамену так, чтобы сдать его на 100 баллов.
Изменения в ЕГЭ по химии
По сравнению с 2022 годом экзамен по химии немного изменится. Вот список нововведений:
-
Немного поменялось условие задания 23, в котором нужно рассчитать концентрацию веществ. Теперь данные в нем будут записаны текстом, а не в таблице.
-
Задания 33 и 34 поменялись местами.
-
Задания 9, 12 и 16 теперь станут повышенной сложности.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
Как хорошо сдать ЕГЭ по химии: разбор сложных задач
Как мы узнали из таблицы в предыдущем разделе, экзамен по химии — один из самых сложных. На 34 задания в нем приходится целых 11 повышенной сложности и 6 — высокой. Но если вы хотите поступить в вуз мечты, советуем научиться их решать так, чтобы не упустить ни одного балла. А потому предлагаем начать подготовку прямо сейчас и вместе разобрать несколько таких задач.
Задание 7
Это задание проверяет буквально все ваши знания в области неорганической химии. Здесь нужно знать как химические свойства простых соединений, так и химические свойства сложных соединений. Давайте разберем одно из таких заданий, чтобы понять, как их решать, чтобы сдать ЕГЭ по химии.
Установите соответствие между веществом и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| Вещество | Реагенты |
|---|---|
| А) S | 1) AgNO3, K3PO4, Cl2 |
| Б) SO3 | 2) BaO, NaOH, H2O |
| В) Zn(OH)2 | 3) H2, Cl2, O2 |
| Г) ZnBr2 | 4) HBr, LiOH, CH3COOH (p-p) |
| 5) H3PO4 (p-p), BaCl2, CuO |
Решение:
-
Вариант под буквой А — простое вещество, сера. Как правило, простые вещества взаимодействуют с другими простыми веществами, значительно реже со сложными веществами. Под это описание подходит вариант № 3.
-
Вещество под буквой Б — кислотный оксид. Кислотные оксиды не реагируют с кислотами, поэтому смело вычеркиваем варианты, где присутствует хоть одна кислота. Остаются варианты № 1–3. Реагенты под цифрой 3 тоже можем вычеркнуть, так как кислотный оксид уже в своей максимальной степени окисления и дальше взаимодействовать с кислородом не может. Остаются варианты № 1 и № 2. Оксид серы (VI) может реагировать с основным оксидом с образованием соли, со щелочью с образованием соли и воды, и с водой, при этом образуя кислоту. Выбираем № 2.
-
Амфотерный нерастворимый в воде гидроксид цинка может взаимодействовать только с теми, что способны его растворить. Единственно верный вариант под № 4, где указаны кислоты и щелочь.
-
При взаимодействии соли с другими сложными веществами надо помнить про три признака протекания химической реакции: выпадения осадка, выделение газа и образование малодиссоциирующего вещества — воды. Под это описание подходит вариант под № 1. Но как же хлор? Дело в том, что вышестоящие в группе галогены способны вытеснить нижестоящие из их солей.
Ответ: 3241.
Задание 15
Это задание Единого государственного экзамена проверит ваши знания химических свойств органических соединений. Чтобы справиться с ним, нужно по записанным словами реагирующим веществам составить уравнение реакции и выбрать из перечня один из получившихся продуктов. Давайте рассмотрим на примере, как решать такую задачу.
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| Реагирующие вещества | Продукт взаимодействия |
|---|---|
| А) уксусная кислота и сульфид калия | пропионат калия |
| Б) муравьиная кислота и гидроксид калия | этилат калия |
| В) муравьиный альдегид и гидроксид меди (II) при нагревании | формиат меди (II) |
| Г) этанол и калий | формиат калия |
| ацетат калия | |
| углекислый газ |
Решение:
-
Органические кислоты могут реагировать с солями, если те имеют летучий анион. В результате взаимодействия образуется соль уксусной кислоты и сероводород (летучее соединение). Соль, которая образована в таких условиях, — ацетат калия. Это вещество № 5.
-
Муравьиная кислота проявляет свойства неорганической кислоты и может взаимодействовать с щелочами с образованием соли и воды. Соль муравьиной кислоты — формиат. Правильный ответ № 4.
-
Под буквой В описана качественная реакция на альдегиды с образованием соответствующей кислоты, оксида меди (I) и воды. Исключение — муравьиный альдегид. Он окисляется до углекислого газа, а остальные продукты реакции те же. Соответственно, правильный ответ № 6.
-
Калий как активный металл может замещать протон водорода в гидроксогруппе у спиртов с образованием алкоголята. Правильный ответ: № 2.
Ответ: 5462.
Задание 16
Это задание всё так же проверяет ваши знания по химическим свойствам и, как следствие, умение записывать превращения в рамках органической химии. Однако оно усложняется тем, что теперь вам самим нужно подобрать такой реактив, чтобы произошло уже известное превращение. Давайте попробуем решить один из вариантов такой задачи вместе — это повысит ваши шансы сдать ЕГЭ на 100 баллов.
Задана схема превращений веществ:
Определите, какие из указанных веществ являются веществами х и у:
-
2-бромбутан;
-
этаналь;
-
этен;
-
метилпропан;
-
хлорэтан.
Решение:
Посмотрим, что случилось с известными нам веществами.
-
У спирта исчезла ОН-группа, затем что-то произошло, и углеродная цепочка увеличилась вдвое. Мы помним, что когда цепочка увеличивается вдвое, то, скорее всего, это реакция Вюрца. А в неё вступают только галогеналканы. Ищем нужный нам вариант. Он находится под номером 5. Первое вещество найдено.
-
Бутан подвергают нагреванию с использованием катализатора. Нужно помнить, что в таких условиях проводится изомеризация алканов. Из бутана получается метилпропан. Ответ: № 4.
Ответ: 54.
Задание 26
Теперь разберем задачи, которые заканчивают тестовую часть ЕГЭ по химии. Рассмотрим условие одной из них на нахождение массы соли, которую необходимо добавить для получения раствора с новой заданной массовой долей.
Вычислите массу нитрата калия (в граммах), которую следует растворить в 160 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%. Ответ округлите до десятых.
Чтобы решить эту задачу, вспомним основную формулу нахождения массовой доли:
-
Найдем массу изначально растворенного нитрата калия в растворе, выразив из формулы выше:
подставим значения:
-
Чтобы увеличить массовую долю соли в растворе, необходимо ее добавить еще. Но мы не знаем сколько, поэтому примем массу добавляемой соли за Х и подставим в исходную формулу нахождения массовой доли с учетом новых значений:
-
Далее в дело вступает чистая математика. Разделим обе части уравнения на 100%:
-
По пропорции перемножим крест-накрест:
0,12 * (160 + X) = 16 + X.
-
Раскроем скобки:
19,2 + 0,12Х = 16 + Х.
-
Приведем подобные: с Х в одну сторону, без Х — в другую:
3,2 = 0,88Х.
-
Найдем Х:
Масса нитрата калия, которую необходимо добавить для увеличения массовой доли раствора до 12%, равна 3,6 граммам.
Ответ: 3,6.
Задание 28
Эта задача может встретиться на экзамене в нескольких вариантах. Давайте разберем один из них — задание на нахождение доли выхода продукта реакции.
В результате реакции тримеризации ацетилена объемом 26,88 л (н.у) получили 24,96 г бензола. Вычислите массовую долю выхода продукта реакции от теоретически возможного.
Решение:
-
Для начала напишем формулу, по которой считается доля выхода продукта:
Как определить, какая масса практическая, а какая — теоретическая? Значения, которые даются после слова «получили», — это практическая масса. Та, которая получилась в результате проведения химической реакции в реальных условиях. Масса теоретическая — та, которую рассчитывают из уравнения реакции, зная массу исходных реагентов.
-
Напишем уравнение химической реакции тримеризации ацетилена:
-
Найдем количество вещества ацетилена:
подставим значения:
-
Перейдем на количество вещества бензола, получаемого из ацетилена:
-
Зная количество вещества бензола, найдем его массу:
подставим значения:
m = 0,4 * 78 = 31,2 грамма.
-
Масса, рассчитываемая по уравнению реакции, является теоретической. Масса практическая дана нам по условию. Подставим полученные данные по массам в формулу для нахождения доли выхода продукта реакции:
Доля выхода бензола из данного объема ацетилена составляет 80%.
Ответ: 80.
Как оценивают готовые работы на ЕГЭ по химии
1-я часть
В 1-й части Единого государственного экзамена по химии задания 1–5, 9–13, 16–21, 25–28 оценивают 1 баллом, если вы запишете верный ответ по эталону. При этом в заданиях 1, 3, 4, 11, 12, 13, 17 и 18 ответ — это ряд цифр. То, в каком порядке вы их запишете, не влияет на оценку. Например, если в задании верны варианты под номерами 1 и 4, их можно записать как 14 или как 41. И в обоих случаях ответ засчитают как верный.
За правильные ответы в заданиях 6, 7, 8, 14, 15, 22, 23 и 24 можно получить по 2 балла. Если ваш ответ отличается от эталона на один символ, его оценят в 1 балл. Во всех остальных случаях задание считают выполненным неверно и ставят 0 баллов.
2-я часть
В этой части нужно записать не только ответ, но и решение. А значит, и оценивать такие задания будут сразу по нескольким критериям. Зато за верный ответ в некоторых вопросах можно получить больше баллов, чем за любое задание 1-й части. Максимум — 5 баллов. А теперь давайте разберемся, как именно их будут оценивать.
| Задание № 29 | Баллы |
|---|---|
| Ответ верный и полный: ученик выбрал вещества и записал уравнение химической реакции, составил электронный баланс, указал окислитель и восстановитель | 2 |
| Есть только один верный элемент ответа | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 2 |
| Задание № 30 | Баллы |
|---|---|
| Ответ верный и полный: ученик выбрал вещества, записал все нужные уравнения реакции | 2 |
| Есть только один верный элемент ответа | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 2 |
| Задание № 31 | Баллы |
|---|---|
| Правильно записаны 4 уравнения реакции | 4 |
| Правильно записаны 3 уравнения реакции | 3 |
| Правильно записаны 2 уравнения реакции | 2 |
| Правильно записано 1 уравнение реакции | 1 |
| Все уравнения реакции записаны неверно | 0 |
| Максимальный балл | 4 |
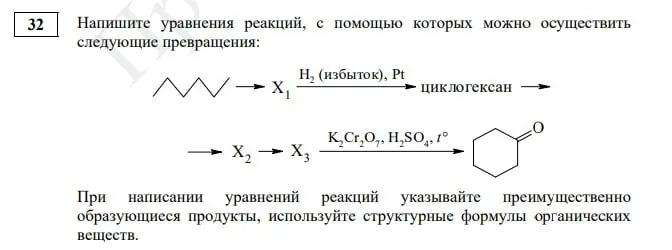
| Задание № 32 | Баллы |
|---|---|
| Правильно записаны 5 уравнений реакции | 5 |
| Правильно записаны 4 уравнения реакции | 4 |
| Правильно записаны 3 уравнения реакции | 3 |
| Правильно записаны 2 уравнения реакции | 2 |
| Правильно записано 1 уравнение реакции | 1 |
| Все уравнения реакции записаны неверно | 0 |
| Максимальный балл | 5 |
| Задание № 33 | Баллы |
|---|---|
| Ответ верный и полный, записаны все 3 элемента | 3 |
| Правильно записаны только 2 элемента ответа | 2 |
| Правильно записан только 1 элемент ответа | 1 |
| Все элемента ответа записаны неверно | 0 |
| Максимальный балл | 3 |
| Задание № 34 | Баллы |
|---|---|
| Ответ верный и полный, записаны все 4 элемента | 4 |
| Правильно записаны только 3 элемента ответа | 3 |
| Правильно записаны только 2 элемента ответа | 2 |
| Правильно записан только 1 элемент ответа | 1 |
| Все элемента ответа записаны неверно | 0 |
| Максимальный балл | 4 |
Как сдать ЕГЭ по химии на 3, 4 и 5
Мы уже познакомились с критериями, по которым будут оценивать работы на ЕГЭ. А теперь давайте разберемся, сколько баллов нужно получить для оценок 3, 4 или 5. Официально ЕГЭ не оценивают по пятибалльной системе с 2008 года. Если вам так проще оценить свои знания, их можно перевести. Но это будет лишь примерный перевод.
Будьте внимательны: баллы из таблиц выше — первичные, а требования к абитуриентам на поступление выражены в тестовых. Чтобы понять, сколько заданий точно нужно решить, чтобы поступить, надо перевести баллы из одной системы в другую. Это можно сделать по таблице ниже.
| Первичные баллы | Тестовые баллы | Оценка |
|---|---|---|
| <11 | <36 | 2 |
| 11–25 | 36–55 | 3 |
| 26–38 | 56–72 | 4 |
| 39–56 | 73–100 | 5 |
6 рекомендаций, как подготовиться к ЕГЭ по химии
Единый государственный экзамен — это ответственная задача, от результатов подготовки к которой иногда многое зависит. Чтобы немного облегчить для вас этот путь, мы собрали 6 простых, но рабочих советов от наших преподавателей. Следуйте им и тогда сможете подготовиться к экзамену по химии как можно лучше.
-
Узнайте все о структуре ЕГЭ и научитесь работать с КИМами.
-
Начинайте готовиться заранее. Но если получилось так, что осталось мало времени, составьте новый экспресс-план с помощью вашего преподавателя.
-
Ведите календарь подготовки к экзамену. Отмечайте на нем запланированные темы, разные методики, занятия у репетитора, пробные ЕГЭ и самоподготовку.
-
Распределяйте время на темы, исходя из ваших знаний. Больше учите то, что «западает», остальное — повторяйте.
-
Советуйтесь с учителем. Это может быть ваш преподаватель по химии или репетитор. Круто, если он сможет поделиться с вами опытом подготовки к ЕГЭ.
-
Заботьтесь о своем здоровье, не забывайте отдыхать, не лишайте себя живого общения. Все это может сказаться на вашем самочувствии, а значит, и баллах тоже.
Если вы хотите сдать ЕГЭ по химии на 100 баллов, советуем тщательно продумать, как вы будете готовиться к нему. Лучший из них — совмещать самостоятельную работу и дополнительные занятия.
На курсах подготовки к ЕГЭ по химии в Skysmart школьники отрабатывают все типы задач и разбирают критерии оценок. Для каждого из них мы составляем индивидуальный план, который приведет к нужным баллам. Он учитывает уровень знаний ученика и время до экзамена, что позволяет «выжать» максимум из подготовки. А еще мы рассказываем о ЕГЭ без «страшилок» и прикрас, чтобы школьник точно знал, что его ждет на экзамене. Ждем на первом бесплатном занятии!
Химия — один из самых сложных предметов для сдачи ЕГЭ. Задания меняются каждый год: то, что раньше казалось трудным, нынешние выпускники должны успевать за пару минут. Несмотря на это экзамен необходим будущим врачам, фармацевтам и, конечно же, химикам. Давайте обсудим, как устроен ЕГЭ по химии 2023 и что нужно выучить для успешной сдачи!
Структура ЕГЭ по химии 2023
ЕГЭ по химии состоит из двух частей. В первой выпускникам предлагают решить 28 заданий — нужен краткий ответ в виде одного числа или последовательности чисел. Во второй части — 6 заданий с развернутым ответом. В них нужно записывать уравнения химических реакций и решать сложные математические задачи. Если выполнить работу без ошибок, можно набрать 56 первичных баллов.
Нововведение ЕГЭ по химии 2023 — сокращение количества заданий и появление новых прототипов.
Изменения в ЕГЭ по химии 2023
Задание № 23. В прошлом году ребята впервые решали задание на расчет равновесных и исходных концентраций. Оно представляло собой уравнение химической реакции, а также таблицу с концентрациями каждого участника. В этом году таблицы не будет, вместо нее предлагается найти исходные данные в тексте. Советуем вам не отходить от уже отработанного алгоритма и самостоятельно составлять таблицы. Немного практики и навык владения калькулятором помогут получить за этот номер максимальные баллы даже с новым условием.
Задания № 9, 12 и 16. Эти задания не изменились на вид. В №9 и 16 предстоит разобраться с небольшими цепочками превращений – неорганической и органической соответственно. А в задании 12 выпускников вновь ожидают химические свойства органических веществ и неизвестное количество правильных ответов. Но в этом году задания станут сложнее, их переносят в разряд заданий повышенного уровня сложности. К сожалению, при неизменном 1 балле за каждый из номеров.
Задания № 33 и 34. Каждый выпускник накануне ЕГЭ по химии очень хочет знать, чему будут посвящены задачи 33 и 34. Конечно же, тайну нам не открыли, но зато эти задания поменяли местами. Теперь №33 – это задача на установление органической формулы, а №34 – сложная расчетная задача, основанная на неорганических превращениях.
Задание № 32. Эта органическая цепочка существенно не изменилась, ребятам предстоит записать пять уравнений химических реакций. Но стоит обратить пристальное внимание на изображение гексана, с такими формулами мы в ЕГЭ еще не сталкивались, но есть вероятность, что видеть их мы теперь будем чаще.
Это главные изменения ЕГЭ по химии 2023. Но для того, чтобы получить высокий балл, просто знать о них недостаточно. Когда ФИПИ обновляет формулировки заданий, может измениться и способ их решения и критерии оценивания. Если не учитывать это во время подготовки к ЕГЭ, то можно потерять немало баллов. Обидно!
Это — лишь малая часть ловушек экзамена, которые составители расставляют выпускникам. На своих занятиях по подготовке ЕГЭ по химии я показываю ученикам их все. Мы учимся обходить каждую из них и делать такие решения заданий, к которым никто не придерется. А еще я всегда делюсь лайфхаками быстрого и правильного решения типичных задач — так можно сэкономить много времени на более сложные вещи.
Всему этому я могу научить и вас! Приходите ко мне на уроки, и я подготовлю вас к ЕГЭ по химии на 80+ 💪🤓
Какие темы есть в ЕГЭ по химии?
Чтобы успешно сдать ЕГЭ по химии 2023, нужно освоить пять разделов этой науки.
Теоретические основы химии
Этот блок включает в себя информацию о строении атомов, об их существовании в молекулах вещества. Выпускникам нужно продемонстрировать навыки работы с таблицей химических элементов Д.И. Менделеева. Этот раздел поможет решить задания 1-4, 18-20, 23 в первой части, а также задание 29 во второй части.
Неорганическая химия
Этой теме посвящены задания 5-9, 17, 21 (первая часть), 30, 31 (вторая часть). Вас ждут любые свойства неорганических соединений: от простых веществ-металлов и неметаллов до комплексных солей и кристаллогидратов. Чтобы получить высокие баллы, необходимо также знать правила номенклатуры, способы получения и основы процессов гидролиза и электролиза.
Органическая химия
В заданиях 10-16 и 32 вы столкнетесь с органической химией. Ученики, которые готовятся самостоятельно, часто стараются выучить все классы веществ по стандартному плану: название класса, номенклатура, физические и химические свойства, способы получения и применение. На самом деле можно значительно облегчить себе жизнь и начать со строения органических молекул. Как только вы поймете, что кратные связи можно разорвать одним набором реактивов, в группе –ОН замещают атом водорода, а –NH2 группа реагирует с кислотами, классы органических веществ и их реакции покажутся однотипными.
Химия и жизнь
Название этого раздела кажется простым и понятным. К сожалению, именно здесь ученики чаще всего теряют баллы. В задании 24 необходимо мысленно представить эксперимент и написать, что произойдет при смешивании заданных веществ. Например, может выпасть осадок, выделиться газ, а может вообще ничего не произойти. В задании 25 нужно определить, где используют то или иное химическое соединение. Ответом может быть химическая промышленность, медицина, сельское хозяйство и, конечно, повседневная жизнь человека.
Решение расчетных задач
Очень важная часть экзамена по химии. В заданиях 26, 27 и 28 в первой части нужно дать ответ в виде числа, не записывая решение. Обычно эти задачи решаются в одно действие — они проверяют не знания химических процессов, а навыки работы с калькулятором.
Задание 34, по мнению многих учеников — самое сложное во всем экзамене. Чтобы его решить, нужно знать химические свойства веществ, уметь составлять причинно-следственные связи в химических системах, понимать, какие вещества реагируют без остатка и почему. Кроме того, в последние годы все чаще встречаются задачи, которые необходимо решать с помощью линейных уравнений или их систем.
В задаче 32 нужно выполнить расчеты, которые позволят установить молекулярную формулу некоторого органического вещества. Далее, используя описание, необходимо представить эту формулу в структурном виде, показывая связи между атомами. Обязательно запишите в ответе уравнение реакции, о которой идет речь в условии!
Как подготовиться к ЕГЭ по химии 2023?
По структуре экзамена видно, что вам придется повторить или освоить заново весь курс химии за год. С какой темы начать? За что взяться в первую очередь?
Скачайте кодификатор по химии 2023 года. Обычно он находится вместе в демоверсией. В этом документе перечислены все темы, которые необходимо хорошо подготовить. Этот перечень охватывает все задания ЕГЭ, в нем нет ничего лишнего.
Подружитесь с таблицами. Периодическая система химических элементов Д. И. Менделеева, таблица растворимости кислот, солей и оснований, ряд активности металлов – это отличные шпаргалки, которые раздают вместе с вариантами на ЕГЭ. Если правильно ими воспользоваться, можно не только понять, протекает ли реакция между веществами, но даже установить среду раствора, силу кислоты и цвет осадка. И это еще не все!
Грамотно распределите время. Учите теорию, но и не забывайте практиковаться. Если вы не нарешаете тренировочных вариантов, время может сыграть злую шутку на реальном экзамене. 210 минут не хватает на размышления, решения, красивую запись и перепроверку. Необходимо работать в хорошем темпе!
Не оставляйте подготовку на конец года. Несмотря на распределение заданий по разделам химии, старайтесь решать их с самого начала подготовки, постепенно усложняя условия. И помните, что задачи второй части ЕГЭ оцениваются по критериям. Даже если вы не знаете, как решить задание полностью, вы всегда можете заработать 1-2 первичных балла, записав без ошибок уравнения химических реакций и проведя простейшие расчеты.
Прорешивайте как можно больше заданий. Это, пожалуй, самый главный совет. Чем больше вы будете тренироваться и решать типовые задачи, тем выше шансы получить на экзамене высокий балл. Все потому, что вы поймете алгоритм решения и сможете находить правильный ответ намного быстрее, чем другие выпускники.
Когда я готовлю к ЕГЭ по химии в MAXIMUM Education, мы посвящаем немало времени решению всех заданий экзамена. Мы разбираем все части экзамена и учимся правильно оформлять ответы, чтобы не потерять ни одного балла. Чтобы проверить, все ли понятно ученикам, я провожу срезы знаний и даже пробный экзамен. После него я разбираю ошибки с каждым учеником отдельно, и дополнительно объясняю сложные темы.
После такой подготовки мои выпускники пишут настоящий экзамен уверенно и получают высокие баллы. Точно выше среднего балла по стране 🙃 Хотите так же? Приходите на мои занятия, и я научу вас всему, что знаю!
Общая и неорганическая химия
По итогам прошлого года можно выделить задания, в которых большинство выпускников допустили ошибки. Из блока «Общая и неорганическая химия» это задания 19, 20, 24, 30, 31, 32 (соответственно, № 17, 18, 22, 29, 30, 31 в нумерации 2022 года).
Задание «Классификация химических реакций в неорганической и органической химии»
Большие трудности вызвало выполнение задания «Классификация химических реакций в неорганической и органической химии». Вероятная причина снижения результативности — изменение формы ответа: вместо фиксированных двух ответов необходимо выбрать все правильные (а их число может быть от двух до четырех).
При выполнении этого задания нужно внимательно анализировать каждое предложенное утверждение, а иногда подбираться к ответу от обратного: «это утверждение точно неверно».
Обратите внимание, что в ЕГЭ 2022 года таких заданий с открытым ответом стало три: №12, №17, №18.
Задание «Скорость химической реакции, ее зависимость от различных факторов»
По-видимому, та же причина привела и к низкой результативности выполнения задания «Скорость химической реакции, ее зависимость от различных факторов» (№18 в новом формате ЕГЭ). При выполнении нужно помнить, что все факторы, влияющие на скорость реакции, условно можно отнести к левой части уравнения. То есть продукты реакции на скорость не влияют никак. Важно не путать скорость реакции и смещение равновесия, помнить, что слово «катализатор» относится к скорости, но никак не к равновесию. А при повышении температуры реакция всегда идет с большей скоростью.
Павел Лисицын/РИА Новости
Задание «Обратимые и необратимые химические реакции. Химическое равновесие и его смещение под действием различных факторов»
Задание №22 — это задание на соответствие, то есть к каждому фактору нужно подобрать направление смещения равновесия.
Особые сложности вызывает анализ ответной реакции равновесной системы на внешнее воздействие, если это воздействие вызвано добавлением твердых веществ в растворы. В этом случае в растворе появляются дополнительные ионы, способные влиять на состояние химического равновесия. Здесь речь идет о факторе «концентрация». Но важно понять, будет ли менять концентрацию добавленное вещество.
Если в систему вносят нерастворимое вещество, то оно никак не смещает равновесие. Точно так же не смещает равновесие и растворимое вещество, если оно не принимает участия в реакции.
Но если растворимое вещество в своем составе содержит те же ионы, какие есть в уравнении, то нужно смотреть, с какой стороны увеличивается их концентрация, а равновесие, соответственно, смещается в другую сторону.
И еще один случай, когда добавленное растворимое вещество смещает равновесие — если оно реагирует с ионами, которые находятся в обратимой реакции, и уменьшает их концентрацию.
Задание «Реакции окислительно-восстановительные»
В задании №29 нужно продемонстрировать умение составлять уравнение окислительно-восстановительной реакции с учетом коэффициентов и электронный баланс к этой реакции. Но часто участники экзамена баланс не засчитывают, так как он составлен к уравнению, не отвечающему условиям задания.
Также выпускники допускают традиционные ошибки:
• неверно выбирают окислитель и восстановитель для реакции;
• записывают уравнения несуществующих химических реакций, которые теоретически не противоречат окислительно-восстановительным превращениям, но практически не осуществимы;
• записывают уравнения реакций, которые не отвечают условиям задания;
• не учитывают характер среды и возможные взаимодействия между продуктами (например, кислота+щелочь) или продуктов с исходными веществами.
При выполнении этого задания нужно учитывать, что не допускается использовать воду в качестве реагента, так как это оговорено в условии задания.
Баллы снимаются, если в балансе неверно определены или записаны степени окисления (сначала пишется знак, а потом цифра).
Также частая ошибка — это неверно записанные процессы окисления и восстановления и, соответственно, неверно определенные окислитель и восстановитель.
Помните: окислитель-грабитель окисляет, забирает электроны, понижает свою степень окисления. Досадной ошибкой, лишающей балла, становится отсутствие множителей в балансе, без которых не будет и самого баланса. Ведь баланс — это равенство, которое должно заключаться в том, что число отданных электронов равно числу принятых. Без множителей запись будет неверной.
Aleksander Polyakov/Global Look Press
Задание «Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. Реакции ионного обмена»
В задании №30 сразу снижает результативность, если в списке веществ для проведения реакции ионного обмена появляются кислые соли.
Следует придерживаться такого принципа: если для реакции взяли кислую соль, в продуктах никогда не получится основание, так как любая кислая соль будет сразу реагировать с основанием.
Если вы будете контролировать себя таким образом, это поможет вам избежать ошибок.
Выпускники часто допускают следующие типичные ошибки:
• неверно выбирают реагенты, например, выбирают вещества, взаимодействие которых не удовлетворяет условиям протекания реакций ионного обмена до конца;
• не сокращают коэффициенты в сокращенном ионном уравнении;
• неверно записывают формулы ионов;
• неправильно определяют и записывают заряды ионов (записывать нужно так, как в таблице растворимости: сначала цифру, потом знак).
Задание «Реакции, подтверждающие взаимосвязь классов неорганических веществ»
При выполнении задания №31 школьники часто невнимательно читают описание конкретного химического эксперимента. Следовательно, неверно записывают продукты реакции, что приводит к нарушению отражения генетической связи, идея которой заложена в задании.
Например, при смешивании твердых гидроксида натрия и иодида аммония и дальнейшем нагревании образуется только газообразный аммиак (гидрат не образуется!)
Часто не учитываются специфические свойства представителей различных классов неорганических веществ, например, соединений хрома, алюминия. Уравнение считается записанным неверно, если в нем пропущен даже один коэффициент, или ошибочно записан хотя бы один индекс в формуле. К сожалению, типичной является ошибка, когда вместо формулы сульфита пишут сульфид. Учите номенклатуру!
Комбинированная расчетная задача
Традиционно самым сложным заданием с самым низким процентом выполнения является комбинированная расчетная задача (№33).
Она сложная, ее выполнение требует целого комплекса знаний и умений, в том числе:
• умения анализировать условия;
• понимать суть химических процессов, отраженных в условии;
• составлять уравнения химических реакций (согласно данным условия задачи), необходимых для выполнения стехиометрических расчетов;
• выстраивать алгоритм решения веществ, выполнять расчеты, необходимые для нахождения ответа;
• логически обосновывать все этапы решения.
Кроме того, участники экзамена часто допускают арифметические ошибки, не указывают размерности физических величин, путаются в обозначениях.
Немаловажное значение имеет грамотная запись данных, извлеченных из условия задания, которая отражает обоснованный логический подход к решению задачи. Но многие выпускники этого не делают.
Если во время подготовки к экзамену вы чувствуете, что не можете решить ни одну из задач подобного типа, может быть, лучше уделить больше внимания другим заданиям?
Органическая химия
В блоке «Органическая химия» наибольшее число ошибок было допущено в заданиях №11 (Гомология и изомерия. Гибридизация), №13 (Свойства азотсодержащих органических веществ), №32 (Взаимосвязь органических веществ), №34 (Установление молекулярной и структурной формулы вещества).
Aleksander Polyakov/Global Look Press
Гомология и изомерия. Гибридизация
При выполнении задания №11 помните: гомологи — это всегда представители одного класса с разным числом атомов, а изомеры могут принадлежать и к одному классу, и к разным, но общая формула, то есть число атомов, у них всегда одинаковое.
Задание, проверяющее знание свойств азотсодержащих органических веществ, часто вызывает проблемы при выполнении. Возможно, это связано с тем, что, изучая свойства кислородсодержащих веществ, школьники обращают внимание на их кислотные свойства. А с азотом все наоборот: аминогруппа проявляет основные свойства за счет не поделенной электронной пары на атоме азота. И чем больше смещена электронная плотность к азоту, тем сильнее основные свойства.
Выполняя задания, относящиеся к органической химии, следует иметь в виду, что химические свойства веществ одного класса являются способами получения веществ другого класса.
И если вы вдруг забыли, с чем реагируют спирты, то, возможно, вспомните, из чего могут быть получены альдегиды.
Внимательно читайте текст задания! Не исключено, что вы найдете в нем подсказки для себя.
Цепочка превращений органических веществ
Задание №32 из года в год вызывает типичные ошибки. Выпускники неверно записывают формулы органических веществ:
• вместо структурной появляется молекулярная формула,
• добавление лишней черточки к азоту образует несуществующий пятивалентный азот,
• бензольное кольцо отображают с указанными сверху атомами углерода.
Помимо ошибочно написанных продуктов реакции, пропускаются коэффициенты, теряются побочные продукты. А еще иногда вместо уравнения реакции бывает записана схема, а это неправильно, потому что в схеме реагенты, а иногда и побочные продукты, записаны не в строке, а над стрелочкой.
Установление молекулярной и структурной формулы вещества
При выполнении задания №34 нужно:
• установить молекулярную формулу органического вещества на основании вычислений с использованием физических величин;
• установить структурную формулу по указанным свойствам или способам получения;
• составить уравнение реакции.
Типичные ошибки здесь такие:
1. вместо молекулярной формулы выводится простейшее соотношение, не позволяющее составить правильную структурную формулу органического вещества;
2. неполный анализ условия задачи приводит к составлению не существующей, придуманной формулы без ориентации на указанные в задании свойства или способы получения вещества.
Для выполнения этой задачи необходимо знать свойства органических веществ.
При повторении органики начните с углеводородов, усвойте для себя, как особенности строения влияют на свойства веществ. Далее — кислородсодержащие. Как их можно получить из углеводородов? В чем проявляется окисление кислородсодержащих веществ по ряду спирт-альдегид-кислота?
Окисление в органике — это появление в молекуле атомов кислорода и двойной связи перед ним.
Свойства азотсодержащих органических веществ
Повторяя свойства азотсодержащих, помните, что аминогруппа — основание. А если в аминокислотах присутствует и аминогруппа, и карбоксильная группа, значит, они являются амфотерными соединениями и реагируют как с кислотами, так и с основаниями.
Поскольку самое главное, что определяет свойства органических веществ, — это их строение, запомните, что реакции идут по функциональным группам или по особенностям связи (одинарные связи алканов позволяют протекать только реакциям замещения, а кратными связями обусловлены реакции присоединения).
Таким образом, при подготовке к экзамену по химии важно уметь выделять нужную информацию, анализировать ее и фиксировать этапы решения задачи.
Полезные ссылки для подготовки к ЕГЭ по химии
• Чтобы хорошо сдать экзамен по химии нужно готовиться, повторять теорию и выполнять практические задания. Найти их можно в открытом банке заданий на сайте Федерального института педагогических измерений.
• Полезными будут и записи вебинаров по разбору заданий ЕГЭ на сайте РЦОИ города Москвы.
• Другой вид подготовки — диагностика в формате ЕГЭ. Проверить свои знания и потренироваться в заполнении экзаменационных бланков школьники могут в Центре независимой диагностики Московского центра качества образования. Записаться на них можно в разделе Центра на сайте МЦКО.
• Кроме того, в Библиотеке «Московской электронной школы» есть виртуальная лаборатория по химии, в которой учащиеся могут проводить безопасные научные опыты с помощью компьютера или планшета, а затем использовать полученные знания на практике. Также выпускники могут проходить неограниченное количество раз самодиагностику.
Муниципальное
бюджетное общеобразовательное учреждение
средняя
общеобразовательная школа села Индерка Сосновоборского района Пензенской
области
Мастер-класс
для учеников 11 класса
«МЕТОДИКА
ПОДГОТОВКИ УЧАЩИХСЯ
К
ВЫПОЛНЕНИЮ ЗАДАНИЙ 32
ЕГЭ
ПО ХИМИИ
С
ПОМОЩЬЮ ХИМИЧЕСКОГО ЭКСПЕРИМЕНТА»
Составитель:
учитель химии и биологии МБОУСОШ с.Индерка Сосновоборского района Абдряхимова
Гузяль Зиннятовна
2020
г
Индерка
Цель мастер-класса:
помочь учащимся осознать сущность
химических операций (действий) и научить ориентироваться в физических свойствах
веществ.
Оборудование и реактивы:
компьютерная презентация, лабораторный штатив, штатив для пробирок, воронка,
фарфоровая чашка, пробиркодержатель , стеклянная палочка, ложка для сухих
веществ, пробирки, растворs CuSO4,
NaOH,
HCl,
Na2CO3,AlCl3,
(NH4)2Cr2O7,
AgNO3
, BaCI2
, колба с водой, фильтровальная бумага
Ход
мастер-класса.
Эпиграфом к нашему
мастер- классу я взяла слова Дмитрия Ивановича Менделеева «Всё учение химии
состоит в учении о свойствах элементов — цель и задача — превратить один в
другой — это будет дальше»
Что лежит у вас на
партах? Имея всё это, как вы думаете, чем мы будем сегодня заниматься? А какое
именно задание ЕГЭ по химии предполагает эксперимент с имеющимися веществами?
Как вы определите тему нашего занятия.
Верно, тема нашего
мастер-класса «Методика выполнения задания 32 с помощью химического
эксперимента.
А какую цель вы
ставите перед собой на этом занятии?
В блок
«неорганическая химия» входит задание 32. Оно высоко уровня сложности. Решив
его правильно вы можете получить 4 первичных балла. Это задание на понимание
взаимосвязи неорганических веществ. От вас дорогие школьники требуется сделать
мысленный эксперимент. Но, я не устаю вам повторять, что мысленный эксперимент
возможен только тогда, когда вы научились делать этот эксперимент практически.
Без наших химических опытов, где вы практически учите цвета, запахи веществ,
мысленный эксперимент сделать только выучив цвета осадков очень сложно.
Итак,
давайте приступим. Но в начале вспомним правила техники безопасности. Вспомните
правила технике безопасности при работе со спиртовкой, с растворами кислот и
щелочей
Прочитайте
внимательно задание. Приступайте к выполнению опытов
Опыт 1.
К раствору сульфата меди (II)
добавьте раствор гидроксида натрия. Отделите выпавший осадок от раствора
сульфата натрия. Просушите осадок. Перенесите его в фарфоровую чашку и нагрейте
над пламенем спиртовки. Полученное вещество растворите в соляной кислоте. По
результатам проведения опытов выполните нижеприведённые задания.
Задание 1. Заполните таблицу.
Физическое свойство веществ.
|
Вещество. |
Формула |
Физические свойства. |
|
Гидроксид меди (II) |
Cu(OH)2 |
Нерастворим в воде, голубого цвета. |
|
Оксид меди(II) |
CuO |
Порошок чёрного цвета. |
|
Хлорид меди(II)-раствор |
CuCl2 |
Цвет от зелёного до светло-голубого (в |
Задание
2. Ответьте на вопросы.
а) Что такое фильтрование? (Фильтрование
– способ разделения неоднородных смесей с помощью фильтров – пористых
материалов, пропускающих жидкость или газ, но задерживающих твёрдые вещества.)
б) Что такое фильтрат? (При разделении
смесей, содержащих жидкую фазу, на фильтре остаётся твёрдое вещество, через
фильтр проходит фильтрат.)
в) Что такое прокаливание? (Прокаливание
– нагревание вещества с целью изменения его химического состава.)
Задание 3. На основе текста, приведённого в опыте
1, составьте цепочку превращений и напишите уравнения соответствующих реакций.
+NaOH
t +HCI
Cu(NO3)2
® Cu(OH)2 ® CuO ® CuCI2
Опыт 2.Раствор карбоната калия
прореагировал с раствором хлорида алюминия. Что получится при их
взаимодействии? А теперь внимание обратите на таблицу растворимости. Если такая
соль. Давайте охарактеризуем соли. Каким основанием и какой кислотой они
образованы? Мы с вами не давно пошли тему « Гидролиз солей». В заданиях типа
32 много заданий на совместный гидролиз солей. Давайте мы с вами выполним этот
опыт. Что вы наблюдаете? Напишите уравнение совместного гидролиза.
Опыт 3 Красивые и опасные опыты с
дихроматами. Следующие опыты вы только пронаблюдаете.
Дихромат аммония является токсичной, канцерогенной,
аллергенной солью. Вдыхание пыли приводит к онкологическим заболеваниям.
Раздражает кожу и дыхательные пути, оказывает разъедающее действие на глаза.
При попадании в ЖКТ или легкие всасывается в организм и может оказывать
действие на почки и печень, приводя к поражению почек при длительном
воздействии. Зрелищный опыт «Вулкан» запрещен к воспроизведению в
школах. Внимание на экран. Что выделяется во время опыта? Девочки будьте
внимательнее. В заданиях типа 32 этот опыт описывают так:
Твёрдое
вещество, образовавшееся при разложении дихромата аммония, растворили в
концентрированной щёлочи. При добавлении брома к полученному раствору последний
приобрёл жёлтый цвет, а после подкисления серной кислотой – оранжевый. Напишите
уравнения четырёх описанных реакций.
Очень зрелищная самоподдерживаемая
экзотермическая реакция разложения дихромата аммония — «вулкан Бёттгера»:
(NH4)2Cr2O7
→ Cr2O3 + N2↑
+ 4H2O
3.2. Превращение дихроматов в хроматы и
наоборот.
- Щёлочи
переводят дихромат в хромат:
(NH4)2Cr2O7 + 2NaOH → Na2CrO4 + (NH4)2CrO4 + H2O
Наливаем в пробирку с дихроматом аммония который у вас уже
находится в пробирках раствор гидроксида натрия. Что вы наблюдаете? Запишите
ваши наблюдения в таблицу.
·
Кислоты переводят хроматы
К вашему раствору добавляем соляную кислоту. При подкислении раствора
цвет изменится на оранжевый, отвечающий дихромат-аниону Cr₂O₇²⁻:
Na2CrO₄ + 2HCl = Na2Cr₂O₇ + H₂O
- Качественная реакция на дихромат-анион Cr₂O₇²⁻.
При добавлении к раствору дихромата
раствора соли серебра образуется осадок красного цвета Ag₂Cr₂O₇:
2Ag +Cr₂O₇²⁻ = Ag₂Cr₂O
·
Качественная
реакция на хромат-анион CrO₄²⁻. При добавлении к раствору хромата раствора солей бария выпадает желтый
осадок хромата бария BaCrO₄, разлагающегося в сильнокислой среде:
Ba²⁺ + CrO₄²⁻ = BаCrO₄↓
Растворы хроматов окрашены в желтый
цвет. Осадок не растворяется в азотной кислоте.
|
Уравнение реакции |
Наблюдение |
|
Na2CrO4+ |
После проведения
химических экспериментов можно приступать к выполнению заданий. Ваше домашнее
задание находится в технологической карте. В рабочих тетрадях напишите
уравнения реакций . В окислительно-восстановительных реакциях определите
окислитель и восстановитель. В реакциях ионного обмена напишите сокращенное
ионное уравнение.
1. Твёрдое вещество, образовавшееся при разложении
дихромата аммония, растворили в концентрированной щёлочи. При добавлении брома
к полученному раствору последний приобрёл жёлтый цвет, а после подкисления
серной кислотой – оранжевый. Напишите уравнения четырёх описанных реакций.
2.
Железо растворили в разбавленной азотной
кислоте. К полученному раствору добавили избыток раствора карбоната
натрия. Выделившийся осадок отфильтровали и прокалили. Полученное
вещество растёрли в мелкий порошок вместе с алюминием и смесь
подожгли. Она сгорела с выделением большого количества теплоты. Напишите
уравнения четырёх описанных реакций.
Занятие наше подходит к концу. Какую цель
мы ставили перед собой в начале работы?
Достигли ли мы ее?
Что нужно для выполнения задания 32 на ЕГЭ
по химии?
Закончить
наш мастер-класс хочется словами Жюля Ренара «Человек, которому повезло, — это
человек, который делал то, что другие только собирались сделать.» Все в ваших
руках. Желаю удачи.



.jpg)
.jpg)