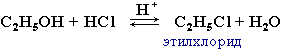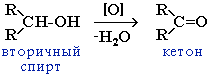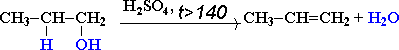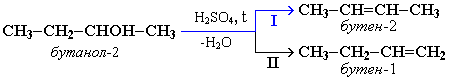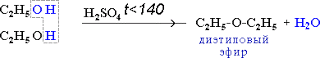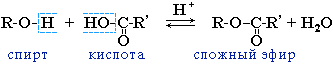Применение веществ в быту и промышленности. ЕГЭ по химии.
Ниже представлены вещества, применение которых на ЕГЭ по химии спрашивается наиболее часто
| Нитрат натрия Нитрат калия Нитрат аммония |
Азотсодержащие удобрения (селитры). |
| Фосфат кальция Гидрофосфат кальция Суперфосфат |
Фосфорные удобрения |
| Оксид кремния (IV) | Производство керамических изделий. |
| Пальмитат натрия/калия Стеарат натрия/калия |
Мыла Натриевые соли высших карбоновых кислот – твердые мыла, а калиевые соли высших карбоновых кислот – жидкие мыла. |
| Сера | Используется при производстве резины. Для этого серу нагревают (вулканизируют) с каучуком. |
| Гидрокарбонат натрия. | Твердое вещество, использующееся в качестве разрыхлителя теста, а также в качестве чистящего средства. |
| Карбонат аммония | Используется как разрыхлитель теста благодаря тому, что при нагревании образует газообразные продукты разложения в соответствии с уравнением: (NH4)2CO3 => 2NH3 + CO2 + H2O |
| Этановая (уксусная) кислота | Используется для консервирования овощей. Концентрированные растворы вызывают ожоги. |
| Активированный уголь | Твердое вещество черного цвета используется в качестве поглотителя (адсорбента) в фильтрах, а также как лекарственное средство при различных видах отравлений. |
| Этанол (этиловый спирт). C2H5OH |
Основной компонент алкогольных напитков, может быть использован в качестве топлива. Жидкость со специфическим запахом. |
| Глицерин | Используется в парфюмерии и пищевой промышленности. |
| Ацетон | Распространенный растворитель. |
| Тетрахлорид углерода CCl4 | Растворитель. |
| Аммиак | Сырье для получения удобрений (нитратов калия, натрия, аммония). Сырье для получения азотной кислоты. |
| Аммиак раствор | Используется как компонент стеклоочистительных жидкостей, жидкость с резким запахом. В аптечке – нашатырный спирт, применяется для приведения в чувство человека, потерявшего сознание. |
| Озон O3 | Дезинфекция (очистка) воды. |
| Хлор Cl2 | Дезинфекция (очистка) воды. |
| Ацетилен C2H2 | Используется для сварки и резки металла благодаря тому, что при горении ацетилена развивается крайне высокая температура – около 3000 оС |
| Метан | Основной компонент природного газа. Горючее для газовых плит. |
| Лимонная кислота | Используется для удаления накипи с внутренней поверхности чайника. |
| Пероксид водорода | Используется в качестве антисептика (дезинфицирующего средства) при обработке небольших ран и порезов. |
| Хлоропрен (2-хлорбутадиен-1,3) Изопрен (2-метилбутадиен-1,3) Бутадиен (дивинил) |
Сырье для производства каучука. |
| Йод | Спиртовой раствор данного вещества используется для дезинфекции мелких порезов и царапин. |
| Анилин | Производство красителей |
Чтобы поделиться, нажимайте

МЕТАНОЛ (древесный спирт) – жидкость (tкип=64,5; tпл=-98; ρ = 0,793г/см3), с запахом алкоголя, хорошо растворяется в воде. Ядовит – вызывает слепоту, смерть наступает от паралича верхних дыхательных путей.
ЭТАНОЛ (винный спирт) – б/цв жидкость, с запахом спирта, хорошо смешивается с водой.
Первые представители гомологического ряда спиртов — жидкости, высшие — твердые вещества. Метанол и этанол смешиваются с водой в любых соотношениях. С ростом молекулярной массы растворимость спиртов в воде падает. Высшие спирты практически нерастворимы в воде.
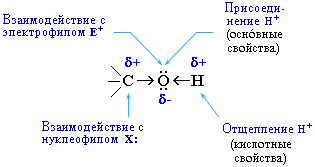
В химических реакциях гидроксисоединений возможно разрушение одной из двух связей:
· С–ОН с отщеплением ОН-группы
· О–Н с отщеплением водорода
Это могут быть реакции замещения, в которых происходит замена ОН или Н, или реакция отщепления (элиминирования), когда образуется двойная связь.
Полярный характер связей С–О и О–Н способствует гетеролитическому их разрыву и протеканию реакций по ионному механизму. При разрыве связи О–Н с отщеплением протона (Н+) проявляются кислотные свойства гидроксисоединения, а при разрыве связи С–О – свойства основания и нуклеофильного реагента.
С разрывом связи О–Н идут реакции окисления, а по связи С–О – восстановления.
Таким образом, гидроксисоединения могут вступать в многочисленные реакции, давая различные классы соединений. Вследствие доступности гидроксильных соединений, в особенности спиртов, каждая из этих реакций является одним из лучших способов получения определенных органических соединений.
I. Кислотно-основные
RO— + H+ ↔ ROH ↔ R+ + OH—
алкоголят-ион
Кислотные свойства уменьшаются в ряду, а основные возрастают:
вода первичный вторичный третичный
Кислотные свойства
С активными щелочными металлами:
2C2H5OH + 2 Na → 2C2H5ONa + H2
этилат натрия
Алкоголяты подвергаются гидролизу, это доказывает, что у воды более сильные кислотные свойства
C2H5ONa + H2O ↔ C2H5OH + NaOH
Основные свойства
С галогенводородными кислотами:
C2H5OH + HBr H2SO4(конц)↔ C2H5Br + H2O
бромэтан
Лёгкость протекания реакции зависит от природы галогенводорода и спирта – увеличение реакционной способности происходит в следующих рядах:
первичные < вторичные < третичные
II. Окисление
1). В присутствии окислителей [O] – K2Cr2O7 или KMnO4 спирты окисляются до карбонильных соединений:
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот.
При окислении вторичных спиртов образуются кетоны.
Третичные спирты более устойчивы к действию окислителей. Они окисляются только в жестких условиях (кислая среда, повышенная температура), что приводит к разрушению углеродного скелета молекулы и образованию смеси продуктов (карбоновых кислот и кетонов с меньшей молекулярной массой).
В кислой среде:
Для первичных и вторичных одноатомных спиртов качественной реакцией является взаимодействие их с кислым раствором дихромата калия. Оранжевая окраска гидратированного иона Cr2O72- исчезает и появляется зеленоватая окраска, характерная для иона Cr3+ . Эта смена окраски позволяет определять даже следовые количества спиртов.
CH3— OH + K2Cr2O7 + 4H2SO4 → CO2 + K2SO4 + Cr2(SO4)3 + 6H2O
3CH3-CH2-OH + K2Cr2O7 + 4H2SO4 → 3CH3COH + K2SO4 + Cr2(SO4)3 + 7H2O
В более жёстких условиях окисление первичных спиртов идёт сразу до карбоновых кислот:
3CH3-CH2-OH + 2K2Cr2O7 + 8H2SO4 t→ 3CH3COOH + 2K2SO4 + 2Cr2(SO4)3 + 11H2O
Третичные спирты устойчивы к окислению в щелочной и нейтральной среде. В жёстких условиях (при нагревании, в кислой среде) они окисляются с расщеплением связей С-С и образованием кетонов и карбоновых кислот.
В нейтральной среде:
CH3 – OH + 2KMnO4 →K2CO3 + 2MnO2 + 2H2O, а остальные спирты до солей соответствующих карбоновых кислот.
2). Качественная реакция на первичные спирты!
3). Горение (с увеличением массы углеводородного радикала – пламя становится всё более коптящим)
CnH2n+1-OH + O2 t → CO2 + H2O + Q
III. Реакции отщепления
1) Внутримолекулярная дегидратация
CH3-CH2-CH(OH)-CH3 t>140,H2SO4(к)→ CH3-CH=CH-CH3 + H2O
бутанол-2 бутен-2
В тех случаях, когда возможны 2 направления реакции, например:
дегидратация идет преимущественно в направлении I, т.е. по правилу Зайцева – с образованием более замещенного алкена. Правило Зайцева: Водород отщепляется от наименее гидрированного атома углерода соседствующего с углеродом, несущим гидроксил.
2) Межмолекулярная дегидратация
2C2H5OH t<140,H2SO4(к)→ С2H5-O-C2H5 + H2O
простой эфир
— при переходе от первичных спиртов к третичным увеличивается склонность к отщеплению воды и образованию алкенов; уменьшается способность образовывать простые эфиры.
3) Реакция дегидрирование и дегидратация предельных одноатомных спиртов – реакция С.В. Лебедева
2C2H5OH 425,ZnO,Al2O3→ CH2=CH-CH=CH2 + H2 + 2H2O
IV. Реакции этерификации
Спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).
Получение спиртов
I. В промышленности
1. Из водяного газа (получение метанола – древесный спирт)
CO + 2H2 t,p → CH3OH
2. Брожение глюкозы (получение этанола)
C6H12O6 дрожжи → 2C2H5OH + 2CO2
3. Гидратация алкенов
II. В лаборатории
Взаимодействие галогеналканов R-Г с водными растворами щелочей
CH3Cl + NaOH t, водн.р-р.→ CH3OH + NaCl (р. обмен)
Применение спиртов
Метанол CH3OH (метиловый спирт)
— производство формальдегида, муравьиной кислоты;
— растворитель.
Этанол С2Н5ОН (этиловый спирт)
— производство ацетальдегида, уксусной кислоты, бутадиена,
простых и сложных эфиров;
— растворитель для красителей, лекарственных и парфюмерных средств;
— производство ликеро-водочных изделий;
— дезинфицирующее средство в медицине;
— горючее для двигателей, добавка к моторным топливам.
Область применения спиртов
Чтобы получить доступ к бесплатным материалам, пожалуйста зарегистрируйтесь.
Извините, у Вас нет прав просматривать контент!
Регистрация
Войти
Одноатомные спирты. Метанол. Этанол. Физические свойства. Физиологическое действие на организм. Применение. Многоатомные спирты. Этиленгликоль. Глицерин
Спиртами называют производные углеводородов, содержащие группу (или несколько групп) -ОН, называемую гидроксильной группой или гидроксилом.
По числу гидроксильных групп, содержащихся в молекуле, спирты делятся на одноатомные (с одним гидроксилом), двухатомные (с двумя гидроксилами), трехатомные (с тремя гидроксилами) и многоатомные.
I. Одноатомные спирты
Общая формула: CnH2n+1—OH
Простейшие представители:
Метанол (древесный спирт) СН3ОН– жидкость (tкип=64,5; tпл=-98; ρ = 0,793г/см3), с запахом алкоголя, хорошо растворяется в воде. Ядовит – вызывает слепоту, смерть наступает от паралича верхних дыхательных путей.
Метанол СН3ОН используют как растворитель, а также в производстве формальдегида, применяемого для получения фенолформальдегидных смол, в последнее время метанол рассматривают как перспективное моторное топливо. Большие объемы метанола используют при добыче и транспорте природного газа. Метанол – наиболее токсичное соединение среди всех спиртов, смертельная доза при приеме внутрь – 100 мл.
Этанол (винный спирт) С2Н5ОН– б/цв жидкость, с запахом спирта, хорошо смешивается с водой, ядовитоенаркотическое вещество.
Этанол С2Н5ОН – исходное соединение для получения ацетальдегида, уксусной кислоты, а также для производства сложных эфиров карбоновых кислот, используемых в качестве растворителей. Кроме того, этанол – основной компонент всех спиртных напитков, его широко применяют и в медицине как дезинфицирующее средство.
Применение этанола
Получение этанола:
1. Брожение глюкозы
C6H12O6 дрожжи→ 2C2H5OH + 2CO2↑
2. Гидратация алкенов
CH2=CH2 + HOH t,kat-H3PO4→ CH3-CH2-ОH
Свойства спиртов:
Спирты горят в кислороде и на воздухе, как и углеводороды:
2CH3OH + 3O2 t→ 2CO2 + 4H2O + Q
II. Многоатомные спирты
Многоатомные спирты– органические соединения, в молекулах которых содержится несколько гидроксильных групп (-ОН), соединённых с углеводородным радикалом.
Применение:
- Этиленгликоль для производства лавсана и для приготовления антифризов — водных растворов, замерзающих значительно ниже 0°С (использование их для охлаждения двигателей позволяет автомобилям работать в зимнее время).
- Глицерин широко используется в кожевенной, текстильной промышленности при отделке кож и тканей и в других областях народного хозяйства. Сорбит (шестиатомный спирт) используется как заменитель сахара для больных диабетом.
- Глицерин находит широкое применение в косметике, пищевой промышленности, фармакологии, производстве взрывчатых веществ. Чистый нитроглицерин взрывается даже при слабом ударе; он служит сырьем для получения бездымных порохов и динамита ― взрывчатого вещества, которое в отличие от нитроглицерина можно безопасно бросать. Динамит был изобретен Нобелем, который основал известную всему миру Нобелевскую премию за выдающиеся научные достижения в области физики, химии, медицины и экономики. Нитроглицерин токсичен, но в малых количествах служит лекарством, так как расширяет сердечные сосуды и тем самым улучшает кровоснабжение сердечной мышцы.
…
Одноатомные спирты являются важным сырьем в химическом производстве многих органических соединений. Так, производство только этанола составляет около 130 млн. тонн/год. Пищевой спирт получают из пищевого сырья — картофеля, зерновых культур, корнеплодов, сахарной патоки, ягод и других богатых углеводами культурами. Но существует множество способов их синтеза из непищевого сырья. Рассмотрим каково получение и применение одноатомных спиртов.
Получение одноатомных спиртов
1)Гидролиз галоидпроизводных водой при повышенных температурах протекает медленно:
R-Hal + Н-OH → R-OH + H-Hal
При применении влажной соли серебра замена галоида на гидроксил происходит быстрее:
2R-Hal + Ag2O + Н-OH → 2R-OH + 2Ag-Hal
Еще быстрее реакция протекает при применении щелочей, но осложняется протеканием побочной реакции отщепления галоидводорода с образованием алкенов:
2)Гидрирование окиси углерода в различных условиях позволяет получить как чистый метиловый спирт, так и смесь его первичных гомологов:
3) Восстановление оксосоединений водородом под действием катализаторов – Pt, Ni или других восстановителей. При этом их альдегидов получаются первичные спирты, а из кетонов – вторичные:
4) Восстановление карбоновых кислот и их производных. Широко известен метод Буво – Блана — восстановление сложных эфиров карбоновых кислот действием натрия в кипящем спирте:
5) Присоединение металлорганических соединений (магний-, литий-, цинк-, натрийорганических соединений) к альдегидам и кетонам. Наиболее часто используются магнийорганические соединения, так называемый реактив Гриньяра. При присоединении таких соединений к формальдегиду приводит к образованию первичных спиртов, к другим альдегидам – ко вторичным спиртам, а при присоединении к кетонам образуются третичные спирты:
6) Гидратация алкенов при повышенной температуре, в присутствии кислот. В зависимости от строения алкена можно получить первичные, вторичные или третичные спирты:
При действии BH3 или B2H6 на алкен также получают спирт: 7) Гидроформилирование с восстановлением позволяет получить из пропена бутанол и 2-метилпропанол в соотношении 3:1 соответственно:
При этом возможно протекание реакции димеризации масляного альдегида с получением 2-этилгексанола:
Этот способ получения спирта относится к промышленным способам.

9) Дрожжевое брожение сахаров (глюкозы, фруктозы, мальтозы и после предварительного гидролиза сахарозы) приводит к образованию этанола и углекислого газа:
Применение одноатомных спиртов
Спирты используют в качестве исходного реагента для получения важных органических соединений, необходимых в производстве растворителей, полимерных соединений, красителей и лекарственных препаратов (например, альдегидов, кетонов, карбоновых кислот простых и сложных эфиров).
Далее представлены сферы применения наиболее важных представителей класса одноатомных спиртов – метанола, этанола, бутанола, бензилового и фенитилового спиртов.
- Метанол – хороший растворитель, его используют в лакокрасочной промышленности, при производстве фенолформальдегидных смол, а также в качестве добавки к незамерзающим жидкостям и моторному топливу.
- Этанол широко применяют в медицинской практике в качестве антисептического средства; на его основе готовят различные лекарственные средства (настойки, сиропы, растворы и др.). Кроме этого он используется в производстве алкогольных напитков, в химическом синтезе органических соединений, например, ацетальдегида, уксусной кислоты, сложных эфиров карбоновых кислот.
- Бутанол чаще всего используют в качестве растворителя жиров и смол. Также из него получают сложные эфиры карбоновых кислот, обладающие приятным запахом — бутилацетат, бутилсалицилат и др. душистые вещества. Как добавка в шампунях он способствует повышению их прозрачности.
- Бензиловый и фенетиловый спирты используются в косметических средствах в качестве консерванта, а также душистого вещества. Бензиловый спирт имеет запах жасмина, а фенетиловый спирт – запах розы.
Урок №30. Получение спиртов. Применение
Получение спиртов
I.
В промышленности
1. Из водяного газа (получение
метанола – древесный спирт)
CO + 2H2 t,p
→ CH3OH
2. Брожение глюкозы (получение
этанола)
C6H12O6 дрожжи
→ 2C2H5OH + 2CO2
3. Гидратация алкенов
СH3—CH=CH2 + HOH t,kat—H3PO4→ CH3—CH—CH3 (пропанол-2)
│
OH
присоединение по правилу Марковникова
II. В лаборатории
Взаимодействие галогеналканов R-Г с водными растворами щелочей
CH3Cl + NaOH t, водн.р-р.→ CH3OH + NaCl (р. обмен)
ПРИМЕНЕНИЕ
Метанол СН3ОН – используют
как растворитель, в производстве муравьиной кислоты, а также в производстве
формальдегида, применяемого для получения фенолформальдегидных смол, в
последнее время метанол рассматривают как перспективное моторное топливо.
Большие объемы метанола используют при добыче и транспорте природного газа.
Метанол – наиболее токсичное соединение среди всех спиртов, смертельная доза
при приеме внутрь – 100 мл.
Этанол С2Н5ОН – исходное
соединение для получения ацетальдегида, уксусной кислоты, а также для
производства сложных эфиров карбоновых кислот, используемых в качестве
растворителей. Кроме того, этанол – основной компонент всех спиртных напитков,
его широко применяют и в медицине как дезинфицирующее средство.
ЦОР:
Применение метанола
Применение этанола
ТРЕНАЖЁРЫ:
Способы получения предельных одноатомных спиртов
Тестовые задания по теме «Спирты»
Задание №1:
Установите соответствие между аппаратом, который используется в химическом производстве, и процессом, происходящем в этом аппарате.
АППАРАТ:
А) печь кипящего слоя
Б) колонна синтеза
В) поглотительная башня
ПРОЦЕСС:
1) взаимодействие водорода и азота
2) окисление оксида азота(IV)
3) получение олеума
4) получение оксида серы(IV)
Решение:
Итак, рассмотрим первый пункт — печь для обжига в «кипящем слое».
Кипящий слой — это часть процесса производства серной кислоты, в которой совмещены твердая и жидкая фазы; при помощи этой технологии получают сернистый газ(SO2), ответ 4.
Колонна синтеза — это сложный аппарат, направленный на получение аммиака из водорода и азота, ответ 1.
Поглотительная башня используется при получении олеума(раствор SO3 в серной кислоте), ответ 3.
Задание №2:
Установите соответствие между осуществляемым в промышленности процессом и оборудованием, которое используется при получении серной кислоты.
ПРОЦЕСС:
А) получение сернистого газа
Б) получение олеума
В) получение оксида серы(VI)
ОБОРУДОВАНИЕ:
1) окислительная башня
2) печь «кипящего слоя»
3) контактный аппарат
4) поглотительная башня
Решение:
Получение сернистого газа сопровождается обжигом пирита(FeS) в печи «кипящего слоя», ответ 2.
Получение олеума происходит путем растворения оксида серы(SO3) в серной кислоте, сам процесс осуществляется в поглотительной башне, ответ 4.
Оксид серы(VI) получают в контактном аппарате с помощью каталитического окисления SO2, ответ 3.
Задание №3:
Установите соответствие между веществом и основной областью его применения.
ВЕЩЕСТВО:
А) стирол
Б) этиленгликоль
В) синтез-газ
ОБЛАСТЬ ПРИМЕНЕНИЯ:
1) получение полиэфиров
2) производство маргарина
3) производство метанола
4) получение пластмасс
Решение:
Стирол(винилбензол) — это гомолог бензола, имеет формулу C6H5ꟷCH=CH2, за счет наличия кратной связи способен к реакциям полимеризации, в частности, в производстве пластмасс, ответ 4.
Этиленгликоль(1,2-этандиол) — это двухатомный спирт, который используется при получении полиэфиров, так как имеет две OH группы, которые потенциально могут вступать в реакцию поликонденсации с образованием полиэтилентерефталата (наши «любимые» пластиковые бутылки), ответ 1.
Синтез-газ(CO + H2) — довольно известная смесь угарного газа и водорода, используется при промышленном способе получения метилового спирта(метанола), ответ 3.
Задание №4:
Установите соответствие между веществом и способом его попадания в окружающую среду.
ВЕЩЕСТВО:
А) углекислый газ
Б) оксиды азота
В) гексахлоран
СПОСОБ ПОПАДАНИЯ В ОКРУЖАЮЩУЮ СРЕДУ:
1) сгорание углеводородного топлива
2) борьба с насекомыми
3) протравливание семян
4) сточные воды
Решение:
Углекислый газ и оксиды азота попадают в окружающую среду путем сгорания углеводородного топлива, А и Б ответ 1.
Гексахлоран используется в качестве инсектицида, ответ 2.
Задание №5:
Установите соответствие между названием процесса переработки нефти и его результатом.
НАЗВАНИЕ ПРОЦЕССА:
А) риформинг
Б) перегонка нефти
В) крекинг
РЕЗУЛЬТАТ:
1) разделение нефти на фракции
2) получение смазочных масел
3) увеличение количества легкокипящих фракций
4) получение ароматических углеводородов
Решение:
Риформинг — это процесс переработки алифатических углеводородов в ароматические(например, бензол), здесь подходит вариант 4.
Перегонка нефти приводит к разделению ее на фракции(лигроин, мазут, бензин), ответ 1.
Крекинг — это процесс высокотемпературного расщепления нефти с получением низкомолекулярных органических соединений, ответ 3.
Задание №6:
Установите соответствие между металлом и веществом, которое используется для получения этого металла в промышленности, или способом промышленного получения.
МЕТАЛЛ:
А) железо
Б) алюминий
В) натрий
ВЕЩЕСТВО /СПОСОБ ПОЛУЧЕНИЯ:
1) красный железняк
2) электролиз раствора оксида в криолите
3) электролиз раствора поваренной соли
4) электролиз расплава поваренной соли
Решение:
Железо — в промышленности его получают из красного железняка, или гематита, который имеет формулу Fe2O3, ответ 1.
Алюминий можно получить электролизом Al2O3 в расплаве криолита, ответ 2.
Криолит, или гексафторалюминат натрия(Na3AlF6) — это необычный, редкий минерал, впервые обнаружен в Гренландии(отсюда название(криос — холод, литос — камень)), плавится при температуре 1012 С,
может растворять оксиды алюминия, что позволяет легко извлекать алюминий электролизом.
Натрий — для него здесь указано два возможных пункта, 3 и 4, однако, чистый Na можно получить только в РАСПЛАВЕ поваренной соли(NaCl), ответ 4.
Задание №7:
Установите соответствие между смесью веществ и способом разделения данной смеси.
СМЕСЬ ВЕЩЕСТВ:
А) вода и этиловый спирт
Б) вода и глина
В) вода и поташ
СПОСОБ РАЗДЕЛЕНИЯ:
1) фильтрование
2) выпаривание
3) использование делительной воронки
4) перегонка
Решение:
Первая смесь — вода и этиловый спирт, она может быть разделена перегонкой, ответ 4.
Следующая смесь — вода и глина, здесь нужно использовать фильтрование, ответ 1.
Последний ряд веществ — вода и поташ; поташ имеет формулу K2CO3, как и все соли калия, она растворима, и отделить ее от воды можно путем выпаривания, ответ 2.
Задание №8:
Установите соответствие между веществом и областью его применения.
ВЕЩЕСТВО:
А) изопропилбензол
Б) этанол
В) триолеин
ОБЛАСТЬ ПРИМЕНЕНИЯ:
1) получение полиэфиров
2) получение ацетона
3) производство маргарина
4) получение дивинила
Решение:
Первое вещество — изопропилбензол, или кумол, оно используется для получения ацетона, ответ 2.
Второе соединение — этанол, который имеет важное значение для получения дивинила, или бутадиена-1,3(это реакция Лебедева, проведенная в 1926 году, давшая начало производству синтетического каучука), ответ 4.
Последнее вещество в списке — триолеин, составной частью этого химического соединения является «олеин», что означает принадлежность к жирам, а соответственно, к получению маргарина, ответ 3.
Задание №9:
Установите соответствие между веществом и основной областью его применения.
ВЕЩЕСТВО:
А) криолит
Б) пирит
В) метилметакрилат
ОБЛАСТЬ ПРИМЕНЕНИЯ:
1) производство антифриза
2) получение алюминия
3) производство серной кислоты
4) получение органического стекла
Решение:
Криолит(Na3AlF6) используется при получении чистого алюминия путем электролиза, ответ 2.
Пирит(FeS2) является начальной составной частью производства серной кислоты, ответ 3.
Метилметакрилат(метил-2-метилпроп-2-еноат) — это сложное органическое соединение, из которого получают органическое стекло, ответ 4.
Задание №10:
Установите соответствие между веществом и областью его применения.
ВЕЩЕСТВО:
А) глицерин
Б) формальдегид
В) глюкоза
ОБЛАСТЬ ПРИМЕНЕНИЯ:
1) получение полиэфиров
2) получение взрывчатых веществ
3) хранение биологических препаратов
4) источник энергии в организме
Решение:
Глицерин, или 1,2,3 — пропантриол, это трехатомный спирт, который используется для получения нитроглицерина, являющегося составной частью взрывчатых веществ, ответ 2.
Формальдегид, или муравьиный альдегид, хорошо знаком биологам для сохранения биологических объектов в течение длительного времени, ответ 3.
Глюкоза(C6H12O6) — это моносахарид, который является источником АТФ(энергия) в организме живых существ, ответ 4.
Задание №11:
Установите соответствие между происхождением полимера и его названием.
ПРОИСХОЖДЕНИЕ ПОЛИМЕРА:
А) природный органический
Б) синтетический органический
В) искусственный органический
Название полимера:
1) сахароза
2) пенька
3) полиэфир
4) вискоза
Решение:
Природный органический полимер — из данного списка нам подходит пенька(грубое лубяное конопляное волокно), ответ 2.
Синтетический органический полимер из указанных веществ — полиэфир, ответ 3.
Искусственным органическим полимером является вискоза, ответ 4.
На сегодня все!