Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
Строение, изомерия и гомологический ряд феноло
Химические свойства спиртов
Способы получения спиртов
Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам.
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Классификация фенолов
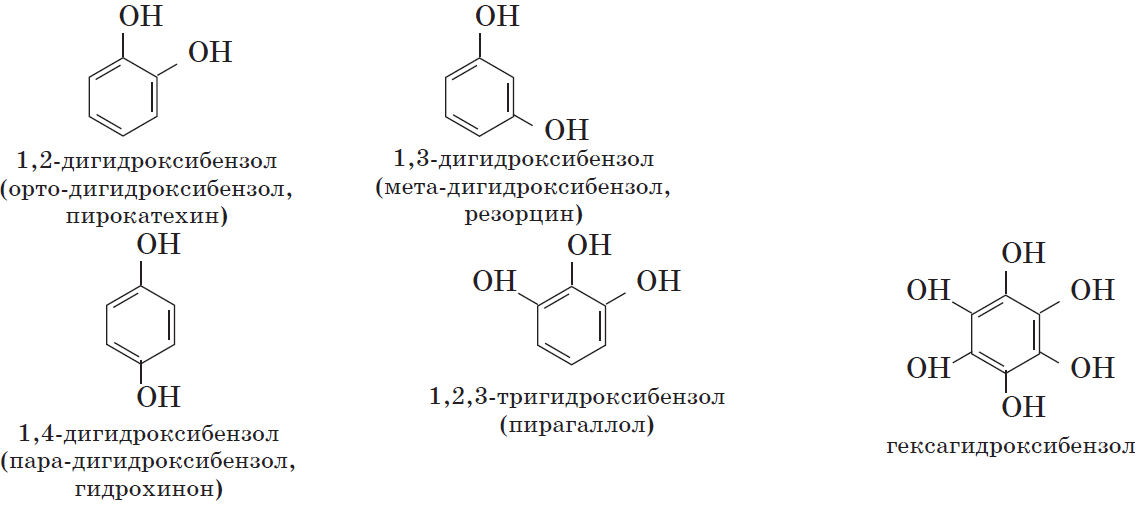
По числу гидроксильных групп:
- фенолы с одной группой ОН — содержат одну группу -ОН. Общая формула CnH2n-7OH или CnH2n-6O.
- фенолы с двумя группами ОН — содержат две группы ОН. Общая формула CnH2n-8(OH)2 или CnH2n-6O2.
Соединения, в которых группа ОН отделена от бензольного кольца углеродными атомами – это не фенолы, а ароматические спирты:
Строение фенолов
В фенолах одна из неподеленных электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца, это является главной причиной отличия свойств фенола от спиртов.
Химические свойства фенолов
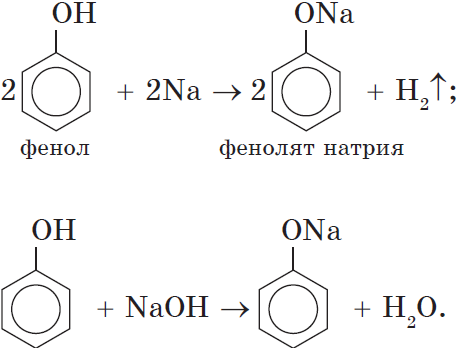
Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
Отличия:
- фенол не реагирует с галогеноводородами: ОН- группа очень прочно связана с бензольным кольцом, её нельзя заместить;
- фенол не вступает в реакцию этерификации, эфиры фенола получают косвенным путем;
- фенол не вступает в реакции дегидратации.
- фенол обладает более сильными кислотными свойствами и вступает в реакцию со щелочами.
1. Кислотные свойства фенолов
Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
Раствор фенола в воде называют «карболовой кислотой», он является слабым электролитом.
1.1. Взаимодействие с раствором щелочей
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия
Видеоопыт взаимодействия фенола с гидроксидом натрия можно посмотреть здесь.
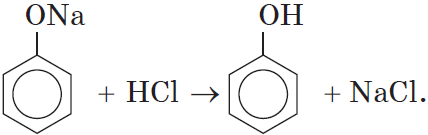
Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
Например, фенол взаимодействует с натрием с образованием фенолята натрия и водорода.
Видеоопыт взаимодействия фенола с натрием можно посмотреть здесь.
2. Реакции фенола по бензольному кольцу
Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце.
2.1. Галогенирование
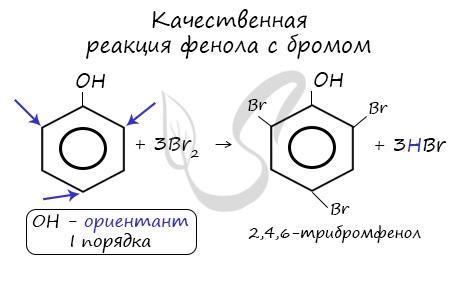
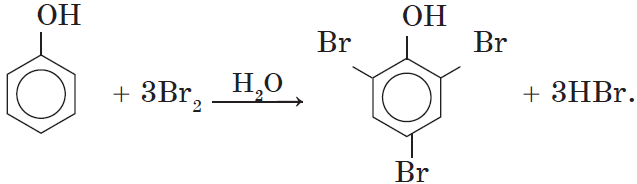
Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол).
Видеоопыт взаимодействия фенола с бромом можно посмотреть здесь.
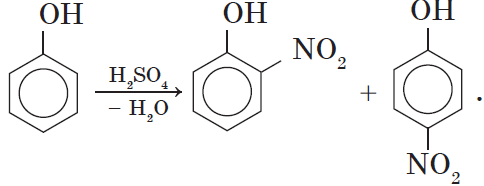
2.2. Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
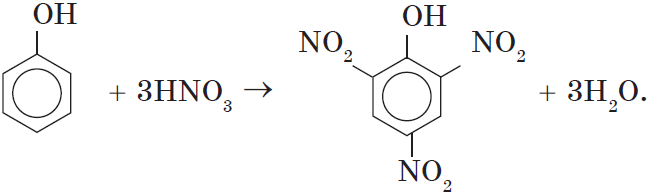
Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):
3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образует фенолоформальдегидные смолы.
4. Взаимодействие с хлоридом железа (III)
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
Видеоопыт взаимодействия фенола с хлоридом железа (III) можно посмотреть здесь.
5. Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический спирт.
Получение фенолов
1. Взаимодействие хлорбензола с щелочами
При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.
При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.
2. Кумольный способ
Фенол в промышленности получают из каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:
Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:
Суммарное уравнение реакции:
3. Замещение сульфогруппы в бензол-сульфокислоте
Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:
Получается фенолят натрия, из которого затем выделяют фенол:
-
Предельные спирты
-
Фенолы
-
Альдегиды
-
Карбоновые кислоты
-
Жиры
-
Углеводы
Фенолы
Фенолы — кислородсодержащие ароматические соединения, в молекулах которых содержится одна или несколько гидроксильных
групп (OH), присоединенных к бензольному кольцу.
Номенклатура фенолов
Нумерацию атомов углерода в молекуле фенола начинают в такой последовательности, чтобы заместители получили наименьшие
номера (идут кратчайшим путем). В основе названия принято сохранять тривиальное название «фенол».
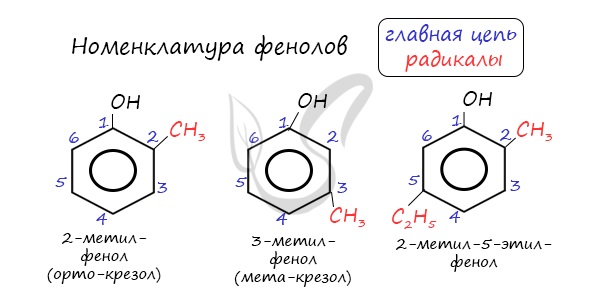
Напомню, что гидроксильная группа является ориентантом I порядка (орто-, пара-ориентант). Поэтому реакции галогенирования,
нитрования протекают в орто- и пара-положениях.
Получение фенолов
- Гидролиз галогенбензолов
- Кумольный способ
При гидролизе галогенбензолов происходит обмен: гидроксогруппа встает на место атома галогена.

Этим способом получают 95% всего производимого фенола. В ходе этой реакции кумол (изопропилбензол) подвергают окислению,
в результате получается фенол и ацетон.

Химические свойства фенолов
- Кислотные свойства
- Галогенирование
- Реакции с кислотами
- Гидрирование
- Поликонденсация фенолов с формальдегидом
Щелочные металлы (Li, Na, K) способны вытеснять водород из фенолов с образованием солей — фенолятов.
В отличие от алифатических одноатомных спиртов, фенолы способны вступать в реакцию с щелочами (KOH, LiOH, NaOH)

Реакция фенола с бромной водой является качественной: в ходе нее выпадает белая взвесь — осадок
трибромфенола.
Реакция между фенолом и азотной кислотой происходит по типу замещения. В бензольном кольце появляется новый радикал —
нитрогруппа. Важно учитывать, что OH группа фенола является ориентантом I порядка: замещение идет в орто-, пара-положении.

При гидрировании разрываются двойные связи бензольного кольца, образуется циклогексанол.

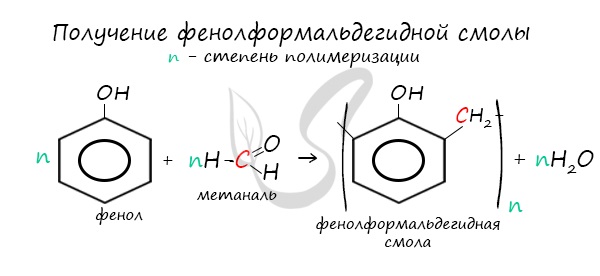
В промышленности получила широкое распространение реакция поликонденсации фенола с формальдегидом, приводящая к образованию
смолообразных полимеров (фенолформальдегидные смолы) и воды.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Фенолы
1. В отличие от предельных одноатомных спиртов, фенолы реагируют с
Na
NaOH
CH3COOH
HCOOH
В отличие от предельных одноатомных спиртов, фенолы реагируют с щелочами, например NaOH.
2. Качественной реакцией на фенол является реакция с
Азотистой кислотой
Азотной кислотой
Натрием
Бромной водой
Качественной реакцией на фенол является реакция c бромной водой.
3. В результате кумольного синтеза фенола, помимо фенола, получают
Ацетон
Этан
Ацетилен
Пропадиен
В результате кумольного синтеза фенола, помимо фенола, получают ацетон (пропанон-2)
4. Гидроксогруппа в молекуле фенола вступает как
Ориентант II порядка
Ориентант I порядка
Гидроксогруппа в молекуле фенола вступает как ориентант I порядка.
5. Фенол с метаналем вступает в реакцию
Гидратации
Поликонденсации
Дегидрирования
Дегидратации
Фенол с метаналем вступает в реакцию поликонденсации, в результате которой получают фенолформальдегидную смолу.
Строение фенолов
Гидроксильная группа в молекулах органических соединений может быть связана с ароматическим ядром непосредственно, а может быть отделена от него одним или несколькими атомами углерода. Можно ожидать, что в зависимости от этого свойства, вещества будут существенно отличаться друг от друга из-за взаимного влияния групп атомов. И действительно, органические соединения, содержащие ароматический радикал фенил $С_6Н_5$—, непосредственно связанный с гидроксильной группой, проявляют особые свойства, отличные от свойств спиртов. Такие соединения называются фенолами.
Фенолы — органические вещества, молекулы которых содержат радикал фенил, связанный с одной или несколькими гидроксогруппами.
Так же как и спирты, фенолы классифицируют по атомности, т.е. по количеству гидроксильных групп.
Одноатомные фенолы содержат в молекуле одну гидроксильную группу:
Многоатомные фенолы содержат в молекулах более одной гидроксильной группы:
Существуют и другие многоатомные фенолы, содержащие три и более гидроксильные группы в бензольном кольце.
Познакомимся подробнее со строением и свойствами простейшего представителя этого класса — фенолом $С_6Н_5ОН$. Название этого вещества и легло в основу названия всего класса — фенолы.
Физические и химические свойства
Физические свойства.
Фенол — твердое, бесцветное, кристаллическое вещество, $t°_{пл.}=43°С, t°_{кип.}=181°С$, с резким характерным запахом. Ядовит. Фенол при комнатной температуре незначительно растворяется в воде. Водный раствор фенола называют карболовой кислотой. При попадании на кожу он вызывает ожоги, поэтому с фенолом необходимо обращаться осторожно!
Химические свойства.
Кислотные свойства. Как уже было сказано, атом водорода гидроксильной группы обладает кислотным характером. Кислотные свойства у фенола выражены сильнее, чем у воды и спиртов. В отличие от спиртов и воды, фенол реагирует не только с щелочными металлами, но и со щелочами с образованием фенолятов:
Однако кислотные свойства у фенолов выражены слабее, чем у неорганических и карбоновых кислот. Так, например, кислотные свойства фенола примерно в $3000$ раз слабее, чем у угольной кислоты. Поэтому, пропуская через водный раствор фенолята натрия углекислый газ, можно выделить свободный фенол:
Добавление к водному раствору фенолята натрия соляной или серной кислоты также приводит к образованию фенола:
Качественная реакция на фенол.
Фенол реагирует с хлоридом железа (III) с образованием интенсивно окрашенного в фиолетовый цвет комплексного соединения.
Эта реакция позволяет обнаруживать его даже в очень ограниченных количествах. Другие фенолы, содержащие одну или несколько гидроксильных групп в бензольном кольце, также дают яркое окрашивание сине-фиолетовых оттенков в реакции с хлоридом железа (III).
Реакции бензольного кольца
Наличие гидроксильного заместителя значительно облегчает протекание реакций электрофильного замещения в бензольном кольце.
1. Бромирование фенола. В отличие от бензола, для бромирования фенола не требуется добавления катализатора (бромида железа (III)).
Кроме того, взаимодействие с фенолом протекает селективно (избирательно): атомы брома направляются в орто- и параположения, замещая находящиеся там атомы водорода. Селективность замещения объясняется рассмотренными выше особенностями электронного строения молекулы фенола.
Так, при взаимодействии фенола с бромной водой образуется белый осадок 2,4,6-трибромфенола:
Эта реакция, так же, как и реакция с хлоридом железа (III), служит для качественного обнаружения фенола.
2. Нитрование фенола также происходит легче, чем нитрование бензола. Реакция с разбавленной азотной кислотой идет при комнатной температуре. В результате образуется смесь орто- и пара-изомеров нитрофенола:
При использовании концентрированной азотной кислоты образуется взрывчатое вещество — 2,4,6-тринитрофенол (пикриновая кислота):
3. Гидрирование ароматического ядра фенола в присутствии катализатора происходит легко:
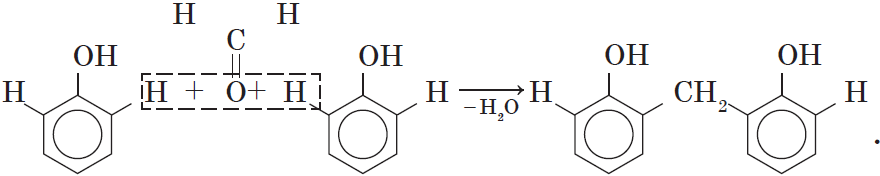
4. Поликонденсация фенола с альдегидами, в частности с формальдегидом, происходит с образованием продуктов реакции — фенолформальдегидных смол и твердых полимеров.
Взаимодействие фенола с формальдегидом можно описать схемой:
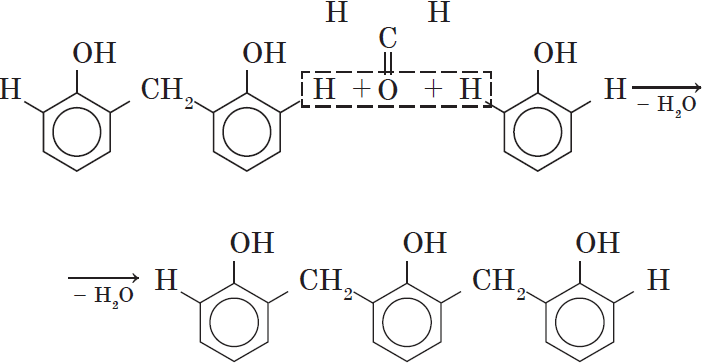
Вы, наверное, заметили, что в молекуле димера сохраняются «подвижные» атомы водорода, а значит, возможно дальнейшее продолжение реакции при достаточном количестве реагентов:
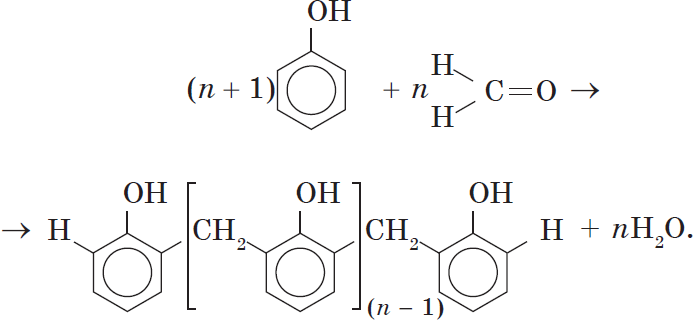
Реакция поликонденсации, т.е. реакция получения полимера, протекающая с выделением побочного низкомолекулярного продукта (воды), может продолжаться и далее (до полного израсходования одного из реагентов) с образованием огромных макромолекул. Процесс можно описать суммарным уравнением:
Образование линейных молекул происходит при обычной температуре. Проведение же этой реакции при нагревании приводит к тому, что образующийся продукт имеет разветвленное строение, он твердый и нерастворим в воде. В результате нагревания фенолформальдегидной смолы линейного строения с избытком альдегида получаются твердые пластические массы с уникальными свойствами. Полимеры на основе фенолформальдегидных смол применяют для изготовления лаков и красок, пластмассовых изделий, устойчивых к нагреванию, охлаждению, действию воды, щелочей и кислот, обладающих высокими диэлектрическими свойствами. Из полимеров на основе фенолформальдегидных смол изготавливают наиболее ответственные и важные детали электроприборов, корпуса силовых агрегатов и детали машин, полимерную основу печатных плат для радиоприборов. Клеи на основе фенолформальдегидных смол способны надежно соединять детали самой различной природы, сохраняя высочайшую прочность соединения в очень широком диапазоне температур. Такой клей применяется для крепления металлического цоколя ламп освещения к стеклянной колбе. Теперь вам понятно, почему фенол и продукты на его основе находят широкое применение.
Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров
Фенолы – радикал С6Н5 –фенил, связанный с одной
или несколькими группами ОН.

С-ОН С-ОН С-ОН
-СН3
Карболовая -С-ОН
кислота
Фенол (гидроксибензол) 2-метилфенол
1,3-дигидроксибензол
1. Физические свойства: Тв, Ц (на воздухе окисляется до
розового цвета)
З, tпл=43 , Ядовит, малорастворим в Н2О,
попадая на кожу, вызывает ожоги.
2. Химические свойства:
А) кислотные свойства – группа ОН взаимодействует с ароматическим
ядром, поляризация связи О-Н возрастает, увеличивается 6+ на
атоме Н, à кислотные свойства усиливаются и фенолы реагирует с
щелочными Ме и щелочами:

2C6H5
OH+ 2Naà 2C6H5ONa+H2 фенолят Na
C6H5
OH+ NaOHà 2C6H5ONa+H2O
Кислотные свойства фенола в 3000 раз меньше, чем Н2СО3,
поэтому пропуская через раствор C6H5ONa СО2 можно выделить фенол;
C6H5ONa +СО2+Н2О à C6H5 OH +NaHCO3
Добавляя к C6H5ONa (раствор) НСl (H2SO4) à образуетсяся
C6H5 –OH
C6H5ONa + НСl à C6H5OH + NaCl
Б) Качественная реакция:
C6H5 OH+ FeCl3à комплексная
соль, фиолетового цвета
В) Реакции бензольного кольца (электрофильное замещение)
Наличие группы ОН приводит к изменению П-облака бензольного кольца,
увеличению электронной плотности у 2,4 и 6 атомов углерода.
1) бромирование C6H5 OH без катализатора

С-ОН C—OH
Br Br
+ 3Br2 à
+ 3HBr
Br
белый осадок 2, 4, 6 – трибромфенол
Как и реакция с FeCl3, служит для обнаружения фенола
2) нитрование – легче, чем у бензола

С-ОН С-ОН
С-NO2
+ HNO3 à +
Разб.
Смесь орто- и пара- изомеров
При комн. t NO2
C-OH

2ON
NO2
+3HNO3à + 3H2O
Конц.
2,4,6 – тринитрофенол (пикриновая к-та)
NO2 взрывчатое
вещество
3) гидрирование

+ 3H2 à циклогексанол
4) поликонденсация с альдегидам ( с Н-С=О формальдегидом)
– с образованием фенолформальдегидных смол и твердых полимеров.

H CH2 C-OH
(n+1) + n C =O à +nH2O
H
n-1
Ароматические
спирты — проявляют свойства одноатомных спиртов.

-СН2— ОН
Группа ОН связана с С6Н5 через
R(-CH2-)
Фенолы. Тренировочные задания для подготовки к ЕГЭ.
Задания с выбором двух вариантов ответа.
Задание №1
Выберите два утверждения, справедливые для фенола
1) плохо растворим в холодной воде
2) образует бурый осадок с бромной водой
3) относится к классу спиртов
4) твердое вещество
5) не имеет запаха
Решение
Ответ: 14
Задание №2
Выберите два утверждения, справедливые для фенола.
1) токсичен
2) атомы углерода в молекуле находятся в состоянии sp-гибридизации
3) реагирует с уксусной кислотой
4) не реагирует с бромной водой
5) способен оставлять ожоги на коже
Решение
Ответ: 15
Задание №3
Выберите два утверждения, справедливые для фенола.
1) проявляет основные свойства
2) используется для производства полимеров
3) газообразное состояние при обычных условиях
4) темнеет при окислении на воздухе
5) при взаимодействии с азотной кислотой образует сложный эфир
Решение
Ответ: 24
Задание №4
Выберите два утверждения, справедливые для фенола.
1) имеет также название карболовая кислота
2) имеет также название пикриновая кислота
3) атомы углерода в молекуле находятся в состоянии sp2-гибридизации
4) не имеет запаха
5) реагирует с гидроксидом меди (II)
Решение
Ответ: 13
Задание №5
Выберите два утверждения, справедливые для фенола.
1) проявляет более выраженные кислотные свойства, чем метанол
2) реакции замещения в ароматическом ядре проходят в положения 3 и 5
3) реагирует со щелочами и некоторыми кислотами
4) вступает в реакцию этерификации
5) атомы углерода в молекуле находятся в состоянии sp3-гибридизации
Решение
Ответ: 13
Задание №6
Выберите два утверждения, которые справедливы и для этанола, и для фенола:
1) образуют сложный эфир в реакциях с азотной кислотой
2) являются жидкостями при комнатной температуре
3) имеют запах
4) между молекулами есть водородные связи
5) реагируют с галогеноводородными кислотами
Решение
Ответ: 34
Задание №7
Выберите два утверждения, которые справедливы и для глицерина, и для фенола.
1) не токсичны
2) атомы углерода в молекулах находятся в состоянии sp3-гибридизации
3) относятся к классу спиртов
4) хорошо растворимы в горячей воде
5) реагируют с азотной кислотой
Решение
Ответ: 45
Задание №8
Выберите два утверждения, которые справедливы и для метанола, и для фенола.
1) вступают в реакцию этерификации
2) являются ядовитыми веществами
3) являются твердыми веществами
4) реагируют с натрием с выделением водорода
5) способны вступать в реакцию внутримолекулярной дегидратации
Решение
Ответ: 24
Задание №9
Выберите два утверждения, которые справедливы и для глицерина, и для фенола.
1) являются многоатомными спиртами
2) реагируют с натрием
3) реагируют с водными растворами щелочей
4) реагируют с азотной кислотой
5) вступают в реакцию этерификации
Решение
Ответ: 24
Задание №10
Выберите два утверждения, которые справедливы и для циклогексанола, и для фенола.
1) являются циклическими спиртами
2) вступают в реакцию внутримолекулярной дегидратации
3) реагируют с натрием
4) реагируют с гидроксидом калия
5) токсичны
Решение
Ответ: 35
[adsp-pro-3]
Задание №11
Выберите два вещества, между молекулами которых нет водородных связей.
1) фенол
2) бензол
3) вода
4) метанол
5) кумол
Решение
Ответ: 25
Задание №12
Из предложенного перечня реакций, выберите две таких, в которые может вступать фенол.
1) галогенирование
2) поликонденсация
3) этерификация
4) гидратация
5) гидрогалогенирование
Решение
Ответ: 12
Задание №13
Из предложенного перечня реакций, выберите две таких, в которые не может вступать фенол.
1) нитрование
2) горение
3) гидрирование
4) гидролиз
5) внутримолекулярной дегидратации
Решение
Ответ: 45
Задание №14
Из предложенного перечня реакций, выберите две таких, в которые может вступать фенол.
1) дегидрирование
2) поликонденсация
3) дегидратация
4) гидратация
5) гидрирование
Решение
Ответ: 25
Задание №15
Из предложенного перечня выберите два вещества, с которыми фенол может вступать в реакцию.
- 1. HBr
- 2. NaCl
- 3. K
- 4. HCHO
- 5. H2O
Решение
Ответ: 34
Задание №16
Из предложенного перечня выберите два вещества, с которыми не может вступать в реакцию фенол.
1) гидроксид натрия
2) медь
3) азотная кислота
4) кислород
5) оксид углерода (IV)
Решение
Ответ: 25
Задание №17
Из предложенного перечня выберите два вещества, с которыми может вступать в реакцию фенол:
1) бензол
2) хлорид железа (III)
3) пропан
4) соляная кислота
5) кислород
Решение
Ответ: 25
Задание №18
Из предложенного перечня выберите два вещества, с которыми может вступать в реакцию фенол.
1) метан
2) метаналь
3) хлорид натрия
4) кремниевая кислота
5) водород
Решение
Ответ: 25
Задание №19
Из предложенного перечня реагентов выберите два таких, которые дают качественную реакцию на фенол.
- 1. NaOH
- 2. FeCl3
- 3. HNO3
- 4. HCHO
- 5. Br2(водн.)
Решение
Ответ: 25
Задание №20
Из предложенного перечня соединений, выберите два вещества, в молекуле которого все атомы углерода находятся в состоянии sp2-гибридизации.
1) ацетилен
2) бензол
3) фенол
4) толуол
5) этанол
Решение
Ответ: 23
[adsp-pro-3]
Задание №21
Из предложенного перечня соединений, выберите два вещества, в молекуле которого все атомы углерода находятся в состоянии sp2-гибридизации.
1) этилен
2) кумол
3) 2-метилфенол
4) этиленгликоль
5) дивинил
Решение
Ответ: 15
Задание №22
Из предложенного перечня выберите два вещества, с которыми не реагирует фенол, но реагирует метанол.
1) соляная кислота
2) гидроксид калия
3) натрий
4) кислород
5) бромоводородная кислота
Решение
Ответ: 15
Задание №23
Из предложенного перечня реагентов выберите два таких, по сравнению с которыми фенол проявляет более сильные кислотные свойства:
1) пикриновая кислота
2) этиленгликоль
3) этанол
4) угольная кислота
5) уксусная кислота
Решение
Ответ: 23
Задание №24
Из предложенного перечня реагентов выберите два таких, с которыми реагирует металлический натрий.
1) фенолят натрия
2) циклогексанол
3) хлорэтан
4) бензол
5) диэтиловый эфир
Решение
Ответ: 23
Задание №25
Из предложенного перечня реагентов выберите два таких, с каждым из которых реагирует металлический натрий:
1) глицерин
2) кумол
3) фенол
4) пентан
5) этилен
Решение
Ответ: 13
Задание №26
Из предложенного перечня реагентов выберите два таких, с каждым из которых реагирует металлический калий.
1) ацетилен
2) о-ксилол
3) циклогексан
4) фенол
5) метан
Решение
Ответ: 14
Задание №27
Из предложенного перечня реакций выберите две такие, с помощью которых может быть получен фенол.
1) С6H5ONa + CH3Cl
2) C6H5CH(CH3)2 + O2
3) С6H5Cl + CH3ONa
4) С6H5ONa + CO2 + H2O
5) С6H6 + H2O
Решение
Ответ: 24
Задание №28
Из предложенного перечня выберите два вещества, с которыми не реагирует этанол, но реагирует фенол.
1) натрий
2) гидроксид натрия
3) гидроксид меди(II)
4) водород
5) хлорид меди (II)
Решение
Ответ: 24
Задание №29
Из предложенного перечня выберите два реагента, с которыми не реагирует пропанол-1, но реагирует фенол.
1) уксусная кислота
2) метаналь
3) вода
4) бромная вода
5) хлорид железа (III)
Решение
Ответ: 45
Задание №30
Из предложенного перечня выберите два ответа в которых перечислены реагенты, с которыми не реагирует фенол, но реагирует пропанол-1.
1) пропановая кислота
2) метаналь
3) хлороводород
4) азотная кислота
5) кислород
Решение
Ответ: 13
[adsp-pro-3]
Задание №31
Из предложенного перечня выберите два вещества, с которыми в отличие от пропанола-1 реагирует фенол.
1) калий
2) бромоводород
3) водород
4) вода
5) хлорид железа (III)
Решение
Ответ: 35
Задание №32
Из предложенного перечня веществ выберите два вещества, в молекулах которых присутствует гидроксильная группа.
1) стирол
2) глицерин
3) бензол
4) ксилол
5) фенол
Решение
Ответ: 25
Задание №33
Из предложенного перечня выберите два вещества, при реакции фенола с которыми протекает реакция замещения по ароматическому ядру:
1) натрий
2) гидроксид калия
3) бромная вода
4) водород
5) азотная кислота
Решение
Ответ: 35
Задание №34
Из предложенного перечня выберите два вещества, при реакции фенола с которыми протекает реакция замещения по ароматическому ядру.
1) хлорид железа(III)
2) азотная кислота
3) кислород
4) гидроксид калия
5) бром
Решение
Ответ: 25
Задание №35
Из предложенного перечня выберите два вещества, при взаимодействии с которыми в молекуле фенола происходит разрыв связи О-Н.
1) водород
2) бромная вода
3) гидроксид калия
4) метаналь
5) натрий
Решение
Ответ: 35
Задание №36
Из предложенного перечня веществ выберите два вещества, при взаимодействии с которыми в молекуле фенола происходит разрыв только связи О-Н.
1) хлорид железа (III)
2) кислород
3) азотная кислота
4) калий
5) водород
Решение
Ответ: 14
Задание №37
Из предложенного перечня веществ выберите два вещества, растворы которых применяются в медицине в качестве антисептика.
1) метанол
2) бензол
3) фенол
4) уксусной кислоты
5) этанол
Решение
Ответ: 35
Задание №38
Из предложенного перечня процессов, выберите два таких, которые используются для получения фенола в промышленности.
1) коксование каменного угля
2) каталитическое превращение синтез-газа
3) окисление кумола
4) гидролиз целлюлозы
5) перегонка мазута
Решение
Ответ: 13
Задание №39
Представлена следующая схема превращений веществ:
бензол хлорбензол
фенолят натрия
Определите, какие из указанных веществ являются веществами X и Y
1) гидроксид натрия
2) натрий
3) нитробензол
4) хлороводород
5) хлор
Решение
Ответ: 51
Задание №40
Представлена следующая схема превращений веществ:
С6Н5Cl фенолят натрия
С6Н5ОСН3
Определите, какие из указанных веществ являются веществами X и Y
1) хлорид натрия
2) гидроксид натрия
3) метилхлорид
4) метан
5) метилат натрия
Решение
Ответ: 23
[adsp-pro-3]
Задание №41
Представлена следующая схема превращений веществ:
бензол изопропилбензол
фенол
Определите, какие из указанных веществ являются веществами X и Y
1) пропан
2) метанол
3) пропин
4) кислород
5) пропен
Решение
Ответ: 54
Задание №42
Представлена следующая схема превращений веществ:
хлорбензол фенолят натрия
пикриновая кислота
Определите, какие из указанных веществ являются веществами X и Y веществом X является
1) азотистая кислота
2) едкий натр
3) бромоводородная кислота
4) оксид натрия
5) азотная кислота
Решение
Ответ: 25
Задание №43
Представлена следующая схема превращений веществ:
фенилацетат фенолят натрия
фенол
Определите, какие из указанных веществ являются веществами X и Y
1) соляная кислота
2) каустическая сода
3) метанол
4) хлорид калия
5) кислород
Решение
Ответ: 21
Фенолы. Задания на установление соответствия.
Задание №1
Установите соответствие между названием вещества и классом органических соединений, к которому оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | КЛАСС/ГРУППА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
|
А) фенол Б) ксилол В) бензол Г) глицерин |
1) одноатомные спирты 2) углеводороды 3) фенолы 4) многоатомные спирты 5) углеводы |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 3224
Задание №2
Установите соответствие между названием вещества и классом органических соединений, к которому оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | КЛАСС/ГРУППА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
|
А) метанол Б) крезол В) стирол Г) этиленгликоль |
1) одноатомные спирты 2) углеводороды 3) фенолы 4) многоатомные спирты 5) галогеналканы |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 1324
Задание №3
Установите соответствие между названием вещества и классом органических соединений, к которому оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | КЛАСС/ГРУППА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
|
А) кумол Б) изопрен В) фенол Г) бутанол-2 |
1) одноатомные спирты 2) диеновые углеводороды 3) фенолы 4) многоатомные спирты 5) предельные углеводороды 6) ароматические углеводороды |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 6231
Задание №4
Установите соответствие между названием вещества и классом органических соединений, к которому оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | КЛАСС/ГРУППА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
|
А) фенилацетат Б) метилат калия В) фенолят калия Г) метанол |
1) одноатомные спирты 2) непредельные углеводороды 3) фенолы 4) соли 5) сложные эфиры |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 5441
Задание №5
Установите соответствие между реагирующими веществами и органическим продуктом, образующимся в результате их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГЕНТЫ | ОРГАНИЧЕСКИЙ ПРОДУКТ РЕАКЦИИ |
|
А) С6Н5ОН + Na Б) С6Н5ОН + NaCl В) С6Н5ОН + NaOH Г) С6Н5ОН + HNO3 |
1) 3,5-динитрофенол 2) хлорбензол 3) пикриновая кислота 4) фенолят натрия 5) вещества не взаимодействуют |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 4543
[adsp-pro-3]
Задание №6
Установите соответствие между основным продуктом реакции и реагирующими веществами: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ОРГАНИЧЕСКИЙ ПРОДУКТ РЕАКЦИИ | РЕАГЕНТЫ |
|
А) фенолят натрия Б) метилат натрия В) циклогексанолят натрия Г) метилформиат |
1) СН3ОН + NaOH 2) С6Н5ОН + Na 3) СН3ОН + Na 4) С6Н11ОН + NaOH 5) С6Н11ОН + Na 6) СН3ОН + HCOOH |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 2356
Задание №7
Установите соответствие между реагирующими веществами и продуктом, образующимся в результате их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ОРГАНИЧЕСКИЙ ПРОДУКТ РЕАКЦИИ |
|
А) С6Н5ОН + HNO3 Б) С6Н5ОK + CO2 + H2O В) С6Н5ОН + Br2(водн) Г) С6Н5ОK + CH3Cl |
1) фенол 2) 3,5-динитрофенол 3) пикриновая кислота 4) 2,4,6-трибромфенол 5) метилфениловый эфир 6) фенилметаноат |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 3145
Задание №8
Установите соответствие между формулой веществ и основным продуктом их взаимодействия с хлороводородом: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАКТИВ | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
|
1) фенол 2) фенолят калия 3) метанол 4) глицерин |
1) фенол 2) 1,2,3-трихлорпропан 3) хлорбензол 4) метилхлорид 5) вещества не взаимодействуют |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 5142
Задание №9
Установите соответствие между формулами веществ и реагентом, применяющимся для обнаружения этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВА | РЕАКТИВ |
|
А) метанол Б) глицерин В) фенол Г) стирол |
1) [Ag(NH3)2]OH 2) Cu(OH)2 3) K2CO3 4) Br2(водн.) 5) CuO |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 5244
Задание №10
Установите соответствие между формулами веществ и реагентом, применяющимся для обнаружения этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВА | РЕАКТИВ |
|
А) фенол Б) ацетилен В) этандиол-1,2 Г) этанол |
1) [Ag(NH3)2]OH 2) Cu(OH)2 3) K2CO3 4) FeCl3 5) CuO |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 4125
[adsp-pro-3]
Задания повышенной сложности на фенолы.
Задание №1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
пропан 2-хлорпропан
кумол
фенол
циклогексанол
Решение
Задание №2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
бензол хлорбензол
фенолят натрия
X
Решение
вариант уравнения с карбонатом натрия недопустим, так как фенол как кислота слабее угольной только по ее первой ступени диссоциации.
Задание №3
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
C2H4Br2 X1
X2
C6H5Cl
X3
X4
Решение
вариант уравнения с карбонатом натрия недопустим, так как фенол как кислота слабее угольной только по ее первой ступени диссоциации.
Задание №4
Навеску неизвестного соединения массой 27,8 г сожгли в избытке кислорода и получили 26,88 л углекислого газа, 9 г воды и 2,24 л азота. Определите молекулярную формулу данного соединения и его структуру, если известно, что для его синтеза не используют взаимодействие фенола с азотной кислотой.
Решение
n(CO2) = V(CO2)/Vm = 26,88/22,4 = 1,2 моль, следовательно, n(C) = n(CO2) = 1,2 моль,
m(C) = M(C)·n(C) = 12·1,2 = 14,4 г,
n(H2O) = m(H2O)/M(H2O) = 9/18 = 0,5 моль, следовательно, n(H) = 2n(H2O) = 1·0,5 = 1 моль,
m(H) = M(H)·n(H) = 1·1 = 1 г,
n(N2) = V(N2)/Vm = 2,24/22,4 = 0,1 моль, следовательно, n(N) = 2n(N2) = 2·0,1 = 0,2 моль,
m(N) = M(N)·n(N) = 14·0,2 = 2,8 г,
m(O) = m(в-ва) — m(C) — m(H) — m(N) = 27,8 — 14,4 — 1 — 2,8 = 9,6 г,
n(O) = m(O)/M(O) = 9,6/16 = 0,6 моль,
n(С):n(H):n(O):n(N) = 1,2:1:0,6:0,2 = 6:5:3:1
Таким образом, простейшая формула искомого соединения C6H5O3N.
По всей видимости, искомым веществом является один из изомерных нитрофенолов. Поскольку в условии сказано, что это вещество не получают нитрованием фенола, это означает, что данным веществом является м-нитрофенол, поскольку при нитровании фенола в качестве мононитропроизводных образуются практически только о— и п-нитрофенол.
Задание №5
При сжигании навески неизвестного вещества массой 3,31 г образовалось только два продукта: 1,344 л углекислого газа и 2,43 г бромоводорода. Определите молекулярную формулу вещества и его структуру, если известно, что оно может быть получено в одну стадию из фенола.
Решение
n(CO2) = V(CO2)/Vm = 1,344/22,4 = 0,06 моль, следовательно, n(C) = n(CO2) = 0,06 моль,
тогда, m(C) = n(C)·M(C) = 0,06·12 = 0,72 г,
n(HBr) = m(HBr)/M(HBr) = 2,43/81 = 0,03 моль, следовательно, n(H) = n(HBr) = 0,03 моль,
n(Br) = n(HBr) = 0,03 моль,
тогда, m(H) = n(H)·M(H) = 0,03·1 = 0,03 г,
m(Br) = n(Br)·M(Br) = 0,03·80 = 2,4 г,
m(O) = m(в-ва) — m(C) — m(H) — m(Br) = 3,31 — 0,72 — 0,03 — 2,4 = 0,16 г,
n(O) = m(O)/M(O) = 0,16/16 = 0,01 моль,
n(C):n(H):n(O):n(Br) = 0,06:0,03:0,01:0,03 = 6:3:1:3
Таким образом, простейшая формула искомого соединения C6H3OBr3.
Если предположить, что истинная молекулярная формула совпадает с простейшей, то искомым веществом может быть 2,4,6-трибромфенол, структурная формула которого:
[adsp-pro-3]
Задание №6
Навеску неизвестного соединения массой 12,85 г сожгли в избытке кислорода. В результате образовалось 13,44 л углекислого газа, 3,6 г паров воды и 2,24 л хлороводорода. Определите молекулярную формулу данного соединения и установите его строение, если известно, что оно реагирует с металлическим натрием и при обработке бромной водой дает трибромпроизводное.
Решение
n(CO2) = V(CO2)/Vm = 13,44/22,4 = 0,6 моль, следовательно, n(C) = n(CO2) = 0,6 моль,
m(C) = M(C)·n(C) = 12·0,6 = 7,2 г,
n(H2O) = m(H2O)/M(H2O) = 3,6/18 = 0,2 моль, следовательно, nI(H) = 2·n(H2O) = 2·0,2 = 0,4 моль,
n(HCl) = V(HCl)/Vm = 2,24/22,4 = 0,1 моль,
n(Cl) = n(HCl) = 0,1 моль,
m(Cl) = n(Cl)·M(Cl) = 0,1·35,5 = 3,55 г,
nII(H) = n(HCl) = 0,1 моль,
n(H) = nI(H) + nII(H) = 0,4 + 0,1 = 0,5 моль,
m(H) = M(H)·n(H) = 1·0,5 = 0,5 г,
m(O) = m(в-ва) — m(C) — m(H) — m(Cl) = 12,85 – 7,2 – 0,5 – 3,55 = 1,6 г,
n(O) = m(O)/M(O) = 1,6/16 = 0,1 моль
n(C):n(H):n(O):n(Cl) = 0,6:0,5:0,1:0,1 = 6:5:1:1
Таким образом, простейшая формула искомого соединения C6H5OCl.
Если предположить, что истинная молекулярная формула совпадает с простейшей, то подходит м-хлорфенол, структурная формула которого:
[adsp-pro-10]
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
СВОЙСТВА ОДНОАТОМНЫХ СПИРТОВ
ОДНОАТОМНЫЕ СПИРТЫ содержат в углеводородной цепи одну гидроксильную группу ОН.
Общая формула CnH2n+1–OH или CnH2n+2O.
СТРОЕНИЕ ГИДРОКСИЛЬНОЙ ГРУППЫ.
Связи О–Н и С–О – полярные ковалентные.
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
Атому кислорода в спиртах свойственна sp3-гибридизация, валентный угол C–О–H близок к тетраэдрическому.
ФИЗИЧЕСКИЕ СВОЙСТВА СПИРТОВ
Следствием полярности связи О–Н является способность гидроксисоединений к образованию водородных связей:
Поэтому даже низшие спирты — жидкости с относительно высокой температурой кипения (t кип. метанола +64,5оС).
При переходе от одноатомных к многоатомным спиртам или фенолам температуры кипения и плавления резко возрастают.
Образование водородных связей с молекулами воды способствует растворимости гидроксисоединений в воде:
Спирты, содержащие до 15 атомов углерода – жидкости, 15 и более – твердые вещества.
Растворимость в воде зависит от молекулярной массы, чем она выше, тем спирт хуже растворяется воде. Так, низшие спирты (до пропанола) смешиваются с водой в любых пропорциях, а высшие практически не растворимы в ней.
Температура кипения также возрастает с увеличением атомной массы. Чем выше температура кипения, тем ниже летучесть, т.е. вещество плохо испаряется, что объясняется возникновением межмолекулярной водородной связи между отдельными молекулами самого соединения или спирта и воды
ХИМИЧЕСКИЕ СВОЙСТВА
В химических реакциях гидроксисоединений возможно разрушение одной из двух связей:
С–ОН с замещением или отщеплением ОН-группы
О–Н с замещением водорода.
ЗАМЕЩЕНИЕ В ГИДРОКСИЛЬНОЙ ГРУППЕ
ОН – поляризована (некоторая кислотность)
1.С активными металлами (Na, K, Mg), образуя соли — алкоголяты (алкоксиды):
Реакционная способность одноатомных спиртов в реакциях по связи О–Н:
CH3OH > первичные > вторичные > третичные.
Алкоголяты нестойкие и под действием воды полностью гидролизуются с выделением спирта и гидроксида металла:
Со щелочами одноатомные спирты НЕ реагируют.
2. Образование сложных эфиров.
Спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры (этерификация).
ЗАМЕЩЕНИЕ ГИДРОКСИЛЬНОЙ ГРУППЫ -ОН
1. Реакции замещения ОН на галоген:
происходит в реакции с галогеноводородами или другими галогенсодержащими веществами в присутствии сильной кислоты (конц. H2SO4).
Реакционная
способность:
третичные
> вторичные > первичные > CH3OH
1. Внутримолекулярная дегидратация: образуются алкены.
Идет в присутствии концентрированной серной кислоты или водоотнимающих оксидов при повышенной температуре:
Дегидратация спиртов с длинной углеродной цепью идет по правилу Зайцева – водород отщепляется от менее гидрогенизированного атома углерода.
Основной
продукт – бутен-2.
2. Межмолекулярная дегидратация: образуются простые эфиры.
При межмолекулярной дегидратации спиртов также происходит нуклеофильное замещение: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы.
3. Реакция Лебедева –
это получение бутадиена каталитическим пиролизом этилового спирта
ОКИСЛЕНИЕ
1.Горение —> углекислый газ и вода
2. Окисление спиртов ( CuO (to), O2 (кат.Cu, to), KMnO₄, K₂Cr₂O₇),
а также дегидрирование при нагревании над медной сеткой.
(первичные окисляются до альдегидов, вторичные до кетонов, третичные более устойчивые – разрыв цепи):
3)Окисление подкисленным раствором перманганата калия приводит к образованию карбоновых кислот:
ИСКЛЮЧЕНИЕ: Окисление метанола ведет к образованию углекислого газа!!!
4) Окисление подкисленным раствором дихромата калия приводит к образованию карбоновых кислот:
Качественная реакция одноатомных спиртов– цвет из оранжевого переходит в зеленый (определение содержания алкоголя)
СВОЙСТВА МНОГОАТОМНЫХ СПИРТОВ
Многоатомные (две и более групп -ОН). Общая формула CnH2n+2Om.
Современное название многоатомных спиртов — полиолы (диолы, триолы и т.д).
Этиленгликоль и глицерин вязкие, сладкие на вкус жидкости, сорбит — белый порошок, все вещества хорошо растворимые в воде.
ХИМИЧЕСКИЕ СВОЙСТВА.
1.Замещение Н –атома (кислотные свойства).
Этиленгликоль, глицерин вследствие взаимного влияния атомов (-I-эффект ОН-групп) являются более сильными кислотами, чем одноатомные спирты.
Образуют соли не только в реакциях с активными металлами, но и под действием щелочей (частично и обратимо):
2.Взаимодействие с раствором гидроксида меди (II) в присутствии щелочи
с образованием комплексных соединений (качественная реакция на многоатомные спирты ). Голубой осадок гидроксида меди растворяется с образованием синего комплексного соединения многоатомного спирта.
3.Образование сложных эфиров
Реакция с азотной кислотой.
4. Образование жиров.
Жиры — это сложные эфиры, продукты взаимодействия глицерина с высшими карбоновыми кислотами.
5. Взаимодействие с галогеноводородами
Замещение -ОН на галоген:
Реагируют также, как и одноатомные спирты.
6. Окисление.
Так же, как и одноатомные спирты – оксидом меди или над медной сеткой (каталитическое дегидрирование) многоатомные спирты окисляются в карбонильные соединения.
Фенолы – гидроксисоединения, в молекулах которых ОН-группы связаны непосредственно с бензольным ядром.
Общая формула – СnH2n-7OH n>6 (для фенолов с одной ОН-группой)
ФИЗИЧЕСКИЕ СВОЙСТВА ФЕНОЛА
Это твёрдое бесцветное вещество с резким запахом.
При температуре больше 70 °C растворяется в воде в любых отношениях. Фенол ядовит.
Неподеленная электронная пара атома кислорода взаимодействует (вступает в сопряжение с ароматической π-системой, в результате:
Увеличивается электронная плотность на ароматической системе, происходит ее перераспределение, и на атомах 2,4,6 появляется избыточный отрицательный заряд;
Электронная пара связи О-Н смещается к атому кислорода, и связь становится менее прочной (по сравнению со спиртами)
ХИМИЧЕСКИЕ СВОЙСТВА ФЕНОЛА
Проявляет свойства слабой кислоты. Реакции замещения группы ОН и образование эфиров нехарактерны: эфиры получают с помощью фенолятов.
Фенол легко вступает в реакции электрофильного замещения в ароматическом кольце.
Качественные реакции:
1. Образование осадка 2,4,6 трибромфенола с бромной водой;
2. Появление фиолетовой окраски с хлоридом железа (FeCl₃)
РЕАКЦИИ С УЧАСТИЕМ ГИДРОКСИЛЬНОЙ ГРУППЫ (КИСЛОТНЫЕ СВОЙСТВА ФЕНОЛОВ)
1. Как и спирты, реагируют с активными металлами.
2. Реагируют с гидроксидами щелочных и щелочноземельных металлов (отличие от спиртов), образуя соли – феноляты.
Кислотные свойства очень слабые, кислота не окрашивает
индикаторы и вытесняется из солей даже угольной кислотой, т.е. феноляты легко гидролизируются.
Из фенолятов получают простые и сложные эфиры
1. Образование простых эфиров
2. Образование сложных эфиров
РЕАКЦИИ ФЕНОЛА ПО БЕНЗОЛЬНОМУ КОЛЬЦУ
1. Галогенирование.
Фенол легко при комнатной температуре взаимодействует с бромной водой (раствор желтый) с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол №1).
2. Нитрование.
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота).
3. Сульфирование фенолов
Образуются сульфофенолы
4. Поликонденсация
– образование полимера и низкомолекулярного побочного продукта (H₂O). С формальдегидом фенол образует фенолоформальдегидные смолы.
ОКИСЛЕНИЕ
Фенолы легко окисляются даже под действием кислорода воздуха.
Полное окисление (горение)
При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона образуется хинон:
Гидрирование (восстановление)— образуются циклические спирты
Качественная реакция на фенол №2: с хлоридом железа (III).
Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
14(Б) Тесты ЕГЭ ФИПИ 2015 Одноатомные спирты
14(Б) Тесты ЕГЭ ФИПИ 2015 Многоатомные спирты
14(Б) Тесты ЕГЭ ФИПИ 2015 Фенолы
Автор: Магадова Каринэ Романовна
Должность: учитель химии и биологии
Учебное заведение: МБОУ гимназия №18
Населённый пункт: г.Краснодар
Наименование материала: Презентация по теме ФЕНОЛЫ
Тема: ФЕНОЛЫ-материал по органической химии для подготовки к ЕГЭ
Раздел: полное образование
Презентация по химии на тему:
Фенолы
учитель химии гимназии №18
города Краснодара Магадова
Каринэ Романовна
•
Фенолы
— это производные ароматических
углеводородов, в молекулах которых
гидроксильные группы связаны с
бензольным ядром
Строение молекулы фенола
•
Гидроксогруппа и бензольное кольцо оказывают
друг на друга взаимное влияние,приводя к
трансформации их химических свойств.Влияние
бензольного кольца на гидроксильную группу
обуславливает большую подвижность ее
водородного атома.Гидроксильная группа
придает атомам водорода бензольного кольца
большую подвижность в положении 2,4,6
Классификация фенолов
Фенолы
классифицируют
по
атомности
,
т
.
е
.
по
количеству
гидроксильных
групп
.
Одноатомные
фенолы
содержат
в
молекуле
одну
гидроксильную
группу
(
фенол
)
Двухатомные
фенолы
содержат
две
гидроксильные
группы
(1,3-
дигидроксибензол
,
мета
—
дигидроксибензол
,
резорцин
)
Трёхатомные
фенолы
содержат
три
гидроксильные
группы
Классификация фенолов
По
количеству
бензольных
колец
фенолы
бывают
моноядерные
и
многоядерные
Номенклатура фенолов
•
При
составлении
названия
фенолов
нумерация
атомов
углерода
в
бензольном
ядре
начинается
с
атома
непосредственно
связанного
с
гидроксильной
группой
Затем
называются
заместители
,
начиная
с
простейшего
,
с
указанием
номера
атома
углерода
,
при
котором
они
находятся
Открытие фенола
Фридлиб Фердинанд
Рунге
(1794 – 1867 гг)
обнаружил в продуктах
перегонки каменноугольной
смолы белое
кристаллическое вещество
с характерным запахом.
Ему не удалось определить
состав вещества
.
Огюст Лоран
(1807 – 1853 гг)
определил состав вещества.
Новое вещество обладало
выраженными кислотными
свойствами и было
производным открытого
незадолго до этого бензола.
Лоран называл бензол
«феном», поэтому новая
кислота получила название
фениловой.
Шарль Фредерик
Жерар
(1816 – 1856 гг)
считал полученное
вещество спиртом и
предложил называть его
фенолом. Было
установлено, что целая
группа веществ обладает
подобным строением и
свойствами, поэтому их
назвали «фенолами».
Физические свойства фенола
•
Фенол-твердое бесцветное кристаллическое
вещество, tпл=41°C, tкип=182°C,с резким характерным
запахом.Ядовит.Окисляется на воздухе с
приобретение розового оттенка.Хорошо растворяется
в горячей воде.Если фенол попадает на кожу,то
остаются ожоги,поэтому при работе с фенолом
необходимо соблюдать технику безопасности
Получение фенола
•
Гидролиз хлорбензола
Из
каменноугольной
смолы
(
как
побочный
продукт
—
выход
мал
)
C
6
H
5
ONa + H
2
SO
4
(
разб
) →
С
6
H
5
– OH + NaHSO
4
Сплавлением
солей
ароматических
сульфокислот
с
твёрдыми
щелочами
:
C
6
H
5
-SO
3
Na + NaOH
t
→ Na
2
SO
3
+
С
6
H
5
– OH
Кумольный
способ
получения
фенола
.
В
настоящее
время
кумольный
способ
используется
как
основной
в
мировом
производстве
фенола
Химические свойства фенола
1.
Взаимодействие
с
натрием
Фенол
,
как
и
спирты
,
взаимодействует
с
металлическим
натрием
с
образованием
соли
(
фенолята
натрия
)
и
водорода
Химические свойства фенола
.
Взаимодействие
со
щелочами
Влияние
бензольного
ядра
обуславливает
свойство
,
которое
совсем
не
характерно
для
спиртов
,
фенол
может
взаимодействовать
со
щелочами
,
проявляя
свойства
слабой
кислоты
Химические свойства фенола
Нитрование
фенола
также
происходит
легче
,
чем
нитрование
бензола
.
В
зависимости
от
концентрации
азотной
кислоты
условия
реакции
и
получаемые
продукты
могут
быть
разными
Химические свойства фенола
В
результате
полного
нитрования
фенола
образуется
2,4,6-
тринитрофенол
(
пикриновая
кислота
) –
взрывчатое
вещество
.
Химические свойства фенола
Реакции гидрирования
•
При
нагревании
в
присутствии
никелевого
катализатора
фенол
присоединяет
три
молекулы
водорода
.
В
результате
чего
образуется
предельный
циклический
спирт
–
циклогексанол
Качественная реакция на фенол
•
Качественной реакцией на фенол является
его взаимодействие с хлоридом
железа(III).К разбавленному раствору(не
эмульсии!)фенола добавляют несколько
капель раствора хлорида
железа(III).Жидкость окрашивается в темно-
фиолетовый цвет
Реакция бромирования
•
Реакция бромирования является
качественной реакцией на фенолы.В ходе
реакции выпадает белый осадок 2,4,6-
трибромфенол
Конденсация
•
Конденсация фенола с формальдегидом
приводит
к образованию высокомолекулярного
соединения разветвленной трехмерной
структуры – фенолоформальдегидной смолы
Правила техники безопасности при работе
с фенолом
Фенол — сильный яд!
При контакте с кожей фенол (карболовая кислота) в
виде
водных
растворов
высокой
концентрации
сначала
резко
уменьшает
чувствительность кожи, а затем разрушает ее. Действие фенола на организм
заключается в основном в разрушении эритроцитов. При попадании фенола в
желудок
появляются
рвота,
понос,
в
моче
обнаруживается
гемоглобин.
У
пострадавшего резко падает температура, появляются судороги, челюсти сильно
сжаты. При втирании препарата в кожу (это может произойти, например, при
случайном
попадании
кристаллов
фенола
в
обувь)
возможны
поражения
со
смертельным исходом.
При работе с фенолом необходимо защищать глаза очками, а руки —
перчатками.
Рукава
и
ворот
должны
быть
плотно
застегнуты.
Необходимо
следить, чтобы кристаллы фенола не попали в обувь. После работы с фенолом
следует тщательно вымыть руки с мылом под проточной водой.
При попадании на кожу нужно промыть пораженное место 10-40%-м
этиловым спиртом, растительным маслом. При отравлении через рот сначала
промывают желудок теплой водой, а затем розовым раствором перманганата
калия
КмnО
4
или
10%-м
этиловым
спиртом,
потом
снова
чистой
водой.
Промывание
продолжается
до
исчезновения
запаха
фенола
в
рвотной
массе.
После этого нужно дать яичный белок — как обволакивающее.
Применение фенола
Фенол
Фенол
Синтетические
волокна
Пестициды
Фенолформаль-
дегидные смолы
Моющие
средства
Антисептики
Лаки,
краски
Медицинские
препараты
Сахарин
Фенолы в растениях


















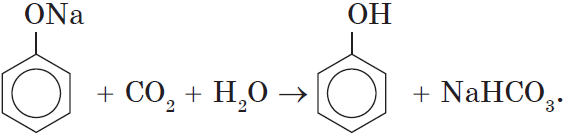
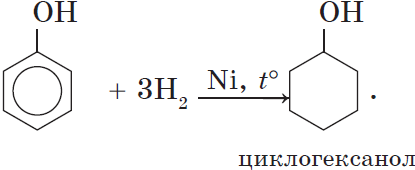


![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)











































