Вы можете бесплатно и без регистрации скачать любую из 3000 презентаций на тему ферменты
Презентация: « ФЕРМЕНТЫ ».
… МЕДИЦИНСКОЙ ЭНЗИМОЛОГИИ 1.ПОНЯТИЕ О ФЕРМЕНТАХ Ферменты, или энзимы, представляют собой … , обеспечивая тем самым высокую специфичность фермента.ферментов гомогенного катализахимических реакций ферментовсубстратамеханизмом реакциймолекулмеханизмы …
Модель фермента нуклеозид- фосфорилазынуклеозид Ферме́нты или …
… лактозыpHщелочная фосфатазаАТФаза Функции ферментов Ферменты белки, являющиеся биологическими катализаторами. Ферменты присутствуют во … равновесие специфичностьконстанта связывания Каталитически совершенный фермент Ферменты широко используются в народном …
Классификация ферментов. Применение ферментов в медицине.
Классификация ферментов. Применение ферментов в медицине. Номенклатура ферментов название субстрата, реакция, катализируемая ферментом, аза … органа- мишени. Иммобилизация ферментов Ковалентная иммобилизация ферментов – фермент ковалентно присоединён к …
Скачать материал

Скачать материал


- Курс добавлен 13.12.2022


- Курс добавлен 13.12.2022




Описание презентации по отдельным слайдам:
-
1 слайд
Презентация преподавателя
химии ГБПОУ «КМТ» Залиевой Н.МФерменты.
Классификация ферментов. Особенности строения и свойств ферментов. -
2 слайд
ФЕРМЕНТЫ
(от лат. fermentum — брожение, закваска) – это энзимы, специфические белки, увеличивающие скорость протекания химических реакций в клетках всех живых организмов.Наука о ферментах называется энзимологией.
-
3 слайд
Термин «фермент» был предложен в XVII веке химиком ван Гельмонтом при обсуждении механизмов пищеварения.
История изучения -
4 слайд
В XIX в. Луи Пастер, изучая превращение углеводов в этиловый спирт под действием дрожжей, пришёл к выводу, что этот процесс (брожение) катализируется некой жизненной силой (ферментом), находящейся в дрожжевых клетках, причём он считал, что эти «силы» неотделимы от структуры живой клетки дрожжей.
История изучения -
5 слайд
Юстас Либих и его сторонники, отстаивая химическую природу брожения, считали, что оно является следствием образования в клетках микроорганизмов растворимых ферментов.
Луи Пастер считал, что брожение вызывается лишь живыми микроорганизмами и что процесс брожения неразрывно связан с их жизнедеятельностью.
История изучения
В середине 19 в. разгорелась дискуссия о природе брожения. -
6 слайд
История изучения
Дискуссия Либиха и Пастера о природе брожения была разрешена в 1897 Эдуардом Бухнером, который, растирая дрожжи с инфузорной землёй, выделил из них бесклеточный растворимый ферментный препарат (зимазу), вызывавший спиртовое брожение. В 1907 г. Бухнеру была присуждена Нобелевская премия по химии «за проведенную им научно-исследовательскую работу по биологической химии и открытие внеклеточной ферментации».
В течение последующих 10 лет было выделено ещё несколько ферментов, и белковая природа ферментов была окончательно доказана. -
7 слайд
Впервые ферменты выделили в кристалитической форме в 1926 году Джеймс Бетчеллер Самнер и Джон Говард Нортроп.
В 1946 году им была присуждена Нобелевская премия.
История изучения
Джеймс Бетчеллер Самнер
Джон Говард Нортроп. -
8 слайд
В 1961 году предложена комиссией международного биохимического союза систематическая номенклатура ферментов. Ферменты подразделили на 6 групп в соответствии с типом реакции, которую они катализируют.
Рабочее название складывалось из названия субстрата, типа каталитической реакции и окончания –аза.
Пример: лактан+дегидрогенизация+аза=лактатдегидрогеназа
Известным ферментам оставлены прежние названия пепсин ,трипсин.
Классификация ферментов -
9 слайд
Классификация ферментов
-
10 слайд
Обычно ферменты выделяют из тканей животных, растений, клеток и культуральных жидкостей микроорганизмов, биологических жидкостей (кровь, лимфа и др.).
Для получения некоторых труднодоступных ферментов используются методы генетической инженерии.
Получение ферментов. -
11 слайд
Строение ферментов
Ферменты
Простые —
протеины
Сложные —
протеиды
небелковая часть или простетическая группа — кофермент
Белковая часть носит название – апофермент
Белковая часть носит название – апофермент -
12 слайд
Строение ферментов
Коферменты можно рассматривать как составную часть молекулы фермента. Это органические вещества, среди которых различают: нуклеотиды (АТФ, УМФ, и пр), витамины или их производные (ТДФ – из тиамина (В1), ФМН – из рибофлавина (В2), коэнзим А – из пантотеновой кислоты (В3), НАД и пр) и тетрапиррольные коферменты – гемы.Функции простетической группы следующие: участие в акте катализа, осуществление контакта между ферментом и субстратом, стабилизация молекулы фермента в пространстве.
-
13 слайд
Ферменты имеют 2 центра:
Активный центр и Аллостерический центр.
Строение ферментов
Активный центр (АЦФ) – это относительно небольшой участок, расположенный на поверхности молекулы фермента, который непосредственно участвует в катализе.
Состоит из уникального сочетания аминокислотных остатков, обеспечивает связь с субстратом и его дальнейшее превращение.В АЦФ различают:
Субстратсвязывающий центр – участок, который отвечает за комплиментарное связывание субстрата и образование фермент – субстратного комплекса.
Каталитический центр – непосредственно участвуют в химические реакции с субстратом. -
14 слайд
Аллостерический центр — комбинация аминокислотных остатков на поверхности фермента, с которым связываются низкомолекулярные соединения (эффекторы), молекулы которых отличаются от субстратов.
Присоединение эффектора изменяет третичную структуру и соответственно и конфигурацию АЦФ, вызывая тем самым снижение (ингибиторы) или повышение (активаторы) активности.
Ферменты, которые подвергались воздействию эффекторов называются аллостерическими.
Строение ферментов -
15 слайд
Строение ферментов
Вещество, химическое превращение которого катализируется ферментом носит название субстрат -
16 слайд
Субстрат- вещество
на которое действует
фермент
Фермент и субстрат должны подходить
друг к другу «как ключ к замку»
Принцип действия ферментов -
17 слайд
Образование комплекса фермент — субстрат
-
18 слайд
Акт катализа складывается из трех последовательных этапов.
1. Образование фермент-субстратного комплекса при взаимодействии через активный центр.
2. Связывание субстрата происходит в нескольких точках активного центра, что приводит к изменению структуры субстрата, его деформации за счет изменения энергии связей в молекуле. Это вторая стадия и называется она активацией субстрата. При этом происходит определенная химическая модификация субстрата и превращение его в новый продукт или продукты.
3. В результате такого превращения новое вещество (продукт) утрачивает способность удерживаться в активном центре фермента и фермент-субстратный, вернее уже фермент-продуктный комплекс диссоциирует (распадается).
Виды каталитических реакций:
А+Е = АЕ = БЕ = Е + Б
А+Б +Е = АЕ+Б = АБЕ = АБ + Е
АБ+Е = АБЕ = А+Б+Е,
где Е — энзим, А и Б — субстраты, либо продукты реакции.
Механизм действия ферментов -
19 слайд
Механизм действия ферментов
-
20 слайд
Ферменты обладают свойствами белков, но имеют и особенности:
1. Зависимость от РН
2. Зависимость от температуры
3. Высокая специфичность действия
4. Способностью к регуляции – т.е. могут подвергаться влиянию активаторов или ингибиторов
Ферменты или энзимы обозначают буквой Е -
21 слайд
Оптимум рН для большинства энзимов 6,0-8,0. Это значение рН при котором фермент проявляет максимальную активность.
Ионы водорода могут изменять степень ионизации субстрата, продукта и фермента.
Оптимум температуры для большинства энзимов 38-40С, при 41-42С происходит тепловая денатурация.
При повышение t на 10С, скорость ферментативной реакции увеличивается в 2 раза.
1. Зависимость от рН
2. Зависимость от температуры
Свойства ферментов -
22 слайд
Специфичность действия определяется структурой активного центра фермента и заключается в том, что каждый фермент катализирует превращение одного субстрата или группы субстратов, сходных по своей структуре.
3. Высокая специфичность действия
Свойства ферментов -
23 слайд
Свойства ферментов
Различают несколько видов специфичности.
Стереохимическая субстратная специфичность — фермент катализирует превращение только одного стереоизомера субстрата. Например, фумаратгидратаза катализирует присоединение молекулы воды к кратной связи фумаровой кислоты, но не к ее стереоизомеру — малеиновой кислоте.
Абсолютная субстратная специфичность — фермент катализирует превращение только одного субстрата. Например, уреаза катализирует гидролиз только мочевины.
Групповая субстратная специфичность — фермент катализирует превращение группы субстратов сходной химической структуры. Например, алкогольдегидрогеназа катализирует превращение этанола и других алифатических спиртов, но с разной скоростью. -
24 слайд
Свойства ферментов
4. Способностью к регуляции
Влияние на активность ферментов активаторов и ингибиторов. К числу факторов, повышающих активность ферментов, относятся катионы металлов и некоторые анионы. Чаще всего активаторами ферментов являются катионы Mg2+, Mn2+, Zn2+, K+ и Со2+, а из анионов — Сl-. Катионы действуют на ферменты по-разному. В одних случаях они облегчают образование фермент-субстратного комплекса, в других — способствуют присоединению кофермента к апоферменту, либо присоединяются к аллостерическому центру фермента и изменяют его третичную структуру, в результате чего субстратный и каталитический центры приобретают наиболее выгодную для осуществления катализа конфигурацию. -
25 слайд
Ингибиторы тормозят действие ферментов. Ингибиторами могут быть как эндогенные, так и экзогенные вещества. Механизмы ингибирующего действия различных химических соединений разнообразны.
-
26 слайд
Ферменты, участвующие в синтезе белков, нуклеиновых кислот и ферменты энергетического обмена присутствуют во всех клетках организма. Но клетки, которые выполняют специальные функции содержат и специальные ферменты.
Так клетки островков Лангерганса в поджелудочной железе содержат ферменты, катализирующие синтез гормонов инсулина и глюкагона. Ферменты, свойственные только клеткам определенных органов называют органоспецифическими: аргиназа и урокиназа — печень, кислая фосфатаза- простата. По изменению концентрации таких ферментов в крови судят о наличии патологий в данных органах.В клетке отдельные ферменты распределены по всей цитоплазме, другие встроены в мембраны митохондрий и эндоплазматического ретикулума, такие ферменты образуют компартменты, в которых происходят определенные, тесно связанные между собой этапы метаболизма.
Многие ферменты образуются в клетках и секретируются в анатомические полости в неактивном состоянии — это проферменты.
Существуют также изоферменты — ферменты, отличающиеся по молекулярной структуре, но выполняющие одинаковую функцию.Распределение ферментов в организме
-
27 слайд
Ферменты получили широкое применение в легкой, пищевой и химической промышленности, а также в медицинской практике.
В пищевой промышленности ферменты используют при приготовлении безалкогольных напитков, сыров, консервов, колбас, копченостей.
В животноводстве ферменты используют при приготовлении кормов.
Ферменты используют при изготовлении фотоматериалов.
Ферменты используют при обработке овса и конопли.
Ферменты используют для смягчения кожи в кожевенной промышленности.
Ферменты входят в состав стиральных порошков, зубных паст.
В медицине ферменты имеют диагностическое значение – определение отдельных ферментов в клетке помогает распознаванию природы заболевания (например вирусный гепатит – по активности фермента в плазме крови) их используют для замещения недостающего фермента в организме.
Применение ферментов -
28 слайд
Тесты «Ферменты»
1. Ферменты являются:
А) регуляторами;
Б) катализаторами;
В) активаторами субстратов;
Г) переносчиками веществ через мембрану;
Д) медиаторами нервного импульса.2. Ферменты могут состоять только из:
А) белка;
Б) белка и небелковой части;
В) нуклеотидов;
Г) низкомолекулярных азотсодержащих органических веществ;
Д) липидов и углеводов.3. Кофермент – это:
А) легкоотделяющаяся белковая часть сложного фермента;
Б) неотделяющаяся небелковая часть сложного фермента;
В) белковая часть сложного фермента;
Г) небелковая часть простого фермента;
Д) непрочносвязанная небелковая часть сложного фермента.
Закрепление нового материала -
29 слайд
4.Простетическая группа – это:
А) белковая часть сложного фермента;
Б) стабилизатор структуры фермента;
В) активатор сложного фермента;
Г) прочносвязанная с ферментом небелковая часть;
Д) часть фермента, образующая каталитический центр.5. Как называется небелковая часть сложного фермента, отвечающая за катализ?
А) Кофермент;
Б) Апофермент.6. К какому классу относятся ферменты, катализирующие реакции переноса функциональных групп и молекулярных остатков с одной молекулы на другую?
А) Гидролазы;
Б) Трансферазы;
В) Оксидоредуктазы;
Г) Изомеразы. -
30 слайд
7. Как называется центр фермента, в котором происходит присоединение субстрата?
А) Каталитический;
Б) аллостерический;
В) субстратный;
Г) активный.
8. Ферменты, катализирующие расщепление химических связей без присоединения воды, относятся к классу:
А) трансфераз;
Б) лигаз;
В) лиаз;
Г) гидролаз;
Д) изомераз.
9. Согласно классификации ферменты подразделяют на:
А) 5 групп;
Б) подгруппы;
В) 6 групп;
Г) подклассы.
10. Как называется центр фермента, отвечающий за катализ?
А) Каталитический;
Б) Аллостерический;
В) Субстратный;
Г) Активный. -
31 слайд
Домашнее задание
1.Творческое задание: подготовить презентацию.
2. Реферат по теме «Области применения ферментов»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
6 156 974 материала в базе
- Выберите категорию:
- Выберите учебник и тему
- Выберите класс:
-
Тип материала:
-
Все материалы
-
Статьи
-
Научные работы
-
Видеоуроки
-
Презентации
-
Конспекты
-
Тесты
-
Рабочие программы
-
Другие методич. материалы
-
Найти материалы
Другие материалы
- 10.05.2016
- 956
- 9
- 10.05.2016
- 684
- 0
- 10.05.2016
- 546
- 2
- 10.05.2016
- 521
- 1
- 10.05.2016
- 976
- 1
- 10.05.2016
- 405
- 0
- 10.05.2016
- 503
- 0
Вам будут интересны эти курсы:
-
Курс повышения квалификации «Химия окружающей среды»
-
Курс профессиональной переподготовки «Химия: теория и методика преподавания в образовательной организации»
-
Курс профессиональной переподготовки «Управление персоналом и оформление трудовых отношений»
-
Курс повышения квалификации «Нанотехнологии и наноматериалы в биологии. Нанобиотехнологическая продукция»
-
Курс профессиональной переподготовки «Экскурсоведение: основы организации экскурсионной деятельности»
-
Курс повышения квалификации «Особенности подготовки к сдаче ОГЭ по химии в условиях реализации ФГОС ООО»
-
Курс повышения квалификации «Правовое регулирование рекламной и PR-деятельности»
-
Курс профессиональной переподготовки «Биология и химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Современные образовательные технологии в преподавании химии с учетом ФГОС»
-
Курс профессиональной переподготовки «Метрология, стандартизация и сертификация»
-
Курс профессиональной переподготовки «Техническое сопровождение технологических процессов переработки нефти и газа»
-
Курс профессиональной переподготовки «Организация системы учета и мониторинга обращения с отходами производства и потребления»
-
Курс профессиональной переподготовки «Организация и управление процессом по предоставлению услуг по кредитному брокериджу»
-
Курс повышения квалификации «Информационная этика и право»
Презентация на тему «Ферменты» для улучшенной подготовки обучающихся к ОГЭ и ЕГЭ.В презентации освящена роль ферментов в организме человека,история их открытия,их свойства и природа.Так же в презентации уделено вниманию роли ферметов при таких значимых процессах как фотосинтез и биосинтез белка.учебная презентация
Ферменты
ФЕРМЕНТЫ
● Подготовил учитель биологии
МГБОУ БИЮЛИ
● Бажан Ольга Анатольевна
Ферменты
Энзимологиянаука о
ферментах
● Энзимологиянаука о ферментах,о
структуре,механизмах действия и путях
регуляции активности
● Открытие ферментов было связано с
исследованиями в области пищеварения.
Первоначально считалось, что они лишь
участвуют в переваривании пищи, и только в
начале XX века была окончательно определена
та огромная роль, которую ферменты играют в
жизнедеятельности человека.
Ферменты
Роль ферментов в организмах
● Ферментыбиологические
катализаторы(ускорители) в живых
клетках
● Как катализаторы они не расходуются
в процессе реакции.Но они заметно
ускоряют реакцию.Без них бы в
организмах обмен веществ был бы
крайне замедлен
Ферменты
Без ферментов невозможно
● Обновление состарившихся клеток;
● Превращение питательных веществ в энергию и соединения, которые
используются затем для построения тканей и органов;
● Обезвреживание “отходов” обмена веществ и чужеродных организму
веществ;
● Защита от болезнетворных микроорганизмов, опухолевых клеток,
воспалительных и аллергических заболеваний.
● Не будь ферментов, человеку грозила бы «смерть у накрытого стола»!
Ведь то многообразие пищи, которое попадает в наш организм,
переваривается и усваивается лишь благодаря ферментам.
Ферменты
Работа ферментов зависит
● 1)От количества субстрата
● 2)От температуры (помним о том ,что
ферменты белки,а белки при
повышенной температуре денатурируют)
● 3)От рН среды (к примеру пепсин
расщепляет белки в кислой среде
желудка, а трипсин расщепляет белки в
щелочной среде)
Ферменты
Факты из истории изучения
ферментов
● Тот самый ученый
Шванн,который
создал клеточную
теорию ,открыл
фермент пепсин в
желудочном соке
● Открыл ферменты
русский химик
Кирхгоф в 1814
году
Ферменты
Кто изучал ферменты?
● «Не все белки
ферменты,но все
ферменты
белки!»
● «Носители жизни»
● И.П.Павлов
● Термин
«фермент»предло
жил ван Гельмонт
в 17 веке при
обсуждении
пищеварения
Ферменты
Макромолекулы энзимов
● Как и другие протеины, энзимы состоят из аминокислот. И что
интересно, на создание каждого фермента уходит от 100 до 1000000
аминокислот, нанизанных, словно жемчуг на нить. Но эта нить не
бывает ровной – обычно изогнута в сотни раз. Таким образом,
создается трехмерная уникальная для каждого фермента структура.
Меж тем, молекула энзима – сравнительно крупное образование, и
лишь небольшая часть его структуры, так называемый активный
центр, участвует в биохимических реакциях.
● Каждая аминокислота соединена с другой определенным типом
химической связи, а каждый фермент имеет свою уникальную
последовательность аминокислот. Для создания большинства из них
используются примерно 20 видов амино веществ. Даже
незначительные изменения последовательности аминокислот могут
кардинально менять внешний вид и «таланты» фермента.
Ферменты
Строение фермента
Ферменты
Сложные фермент
Ферменты
Витамины и ферменты
● Некоторые витамины являются
составной частью ферментов
(коферменты).Например витамины
В1,В2,В6,РР и другие
● Поэтому если в пище недостаточно
витаминов,то работа ферменты будет
затруднена и обмен веществ будет
нарушен
Ферменты
От чего гибнут ферменты
● 1) Температура выше 37
● 2)Заморозка (после разморозки ) через 15
минут ферменты не работают
● 3)Гниение,брожение
● 4)Уксус
● 5)Микроволновка
● 6) Химикаты
Ферменты
Ферменты в фотосинтезе
● В световой фазе фотосинтеза происходит синтез АТФ и НАДФ∙H2
за счет лучистой энергии. Это происходит на тилакоидах
хлоропластов, где пигменты и ферменты образуют сложные
комплексы для функционирования электрохимических цепей, по
которым передаются электроны и отчасти протоны водорода.
● ФЕРМЕНТЫ ПЕРЕНОСЧИКИ
● Электроны в конечном итоге оказываются у кофермента НАДФ,
который, заряжаясь отрицательно, притягивает к себе часть
протонов и превращается в НАДФ∙H2. Также накопление протонов
по одну сторону тилакоидной мембраны и электронов по другую
создает электрохимический градиент, потенциал которого
используется ферментом АТФсинтетазой для синтеза АТФ из
АДФ и фосфорной кислоты.
Ферменты
Роль ферментов
переносчиков
Ферменты
Ферменты в биосинтезе белка
Все реакции белкового синтеза катализируются
специальными ферментами. Синтез информационной РНК
ведет фермент, который «ползет» вдоль молекулы ДНК от
начала гена до его конца и оставляет позади себя готовую
молекулу информационной РНК. Ген в этом процессе дает
только программу для синтеза, а сам процесс осуществляет
фермент. Без участия ферментов не происходит и
соединения аминокислот с транспортной РНК.
Существуют особые ферменты, обеспечивающие захват и
соединение аминокислот с их транспортными РНК. Наконец,
в рибосоме в процессе сборки белка работает фермент,
сцепляющий аминокислоты между собой.
Ферменты
РНК полимераза ,фермент
,создающий иРНК
Ферменты
ДНКполимераза ,фермент
отвечающий за удвоение
молекулы ДНК
Материалы на данной страницы взяты из открытых истончиков либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.
Введите ваш emailВаш email
Опубликовано 19.06.2015 — 15:49 — Поспелова Светлана Викторовна
Учебная презентация к уроку в 10 классе по теме «Ферменты»
Скачать:
| Вложение | Размер |
|---|---|
| 1.76 МБ |
Предварительный просмотр:
Подписи к слайдам:
- Мне нравится
1. Ферменты
2. Ферменты
Ферменты — белки, участвующие в процессах
анаболизма (синтеза) и катаболизма (распада), т.е.
в метаболизме. Ферменты распознают
соответствующие им метаболиты (субстраты),
вступают с ними во взаимодействие и ускоряют
химические реакции.
Фермент – это белковая молекула, которая
ускоряет протекание биохимических реакций в
организме человека. Синонимом понятия
фермент является термин энзим.
3. Ферменты
Фермент состоит из двух частей –
собственно белковой части и активного
центра фермента. Белковая часть
называется апофермент, а активный центр
– кофермент. Вся молекула фермента, то
есть апофермент плюс кофермент носит
название голофермент. Апофермент всегда
представлен
исключительно белком третичной
структуры. Третичная структура означает,
что линейная цепочка аминокислот
преобразуется в структуру сложной
пространственной конфигурации.
Кофермент может быть представлен
органическими веществами (витамин В6,
В1, В12, флавин, гем и т.д.) или
неорганическими (ионы металлов – Cu, Co,
Zn и т.д.). Собственно ускорение
биохимической реакции производится
именно коферментом.
4. Ферменты
Классы ферментов
1.
Оксиредуктазы
катализируют окислительновосстановительные реакции.
Каталаза, Алкогольдегидрогенаща
2. Трансферазы катализируют реакции переноса различных групп
от одного субстрата (донор) к другому (акцептор).
5. Ферменты
Классы ферментов
3. Гидролазы катализируют гидролиз химических связей.
4. Лиазы катализируют разрыв химических связей без
гидролиза с образованием двойной связи в одном из продуктов
Пример: эстеразы, пепсин, трипсин, амилаза, липопротеинлипаз
а.
6. Ферменты
Классы ферментов
5. Изомеразы катализирующие структурные или геометрические
изменения в молекуле субстрата с образованием изоформ.
6. Лигазы катализирующие образование химических связей C—
C, C—S, C—O и C—N между субстратами за счёт реакций
конденсации, сопряжённых с гидролизом АТФ.
7. Ферменты
Активный центр — это особая часть молекулы фермента, определяющая её
специфичность и каталитическую активность.
Коферменты или коэнзимы — малые молекулы небелковой
природы, специфически соединяющиеся с
соответствующими белками, называемыми апоферментами,
и играющие роль активного центра или простетической
группы молекулы фермента.
8. Изменение количества фермента в крови
• Гиперферментемия
— нарушение проницаемости клеточных
мембран (пример — воспалительный процесс)
— лизис клеток (цитолиз) при действии разных
факторов (токсины, гипоксия, недостаток АТФ и др.)
— клеточная пролифирация (опухоль)
9. Изменение количества ферментов
Гипоферментемия
— генетически обусловленная (первичная)
— нарушение синтеза фермента (вторичная)
— нарушение функций органа,
синтезирующего фермент (например, печень)
Дисферментемия -нарушение
соотношения ферментов (АЛТ и АСТ)
10. Разделение ферментов по месту синтеза и выполнения функции
Секреционные
Индикаторные
Экскреционные
Оценка ферментативных соотношений в сыворотке
с позиции данной классификации используется для
диагностики и дифференциальной диагностики
патологии органов и тканей.
11. СЕКРЕционНЫЕ ферменты
Ферменты, синтезируемые клетками органов и
тканей, поступающие в кровь, где и выполняют
свои специфические функции
(ферменты свертывающей системы крови,
холинэстераза)
При патологии в органах и тканях синтез этих
ферментов нарушается и уровень в сыворотке
крови снижается (пример, снижение активности
холинэстеразы при заболеваниях печени
печени)
12. Клеточные (индикаторные) ферменты
Ферменты, синтезируемые клетками органов и тканей и
выполняющие функции в этих клетках (АЛТ, АСТ, ГЛДГ и
др).
Количество их в крови зависит от
внутриклеточной локализации фермента
проницаемости клеточных мембран
усиления клеточной пролифирации
наличия и степени цитолиза клеток
ПРИ ПАТОЛОГИИ УРОВЕНЬ ЭТИХ ФЕРМЕНТОВ В СЫВОРОТКЕ
КРОВИ УВЕЛИЧИВАЕТСЯ (ПРИМЕР, ПЕЧЕНЬ)
13. Экскреционные ферменты
Ферменты, синтезирующиеся клетками желез
ЖКТ, или, в частности, клетками внутри- и
внепеченочных желчных протоков (ЩФ, ГГТ, ЛАП)
При патологии (например, холестазе) уровень
этих ферментов в сыворотке крови повышается.
Оценка ферментативных соотношений в сыворотке с
позиции данной классификации используется для
диагностики и дифференциальной диагностики
патологии органов и тканей.
14. Амилаза
Амилаза вырабатывается поджелудочной железой и участвует в
расщеплении крахмала и гликогена до глюкозы. Амилаза – это один
из ферментов, участвующих в пищеварении. Наибольшее содержание
амилазы определяется в поджелудочной железе и слюнных железах.
Активность α-амилазы в моче в 10 раз выше, чем активность αамилазы в крови. Определение активности α-амилазы и диастазы
используют для диагностики панкреатитов и некоторых других
заболеваний поджелудочной железы. При хронических и подострых
панкреатитах используют определение активности α-амилазы в соке
двенадцатиперстной кишки
20-100 Ед/л
• активность амилазы крови
• активность диастазы (амилазы) мочи до 1000 Ед/л
15.
Повышение амилазы крови
Повышение активности α-амилазы в крови называется гиперамилаземия, а повышение активности диастазы
мочи – гиперамилазурия.
Повышение амилазы крови выявляется при следующих состояниях:
в начале острого панкреатита, максимум достигается через 4 часа от начала приступа, а снижается до нормы на
2-6 сутки от начала приступа (повышение активности α-амилазы возможно в 8 раз)
при обострении хронического панкреатита (при этом активность α-амилазы возрастает в 3-5 раз)
при наличии опухолей или камней в поджелудочной железе
острая вирусная инфекция – свинка
алкогольная интоксикация
внематочная беременность
Когда амилаза мочи повышена?
Повышение концентрации амилазы в моче развивается в следующих случаях:
при остром панкреатите происходит увеличение активности диастазы в 10-30 раз
при обострении хронического панкреатита активность диастазы возрастает в 3-5 раз
при воспалительных заболеваниях печени наблюдается умеренное повышение активности диастазы в 1,5-2
раза
острый аппендицит
холецистит
кишечная непроходимость
алкогольная интоксикация
кровотечения из язвы желудочно-кишечного тракта
при лечении сульфаниламидными препаратами, морфином, мочегонными средствами и оральными
контрацептивами
При развитии тотального панкреонекроза, раке поджелудочной железы и хроническом панкреатите активность
α-амилазы может не увеличиваться.Снижение амилазы крови и мочи
Существуют состояния организма, при которых активность α-амилазы может снижаться. Низкая активность
диастазы мочи выявляется при тяжелом наследственном заболевании – муковисцидозе.
16. Липаза
Липаза – это один из пищеварительных ферментов, который участвует в расщеплении жиров.Для
работы данного фермента необходимо присутствие желчных кислот и кофермента, который
называется колипаза. Липаза вырабатывается различными органами человека – поджелудочной
железой, легкими, лейкоцитами.
активность липазы крови ——— 13 — 60Ед/мл
Наибольшее диагностическое значение имеет липаза, которая синтезируется в поджелудочной
железе. Поэтому определение активности липазы применяют преимущественно в диагностике
заболеваний поджелудочной железы.
Когда липаза крови повышена?
При каких состояниях повышается активность липазы в сыворотке крови:
острый панкреатит
различные опухоли и опухолевидные образования поджелудочной железы
холециститы
холестаз
прободение язв
болезни обмена веществ – сахарный диабет, подагра, ожирение
прием лекарств (гепарин, наркотические обезболивающие, снотворные барбитурового
ряда, индометацин)
Также повышение активности липазы возможно при травмах, ранениях, операциях, переломах и
острой почечной недостаточности. Однако повышенная активность липазы при указанных состояниях
не является специфичной для них, поэтому в диагностике данных заболеваний не используется.
Когда уровень липазы крови понижен?
Снижение активности липазы в сыворотке крови наблюдается при опухолях различной локализации
(кроме поджелудочной железы), удаленной поджелудочной железе,неправильном питании или
наследственной триглицеридемии.
17. ЛДГ
Лактатдегидрогеназа (ЛДГ) – это фермент, который содержится в цитоплазме клеток почек, сердца, печени, мышц,
селезенки, поджелудочной железы. Коферментом ЛДГ являются ионы цинка и никотинамидадениндинуклеотид
(НАД). ЛДГ участвует в обмене глюкозы, катализируя превращение лактата (молочной кислоты) в пируват
(пировиноградную кислоту). В сыворотке крови имеется пять изоформ данного фермента.ЛДГ1 и ЛДГ2 изоформы
сердечного происхождения, то есть содержатся преимущественно в сердце. ЛДГ3, ЛДГ4 и ЛДГ5 – печеночного
происхождения.
Взрослые 0,8-4 мкмоль/ч*л140-350 Ед/л
Новорожденные 2,0-8 мкмоль/ч*л400-700 Ед/л
ЛДГ в диагностике инфаркта миокарда
Рассмотрим диагностическое значение определения суммарной активности ЛДГ. Определение активности ЛДГ
используют для поздней диагностики инфаркта миокарда, поскольку увеличение его активности развивается через 1224 часа после приступа и может сохраняться на высоком уровне до 10-12 суток. Это очень важное обстоятельство при
обследовании больных, поступивших в лечебное учреждение после приступа. Если увеличение активности ЛДГ
незначительно, значит, мы имеем дело с мелкоочаговым инфарктом, если, напротив, увеличение активности
длительное – значит, речь идет об обширном инфаркте.У больных стенокардией активность ЛДГ увеличена в первые
2-3 дня после приступа.
ЛДГ в диагностике гепатита
Активность суммарной ЛДГ может увеличиваться при остром гепатите (за счет увеличения активности ЛДГ4 и ЛДГ5).
При этом активность ЛДГ в сыворотке крови повышается в первые недели желтушного периода, то есть в первые 10
дней.
Норма ЛДГ у здоровых людей:
Возможно повышение активности ЛДГ у здоровых людей (физиологическое) после физических нагрузок, во время
беременности и после принятия алкоголя. Кофеин, инсулин, аспирин, ацебутолол, цефалоспорины, гепарин,
интерферон, пенициллин, сульфаниламиды также вызывает увеличение активности ЛДГ. Поэтому при приеме данных
препаратов нужно учитывать возможность повышенной активности ЛДГ, которая не говорит о наличии патологических
процессов в организме.
18. АЛТ
Аланинаминотрансфераза (АЛТ, АлАТ) – фермент, относящийся к аминотрансферазам
(трансаминазам), то есть осуществляющим перенос аминокислот с одной биологической
молекулы на другую. Поскольку в названии фермента присутствует аминокислота аланин, это
означает, что данный фермент переносит именно аминокислоту аланин. Коферментом АСТ
является витамин В6. АЛТ синтезируется в клетках, поэтому в норме его активность в крови
невысока. Преимущественно синтезируется в клетках печени, но также имеется в клетках почек,
сердца, мышцах и поджелудочной железе.
для мужчин
до 40Ед/л
для женщин
до 32Ед/л
Повышение активности АЛТ у здоровых людей (физиологическое) может быть вызвано приемом
некоторых лекарственных препаратов (антибиотиков, барбитуратов,наркотиков,
противоопухолевых препаратов, оральных контрацептивов, нестероидных
противовоспалительных препаратов, дикумаринов, эхинацеи, валерианы), сильными
физическими нагрузками, травмами. Также высокая активность АЛТ наблюдается у подростков в
период интенсивного роста.
АЛТ в диагностике заболеваний печени
При диагностике патологических состояний организма повышение активности АЛТ является
специфическим признаком острого заболевания печени. Повышение активности АЛТ в крови
выявляется за 1-4 недели до проявления симптомов болезни и за 7-10 дней до появления
максимального уровня билирубина в крови. Увеличение активности АЛТ при остром заболевании
печени составляет 5-10 раз. Повышенная активность АЛТ в течение длительного времени или
повышение ее в поздние сроки заболевания свидетельствует о начале массивного некроза
печени.
19. АСТ
AСТ — строение и функция фермента
Аспартатаминотрансфераза (АСТ, АсАТ) – фермент из группы трансаминаз, который осуществляет перенос аминокислоты аспартата
с одной биологической молекулы на другую. Коферментом АСТявляется витамин В6. АСТ является внутриклеточным ферментом, то
есть в норме находится в клетках. В клетках фермент может присутствовать в цитоплазме и митохондриях. Наибольшая активность
АСТ выявлена в сердце, печени, мышцах и почках. В крови присутствует в основном цитоплазматическая фракция АСТ.Норма
для мужчин
для женщин
15-31Ед/л
20-40Ед/л
Аспартатаминотрансферазы (АСТ / АсАТ)
Возможны более высокие значения активности АСТ у здоровых людей (физиологические) при чрезмерных мышечных нагрузках,
приеме некоторых лекарств, например, эхинацеи,валерианы,алкоголя, больших доз витамина А, парацетамола, барбитуратов,
антибиотиков и т.д.
Активность АСТ в сыворотке крови повышается в 4-5 раз при инфаркте миокарда и сохраняется таковой в течение 5 дней. Если
активность АСТ держится на высоком уровне и не снижается в течение 5 дней после приступа, то это говорит о неблагоприятном
прогнозе для больного с инфарктом миокарда. Если наблюдаются ещё повышения активности фермента в крови, то данный факт
свидетельствует о расширении зоны инфаркта.
При некрозе или повреждении печеночных клеток также повышается активность АСТ. Причем чем выше активность фермента, тем
больше степень повреждения.
Почему Аспартатаминотрансфераза (АСТ, АсАТ) повышена?
Повышение активности АСТ крови присутствует в следующих случаях:
гепатиты
некроз печени
цирроз
алкоголизм
рак печени и метастазы в печени
инфаркт миокарда
наследственные и аутоиммунные заболевания мышечной системы (миодистрофия Дюшена)
мононуклеоз
гепатоз
холестаз
Существует еще целый ряд патологических состояний, при которых также происходит увеличение активности АСТ. К таким
состояниям относят – ожоги, травмы, тепловой удар, отравление ядовитыми грибами.
Низкая активность АСТ наблюдается при дефиците витамина В6 и наличии обширных повреждений печени (некроз, цирроз).
Однако в клинике используют определение активности АСТ в основном для диагностики повреждений сердца и печени. При
других патологических состояниях активность фермента также изменяется, однако ее изменение не является специфичным,
следовательно, не представляет высокой диагностической ценности.
20. ШФ
Щелочная фосфатаза (ЩФ) – является мембранным ферментом, который локализован в щеточной каемке желчных
канальцев. ЩФ может быть кишечной, плацентарной и неспецифичной (в тканях печени, почек и костей). Данный
фермент является ключевым в обмене фосфорной кислоты.
Норма щелочной фосфатазы крови
взрослые
Подростки
Беременные
30-90Ед/л
до 400Ед/л
до 250Ед/л
Возрастает активность ЩФ в крови здоровых людей (физиологическое повышение) при передозировке витамина С,
недостаточности кальция и фосфора в пищевом рационе, приеме оральных контрацептивов, гормональных препаратов
эстрогенов и прогестеронов, антибиотиков, сульфаниламидов, магнезии, омепразола, ранитидина и прочее.
Щелочная фосфатаза в диагностике заболеваний печени и желчных путей
Высокой специфичностью и диагностическим значением обладает определение активности ЩФ при подозрении на
заболевания печени. При обтурационной желтухе происходит увеличение активности ЩФ крови в 10 раз относительно
нормы. Определение данного показателя используется для лабораторного подтверждения именно этой формы желтухи.
В меньшей степени увеличение активности ЩФ происходит при гепатитах, холангитах, язвенном колите, кишечных
бактериальных инфекциях и тиреотоксикозе.
Значение щелочной фосфатазыпри заболеваниях костей и в травматологии
ЩФ является маркерным ферментом остеосинтеза, то есть увеличивается активность при заболеваниях костей или
метастазах опухолей в кость, а также при заживлении переломов.
Причины повышения щелочной фосфатазы
Высокую активность ЩФ выявляют при следующих патологиях:
обтурационная желтуха
опухоли кости или метастазы в кости
гипертиреоз
заболевания крови (миеломная болезнь, лимфогранулематоз, мононуклеоз)
рахит
деструктивные заболевания печени (цирроз, рак, туберкулез)
белые инфаркты (почки, легкого)
амилоидоз
Ферменты
История открытия
Впервые ферменты были открыты русским химиком К.С.Кирхгофом в 1814 году.
Русский физиолог И.П.Павлов
назвал ферменты
«Носителями жизни».
ОПРЕДИЛЕНИЕ:
- Ферменты или энзимы- это органические катализаторы белковой природы, которые ускоряют реакции, необходимые для функционирования организмов. На данный момент известно 2000 ферментов.
Классификация ферментов
Классы ферментов
Примеры
Катализируемая реакция
Перенос атомов(н)или электронов от одного в-ва к другому.
Дегидродегеназа,оксидаза.
Оксидоредуктазы
Тансмираза,кин.аза
П еренос определенной группы атомов(метильной,ацильной,фосфатной,амино)от одного в-ва к другому.
Трансферазы
Р еакции гидролиза
Липаза,амилаза,пептидаза.
Гидролазы
Изомеразы
Изомераза,мутаза.
Внутримолекулярная перестройка.
Негидролитическое присоединение к субстрату или отщепление от него группы атомов.(разрываются связи С-С,С-N,C-О,илиС-N
Декарбоксилаза,фумараза,альдолаза
Лиазы
СВОЙСТВА ФЕРМЕНТОВ :
- Селективность
- Эффективность
- Зависимость от температуры
- Зависимость от среды раствора
Селективность ферментов :
- Селективность (избирательность) -это свойство ферментов ускорять только одну или группу однотипных реакции.
- Селективность позволяет организму быстро и точно выполнить четкую программу синтеза веществ.
Эффективность ферментов :
- Эффективность-свойство ускорения реакции. Скорость некоторых ферментативных реакции может быть в 10 15 раз больше скорости реакции, протекающей в их отсутствие ……
Пример: 2Н 2 О 2 каталаза 2Н 2 О+О 2
Эффективность
зависит от
Температуры (наибольшая при t 37 º )
Среды раствора (от рН) пепсин (рН – от 1,5 до 2) (0,9-2,0) слюна (рН –6,8)) (5,6-7,9) желчь (рН – 6,8) (5,6-8,0) кровь плазма (рН – 7,4) (7,25-7,44) пот (рН – 7,4) (4,2-7,8) отклонение – причина заболеваний
Ферменты
Простые
.
Сложные
Белковый
компонент
Белковый
компонент
+
небелковая
часть
кофермент
Принцип действия ферментов
Фермент и субстрат должны подходить
друг к другу «как ключ к замку»
Субстрат- вещество
на которое действует
фермент
Действие каталазы (пероксидазы) сырого мяса
- В ПРОБИРКУ ПОМЕСТИЛИ
КУСОЧЕК СЫРОГО МЯСА И
ДОБАВИЛИ 2 МЛ Р-Р ПЕРЕКИСИ
ВОДОРОДА ,ВСЕ МЯСО
ПОКРЫЛОСЬ ПУЗЫРЬКАМИ
ГАЗА (О 2 ). ( ПРОВЕРИЛИ ЭТО С ПОМОЩЬЮ
ТЛЕЮЩЕЙ ЛУЧИНКИ , ОНА РАЗГОРЕЛАСЬ.)
Действие каталазы (пероксидазы) клубня картофеля
- РАСТЕРТЫЙ КАРТОФЕЛЬ СМЕШАЛИ С МЕЛКИМ ЧИСТЫМ ПЕСКОМ И ДОБАВИЛИ ПЕРЕКИСЬ ВОДОРОДА,ПРОИЗОШЛА БЫСТРАЯ Р-Я, ВЫДЕЛИЛИСЬ ПУЗЫРЬКИ ГАЗА (О 2 ) . РЕАКЦИЯ ПРОИЗОШЛА ОЧЕНЬ БЫСТРО , Т.К АКТИВНОСТЬ РАЗМЕЛЬЧЕНОЙ ТКАНИ КАРТОФЕЛЯ ОЧЕНЬ ВЕЛИКА.
Действие каталазы (пероксидазы) клеток зеленого листа
- В ПРОБИРКУ ПОМЕСТИЛИ КЛЕТКИ ЗЕЛЕНОГО ЛИСТА И ДОБАВИЛИ ПЕРОКСИДАЗУ ,В ПРОБИРКЕ ОБРАЗОВАЛСЯ ГАЗ КИСЛОРОД .
ГАЗ КИСЛОРОД ПОДНЯЛ КЛЕТКИ ЗЕЛЕНОГО
ЛИСТА НАД РАСТВОРОМ.
ДЛЯ ТОГО ,ЧТОБЫ ПРОВЕРИТЬ ,ЧТО ВЫДЕЛИЛСЯ
ГАЗ КИСЛОРОД ПОДНЕСЕМ ТЛЕЮЩУЮ ЛУЧИНКУ
К ПРОБИРКЕ ОНА НАЧНЕТ РАЗГОРАТЬСЯ
(Т.К КИСЛОРОД ПОДДЕРЖИВАЕТ ГОРЕНИЕ).
Действие дегидрогеназы коровьего молока на краситель
ВМОЛОКО(5МЛ),ДОБАВИЛИ ПО 5
КАПЕЛЬ МЕТИЛОВОГО СИНЕГО И
15 КАПЕЛЬ 0,5 %-ГО Р-РА ФОРМАЛЬДЕГИДА.
КРАСИТЕЛЬ
ПОСТЕПЕННО ОБЕСЦВЕЧИВАЕТСЯ .ЭТО
ПРОИСХОДИТ ПОТОМУ,ЧТО К ЕГО
МОЛЕКУЛЕ ПРИСОЕДИНЯЕТСЯ ВОДОРОД,
ОТОБРАННЫЙ У
ФОРМАЛЬДЕГИДА ПРИ УЧАСТИИ
ФЕПМЕНТА ДЕГИДРОГЕНАЗЫ,
КОТОРЫЙ СОДЕРЖИТСЯ В КОРОВЬЕМ МОЛОКЕ .
Практическое применение
Амилазы.
Пивоваренная
Текстильная
Осахаривание содержащегося
в солоде крахмала
Хлебопекарная
Удаление крахмала ,наносимого на
нити во время шлихтования
Хлеб лучше подрумянивается и дольше не черствеет
Протеазы(расщепляют белки)
Папаин
.
Пивоваренная
Мясная
Этапы процесса пивоварения, регулирующие качество пены
фармацевтическая
Умягче-ние мяса
Добавки к зубным пастам для удаления зубного налета
Трипсин
Фицин
Смывание желатина
с использованной
пленки для того,
чтобы извлечь
находящееся в нем
серебро
Пищевая — производство продуктов для детского питания
Сыроварение — свертывание молока
(получение сгустка казеина)
Ренин
Пепсин
Пищевая
Фармацевтическая
Производство «готовых» каш
Препараты,способствующие пищеварению(в дополнение к обычному действию пепсина в желудке)
Каталаза
Пищевая
Удаление пероксида водорода
Резиновая
Получение(из пероксида водорода)кислорода,необходимо-го для превращения латекса в губчатую резину
Бактериальные протеазы
Стирка белья
Кожевенная
Стиральные порошки с ферментными добавками
Текстильная
Отделение волоса-способ,при котором не повреждаются ни волос, ни шкура
Пищевая
Извлечение шерсти из обрывков овечьих шкур
Получение
белковых гидролизатов(для производства кормов)
1. Ферментами называются:
а) низкомолекулярные органические соединения, необходимые для осуществления процессов, протекающих в организме, б) природные катализаторы белковой природы, ускоряющие биохимические процессы,
в)биологически активные вещества, которые вырабатываются железами внутренней секреции и регулируют деятельность органов и тканей живого организма,
г)биологически активные вещества, угнетающие жизнедеятельность болезнетворных микроорганизмов.
2. Соотнесите:
природа катализатора : 1) органический, 2) неорганический ;
характерное свойство : а)высокая селективность,
б)небольшая относительная молекулярная масса, в) белковая природа, г) высокая эффективность.
3. Активность фермента зависит от:
а) температуры, б) кислотности среды, в) присутствия кофермента,
г) все предыдущие ответы верны.
Вывод:
Ферменты — катализаторы и для них характерны все принципы катализа, но ферменты обладают и рядом уникальных свойств, которые их отличают от неорганических катализаторов. Это отличие объясняется белковой природой фермента.
Сказ о дележе наследства
Умирал старый араб. Все его богатство состояло из 17 прекрасных белых верблюдов. Он собрал своих сыновей и объявил им свою последнюю волю: «Мой старший сын, опора семьи, должен получить после моей смерти половину верблюдов. Среднему сыну я завещаю треть всех верблюдов. Но и мой младший, любимый сын должен получить свою долю — одну девятую часть стада». Сказав это, старый араб умер. Похоронив отца, три брата стали делить верблюдов. Но исполнить волю отца они не смогли: невозможно было разделить 17 верблюдов ни пополам, ни на три части, ни на девять частей. Но тут через пустыню проходил дервиш. Бедный, как все ученые, он вел с собой черного облезлого верблюда, нагруженного книгами. Братья обратились к нему за помощью. И дервиш сказал: «Выполнить волю вашего отца очень просто. Я дарю вам моего верблюда, а вы попробуйте разделить наследство». У братьев оказалось 18 верблюдов, и все разрешилось. Старший сын получил половину верблюдов – 9, средний – треть стада – 6 и младший сын получил свою долю – двух верблюдов. Но 9, 6 и 2 дают 17, и после дележа оказался лишний верблюд — старый облезлый верблюд ученого. И дервиш сказал: «Отдайте мне назад моего верблюда за то, что я помог разделить вам наследство, а то мне придется самому тащить книги через пустыню». Вот этот черный верблюд и подобен ферменту. Он сделал возможным такой процесс, который без него был бы немыслим, а сам остался без изменений. Это действительно основное свойство ферментов, да и вообще всякого катализатора. Ферменты – это прежде всего катализаторы.
Слайд 2Оглавление
1.Притча о верблюдах.
2.Создание проблемной ситуации:
А) Демонсрационный опыт с пероксидом водорода;
1.Определение-
фермент.
2.История вопроса о ферментах
3.Строение ферментов
4.Механизм действия ферментов
5.Свойства ферментов .
6.Многообразие ферментов
7.Классификация ферментов

Слайд 3Оглавление
8.Результаты исследовательских работ:
а.Действие ферментов желудочного сока на белки
б.Специфичность действия ферментов:
лактаза,
уреаза.
амилаза и сахараза
9.Каталитическая активность ферментов

Слайд 4Определение
Ферменты – биологические катализаторы белковой природы, ускоряющие химические реакции в живых
организмах и вне их.
На данный момент химикам известно более 2000 ферментов

Слайд 5Строение ферментов
1.двухкомпонентными — сложными белками
Характерной особенностью двухкомпонентного фермента
является то, что
ни белковая часть, ни добавочная группа в
отдельности не обладают заменой каталитической активностью.
Только их комплекс проявляет ферментативные свойства.
2.однокомпонентными -простыми белками;
Иначе обстоит дело у однокомпонентных ферментов, не имеющих
добавочной группы, которая могла бы входить в
непосредственный контакт с преобразуемым соединением. Эту
функцию выполняет часть белковой молекулы, называемая
каталитическим центром.
По строению ферменты могут быть:

Слайд 6Механизм действия ферментов:
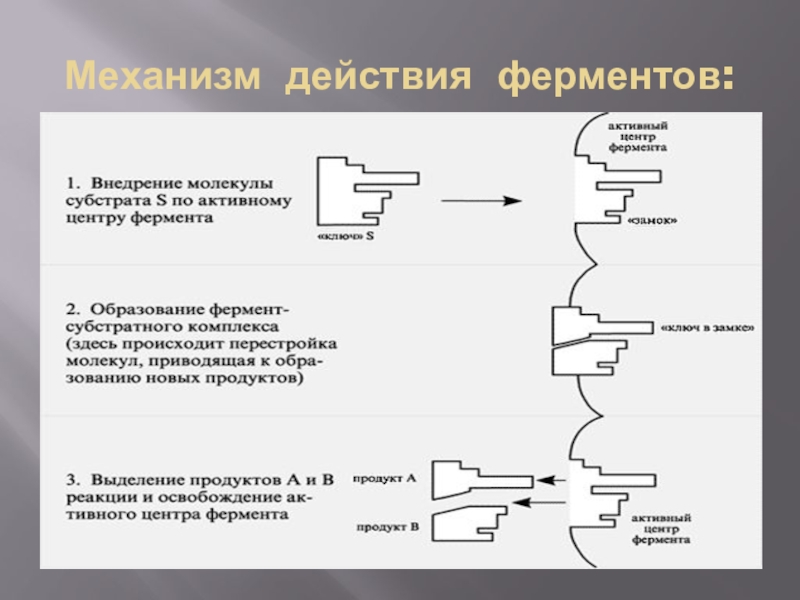
Слайд 7Механизм действия фермента
Е + S → Е S → Е S
1 → ЕР → Е + Р
фермент субстрат фермент- преобразованный фермент- фермент продукт
субстратный фермент- продуктивный
комплекс субстратный комплекс
комплекс

Слайд 8Исчезновение каталитической активности фермента:
При денатурации фермента его каталитическая активность исчезает,
т.к.
нарушается структура активного центра.

Слайд 9Центры в молекуле фермента:
1.Активный центр:
-присоединяет субстрат;
2.Аллостерический
центр:
присоединяет низкомолекулярные
вещества-активаторы или ингибиторы

Слайд 10Свойства ферментов:
Термолабильность — изменчивость фермента под влиянием температуры.
При возрастании температуры активность фермента
сначала растет, а затем, выше
определенной температуры, начинает снижаться.

Слайд 11фермент характеризуется температурным оптимумом:
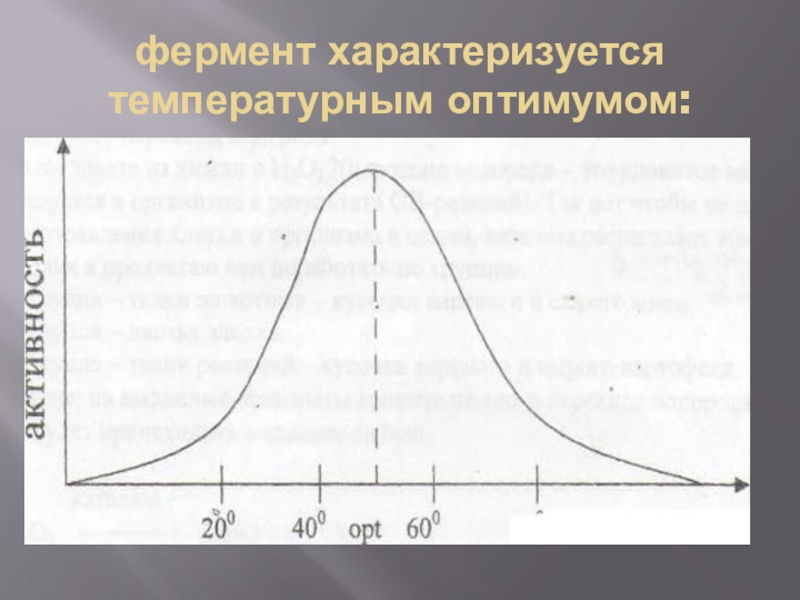
Слайд 12Температурные оптимумы:
1.Для ферментов животного происхождения topt = 40-50
2. для ферментов растительного происхождения -50-60°
3.

Слайд 13Влияние РН на активность ферментов:
1) амилаза слюны: РН = 7 (нейтральная
среда);
2) пепсин желудочного сока действует в кислой среде (РН=1,5-2,5),
3) трипсин кишечного сока имеет РН = 8-9 (щелочная среда).

Слайд 14Лактаза- молочный сахар
(лактозу)—
глюкоза + галактоза
Уреаза—мочевину—
Аммиак + углекислый газ

Слайд 15Скорость расщепления уреазы:
За 1 секунду 1 молекула уреазы расщепляет 30.000 молекул
мочевины. Если бы не было уреазы, то на это потребовалось бы 3 млн. лет.

Слайд 16Номенклатура ферментов
Сейчас используется новая номенклатура ферментов, принятая в 1961 году. В
связи со значительным усложнением научных названий в новой номенклатуре допускается сохранение, наряду с новыми, старых тривиальных названий ферментов.

Слайд 17Свойства ферментов
Ферменты обладают такими общими для всех белков свойствами, как:
Способность к
растворению в воде и образованию коллоидных растворов
Амфотерность (способность проявлять в зависимости от условий как кислотные, так и основные свойства)
Способность к денатурации и гидролизу
Протекание цветных реакций (биуретовой и ксантопротеиновой)

Слайд 18Денатурация белка —
— это разрушение вторичной и третичной структур до первичной
под влиянием высокой или низкой температур, сильных кислот или щелочей, этилового спирта и других факторов
Необратимая
(пример – вареное яйцо)
Обратимая
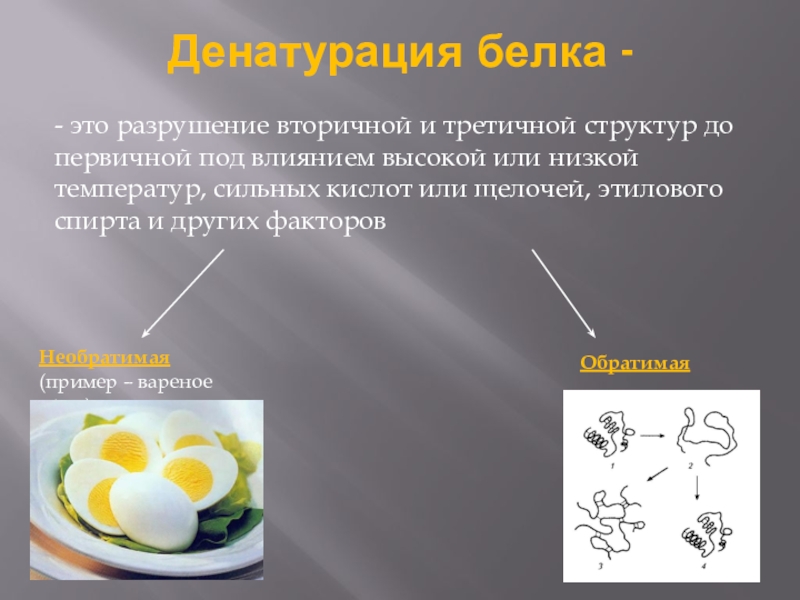
Слайд 19Свойства ферментов
Ферменты обладают также уникальными свойствами:
Необычно высокая каталитическая активность. Так, добавка
незначительных количеств фермента (10 — 10 М) ускоряет превращение субстрата в 10 — 10 раз.
Селективность (избирательность) действия – определяется их способностью превращать только данный тип субстратов в определенных реакциях и условиях
-9
-7
8
12

Слайд 20Свойства ферментов
Высокая специфичность ферментов. Благодаря данному свойству в организме не воцаряется
хаос: каждый из них выполняет строго определенные функции
Стабильность – способность сохранять каталитическую активность при определенных условиях
Эффективность – скорость некоторых ферментативный реакций может быть в 10 раз больше скорости реакций, протекающих в их отсутствие
15

Слайд 21Роль ферментов в жизнедеятельности организмов можно проиллюстрировать схемой:
Слайд 22Особенности ферментов
Многие ферменты наиболее эффективны при температуре человеческого тела (35-42 С).
При температуре, отличной от данной, ферменты перестают действовать, следовательно, прекращаются важнейшие жизненные процессы.

Слайд 23Особенности ферментов
Ферменты наиболее эффективно действуют при строго определенной среде раствора, при
определенных показателях т.н. водородного показателя pH. Данная величина характеризует кислотность растворов.
Например, пепсин наиболее активен при pH от 1,5 до 2,0; каталаза крови – при pH, равном 7,0

Слайд 24Применение
Ферменты используются в производстве:
Пищи и напитков(вино, хлеб, сыр)
Медикаментов («Пепсин», «Мезим», «Фестал»)
Моющих

Слайд 25Классификация ферментов:
Названия ферментов происходят
от:
типа катализируемой данным ферментом реакции + название
одного из продуктов реакции (или одного из ее участников) с прибавлением окончания -аза.
Окончание -аза служит для обозначения ферментной природы

Слайд 26 Классификация ферментов:
—Оксидоредуктазы.
—Трансферазы.
—Гидролазы.
—Лиазы.
—Изомеразы.
—Лигазы (Синтетазы)

Слайд 27Применение ферментов:
—. в животноводстве
—при изготовлении фотоматериалов
—при обработке овса и конопли.
—для
смягчения кожи в кожевенной промышленности
—в состав стиральных порошков, зубных паст.
— медицине ( диагностическое значение )
—для превращения химической энергии в электрическую.

Слайд 28Применение ферментов:
ферменты применяются более чем в 25 отраслях промышленности

Слайд 29Обобщение знаний:
1.Что такое ферменты?
2. Какими свойствами они обладают?
3.Чем объяснить
их отличие от неорганических катализаторов?

Слайд 30Вывод по изученной теме:
Как вы понимаете выражение:
«Все ферменты — белки,
но не все белки — ферменты»?

Слайд 32Тест
1.(3 балла). Класс соединений, к которому относятся ферменты:
А. Белки
Б. Жиры
В. Углеводы.
Г.

Слайд 33Тест
1.(3 балла). Класс соединений, к которому относятся ферменты:
А. Белки
Б. Жиры
В. Углеводы.
Г.

Слайд 34Тест
2.(3 балла). Вещества, подвергающиеся в организме ферментативному разложению:
А. Аминокислоты
Б. Углеводороды.
В. Углеводы.
Г.

Слайд 35Тест
2.(3 балла). Вещества, подвергающиеся в организме ферментативному разложению:
А. Аминокислоты
Б. Углеводороды.
В. Углеводы.
Г.

Слайд 36Тест
3.(3 балла). Продуктами гидролиза белков являются:
А. Глюкоза.
Б. Аминокислоты.
В. Глицерин и жирные

Слайд 37Тест
3.(3 балла). Продуктами гидролиза белков являются:
А. Глюкоза.
Б. Аминокислоты.
В. Глицерин и жирные

Слайд 38Тест
4. (3 балла). Температура, при которой ферменты в организме человека наиболее
эффективны:
А. 10 °С.
Б. 30 °С.
В. 37 °С.
Г. 40 °С.

Слайд 39Тест
4. (3 балла). Температура, при которой ферменты в организме человека наиболее
эффективны:
А. 10 °С.
Б. 30 °С.
В. 37 °С.
Г. 40 °С.

Слайд 40Тест
5.(3 балла). Селективностью (избирательностью) действия ферментов называется:
А. Способность фермента ускорять одну
или группу однотипных реакций.
Б. Способность фермента ускорять любые реакции.
В. Способность фермента замедлять любые реакции.
Г. Способность фермента замедлять одну или группу однотипных реакций.

Слайд 41Тест
5.(3 балла). Селективностью (избирательностью) действия ферментов называется:
А. Способность фермента ускорять одну
или группу однотипных реакций.
Б. Способность фермента ускорять любые реакции.
В. Способность фермента замедлять любые реакции.
Г. Способность фермента замедлять одну или группу однотипных реакций.

Слайд 42Тест
6.(3 балла). Значение рН желудочного сока, при котором фермент пепсин наиболее
активен:
А. 1,5—2,0.
Б. 3,0—4,0.
В. 5,0—6,0.
Г. 7,0—8,0.

Слайд 43Тест
6.(3 балла). Значение рН желудочного сока, при котором фермент пепсин наиболее
активен:
А. 1,5—2,0.
Б. 3,0—4,0.
В. 5,0—6,0.
Г. 7,0—8,0.

Слайд 44Тест
7.(3 балла). Фермент, добавляемый к зубным пастам для удаления зубного налета:
А.
Амилаза.
Б. Пепсин.
В. Каталаза.
Г. Фицин

Слайд 45Тест
7.(3 балла). Фермент, добавляемый к зубным пастам для удаления зубного налета:
А.
Амилаза.
Б. Пепсин.
В. Каталаза.
Г. Фицин

Слайд 46Тест
8.(3 балла). Фермент трипсин расщепляет:
А. Углеводы.
Б. Белки.
В. Жиры.
Г. Нуклеиновые кислоты.

Слайд 47Тест
8.(3 балла). Фермент трипсин расщепляет:
А. Углеводы.
Б. Белки.
В. Жиры.
Г. Нуклеиновые кислоты.

Слайд 48Тест
9.(3 балла). Высокая эффективность ферментов объясняется:
А. Быстрым восстановлением их молекул в
процессе работы.
Б. Многообразием ферментов.
В. Высокой активностью молекул ферментов.
Г. Все предыдущие ответы верны.

Слайд 49Тест
9.(3 балла). Высокая эффективность ферментов объясняется:
А. Быстрым восстановлением их молекул в
процессе работы.
Б. Многообразием ферментов.
В. Высокой активностью молекул ферментов.
Г. Все предыдущие ответы верны.

Слайд 50Тест
10.(3 балла). Отдел желудка жвачных животных, в котором вырабатывается фермент реннин,
используемый в сыроделии:
А. Сетка.
Б. Книжка.
В. Сычуг.
Г. Рубец.

Слайд 51Тест
10.(3 балла). Отдел желудка жвачных животных, в котором вырабатывается фермент реннин,
используемый в сыроделии:
А. Сетка.
Б. Книжка.
В. Сычуг.
Г. Рубец.

Слайд 52Домашнее задание.
§ 19 учебника. Ответить на вопросы и выполнить задания после
текста § 19 учебника
Подготовить презентацию «Витамины»
10-12 слайдов.

Слайд 53Список литературы
1. Габриелян О.С.,А.В.Яшукова Методическое пособие. Химия. 10 класс.(базовый уровень) ,
М.Дрофа,2008
2. Габриелян О.С.Химия.10 класс: контрольные и проверочные работы-М. Дрофа,2011
3. Власова З. А. Биология. Справочник школьника. Всероссийское слово, 1995 г.
4. Хомченко Г. Л. Химия для поступающих в ВУЗЫ. Высшая школа,1993 г.
5. Биологический энциклопедический словарь. Советская энциклопедия, 1987г.

Слайд 54Интернет -ресурсы
http://files.school-collection.edu.ru/dlrstore/d7794640-8cff-11db-b606-0800200c9a66/ch10_30_02.swf
http://files.school-collection.edu.ru/dlrstore/d7791f54-8cff-11db-b606-0800200c9a66/ch10_30_01.swf





















































