6 августа 2021
В закладки
Обсудить
Жалоба
ЕГЭ по химии: справочные материалы
Предложенный материал адресован абитуриентам, преподавателям химии и ученикам 8-11 классов.
Материал содержит справочные таблицы, тривиальные названия неорганических и органических соединений, краткие теоретические сведения о гидролизе, электролизе, тренажёр для повторения большого количества неорганических реакций.
spr-himiya.docx
spr-himiya.pdf
Автор: Аветисян Сатеник Вагеевна.
Полезные справочные материалы к ЕГЭ
В данной рубрике выкладывается довольно разношерстный материал. Здесь вы можете найти ответы на часто возникающие при подготовке к ЕГЭ по химии вопросы, которые не удалось осветить в разделе Теория для подготовки к ЕГЭ. Например, здесь вы можете найти простые алгоритмы по нахождению правильных вариантов ответов на распространенные вопросы КИМов своеобразные «рецепты» получения ответов на отдельные задания из ЕГЭ по химии.
И хотя, заучивание данных «рецептов» несомненно будет для вас полезным, однако, вы все же не сможете обойтись без фундаментальной подготовки по программе кодификатора ЕГЭ по химии. Подготовку к ЕГЭ по химии вы можете проводить по пособиям для подготовки к ЕГЭ, либо же используя информацию с моего сайта, размещенную в разделе Теория для подготовки к ЕГЭ. Правда, на данный момент, этот раздел еще не полностью заполнен, поскольку все материалы пишутся лично мной, а не являются копипастом чужих работ.
Если у вас есть какие-либо интересные материалы, которые были бы весьма кстати в данном разделе и вы хотите ими поделиться присылайте их мне на почту shirokopoyas-s-i@yandex.ru.
Таблицы на ЕГЭ и ОГЭ по химии
На сдаче ЕГЭ и ОГЭ по химии можно использовать три таблицы:
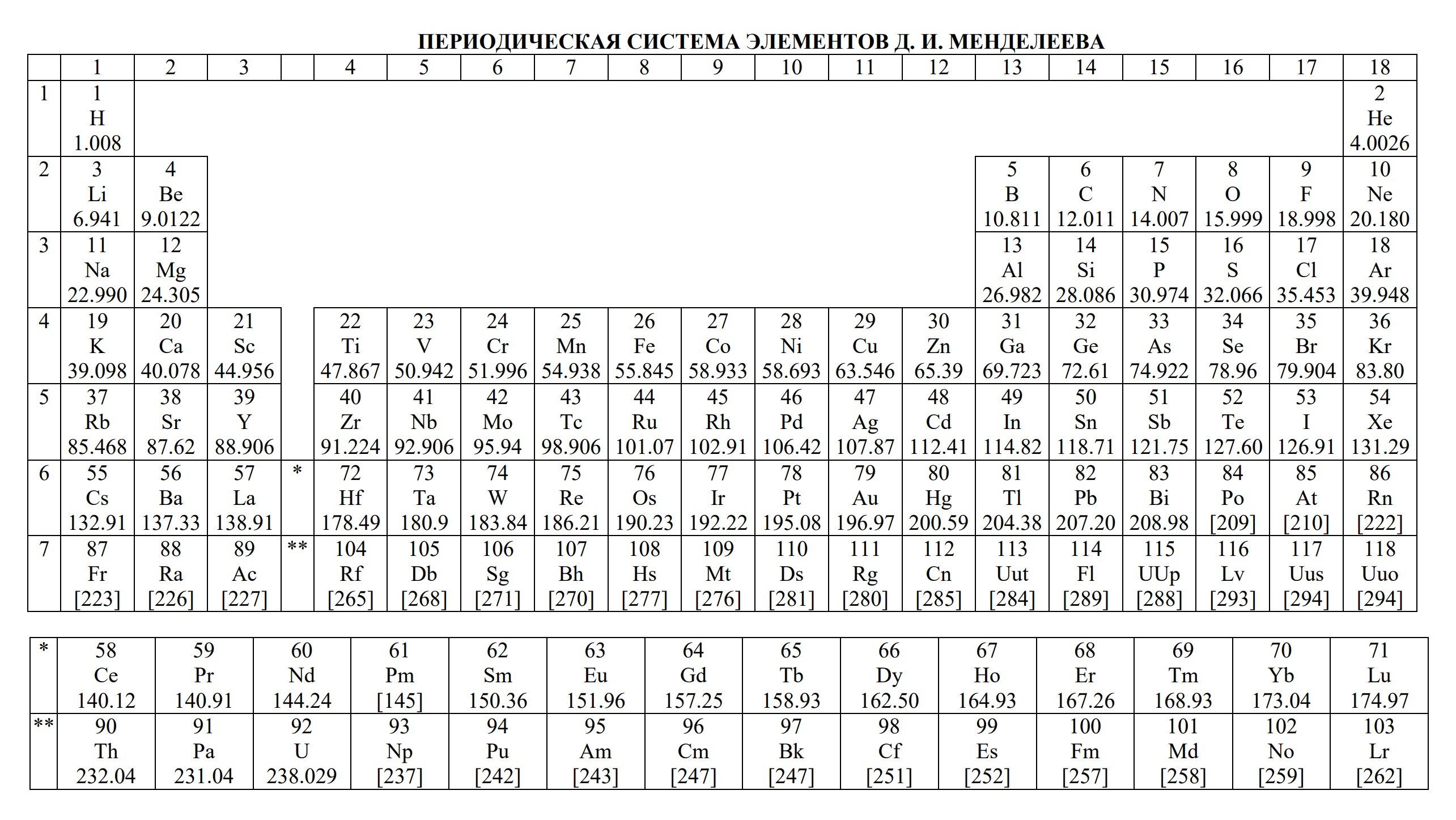
- периодическая система химических элементов Д.И. Менделеева
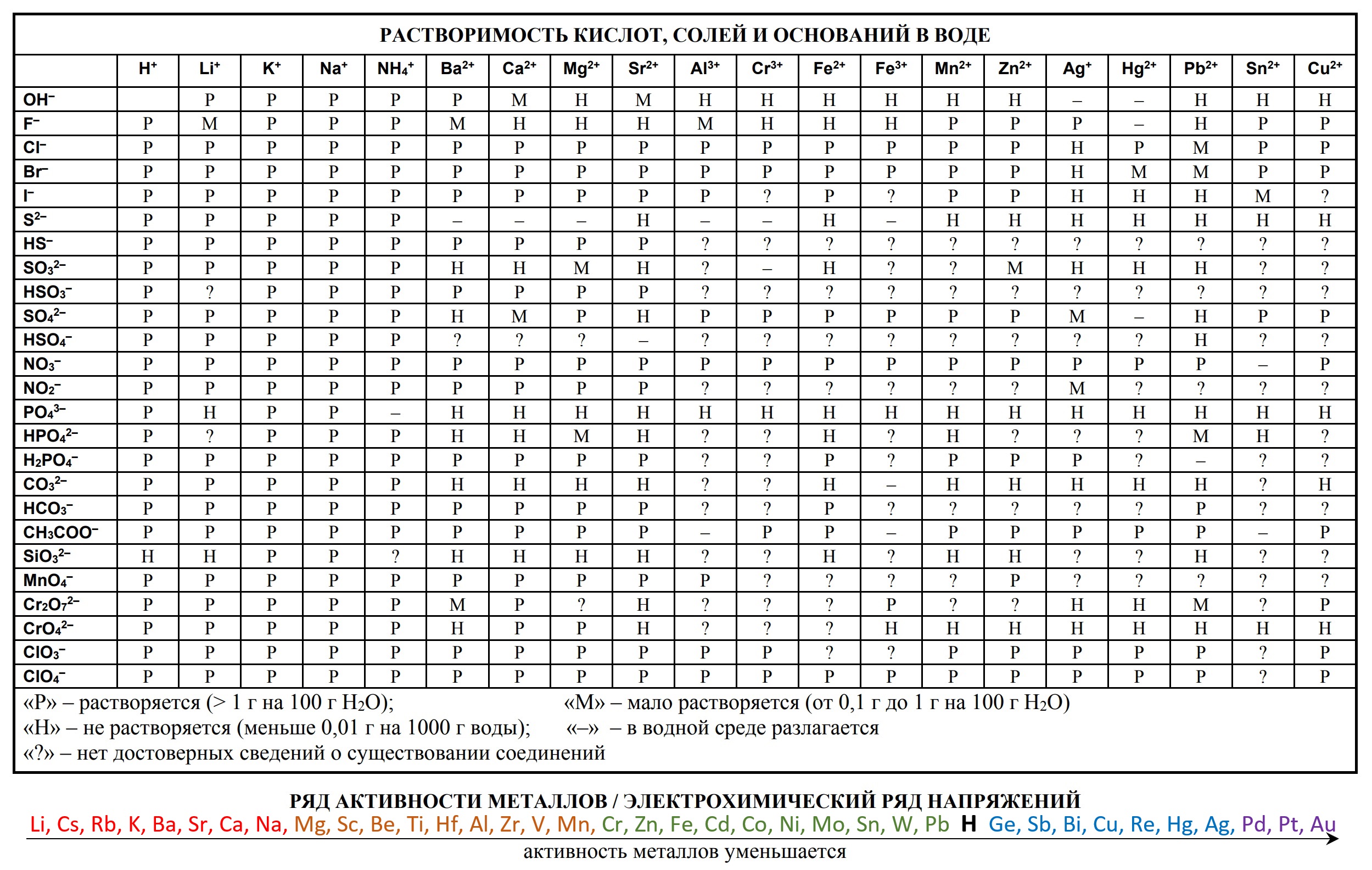
- таблица растворимости
- ряд активности металлов.
Они содержат в себе 80% информации, необходимой для решения большинства заданий.
Однако таблицы на форзацах разных учебников, продаваемые в книжных магазинах, располагающиеся на просторах интернета отличаются не только оформлением, но и содержанием. Что бы они оказались надёжно шпаргалкой, а не приятной неожиданностью, лучше с самого начала начинать работать с тем форматом, который официально разрешен на ЕГЭ твоего года.
Скачать эти таблицы можно ниже. А как сделать эти безликие таблицы наиболее информационными для тебя я расскажу на уроке.
- Таблица Д.И. Менделеева для ОГЭ и ЕГЭ
- Таблица растворимости и ряд активности для ОГЭ и ЕГЭ
- Таблица растворимости с расширенным рядом активности
- Таблица Д.И. Менделеева длиннопериодная для олимпиады
Таблицы для ЕГЭ по химии
- 31.10.2020
Приводим таблицы, которые можно использовать на ЕГЭ по химии, эти таблицы можно использовать на ЕГЭ в любом году, входит в пакет разрешённых документов, т.е. то, чем можно пользоваться на ЕГЭ по химии.
Из года в год эти таблицы не меняются. В 2023 году поменялась только таблица растворимости — информацию обновили. Используйте ссылки ниже.
В состав документа входят:
- Таблица растворимости солей
- Таблица Менделеева
Добавить комментарий
Комментарии без регистрации. Несодержательные сообщения удаляются.
Терефталевая кислота
Фталевая кислота
О-ксилол
О-крезол
Кумол
Бензол
Фенол
Толуол
Анилин
Бензойная кислота
Пикриновая кислота
Глицин
Аланин
Уксусный ангидрид
CnH2nO
Гидрогенизация + Н2
Элеминирование (отщепление)
Декарбоксилирование Реакция Дюма – это сплавление солей карбоновых кислотw с щелочами. При этом отщепляется карбоксилатная группа (–COOMe), и образуется карбонат:
пропионат натрия → этан
бензоат калия → бензол
Электролиз по Кольбе
2CH3CH2–COONa + 2H2O → H2 + 2NaOH + 2CO2 + CH3CH2–CH2CH3
Разложение термически неустойчивых солей*
Соли двухвалентных металлов (Ca, Mg, Ba) термически неустойчивы, при нагревании они разлагаются с отщеплением карбоната, остатки молекулы соединяются с образованием кетона:
бензоат кальция → бензофенон
Термически неустойчивы также оксалаты любых металлов. Оксалаты разлагаются на карбонат и угарный газ:
Разложение термически неустойчивых кислот*
Важнейшие термически неустойчивые кислоты:
Муравьиная кислота разлагается до угарного газа:
Щавелевая кислота разлагается до углекислого и угарного газа:
Бензойная кислота при нагревании декарбоксилируется, образуется бензол:
Карбоновые кислоты, у которых карбоксильная группа находится рядом с электроноакцепторным заместителем, являются термически неустойчивыми, при нагревании такие кислоты теряют карбоксильную группу в виде CO2, например, пировиноградная кислота разлагается до ацетальдегида:
Окисление кумола
Хлористый ацетил
ацетилхлорид + вода → уксусная кислота + соляная кислота
ацетилхлорид + этанол → этиловый эфир уксусной кислоты + соляная кислота
ацетилхлорид + ацетат натрия → уксусный ангидрид + хлорид натрия
Синтез газ: C + H2O → H2 + CO.; CH4 + H2O → CO + 3H2
CO+2H2⇔СH3OH+90,8кДж
угарный газ + гидроксид натрия → (t°, p) → формиат натрия
Реакция первичных аминов с азотистой кислотой*
этиламин + азотистая кислота → этанол + азот↑ + вода
Гидролиз нитрилов
CH3CN + 2H2O + HCl → CH3COOH + NH4Cl
Электролиты:
Сильные а) кислоты НNO3 , HCl, HBr , HI НСlО4 (хлорная), НСlО3 (хлорноватая), H2SO4, HMnO4
б) основания –растворимые: Гидроксиды элементов главных подгрупп I и II групп периодической системы: LiОН, NaОН, КОН, Са(ОН)2
в) Все растворимые соли.
К слабым электролитам относятся а) некоторые неорганические и почти все органические кислоты: HF, H2S , H2SO3, H2CO3, HCN, Н3РО4,, H2SiO3, H3BO3, НСlО (Хлорноватистая кислота), СН3СООН ,
б) основания – нерастворимые Аl(OH)3, Cu(OH)2, Fe(OH)2, Fe(OH)3 и др. и гидроксид аммония NH4OH.
2KF тв + H2SO4 конц → K2SO4 (KHSO4)+ 2HF↑
2NaCl тв + H2SO4 конц → Na2SO4 + 2HCl↑
8NaBr + 5H2SO4 → H2S + 8Br + 4Na2SO4 + 4H2O
8NaI +5H2SO4 = 4I2 + H2S + 4Na2SO4 + 4H2O.
Таблицы ЕГЭ по химии
Ниже приведены таблицы, идентичные используемым на ЕГЭ по химии: «Периодическая система химических элементов Д.И.Менделеева»
«Растворимость солей, кислот и оснований в воде» и «Электрохимический ряд напряжений металлов»: