…
Циклоалканы (циклопарафины) – органические насыщенные соединения, атомы углерода в молекулах которых, соединяясь образуют циклы. Общая формула – CnH2n . Строение, получение и свойства циклоалканов отличаются от свойств нормальных алканов с тем же числом углеродных атомов.
Строение циклоалканов
В молекулах циклоалканов углеродные атомы связаны между собой σ – связями. Устойчивость циклопарафинов, т.е. прочность С-С связей возрастает с увеличением количества атомов углерода, образующих цикл. Циклы делят на малые (С3, С4) и обычные (C5 – С7).
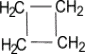
В качестве представителя малого цикла рассмотрим циклопропан:
- Молекула циклопропана представляет собой плоский цикл, образованный тремя атомами углерода; атомы водорода при этом расположены вне его плоскости и занимают энергетически невыгодное («заслоненное») положение, что способствует увеличению «напряженности» цикла и его неустойчивости.
- Валентные углы в плоском равностороннем треугольнике принимают значение равное 60°. А для sp3-гибридизованного атома углерода это значение соответствует 109,5°. В случае молекулы циклопропана, sp3-гибридизованные орбитали атомов углерода перекрываются между собой вне прямой, соединяющей ядра атомов. Образующиеся σ-связи с подобным способом перекрывания называют «банановыми». Их свойства обладают сходными чертами с π-связями, например, вступают в реакции присоединения.
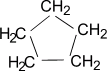
В отличие от трехчленных циклов, устойчивость пяти- и шестичленных циклических алканов на столько высока, что они не способны к разрыву.
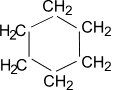
В качестве представителя обычного цикла рассмотрим циклогексан.
Для молекулы циклогексана не характерно плоское строение, напротив — ей присуще несколько форм — конформаций. Наиболее выгодной с энергетической точки зрения являются конформации кресла (более устойчива) и ванны. Валентные углы образованные гибридными орбиталями атомов углерода в цикле равны 109,5°, атомы водорода у соседних атомов углерода расположены относительно друг друга в положении энергетически выгодном.
Тетраэдрическое расположение связей вокруг каждого атома углерода способствует большей устойчивости обычных циклов по сравнению с малыми. Для них возможны реакции замещения и невозможны реакции присоединения.
Физические свойства циклоалканов
При обычных условиях циклоалканы закипают и плавятся при более высоких температурах, по сравнению с соответствующими алканами. С увеличением размера цикла, температуры кипения и плавления растут. Циклоалканы С3 — С4 представляют собой газы, С5 — С16 — жидкости, C17 и более — твердые вещества. Растворимость циклических алканов в воде очень низка.
Получение циклоалканов
- Переработка нефти (получают циклогексан и его производные)
- Реакция отщепления.
При отщеплении от дигалогенпроизводных алканов двух атомов галогена получают трех- и четырехчленные циклоалканы:
- Реакция пиролиза солей дикарбоновых кислот.
Методом Ружичка получают циклогексан и циклопентан. Метод основан на воздействии высоких температур без доступа воздуха на соли дикарбоновых кислот.
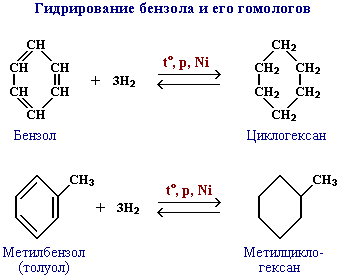
- Реакция гидрирования ароматических углеводородов в присутствии катализатора каталитического.
При нагревании бензола или его гомологов и водорода в присутствии никелиевого катализатора получают циклогексан или его производные:
Химические свойства циклоалканов
Устойчивость, а, следовательно, и реакционная активность малых и обычных циклов сильно различаются.
Малые циклы, такие как циклопропан и циклобутан проявляют склонность к реакциям присоединения, тогда как для обычных циклов (циклопентан и циклогексан) более характерны реакции замещения.
1. Реакции присоединения
- Галогенирование:
- Гидрогалогенирование:
- Гидрирование:
- Расщепление серной кислотой:
- Взаимодействие с сильными карбоновыми кислотами:
2. Реакции замещения (радикальный механизм)
- Галогенирование при действии ультрафиолета:
- Нитрование:
3. Реакция дегидрирования
В присутствии катализатора ведет к образованию бензола:
4. Реакция окисления
Как малые, так и обычные циклы при окислении сильными окислителями (например, 50%-ной азотной кислоты, перманганат натрия, бихромат калия) раскрываются с образованием двухосновных карбоновых кислот:
5. Перегруппировка (сужение или расширение цикла)
Применение циклоалканов
Чтобы поделиться, нажимайте
В отличие от предельных углеводородов, характеризующихся наличием открытых углеродных цепей, существуют углеводороды с замкнутыми цепями (циклами). По своим свойствам они напоминают обычные предельные углеводороды алканы (парафины), отсюда и произошло их название – циклоалканы (циклопарафины, нафтены). Общая формула гомологического ряда циклоалканов CnH2n. Представителями этого ряда соединений являются циклопропан, циклобутан, циклопентан, циклогексан.
 |
|
|
|
|
Циклопропан |
Циклобутан |
Циклопентан |
Циклогексан |
Очень часто в органической химии структурные формулы перечисленных циклоалканов изображают без символов C и H простыми геометрическими фигурами
Физические свойства
Циклоалканы имеют более высокие температуры плавления, кипения и большую плотность, чем соответствующие алканы. При одинаковом составе температура кипения циклопарафина тем выше, чем больше размер цикла. Циклоалканы в воде практически не растворимы, однако растворимы в органических растворителях. Физические свойства некоторых циклоалканов представлены в таблице.
Таблица. Физические свойства некоторых циклоалканов
| Соединение | t°пл., °С |
t°кип., °С |
| Циклопропан | -126,9 | -33 |
| Метилциклопропан | -177,2 | 0,7 |
| Циклобутан | — 80 | 13 |
| Метилциклобутан | -149,3 | 36,8 |
| Циклопентан | — 94,4 | 49,3 |
| Метилциклопентан | -142,2 | 71,9 |
| Циклогексан | 6,5 | 80,7 |
Изомерия циклоалканов
Для циклоалканов характерны как структурная, так и пространственная изомерия.
Структурная изомеpия
1. Изомерия углеродного скелета:
а) кольца
б) боковых цепей
2. Изомерия положения заместителей в кольце:
3. Межклассовая изомерия с алкенами:
Пространственная изомерия
1. Цис-транс-изомерия, обусловленная различным взаимным расположением в пространстве заместителей относительно плоскости цикла. В цис-изомерах заместители находятся по одну сторону от плоскости кольца, в транс-изомерах – по разные:
2. Оптическая изомерия некоторых ди- (и более) замещенных циклов. Например, транс-1,2-диметилциклопропан может существовать в виде двух оптических изомеров, относящихся друг к другу как предмет и его зеркальное изображение:
3. Конформационная изомерия циклоалканов. Все циклы, кроме циклопропана, имеют неплоское строение, что обусловлено стремлением атомов углерода к образованию нормальных (тетраэдрических) углов между связями. Это достигается поворотами по σ-связям С–С, входящим в цикл. При этом возникают различные конформации (поворотные изомеры) с разной энергией и чаще реализуются те из них, которые обладают наименьшей энергией, т.е. более устойчивые. Например, в циклогексане наиболее устойчивой является конформация «кресла».
Химические свойства
Химические свойства циклопарафинов зависят от числа атомов углерода, составляющих цикл. Низшие циклоалканы (циклопропан и циклобутан) ведут себя как ненасыщенные углеводороды, они способны вступать в реакции присоединения. Циклоалканы с большим количеством углеродных атомов в цикле ведут себя как алканы, для них характерны реакции замещения.
Реакции горения:
CnH2n + 3n/2O2 — t → nCO2 + nH2O +Q
|
Малые циклы (n=3,4) |
| Реакции присоединения – сходство с алкенами.
1) Галогенирование: C3H6 + Br2 → C3H6Br2 (1,3-дибромпропан ) циклопропан 2) Гидрирование: C4H8 + H2 — t,Ni или Pt → C4H10 ( бутан ) циклобутан 3) Гидрогалогенирование (по правилу Марковникова): C3H6 + HI → CH3-CH2-CH2I ( 1- йодпропан ) |
|
Обычные циклы (n=5-7) |
| Реакции замещения – сходство с алканами.
1) Галогенирование: C6H12 + Br2 — t → C6H11Br + HBr бромциклогексан Реакции отщепления – дегидрирования циклогексана (р. Зелинского-Казанского): C6H12 — t=300˚С ,Pt,Pd→ C6H6 + 3H2 бензол |
Получение циклоалканов
|
В промышленности |
| 1) Из нефти (пяти- и шестичленных)
Циклоалканы содержатся в значительных количествах в нефтях некоторых месторождений (отсюда произошло одно из их названий — нафтены). При переработке нефти выделяют главным образом циклоалканы С5 — С7. 2) Из ароматических углеводородов – каталитическое гидрирование: C6H6 + H2 —t,p,Ni→ C6H12 |
|
В лаборатории |
| Из дигалогенпроизводных алканов (внутримолекулярная реакция Вюрца):
Br-CH2-CH2-CH2-Br + Mg — t → MgBr2 + C3H6 или Cl-CH2-CH2-CH2-CH2-Cl + 2Na → 2NaCl + C4H8 |
Применение
Наибольшее практическое значение имеют циклогексан, этилциклогексан. Циклогексан используется для получения циклогексанола, циклогексанона, адипиновой кислоты, капролактама, а также в качестве растворителя. Циклопропан используется в медицинской практике в качестве ингаляционного анестезирующего средства.
Циклоалканы – это предельные (насыщенные) углеводороды, которые содержат замкнутый углеродный цикл.
Общая формула циклоалканов CnH2n, где n≥3.
Строение, номенклатура и изомерия циклоалканов
Химические свойства циклоалканов
Получение циклоалканов
Строение циклоалканов
Атомы углерода в молекулах циклоалканов находятся в состоянии sp3-гибридизации и образует четыре σ-связи С–С и С–Н. В зависимости от размеров цикла меняются валентные углы.
В малых циклах (циклопропан и циклобутан) валентные углы между связями С–С сильно отличаются от валентных углов между связями С–С в алканах (109о35′). Поэтому в малых циклах возникает напряжение, которое приводит к высокой реакционной способности таких циклоалканов.
Самый простой циклоалкан — циклопропан, представляет, по сути, плоский треугольник.
σ-Связи в циклопропане называют «банановыми». Они не лежат вдоль оси, соединяющей ядра атомов, а отклоняются от неё, уменьшая напряжение в молекуле циклопропана.
По свойствам «банановые» связи напоминают π-связи. Они легко разрываются.
Поэтому циклопропан очень легко вступает в реакции присоединения с разрывом углеродного цикла.
Остальные циклоалканы имеют неплоское строение. Молекула циклобутана имеет перегиб по линии, соединяющей первый и третий атомы углерода в кольце:
Циклобутан также вступает в реакции присоединения, но угловое напряжение в циклобутане меньше, чем в циклопропане, поэтому реакции присоединения к циклобутану протекают сложнее.
Большие циклы имеют более сложное, неплоское строение, вследствие чего угловое напряжение в молекулах больших циклоалканов почти отсутствует.
Циклоалканы с большим циклом не вступают в реакции присоединения. Для них характерны реакции замещения.
Строение циклопентана также неплоское, молекула представляет собой так называемый «конверт».
Молекула циклогексана не является плоским многоугольником и принимает различные конформации, имеющие названия «кресло» и «ванна»:
«кресло» «ванна»
Изомерия циклоалканов
Структурная изомерия
Для циклоалканов характерна структурная изомерия, связанная с разным числом углеродных атомов в кольце, разным числом углеродных атомов в заместителях и с положением заместителей в цикле.
- Изомеры с разным числом атомов углерода в цикле отличаются размерами углеродного цикла.
Изомеры с разным числом углеродных атомов в цикле – это этилциклопропан и метилциклобутан с общей формулой С5Н10
- Изомеры с разным числом атомов углерода в заместителях отличаются строением заместителей у одинакового углеродного цикла.
Структурные изомеры с различным числом углеродных атомов в заместителях – 1-метил-2-пропилциклопентан и 1,2-диэтилциклопентан
- Изомеры с разным положением одинаковых заместителей в углеродном цикле.
- Межклассовая изомерия: циклоалканы изомерны алкенам.
Формуле С3Н6 соответствуют циклопропан и пропен.
Геометрическая (цис-транс-) изомерия
У циклоалканов с двумя заместителями, расположенными у соседних атомов углерода в цикле цис-транс-изомерия обусловлена различным взаимным расположением в пространстве заместителей относительно плоскости цикла.
В цис-изомерах заместители находятся по одну сторону от плоскости цикла, в транс-изомерах – заместители расположены по разные стороны.
В молекуле 1,2-диметилциклопропана две группы СН3 могут находиться по одну сторону от плоскости цикла (цис-изомер) или по разные стороны (транс-изомер):
Для 1,1-диметилциклопропана цис-транс-изомерия не характерна.
Номенклатура циклоалканов
В названиях циклоалканов используется префикс -ЦИКЛО.
Название циклоалканов строится по следующим правилам:
1. Цикл принимают за главную углеродную цепь. При этом считают, что углеводородные радикалы, которые не входят в главной цепь, являются в ней заместителями.
2. Нумеруют атомы углерода в цикле так, чтобы атомы углерода, которые соединены с заместителями, получили минимальные возможные номера. Причем нумерацию следует начинать с более близкого к старшей группе конца цепи.
3. Называют все радикалы, указывая впереди цифры, которые обозначают их расположение в главной цепи.
Для одинаковых заместителей эти цифры указывают через запятую, при этом количество одинаковых заместителей обозначается приставками ди- (два), три- (три), тетра- (четыре), пента- (пять) и т.д.
Например, 1,1-диметилциклопропан или 1,1,3-триметилциклопентан.
4. Названия заместителей со всеми приставками и цифрами располагают в алфавитном порядке.
Например: 1,1-диметил-3-этилциклопентан.
5. Называют углеродный цикл.
Химические свойства циклоалканов
Циклоалканы с малым циклом (циклопропан, циклобутан и их замещенные гомологи) из-за большой напряженности в кольце могут вступать в реакции присоединения.
1. Реакции присоединения к циклоалканам
Чем меньше цикл и чем больше угловое напряжение в цикле, тем легче протекают реакции присоединения. Способность вступать в реакции присоединения уменьшается в ряду: циклопропан > циклобутан > циклопентан.
1.1. Гидрирование циклоалканов
С водородом могут реагировать малые циклы, а также (в жестких условиях) циклопентан. При этом происходит разрыв кольца и образование алкана.
Циклопропан и циклобутан довольно легко присоединяют водород при нагревании в присутствии катализатора:
Циклопентан присоединяет водород в жестких условиях:
Бромирование протекает более медленно и избирательно.
Циклогексан и циклоалканы с большим число атомов углерода в цикле с водородом не реагируют.
1.2. Галогенирование циклоалканов
Циклопропан и циклобутан реагируют с галогенами, при этом тоже происходит присоединение галогенов к молекуле, сопровождающееся разрывом кольца.
Например. Циклопропан присоединяет бром с образованием 1,3-дибромпропана:
1.3. Гидрогалогенирование
Циклопропан и его гомологи с алкильными заместителями у трехчленного цикла вступают с галогеноводородами в реакции присоединения с разрывом цикла.
Например, циклопропан присоединяет йодоводород.
Присоединение галогеноводородов к гомологам циклопропана с заместителями у трехатомного цикла (метилциклопропан и др.) происходит по правилу Марковникова.
Например, при присоединении бромоводорода к метилциклопропану преимущественно образуется 2-бромбутан
2. Реакции замещения
Поэтому большие циклы гораздо более устойчивы, чем малые, и реакции присоединения с разрывом связей С-С для них не характерны. В химических реакциях они ведут себя подобно алканам, вступая в реакции замещения без разрыва кольца.
2.1. Галогенирование
Галогенирование циклопентана, циклогексана и циклоалканов с большим количеством атомов углерода в цикле протекает по механизму радикального замещения.
Например, при хлорировании циклопентана на свету или при нагревании образуется хлорциклопентан
При хлорировании метилциклопентана замещение преимущественно протекает у третичного атома углерода:
2.2. Нитрование циклоалканов
При взаимодействии циклоалканов с разбавленной азотной кислотой при нагревании образуются нитроциклоалканы.
Например, нитрование циклопентана.
2.3. Дегидрирование
При нагревании циклоалканов в присутствии катализаторов протекает дегидрирование – отщепление водорода.
Циклогексан и его производные дегидрируются при нагревании и под действием катализатора до бензола и его производных.
Например, бензол образуется при дегидрировании циклогексана.
Например, при отщеплении водорода от метилциклогексана образуется толуол.
3. Окисление циклоалканов
3.1. Горение
Как и все углеводороды, алканы горят до углекислого газа и воды. Уравнение сгорания циклоалканов в общем виде:
CnH2n + 3n/2O2 → nCO2 + nH2O + Q
Например, горение циклопентана.
2C5H10 + 15O2 → 10CO2 + 10H2O + Q
3.2. Окисление
При окислении циклогексана азотной кислотой или в присутствии катализатора образуется адипиновая (гександиовая) кислота:
Получение циклоалканов
1. Дегидрирование алканов
Алканы с длинным углеродным скелетом, содержащие 5 и более атомов углерода в главной цепи, при нагревании в присутствии металлических катализаторов образуют циклические соединения.
При этом протекает дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла.
Пентан и его гомологи, содержащие пять атомов углерода в главной цепи, при нагревании над платиновым катализатором образуют циклопентан и его гомологи:
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
Дегидроциклизация алканов — важный промышленный способ получения циклоалканов.
2. Гидрирование бензола и его гомологов
При гидрировании бензола при нагревании и в присутствии катализатора образуется циклогексан:
При гидрировании толуола образуется метилциклогексан:
Этим способом можно получить только циклогексан и его гомологи с шестичленным кольцом.
3. Дегалогенирование дигалогеналканов
При действии активных металлов на дигалогеналканы, в которых между атомами галогенов находится три и более атомов углерода.
Например, 1,4-дибромбутан реагирует с цинком с образованием циклобутана
Таким образом можно синтезировать циклоалканы заданного строения, в том числе циклоалканы с малыми циклами (С3 и С4).
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
ФИЗИЧЕСКИЕ СВОЙСТВА ЦИКЛОАЛКАНОВ
При обычных условиях первые два члена ряда (С3 — С4) — газы, (С5 — С11) — жидкости, начиная с С12 — твёрдые вещества.
Температуры кипения и плавленияциклоалканов выше, чем у соответствующих алканов
Циклоалканы в воде практически не растворяются.
При увеличении числа атомов углерода возрастает молярная масса, следовательно, увеличивается температура плавления.
ХИМИЧЕСКИЕ СВОЙСТВА ЦИКЛОАЛКАНОВ
Циклоалканы проявляют свойства и алканов, и алкенов.
Циклопропан и циклобутан – имеют напряженные связи, угол отличается от 109°28´,
цикл разрывается и они легко вступают в реакции присоединения с H₂, Cl₂, Br₂,HCl, растворами окислителей, присоединяя по месту разрыва связи.
ПРИСОЕДИНЕНИЕ
1. Гидрирование.
При каталитическом гидрировании трех-, четырех- и даже пятичленные циклы разрываются с образованием алканов.
Циклопентан и циклогексан с трудом присоединяют водород:
2) Галогенирование.
Циклопропан и циклобутан разрываются, присоединяя атомы галогена, превращаясь в галогеналкан
3)Гидрогалогенирование.
Замещенные циклопропаны тоже взаимодействуют с галогеноводородами и другими соединениями с разрывом цикла.
ЗАМЕЩЕНИЕ
Большие циклы – циклопентан и циклогексан – гораздо более устойчивы, цикл в них не разрывается. Они ведут себя как алканы, вступая в реакции замещения :
1) Галогенирование:
циклопентан и циклогексан реагируют с галогенами на свету, вступая в реакцию замещения.
ДЕГИДРИРОВАНИЕ
Производные циклогексана дегидрируются в производные бензола:
ГОРЕНИЕ
Как и любые органические вещества, циклоалканы горят с образованием углекислого газа и воды.
Это циклические углеводороды с тремя двойными сопряженными связями в цикле.
ФИЗИЧЕСКИЕ СВОЙСТВА.
Бензол и его ближайшие гомологи – бесцветные жидкости с характерным запахом, с плотностью менее 1 г/мл.
Высшие арены – твердые вещества. Нерастворимы в воде, но хорошо растворимы в неполярных растворителях.
Огнеопасны.
Бензол и толуол ядовиты (поражают почки, печень, костный мозг, кровь).
ХИМИЧЕСКИЕ СВОЙСТВА.
Свойственны:
1. Реакции присоединения (мало характерны из-за наличия делокализованой (электронная пара рассредоточена между несколькими ядрами атомов). системы аренам реакции присоединения или окисления, которые ведут к нарушению ароматичности.
2. Реакции замещения в бензольном кольце
3. Реакции замещения в боковой цепи
Реакции окисления
РЕАКЦИИ ПРИСОЕДИНЕНИЯ
1. Гидрирование → циклопарафины
Условия: повышенная температура, давление, металлические катализаторы (350⁰С, Pt или Ni).
2. Радикальное хлорирование → галогенпроизводное циклоалканов
Из бензола образуется гексахлорциклогексан (гексахлоран — средство борьбы с вредными насекомыми).
РЕАКЦИИ ЗАМЕЩЕНИЯ В БЕНЗОЛЬНОМ КОЛЬЦЕ
1. Галогенирование → галогенпроизводные аренов + HCl.
У бензола замещение одного атома водорода, у толуола при малом количестве галогена замещение присходит в положении орто- и пара-, при избытке галогена в положении 2,4,6-
Условия: нагревание, наличие катализаторов AlCl3, AlBr3, FeCl3 и т.п.:
2. Нитрование бензола → нитросоединения аренов + H₂O
Бензол реагирует с нитрующей смесью (смесью концентрированных азотной и серной кислот):
Нитрование толуола
При нитровании толуола С6Н5-CH3, в зависимости от количества азотной кислоты, могут образовываться разные продукты реакции
3. Сульфирование → моносульфокислота.
Осуществляется концентрированной серной кислотой (олеум – это раствор серного ангидрида в безводной серной кислоте)
4. Взаимодействие с галогенопроизводными алканов → гомологи бензола с боковой цепью (реакция Фриделя— Крафтса)
5. Взаимодействие с непредельными углеводородами — гомологи бензола с боковой цепью
ЗАМЕЩЕНИЕ В БОКОВОЙ ЦЕПИ
При действии хлора на свету или при нагревании на гомологи бензола происходит реакция радикального замещения в боковой цепи:
Бромирование метилбензола осуществляется при аналогичных условиях и приводит к образованию соответствующих бромзамещающих соединений.
РЕАКЦИИ ОКИСЛЕНИЯ АРЕНОВ
Бензол не окисляется даже под действием сильных окислителей (KMnO4, K2Cr2O7 и т.п.), поэтому используется как инертный растворитель при окислении других органических соединений.
1. Горение бензола
Бензол содержит около 92% углерода, при неполном сгорании бензола образуется много копоти (C). При горении бензола образуются углекислый газ и водяные пары.
Бензол не подвергается окислению
2. Окисление оксидом марганца
Метильная боковая цепь в толуоле подвергается окислению даже такими сравнительно мягкими окислителями, как оксид марганца (IV):
3. Окисление перманганатом калия в кислой среде
Более сильные окислители, например перманганат калия, вызывают дальнейшее окисление:
3) Окисление перманганатом калия в нейтральной среде при нагревании — образуется соль бензойной кислоты и карбонаты:
СТИРОЛ (винилбензол) С8Н8
производное
бензола, которое имеет в своём составе двойную связь в боковом заместителе,
поэтому он НЕ
относится к гомологическому ряду аренов.
Проявляются все свойства
непредельных углеводородов.
РЕАКЦИИ ПРИСОЕДИНЕНИЯ
протекают в боковой цепи в соответствии с правилом Марковникова, например:
РЕАКЦИИ ОКИСЛЕНИЯ
1. Мягкое окисление стирола:
в нейтральной среде → многоатомный спирт
2. Жесткое окисление (t°) стирола:
в кислой среде → бензойная кислота,
в нейтральной при нагревании → бензоаты
3. Полимеризация полистирола (по боковой цепи):
→ полистирол.
Полистирол — полимер широкого применения
План урока:
Формула и строение циклоалканов
Номенклатура и изомерия циклоалканов
Методы получения циклоалканов
Физические свойства циклоалканов
Химические свойства циклоалканов
Области применения циклоалканов
Формула и строение циклоалканов
Углеродным атомам характерна sp3-гибридизация и формирование четырех сигма-связей (σ-связи) С-Н и С-С. От размеров цикла зависят свойства вещества. У первых двух представителей гомологического ряда валентный угол равен не 109˚35’, как в алканах, а меньше. Из-за возникающего напряжения в молекуле эти циклы имеют высокую реакционную способность.
«Банановые» σ-связи в циклопропане – особенность строения циклоалканов. Они расположены так, что соединяют ядра атомов углерода не прямой, а дугообразной линией. «Банановые» связи схожи с π-связями, т.к. легко рвутся. Они необходимы для уменьшения напряжения внутри цикла.
Рис. Малые циклопропаны. А, б, в – «банановые» связи циклоалканов; г – конформации циклоалканов. Источник
Другие нафтены имеют особенность – пространственное строение. В циклобутане есть перегиб между первым и третьим углеродным атомами. Циклопентан представлена в конформации «конверт», а циклогексан – в «кресло» и «ванна».
Общая формула циклоалканов: CnH2n, где n≥3.
Номенклатура и изомерия циклоалканов
Название состоит из приставки «цикло» и названия алкана с определенным количеством углеродных атомов. Циклоалканы подразделяются на малые и большие циклы. К первой группе относятся циклопропан и циклобутан, а ко второй все остальные вещества. Соединения этого класса часто изображают в виде геометрических фигур, где количество углов соответствует числу атомов углерода.
Для циклоалканов свойственно два вида изомерии – структурная и пространственная. Структурная включает в себя:
- изомерию углеродного скелета (расположение атомов может меняться как в цикле, так и в боковой цепи),
- изомерию положения заместителей в кольце,
- межклассовую изомерию (изомерны алкенам).
Пространственная включает в себя:
- цис-транс-изомерию,
- зеркальную изомерию (основана на существовании нескольких оптических изомеров),
- поворотную изомерию (основана на повороте относительно σ-связи).
Источник
Методы получения циклоалканов
В промышленном производстве циклоалканы получают двумя способами.
- Гидрирование аренов при нагревании с катализатором Ni
- Дегидрирование алканов при нагревании с катализатором
Циклы, имеющие шесть и более углеродных атома, получают под воздействием оксида хрома (III).
В лабораториях циклоалканы получают с помощью дегалогенирования дигалогеналканов. Особенность этого метода заключается в том, что галогены должны находиться на концах молекулы алкана.
Физические свойства циклоалканов
Циклоалканы во многом схожи с алканами. Первые два представителя гомологичного ряда – газы, следующие два – жидкости (они входят во фракции нефти), последующие соединения циклоалканов – твердые вещества. Температуры плавления и кипения выше, чем алканов с соответствующим количеством углеродных атомов. Это объясняется плотным расположением атомов внутри молекулы. Циклоалканы не растворимы в воде, но растворимы в органических растворителях.
Химические свойства циклоалканов
Свойства циклоалканов различны и меняются по мере изменения размеров молекулы. Малым циклам характерны реакции присоединения, а большим – замещения.
Реакции присоединения
Малые циклы хотя и проявляют насыщенность, но им не характерны свойства предельных углеводородов. Это связано с тем, что у первых двух простейших представителей циклоалканов валентные углы меньше. Для них свойственно напряжение внутри кольца и тяга к раскрытию при воздействии реагентов.
- Гидрирование при воздействии катализатора и высоких температур
- Галогенирование
- Гидрогалогенирование при нагревании
Реакции гидрогалогенирования гомологов циклоалканов осуществляется по правилу Марковникова.
Реакции замещения
Циклы с шестью и более углеродными атомами наиболее устойчивы из-за отсутствия углового напряжения.
- Галогенирование под действием света
У гомологов циклоалканов галоген замещается у третичного атома углерода.
Окисление
Уравнения реакции окисления характерны как для малых, так и для больших циклов.
Области применения циклоалканов
Нафтены нашли широкое применение в качестве:
- анестезирующих ингаляторов;
- продукта народного хозяйства;
- растворителей и др.
Также их применяют в получении полупродуктов при производстве синтетических волокон, адипиновой кислоты, циклогексанола. Применение циклоалканов актуально для получения аренов в нефтяной промышленности.

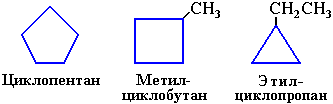

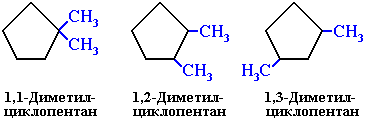
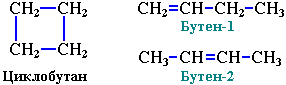


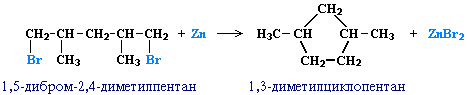























![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)



















































