Задание №1:
Установите соответствие между аппаратом, который используется в химическом производстве, и процессом, происходящем в этом аппарате.
АППАРАТ:
А) печь кипящего слоя
Б) колонна синтеза
В) поглотительная башня
ПРОЦЕСС:
1) взаимодействие водорода и азота
2) окисление оксида азота(IV)
3) получение олеума
4) получение оксида серы(IV)
Решение:
Итак, рассмотрим первый пункт — печь для обжига в «кипящем слое».
Кипящий слой — это часть процесса производства серной кислоты, в которой совмещены твердая и жидкая фазы; при помощи этой технологии получают сернистый газ(SO2), ответ 4.
Колонна синтеза — это сложный аппарат, направленный на получение аммиака из водорода и азота, ответ 1.
Поглотительная башня используется при получении олеума(раствор SO3 в серной кислоте), ответ 3.
Задание №2:
Установите соответствие между осуществляемым в промышленности процессом и оборудованием, которое используется при получении серной кислоты.
ПРОЦЕСС:
А) получение сернистого газа
Б) получение олеума
В) получение оксида серы(VI)
ОБОРУДОВАНИЕ:
1) окислительная башня
2) печь «кипящего слоя»
3) контактный аппарат
4) поглотительная башня
Решение:
Получение сернистого газа сопровождается обжигом пирита(FeS) в печи «кипящего слоя», ответ 2.
Получение олеума происходит путем растворения оксида серы(SO3) в серной кислоте, сам процесс осуществляется в поглотительной башне, ответ 4.
Оксид серы(VI) получают в контактном аппарате с помощью каталитического окисления SO2, ответ 3.
Задание №3:
Установите соответствие между веществом и основной областью его применения.
ВЕЩЕСТВО:
А) стирол
Б) этиленгликоль
В) синтез-газ
ОБЛАСТЬ ПРИМЕНЕНИЯ:
1) получение полиэфиров
2) производство маргарина
3) производство метанола
4) получение пластмасс
Решение:
Стирол(винилбензол) — это гомолог бензола, имеет формулу C6H5ꟷCH=CH2, за счет наличия кратной связи способен к реакциям полимеризации, в частности, в производстве пластмасс, ответ 4.
Этиленгликоль(1,2-этандиол) — это двухатомный спирт, который используется при получении полиэфиров, так как имеет две OH группы, которые потенциально могут вступать в реакцию поликонденсации с образованием полиэтилентерефталата (наши «любимые» пластиковые бутылки), ответ 1.
Синтез-газ(CO + H2) — довольно известная смесь угарного газа и водорода, используется при промышленном способе получения метилового спирта(метанола), ответ 3.
Задание №4:
Установите соответствие между веществом и способом его попадания в окружающую среду.
ВЕЩЕСТВО:
А) углекислый газ
Б) оксиды азота
В) гексахлоран
СПОСОБ ПОПАДАНИЯ В ОКРУЖАЮЩУЮ СРЕДУ:
1) сгорание углеводородного топлива
2) борьба с насекомыми
3) протравливание семян
4) сточные воды
Решение:
Углекислый газ и оксиды азота попадают в окружающую среду путем сгорания углеводородного топлива, А и Б ответ 1.
Гексахлоран используется в качестве инсектицида, ответ 2.
Задание №5:
Установите соответствие между названием процесса переработки нефти и его результатом.
НАЗВАНИЕ ПРОЦЕССА:
А) риформинг
Б) перегонка нефти
В) крекинг
РЕЗУЛЬТАТ:
1) разделение нефти на фракции
2) получение смазочных масел
3) увеличение количества легкокипящих фракций
4) получение ароматических углеводородов
Решение:
Риформинг — это процесс переработки алифатических углеводородов в ароматические(например, бензол), здесь подходит вариант 4.
Перегонка нефти приводит к разделению ее на фракции(лигроин, мазут, бензин), ответ 1.
Крекинг — это процесс высокотемпературного расщепления нефти с получением низкомолекулярных органических соединений, ответ 3.
Задание №6:
Установите соответствие между металлом и веществом, которое используется для получения этого металла в промышленности, или способом промышленного получения.
МЕТАЛЛ:
А) железо
Б) алюминий
В) натрий
ВЕЩЕСТВО /СПОСОБ ПОЛУЧЕНИЯ:
1) красный железняк
2) электролиз раствора оксида в криолите
3) электролиз раствора поваренной соли
4) электролиз расплава поваренной соли
Решение:
Железо — в промышленности его получают из красного железняка, или гематита, который имеет формулу Fe2O3, ответ 1.
Алюминий можно получить электролизом Al2O3 в расплаве криолита, ответ 2.
Криолит, или гексафторалюминат натрия(Na3AlF6) — это необычный, редкий минерал, впервые обнаружен в Гренландии(отсюда название(криос — холод, литос — камень)), плавится при температуре 1012 С,
может растворять оксиды алюминия, что позволяет легко извлекать алюминий электролизом.
Натрий — для него здесь указано два возможных пункта, 3 и 4, однако, чистый Na можно получить только в РАСПЛАВЕ поваренной соли(NaCl), ответ 4.
Задание №7:
Установите соответствие между смесью веществ и способом разделения данной смеси.
СМЕСЬ ВЕЩЕСТВ:
А) вода и этиловый спирт
Б) вода и глина
В) вода и поташ
СПОСОБ РАЗДЕЛЕНИЯ:
1) фильтрование
2) выпаривание
3) использование делительной воронки
4) перегонка
Решение:
Первая смесь — вода и этиловый спирт, она может быть разделена перегонкой, ответ 4.
Следующая смесь — вода и глина, здесь нужно использовать фильтрование, ответ 1.
Последний ряд веществ — вода и поташ; поташ имеет формулу K2CO3, как и все соли калия, она растворима, и отделить ее от воды можно путем выпаривания, ответ 2.
Задание №8:
Установите соответствие между веществом и областью его применения.
ВЕЩЕСТВО:
А) изопропилбензол
Б) этанол
В) триолеин
ОБЛАСТЬ ПРИМЕНЕНИЯ:
1) получение полиэфиров
2) получение ацетона
3) производство маргарина
4) получение дивинила
Решение:
Первое вещество — изопропилбензол, или кумол, оно используется для получения ацетона, ответ 2.
Второе соединение — этанол, который имеет важное значение для получения дивинила, или бутадиена-1,3(это реакция Лебедева, проведенная в 1926 году, давшая начало производству синтетического каучука), ответ 4.
Последнее вещество в списке — триолеин, составной частью этого химического соединения является «олеин», что означает принадлежность к жирам, а соответственно, к получению маргарина, ответ 3.
Задание №9:
Установите соответствие между веществом и основной областью его применения.
ВЕЩЕСТВО:
А) криолит
Б) пирит
В) метилметакрилат
ОБЛАСТЬ ПРИМЕНЕНИЯ:
1) производство антифриза
2) получение алюминия
3) производство серной кислоты
4) получение органического стекла
Решение:
Криолит(Na3AlF6) используется при получении чистого алюминия путем электролиза, ответ 2.
Пирит(FeS2) является начальной составной частью производства серной кислоты, ответ 3.
Метилметакрилат(метил-2-метилпроп-2-еноат) — это сложное органическое соединение, из которого получают органическое стекло, ответ 4.
Задание №10:
Установите соответствие между веществом и областью его применения.
ВЕЩЕСТВО:
А) глицерин
Б) формальдегид
В) глюкоза
ОБЛАСТЬ ПРИМЕНЕНИЯ:
1) получение полиэфиров
2) получение взрывчатых веществ
3) хранение биологических препаратов
4) источник энергии в организме
Решение:
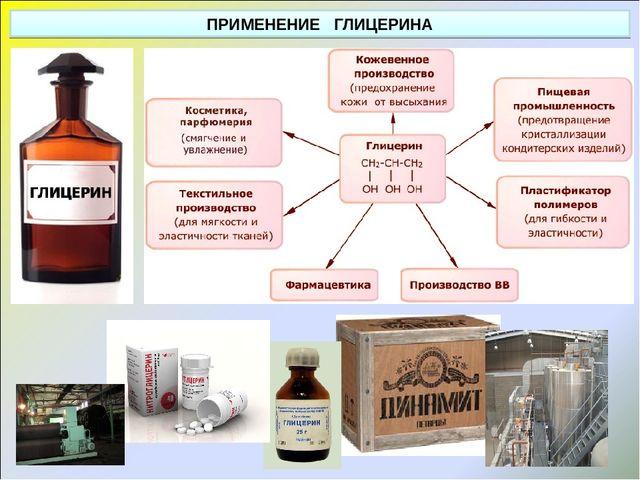
Глицерин, или 1,2,3 — пропантриол, это трехатомный спирт, который используется для получения нитроглицерина, являющегося составной частью взрывчатых веществ, ответ 2.
Формальдегид, или муравьиный альдегид, хорошо знаком биологам для сохранения биологических объектов в течение длительного времени, ответ 3.
Глюкоза(C6H12O6) — это моносахарид, который является источником АТФ(энергия) в организме живых существ, ответ 4.
Задание №11:
Установите соответствие между происхождением полимера и его названием.
ПРОИСХОЖДЕНИЕ ПОЛИМЕРА:
А) природный органический
Б) синтетический органический
В) искусственный органический
Название полимера:
1) сахароза
2) пенька
3) полиэфир
4) вискоза
Решение:
Природный органический полимер — из данного списка нам подходит пенька(грубое лубяное конопляное волокно), ответ 2.
Синтетический органический полимер из указанных веществ — полиэфир, ответ 3.
Искусственным органическим полимером является вискоза, ответ 4.
На сегодня все!
Применение веществ в быту и промышленности. ЕГЭ по химии.
Ниже представлены вещества, применение которых на ЕГЭ по химии спрашивается наиболее часто
| Нитрат натрия Нитрат калия Нитрат аммония |
Азотсодержащие удобрения (селитры). |
| Фосфат кальция Гидрофосфат кальция Суперфосфат |
Фосфорные удобрения |
| Оксид кремния (IV) | Производство керамических изделий. |
| Пальмитат натрия/калия Стеарат натрия/калия |
Мыла Натриевые соли высших карбоновых кислот – твердые мыла, а калиевые соли высших карбоновых кислот – жидкие мыла. |
| Сера | Используется при производстве резины. Для этого серу нагревают (вулканизируют) с каучуком. |
| Гидрокарбонат натрия. | Твердое вещество, использующееся в качестве разрыхлителя теста, а также в качестве чистящего средства. |
| Карбонат аммония | Используется как разрыхлитель теста благодаря тому, что при нагревании образует газообразные продукты разложения в соответствии с уравнением: (NH4)2CO3 => 2NH3 + CO2 + H2O |
| Этановая (уксусная) кислота | Используется для консервирования овощей. Концентрированные растворы вызывают ожоги. |
| Активированный уголь | Твердое вещество черного цвета используется в качестве поглотителя (адсорбента) в фильтрах, а также как лекарственное средство при различных видах отравлений. |
| Этанол (этиловый спирт). C2H5OH |
Основной компонент алкогольных напитков, может быть использован в качестве топлива. Жидкость со специфическим запахом. |
| Глицерин | Используется в парфюмерии и пищевой промышленности. |
| Ацетон | Распространенный растворитель. |
| Тетрахлорид углерода CCl4 | Растворитель. |
| Аммиак | Сырье для получения удобрений (нитратов калия, натрия, аммония). Сырье для получения азотной кислоты. |
| Аммиак раствор | Используется как компонент стеклоочистительных жидкостей, жидкость с резким запахом. В аптечке – нашатырный спирт, применяется для приведения в чувство человека, потерявшего сознание. |
| Озон O3 | Дезинфекция (очистка) воды. |
| Хлор Cl2 | Дезинфекция (очистка) воды. |
| Ацетилен C2H2 | Используется для сварки и резки металла благодаря тому, что при горении ацетилена развивается крайне высокая температура – около 3000 оС |
| Метан | Основной компонент природного газа. Горючее для газовых плит. |
| Лимонная кислота | Используется для удаления накипи с внутренней поверхности чайника. |
| Пероксид водорода | Используется в качестве антисептика (дезинфицирующего средства) при обработке небольших ран и порезов. |
| Хлоропрен (2-хлорбутадиен-1,3) Изопрен (2-метилбутадиен-1,3) Бутадиен (дивинил) |
Сырье для производства каучука. |
| Йод | Спиртовой раствор данного вещества используется для дезинфекции мелких порезов и царапин. |
| Анилин | Производство красителей |
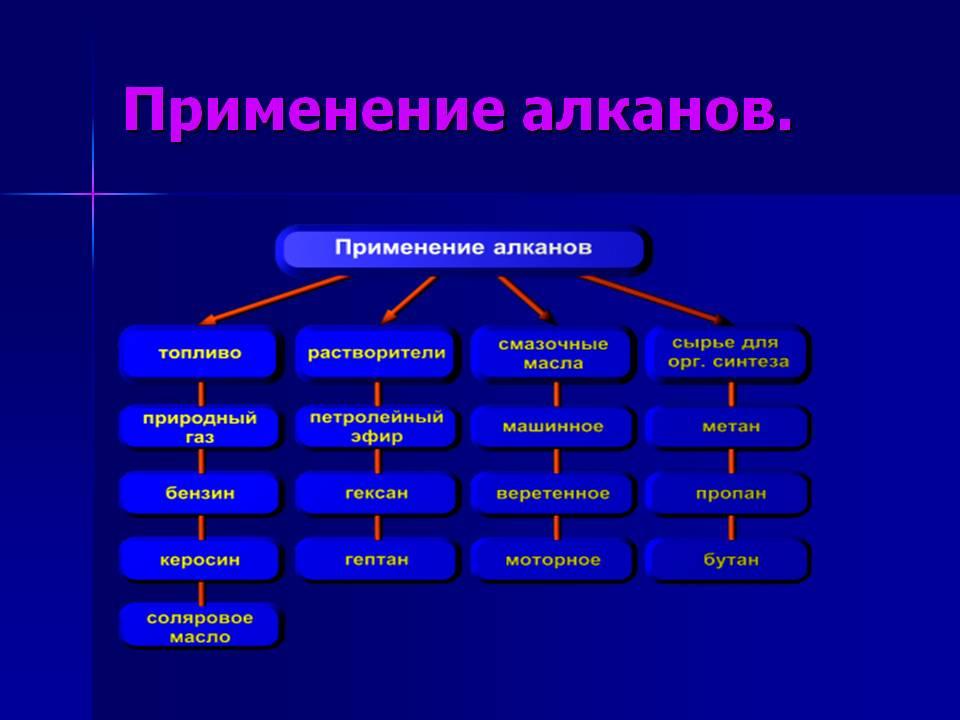
Применение
веществ
Органика
Алканы
Алканы
используются при изготовлении каучука,
синтетических тканей, пластмасс,
поверхностно-активных веществ.
Пропан,
бутан – исп-ся в качестве заправки
баллонов для тушения пожаров в сжиженном
виде
Пропан-бутановая
— смесь в зажигалках
Пропан
— баллоны для дачи
Алканы-газы
– в качестве пропеллентов для изготовления
аэрозолей
СН4
– горючее для газовых плит
С5-С19
– бензин, керосин, смеси для розжига,
топливо
С20
и далее – свечи
С₁₈Н₃₈
до С₃₅Н₇₂ (парафин) — Изготовление
вазелинового масла (смесь жидких
алканов), вазелина (смесь жидких и твёрдых
алканов), свечей, моющих средств, лаков,
эмалей, мыла. В качестве пропитки спичек.
Использование при производстве
органических кислот. В качестве пропитки
упаковочной бумаги. Производство
жевательных резинок
Хлорпроизводные
алканов — изготовление спиртов, альдегидов,
кислот, РАСТВОРИТЕЛИ
Алкены
Циклоалканы
Циклопропан
– анестетик
Циклопентан
— добавка к моторному топливу для
повышения качества.
Циклогексан
используется для синтеза полупродуктов
при производстве синтетических волокон
нейлона и капрона, для получения
циклогексанола, циклогексанона,
адипиновой кислоты, а также в качестве
растворителя.
Алкины
Ацетилен
– газовая сварка, получение технического
карбона; прим-ся в автономных светильниках
и при производстве ракетного топлива
Алкадиены
Синтез
каучуков => пол-е резины, эбонита (не
проводит эл. ток, исп-ся для изоляции),
пвх и т.д.
Бензол
Применяется
в синтезе современных отхаркивающих
средств, препаратов для лечения кожных
заболеваний и других лекарств. В малых
количествах практически не обладает
токсичностью. Применяется в качестве
исходного реагента для синтеза. Он
эффективно растворяет смолы, масла,
жиры, йод и серу.
Бензойная
кислота
Снижает
активность ферментов в структуре
микробов их
Проявляет
дезинфицирующие свойства.
Это
качество нашло активное применение
бензойной кислоты и с успехом используется
для изготовления лекарственных составов
от кашля, отхаркивающих и антисептических
средств
Получение
фунгицид, применяющихся в сельском
хозяйстве для защиты разнообразных
культурных растений.
Консервавнт
Толуол
Лакокрасочные
материалы
Лаки
Краски
РАСТВОРИТЕЛЬ
полимеров
Спирты
—
В
органическом синтезе.
— Биотопливо,
добавки в топливо, ингредиент тормозной
жидкости, гидравлических жидкостей.
—
Растворители.
— Сырье для производства
ПАВ, полимеров, пестицидов, антифризов,
взрывчатых и отравляющих веществ,
бытовой химии.
— Душистые вещества
для парфюмерии. Входят в состав
косметических и медицинских средств.
—
Основа алкогольных напитков, растворитель
для эссенций; сахарозаменитель (маннит
и т.п.); краситель (лютеин), ароматизатор
(ментол).
Этиленгликоль
Производство
теплоносителей и охлаждающих жидкостей,
задачами которых является теплопередача
и теплоотвод соответственно. Производство
пластиковых бутылок. Производство
синтетических волокон. Производство
гидравлических жидкостей. Изготовление
лекарственных средств.
Глицерин
Фенол
АНТИСЕПТИКИ,
лекарства, заменители сахара, красители,
клеи, фенолформальдегидная смола
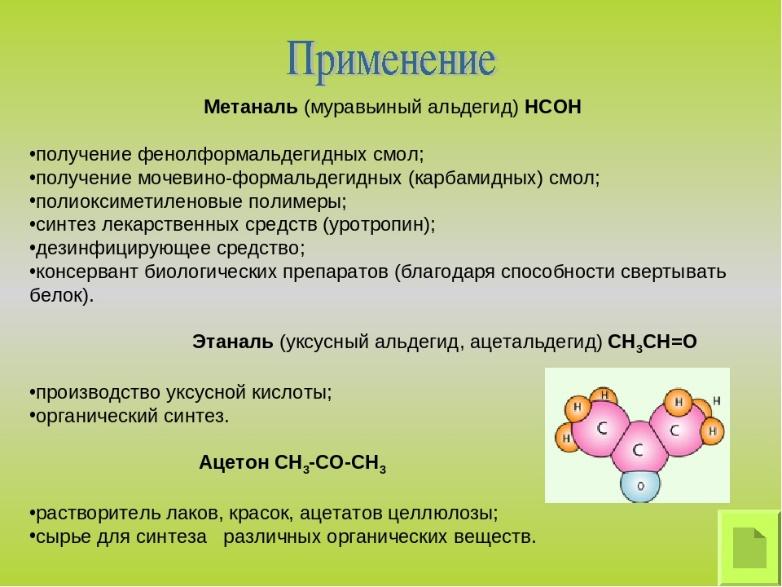
Альдегиды
и ацетон
Альдегиды
нашли широкое применение в качестве
сырья для синтеза различных продуктов.
Так, из формальдегида (крупнотоннажное
производство) получают различные смолы
(фенол-формальдегидные и т.д.), лекарственные
препараты (уротропин); ацетальдегид —
сырье для синтеза уксусной кислоты,
этанола, различных производных пиридина
и т.д. Многие альдегиды (масляный, коричный
и др.) используют в качестве ингредиентов
в парфюмерии
Карб
кислоты
Стеарат/пальмитат
натрия – мыло
Амины
Нитросоединения
Аминокислоты
Жиры
Неорганика
Нитраты
– азотсодержащие удобрения
Фосфат,
гидрофосфат кальция; суперфосфат –
фосфорные удобрения
SiO2
– керамика, стекло
S
– резина
NaHCO3
– разрыхлитель теста, чистящее средство
(NH4)2CO3
– разрыхлитель теста
С
акт. – поглотитель в фильтрах и при
отравлениях
ССl4
– растворитель
NH3
– пол-е удобрений, пол-е азотной к-ты
NH3*H2O
– стеклоочистительные ж-ти и при потере
сознания
O3
– Дезинфекция воды; обнаруживание KI
с крахмалом
Cl2
– Дезинфекция воды; обнаруживание KI
с крахмалом
Лимонная
кислота – удвление накипи с внутр.
пов-ти чайника
H2O2
– антисептик для ран
I2
— антисептик для ран; обнар-е крахмала
№ п/п
Вещество
Применение
1
Сера
Для получения серной кислоты, вулканизации каучука (производство резины), изготовления горючих и светящихся составов, в сельском хозяйстве и в медицине.
2
Соляная кислота
Пищевая добавка Е507, которая применяется в процессе изготовления водочной продукции, а так же различных сиропов. В металлургии для очистки металла перед паянием или лужением. Входит в состав чистящих средств.
3
Серная кислота
Очистка нефтепродуктов от сернистых, непредельных органических соединений; Удаление окалины с проволоки, а также листов перед лужением и оцинкованием (разбавленная), для травления различных металлических поверхностей перед покрытием их хромом, медью, никелем. Средство при получении красителей и лекарственных веществ, для производства удобрений, этилового спирта, искусственного волокна, анилиновых красителей.
4
Сероводород и сульфиды
В производстве серной кислоты, в медицине, для проведения химического анализа катионов.
5
Сернистый газ (SO2) и сульфиты
В производстве серной кислоты, получение бумаги, для отбеливания шелковых и шерстяных тканей, для уничтожения микроорганизмов и грибковых заболеваний (окуривание виноградников, подвалов, добавление в вино). Используется SO2 в пищевой промышленности как консервирующее и антибактериальное вещество. Добавляют его в сиропы, вымачивают в нем свежие плоды. Консервированные овощные пюре и соки тоже содержат диоксид серы в качестве консервирующего агента.
6
Оксид серы (VI)
Для получения серной кислоты.
7
Соли серной кислоты
- Na2SO4 ∙ 10H2O (глауберова соль) – применяют в медицине в качестве слабительного средства, а безводный сульфат натрия – для производства соды и стекла.
- (NH4)2SO4 – азотное удобрение, K2SO4 – калийное удобрение.
- CaSO4 ∙ 2H2O (гипс) – в медицине и строительстве.
- MgSO4 (горькая соль) – в медицине в качестве слабительного средства.
- ВаSO4 (баритовая каша) – в медицине как рентгеноконтрастное вещество.
- Купоросы: CuSO4 ∙ 5H2O – используют для протравливания семян, для борьбы с болезнями растений; FeSO4 ∙ 7H2O – для приготовления чернил, минеральных красок; ZnSO4 ∙ 7H2O – для производства минеральных красок и в медицине (как антисептик).
8
Азот
Жидкий азот применяется для глубокого охлаждения, газообразный – для синтеза аммиака, для создания инертной атмосферы (лампы накаливания, сварка).
9
Азотная кислота
Производство азотных и комбинированных удобрений (натриевой, аммиачной, кальциевой и калиевой селитры, нитрофоса, нитрофоски). Взрывчатые вещества (тринитротолуола и др.), органических красителей. В металлургии — для растворения и травления металлов, а также для разделения золота и серебра.
10
Аммиак
Производство азотной кислоты, которая идет на производство удобрений (аммиачная селитра NH4NO3, мочевины (NH2)2CO, аммофос – смесь гидрофосфата (NH4)2HPO4 и дигидрофосфата аммония NH4H2PO4). В качестве дешевого хладагента в промышленных холодильных установках. Для получения синтетических волокон, например, найлона и капрона. При очистке и окрашивании хлопка, шерсти и шелка. Водный раствор аммиака (нашатырь) – в медицине.
11
Соли аммония
Производство взрывчатых веществ в смеси с порошками алюминия и угля при горных разработках, в качестве удобрений, при пайке металлов.
12
Оксиды азота
N2O – в медицине (наркоз), NO2 – производство азотной кислоты.
13
Водород
Экологически чистое топливо, для сварки и резки металлов, для получения металлов, аммиака, метанола, хлороводорода, гидрирования жидких жиров (в производстве маргарина).
14
Кислород
Реагент в органическом и неорганическом синтезе, для обеспечения дыхания в медицине.
15
Фосфор
Производство фосфорных удобрений (фосфоритной муки, простых и двойных суперфосфатов, комплексных азотно-фосфорных удобрений). Производство синтетических моющих средств, фосфатных стёкол, для обработки и крашения натуральных и синтетических волокон.
16
Оксид фосфора (V)
Получение ортофосфорной кислоты, в качестве осушителя (поглощает воду)
17
Ортофосфорная кислота
Производство фосфорных удобрений, в органическом синтезе.
18
Галогены
- Фтор — для получения смазочных веществ, выдерживающих высокую температуру, тефлона, фреонов и т.д.
- Хлор – в производстве соляной кислоты, хлорной извести, гипохлоритов и хлоратов, для отбеливания тканей и целлюлозы, идущей на изготовление бумаги, для стерилизации питьевой воды и обеззараживания сточных вод, полимеров.
- Бром — выработка различных лекарственных веществ, расителей, а также бромида серебра, использующегося в производстве фотоматериалов.
- Йод — в медицине в виде 10%-го раствора в этаноле в качестве антисептического и кровоостанавливающего средства. Йод входит в состав ряда фармацевтических препаратов.
19
Хлориды
- NaCl – для получения хлороводорода, натрия, хлора, едкого натра, водорода, в производстве соды, в пищевой промышленности медицине.
- KCl – в качестве калийного удобрения.
- ZnCl2 – для пропитки древесины от гниения и при пайке металлов, в медицине в качестве антисептика.
- BaCl2 — для борьбы с вредителями растений.
- CaCl2 — в качестве осушителя и в медицине.
- AlCl3 – катализатор в органическом синтезе.
- HgCl2 – для протравливания семян, дубления кожи в органическом синтезе.
20
Углерод
Алмазы применяются для обработки твёрдых материалов (бурение горных пород, металлообрабатывающий инструмент) в ювелирной промышленности (производство бриллиантов). Графит используется в производстве карандашей и электродов. Уголь и кокс используют в качестве топлива и для получения металлов, активированный уголь является адсорбентом.
21
Угарный газ
В качестве топлива, при получении метанола, металлов, фосгена (COCl2), в органическом синтезе.
22
Углекислый газ
В производстве напитков, соды, сахара, в огнетушителях, для хранения скоропортящихся продуктов («сухой лёд»), для получения угарного газа и участвует в процессе фотосинтеза.
23
Соли угольной кислоты
- Na2CO3 – кальцинированная сода и Na2CO3 ∙ 10Н2О – кристаллическая сода применяются в производстве бумаги, стекла, мыла, в быту.
- NaHCO3 – гидрокарбонат натрия (питьевая сода, двууглекислая сода) применяется в медицине, в пищевой и кондитерской промышленности.
- K2CO3 – поташ, применяется для производства мыла и специальных сортов стекла, в химической промышленности.
- CaCO3 – применяется для получения негашеной извести CaO, в строительстве, в архитектуре, для изготовления скульптур.
24
Кремний
Для получения легированных сталей, производства полупроводниковых приборов и изготовления кислотоустойчивой аппаратуры.
25
Оксид кремния (IV)
При производстве стекла, цемента, в строительстве, в производстве керамических изделий, химической посуды.
26
Натрий и калий
Получение пероксидов и амидов, сплав этих металлов используется в качестве теплоносителей в ядерных реакторах.
27
Бериллий
Получение сплавов
28
Медь
Для изготовления электропроводов и сплавов – бронзы, латуни, дюралюминия.
29
Серебро
Компонентов сплавов ювелирных изделий, монет, медалей, столовой и лабораторной посуды, для серебрения зеркал, как катализатор в органическом синтезе.
30
Цинк
Получение сплавов, для цинкования стали и чугуна в антикоррозионных целях.
31
Хром
Компонент стали (хромированная сталь), изготовление инструментов.
32
Железо
В качестве катализатора (губчатое железо), производство чугуна и сталей.
33
Алюминий
Используется для изготовления различных сплавов, применяемых в авиационной, машиностроительной, пищевой и электротехнической промышленности; для получения металлов методом алюмотермии (Cr, Mn, V, Ti и др.)
34
Ртуть
Производство люминесцентных и ртутных ламп, контрольно-измерительных приборов (термометров, манометров, барометров и т.д.), в медицине для изготовления мазей для лечения кожных заболеваний.
35
Гидроксид натрия
NaOH (едкий натр, каустическая сода, каустик) применяют для очистки нефтепродуктов, в производстве мыла, бумаги, в текстильной и химической промышленности.
36
Гидроксид кальция
В строительстве, производстве стекла, смягчитель воды.
37
Гидроксид магния
Очистка сахарных растворов, входит в состав зубной пасты.
38
Гидроксид алюминия
Для очистки воды, в медицине как обволакивающее и адсорбирующее вещество.
39
Алканы (метан, пропан)
В качестве топлива, как растворители и как сырьё для получения органических веществ.
40
Алкены (изопрен, этилен, пропилен)
Получение полимеров, фенола, ацетона, ацетальдегида, растворителей; для улучшения детонационных качеств топлива. Этилен – для ускорения созревания плодов растений.
41
Алкины
Ацетилен используется для резки и сварки металлов, в органическом синтезе: в производстве синтетических каучуков, поливинилхлорида, уксусной кислоты и растворителей.
42
Алкадиены
Производство полимеров (каучуков).
43
Бензол и его производные
Получение красителей, лекарственных веществ, взрывчатых веществ, ядохимикатов, пластмасс и синтетических волокон; используются в качестве растворителей; добавляются в бензины, повышая их октановое число.
44
Спирты
В качестве растворителей и в органическом синтезе. Этанол применяется для изготовления спиртных напитков, в медицине как дезинфицирующее средство, в качестве топлива. В промышленности – растворитель в производстве каучука, сложных эфиров, лаков, медикаментов. Метанол применяют для получения формальдегида, растворителей, в органическом синтезе.
45
Многоатомные спирты
Этиленгликоль применяется для приготовления охлаждающей жидкости (антифризов) для автомобилей, для получения растворителей и взрывчатых веществ. Глицерин – используется в медицине, парфюмерии, кожевенной промышленности, для получения взрывчатого вещества (тринитроглицерин), лакокрасочных материалов.
46
Фенолы
Применяют для получения фенолформальдегидной смолы, взрывчатых веществ, красителей, лекарственных препаратов, капрона, для дезинфекции (карболка).
47
Альдегиды и кетоны
Формальдегид – используется для получения фенолформальдегидной и карбамидной смол, в органическом синтезе; 40%-ный раствор (формалин) применяется в медицине, для консервирования биологических препаратов, в кожевенной промышленности и для протравливания семян.
Ацетальдегид – применяется для получения уксусной кислоты и для синтеза различных органических веществ.
Ацетон – в качестве растворителя лаков, красок.
48
Карбоновые кислоты
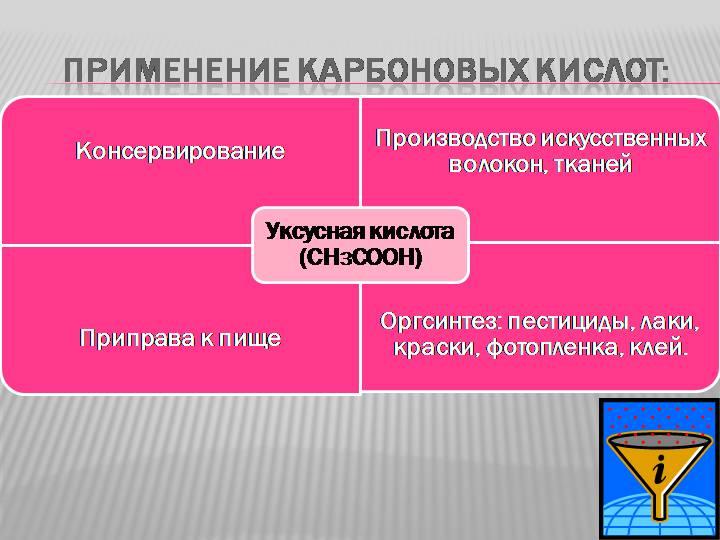
Муравьиная кислота – 1,25% -ный спиртовой раствор (муравьиный спирт) применяется в медицине, для производства сложных эфиров.
Уксусная кислота – в пищевой промышленности, для производства красителей, лекарств (аспирин), сложных эфиров, ацетатного волокна.
Стеариновая C17H35COOH и пальмитиновая C17H33COOH кислоты – входят в состав жиров. Натриевая и калиевая соли входят в состав мыла.
Щавелевая кислота – используется в кожевенной и текстильной промышленности.
Акриловая и метакриловая кислоты – для получения полимеров (органического стекла), волокон.
Бензойная кислота – в качестве консерванта в пищевой промышленности.
49
Сложные эфиры
Применяются в качестве растворителей лакокрасочных материалов, в парфюмерии, при производстве напитков.
50
Жиры
Жиры применяются в качестве продукта питания, для получения мыла, в косметической и фармацевтической промышленности. Гидрированные жиры применяются для изготовления маргарина.
51
Целлюлоза
Нитраты целлюлозы используются для производства бездымного пороха и лаков, ацетаты – в производстве ацетатного волокна, лаков, плёнок. Целлюлоза используется в производстве бумаги, волокон (ацетатного и вискозного), одежды, бинтов, ваты
52
Крахмал
Применяется для получения клея (декстриновый клей), накрахмаливания белья, в кондитерском производстве (получение патоки), в производстве спирта и вина.
53
Амины
Анилин и другие ароматические амины используются для получения красителей, лекарственных и взрывчатых веществ. Алифатические амины используются для получения лекарственных препаратов, пестицидов и пластмасс.
Задания
Версия для печати и копирования в MS Word
Установите соответствие между веществом и его применением: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) гидроксид натрия
Б) азотная кислота
В) формальдегид
ПРИМЕНЕНИЕ
1) производство смол
2) очистка воды
3) производство взрывчатых веществ
4) омыление жиров
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Спрятать решение
Решение.
А. Взаимодействие жиров со щёлочью называется омылением (4).
Б. Азотная кислота используется для производства многих взрывчатых веществ: нитроглицерина, тротила, гексогена и других (3).
В. Формальдегид способен вступать в реакции полимеризации с образованием смол. Наиболее известной является фенолформальдегидная смола (1).
Ответ: 431.
Область применения:
Аммиак — производство удобрений
Метан (природный газ) — в качестве топлива , энергетика
Изопрен — получение каучука
Этилен — получение пластмасс
капролактам — получение капрона
пропан — в качестве топлива
изопрен — получение каучука
стирол — получение полистирола
пропилен — получение
полипропилена
гидроксид аммония — в медицине
оксид кремния — получение стекол
сера — процесс вулканизации резины
тетрахлорид углерода — в качестве растворителя
ацетон — в качестве растворителя
углерод – для металлургия , для
производство чугуна
стирол — для производство
пластмасс
азот — для производство
удобрений
уксусная кислота — для производство
волокон, для пищевая промышленность
фосфорная кислота — для
производство удобрений
кислород — для металлургия
бензол — -для
производство пластмасс
хлор — для производство
пластмасс , производство органических растворителей
азотная кислота- для
производство удобрений
карбонат кальция – для
производство стекла
углекислый газ – для пищевая
промышленность
аргон создание инертной
атмосферы
карбонат натрия – для
производство стекла
озон — для очистка воды
кислород – для производство
стали
Полиэтилен – для игрушки,
пластиковые пакеты
политетрафторэтилен – для
тефлоновая посуда
изопреновый каучук — для автомобильные
шины
поливинилхлорид — для трубы,
оконные панели
поликарбонат — для пластиковые
бутыли, DVD-диски
полистирол – для контейнеры
для пищи
нефть – для
производства топлива
сода — для производство
стекла
водород –для производство
аммиака
кислород – для выплавка стали
бутадиен – для производство
пластмасс
Классификация:
Каучук — происхождение
-природный органический
Асбест- происхождение-
неорганический
Вискозное волокно- происхождение
-искусственный
Лен — происхождение -природный
органический
Поливинилхлорид —
происхождение -синтетический
Карбидное волокно — происхождение
-неорганический
Капрон — происхождение
-синтетический
Борное волокно- происхождение
— неорганический
Ацетатное волокно —
происхождение -искусственный
Винол — происхождение
-синтетический
Хлопок — происхождение
-природный органический
Кварцевое волокно —
происхождение -неорганический
Стекловолокно- происхождение —
неорганический
Нейлон- происхождение —
синтетический
Шелк — происхождение
-природный органический
Базальт- происхождение —
неорганический
Пенька- происхождение
-природный органический
Акрил- происхождение
-синтетический
Карбидкремниевое волокно-
происхождение — неорганический
Эластан- происхождение —
синтетический
Оксидное волокно —
происхождение -неорганический
Лайкра- происхождение —
синтетический
Триацетатное волокно —
происхождение -искусственный
Полиэстер- происхождение —
синтетический
Мономер-полимер:
винилхлорид — поливинилхлорид
хлорэтилен — поливинилхлорид
этилен — полиэтилен
пропен — полипропилен
винилбензол — полистирол
бутадиен — каучук
пропен — полипропилен
капролактам — капрон
терефталевая кислота —
полиэтилентерефталат
изопрен — каучук
этилен — полиэтилен
стирол — полистирол
тетрафторэтилен — тефлон
винилацетат — поливинилацетат
акриламид — полиакриламид
ацетилен — полиацетилен
этиленоксид — полиэтиленгликоль
винилбромид — поливинилбромид
Алюминий – из электролиз
расплава
железо – из восстановление
оксида углеродом
Натрий — электролиз расплава
кремний — восстановление оксида
углеродом
Аммиак -из воздуха
Стекло – из сода
этилен — из нефть
чугун – из магнитный железняк
Хлор — водный раствор хлорида
натрия
медь — халькопирит
полипропилен — получают из
пропилен
полиэтилен — получают из этилен
железо — получают из гематит,
пирит
Этанол — получают из древесина
Кислород — получают из воздух
углекислый газ — получают из
дымовые газы
фтор — получают из расплав
фторида калия
Процессы:
электролиз воды — получение
легких газов (водород, кислород)
крекинг нефтепродуктов —
получение бензина
перегонка (фракционирование)
сжиженного воздуха — получение легких газов (азот, кислород)
брожение древесины или соломы —
получение этанола
горение — получение тепловой
энергии
этерификация — получение
сложных эфиров
полимеризация — получение пластмасс и резины
вулканизация —
получение резины
перегонка (фракционирование)
сжиженного воздуха — получение легких газов (азот, кислород)
прокаливание фосфатов кальция с
углем и диоксидом кремния — получение фосфора
каталитическое окисление
диоксида серы в триоксид серы — получение серной кислоты
сшивание
молекул каучука в единую пространственную сеть — вулканизация
термическое или каталитическое
разложение тяжелых углеводородов — крекинг
присоединение воды к
непредельным соединениям — гидратация
реакция образования сложных
эфиров при взаимодействии кислот и спиртов — этерификация
присоединение водорода к
непредельным соединением с получением предельных соединений — гидрирование
замещение
водорода на галоген — радикальное галогенирование
присоединение воды к
непредельным соединениям — гидратация
присоединение водорода к
непредельным соединением с получением предельных соединений — гидрирование
переработка каменного угля —
коксование
Способ
разделения:
воды и октана — разделение с
помощью делительной воронки
воды и карбоната кальция
–разделение фильтрованием
железо и нитрат калия -с
помощью магнита
железо и магний — разделить с помощью
магнита
железа и меди -разделение с
помощью магнита
гексана и бензола — разделение фракционной
перегонкой
жидкий азот и кислород – разделяют фракционной
перегонкой
вода и пропанол —
фракционной перегонкой
вода и ацетон — разделить фракционной
перегонкой
вода и этанол -фракционной
перегонкой
поваренная соль и кварцевый песок —
-разделить обработка водой, фильтрование, выпаривание раствора
воды и бензола — декантацией
воды и сульфата бария —
фильтрованием
хлорид лития и кварцевый
песок -обработка водой
железа и хлорида стронция — с
помощью магнита
воды и фенол — декантацией
бутанола и этанола —
фракционной перегонкой
сульфат бария и хлорид калия
обработка водой
воды и тетрахлорметан — декантацией
алюминия и железа разделить с
помощью магнита
углерод и хлорид натрия —
обработка водой
изопропанол и этанол —
фракционной перегонкой
ацетон и изопропанол фракционной перегонкой
хлорид натрия и полиэтилен
обработка водой
Цвет
пламени:
соли борной кислоты- зеленое
пламя
соли стронция — карминово-красное
пламя
соли калия – фиолетовое пламя
соли меди — зеленое пламя
соли кальция — кирпично-красное
пламя
соли натрия — желтое пламя
соли калия — фиолетовое пламя
соли меди — зеленое пламя
соли бария —
желто-зеленое
соли лития — красное
Альдегиды — летучие жидкости органического состава, являющиеся продуктом неполного окисления спиртов. Карбонильная группа
в молекулах альдегидов связана с одним атомом водорода и одной группой R.
Не часто встречаются в природе в отдельном виде, но, несомненно, играют важную роль в физиологических процессах растений и животных.
Общая формула альдегидов CnH2nO.
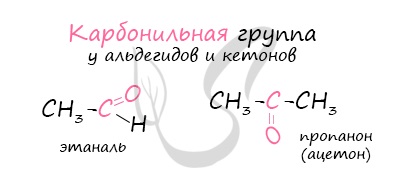
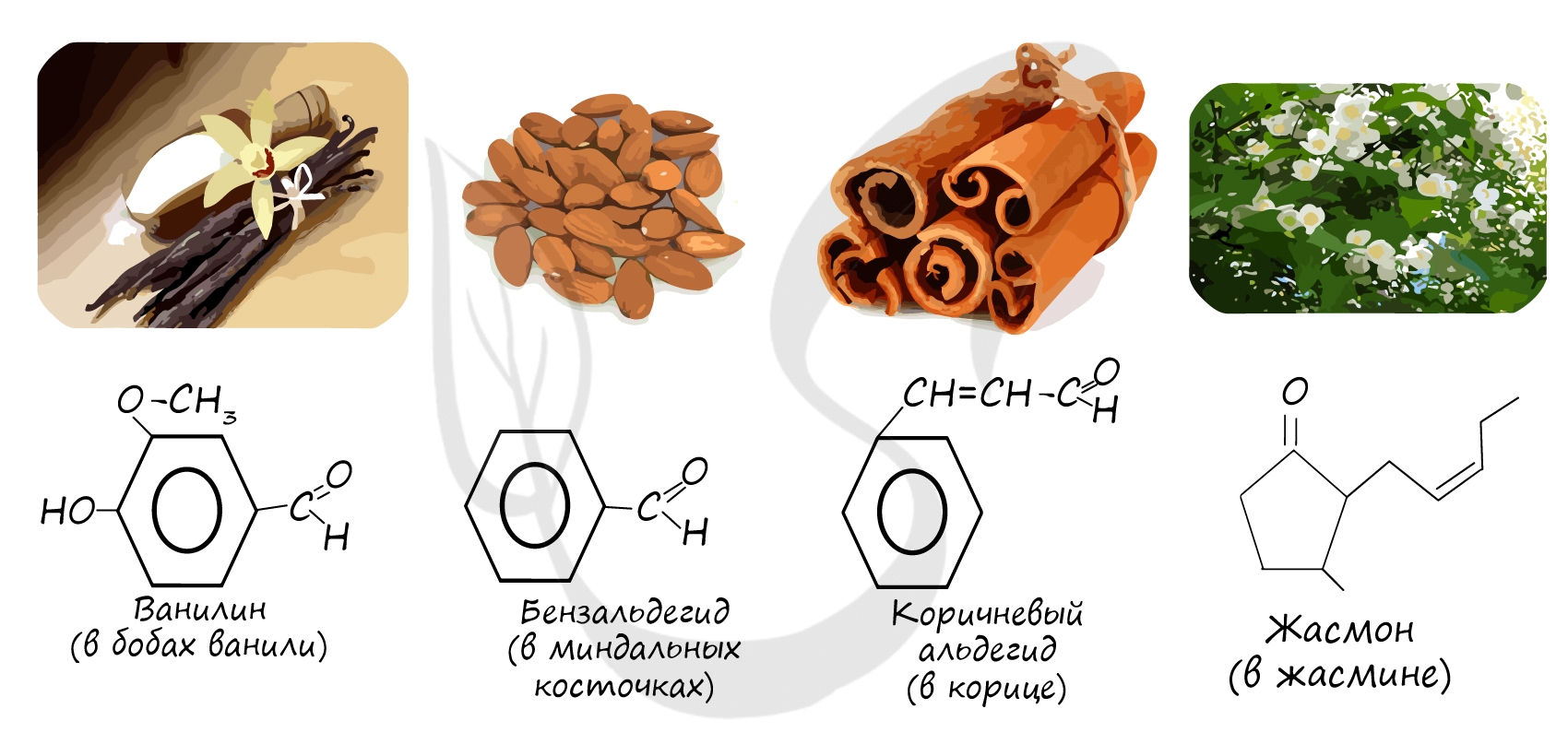
Многие альдегиды имеют специфический запах. Высшие альдегиды, в особенности непредельные, используются в пищевой промышленности и парфюмерии.
Номенклатура и изомерия альдегидов
Названия альдегидов формируются путем добавления суффикса «аль» к названию алкана с соответствующим числом атомов углерода: метаналь,
этаналь, пропаналь, бутаналь, пентаналь и т.д.
Вы можете встретить их молекулярные формулы, где группа OH записана наоборот — HO. Например: метаналь — HCHO, этаналь —
CH3CHO, пропаналь — C2H5CHO. Это делают специально для того, чтобы их было легче отличить от спиртов.
Многие альдегиды имеют тривиальные названия. Наиболее известные: метаналь — формальдегид, этаналь — ацетальдегид. Замечу, что формалином
называется 40% раствор формальдегида.
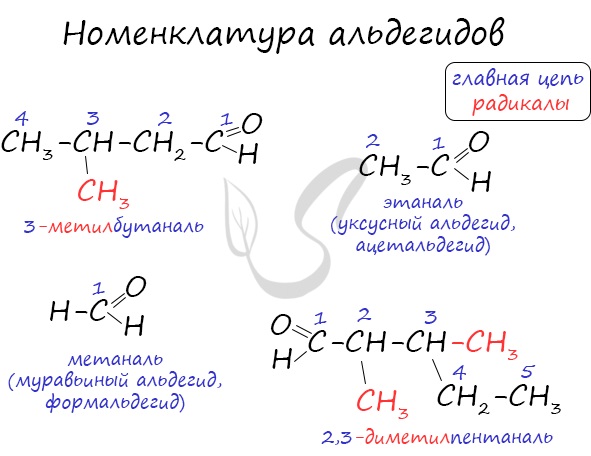
Для альдегидов характерна структурная изомерия: углеродного скелета, межклассовая изомерия с кетонами.
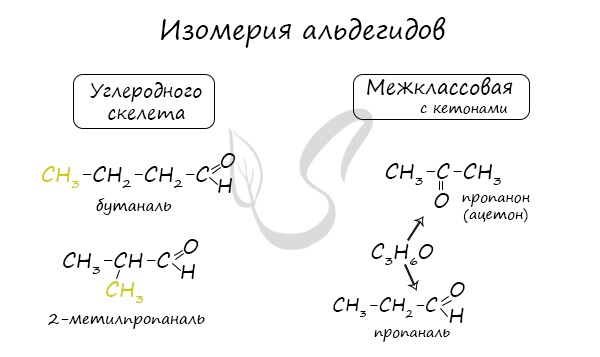
Получение альдегидов и кетонов
- Окисление спиртов
- Пиролиз солей карбоновых кислот
- Каталитическое дегидрирование спиртов
- Реакция Кучерова
- Гидролиз дигалогеналканов
- Окисление метана
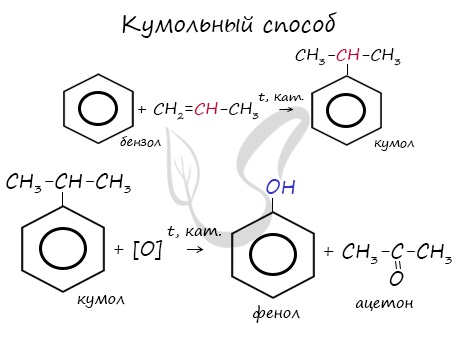
- Кумольный способ получения ацетона (и фенола)
Важно заметить, что при окислении первичных спиртов образуются альдегиды, при окислении вторичных спиртов — кетоны.
Окисление с помощью оксида меди относится к лабораторным способам получения альдегидов.
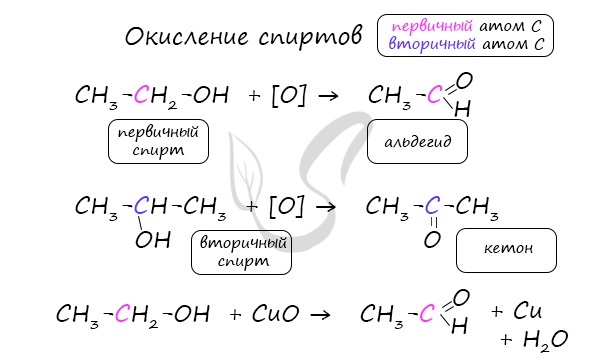
Этот способ также просто осуществить в лабораторных условиях. При пиролизе (нагревании без доступа кислорода) кальциевых или
бариевых солей карбоновых кислот возможно получение кетонов.

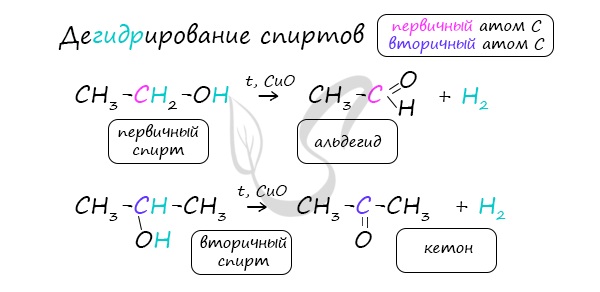
В присутствии катализатора и при нагревании спиртов от гидроксогруппы и прилежащего к ней атома углерода отщепляется по
атому водорода. В результате образуется карбонильная группа.
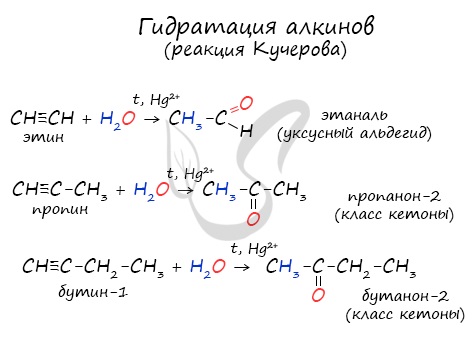
Реакцией Кучерова называют гидратацию алкинов в присутствии солей двухвалентной ртути.
В результате такой реакции ацетилен превращается в уксусный альдегид. Все остальные его гомологи: пропин, бутин, пентин и т.д. превращаются в
соответствующие кетоны.
Для получения альдегида два атома галогена должны находиться у первичного атома углерода, для получения кетонов — у вторичного.
В результате такого гидролиза образуются двухатомные спирты, в которых две OH-группы прилежат к одному атому углерода. Такие соединения неустойчивы
и распадаются на карбонильное соединение (альдегид или кетон) и воду.
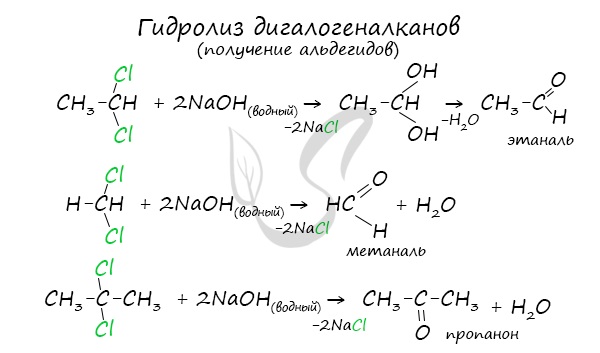
В промышленности окислением метана при температуре 500 °C и в присутствии катализатора получают формальдегид.

В прошлой теме, посвященной фенолам, мы касались данного способа. В результате такой реакции образуется не только фенол, но и ацетон.
Химические свойства альдегидов и кетонов
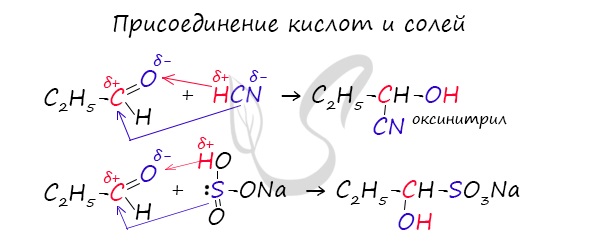
Запомните, что для альдегидов и кетонов характерны реакции присоединения по карбонильной группе. Это является важным отличием альдегидов от карбоновых кислот, для которых реакции присоединения не характерны.
- Реакции присоединения
- Окисление альдегидов
Для понимания механизма реакции важно вспомнить об электроотрицательности. В карбонильной группе кислорд, как более электроотрицательный
элемент, тянет электронную плотность на себя от углерода. На атоме кислорода возникает частичный отрицательный заряд (δ-), а на атоме
углерода частичный положительный (δ+).
Основы школьного курса физики подсказывают, что отрицательный заряд притягивает положительный: именно так и будет происходить
при присоединении различных молекул к карбонильной группе альдегидов и кетонов.
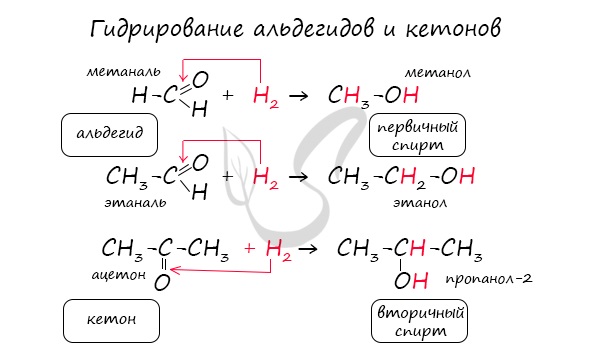
Реакция гидрирования альдегидов происходит по типу присоединения, сопровождается разрывом двойной связи в карбонильной группе.
Гидрирование альдегидов приводит к образованию первичных, а гидрирование кетонов — вторичных спиртов.
В результате полного окисления, горения, образуется углекислый газ и вода.
2CH3CHO + 5O2 → 4CO2 + 4H2O
Альдегиды легко окисляются до карбоновых кислот в лабораторных условиях. Это осуществляется с помощью известной реакции
серебряного зеркала. Данная реакция является качественной для альдегидов.
Кетоны, в отличие от альдегидов, в реакции окисления не вступают.

Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли

Важно заметить, что при окислении метаналя, образовавшаяся муравьиная кислота тут же окисляется до угольной кислоты, которая
распадается на углекислый газ и воду. Это связано с интересным фактом — наличием альдегидной группы у муравьиной кислоты.

Окисление также возможно другим реагентом — гидроксидом меди II. Эта реакция также относится к качественным для
альдегидов, в результате образуется кирпично-красный осадок оксида меди I.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.