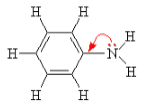
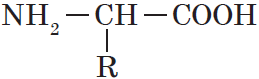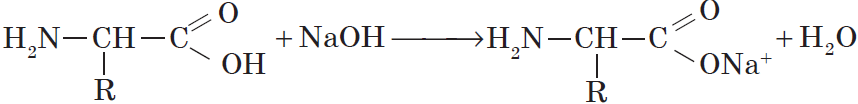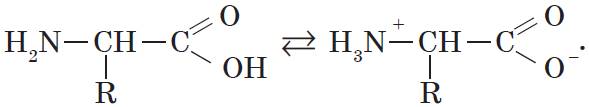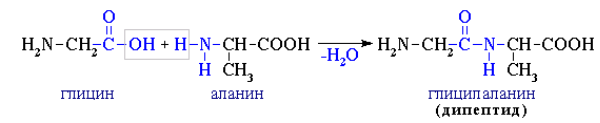Аминокислоты – органические бифункциональные соединения, в состав которых входят карбоксильные группы –СООН и аминогруппы –NH2.
Природные аминокислоты можно разделить на следующие основные группы:
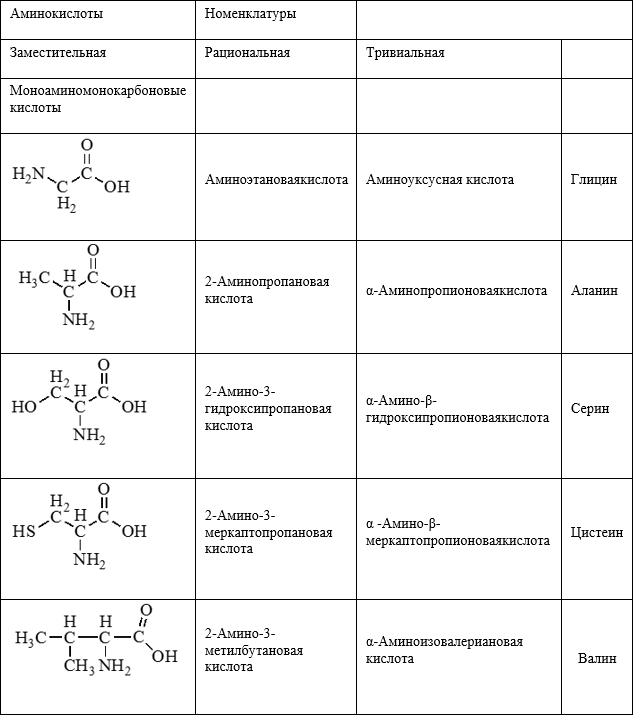
| 1) Алифатические предельные аминокислоты (глицин, аланин) | NH2-CH2-COOH глицин
NH2-CH(CH3)-COOH аланин |
| 2) Серосодержащие аминокислоты (цистеин) | 
цистеин |
| 3) Аминокислоты с алифатической гидроксильной группой (серин) | NH2-CH(CH2OH)-COOH серин |
| 4) Ароматические аминокислоты (фенилаланин, тирозин) | NH2-CH(CH2C6H5)-COOH
фенилаланин _________________________________ тирозин |
| 5) Аминокислоты с двумя карбоксильными группами (глутаминовая кислота) | HOOC-CH(NH2)-CH2-CH2-COOH
глутаминовая кислота |
| 6) Аминокислоты с двумя аминогруппами (лизин) | CH2(NH2)-CH2-CH2-CH2-CH(NH2)-COOH
лизин |
Номенклатура аминокислот
- Для природных α-аминокислот R-CH(NH2)COOH применяются тривиальные названия: глицин, аланин, серин и т. д.
- По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино- и указанием места расположения аминогруппы по отношению к карбоксильной группе:
- Часто используется также другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставка амино- с указанием положения аминогруппы буквой греческого алфавита.
Физические свойства аминокислот
Аминокислоты – твердые кристаллические вещества с высокой температурой плавления. Хорошо растворимы в воде, водные растворы хорошо проводят электрический ток.
Получение аминокислот
- Замещение галогена на аминогруппу в соответствующих галогензамещенных кислотах:
- Восстановление нитрозамещенных карбоновых кислот (применяется для получения ароматических аминокислот):
Химические свойства аминокислот
При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион:
1. Кислотно-основные свойства аминокислот
Аминокислоты — это амфотерные соединения.
Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами.
Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп.
Так, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH2), лизин — щелочной (одна группа -СООН, две -NH2).
1.1. Взаимодействие с металлами и щелочами
Как кислоты (по карбоксильной группе), аминокислоты могут реагировать с металлами, щелочами, образуя соли:
1.2. Взаимодействие с кислотами
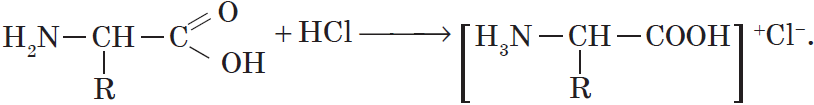
По аминогруппе аминокислоты реагируют с кислотами:
2. Взаимодействие с азотистой кислотой
Аминокислоты способны реагировать с азотистой кислотой.
Например, глицин взаимодействует с азотистой кислотой:
3. Взаимодействие с аминами
Аминокислоты способны реагировать с аминами, образуя соли или амиды.
4. Этерификация
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир:
Например, глицин взаимодействует с этиловым спиртом:
5. Декарбоксилирование
Протекает при нагревании аминокислот с щелочами или при нагревании.
Например, глицин взаимодействует с гидроксидом бария при нагревании:
Например, глицин разлагается при нагревании:
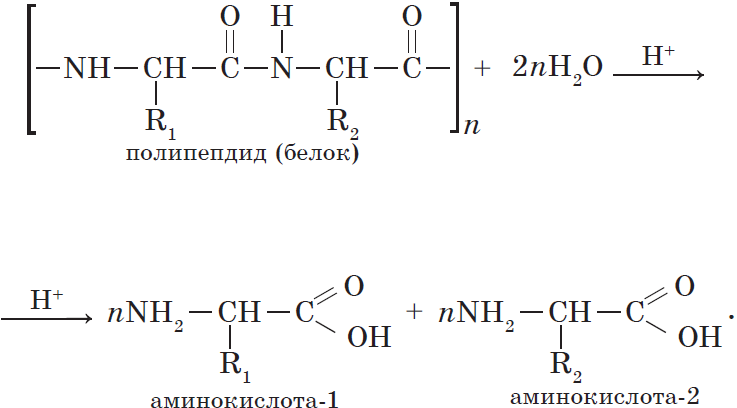
6. Межмолекулярное взаимодействие аминокислот
При взаимодействии аминокислот образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
Например, глицин реагирует с аланином с образованием дипептида (глицилаланин):
Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO–NH — пептидной связью.
8 мая 2022
В закладки
Обсудить
Жалоба
Формулы аминокислот
20 формул.
Аминокислоты — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Основные химические элементы аминокислот — это углерод (C), водород (H), кислород (O) и азот (N), хотя другие элементы также встречаются в радикале определенных аминокислот. Известны около 500 встречающихся в природе аминокислот (хотя только 20 используются в генетическом коде). Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминогруппы.
aminokisloti.docx
Чтобы поделиться, нажимайте
Номенклатура аминокислот
По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино и указанием места расположения аминогруппы по отношению к карбоксильной группе.
Например:
Часто используется также другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставка амино с указанием положения аминогруппы буквой греческого алфавита. Пример:
Для a-аминокислот, которые играют исключительно важную роль в процессах жизнедеятельности животных и растений, применяются тривиальные названия.
Если в молекуле аминокислоты содержится две аминогруппы, то в ее названии используется приставка диамино, три группы NH2 – триамино и т.д.
Пример:
Наличие двух или трех карбоксильных групп отражается в названии суффиксом –диовая или -триовая кислота:
Тривиальные названия:
- Оптическая изомерия
Все a-аминокислоты, кроме глицина H2N-CH2-COOH, содержат асимметрический атом углерода (a-атом) и могут существовать в виде зеркальных антиподов.
Оптическая изомерия природных a-аминокислот играет важную роль в процессах биосинтеза белка.
Свойства аминокислот
Физические свойства. Аминокислоты – твердые кристаллические вещества с высокой т.пл., при плавлении разлагаются. Хорошо растворимы в воде, водные растворы электропроводны. Эти свойства объясняются тем, что молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе
Химические свойства
Аминокислоты проявляют свойства оснований за счет аминогруппы и свойства кислот за счет карбоксильной группы, т.е.являются амфотерными соединениями. Подобно аминам, они реагируют с кислотами с образованием солей аммония:
H2N–CH2–COOH + HCl = Cl— [H3N–CH2–COOH]+
Как карбоновые кислоты они образуют функциональные производные:
а) соли
H2N–CH2–COOH + NaOH = H2N–CH2–COO— Na+ + H2O
б) сложные эфиры
H+
H2N–CH2–COOH + C2H5OH = H2N–CH2–COOC2H5 + H2O
в) амиды
H2N–R–COOH + NH3 = H2N–R–CONH2 + H2O
Кроме того, возможно взаимодействие амино- и карбоксильной групп как внутри одной молекулы (внутримолекулярная реакция для g-, d- e- и т.д. аминокислот), так и принадлежащих разным молекулам (межмолекулярная реакция).
Практическое значение имеет внутримолекулярное взаимодействие функциональных групп e-аминокапроновой кислоты, в результате которого образуется e-капролактам – полупродукт для получения капрона.
Межмолекулярное взаимодействие a-аминокислот приводит к образованию пептидов. При взаимодействии двух a-аминокислот образуется дипептид Межмолекулярное взаимодействие трех a-аминокислот приводит к образованию трипептида и т.д.
Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO–NH — пептидной связью.
Аминокислоты — гетерофункциональные соединения, которые обязательно содержат две функциональные группы: аминогруппу $—NH_2$ и карбоксильную группу $—СООН$, связанные с углеводородным радикалом.
Общую формулу простейших аминокислот можно записать так:
Так как аминокислоты содержат две различные функциональные группы, которые оказывают влияние друг на друга, характерные реакции отличаются от характерных реакций карбоновых кислот и аминов.
Свойства аминокислот
Аминогруппа $—NH_2$ определяет основные свойства аминокислот, т.к. способна присоединять к себе катион водорода по донорно-акцепторному механизму за счет наличия свободной электронной пары у атома азота.
Группа $—СООН$ (карбоксильная группа) определяет кислотные свойства этих соединений. Следовательно, аминокислоты — это амфотерные органические соединения.
Со щелочами они реагируют как кислоты:
С сильными кислотами — как основания-амины:
Кроме того, аминогруппа в аминокислоте вступает во взаимодействие с входящей в ее состав карбоксильной группой, образуя внутреннюю соль:
Так как аминокислоты в водных растворах ведут себя как типичные амфотерные соединения, то в живых организмах они играют роль буферных веществ, поддерживающих определенную концентрацию ионов водорода.
Аминокислоты представляют собой бесцветные кристаллические вещества, плавящиеся с разложением при температуре выше $200°С$. Они растворимы в воде и нерастворимы в эфире. В зависимости от радикала $R—$ они могут быть сладкими, горькими или безвкусными.
Аминокислоты подразделяют на природные (обнаруженные в живых организмах) и синтетические. Среди природных аминокислот (около $150$) выделяют протеиногенные аминокислоты (около $20$), которые входят в состав белков. Они представляют собой L-формы. Примерно половина из этих аминокислот относятся к незаменимым, т.к. они не синтезируются в организме человека. Незаменимыми являются такие кислоты, как валин, лейцин, изолейцин, фенилаланин, лизин, треонин, цистеин, метионин, гистидин, триптофан. В организм человека данные вещества поступают с пищей. Если их количество в пище будет недостаточным, нормальное развитие и функционирование организма человека нарушаются. При отдельных заболеваниях организм не в состоянии синтезировать и некоторые другие аминокислоты. Так, при фенилкетонурии не синтезируется тирозин.
Важнейшим свойством аминокислот является способность вступать в молекулярную конденсацию с выделением воды и образованием амидной группировки $—NH—CO—$, например:
${nNH_2—(CH_2)_5—COOH}↙{text»аминокапроновая кислота»}→{(…—NH—(CH_2)_5—COO—…)_n}↙{text»капрон»}+(n+1)H_2O$.
Получаемые в результате такой реакции высокомолекулярные соединения содержат большое число амидных фрагментов и поэтому получили название полиамидов.
Для получения синтетических волокон пригодны аминокислоты с расположением аминои карбоксильной групп на концах молекул.
Полиамиды $α$-аминокислот называются пептидами. В зависимости от числа остатков аминокислот различают дипептиды, пептиды, полипептиды. В таких соединениях группы $—NH—CO—$ называют пептидными.
Некоторые аминокислоты, входящие в состав белков.
| Название аминокислоты | Формула |
| Глицин (аминоуксусная) | $NH_2-CH_2-COOH$ |
| Аланин ($α$-аминопропионовая) | 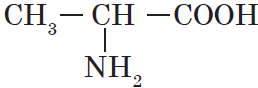 |
| Цистеин ($α$-амино-$β$меркаптопропионовая) | 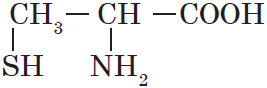 |
| Лизин ($α$, $ε$-диаминокапроновая) | 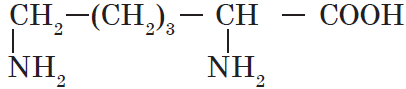 |
| Фенилаланин ($α$-амино-$β$фенилпропионовая) | 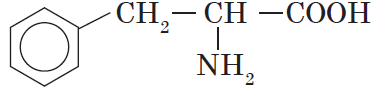 |
Белки
Белками, или белковыми веществами, называют высокомолекулярные (молекулярная масса варьируется от $5–10$ тыс. до $1$ млн и более) природные полимеры, молекулы которых построены из остатков аминокислот, соединенных амидной (пептидной) связью.
Белки также называют протеинами (от греч. protos — первый, важный). Число остатков аминокислот в молекуле белка очень сильно колеблется и иногда достигает нескольких тысяч. Каждый белок обладает своей, присущей ему, по следовательностью расположения аминокислотных остатков.
Белки выполняют разнообразные биологические функции: каталитические (ферменты), регуляторные (гормоны), структурные (коллаген, фиброин), двигательные (миозин), транспортные (гемоглобин, миоглобин), защитные (иммуноглобулины, интерферон), запасные (казеин, альбумин, глиадин) и другие.
Белки — основа биомембран, важнейшей составной части клетки и клеточных компонентов. Они играют ключевую роль в жизни клетки, составляя как бы материальную основу ее химической деятельности.
Исключительное свойство белка — самоорганизация структуры, т.е. его способность самопроизвольно создавать определенную, свойственную только данному белку пространственную структуру. По существу, вся деятельность организма (развитие, движение, выполнение им различных функций и многое другое) связана с белковыми веществами. Без белков невозможно представить себе жизнь.
Белки — важнейшая составная часть пищи человека и животных, поставщик необходимых аминокислот.
Строение белков
Все белки образованы двадцатью разными $α$-аминокислотами, общую формулу которых можно представить в виде
$R-CHNH_2-COOH$
где радикал R может иметь самое разнообразное строение.
Белки представляют собой полимерные цепи, состоящие из десятков тысяч, миллионов и более остатков $α$-аминокислот, связанных между собой пептидными связями. Последовательность аминокислотных остатков в молекуле белка называют его первичной структурой.
Для белковых тел характерны огромные молекулярные массы (до миллиарда) и почти макроразмеры молекул. Такая длинная молекула не может быть строго линейной, поэтому ее участки изгибаются и сворачиваются, что приводит к образованию водородных связей с участием атомов азота и кислорода. Образуется регулярная спиралевидная структура, которую называют вторичной структурой.
В белковой молекуле могут возникать ионные взаимодействия между карбоксильными и аминогруппами различных аминокислотных остатков и образование дисульфидных мостиков. Эти взаимодействия приводят к появлению третичной структуры.
Белки с $M_r > 50000$ состоят, как правило, из нескольких полипептидных цепей, каждая из которых уже имеет первичную, вторичную и третичную структуры. Говорят, что такие белки обладают четвертичной структурой.
Свойства белков
Белки — амфотерные электролиты. При определенном значении $рН$ среды (оно называется изоэлектрической точкой) число положительных и отрицательных зарядов в молекуле белка одинаково.
Это одно из основных свойств белка. Белки в этой точке электронейтральны, а их растворимость в воде наименьшая. Способность белков снижать растворимость при достижении электронейтральности их молекул используется для выделения из растворов, например, в технологии получения белковых продуктов.
Гидратация. Процесс гидратации означает связывание белками воды, при этом они проявляют гидрофильные свойства: набухают, их масса и объем увеличиваются. Набухание отдельных белков зависит от их строения. Имеющиеся в составе и расположенные на поверхности белковой макромолекулы гидрофильные амидные ($—СО—NH—$, пептидная связь), аминные ($—NH_2$) и карбоксильные ($—СООН$) группы притягивают к себе молекулы воды, строго ориентируя их на поверхности молекулы. Окружающая белковые глобулы гидратная (водная) оболочка препятствует агрегации и осаждению, а следовательно, способствует устойчивости растворов белка. В изоэлектрической точке белки обладают наименьшей способностью связывать воду, происходит разрушение гидратной оболочки вокруг белковых молекул, поэтому они соединяются, образуя крупные агрегаты. Агрегация белковых молекул происходит и при их обезвоживании с помощью некоторых органических растворителей, например этилового спирта. Это приводит к выпадению белков в осадок. При изменении $рН$ среды макромолекула белка становится заряженной, и его гидратационная способность меняется.
При ограниченном набухании концентрированные белковые растворы образуют сложные системы, называемые студнями. Студни не текучи, упруги, обладают пластичностью, определенной механической прочностью, способны сохранять свою форму.
Различная гидрофильность клейковинных белков — один из признаков, характеризующих качество зерна пшеницы и получаемой из него муки (так называемые сильные и слабые пшеницы). Гидрофильность белков зерна и муки играет важную роль при хранении и переработке зерна, в хлебопечении. Тесто, которое получают в хлебопекарном производстве, представляет собой набухший в воде белок, концентрированный студень, содержащий зерна крахмала.
Денатурация белков. При денатурации под влиянием внешних факторов (температуры, механического воздействия, действия химических агентов и ряда других факторов) происходит изменение вторичной, третичной и четвертичной структур белковой макромолекулы, т.е. ее нативной пространственной структуры. Первичная структура, а следовательно, и химический состав белка не меняются. Изменяются физические свойства: снижается растворимость, способность к гидратации, теряется биологическая активность. Меняется форма белковой макромолекулы, происходит агрегирование. В то же время увеличивается активность некоторых химических групп, облегчается воздействие на белки протеолитических ферментов, а следовательно, он легче гидролизуется.
В пищевой технологии особое практическое значение имеет тепловая денатурация белков, степень которой зависит от температуры, продолжительности нагрева и влажности. Это необходимо помнить при разработке режимов термообработки пищевого сырья, полуфабрикатов, а иногда и готовых продуктов. Особую роль процессы тепловой денатурации играют при бланшировании растительного сырья, сушке зерна, выпечке хлеба, получении макаронных изделий. Денатурация белков может вызываться и механическим воздействием (давлением, растиранием, встряхиванием, ультразвуком). Наконец, к денатурации белков приводит действие химических реагентов (кислот, щелочей, спирта, ацетона). Все эти приемы широко используются в пищевой и биотехнологии.
Пенообразование. Под процессом пенообразования понимают способность белков образовывать высококонцентрированные системы «жидкость — газ», называемые пенами. Устойчивость пены, в которой белок является пенообразователем, зависит не только от его природы и от концентрации, но и от температуры. Белки в качестве пенообразователей широко используются в кондитерской промышленности (пастила, зефир, суфле). Структуру пены имеет хлеб, а это влияет на его вкусовые качества.
Молекулы белков под влиянием ряда факторов могут разрушаться или вступать во взаимодействие с другими веществами с образованием новых продуктов. Для пищевой промышленности можно выделить два важных процесса: 1) гидролиз белков под действием ферментов; 2) взаимодействие аминогрупп белков или аминокислот с карбонильными группами восстанавливающих сахаров. Под влиянием протеаз-ферментов, катализирующих гидролитическое расщепление белков, последние распадаются на более простые продукты (поли- и дипептиды) и в итоге на аминокислоты. Скорость гидролиза белка зависит от его состава, молекулярной структуры, активности фермента и условий.
Гидролиз белков. Реакцию гидролиза с образованием аминокислот в общем виде можно записать так:
Горение. Белки горят с образованием азота, углекислого газа и воды, а также некоторых других веществ. Горение сопровождается характерным запахом жженых перьев.
Цветные реакции. Используют следующие реакции:
— ксантопротеиновую, при которой происходит взаимодействие ароматических и гетероатомных циклов в молекуле белка с концентрированной азотной кислотой, сопровождающееся появлением желтой окраски;
— биуретовую, при которой происходит взаимодействие слабощелочных растворов белков с раствором сульфата меди (II) с образованием комплексных соединений между ионами $Cu^{2+}$ и полипептидами. Реакция сопровождается появлением фиолетово-синей окраски.
Белки (син. протеины) — высокомолекулярные органические вещества, построенные из остатков аминокислот. По
своему биологическому значению принадлежат к числу важнейших составных частей организма.
Несомненно, белки абсолютно необходимы для жизни растений, животных и грибов. Именно вследствие такого
большого значения белки получили названия протеинов (греч. protos — первый, главный).

Качественной реакцией на белки служит ксантопротеиновая реакция. Ее проводят путем добавления к раствору белка HNO3(конц.) до
тех пор, пока не прекратится выпадение осадка. Осадок окрашивается в характерный желтый цвет.

Аминокислота
Аминокислота — органическая кислота, содержащая, по меньшей мере, одну карбоксильную группу (COOH) и одну аминогруппу (NH2).
Аминокислоты являются основной составляющей всех белков.
В построении белков участвуют 20 наиболее распространенных аминокислот. На данном этапе учить их наизусть не обязательно, эта
задача настигнет вас на кафедре биохимии 
И все же для успешного изучения данной темы мы возьмем за основу две аминокислоты: глицин и аланин.

Я хочу вас обрадовать (надеюсь, что обрадую)). Если вы успешно изучили темы: карбоновые кислоты, амины — то вы уже знаете химические
свойства аминокислот!
Они напоминают амфотерные соединения: по аминогруппе вступают в реакции с кислотами, по карбоксильной — с основаниями. Мы разберем их подробнее чуть
ниже.
Получение аминокислот
Аминокислоты можно получить в реакции аммиака с галогенкарбоновыми кислотами.

Химические свойства аминокислот
- Основные свойства
- Кислотные свойства
- Пептидные связи
За счет наличия аминогруппы, аминокислоты проявляют основные свойства. Реагируют с кислотами.

По карбоксильной группе аминокислоты способны вступать в реакции с металлами, основными оксидами, основаниями и солями более слабых кислот.

Аминокислоты способны вступать в реакцию этерификации, образуя сложные эфиры.

В молекуле белка аминокислоты связаны друг с другом пептидной связью. Она образуется между карбоксильной группой одной аминокислоты и
аминогруппой другой аминокислоты.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
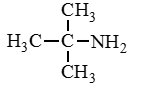
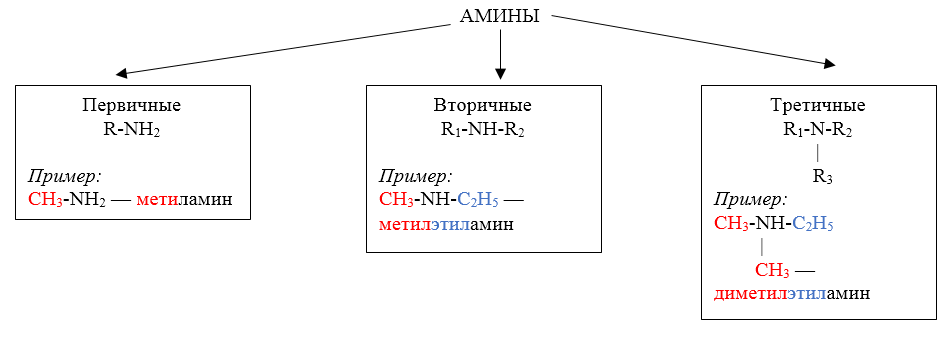
Амины — это производные аммиака (NH3), в молекуле которого один, два или три атома водорода замещены углеводородными радикалами.
Классификация аминов
Номенклатура первичных аминов
|
Радикально-функциональная |
Заместительная |
|
|
CH3-NH2 |
Метиламин |
Аминометан |
|
|
Изопропиламин |
2-аминопропан |
Изомерия
Рассмотрим все виды изомерии на примере C4H11N
|
Изомерия цепи |
Изомерия положения функциональной группы |
Изомерия между типами аминов |
|
|
CH3-CH2-CH2-CH2-NH2 |
|
|
|
|
|
Физические свойства:
Низшие предельные первичные амины — газообразные вещества, имеют запах аммиака, хорошо растворяются в воды. Амины с большей относительной молекулярной массой — жидкости или твердые вещества, растворимость из в воде с увеличением молекулярной массы уменьшается.
Химические свойства аминов
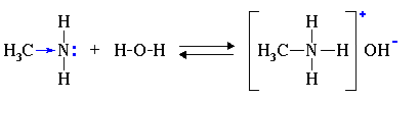
1. Водные растворы алифатических аминов проявляют щелочную реакцию, т.к. при их взаимодействии с водой образуются гидроксиды алкиламмония, аналогичные гидроксиду аммония:
Связь протона с амином, как и с аммиаком, образуется по донорно-акцепторному механизму за счет неподеленной электронной пары атома азота.
Алифатические амины — более сильные основания, чем аммиак, т.к. алкильные радикалы увеличивают электронную плотность на атоме азота за счет +I-эффекта. По этой причине электронная пара атома азота удерживается менее прочно и легче взаимодействует с протоном.
2. Взаимодействуя с кислотами, амины образуют соли:
При нагревании щелочи вытесняют из них амины:
[CH3NH3]+Cl— + NaOH = CH3NH2 + NaCl + H2O
Ароматические амины являются более слабыми основаниями, чем аммиак, поскольку неподеленная электронная пара атома азота смещается в сторону бензольного кольца, вступая в сопряжение с его p-электронами.
Окисление аминов
Амины, особенно ароматические, легко окисляются на воздухе. В отличие от аммиака, они способны воспламеняться от открытого пламени.
4СH3NH2 + 9O2 = 4CO2 + 10H2O + 2N2
Взаимодействие с азотистой кислотой
Азотистая кислота HNO2 — неустойчивое соединение. Поэтому она используется только в момент выделения. Образуется HNO2, как все слабые кислоты, действием на ее соль (нитрит) сильной кислотой:
KNO2 + HCl = НNO2 + KCl
Строение продуктов реакции с азотистой кислотой зависит от характера амина. Поэтому данная реакция используется для различения первичных, вторичных и третичных аминов.
-
Первичные алифатические амины c HNO2 образуют спирты:
R-NH2 + HNO2 = R-OH + N2 + H2O
-
Вторичные амины (алифатические и ароматические) под действием HNO2
превращаются в нитрозосоединения (вещества с характерным запахом).
Реакция с третичными аминами приводит к образованию неустойчивых солей и не имеет практического значения.
Анилин – простейший представитель первичных ароматических аминов.
Физические свойства:
Бесцветная масляниста жидкость с характерным запахом, малорастворим в воде, ядовит.
Применение анилина:
1. Взрывчатые вещества.
2. Пластмассы.
3. Фотореактивы.
4. Красители.
5. Лекарственные вещества.
Аминокислоты
Аминокислоты — это производные углеводородов, содержащие аминогруппы (-NH2) и карбоксильные группы (-COOH).
Общая формула: (NH2)mR(COOH)n, где m и n чаще всего равны 1 или 2.
Классификация аминокислот:
По числу функциональных групп:
1. моноаминомонокарбоновые кислоты;
2. диаминомонокарбоновые кислоты;
3. моноаминодикарбоновые кислоты.
По положению аминогрупп:
1. α — аминокислоты;
2. β — аминокислоты;
3. γ — аминокислоты.
Формулы и названия некоторых α — аминокислот, остатки которых входят в состав белков.
Аминокислоты организма:
1. Заменимые (Синтезируются в организме человек. К ним относятся глицин, аланин, глутаминовая кислота, серин, аспарагиновая кислота, тирозин, цистеин).
2. Незаменимые (Не синтезируются в организме человека, поступают с пищей. К ним относятся валин, лизин, фенилаланин).
Физические свойства аминокислот:
Аминокислоты — бесцветные кристаллические вещества, хорошо растворяются в воде, температура плавления 230-300. Многие α-аминокислоты имеют сладкий вкус.
Химические свойства аминокислот:
Аминокислоты амфотерные органические соединения, для них характерны кислотно-основные свойства.
I. Общие свойства
1. Внутримолекулярная нейтрализация
Водные растворы электропроводны. Эти свойства объясняются тем, что молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе:
Водные растворы аминокислот имеют нейтральную, кислую или щелочную среду в зависимости от количества функциональных групп.
2. Поликонденсация → образуются полипептиды (белки):
II. Свойства карбоксильной группы (кислотность)
1. С основаниями → образуются соли:
NH2-CH2-COOH + NaOH → NH2-CH2-COONa + H2O
NH2-CH2-COONa -натриевая соль 2-аминоуксусной кислоты
2. Со спиртами → образуются сложные эфиры – летучие вещества (р. этерификации):
NH2-CH2-COOH + CH3OH → NH2-CH2-COOCH3 + H2O
NH2-CH2-COOCH3 — метиловый эфир 2- аминоуксусной кислоты
3. С аммиаком → образуются амиды:
NH2-CH(R)-COOH + H-NH2 → NH2-CH(R)-CONH2 + H2O
III. Свойства аминогруппы (основность)
1. С сильными кислотами → соли:
HOOC-CH2-NH2 + HCl → [HOOC-CH2-NH3]+Cl—
или HOOC — CH2 — NH2* HCl
2. С азотистой кислотой (подобно первичным аминам):
NH2-CH(R)-COOH + HNO2 → HO-CH(R)-COOH + N2↑+ H2O
гидроксокислота