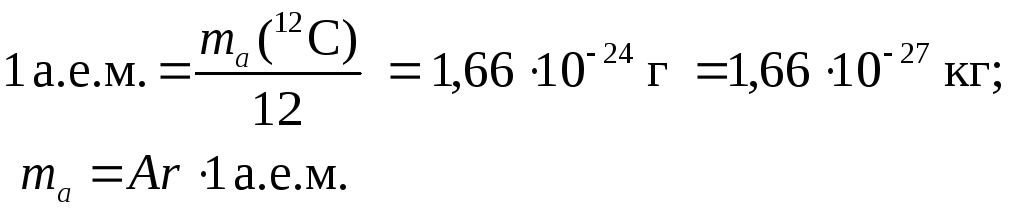Формулы для решения задач
Дата публикации: Nov 12, 2016 5:18:21 PM
Основные формулы для решения задач по химии
Основные формулы для решения задач по химии
Все, все основные задачи по химии решаются с помощью нескольких основных понятий и формул.
Моль (количество моль)
обозначение: моль, международное: mol — единица измерения количества вещества. Соответствует количеству вещества, в котором содержится NA частиц (молекул, атомов, ионов)Поэтому была введена универсальная величина —количество моль. Часто встречающаяся фраза в задачах — «было получено… моль вещества»
NA = 6,02 · 1023
NA — число Авогадро. Тоже «число по договоренности». Сколько атомов содержится в стержне кончика карандаша? Порядка тысячи. Оперировать такими величинами не удобно. Поэтому химики и физики всего мира договорились — обозначим 6,02 · 1023 частиц (атомов, молекул, ионов) как 1 моль вещества.
1 моль = 6,02 · 1023 частиц
Это была первая из основных формул для решения задач.
Молярная масса вещества
Молярная масса вещества — это масса одного моль вещества.
Обозначается как Mr. Находится по таблице Менделеева — это просто сумма атомных масс вещества.
Например, нам дана серная кислота — H2SO4. Давайте посчитаем молярную массу вещества: атомная масса H =1, S-32, O-16. Mr(H2SO4)=1•2+32+16•4=98 гмоль.
Вторая необходимая формула для решения задач —
формула массы вещества:
Т.е., чтобы найти массу вещества, необходимо знать количество моль (n), а молярную массу мы находим из Периодической системы.
Закон сохранения массы — масса веществ, вступивших в химическую реакцию, всегда равна массе образовавшихся веществ.
Если мы знаем массу (массы) веществ, вступивших в реакцию, мы можем найти массу (массы) продуктов этой реакции. И наоборот.
Третья формула для решения задач по химии —
объем вещества:
Откуда взялось число 22.4? Из закона Авогадро:
в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (н.у.) имеет один и тот же объём Vm = 22,413 996(39) л
Т.е., если в задаче нам даны нормальные условия, то, зная количество моль (n), мы можем найти объем вещества.
Итак, основные формулы для решения задач по химии
Число Авогадро NA
6,02 · 1023 частиц
Количество вещества n (моль)
n=mMr
n=V22.4 (лмоль)
Масса веществаm (г)
m=n•Mr
Объем вещества V(л)
V=n•22.4 (лмоль)
Основные формулы для решения задач по химии
05-Авг-2012 | комментариев 450 | Лолита Окольнова
Все, все основные задачи по химии решаются с помощью
нескольких основных понятий и формул.
У всех веществ разная масса, плотность и объем. Кусочек металла одного элемента может весить во много раз больше, чем точно такого же размера кусочек другого металла.
Моль (количество моль)
обозначение: моль, международное: mol — единица измерения количества вещества. Соответствует количеству вещества, в котором содержится NA частиц (молекул, атомов, ионов). Поэтому была введена универсальная величина — количество моль. Часто встречающаяся фраза в задачах — «было получено… моль вещества»
NA = 6,02 · 1023
NA — число Авогадро. Тоже «число по договоренности». Сколько атомов содержится в стержне кончика карандаша? Несколько миллионов. Оперировать такими величинами не удобно. Поэтому химики и физики всего мира договорились — обозначим 6,02 · 1023 частиц (атомов, молекул, ионов) как 1 моль вещества.
1 моль = 6,02 · 1023 частиц
Это была первая из основных формул для решения задач.
Молярная масса вещества
Молярная масса вещества — это масса одного моль вещества. Обозначается как M
Есть еще молекулярная масса — Mr
Находится по таблице Менделеева — это просто сумма атомных масс вещества.
Например, нам дана серная кислота — H2SO4. Давайте посчитаем молярную массу вещества: атомная масса H =1, S-32, O-16.
Mr(H2SO4)=1•2+32+16•4=98 гмоль.
Вторая необходимая формула для решения задач —
формула массы вещества:
Т.е., чтобы найти массу вещества, необходимо знать количество моль (n), а молярную массу мы находим из Периодической системы.
Закон сохранения массы — масса веществ, вступивших в химическую реакцию, всегда равна массе образовавшихся веществ.
Если мы знаем массу (массы) веществ, вступивших в реакцию, мы можем найти массу (массы) продуктов этой реакции. И наоборот.
Третья формула для решения задач по химии —
объем вещества:
Откуда взялось число 22.4? Из закона Авогадро:
в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (н.у.) имеет один и тот же объём Vm = 22,413 996(39) л
Т.е., если в задаче нам даны нормальные условия, то, зная количество моль (n), мы можем найти объем вещества.
Итак, основные формулы для решения задач по химии
Число Авогадро NA
6,02 · 1023 частиц
Количество вещества n (моль)
n=mM
n=V22.4 (лмоль)
Масса вещества m (г)
m=n•Mr
Объем вещества V(л)
V=n•22.4 (лмоль)
или вот еще удобная табличка:
Это формулы. Часто для решения задач нужно сначала написать уравнение реакции и (обязательно!) расставить коэффициенты — их соотношение определяет соотношение молей в процессе.
В ОГЭ и ЕГЭ по химии задач , в которых нужно было бы найти только объем массу кол-во моль нет — это обычно ЧАСТЬ решения задачи. Однако, чтобы легко решать более сложные задачи, нужно тренироваться на таких вот небольших упражнениях.
Находим количество вещества по массе
1 Какое количество вещества алюминия содержится в образце металла массой 10.8 г?2 Какое количество вещества содержится в оксиде серы (VI) массой 12 г?
3 Определите количество моль брома, содержащееся в массе 12.8 г.
Находим массу по количеству вещества:
4. Определите массу карбоната натрия количеством вещества 0.25 моль.Объем по количеству вещества:
5. Какой объем будет иметь азот при н.у., если его количество вещества 1.34 моль?6. Какой объем занимают при н.у. 2 моль любого газа?
Ответы:/p>
- 0.4 моль
- 0.15 моль
- 0.08 моль
- 26.5 г
- 30 л
- 44.8 л
Категории:
|
Обсуждение: «Основные формулы для решения задач по химии»
(Правила комментирования)
Химия
В помощь сдающим ОГЭ
методическое пособие по химии
для учащихся 9-х классов,
Тема №1: «Строение атомов первых 20 химических элементов
ПСХЭ Д. И. Менделеева».
Обязательный минимум знаний.
Строение атома: ядро (протоны и нейтроны) + электроны.
Число протонов (p+) – равно порядковому номеру химического элемента (Z).
Число нейтронов (n0) – равно A-Z, где А – массовое число.
Число электронов (е—) — равно порядковому номеру химического элемента (Z).
Заряд ядра = число протонов = число электронов (+Z = p+ = е—).
Номер периода показывает – число электронных слоев в электронной оболочке атома.
Номер группы показывает – число электронов на внешнем электронном слое атома + число валентных электронов.
Валентные электроны – электроны, участвующие в образовании химической связи.
Распределение электронов по энергетическим уровням: на 1-м максимум 2 электрона, на 2-м – 8 электронов, на 3-м – 18 электронов (если уровень последний – то число электронов на нём равно номеру группы или высчитывается как разница общего числа электронов и электронов на предыдущих уровнях). Если последний (внешний) уровень атома имеет максимальное число электронов, то такой электронный слой называется завершенным (его имеют атомы благородных газов – элементы 8 группы).
Тема №2: «Периодический закон и ПСХЭ Д. И. Менделеева».
Обязательный минимум знаний.
Закономерности изменения свойств элементов и их соединений.
В периоде слева направо:
-
Радиус атома уменьшается;
-
Металлические свойства ослабевают;
-
Неметаллические свойства возрастают;
-
Восстановительные свойства ослабевают;
-
Окислительные свойства возрастают;
-
Электроотрицательность возрастает;
-
Число валентных электронов возрастает;
-
Основные оксиды через амфотерные сменяются кислотными.
В группе сверху вниз:
-
Радиус атома возрастает;
-
Металлические свойства возрастают;
-
Неметаллические свойства ослабевают;
-
Восстановительные свойства возрастают;
-
Окислительные свойства ослабевают;
-
Электроотрицательность уменьшается;
-
Число валентных электронов постоянно и равно номеру группы.
Тема №3: «Химическая связь».
Обязательный минимум знаний.
Типы химических связей:
-
Ковалентная полярная химическая связь (образуется между атомами неметаллов с разным значением электроотрицательности или между атомами металла и неметалла с небольшой разностью в значении электроотрицательности). Например: H2S, NH3.
-
Ковалентная неполярная химическая связь (образуется между атомами неметаллов с одинаковым значением электроотрицательности). Например: H2, O2, P4, S8.
-
Ионная химическая связь (образуется между атомами неметалла и металла). Например: NaCl, CaO, K2S.
-
Металлическая химическая связь – характерна для металлов и сплавов. Например: Al, Cu, бронза, чугун, латунь.
Тема №4: «Степень окисления химических элементов».
Обязательный минимум знаний.
Правила расчета степени окисления:
-
С.о. водорода = +1 в соединениях с неметаллами и = -1 в соединениях с металлами (гидриды металлов);
-
С.о. кислорода = -2, кроме пероксидов (-1) и фторидов (+2);
-
С.о. металла = заряду его иона (в таблице растворимости);
-
С.о. простого вещества = 0;
-
Сумма с.о. всех элементов в сложном веществе = 0;
-
С.о. иона = заряду иона (в таблице растворимости).
Алгоритм определения степени окисления элементов в бинарных соединениях:
-
Выбрать более электроотрицательный элемент и найти его степень окисления, как № группы – 8. Написать над ним степень окисления.
-
Умножить степень окисления на индекс у этого элемента. Полученное число со знаком «минус» подписать под другим элементом.
-
Такое же число со знаком «плюс» подписать под другим элементом.
-
Разделить это число на индекс другого элемента. Полученную степень окисления написать над элементом.
Алгоритм определения степени окисления неметалла в кислотах и солях:
-
Отделить кислород вертикальной чертой, записать сверху его степень окисления – 2 и умножить на индекс. Полученное число написать под кислородом.
-
Такое же число с противоположным знаком записать под левой частью формулы.
-
Вычесть из него число атомов водорода (для кислот) или заряд металла*индекс металла (для солей). Полученное число написать над знаком центрального элемента.
Тема №5: «Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура органических соединений».
Обязательный минимум знаний.
Классификация веществ
Металлы Неметаллы Оксиды Основания Кислоты Соли
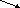
Оксиды – бинарные соединения кислорода, в котором он проявляет степень окисления –2 (CaO, Al2O3).
Классификация оксидов.
Оксиды
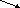
несолеобразующие солеобразующие
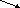
основные амфотерные кислотные
Несолеобразующие оксиды – не взаимодействуют с кислотами и щелочами и, как следствие, не образуют солей. Основные оксиды – образованы металлом в с.о.+1 и +2 (Na2O, MgO). Амфотерные оксиды – образованы металлами в с.о. +3 и +4 (Al2O3, PbO2). Исключения: ZnO, PbO, SnO, BeO (у них с.о. металла равна +2). Кислотные оксиды – образованы металлом в с.о.+5,+6,+7 или неметаллов, исключая несолеобразующие (SO3, CO2).
Основания – сложные соединения, в составе которых катион металла соединен с гидроксид-анионами: Me(OH)n. Например: NaOH, Ca(OH)2. Основания могут быть растворимыми и нерастворимыми. Растворимые в воде основания – щелочи (они окрашивают индикаторы).
Кислоты – сложные соединения, в составе которых атом водорода соединен с кислотным остатком (HCl, H2SO4). Кислотный остаток может состоять из одного элемента (Cl—) и быть сложным (SO4—).
Соли – сложные вещества, в составе которых катион металла соединен с кислотным остатком (NaCl, CaSO4).
Формулы и названия кислот и солей.
|
Формула кислоты |
Название кислоты |
Название соли |
Пример соли |
|
HF |
Фтороводородная (плавиковая) |
Фторид |
FeF3, фторид железа (III) |
|
HCl |
Хлороводородная (соляная) |
Хлорид |
CuCl2, хлорид меди (II) |
|
HBr |
Бромоводородная |
Бромид |
MgBr2, бромид магния |
|
HI |
Йодоводородная |
Йодид |
NaI, йодид натрия |
|
H2S |
Сероводородная |
Сульфид |
FeS, сульфид железа (II) |
|
H2SO3 |
Сернистая |
Сульфит |
Na2SO3, сульфит натрия |
|
H2SO4 |
Серная |
Сульфат |
BaSO4, сульфат бария |
|
HNO2 |
Азотистая |
Нитрит |
KNO2, нитрит калия |
|
HNO3 |
Азотная |
Нитрат |
Cu(NO3)2, нитрат меди (II) |
|
H2CO3 |
Угольная |
Карбонат |
CaCO3, карбонат кальция |
|
H2SiO3 |
Кремниевая |
Силикат |
Na2SiO3, силикат натрия |
|
H3PO4 |
Фосфорная |
Фосфат |
Ca3(PO4)2, фосфат кальция |
Тема №6: «Условия и признаки протекания химических реакций. Химические уравнения».
Обязательный минимум знаний.
Физические явления – явления, при которых состав вещества остается постоянным, а изменяется лишь его агрегатное состояние или форма и размеры тел. Примеры: плавление парафина, таяние льда, испарение воды.
Химические явления (химические реакции)– явления, при которых одни химические вещества превращаются в другие. Примеры: горение древесины, ржавление металлов, скисание молока.
Химическое уравнение – это условная запись химической реакции с помощью химических формул и коэффициентов.
Признаки химических реакций:
-
Изменение цвета;
-
Выделение тепла и света;
-
Выделение газа;
-
Растворение осадка;
-
Изменение запаха;
-
Выпадение осадка.
.
Тема №7: «Классификация химических реакций».
Обязательный минимум знаний.
Типы химических реакций по числу и составу исходных и полученных веществ:
-
Реакция разложения – это реакции, при которых из одного вещества образуется несколько других. Например: Cu(OH)2 → CuO + H2O
-
Реакция соединения – это реакции, при которых из нескольких веществ образуется одно. Например: S + O2 → SO2
-
Реакция обмена – это реакции, при которых два сложных вещества обмениваются своими составными частями. Например:
CuSO4 + BaCl2 → BaSO4 + CuCl2
-
Реакция замещения – это реакция между простым и сложным веществом, при которой атомы простого вещества, замещают атомы одного из элементов в сложном веществе. Например:
Zn + 2HCl → ZnCl2 + H2
Типы химических реакций по тепловому эффекту:
-
Экзотермические – протекают с выделением теплоты;
-
Эндотермические – протекают с поглощением теплоты.
По изменению степени окисления исходных веществ и продуктов реакции:
-
Окислительно-восстановительные реакции (ОВР) – реакции, протекающие с изменением степени окисления;
-
Не окислительно-восстановительные реакции – реакции, протекающие без изменением степени окисления;
По участию катализатора:
-
Каталитические – протекают с участием катализатора;
-
Некаталитические – протекают без участия катализатора.
По обратимости:
-
Обратимые – протекают в двух противоположных направлениях;
NaCl + HNO3 ↔ HCl +NaNO3
-
Необратимые – протекают только в одном направлении.
NaCl + AgNO3 → AgCl↓ + NaNO3
Тема №8: «Электролиты и неэлектролиты. Катионы и анионы».
Обязательный минимум знаний.
Электролиты – вещества, растворы которых проводят электрический ток. К электролитам относятся – растворимые кислоты, щелочи, соли.
Неэлектролиты – вещества, растворы которых не проводят электрический ток. К неэлектролитам относятся – нерастворимые кислоты, основания, соли; оксиды; органические вещества: раствор сахарозы, метанол, этанол, глюкоза.
Дополнительная информация: Габриелян О. С., Химия 8 кл., 2008г., § 35.
Тема №9: «Электролитическая диссоциация кислот, щелочей и солей».
Обязательный минимум знаний.
Положения ТЭД:
-
При растворении в воде электролиты диссоциируют на положительные ионы (катионы) и отрицательные ионы (анионы).
-
Под действие электрического тока катионы движутся к катоду (-), анионы – к аноду (+).
-
Диссоциация – обратимый процесс.
-
Не все электролиты диссоциируют в равной мере.
-
Химические свойства электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
Кислоты – электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. Например: HCl → H+ + Cl—
Основания – электролиты, которые при диссоциации образуют катионы металла и гидроксид-анионы. Например: NaOH → Na+ + OH—
Соли — электролиты, которые при диссоциации образуют катионы металла и анионы кислотного остатка. Например: NaCl → Na+ + Cl—
Это важно! При диссоциации индексы выносятся вперед ионов. Например: Al2(SO4)3 → 2Al3+ + 3SO42-
Тема №10: «Реакции ионного обмена и условия их осуществления».
Обязательный минимум знаний.
Взаимодействие кислот, оснований и солей

1р р
р
Алгоритм составления реакций ионного обмена:
-
Записать исходные вещества. Подписать классы веществ.
-
Проверить, являются ли они электролитами (по таблице растворимости). По схеме определить, возможна ли такая реакция.
-
Если возможно, над ионами в исходных веществах проставить заряды (по таблице растворимости).
-
Поменять правые части формул местами и записать, таким образом продукты реакции.
-
Правильно составить формулы продуктов. Для этого поставить заряды ионов, снести их крест-накрест и сократить, если нужно.
-
Расставить коэффициенты в уравнении
-
Под формулами продуктов реакции подписать, являются ли они электролитами или неэлектролитами.
-
Записать электролиты в виде ионов с учетом индексов и коэффициентов; неэлектролиты оставить в молекулярном виде.
-
В левой и правой части сократить одинаковые частицы.
-
Записать оставшиеся после сокращения ионы и молекулы.
Условия протекания реакций ионного обмена до конца (необратимо):
-
Образуется осадок.
-
Образуется газ.
-
Образуется малодиссоциируемое вещество, например вода.
Тема №11: «Химические свойства простых веществ: металлов и неметаллов».
Обязательный минимум знаний.
+ неметалл → соль или оксид (1)
+ Н2О → Ме(ОН)n+H2 (если Ме от Li-Al) (2)
+ Н2О → Ме2Оn+H2 (если Ме от Mn-Cd) (3)
Металл + кислота → соль (растворимая) + Н2 (Ме левее Н) (4)
+ соль → соль’ (растворимая)+ Ме (5)
+ Ме2Оn → Ме’ + Ме2Om (6)
-
. Образуется бинарное соединение. Металл пишется слева, неметалл справа. У металла с.о. равна +№ группы (есть исключения), у неметалла с.о. равна № группы — 8.Например: 2Са + О2 → 2Са+2О-2.
-
. Металлы от лития до натрия реагируют с водой при комнатной температуре, остальные – при нагревании. 2Na + 2H2O → 2NaOH + H2.
-
. Данная реакция протекает при нагревании. Zn + H2O → ZnO + H2.
-
.Данная реакция характерна только для разбавленных кислот. Металлы, стоящие в ряду напряжений после водорода, с разбавленными кислотами не взаимодействуют. Ещё одно условие данной реакции: в результате неё должна быть образована растворимая соль. Mg + 2HCl → MgCl2 + H2. Это важно!: азотная кислота по особому взаимодейстует с металлами (см. А.14).
-
. Zn + CuCl2 → ZnCl2 +Cu.
-
. 2Al + Cr2O3 → Al2O3 + 2Cr
Это важно! Особенности химических свойств некоторых металлов:
1. Особенности щелочных металлов (Li, Na, K):
-
При взаимодействии с кислородом литий образует оксид Li2O, натрий образует пероксид Na2O2: 2Na + O2 → Na2O2.
-
С растворами кислот и солей не взаимодействуют, т.к. в первую очередь будут вступать в реакцию с водой.
2. Особенности алюминия:
-
При обычных условиях малоактивен, т.к. покрыт прочной оксидной пленкой Al2O3 (большинство реакций идут при нагревании);
-
Является амфотерным металлом, поэтому взаимодействует не только с растворами кислот, но и с щелочами, образуя соль — алюминат:
2Al+2NaOH+2H2O→2NaAlO2+3H2↑
-
На холоду не взаимодействует с концентрированными серной и азотной кислотами (пассивируется).
3. Особенности железа:
-
Для железа характерно образование двух соединений: Fe2+ и Fe3+;
-
Образование соединений железа:
|
+2 |
+3 |
|
1). С неметаллами |
|
|
Fe + S → FeS |
2Fe + 3Cl2 → 2FeCl3 |
|
3Fe + 2O2 → Fe3O4 |
|
|
2). C водой: |
|
|
3Fe + 4H2O → Fe3O4 + 4H2↑ |
|
|
3). С кислотами |
|
|
Fe + 2HCl → FeCl2 + H2↑ |
|
|
4). С солями: |
|
|
Fe + СuSO4 → FeSO4 + Cu |
Тема №12: «Химические свойства оксидов: основных, амфотерных, кислотных».
Обязательный минимум знаний.





Это важно! Амфотерные оксиды будут сочетать свойства основных и кислотных оксидов, т.е. будут вступать в реакции с щелочами и кислотами.
Дополнительная информация: Габриелян О. С., Химия 8 кл., 2008г., § 40.
Тема №13: «Химические свойства оснований».
Обязательный минимум знаний.
+ кислотный оксид → соль + H2O
Щелочи + кислота → соль + H2O
Основания + соль → соль + основание (↑,↓)
Нерастворимые + кислота → соль + H2O
нагревание → МеО + H2O
Тема №14: «Химические свойства кислот».
Обязательный минимум знаний.
+ Ме (до Н) → соль + Н2
+ основный/амфотерный оксид → соль + Н2О
Кислота + основание/амфотерный гидроксид → соль + Н2О
+ соль → соль + кислота (↓,↑)
!Особенности взаимодействия азотной кислоты с металлами:
-
Водород никогда не выделяется;
-
Металл в полученном нитрате имеет максимальную степень окисления;
-
На холоду не взаимодействует с: Al, Fe, Cr, Co, Ni.
-
Продукты реакции зависят от двух факторов:
-
Активность металла;
-
Концентрация кислоты.
HNO3 (к) + Ме (I, II группа, гл.подгр.) → нитрат + N2O + H2O
HNO3 (к) + Ме (остальные) → нитрат + NO2 +H2O
HNO3 (р) + Ме (I, II группа, гл.подгр.) → нитрат + NH3 (или NH4NO3) + H2O
HNO3 (р) + Ме (остальные) → нитрат + NO + H2O
Например:
Дополнительная информация: Габриелян О. С., Химия 8 кл., 2008г., § 38.
Ag + 2HNO3 (к) → AgNO3 + NO2 + H2O.
!Особенности химических свойств концентрированной серной кислоты:
-
С металлами:
-
Может взаимодействовать с металлами, стоящими в ряду напряжений после водорода;
-
Металл в полученном сульфате имеет максимальную с.о.
-
Водород никогда не выделяется;
-
На холоду не взаимодействует с: Al, Fe, Cr, Co, Ni.
H2SO4 (к) + Me (I, II группа, гл.подгр, Zn) → сульфат + H2S/S/SO2 +H2O
H2SO4 (к) + Me (остальные) → сульфат + SO2 + H2O.
-
С неметаллами:
2H2SO4 (к) + C → CO2 + 2SO2 + 2H2O
2H2SO4 (к) + S → 3SO2 + 2H2O
-
С органическими веществами: обугливает бумагу, ткань, древесину, сахарозу.
Тема №15: «Химические свойства солей».
Обязательный минимум знаний.
+ кислота → соль + кислота’
Соли + щелочь → соль + основание’ (↑,↓).
+ соль → соль + соль’
Дополнительная информация: Габриелян О. С., Химия 8 кл., 2008г., § 41.
Тема №16: «Первоначальные представления об органических веществах».
Обязательный минимум знаний.
Общие признаки органических веществ:
-
Наличие углерода;
-
Наличие в молекулах только ковалентных связей;
-
Валентность углерода всегда равна четырем.
Основные классы органических веществ.
-
Предельные углеводороды (алканы). Общая формула CnH2n+2. Важнейшие представители алканов:
|
Формула |
Название |
|
CH4 |
Метан |
|
C2H6 |
Этан |
|
C3H8 |
Пропан |
|
C4H10 |
Бутан |
|
C5H12 |
Пентан |
Характерные реакции: замещение и окисление.
-
Непредельные углеводороды (алкены). Общая формула CnH2n. Важнейшие представители:
|
Формула |
Название |
|
C2H4 |
Этен (этилен) |
|
C3H6 |
Пропен (пропилен) |
|
C4H8 |
Бутен |
|
C5H10 |
Пентен |
Особенность строения: наличие двойной С-С связи. Характерные реакции: присоединения и окисления.
-
Непредельные углеводороды (алкины). Общая формула CnH2n-2. Важнейшие представители:
|
Формула |
Название |
|
C2H2 |
Этин (ацетилен) |
|
C3H4 |
Пропин |
|
C4H6 |
Бутин |
|
C5H8 |
Пентин |
Особенность строения: наличие тройной С-С связи. Характерные реакции: присоединения и окисления.
-
Спирты. Общая формула CnH2n+1ОН. Важнейшие представители:
|
Формула |
Название |
|
CH3ОН |
Метанол (метиловый спирт) |
|
C2H5ОН |
Этанол (этиловый спирт) |
|
C3H5(ОН)3 |
Глицерин |
-
Карбоновые кислоты. Общая формула CnH2n+1СООН. Важнейшие представители:
|
Формула |
Название |
|
НСООН |
Муравьиная кислота |
|
CH3СООН |
Уксусная кислота |
|
C17H35СООН |
Стеариновая кислота |
Характерны все свойства кислот (взаимодействие с металлами, оксидами металлов, основаниями, солями).
Тема №17: «Чистые вещества и смеси. Правила безопасной работы в школьной лаборатории. Разделение смесей и очистка веществ».
Обязательный минимум знаний.
Химические формулы соответствуют чистым веществам. Все изучаемы в школьном курсе способы разделения смесей относятся к физическим.
Смесь – многокомпонентная система (воздух, нефть, морская вода, стекло, бронза, молоко, лимонад).
Смеси бывают однородными (нельзя увидеть границу раздела между веществами): раствор сахара в воде и неоднородными (видна граница раздела между веществами): взвесь мела в воде.
Способы разделения неоднородных смесей:
-
Отстаивание (этим же методом можно разделить две несмешивающиеся жидкости с помощью делительной воронки). Ускоряют отстаивание центрифугированием;
-
Фильтрование;
-
Некоторые твердые смеси можно разделить при помощи магнита (смесь железных и медных опилок, смесь железных опилок и серы).
Способы разделения однородных смесей:
-
Выпаривание;
-
Перегонка (дистилляция).
Некоторые правила безопасной работы в химической лаборатории:
-
При растворении серной кислоты нужно вливать её тонкой струей в воду и перемешивать;
-
При работе с растворами едких веществ необходимо надевать защитные перчатки и очки;
-
Воспламенившиеся ЛВЖ (нефть, спирт, ацетон) необходимо тушить песком;
-
Опыты с получением токсичных газообразных веществ (SO2, H2S, NO2) необходимо проводить в вытяжном шкафу.
Дополнительная информация: Габриелян О. С., Химия 8 кл., 2008 г., § 23.
Тема №18: «Определение характера среды раствора кислот и щелочей с помощью индикаторов. Качественные реакции на ионы в растворе и на газообразные вещества».
Обязательный минимум знаний.
Индикаторы
|
Кислая |
Нейтральная |
Щелочная |
|
|
Фенолфталеин |
бесцветный |
бесцветный |
малиновый |
|
Лакмус |
красный |
фиолетовый |
синий |
|
Метилоранж |
розовый |
оранжевый |
желтый |
Качественные реакции
|
Хлорид-ион Cl— |
+ Ag+ → AgCl↓ белый творожистый осадок |
|
Сульфат-ион SO42- |
+ Ba2+ → BaSO4↓ белый осадок |
|
Карбонат-ион CO32- |
+ H+ → CO2↑+H2O выделение газа + Ca2+ → CaCO3↓ белый осадок |
|
Ион аммония NH4+ |
+ OH— → NH4OH при нагревании запах аммиака |
|
Кислород O2 |
Загорание тлеющей лучины |
|
Водород H2 |
Хлопок при поднесении горящей лучины |
|
Углекислый газ CO2 |
Горящая лучина гаснет |
|
Аммиак NH3 |
По запаху; посинение влажной лакмусовой бумаги; появление белого дыма при внесении палочки, смоченной соляной кислотой («дым без огня»). |
Тема №19: «Вычисление массовой доли химического элемента в веществе».
Обязательный минимум знаний.
Вычисления производятся по следующей формуле:
ω = Ar∙n/Mr ∙ 100%, где Ar – атомная масса химического элемента; n – число атомов того элемента, массовая доля которого находится; Mr – молярная масса молекулы. Например: вычислите массовую долю кислорода в карбиде натрия. Решение:
1. Составляем формулу карбида натрия: Na4C.
2. Ar(Na)=23 г/моль; n(Na)=4; Mr(Na4C)=104г/моль.
3. Подставляем в формулу и вычисляем: ω(Na)=23∙4/104 ∙100% = 88,5%
4. Ответ: 88,5%.
Задания части В.
Тема №1: «Периодический закон Д. И. Менделеева».
Обязательный минимум знаний.
См. тема №2 части А.
Тема №2: «Химические свойства простых веществ и оксидов».
Обязательный минимум знаний.
Химические свойства неметаллов.
|
Как окислитель |
Как восстановитель |
|
|
H2 |
Щелочные металлы |
НеМе и МеО |
|
O2 |
Ме, неМе (большинство), неМеО (в которых степень окисления неМе не max) |
F2 |
|
Галогены (F2, Cl2, Br2) |
Ме, H2 |
— |
|
S |
Ме, H2 |
O2, галогены, H2SO4 (к), HNO3(к) |
|
N2 |
Ме (в обычных условиях только с литией, с остальными – при нагревании), H2(при нагревании и давлении) |
O2 (при температуре электрической дуги), галогены. |
|
P |
Ме, H2 |
O2, галогены, HNO3(к) |
|
C |
Ме, H2 |
O2, галогены, МеО, H2SO4(к), HNO3(к) |
|
Si |
Ме, H2 |
O2, галогены, щелочи |
+ см. тема № 12 части А.
Тема №3: «Окислительно-восстановительные реакции».
Обязательный минимум знаний.
Окислительно-восстановительные реакции (ОВР) – реакции, в ходе которых атомы меняют степени окисления.
Восстановитель – элемент, отдающий электроны (в ОВР его степень окисления повышается). Им может быть атом, ион, имеющий минимальную или промежуточную степень окисления. Например: Zn0 – 2e— = Zn+2.
Окислитель – элемент, принимающий электроны (в ОВР его степень окисления понижается). Им может быть атом, ион, максимальную или промежуточную степень окисления. Например: S0 + 4e— = S+4.
Атом или ион, имеющий промежуточную степень окисления, может проявлять как восстановительные, так и окислительные свойства, т.е. проявлять окислительно-восстановительную двойственность. Для элементов главных подгрупп максимальная степень окисления = +№ группы; минимальная № группы – 8.
Восстановление – процесс принятия электронов.
Окисление – процесс отдачи электронов.
+ см. тема №4 части А.
Тема №4: «Химические свойства кислот, оснований и солей».
Обязательный минимум знаний.
см. тема №13, 14, 15 части А.
Задания части С.
Тема №1: «Взаимосвязь различных классов неорганических веществ».
Обязательный минимум знаний.
Схема генетической связи веществ.
+O2 +H2O
металл основной оксид основание соль
неметалл кислотный оксид кислота соль
+O2 +H2O
Дополнительная информация: Габриэлян О. С., Химия 8 кл., 2008г., § 42.
Тема №2: «Вычисление массовой доли растворенного вещества в растворе».
Обязательный минимум знаний.
Алгоритм решения расчетных задач на нахождение массы выпавшего осадка по уравнению реакции:
-
Составить уравнение реакции, уравнять его.
-
По таблице растворимости определить в правой части реакции осадок, обозначить его ↓.
-
Рассчитать массу вещества в растворе по формуле:
m(вещества) = m(раствора)∙ω.
-
Рассчитать количество вещества по формуле: n = m/M.
-
По уравнению реакции определить количество вещества того вещества, которое выпало в осадок.
-
Рассчитать массу осадка по формуле: m = M·n.
Пример. К 80 г раствора с массовой долей гидроксида натрия 5% добавили избыток раствора сульфата меди (II). Определите массу выпавшего осадка.
Решение.
-
Составляем уравнение реакции: NaOH + CuSO4 → Na2SO4 + Cu(OH)2.
-
По таблице растворимости определяем, что в осадок выпадает гидроксид меди(II), тогда уравнение реакции принимает вид: NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓.
-
Рассчитаем массу NaOH по формуле m(вещества) = m(раствора)∙ω:
m(NaOH)=80г · 0,05= 4г.
-
Рассчитаем количество вещества NaOH по формуле m = M·n:
n(NaOH)= 4г/40г/моль=0,1моль.
-
По уравнению реакции определяем (по коэффициентам перед веществами), что n(Cu(OH)2)=1/2n(NaOH)→n(Cu(OH)2)=0,05моль.
-
Рассчитаем массу Cu(OH)2 (осадок) по формуле m = M·n:
m(Cu(OH)2)= 98г/моль∙0,05моль = 4,9г.
Ответ: 4,9 г.
Необходимые формулы:
-
m = M·n; n = m/M.
-
m(в-ва)=m(р-ра)·ω; m(р-ра)=m(в-ва)/ω.
-
V=Vm·n; n=V/Vm.
I. Общая химия
1. Основные понятия химии
Химия — наука о составе, строении, свойствах и превращениях веществ.
Атомно-молекулярное учение. Вещества состоят из химических частиц (молекул, атомов, ионов), которые имеют сложное строение и состоят из элементарных частиц (протонов, нейтронов, электронов).
Атом — нейтральная частица, состоящая из положительного ядра и электронов.
Молекула — устойчивая группа атомов, связанных химическими связями.
Химический элемент — вид атомов с одинаковым зарядом ядра. Элемент обозначают
где X — символ элемента, Z — порядковый номер элемента в Периодической системе элементов Д.И. Менделеева, A — массовое число. Порядковый номер Z равен заряду ядра атома, числу протонов в ядре атома и числу электронов в атоме. Массовое число A равно сумме чисел протонов и нейтронов в атоме. Число нейтронов равно разности A — Z.
Изотопы — атомы одного элемента, имеющие разные массовые числа.
Относительная атомная масса (Ar) — отношение средней массы атома элемента естественного изотопического состава к 1/12 массы атома изотопа углерода 12С.
Относительная молекулярная масса (Mr) — отношение средней массы молекулы вещества естественного изотопического состава к 1/12 части массы атома изотопа углерода 12С.
Атомная единица массы (а.е.м) — 1/12 часть массы атома изотопа углерода 12С. 1 а.е. м = 1,66 × 10-24 г.
Моль — количество вещества, содержащее столько структурных единиц (атомов, молекул, ионов), сколько содержится атомов в 0,012 кг изотопа углерода 12С. Моль — количество вещества, содержащее 6,02 • 1023 структурных единиц (атомов, молекул, ионов).
n = N/NA, где n — количество вещества (моль), N — число частиц, a NA — постоянная Авогадро. Количество вещества может обозначаться также и символом v.
Постоянная Авогадро NA = 6,02 • 1023 частиц/моль.
Молярная масса M (г/моль) — отношение массы вещества m(г) к количеству вещества n (моль):
М = m/n, откуда: m = М • n и n = m/М.
Молярный объем газа VM (л/моль) — отношение объема газа V (л) к количеству вещества этого газа n (моль). При нормальных условиях VM = 22,4 л/моль.
Нормальные условия: температура t = 0°C, или Т = 273 К, давление р = 1 атм = 760 мм. рт. ст. = 101 325 Па = 101,325 кПа.
VM = V/n, откуда: V = VM • n и n = V/VM.
В результате получается общая формула:
n = m/M = V/VM = N/NA.
Эквивалент — реальная или условная частица, взаимодействующая с одним атомом водорода, или замещающая его, или эквивалентная ему каким-либо другим способом.
Молярная масса эквивалентов Мэ — отношение массы вещества к количеству эквивалентов этого вещества: Мэ = m/n(экв).
В реакциях обмена зарядов молярная масса эквивалентов вещества
с молярной массой М равна: Мэ = М/(n × m).
В окислительно-восстановительных реакциях молярная масса эквивалентов вещества с молярной массой М равна: Мэ = М/n(ē), где n(ē) — число переданных электронов.
Закон эквивалентов — массы реагирующих веществ 1 и 2 пропорциональны молярным массам их эквивалентов. m1/m2 = МЭ1/МЭ2, или m1/МЭ1 = m2/МЭ2, или n1 = n2, где m1 и m2 — массы двух веществ, МЭ1 и МЭ2 — молярные массы эквивалентов, n1 и n2 — количества эквивалентов этих веществ.
Для растворов закон эквивалентов может быть записан в следующем виде:
cЭ1 • V1 = cЭ2 • V2, где сЭ1, сЭ2, V1 и V2 — молярные концентрации эквивалентов и объемы растворов этих двух веществ.
Объединенный газовый закон: pV = nRT, где p — давление (Па, кПа), V — объем (м3, л), n — количество вещества газа (моль), T — температура (К), T (К) = t (°C) + 273, R — константа, R = 8,314 Дж/(К × моль), при этом Дж = Па • м3 = кПа • л.
2. Строение атома и Периодический закон
Корпускулярно-волновой дуализм материи — представление о том, что каждый объект может иметь и волновые, и корпускулярные свойства. Луи де Бройль предложил формулу, связывающую волновые и корпускулярные свойства объектов: λ = h/(mV), где h — постоянная Планка, λ — длина волны, которая соответствует каждому телу с массой m и скоростью V. Хотя волновые свойства существуют для всех объектов, но наблюдаться они могут лишь для микрообъектов, имеющих массы порядка массы атома и электрона.
Принцип неопределенности Гейзенберга: Δ(mVx) • Δх > h/2n или ΔVx • Δx > h/(2πm), где m — масса частицы, x — ее координата, Vx — скорость в направлении x, Δ — неопределенность, погрешность определения. Принцип неопределенности означает, что нельзя одновременно сколь угодно точно указать положение (координату x) и скорость (Vx) частицы.
Частицы с маленькими массами (атомы, ядра, электроны, молекулы) не являются частицами в понимании этого механикой Ньютона и не могут изучаться классической физикой. Они изучаются квантовой физикой.
Главное квантовое число n принимает значения 1, 2, 3, 4, 5, 6 и 7, соответствующие электронным уровням (слоям) К, L, M, N, О, Р и Q.
Уровень — пространство, где расположены электроны с одинаковым числом n. Электроны разных уровней пространственно и энергетически отделены друг от друга, поскольку число n определяет энергию электронов Е (чем больше n, тем больше Е) и расстояние R между электронами и ядром (чем больше n, тем больше R).
Орбитальное (побочное, азимутальное) квантовое число l принимает значения в зависимости от числа n: l = 0, 1,…(n — 1). Например, если n = 2, то l = 0, 1; если n = 3, то l = 0, 1, 2. Число l характеризует подуровень (подслой).
Подуровень — пространство, где расположены электроны с определенными n и l. Подуровни данного уровня обозначаются в зависимости от числа l: s — если l = 0, p — если l = 1, d — если l = 2, f — если l = 3. Подуровни данного атома обозначаются в зависимости от чисел n и l, например: 2s (п = 2, l = 0), 3d (n = 3, l = 2) и т. д. Подуровни данного уровня имеют разную энергию (чем больше l, тем больше Е): Es< E < ЕА <… и разную форму орбиталей, составляющих эти подуровни: s-орбиталь имеет форму шара, p-орбиталь имеет форму гантели и т. д.
Магнитное квантовое число m1 характеризует ориентацию орбитального магнитного момента, равного l, в пространстве относительно внешнего магнитного поля и принимает значения: — l,…-1, 0, 1,…l, т. е. всего (2l + 1) значение. Например, если l = 2, то m1 = -2, — 1, 0, 1, 2.
Орбиталь (часть подуровня) — пространство, где расположены электроны (не более двух) с определенными n, l, m1. Подуровень содержит 2l+1 орбиталь. Например, d — подуровень содержит пять d-орбиталей. Орбитали одного подуровня, имеющие разные числа m1, имеют одинаковую энергию.
Магнитное спиновое число ms характеризует ориентацию собственного магнитного момента электрона s, равного ½, относительно внешнего магнитного поля и принимает два значению: +½ и _½.
Электроны в атоме занимают уровни, подуровни и орбитали согласно следующим правилам.
Правило Паули: в одном атоме два электрона не могут иметь четыре одинаковых квантовых числа. Они должны отличаться по меньшей мере одним квантовым числом.
Из правила Паули следует, что на орбитали могут располагаться не более двух электронов, на подуровне может содержаться не более 2(2l + 1) электронов, на уровне содержится не более 2n2 электронов.
Правило Клечковского: заполнение электронных подуровней осуществляется в порядке возрастания суммы (n + l), а в случае одинаковой суммы (n + l) — в порядке возрастания числа n.
Графическая форма правила Клечковского.
Согласно правилу Клечковского, заполнение подуровней осуществляется в следующем порядке: 1s, 2s, 2р, 3s, Зр, 4s, 3d, 4р, 5s, 4d, 5р, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, 8s,…
Хотя заполнение подуровней происходит по правилу Клечковского, в электронной формуле подуровни записываются последовательно по уровням: 1s, 2s, 2p, 3s, 3p, 3d, 4s, 4р, 4d, 4f и т. д. Таким образом, электронная формула атома брома записывается следующим образом: Br(35ē) 1s22s22p63s23p63d104s24p5.
Электронные конфигурации ряда атомов отличаются от предсказанных по правилу Клечковского. Так, для Сr и Cu:
Сr(24ē) 1s22s22p63s23p63d54s1 и Cu(29ē) 1s22s22p63s23p63d104s1.
Правило Хунда (Гунда): заполнение ор-биталей данного подуровня осуществляется так, чтобы суммарный спин был максимален. Орбитали данного подуровня заполняются сначала по одному электрону.
Электронные конфигурации атомов можно записать по уровням, подуровням, ор-биталям. Например, электронная формула Р(15ē) может быть записана:
а) по уровням)2)8)5;
б) по подуровням 1s22s22p63s23p3;
в) по орбиталям
Примеры электронных формул некоторых атомов и ионов:
V(23ē) 1s22s22p63s23p63d34s2;
V3+(20ē) 1s22s22p63s23p63d24s0.
3. Химическая связь
3.1. Метод валентных связей
Согласно методу валентных связей, связь между атомами А и В образуется с помощью общей пары электронов.
Ковалентная связь.
Донорно-ацепторная связь.
Валентность характеризует способность атомов образовывать химические связи и равна числу химических связей, образованных атомом. Согласно методу валентных связей, валентность равна числу общих пар электронов, а в случае ковалентной связи валентность равна числу неспаренных электронов на внешнем уровне атома в его основном или возбужденных состояниях.
Валентность атомов
Например, для углерода и серы:
Насыщаемость ковалентной связи: атомы образуют ограниченное число связей, равное их валентности.
Гибридизация атомных орбиталей — смешение атомных орбиталей (АО) разных подуровней атома, электроны которых участвуют в образовании эквивалентных σ-связей. Эквивалентность гибридных орбиталей (ГО) объясняет эквивалентность образующихся химических связей. Например, в случае четырехвалентного атома углерода имеется один 2s — и три 2p-электрона. Чтобы объяснить эквивалентность четырех σ-связей, образованных углеродом в молекулах CH4, CF4 и т. д., атомные одна s- и три р-орбитали заменяют четырьмя эквивалентными гибридными sp3-орбиталями:
Направленность ковалентной связи состоит в том, что она образуется в направлении максимального перекрывания орбиталей, образующих общую пару электронов.
В зависимости от типа гибридизации гибридные орбитали имеют определенное расположение в пространстве:
sp — линейное, угол между осями орби-талей 180°;
sp2 — треугольное, углы между осями орбиталей 120°;
sp3 — тетраэдрическое, углы между осями орбиталей 109°;
sp3d1 — тригонально-бипирамидальное, углы 90° и 120°;
sp2d1 — квадратное, углы между осями орбиталей 90°;
sp3d2 — октаэдрическое, углы между осями орбиталей 90°.
3.2. Теория молекулярных орбиталей
Согласно теории молекулярных орбита-лей, молекула состоит из ядер и электронов. В молекулах электроны находятся на молекулярных орбиталях (МО). МО внешних электронов имеют сложное строение и рассматриваются как линейная комбинация внешних орбиталей атомов, составляющих молекулу. Число образующихся МО равно числу АО, участвующих в их образовании. Энергии МО могут быть ниже (связывающие МО), равны (несвязывающие МО) или выше (разрыхляющие, антисвя-зывающие МО), чем энергии образующих их АО.
Условия взаимодействия АО
1. АО взаимодействуют, если имеют близкие энергии.
2. АО взаимодействуют, если они перекрываются.
3. АО взаимодействуют, если имеют соответствующую симметрию.
Для двухатомной молекулы АВ (или любой линейной молекулы) симметрия МО может быть:
σ, если данная МО имеет ось симметрии,
π, если данная МО имеет плоскость симметрии,
δ, если МО имеет две перпендикулярные плоскости симметрии.
Присутствие электронов на связывающих МО стабилизирует систему, так как уменьшает энергию молекулы по сравнению с энергией атомов. Стабильность молекулы характеризуется порядком связи n, равным: n = (nсв — nразр)/2, где nсв и nразр — числа электронов на связывающих и разрыхляющих орбиталях.
Заполнение МО электронами происходит по тем же правилам, что и заполнение АО в атоме, а именно: правилу Паули (на МО не может быть более двух электронов), правилу Хунда (суммарный спин должен быть максимален) и т. д.
Взаимодействие 1s-AO атомов первого периода (Н и Не) приводит к образованию связывающей σ-МО и разрыхляющей σ*-МО:
Электронные формулы молекул, порядки связей n, экспериментальные энергии связей Е и межмолекулярные расстояния R для двухатомных молекул из атомов первого периода приведены в следующей таблице:
Другие атомы второго периода содержат, помимо 2s-AO, также и 2рх-, 2рy — и 2рz-АО, которые при взаимодействии могут образовывать σ — и π-MO. Для атомов О, F и Ne энергии 2s — и 2р-АО существенно различаются, и можно пренебречь взаимодействием 2s-AO одного атома и 2р-АО другого атома, рассматривая взаимодействие между 2s-AO двух атомов отдельно от взаимодействия их 2р-АO. Схема МО для молекул O2, F2, Ne2 имеет следующий вид:
Для атомов В, С, N энергии 2s — и 2р-АО близки по своим энергиям, и 2s-AO одного атома взаимодействует с 2рz-АО другого атома. Поэтому порядок МО в молекулах В2, С2 и N2 отличается от порядка МО в молекулах O2, F2 и Ne2. Ниже приведена схема МО для молекул В2, С2 и N2:
На основании приведенных схем МО можно, например, записать электронные формулы молекул O2, O2+ и O2¯:
O2+(11ē)σs2σs*2σz2(πx2πy2)(πx*1πy*0)
n = 2 R = 0,121 нм;
O2(12ē)σs2σs*2σz2(πx2πy2)(πx*1πy*1)
n = 2,5 R = 0,112 нм;
O2¯(13ē)σs2σs*2σz2(πx2πy2)(πx*2πy*1)
n = 1,5 R = 0,126 нм.
В случае молекулы O2 теория МО позволяет предвидеть большую прочность этой молекулы, поскольку n = 2, характер изменения энергий связи и межъядерных расстояний в ряду O2+ — O2 — O2¯, а также парамагнетизм молекулы O2, на верхних МО которой имеются два неспаренных электрона.
3.3. Некоторые виды связей
Ионная связь — электростатическая связь между ионами противоположных зарядов. Ионная связь может рассматриваться как предельный случай ковалентной полярной связи. Ионная связь образуется, если разница электроотрицательностей атомов ΔХ больше чем 1,5–2,0.
Ионная связь является ненаправленной ненасыщаемой связью. В кристалле NaCl ион Na+ притягивается всеми ионами Cl¯ и отталкивается всеми другими ионами Na+, независимо от направления взаимодействия и числа ионов. Это предопределяет большую устойчивость ионных кристаллов по сравнению с ионными молекулами.
Водородная связь — связь между атомом водорода одной молекулы и электроотрицательным атомом (F, CI, N) другой молекулы.
Существование водородной связи объясняет аномальные свойства воды: температура кипения воды гораздо выше, чем у ее химических аналогов: tкип(Н2O) = 100 °С, а tкип(H2S) = — 61°C. Между молекулами H2S водородные связи не образуются.
4. Закономерности протекания химических процессов
4.1. Термохимия
Энергия (Е) — способность производить работу. Механическая работа (А) совершается, например, газом при его расширении: А = р • ΔV.
Реакции, которые идут с поглощением энергии, — эндотермические.
Реакции, которые идут с выделением энергии, — экзотермические.
Виды энергии: теплота, свет, электрическая, химическая, ядерная энергия и др.
Типы энергии: кинетическая и потенциальная.
Кинетическая энергия — энергия движущегося тела, это работа, которую может совершить тело до достижения им покоя.
Теплота (Q) — вид кинетической энергии — связана с движением атомов и молекул. При сообщении телу массой (m) и удельной теплоемкостью (с) теплоты ΔQ его температура повышается на величину Δt: ΔQ = m • с • Δt, откуда Δt = ΔQ/(c • т).
Потенциальная энергия — энергия, приобретенная телом в результате изменения им или его составными частями положения в пространстве. Энергия химических связей — вид потенциальной энергии.
Первый закон термодинамики: энергия может переходить из одного вида в другой, но не может исчезать или возникать.
Внутренняя энергия (U) — сумма кинетической и потенциальной энергий частиц, составляющих тело. Поглощаемая в реакции теплота равна разности внутренней энергии продуктов реакции и реагентов (Q = ΔU = U2 — U1), при условии, что система не совершила работы над окружающей средой. Если реакция идет при постоянном давлении, то выделяющиеся газы совершают работу против сил внешнего давления, и поглощаемая в ходе реакции теплота равна сумме изменений внутренней энергии ΔU и работы А = р • ΔV. Эту поглощаемую при постоянном давлении теплоту называют изменением энтальпии: ΔН = ΔU + р • ΔV, определяя энтальпию как Н = U + pV. Реакции жидких и твердых веществ протекают без существенного изменения объема (ΔV = 0), так что для этих реакций ΔН близка к ΔU (ΔН = ΔU). Для реакций с изменением объема имеем ΔН > ΔU, если идет расширение, и ΔН < ΔU, если идет сжатие.
Изменение энтальпии обычно относят для стандартного состояния вещества: т. е. для чистого вещества в определенном (твердом, жидком или газообразном) состоянии, при давлении 1 атм = 101 325 Па, температуре 298 К и концентрации веществ 1 моль/л.
Стандартная энтальпия образования ΔНобр — теплота, выделяемая или поглощаемая при образовании 1 моль вещества из простых веществ, его составляющих, при стандартных условиях. Так, например, ΔНобр(NaCl) = — 411 кДж/моль. Это означает, что в реакции Na(тв) + ½Cl2(г) = NaCl(тв) при образовании 1 моль NaCl выделяется 411 кДж энергии.
Стандартная энтальпия реакции ΔН — изменение энтальпии в ходе химической реакции, определяется по формуле: ΔН = ΔНобр(продуктов) — ΔНобр(реагентов).
Так для реакции NH3(г) + HCl(г) = NH4Cl(тв), зная ΔHo6p(NH3)=-46 кДж/моль, ΔHo6p(HCl) = — 92 кДж/моль и ΔHo6p(NH4Cl) = — 315 кДж/моль имеем:
ΔH = ΔHo6p(NH4Cl) — ΔHo6p(NH3) — ΔHo6p(HCl) = — 315 — (-46) — (-92) = — 177 кДж.
Если ΔН < 0, то реакция экзотермическая. Если ΔН > 0, то реакция эндотермическая.
Закон Гесса: стандартная энтальпия реакции зависит от стандартных энтальпий реагентов и продуктов и не зависит от пути протекания реакции.
Самопроизвольно идущие процессы могут быть не только экзотермическими, т. е. процессами с уменьшением энергии (ΔН < 0), но могут быть и эндотермическими процессами, т. е. процессами с увеличением энергии (ΔН > 0). Во всех этих процессах «беспорядок» системы увеличивается.
Энтропия S — физическая величина, характеризующая степень беспорядка системы. S — стандартная энтропия, ΔS — изменение стандартной энтропии. Если ΔS > 0, беспорядок растет, если AS < 0, то беспорядок системы уменьшается. Для процессов в которых растет число частиц, ΔS > 0. Для процессов, в которых число частиц уменьшается, ΔS < 0. Например, энтропия меняется в ходе реакций:
СаО(тв) + Н2O(ж) = Са(OH)2(тв), ΔS < 0;
CaCO3(тв) = СаО(тв) + CO2(г), ΔS > 0.
Самопроизвольно идут процессы с выделением энергии, т. е. для которых ΔН < 0, и с увеличением энтропии, т. е. для которых ΔS > 0. Учет обоих факторов приводит к выражению для энергии Гиббса: G = Н — TS или ΔG = ΔН — Т • ΔS.
Конец ознакомительного фрагмента.
Химические формулы
| № | Количественные характеристики вещества | Обозначение | Единицы измерения | Формула для расчета |
|---|---|---|---|---|
| 1 | Плотность вещества | ρ | кг/м³ | ρ = m / V(Массу делим на объем вещества) |
| 2 | Относительная атомная масса элемента | Аr | — | Ar = ma / u см. в периодической система химических элементов |
| 3 | Атомная единица массы | u а.е.м. |
кг | u = 1/12 * ma (12C) const = 1.66*10-27 |
| 4 | Масса атома (абсолютная) | ma | кг | ma = Ar * u |
| 5 | Относительная молекулярная (формульная) масса вещества | Mr | — | Mr (AxBy)=m(AB) / u Mr(AxBy)=x*Ar(A) + y*Ar(B) |
| 6 | Масса молекулы (формульной единицы) | m M | кг | mM = Mr*u |
| 7 | Количество вещества | n | моль | n=m/M n=N/NA n=V/VM |
| 8 | Молярная масса (масса 1 моль вещества) | M | г/моль | M=m/n M=Mr M=Ar (для простых веществ) |
| 9 | Масса вещества | m | г (кг) | m=M*n m=ρ*V |
| 10 | Число структурных единиц | N | атомов, молекул, ионов, частиц, формульных единиц (Ф.Е.) | N=NA*n |
| 11 | Молярный объем — число 1 моль ГАЗООБРАЗНОГО вещества в нормальных условиях (н.у.) | VM | л/моль | const=22,4 |
| 12 | Объем газа при н.у. | V | л | V=VM*n V=m/ρ |
| 13 | Постоянная Авогадро | NA | частиц/моль | const=6,02*1023 |
| 14 | Массовая доля вещества (омега) | ωЭ/В | % | ωЭ/В = (Ar(э) * k) / Mr(В) |
Формулы и названия кислот. Формулы и названия кислотных остатков.
| Формула | Название кислоты | Формула кислотного остатка | Название кислотного остатка |
|---|---|---|---|
| HF | Фтороводород, плавиковая | F— | Фторид |
| HCl | Хлороводород, соляная | Cl— | Хлорид |
| HBr | Бромоводород | Br— | Бромид |
| HI | Йодоводород | I— | Йодид |
| H2S | Сероводород | S2- | Сульфид |
| HCN | Циановодородная | CN— | Цианид |
| HNO2 | Азотистая | NO2— | Нитрит |
| HNO3 | Азотная | NO3— | Нитрат |
| H3PO4 | Ортофосфорная | PO43- | Фосфат |
| H3AsO4 | Мышьяковая | AsO43- | Арсенат |
| H2SO3 | Сернистая | SO32- | Сульфит |
| H2SO4 | Серная | SO42- | Сульфат |
| H2CO3 | Угольная | CO32- | Карбонат |
| H2SiO3 | Кремниевая | SiO32- | Силикат |
| H2CrO4 | Хромовая | CrO42- | Хромат |
| H2Cr2O7 | Дихромовая | Cr2O72- | Дихромат |
| HMnO4 | Марганцовая | MnO4— | Перманганат |
| HClO | Хлорноватистая | ClO— | Гипохлорит |
| HClO2 | Хлористая | ClO2— | Хлорит |
| HClO3 | Хлорноватая | ClO3— | Хлорат |
| HClO4 | Хлорная | ClO4— | Перхлорат |
| HCOOH | Метановая, муравьиная | HCOO— | Формиат |
| CH3COOH | Этановая, уксусная | CH3COO— | Ацетат |
| H3C2O4 | Этандиовая, щавелевая | C2O42- | Оксалат |
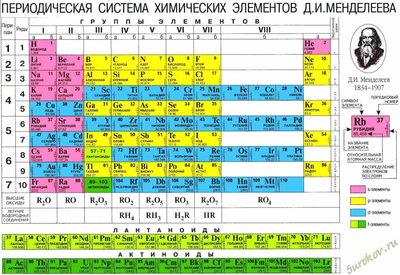
Периодическая система Менделеева
Нажмите на картинку для увеличения
Основные формулы для решения задач
|
Величина |
Соотношение |
|
Атомная |
|
|
Порядковый |
Z |
|
Массовая |
|
|
Количество |
|
|
Количество |
н.у. |
|
Молярная |
|
|
Масса |
m(X) |
|
Молярный |
Vm |
|
Объем |
V |
|
Выход |
|
|
Плотность |
|
|
Плотность |
|
|
Плотность |
М(воздуха) |
|
Объединенный |
|
|
Уравнение |
PV |
|
Объемная |
|
|
Молярная |
|
|
Молярная |
|
|
Количество |
Q |
|
Тепловой |
Q |
|
Теплота |
|
|
Скорость |
|
|
Закон (для |
aA
u |
|
Правило |
|
|
Растворимость |
|
|
Массовая |
|
|
Масса |
m(р-р)
m(р-р) |
|
Массовая |
|
|
Плотность |
|
|
Объем |
|
|
Молярная |
|
|
Степень |
|
|
Ионное |
K(H2O) |
|
Водородный |
рН = –lg[H+] |
Рекомендуемая литература
Основная:
Кузнецова
Н.Е. и др.
Химия. 8 кл-10 кл.. – М.: Вентана-Граф,
2005-2007.
Кузнецова
Н.Е., Литвинова Т.Н., Левкин А.Н.
Химия.11 класс в 2-х частях, 2005-2007 гг.
Егоров
А.С. Химия.
Новое учебное пособие для подготовки
в вузы. Ростов н/Д: Феникс, 2004.– 640 с.
Егоров а.С. Химия: современный курс для подготовки к егэ. Ростов н/д: Феникс, 2011. (2012)– 699 с.
Егоров
А.С. Самоучитель
по решению химических задач. –
Ростов-на-Дону: Феникс, 2000.– 352 с.
Химия/пособие-репетитор
для поступающих в вузы. Ростов-н/Д,
Феникс, 2005– 536 с.
Хомченко
Г.П.,Хомченко И.Г.
Задачи по химии для поступающих в вузы.
М.: Высшая школа. 2007.–302с.
Дополнительная:
Врублевский
А.И.
Учебно-тренировочные материалы для
подготовки к централизованному
тестированию по химии/ А.И. Врублевский
–Мн.: ООО «Юнипресс», 2004.– 368 с.
Врублевский
А.И. 1000 задач
по химии с цепочками превращений и
контрольными тестами для школьников и
абитуриентов.– Мн.: ООО «Юнипресс»,
2003.– 400 с.
Егоров
А.С. Все типы
расчетных задач по химии для подготовки
к ЕГЭ.–Ростов н/Д: Феникс, 2003.–320с.
Егоров
А.С., Аминова Г.Х.
Типовые задания и упражнения для
подготовки к экзамену по химии. – Ростов
н/Д: Феникс, 2005.– 448 с.
Единый
государственный экзамен 2007. Химия.
Учебно-тренировочные материалы для
подготовки учащихся/ФИПИ – М.:
Интеллект-Центр, 2007.– 272 с.
ЕГЭ-2011.
Химия. Учебно-тренировочный комплект
под ред. А.А. Кавериной.– М.: Национальное
образование, 2011.
Единственные
реальные варианты заданий для подготовки
к единому государственному экзамену.
ЕГЭ.2007. Химия/В.Ю. Мишина, Е.Н. Стрельникова.
М.: Федеральный центр тестирования,
2007.–151с.
Каверина
А.А. Оптимальный
банк заданий для подготовки учащихся.
Единый государственный экзамен
2012.Химия. Учебное пособие./ А.А. Каверина,
Д.Ю. Добротин, Ю.Н. Медведев, М.Г. Снастина.–
М.: Интеллект-Центр, 2012.– 256 с.
Литвинова
Т.Н., Выскубова Н.К., Ажипа Л.Т., Соловьева
М.В. Тестовые
задания в дополнение к контрольным
работам для слушателей 10-месячных
заочных подготовительных курсов
(методические указания). Краснодар,
2004. – С. 18 – 70.
Литвинова
Т.Н. Химия.
ЕГЭ-2011. Тренировочные тесты. Ростов
н/Д: Феникс, 2011.– 349 с.
Литвинова
Т.Н. Химия.
Тесты к ЕГЭ. Ростов н/Д.: Феникс, 2012. — 284
с.
Литвинова
Т.Н. Химия.
Законы, свойства элементов и их соединений.
Ростов н/Д.: Феникс, 2012. — 156 с.
Литвинова
Т.Н., Мельникова Е.Д., Соловьева М.В.,
Ажипа Л.Т.,
Выскубова Н.К. Химия
в задачах для поступающих в вузы.– М.:
ООО «Изд-во Оникс»: ООО «Изд-во «Мир и
образование», 2009.– 832 с.
Учебно-методический
комплекс по химии для учащихся
медико-биологических классов под ред.
Т.Н.Литвиновой.– Краснодар.: КГМУ, –
2008.
Химия.
ЕГЭ–2008. Вступительные испытания,
учебно-методическое пособие
/ под ред. В.Н. Доронькина. – Ростов н/Д:
Легион, 2008.– 271 с
Список
сайтов по химии:
1.
Alhimik.
http://www.alhimik.ru
2.
Химия для всех. Электронный справочник
за полный курс химии.
http://www.informika.ru/text/database/chemy/START.html
3.
Школьная химия – справочник.
http://www.schoolchemistry.by.ru
4.
Репетитор по химии. http://www.
chemistry.nm.ru
Интернет-ресурсы
-
Alhimik.
http://www.alhimik.ru -
Химия
для всех. Электронный справочник за
полный курс химии.
http://www.informika.ru/text/database/chemy/START.html
-
Школьная
химия – справочник.
http://www.schoolchemistry.by.ru -
http://www.classchem.narod.ru
-
Репетитор
по химии. http://www.
chemistry.nm.ru -
http://www.alleng.ru/edu/chem.htm
— образовательные
ресурсы Интернета по химии -
http://schoolchemistry.by.ru/
— школьная
химия. На этом сайте есть возможность
пройти On-line тестирование по разным
темам, а также демонстрационные варианты
Единого Государственного Экзамена -
Химия
и жизнь–ХХ1 век: научно-популярный
журнал. http://www.hij.ru
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
21.05.20151.82 Mб56Klassifikatsia_Zabolevany_Vo.djvu
- #
- #
- #
- #
|
№ |
Количественные |
Обозначение |
Единицы |
Формула |
|
1 |
Относительная атомная |
Аr |
— |
Ar = ma / u см. в периодической система химических элементов (ПСХЭ) |
|
2 |
Атомная единица массы |
u а.е.м. |
кг |
u=1/12 * ma(12C) const=1.66*10-27 |
|
3 |
Масса тома (абсолютная) |
ma |
кг |
ma = Ar * u |
|
4 |
Относительная молекулярная (формульная) масса вещества |
Mr |
— |
Mr (AxBy)=m(AB) / u Mr(AxBy)=x*Ar(A) + y*Ar(B) |
|
5 |
Масса молекулы (формульной единицы) |
mM |
кг |
mM = Mr*u |
|
6 |
Количество вещества |
n |
моль |
n=m/M n=N/NA n=V/Vm |
|
7 |
Молярная масса (масса 1 моль вещества) |
M |
г/моль |
M=m/n M=Mr, M=Ar (для простых веществ) |
|
8 |
Масса вещества |
m |
г (кг) |
m=M*n m=ρ*V |
|
9 |
Число структурных единиц |
N |
атомов, молекул, ионов, частиц, формульных единиц (Ф.Е.) |
N=NA*n |
|
10 |
Молярный объем — число 1 моль ГАЗООБРАЗНОГО вещества в нормальных условиях (н.у.) |
Vm |
л/моль |
const=22,4 |
|
11 |
Объем газа при н.у. |
V |
л |
V=Vm*n V=m/ρ |
|
12 |
Постоянная Авогадро |
NA |
частиц/моль |
const=6,02*1023 |
Вернуться в меню выбора предмета