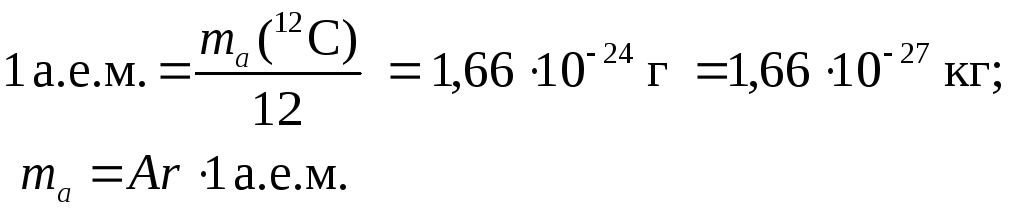Формулы для решения задач
Дата публикации: Nov 12, 2016 5:18:21 PM
Основные формулы для решения задач по химии
Основные формулы для решения задач по химии
Все, все основные задачи по химии решаются с помощью нескольких основных понятий и формул.
Моль (количество моль)
обозначение: моль, международное: mol — единица измерения количества вещества. Соответствует количеству вещества, в котором содержится NA частиц (молекул, атомов, ионов)Поэтому была введена универсальная величина —количество моль. Часто встречающаяся фраза в задачах — «было получено… моль вещества»
NA = 6,02 · 1023
NA — число Авогадро. Тоже «число по договоренности». Сколько атомов содержится в стержне кончика карандаша? Порядка тысячи. Оперировать такими величинами не удобно. Поэтому химики и физики всего мира договорились — обозначим 6,02 · 1023 частиц (атомов, молекул, ионов) как 1 моль вещества.
1 моль = 6,02 · 1023 частиц
Это была первая из основных формул для решения задач.
Молярная масса вещества
Молярная масса вещества — это масса одного моль вещества.
Обозначается как Mr. Находится по таблице Менделеева — это просто сумма атомных масс вещества.
Например, нам дана серная кислота — H2SO4. Давайте посчитаем молярную массу вещества: атомная масса H =1, S-32, O-16. Mr(H2SO4)=1•2+32+16•4=98 гмоль.
Вторая необходимая формула для решения задач —
формула массы вещества:
Т.е., чтобы найти массу вещества, необходимо знать количество моль (n), а молярную массу мы находим из Периодической системы.
Закон сохранения массы — масса веществ, вступивших в химическую реакцию, всегда равна массе образовавшихся веществ.
Если мы знаем массу (массы) веществ, вступивших в реакцию, мы можем найти массу (массы) продуктов этой реакции. И наоборот.
Третья формула для решения задач по химии —
объем вещества:
Откуда взялось число 22.4? Из закона Авогадро:
в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (н.у.) имеет один и тот же объём Vm = 22,413 996(39) л
Т.е., если в задаче нам даны нормальные условия, то, зная количество моль (n), мы можем найти объем вещества.
Итак, основные формулы для решения задач по химии
Число Авогадро NA
6,02 · 1023 частиц
Количество вещества n (моль)
n=mMr
n=V22.4 (лмоль)
Масса веществаm (г)
m=n•Mr
Объем вещества V(л)
V=n•22.4 (лмоль)
Основные формулы для решения задач
|
Величина |
Соотношение |
|
Атомная |
|
|
Порядковый |
Z |
|
Массовая |
|
|
Количество |
|
|
Количество |
н.у. |
|
Молярная |
|
|
Масса |
m(X) |
|
Молярный |
Vm |
|
Объем |
V |
|
Выход |
|
|
Плотность |
|
|
Плотность |
|
|
Плотность |
М(воздуха) |
|
Объединенный |
|
|
Уравнение |
PV |
|
Объемная |
|
|
Молярная |
|
|
Молярная |
|
|
Количество |
Q |
|
Тепловой |
Q |
|
Теплота |
|
|
Скорость |
|
|
Закон (для |
aA
u |
|
Правило |
|
|
Растворимость |
|
|
Массовая |
|
|
Масса |
m(р-р)
m(р-р) |
|
Массовая |
|
|
Плотность |
|
|
Объем |
|
|
Молярная |
|
|
Степень |
|
|
Ионное |
K(H2O) |
|
Водородный |
рН = –lg[H+] |
Рекомендуемая литература
Основная:
Кузнецова
Н.Е. и др.
Химия. 8 кл-10 кл.. – М.: Вентана-Граф,
2005-2007.
Кузнецова
Н.Е., Литвинова Т.Н., Левкин А.Н.
Химия.11 класс в 2-х частях, 2005-2007 гг.
Егоров
А.С. Химия.
Новое учебное пособие для подготовки
в вузы. Ростов н/Д: Феникс, 2004.– 640 с.
Егоров а.С. Химия: современный курс для подготовки к егэ. Ростов н/д: Феникс, 2011. (2012)– 699 с.
Егоров
А.С. Самоучитель
по решению химических задач. –
Ростов-на-Дону: Феникс, 2000.– 352 с.
Химия/пособие-репетитор
для поступающих в вузы. Ростов-н/Д,
Феникс, 2005– 536 с.
Хомченко
Г.П.,Хомченко И.Г.
Задачи по химии для поступающих в вузы.
М.: Высшая школа. 2007.–302с.
Дополнительная:
Врублевский
А.И.
Учебно-тренировочные материалы для
подготовки к централизованному
тестированию по химии/ А.И. Врублевский
–Мн.: ООО «Юнипресс», 2004.– 368 с.
Врублевский
А.И. 1000 задач
по химии с цепочками превращений и
контрольными тестами для школьников и
абитуриентов.– Мн.: ООО «Юнипресс»,
2003.– 400 с.
Егоров
А.С. Все типы
расчетных задач по химии для подготовки
к ЕГЭ.–Ростов н/Д: Феникс, 2003.–320с.
Егоров
А.С., Аминова Г.Х.
Типовые задания и упражнения для
подготовки к экзамену по химии. – Ростов
н/Д: Феникс, 2005.– 448 с.
Единый
государственный экзамен 2007. Химия.
Учебно-тренировочные материалы для
подготовки учащихся/ФИПИ – М.:
Интеллект-Центр, 2007.– 272 с.
ЕГЭ-2011.
Химия. Учебно-тренировочный комплект
под ред. А.А. Кавериной.– М.: Национальное
образование, 2011.
Единственные
реальные варианты заданий для подготовки
к единому государственному экзамену.
ЕГЭ.2007. Химия/В.Ю. Мишина, Е.Н. Стрельникова.
М.: Федеральный центр тестирования,
2007.–151с.
Каверина
А.А. Оптимальный
банк заданий для подготовки учащихся.
Единый государственный экзамен
2012.Химия. Учебное пособие./ А.А. Каверина,
Д.Ю. Добротин, Ю.Н. Медведев, М.Г. Снастина.–
М.: Интеллект-Центр, 2012.– 256 с.
Литвинова
Т.Н., Выскубова Н.К., Ажипа Л.Т., Соловьева
М.В. Тестовые
задания в дополнение к контрольным
работам для слушателей 10-месячных
заочных подготовительных курсов
(методические указания). Краснодар,
2004. – С. 18 – 70.
Литвинова
Т.Н. Химия.
ЕГЭ-2011. Тренировочные тесты. Ростов
н/Д: Феникс, 2011.– 349 с.
Литвинова
Т.Н. Химия.
Тесты к ЕГЭ. Ростов н/Д.: Феникс, 2012. — 284
с.
Литвинова
Т.Н. Химия.
Законы, свойства элементов и их соединений.
Ростов н/Д.: Феникс, 2012. — 156 с.
Литвинова
Т.Н., Мельникова Е.Д., Соловьева М.В.,
Ажипа Л.Т.,
Выскубова Н.К. Химия
в задачах для поступающих в вузы.– М.:
ООО «Изд-во Оникс»: ООО «Изд-во «Мир и
образование», 2009.– 832 с.
Учебно-методический
комплекс по химии для учащихся
медико-биологических классов под ред.
Т.Н.Литвиновой.– Краснодар.: КГМУ, –
2008.
Химия.
ЕГЭ–2008. Вступительные испытания,
учебно-методическое пособие
/ под ред. В.Н. Доронькина. – Ростов н/Д:
Легион, 2008.– 271 с
Список
сайтов по химии:
1.
Alhimik.
http://www.alhimik.ru
2.
Химия для всех. Электронный справочник
за полный курс химии.
http://www.informika.ru/text/database/chemy/START.html
3.
Школьная химия – справочник.
http://www.schoolchemistry.by.ru
4.
Репетитор по химии. http://www.
chemistry.nm.ru
Интернет-ресурсы
-
Alhimik.
http://www.alhimik.ru -
Химия
для всех. Электронный справочник за
полный курс химии.
http://www.informika.ru/text/database/chemy/START.html
-
Школьная
химия – справочник.
http://www.schoolchemistry.by.ru -
http://www.classchem.narod.ru
-
Репетитор
по химии. http://www.
chemistry.nm.ru -
http://www.alleng.ru/edu/chem.htm
— образовательные
ресурсы Интернета по химии -
http://schoolchemistry.by.ru/
— школьная
химия. На этом сайте есть возможность
пройти On-line тестирование по разным
темам, а также демонстрационные варианты
Единого Государственного Экзамена -
Химия
и жизнь–ХХ1 век: научно-популярный
журнал. http://www.hij.ru
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
21.05.20151.82 Mб56Klassifikatsia_Zabolevany_Vo.djvu
- #
- #
- #
- #
В этой статье мы коснемся нескольких краеугольных понятий в химии, без которых совершенно невозможно
решение задач. Старайтесь понять смысл физических величин, чтобы усвоить эту тему.
Я постараюсь приводить как можно больше примеров по ходу этой статьи, в ходе изучения вы увидите множество примеров
по данной теме.

Относительная атомная масса — Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической
таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса — Mr
Относительная молекулярная масса складывается из суммы относительных атомных масс всех атомов, входящих в состав вещества.
В качестве примера найдем относительные молекулярные массы кислорода, воды, перманганата калия и медного купороса:
Mr (O2) = (2 × Ar(O)) = 2 × 16 = 32
Mr (H2O) = (2 × Ar(H)) + Ar(O) = (2 × 1) + 16 = 18
Mr (KMnO4) = Ar(K) + Ar(Mn) + (4 × Ar(O)) = 39 + 55 + (4 * 16) = 158
Mr (CuSO4*5H2O) = Ar(Cu) + Ar(S) + (4 × Ar(O)) + (5 × ((Ar(H) × 2) +
Ar(O))) = 64 + 32 + (4 × 16) + (5 × ((1 × 2) + 16)) = 160 + 5 * 18 = 250
Моль и число Авогадро
Моль — единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц
этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12C, т.е. 6 × 1023.
Число Авогадро (постоянная Авогадро, NA) — число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.

Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль — международная единица количества вещества, которая
показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества. Один моль любого вещества
содержит 6.02 × 1023 атомов/молекул/ионов — вот самое важное, что сейчас нужно понять.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии
обозначается N, ν (по греч. читается «ню»).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 1023 молекул воды и 12.04 × 1023 атомов углерода.

Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти
количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса — M
Молярная масса — масса одного моля вещества, выражается в «г/моль» (грамм/моль). Численно совпадает с изученной нами ранее
относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (CaCO3) = Ar(Ca) + Ar(C) + (3 × Ar(O)) = 40 + 12 + (3 × 16) = 100 г/моль
M (HCl) = Ar(H) + Ar(Cl) = 1 + 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали
молярные массы — массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 1023 молекул),
молекулярные массы отличаются. Так, 6.02 × 1023 молекул N2 весят 28 грамм, а такое же количество молекул
HCl — 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково — 6.02 × 1023, в их состав входят разные атомы, поэтому и
массы получаются разные.

Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции.
Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные
массы были найдены нам уже чуть раньше, что ускорит ход решения.

ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать
количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 1023 молекул азота, 3.01 × 1023 молекул CaCO3 и 18.06 × 1023 молекул
HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать
моль и число Авогадро.

Теперь вы всесторонне посвящены в тему. Надеюсь, что вы поняли, как связаны молярная масса, число Авогадро и количество вещества.
Практика — лучший учитель. Найдите самостоятельно подобные значения для оставшихся CaCO3 и HCl.
Молярный объем
Молярный объем — объем, занимаемый одним молем вещества. Примерно одинаков для всех газов при стандартной температуре
и давлении составляет 22.4 л/моль. Он обозначается как — VM.
Подключим к нашей системе еще одно понятие. Предлагаю найти количество вещества, количество молекул и массу газа объемом
33.6 литра. Поскольку показательно молярного объема при н.у. — константа (22.4 л/моль), то совершенно неважно, какой газ мы
возьмем: хлор, азот или сероводород.
Запомните, что 1 моль любого газа занимает объем 22.4 литра. Итак, приступим к решению задачи. Поскольку какой-то газ
все же надо выбрать, выберем хлор — Cl2.


Моль (количество вещества) — самое гибкое из всех понятий в химии. Количество вещества позволяет вам перейти и к
числу Авогадро, и к массе, и к объему. Если вы усвоили это, то главная задача данной статьи — выполнена 

Относительная плотность и газы — D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество
легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или
воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу
газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере.
Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5

Предлагаю самостоятельно решить следующую задачку (ниже вы найдете решение): «Плотность неизвестного вещества по
кислороду 3.5, найдите молярную массу неизвестного вещества»

Относительная плотность и водный раствор — ρ
Пишу об этом из-за исключительной важности в решении
сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы
измерения плотности: г/мл, г/см3, кг/м3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не
запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении — так
вы точно не запутаетесь.

Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки,
если вы будете следовать моему правилу и относится к обозначенным условным единицам «как к числам», то не запутаетесь.
В ходе ваших действий «грамм» и «грамм» должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае
вы бы получили граммы в квадрате 
К примеру, даны масса раствора HCl — 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.

Массовая доля — ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит
как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю
в долях от единицы, если хотите получить в процентах — его нужно умножить на 100%. Продемонстрирую это на примере.

Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Формулы по химии для ЕГЭ: формулы для решения задач по химии
- 09.11.2013
Отличный рукописный сборник самых главных формул, которые необходимы для того, чтобы научиться правильно решать задачи по химии.
Рекомендуем для тех, кто хочет сдать ЕГЭ по химии на высокий балл и не допустить самых разных ошибок при решении задач.
Эти формулы используются в заданиях Части А, Части В и части С по химии.
Смотреть в PDF:
Или прямо сейчас: Скачайте в pdf файле.
Добавить комментарий
Комментарии без регистрации. Несодержательные сообщения удаляются.
25 апреля 2020г.
Так как химия наука точная, она неразрывно связана с различного рода вычислениями. Чтобы решать задачи, нужно знать формулы и хорошо в них ориентироваться. Без этих базовых знаний и навыков изучение химии становится невозможным.
Мы собрали для вас основные химические формулы, изучаемые в школьном курсе. Они пригодятся каждому ученику, особенно тем, кто будет сдавать ОГЭ или ЕГЭ по этому непростому, но очень интересному предмету.
Нахождение количества вещества
Первое и основное понятие, которое необходимо усвоить – это количество вещества, измеряемое в молях и обозначающееся латинской буквой «n». Для его нахождения нужно основываться на условии задачи, так как вычислить количество вещества можно по трём формулам:
1) По массе. n=m/M — Массу вещества (в граммах) разделить на его молярную массу (в г/моль).
2) По объёму. n=V/Vm — Отношением объёма вещества к его молярному объёму (используется для газов).
3) По числу молекул. n=N/NA – Число молекул вещества делённое на число Авогадро. Число Авогадро (NA) – физическая величина, указывающая на число молекул, содержащихся в 1 моле вещества, и численно равная 6,0221 * 1023 моль-1.
Формулы для нахождения массы
Массу вещества можно найти несколькими способами:
1. Умножив количество вещества на молярную массу: m (г) = n (моль)×M (г/моль).
2. Произведением объёма раствора и его плотности: m = V (л) ×ρ (г/л).
3. Перемножив массовую долю с массой раствора: m = m(р-ра) × ω.
Молярная масса (М) – это масса одного моля вещества. Вычисляется она следующим образом: посредством сложения атомных масс элементов, из которых состоит вещество, получаем относительную молекулярную массу. Молярная масса численно равна относительной молекулярной массе, но имеет размерность «г/моль». Также молярную массу можно найти с помощью отношения массы вещества к его количеству:
M = m/n
Формулы для нахождения объёма
Для вычисления объёма того или иного вещества можно воспользоваться одной из формул:
1. Объём раствора находится как отношение массы раствора к его плотности:
V(р-ра) = m(р-ра) / ρ
2. Объём газа равен отношению его количества вещества к молярному объёму:
V(газа) = n/VM
Молярный объём (VM) – объём, который занимает 1 моль вещества при определённых показателях давления и температуры. Находится при делении молярной массы вещества на его плотность:
VM = M/ρ
При нормальных условиях молярный объём газа равен 22,4 л/моль.
Формулы для нахождения плотности и относительной плотности
Плотность (ρ) – физическая величина, указывающая на массу определённого вещества, содержащуюся в единице объёма.
Следовательно, формула для её вычисления имеет вид:
ρ=m/V
Помимо основной, существует формула для нахождения плотности газа при нормальных условиях, где молярная масса делится на молярный объём газа при н.у.:
ρ=M/VM
Относительная плотность (D) газов – величина, указывающая насколько одно вещество тяжелее или легче другого. Вычисляется она отношением молярных масс газов:
D = M(1) / M(2)
Например, условием было найти плотность газа по водороду. Решение будет иметь вид: D = M(газа)/M(H2) = M(газа)/2. Относительная плотность является безразмерной величиной.
Формулы для нахождения концентрации
Молярная концентрация (С) – отношение количества растворённого вещества к объёму раствора. Единица измерения – моль/л. Молярная концентрация вычисляется по формуле:
С = n/V
Массовая концентрация чаще всего называется титром (Т). Это отношение массы растворённого вещества к объёму раствора. Единица измерения — г/л.
T = m/V
Массовая доля (ω) – это один из вариантов выражения концентрации. С её помощью можно вычислить процентное содержание растворённого вещества в общей массе раствора:
ω = (mр.в./mр-ра) × 100%
По такому же принципу вычисляется массовая доля определённого компонента в смеси:
ω = (mкомпонента / mсистемы) × 100%
Если возникает необходимость найти массовую долю химического элемента в соединении, то нужно относительную атомную массу этого элемента умножить на число атомов в соединении и разделить на молекулярную массу вещества:
ω = (Ar × N) / M
Формулы для нахождения выхода продукта реакции
Под выходом продукта реакции (ᶯ) подразумевается отношение массы (объёма, количества) вещества, полученного на практике, к теоретически возможному (рассчитанному по уравнению реакции). Единица измерения – доля, а проценты — если результат умножить на 100 !
Для его вычисления, в зависимости от условия задачи, используются следующие формулы:
ᶯ=(mпракт./mтеорет.) × 100%
ᶯ=(Vпракт./Vтеорет.) × 100%
ᶯ=(nпракт./nтеорет.) × 100%
Попрактиковать решение задач и знание формул возможно в приложении «ХиШник». Оно содержит в себе каталог заданий, которые, в свою очередь, разделены по темам и уровням сложности. Если вы дали неверный ответ, то приложение не просто уведомит об этом, а предложит правильный алгоритм решения. Также в нём есть раздел для подготовки к ОГЭ и ЕГЭ, в котором собраны типовые задания.
Знание расчётных формул – это ключевой момент при решении задач. Главное, понимать их, а не бездумно заучивать. Так как они будут использоваться не только в школьных задачах, на ЕГЭ и ОГЭ, но и в дальнейшей жизни, даже если ваша профессиональная сфера будет далека от химии.
Формулы
для решения задач по химии:
n(в-ва) —
количество вещества в молях;
m(в-ва) —
масса вещества в граммах;
M(в-ва) —
молярная масса в ;
V(в-ва) —
объем газообразного вещества при нормальных условиях в л;
Vm(в-ва) —
постоянная величина=22,4;
N(ед) –
число структурных единиц (молекул, атомов);
N(A) – Число
Авогадро-постоянная величина=;
P –
давление в Па
R – универсальная
газовая постоянная 8,31
T — температура
в К
(в-ва) – массовая
доля вещества в растворе в %;
m(в-ва) –
масса вещества в растворе в г;
m(р-ра) –
масса всего раствора в г;
𝜑(в-ва) –
объемная доля газообразного вещества в смеси в %;
V(смеси) –
объем газовой смеси в л;
,
.
Формулы
на растворы:
(в-ва) – массовая
доля вещества в растворе в %;
Cm(в-ва) –
молярная концентрация вещества в растворе в %;
Cmэ(в-ва) –
молярная концентрация эквивалента вещества в растворе в %;
T(в-ва) –
титр в %;
X(в-ва) –
мольная доля вещества в растворе в %.