Под этими номерами вам попадутся задачи на темы:
- Расчет с использованием понятия «массовая доля вещества в растворе»
- Расчет массы вещества или объемов газа по известному количеству вещества, массе или объему одного из участвующих в реакции веществ.
Формулы, которые вам понадобятся для решения этих задач:
- Зная молярную массу вещества M, можно рассчитать количество вещества (число молей) n в любой данной массе m этого вещества по формуле:
- Зная молярный объем газа Vm, можно рассчитать объем V любого количества n по формуле:
V = Vm* n
$V_m = 22,4 text{ л/моль}$
-
Плотность любого вещества ρ — это отношение массы этого вещества m к его объему V:
$rho = displaystyle frac{m}{V}$
-
Соотношение между давлением газа P, его объемом V, количеством вещества (газа) n и температурой T описывается уравнением Менделеева-Клапейрона (уравнение состояния идеального газа)
PV = nRT
$R =8,314text{ Дж/Моль} cdot K$
-
При расчетах, связанных со смесями двух или нескольких газов, часто используют понятие объемная доля газа в смеси, которая обозначается буквой φ (фи):
$varphi $ (газа) $=displaystyle frac{Vtext{(газа)}}{Vtext{(смеси)}} cdot 100%$
-
При протекании химических реакции всегда происходят «потери» веществ или имеет место неполное превращение исходных веществ в продукты реакции, в результате чего практически образующаяся масса того или иного продукта реакции оказывается меньше, чем теоретически рассчитанная по уравнению реакции. В этом случае говорят о практическом выходе, или просто выходе продукта реакции, который обозначается греческой буквой η (эта):
$eta = displaystyle frac{m(text{практ.})}{m(text{теор.})} cdot 100%$
-
Массовая доля вещества, находится по формуле:
$omega = displaystyle frac{m(text{вещества})}{m(text{раствора})} cdot 100%$
Рассчитаем молярную массу — AlCl3
M(AlCl3) = 1 * Mr(Al) + 3 * Mr(Cl) = 1 * 27 + 3 * 35,5 = 133,5 г/моль
За это задание ты можешь получить 1 балл. На решение дается около 2 минут. Уровень сложности: базовый.
Средний процент выполнения: 65.8%
Ответом к заданию 27 по химии может быть целое число или конечная десятичная дробь.
Разбор сложных заданий в тг-канале
Задачи для практики
Задача 1
Рассчитайте массу газа, образующегося при взаимодействии с избытком кислорода 30,24 л (н. у.) оксида азота(II). (Запишите число с точностью до десятых.) Ответ в (г).
Решение
$2NO+O _2 →2NO_2$
V (NO)=30.24 л
n(NO)= 1.35 моль
n (NO)=n($NO_2$), так как коэффициенты при веществах равны
m ($NO_2$)=1.35⋅M
m ($NO_2$)=1.35⋅46=62.1 г
Ответ: 62.1
Задача 2
В результате осуществления реакции, термохимическое уравнение которой $СаО_{(тв.)} + Н_2О_{(ж)} = Са(ОН)_{2(тв.)} + 70 кДж$, было получено 185 г гидроксида кальция. Вычислите количество выделившейся теплоты. (Запишите число с точностью до целых.) Ответ в (кДж).
Решение
$СаО+H_2O=Ca(OH)_2 +70кДж$
70кДж выделяется при образовании 1моля гидроксида кальция $Са(ОН)_2$. Переходим от количества вещества к массе и получаем, что такое количество теплоты выделится при получении 1моль*74г/моль=74г гидроксида кальция. Составим пропорцию и найдем количество выделившейся теплоты: 74г — 70кДж 185г — X кДж
X=70*185/74=175кДж
Ответ: 175
Задача 3
Какой объём (н. у.) оксида углерода(II) нужно окислить оксидом железа(II) для получения 64 л (н. у.) оксида углерода(IV)? (Запишите число с точностью до целых.) Ответ в (л).
Решение
$СО + FeО = СО_2 + Fe$
Количество вещества для газов пропорционально их объёму, поэтому отношение объёмов газов в одной реакции равно отношению их коэффициентов:
V(СО) : V($СО_2$) = n(СО) : n($СО_2$) = 1 : 1
V(СО) = 64 л
Ответ: 64
Задача 4
Какой объём (н. у.) кислорода необходим для получения 80 л (н. у.) оксида углерода(IV) из угля? (Запишите число с точностью до целых.) Ответ в (л).
Решение
$C + O_2 = CO_2$
Количество вещества для газов пропорционально их объёму, поэтому отношение объёмов газов в одной реакции равно отношению их коэффициентов:
V($O_2$) : V($СО_2$) = n($O_2$) : n($СО_2$) = 1 : 1
V($O_2$) = 80 л
Ответ: 80
Задача 5
В результате реакции, термохимическое уравнение которой $NH_4NO_{2(тв.)} = N_{2(г)} + 2H_2O_{(ж)} + 316 кДж$, выделилось 94,8 кДж теплоты. Сколько граммов нитрита аммония вступило в реакцию? (Запишите число с точностью до десятых.) Ответ в (г).
Решение
Найдем моли реакции, разделив данное количество теплоты на количество теплоты на 1 моль:
n($NH_4NO_2$) = 94.8/316 = 0.3 моль
Найдем массу нитрита, умножив его количество на молярную массу:
m($NH_4NO_2$) = 0.3*64 = 19.2 г.
Ответ: 19.2
Задача 6
Какой объём кислорода необходим для окисления 46 л оксида серы(IV) в оксид серы(VI)? Объёмы газов измерены при одинаковых условиях. (Запишите число с точностью до целых.) Ответ в (л).
Решение
$2SO_2 + O_2 = 2SO_3$
Количество вещества для газов пропорционально их объёму, поэтому отношение объёмов газов в одной реакции равно отношению их коэффициентов:
V($O_2$) : V($SO_2$) = n($O_2$) : n($SO_2$) = 1 : 2
V($O_2$) = V($SO_2$) : 2
V($O_2$) = 46 : 2 = 23 л
Ответ: 23
Задача 7
Какой объём (н. у.) водорода теоретически необходим для синтеза 100 л (н. у.) аммиака? (Запишите число с точностью до целых.) Ответ в (л).
Решение
$N_2 + 3H_2 = 2NH_3$
Моли аммиака в реакции в полтора раза меньше моль водорода (коэффициенты 2 и 3), поэтому рассчитаем объем затраченного водорода:
$V(H_2) = 100 ⋅ 1.5 = 150$ л.
Ответ: 150
Задача 8
В соответствии с термохимическим уравнением реакции
2Mg(тв.) + O2(г) = 2MgO(тв.) + 1200 кДж выделилось 360 кДж теплоты.
Рассчитайте массу полученного оксида магния. (Запишите число с точностью до целых.) Ответ в (г).
Решение
По уравнению реакции находим количество вещества MgO:
$2Mg_{(тв.)} + O_{2(г)} = {{2MgO_{(тв.)}}↖{x}}/{2 моль} + {{1200 кДж}↖{360 кДж}}/{1200 кДж}$
x = 2 · 360 / 1200 = 0.6 моль MgO.
Находим массу MgO:
$n = m_{в-ва} / М_{в-ва}$
M(MgO) = 40 г/моль; m(MgO) = 0.6 · 40 = 24 г
Ответ: 24
Задача 9
Какой объём хлора (объёмы газов измерены при одинаковых условиях) теоретически вступает в реакцию с 56 л водорода? (Запишите число с точностью до целых.) Ответ в (л).
Решение
Основные формулы для расчёта:
$n = V_г /V_M$; $n = m_{в-ва} / М_{в-ва}$
1) Составляем уравнение реакции:
$H_{2(г)} + Cl_{2(г)} = 2HCl_{(г)}$
2) Логическая связь:
Требуется найти объём хлора, расчёт будем производить по количеству вещества водорода.
3) Расчёт по уравнению реакции.
Только для расчёта объёма реагирующих газов:
объёмы реагирующих газов относятся как коэффициенты в уравнении реакции:
$V(H_2) / 1 = V(Cl_2) / 1$
56 / 1 = x / 1
x = 56.
Ответ: 56
Рекомендуемые курсы подготовки
Занятие по химии на тему : «Решение задач на растворы» (задания ЕГЭ №27 )
Подготовила:
учитель химии
МКОУ Аверьяновская СОШ
Кизлярского района
ИСМАИЛОВА ХАДИЖАТ АМИРАРСЛАНОВНА
— массовая доля вещества в растворе
𝙢 р.в = × 𝙢 р-ра
𝙢 р-ра = 𝙢 р.в (соли)+ 𝙢 растворителя (воды)
27 задания, по оказываемым воздействиям на первоначальный раствор, условно делим на три группы:
I гр
1-й раствор (воздействия)
2-й раствор
а) разбавление
II гр
б) выпаривание
Изменяется только 𝙢 р-ра ,
+ 𝙢 (воды)
а 𝙢 р.в остается такой же
1-й раствор (воздействия)
— 𝙢 (воды)
2-й раствор
а) добавление соли
Изменяются 𝙢 р.в и 𝙢 р-ра
б) выпадение соли в осадок
III гр
+ 𝙢 (соли)
1-й раствор (воздействия)
— 𝙢 (соли)
3-й раствор
Приливают 2-й раствор
3 раствор
Изменяются 𝙢 р.в и 𝙢 р-ра
𝙢 (1 р.в) + 𝙢 (2 р.в)
𝙢 (1 р-ра) + 𝙢 (2 р-ра)
либо дана по условию, либо вычисляем.
Чтобы выразить в %, умножаем на 100 %.
Чтобы выразить в долях, % делим на 100%.
1. Упариванием 500 г раствора с массовой долей соли 10 % получен раствор с массовой долей соли 14 % . Вычислите массу выпаренной при этом воды. Ответ укажите в граммах с точностью до целых.
=
𝙢 р.в
×
𝙢 р-ра
𝙢 р.в
По условию задачи:
- Определяем, что известно для 1-го и 2-го растворов и заносим в таблицу;
- Определяем какое воздействие оказано на 1-й раствор;
- Определяем, что надо найти и обозначаем ее через 𝝌 ;
- Составляем уравнение с одним неизвестным и решаем;
- Ответ округляем по условию задачи.
=
×
1 р-р
50
0,1
=
×
50
500
0,1
=
×
1 р-р
0,14
=
50
2–й р-р
×
×
0,14
50
=
2–й р-р
(500 – 𝝌)
50 = 0,14 × (500- 𝝌 )
50 = 70 – 0,14 𝝌
0,14 𝝌 = 70-50
× 𝝌 = 20 : 0,14
𝝌 = 142, 9
ответ до целых: 143г
2. К 240 г раствора с массовой долей соли 10% добавили 160 мл воды. Вычислите массовую долю соли в полученном растворе. Ответ дайте в процентах с точностью до целых .
𝙢 р-ра
𝙢 р.в
По условию задачи:
- Определяем, что известно для 1-го и 2-го растворов и заносим в таблицу;
- Определяем какое воздействие оказано на 1-й раствор;
- Определяем, что надо найти и обозначаем ее через 𝝌 ;
- Составляем уравнение с одним неизвестным и решаем;
- Ответ округляем по условию задачи.
=
×
24
0,1
240
=
×
1-й р-р
𝝌
24
(240 +160)
2–й р-р
=
×
24 = 𝝌 × 400
𝝌 = 24: 400
𝝌 = 0,06
ответ в процентах до целых:
0,06 × 100% = 6%
3. К 75 г раствора с массовой долей соли 14% добавили 10 г этой же соли и 10 мл воды . Вычислите массовую долю соли в полученном растворе ( в процентах). (Запишите число с точностью до десятых.)
𝙢 р-ра
𝙢 р.в
По условию задачи:
- Определяем, что известно для 1-го и 2-го растворов и заносим в таблицу;
- Определяем какое воздействие оказано на 1-й раствор;
- Определяем, что надо найти и обозначаем ее через 𝝌 ;
- Составляем уравнение с одним неизвестным и решаем;
- Ответ округляем по условию задачи.
=
×
10,5
75
0,14
=
×
1-й р-р
𝝌
10,5+10
(75+10 +10)
2–й р-р
=
×
20,5 = 𝝌 × 95
𝝌 = 20,5: 95
𝝌 = 0,216
ответ в процентах до десятых:
0,216 × 100% = 21,6%
6
4. При охлаждении 400 г горячего 50%-го раствора нитрата калия выпал осадок , не содержащий кристаллизационной воды. Чему равна масса осадка (в г), если раствор над осадком содержал 34% нитрата калия по массе? Ответ округлите до ближайшего целого числа.
𝙢 р-ра
𝙢 р.в
По условию задачи:
- Определяем, что известно для 1-го и 2-го растворов и заносим в таблицу;
- Определяем какое воздействие оказано на 1-й раствор;
- Определяем, что надо найти и обозначаем ее через 𝝌 ;
- Составляем уравнение с одним неизвестным и решаем;
- Ответ округляем по условию задачи.
=
×
200
400
0,5
=
×
1-й р-р
0,34
200 — 𝝌
2–й р-р
(400- 𝝌)
=
×
200 — 𝝌 = 0,34 × (400- 𝝌 )
200 — 𝝌 = 136 – 0,34 𝝌
200 — 136 = 𝝌 — 0,34 𝝌
64 = 0, 66 𝝌
𝝌 = 64:0,66
𝝌 =96,97
ответ до целого числа: 97г
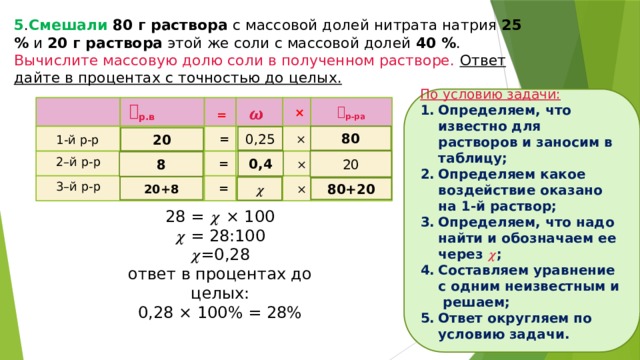
5 . Смешали 80 г раствора с массовой долей нитрата натрия 25 % и 20 г раствора этой же соли с массовой долей 40 % . Вычислите массовую долю соли в полученном растворе. Ответ дайте в процентах с точностью до целых.
По условию задачи:
- Определяем, что известно для растворов и заносим в таблицу;
- Определяем какое воздействие оказано на 1-й раствор;
- Определяем, что надо найти и обозначаем ее через 𝝌 ;
- Составляем уравнение с одним неизвестным и решаем;
- Ответ округляем по условию задачи.
𝙢 р-ра
𝙢 р.в
×
=
80
0,25
20
=
×
1-й р-р
20
0,4
2–й р-р
8
=
×
3–й р-р
20+8
𝝌
80+20
=
×
28 = 𝝌 × 100
𝝌 = 28:100
𝝌 =0,28
ответ в процентах до целых:
0,28 × 100% = 28%
8
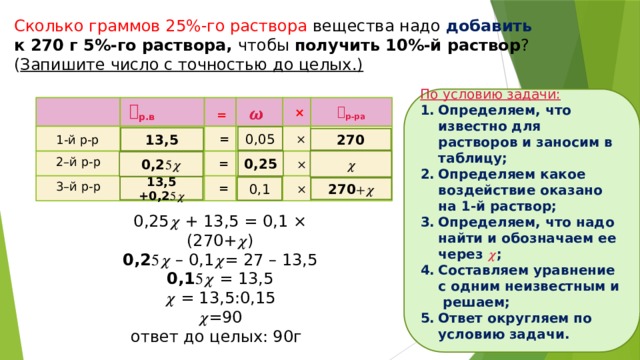
Сколько граммов 25%-го раствора вещества надо добавить к 270 г 5%-го раствора, чтобы получить 10%-й раствор ? ( Запишите число с точностью до целых.)
По условию задачи:
- Определяем, что известно для растворов и заносим в таблицу;
- Определяем какое воздействие оказано на 1-й раствор;
- Определяем, что надо найти и обозначаем ее через 𝝌 ;
- Составляем уравнение с одним неизвестным и решаем;
- Ответ округляем по условию задачи.
𝙢 р-ра
𝙢 р.в
×
=
0,05
13,5
270
=
×
1-й р-р
𝝌
0,25
2–й р-р
0,25𝝌
=
×
3–й р-р
13,5 +0,25𝝌
0,1
270+𝝌
=
×
0,25 𝝌 + 13,5 = 0,1 × (270+ 𝝌 )
0,25𝝌 – 0,1 𝝌 = 27 – 13,5
0,15𝝌 = 13,5
𝝌 = 13,5:0,15
𝝌 =90
ответ до целых: 90г 0
9
Задания для закрепления:
1. При выпаривании 25%-го водного раствора получено 60 г сухого вещества. Вычислите массу испарившейся воды. Ответ дайте в граммах с точностью до целых.
Ответ: 180
2. Вычислите массу гидроксида калия, который необходимо растворить в 150 г воды для получения раствора с массовой долей щёлочи 25 %. Ответ дайте в граммах с точностью до целых.
Ответ: 50
3.Растворяя соль в горячей воде, приготовили 300 г 40%-го раствора. При охлаждении раствора из него выпало 50 г осадка безводной соли. Вычислите массовую долю соли в растворе над осадком. Ответ дайте в процентах с точностью до целых.
Ответ: 40
4. Вычислите массу твёрдого нитрата аммония, который надо добавить к 210 г воды, чтобы получить 16%-й раствор соли. Ответ укажите в граммах с точностью до целых.
Ответ: 40
Спасибо за внимание!
9
В этой статье мы коснемся нескольких краеугольных понятий в химии, без которых совершенно невозможно
решение задач. Старайтесь понять смысл физических величин, чтобы усвоить эту тему.
Я постараюсь приводить как можно больше примеров по ходу этой статьи, в ходе изучения вы увидите множество примеров
по данной теме.

Относительная атомная масса — Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической
таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса — Mr
Относительная молекулярная масса складывается из суммы относительных атомных масс всех атомов, входящих в состав вещества.
В качестве примера найдем относительные молекулярные массы кислорода, воды, перманганата калия и медного купороса:
Mr (O2) = (2 × Ar(O)) = 2 × 16 = 32
Mr (H2O) = (2 × Ar(H)) + Ar(O) = (2 × 1) + 16 = 18
Mr (KMnO4) = Ar(K) + Ar(Mn) + (4 × Ar(O)) = 39 + 55 + (4 * 16) = 158
Mr (CuSO4*5H2O) = Ar(Cu) + Ar(S) + (4 × Ar(O)) + (5 × ((Ar(H) × 2) +
Ar(O))) = 64 + 32 + (4 × 16) + (5 × ((1 × 2) + 16)) = 160 + 5 * 18 = 250
Моль и число Авогадро
Моль — единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц
этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12C, т.е. 6 × 1023.
Число Авогадро (постоянная Авогадро, NA) — число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.

Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль — международная единица количества вещества, которая
показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества. Один моль любого вещества
содержит 6.02 × 1023 атомов/молекул/ионов — вот самое важное, что сейчас нужно понять.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии
обозначается N, ν (по греч. читается «ню»).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 1023 молекул воды и 12.04 × 1023 атомов углерода.

Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти
количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса — M
Молярная масса — масса одного моля вещества, выражается в «г/моль» (грамм/моль). Численно совпадает с изученной нами ранее
относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (CaCO3) = Ar(Ca) + Ar(C) + (3 × Ar(O)) = 40 + 12 + (3 × 16) = 100 г/моль
M (HCl) = Ar(H) + Ar(Cl) = 1 + 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали
молярные массы — массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 1023 молекул),
молекулярные массы отличаются. Так, 6.02 × 1023 молекул N2 весят 28 грамм, а такое же количество молекул
HCl — 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково — 6.02 × 1023, в их состав входят разные атомы, поэтому и
массы получаются разные.

Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции.
Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные
массы были найдены нам уже чуть раньше, что ускорит ход решения.

ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать
количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 1023 молекул азота, 3.01 × 1023 молекул CaCO3 и 18.06 × 1023 молекул
HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать
моль и число Авогадро.

Теперь вы всесторонне посвящены в тему. Надеюсь, что вы поняли, как связаны молярная масса, число Авогадро и количество вещества.
Практика — лучший учитель. Найдите самостоятельно подобные значения для оставшихся CaCO3 и HCl.
Молярный объем
Молярный объем — объем, занимаемый одним молем вещества. Примерно одинаков для всех газов при стандартной температуре
и давлении составляет 22.4 л/моль. Он обозначается как — VM.
Подключим к нашей системе еще одно понятие. Предлагаю найти количество вещества, количество молекул и массу газа объемом
33.6 литра. Поскольку показательно молярного объема при н.у. — константа (22.4 л/моль), то совершенно неважно, какой газ мы
возьмем: хлор, азот или сероводород.
Запомните, что 1 моль любого газа занимает объем 22.4 литра. Итак, приступим к решению задачи. Поскольку какой-то газ
все же надо выбрать, выберем хлор — Cl2.


Моль (количество вещества) — самое гибкое из всех понятий в химии. Количество вещества позволяет вам перейти и к
числу Авогадро, и к массе, и к объему. Если вы усвоили это, то главная задача данной статьи — выполнена 

Относительная плотность и газы — D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество
легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или
воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу
газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере.
Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5

Предлагаю самостоятельно решить следующую задачку (ниже вы найдете решение): «Плотность неизвестного вещества по
кислороду 3.5, найдите молярную массу неизвестного вещества»

Относительная плотность и водный раствор — ρ
Пишу об этом из-за исключительной важности в решении
сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы
измерения плотности: г/мл, г/см3, кг/м3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не
запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении — так
вы точно не запутаетесь.

Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки,
если вы будете следовать моему правилу и относится к обозначенным условным единицам «как к числам», то не запутаетесь.
В ходе ваших действий «грамм» и «грамм» должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае
вы бы получили граммы в квадрате 
К примеру, даны масса раствора HCl — 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.

Массовая доля — ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит
как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю
в долях от единицы, если хотите получить в процентах — его нужно умножить на 100%. Продемонстрирую это на примере.

Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Статьи
Среднее общее образование
Линия УМК О. С. Габриеляна. Химия (10-11) (Б)
Химия
Представляем вашему вниманию разбор 27 задания ЕГЭ-2019 по химии.
29 октября 2018
Блок «Химическая реакция. Методы познания в химии. Химия и жизнь. Расчеты по химическим формулам и уравнениям реакций»
Усвоение элементов содержания этого блока проверяется заданиями различного уровня сложности, в их числе 4 задания базового уровня сложности, 4 задания повышенного уровня сложности и 2 задания высокого уровня сложности.
Элементы содержания блока имеют прикладной и практико-ориентированный характер, что обусловливает некоторую особенность заданий, ориентированных на проверку усвоения данного материала.
Выполнение заданий этого блока предусматривает проверку сформированности следующих умений: использовать в конкретных ситуациях знания о применении изученных веществ и химических процессов, а также о промышленных методах получения некоторых веществ и способах их переработки; планировать проведение эксперимента по получению и распознаванию важнейших неорганических и органических веществ на основе приобретённых знаний о правилах безопасной работы с веществами в быту; проводить вычисления по химическим формулам и уравнениям.
Некоторые из элементов содержания данного блока, такие как определение характера среды водных растворов веществ, индикаторы, расчёты массовой или объёмной доли выхода продукта реакции от теоретически возможного, расчёты массовой доли (массы) химического соединения в смеси, проверялись в рамках одного задания в комплексе с другими элементами содержания.
Рассмотрим задания этого блока из демонстрационного варианта.
#ADVERTISING_INSERT#
В контрольной работе ЕГЭ по химии большая роль отведена расчетным задачам. Это объясняется тем, что при их решении необходимо опираться на знания химических свойств соединений, использовать умение составлять уравнения химических реакций, т.е. использовать во взаимосвязи теоретическую базу и определенные операционно-логические и вычислительные навыки.
Решение расчётных задач требует знания химических свойств веществ и предполагает осуществление некоторой совокупности действий, обеспечивающих получение правильного ответа. К таким действиям относятся:
- составление уравнений химических реакций (в соответствии с условием задачи), необходимых для выполнения стехиометрических расчетов;
- выполнение расчетов, необходимых для нахождения ответов на поставленные в условии задачи вопросы;
- формулирование логически обоснованного ответа на все поставленные в условии задания вопросы (например, определить физическую величину – массу, объём, массовую долю вещества).
Однако следует иметь в виду, что не все названные действия обязательно должны присутствовать при решении любой расчетной задачи, а в отдельных случаях некоторые из них могут использоваться неоднократно.
Согласно кодификатору элементов содержания и требований к уровню подготовки выпускников образовательных организаций для проведения единого государственного экзамена по химии учащиеся должны уметь проводить следующие расчеты по химическим формулам и уравнениям реакций:
- расчеты с использованием понятия «массовая доля вещества в растворе»;
- расчеты объемных отношений газов при химических реакциях;
- расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ;
- расчеты теплового эффекта реакции;
- расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси);
- расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества;
- установление молекулярной и структурной формулы вещества;
- расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного;
- расчеты массовой доли (массы) химического соединения в смеси.
При решении расчетных задач школьники часто допускают следующие типичные ошибки:
- не делают различия между массой раствора и массой растворенного вещества;
- при нахождении количества газообразного вещества делят его массу на молярный объем или, наоборот, делят объем газообразного вещества на его молярную массу;
- забывают расставить коэффициенты в уравнениях реакций;
- не находят, какое вещество в избытке (эта ошибка может быть связана также с отсутствием навыка решения задач на «избыток – недостаток»);
- при расчетах неправильно преобразовывают математические формулы, не задумываясь при этом об абсурдности полученного ответа (например, производят умножение, а не деление массы растворенного вещества на его массовую долю при нахождении массы раствора).
Большинство расчетных задач лучше решать в молях, так как этот способ является более рациональным. Однако сам способ решения и его рациональность при оценивании расчетных задач не учитываются. Главное, чтобы ученик продемонстрировал логику предложенного им способа решения и в соответствии с ним выполнил правильные вычисления, которые должны привести его к верному ответу.
Анализ результатов выполнения расчетных задач в 2018 г. показывает, что расчетные задачи даже базового уровня сложности вызывают у школьников затруднения. В первую очередь это касается заданий 28 и 29. В задаче 28 необходимо провести расчеты объёмных отношений газов при химических реакциях или расчёты по термохимическим уравнениям. С заданием 27, в котором необходимо произвести расчеты с использованием понятия «массовая доля вещества в растворе», школьники справляются более успешно.
При выполнении расчетных задач базового уровня сложности необходимо обращать внимание на размерность искомой величины (г, кг, л, м3 и др.) и степень точности ее округления (до целых, десятых, сотых и т.д).
Приведем расчетные задачи базового уровня сложности из демонстрационного варианта ЕГЭ 2019 г.
Задание 27
Вычислите массу нитрата калия (в граммах), которую следует растворить в 150,0 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%. Запишите число с точностью до десятых.
Ответ:___________________ г.
Правильный ответ – 3,4.
С заданием 27 в 2018 году успешно справились 61,2 % экзаменуемых.

ЕГЭ-2020. Химия. Сборник заданий: 600 заданий с ответами
Пособие содержит тренировочные задания базового и повышенного уровней сложности, сгруппированные по темам и типам. Задания расположены в такой же последовательности, как предлагается в экзаменационном варианте ЕГЭ. В начале каждого типа задания указаны проверяемые элементы содержания – темы, которые следует изучить, прежде чем приступать к выполнению. Пособие будет полезно учителям химии, так как дает возможность эффективно организовать учебный процесс на уроке, проведение текущего контроля знаний, а также подготовку учащихся к ЕГЭ.
Купить
В результате выполнения задания 27 ЕГЭ по химии проверяются следующие требования/умения:
Коды проверяемых требований к уровню подготовки (по кодификатору):
Читать подробнее…
Коды проверяемых элементов содержания (по кодификатору):
Уровень сложности задания:
Максимальный балл за выполнение задания:
Примерное время выполнения задания выпускником, изучавшим предмет:
Определите массу воды, которую нужно добавить к 50 г 20%-ной раствора соляной кислоты, чтобы она стала 10%-ной.
Ответ:___________________г.
(Запишите число с точностью до целых).
При упаривании 300 г 5%-ного раствора сахарозы получено 245 г раствора. Какова массовая доля сахарозы в нём? (Запишите число с точностью до целых.)
К 75 г раствора с массовой долей соли 14% добавили 10 г той же соли и 10 мл воды. Вычислите массовую долю соли в полученном растворе. (Запишите число с точностью до десятых.)
Ответ: _____%.
Вычислите массу хлорида бария (в граммах), которую следует растворить в 120 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%.
Ответ:____________________г.
(Запишите число с точностью до сотых.)
К 250 г 20%-ной серной кислоты добавили 50 мл 60%-ной кислоты (плотностью 1,6 г/мл). Какова массовая доля кислоты в полученном растворе? (Запишите число с точностью до целых.)
К 105 г раствора с массовой долей хлорида натрия 10% добавили 40 мл воды и 10 г соли. Определите массовую долю соли в полученном растворе.
Ответ:____________________%.
(Запишите число с точностью до десятых.)
Сколько граммов едкого натра следует растворить в 300 г 5%-ного раствора для получения 10%-ного раствора NaOH? (Запишите число с точностью до десятых.)
К 300 г раствора с массовой долей бромида кальция 6% добавили 50 мл воды и 20 г соли. Определите массовую долю соли в полученном растворе.
Ответ:___________________%.
(Запишите число с точностью до десятых.)
Сколько граммов воды нужно испарить из 500 г 10%-ного раствора гидроксида натрия, чтобы увеличить его массовую долю в 1,5 раза?
Ответ:_______________________г.
(Запишите число с точностью до целых.)
Упариванием 500 г раствора с массовой долей соли 10% получен раствор с массовой долей соли 14%. Какова масса выпаренной при этом воды? (Запишите число с точностью до целых.)
№ 27.
1.Определите массу воды, которую надо выпарить из 50 г 3%-ного раствора поваренной соли для получения раствора с массовой долей соли 10%. (Запишите число с точностью до целых.)
2. Вычислите массу нитрата калия (в граммах), которую следует растворить в 150 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%. (Запишите число с точностью до десятых.)
3. К 70 г раствора с массовой долей хлорида кальция 40% добавили 18 мл воды и 12 г этой же соли. Массовая доля соли в полученном растворе равна __________%. (Запишите число с точностью до целых.)
4. Какую массу воды надо добавить к 50 г 70%-ного раствора серной кислоты для получения раствора с массовой долей кислоты 5%? (Запишите число с точностью до целых.)
5. К раствору нитрата кальция массой 80 г с массовой долей 4% добавили 1,8 г этой же соли. Массовая доля соли в полученном растворе равна _____ %. (Запишите число с точностью до десятых.)
6. Вычислите массу воды (в граммах), которую надо выпарить из 1 кг 3%-ного раствора сульфата меди для получения 5%-ного раствора. (Запишите число с точностью до целых.)
7. Вычислите массу уксусной кислоты, которую следует растворить в 150 г столового 5%-ного уксуса для получения 10%-ного раствора. (Запишите число с точностью до десятых.)
8. Определите массу 10%-ного раствора поваренной соли (в граммах), полученного при разбавлении 50 г раствора с массовой долей соли 30%? (Запишите число с точностью до целых.)
9. К 240 г раствора с массовой долей 10% добавили 160 мл воды. Определите массовую долю соли в полученном растворе. (Запишите число с точностью до целых.)
10. Смешали 80 г раствора с массовой долей нитрата натрия 10% и 120 г 25%-ного раствора этой же соли. Определите массовую долю соли в полученном растворе. (Запишите число с точностью до целых.)
11. Какую массу воды необходимо добавить к 150 г раствора гидроксида натрия с массовой долей 10%, чтобы получить раствор с массовой долей 2%? (Запишите число с точностью до целых.)
12. Какую массу воды необходимо выпарить из 500 г 4%-ного раствора гидроксида калия, чтобы получить раствор с массовой долей щелочи 10%? (Запишите число с точностью до целых.)
13. К 214 г 7%-ного раствора карбоната калия добавили 16 г этой же соли. Определите массовую долю соли в полученном растворе. (Запишите число с точностью до десятых.)
14. Смешали 250 г раствора с массовой долей соли 12% и 300 г раствора с массовой долей этой же соли 8%. Определите массовую долю соли в полученном растворе. (Запишите число с точностью до десятых.)
15. Из 150 г раствора с массовой долей бромида натрия 6% выпарили 10 г и добавили 5 г этой же соли. Определите массовую долю соли в полученном растворе. (Запишите число с точностью до десятых.)
16. Массовая доля ацетата натрия в растворе, полученном при добавлении 120 г воды к 200 г раствора с массовой долей соли 8%, равна _____ %. (Запишите число с точностью до целых.)
17. К 180 г 8%-ного раствора хлорида натрия добавили 20 г NaCl. Массовая доля хлорида натрия в образовавшемся растворе равна _____ %. (Запишите число с точностью до десятых.)
18. Какую массу нитрата натрия необходимо растворить в 200 г воды для получения раствора с массовой долей 20%? (Запишите число с точностью до целых.
19. При растворении в 270 г воды сульфата калия был получен раствор с массовой долей 10%. Масса растворенного K2SO4 равна _____ г. (Запишите число с точностью до целых.)
20. Определите массу воды, которую надо добавить к 20 г 70%-ного раствора уксусной кислоты для получения 3%-ного раствора уксуса. (Запишите число с точностью до целых.)
21. Смешали 250 г 16%-ного раствора гидроксида натрия и 300 мл 20%-ного (плотность 1,2 г/мл) раствора едкого натра. В полученный раствор добавили 50 мл воды. Рассчитайте массовую долю гидроксида натрия в растворе.
22. 200 мл 36,5%-ного раствора соляной кислоты (плотность 1,18 г/мл) оставили в открытой колбе в вытяжном шкафу, в результате концентрация кислоты снизилась до 30%. Рассчитайте массу испарившейся кислоты.
23. Какой объём (н.у.) бромоводорода необходимо растворить в 1 л воды для получения раствора с массовой долей 8,1%?