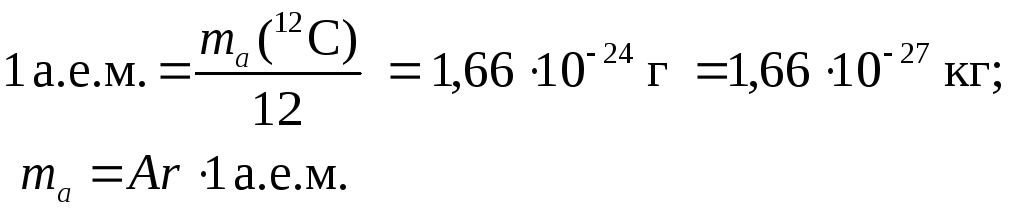Формулы по химии для ЕГЭ: формулы для решения задач по химии
- 09.11.2013
Отличный рукописный сборник самых главных формул, которые необходимы для того, чтобы научиться правильно решать задачи по химии.
Рекомендуем для тех, кто хочет сдать ЕГЭ по химии на высокий балл и не допустить самых разных ошибок при решении задач.
Эти формулы используются в заданиях Части А, Части В и части С по химии.
Смотреть в PDF:
Или прямо сейчас: Скачайте в pdf файле.
Добавить комментарий
Комментарии без регистрации. Несодержательные сообщения удаляются.
Основные формулы для решения задач
|
Величина |
Соотношение |
|
Атомная |
|
|
Порядковый |
Z |
|
Массовая |
|
|
Количество |
|
|
Количество |
н.у. |
|
Молярная |
|
|
Масса |
m(X) |
|
Молярный |
Vm |
|
Объем |
V |
|
Выход |
|
|
Плотность |
|
|
Плотность |
|
|
Плотность |
М(воздуха) |
|
Объединенный |
|
|
Уравнение |
PV |
|
Объемная |
|
|
Молярная |
|
|
Молярная |
|
|
Количество |
Q |
|
Тепловой |
Q |
|
Теплота |
|
|
Скорость |
|
|
Закон (для |
aA
u |
|
Правило |
|
|
Растворимость |
|
|
Массовая |
|
|
Масса |
m(р-р)
m(р-р) |
|
Массовая |
|
|
Плотность |
|
|
Объем |
|
|
Молярная |
|
|
Степень |
|
|
Ионное |
K(H2O) |
|
Водородный |
рН = –lg[H+] |
Рекомендуемая литература
Основная:
Кузнецова
Н.Е. и др.
Химия. 8 кл-10 кл.. – М.: Вентана-Граф,
2005-2007.
Кузнецова
Н.Е., Литвинова Т.Н., Левкин А.Н.
Химия.11 класс в 2-х частях, 2005-2007 гг.
Егоров
А.С. Химия.
Новое учебное пособие для подготовки
в вузы. Ростов н/Д: Феникс, 2004.– 640 с.
Егоров а.С. Химия: современный курс для подготовки к егэ. Ростов н/д: Феникс, 2011. (2012)– 699 с.
Егоров
А.С. Самоучитель
по решению химических задач. –
Ростов-на-Дону: Феникс, 2000.– 352 с.
Химия/пособие-репетитор
для поступающих в вузы. Ростов-н/Д,
Феникс, 2005– 536 с.
Хомченко
Г.П.,Хомченко И.Г.
Задачи по химии для поступающих в вузы.
М.: Высшая школа. 2007.–302с.
Дополнительная:
Врублевский
А.И.
Учебно-тренировочные материалы для
подготовки к централизованному
тестированию по химии/ А.И. Врублевский
–Мн.: ООО «Юнипресс», 2004.– 368 с.
Врублевский
А.И. 1000 задач
по химии с цепочками превращений и
контрольными тестами для школьников и
абитуриентов.– Мн.: ООО «Юнипресс»,
2003.– 400 с.
Егоров
А.С. Все типы
расчетных задач по химии для подготовки
к ЕГЭ.–Ростов н/Д: Феникс, 2003.–320с.
Егоров
А.С., Аминова Г.Х.
Типовые задания и упражнения для
подготовки к экзамену по химии. – Ростов
н/Д: Феникс, 2005.– 448 с.
Единый
государственный экзамен 2007. Химия.
Учебно-тренировочные материалы для
подготовки учащихся/ФИПИ – М.:
Интеллект-Центр, 2007.– 272 с.
ЕГЭ-2011.
Химия. Учебно-тренировочный комплект
под ред. А.А. Кавериной.– М.: Национальное
образование, 2011.
Единственные
реальные варианты заданий для подготовки
к единому государственному экзамену.
ЕГЭ.2007. Химия/В.Ю. Мишина, Е.Н. Стрельникова.
М.: Федеральный центр тестирования,
2007.–151с.
Каверина
А.А. Оптимальный
банк заданий для подготовки учащихся.
Единый государственный экзамен
2012.Химия. Учебное пособие./ А.А. Каверина,
Д.Ю. Добротин, Ю.Н. Медведев, М.Г. Снастина.–
М.: Интеллект-Центр, 2012.– 256 с.
Литвинова
Т.Н., Выскубова Н.К., Ажипа Л.Т., Соловьева
М.В. Тестовые
задания в дополнение к контрольным
работам для слушателей 10-месячных
заочных подготовительных курсов
(методические указания). Краснодар,
2004. – С. 18 – 70.
Литвинова
Т.Н. Химия.
ЕГЭ-2011. Тренировочные тесты. Ростов
н/Д: Феникс, 2011.– 349 с.
Литвинова
Т.Н. Химия.
Тесты к ЕГЭ. Ростов н/Д.: Феникс, 2012. — 284
с.
Литвинова
Т.Н. Химия.
Законы, свойства элементов и их соединений.
Ростов н/Д.: Феникс, 2012. — 156 с.
Литвинова
Т.Н., Мельникова Е.Д., Соловьева М.В.,
Ажипа Л.Т.,
Выскубова Н.К. Химия
в задачах для поступающих в вузы.– М.:
ООО «Изд-во Оникс»: ООО «Изд-во «Мир и
образование», 2009.– 832 с.
Учебно-методический
комплекс по химии для учащихся
медико-биологических классов под ред.
Т.Н.Литвиновой.– Краснодар.: КГМУ, –
2008.
Химия.
ЕГЭ–2008. Вступительные испытания,
учебно-методическое пособие
/ под ред. В.Н. Доронькина. – Ростов н/Д:
Легион, 2008.– 271 с
Список
сайтов по химии:
1.
Alhimik.
http://www.alhimik.ru
2.
Химия для всех. Электронный справочник
за полный курс химии.
http://www.informika.ru/text/database/chemy/START.html
3.
Школьная химия – справочник.
http://www.schoolchemistry.by.ru
4.
Репетитор по химии. http://www.
chemistry.nm.ru
Интернет-ресурсы
-
Alhimik.
http://www.alhimik.ru -
Химия
для всех. Электронный справочник за
полный курс химии.
http://www.informika.ru/text/database/chemy/START.html
-
Школьная
химия – справочник.
http://www.schoolchemistry.by.ru -
http://www.classchem.narod.ru
-
Репетитор
по химии. http://www.
chemistry.nm.ru -
http://www.alleng.ru/edu/chem.htm
— образовательные
ресурсы Интернета по химии -
http://schoolchemistry.by.ru/
— школьная
химия. На этом сайте есть возможность
пройти On-line тестирование по разным
темам, а также демонстрационные варианты
Единого Государственного Экзамена -
Химия
и жизнь–ХХ1 век: научно-популярный
журнал. http://www.hij.ru
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
21.05.20151.82 Mб56Klassifikatsia_Zabolevany_Vo.djvu
- #
- #
- #
- #
Основные формулы для решения задач по химии
05-Авг-2012 | комментариев 450 | Лолита Окольнова
Все, все основные задачи по химии решаются с помощью
нескольких основных понятий и формул.
У всех веществ разная масса, плотность и объем. Кусочек металла одного элемента может весить во много раз больше, чем точно такого же размера кусочек другого металла.
Моль (количество моль)
обозначение: моль, международное: mol — единица измерения количества вещества. Соответствует количеству вещества, в котором содержится NA частиц (молекул, атомов, ионов). Поэтому была введена универсальная величина — количество моль. Часто встречающаяся фраза в задачах — «было получено… моль вещества»
NA = 6,02 · 1023
NA — число Авогадро. Тоже «число по договоренности». Сколько атомов содержится в стержне кончика карандаша? Несколько миллионов. Оперировать такими величинами не удобно. Поэтому химики и физики всего мира договорились — обозначим 6,02 · 1023 частиц (атомов, молекул, ионов) как 1 моль вещества.
1 моль = 6,02 · 1023 частиц
Это была первая из основных формул для решения задач.
Молярная масса вещества
Молярная масса вещества — это масса одного моль вещества. Обозначается как M
Есть еще молекулярная масса — Mr
Находится по таблице Менделеева — это просто сумма атомных масс вещества.
Например, нам дана серная кислота — H2SO4. Давайте посчитаем молярную массу вещества: атомная масса H =1, S-32, O-16.
Mr(H2SO4)=1•2+32+16•4=98 гмоль.
Вторая необходимая формула для решения задач —
формула массы вещества:
Т.е., чтобы найти массу вещества, необходимо знать количество моль (n), а молярную массу мы находим из Периодической системы.
Закон сохранения массы — масса веществ, вступивших в химическую реакцию, всегда равна массе образовавшихся веществ.
Если мы знаем массу (массы) веществ, вступивших в реакцию, мы можем найти массу (массы) продуктов этой реакции. И наоборот.
Третья формула для решения задач по химии —
объем вещества:
Откуда взялось число 22.4? Из закона Авогадро:
в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (н.у.) имеет один и тот же объём Vm = 22,413 996(39) л
Т.е., если в задаче нам даны нормальные условия, то, зная количество моль (n), мы можем найти объем вещества.
Итак, основные формулы для решения задач по химии
Число Авогадро NA
6,02 · 1023 частиц
Количество вещества n (моль)
n=mM
n=V22.4 (лмоль)
Масса вещества m (г)
m=n•Mr
Объем вещества V(л)
V=n•22.4 (лмоль)
или вот еще удобная табличка:
Это формулы. Часто для решения задач нужно сначала написать уравнение реакции и (обязательно!) расставить коэффициенты — их соотношение определяет соотношение молей в процессе.
В ОГЭ и ЕГЭ по химии задач , в которых нужно было бы найти только объем массу кол-во моль нет — это обычно ЧАСТЬ решения задачи. Однако, чтобы легко решать более сложные задачи, нужно тренироваться на таких вот небольших упражнениях.
Находим количество вещества по массе
1 Какое количество вещества алюминия содержится в образце металла массой 10.8 г?2 Какое количество вещества содержится в оксиде серы (VI) массой 12 г?
3 Определите количество моль брома, содержащееся в массе 12.8 г.
Находим массу по количеству вещества:
4. Определите массу карбоната натрия количеством вещества 0.25 моль.Объем по количеству вещества:
5. Какой объем будет иметь азот при н.у., если его количество вещества 1.34 моль?6. Какой объем занимают при н.у. 2 моль любого газа?
Ответы:/p>
- 0.4 моль
- 0.15 моль
- 0.08 моль
- 26.5 г
- 30 л
- 44.8 л
Категории:
|
Обсуждение: «Основные формулы для решения задач по химии»
(Правила комментирования)
Химические формулы
| № | Количественные характеристики вещества | Обозначение | Единицы измерения | Формула для расчета |
|---|---|---|---|---|
| 1 | Плотность вещества | ρ | кг/м³ | ρ = m / V(Массу делим на объем вещества) |
| 2 | Относительная атомная масса элемента | Аr | — | Ar = ma / u см. в периодической система химических элементов |
| 3 | Атомная единица массы | u а.е.м. |
кг | u = 1/12 * ma (12C) const = 1.66*10-27 |
| 4 | Масса атома (абсолютная) | ma | кг | ma = Ar * u |
| 5 | Относительная молекулярная (формульная) масса вещества | Mr | — | Mr (AxBy)=m(AB) / u Mr(AxBy)=x*Ar(A) + y*Ar(B) |
| 6 | Масса молекулы (формульной единицы) | m M | кг | mM = Mr*u |
| 7 | Количество вещества | n | моль | n=m/M n=N/NA n=V/VM |
| 8 | Молярная масса (масса 1 моль вещества) | M | г/моль | M=m/n M=Mr M=Ar (для простых веществ) |
| 9 | Масса вещества | m | г (кг) | m=M*n m=ρ*V |
| 10 | Число структурных единиц | N | атомов, молекул, ионов, частиц, формульных единиц (Ф.Е.) | N=NA*n |
| 11 | Молярный объем — число 1 моль ГАЗООБРАЗНОГО вещества в нормальных условиях (н.у.) | VM | л/моль | const=22,4 |
| 12 | Объем газа при н.у. | V | л | V=VM*n V=m/ρ |
| 13 | Постоянная Авогадро | NA | частиц/моль | const=6,02*1023 |
| 14 | Массовая доля вещества (омега) | ωЭ/В | % | ωЭ/В = (Ar(э) * k) / Mr(В) |
Формулы и названия кислот. Формулы и названия кислотных остатков.
| Формула | Название кислоты | Формула кислотного остатка | Название кислотного остатка |
|---|---|---|---|
| HF | Фтороводород, плавиковая | F— | Фторид |
| HCl | Хлороводород, соляная | Cl— | Хлорид |
| HBr | Бромоводород | Br— | Бромид |
| HI | Йодоводород | I— | Йодид |
| H2S | Сероводород | S2- | Сульфид |
| HCN | Циановодородная | CN— | Цианид |
| HNO2 | Азотистая | NO2— | Нитрит |
| HNO3 | Азотная | NO3— | Нитрат |
| H3PO4 | Ортофосфорная | PO43- | Фосфат |
| H3AsO4 | Мышьяковая | AsO43- | Арсенат |
| H2SO3 | Сернистая | SO32- | Сульфит |
| H2SO4 | Серная | SO42- | Сульфат |
| H2CO3 | Угольная | CO32- | Карбонат |
| H2SiO3 | Кремниевая | SiO32- | Силикат |
| H2CrO4 | Хромовая | CrO42- | Хромат |
| H2Cr2O7 | Дихромовая | Cr2O72- | Дихромат |
| HMnO4 | Марганцовая | MnO4— | Перманганат |
| HClO | Хлорноватистая | ClO— | Гипохлорит |
| HClO2 | Хлористая | ClO2— | Хлорит |
| HClO3 | Хлорноватая | ClO3— | Хлорат |
| HClO4 | Хлорная | ClO4— | Перхлорат |
| HCOOH | Метановая, муравьиная | HCOO— | Формиат |
| CH3COOH | Этановая, уксусная | CH3COO— | Ацетат |
| H3C2O4 | Этандиовая, щавелевая | C2O42- | Оксалат |
Периодическая система Менделеева
Нажмите на картинку для увеличения
25 апреля 2020г.
Так как химия наука точная, она неразрывно связана с различного рода вычислениями. Чтобы решать задачи, нужно знать формулы и хорошо в них ориентироваться. Без этих базовых знаний и навыков изучение химии становится невозможным.
Мы собрали для вас основные химические формулы, изучаемые в школьном курсе. Они пригодятся каждому ученику, особенно тем, кто будет сдавать ОГЭ или ЕГЭ по этому непростому, но очень интересному предмету.
Нахождение количества вещества
Первое и основное понятие, которое необходимо усвоить – это количество вещества, измеряемое в молях и обозначающееся латинской буквой «n». Для его нахождения нужно основываться на условии задачи, так как вычислить количество вещества можно по трём формулам:
1) По массе. n=m/M — Массу вещества (в граммах) разделить на его молярную массу (в г/моль).
2) По объёму. n=V/Vm — Отношением объёма вещества к его молярному объёму (используется для газов).
3) По числу молекул. n=N/NA – Число молекул вещества делённое на число Авогадро. Число Авогадро (NA) – физическая величина, указывающая на число молекул, содержащихся в 1 моле вещества, и численно равная 6,0221 * 1023 моль-1.
Формулы для нахождения массы
Массу вещества можно найти несколькими способами:
1. Умножив количество вещества на молярную массу: m (г) = n (моль)×M (г/моль).
2. Произведением объёма раствора и его плотности: m = V (л) ×ρ (г/л).
3. Перемножив массовую долю с массой раствора: m = m(р-ра) × ω.
Молярная масса (М) – это масса одного моля вещества. Вычисляется она следующим образом: посредством сложения атомных масс элементов, из которых состоит вещество, получаем относительную молекулярную массу. Молярная масса численно равна относительной молекулярной массе, но имеет размерность «г/моль». Также молярную массу можно найти с помощью отношения массы вещества к его количеству:
M = m/n
Формулы для нахождения объёма
Для вычисления объёма того или иного вещества можно воспользоваться одной из формул:
1. Объём раствора находится как отношение массы раствора к его плотности:
V(р-ра) = m(р-ра) / ρ
2. Объём газа равен отношению его количества вещества к молярному объёму:
V(газа) = n/VM
Молярный объём (VM) – объём, который занимает 1 моль вещества при определённых показателях давления и температуры. Находится при делении молярной массы вещества на его плотность:
VM = M/ρ
При нормальных условиях молярный объём газа равен 22,4 л/моль.
Формулы для нахождения плотности и относительной плотности
Плотность (ρ) – физическая величина, указывающая на массу определённого вещества, содержащуюся в единице объёма.
Следовательно, формула для её вычисления имеет вид:
ρ=m/V
Помимо основной, существует формула для нахождения плотности газа при нормальных условиях, где молярная масса делится на молярный объём газа при н.у.:
ρ=M/VM
Относительная плотность (D) газов – величина, указывающая насколько одно вещество тяжелее или легче другого. Вычисляется она отношением молярных масс газов:
D = M(1) / M(2)
Например, условием было найти плотность газа по водороду. Решение будет иметь вид: D = M(газа)/M(H2) = M(газа)/2. Относительная плотность является безразмерной величиной.
Формулы для нахождения концентрации
Молярная концентрация (С) – отношение количества растворённого вещества к объёму раствора. Единица измерения – моль/л. Молярная концентрация вычисляется по формуле:
С = n/V
Массовая концентрация чаще всего называется титром (Т). Это отношение массы растворённого вещества к объёму раствора. Единица измерения — г/л.
T = m/V
Массовая доля (ω) – это один из вариантов выражения концентрации. С её помощью можно вычислить процентное содержание растворённого вещества в общей массе раствора:
ω = (mр.в./mр-ра) × 100%
По такому же принципу вычисляется массовая доля определённого компонента в смеси:
ω = (mкомпонента / mсистемы) × 100%
Если возникает необходимость найти массовую долю химического элемента в соединении, то нужно относительную атомную массу этого элемента умножить на число атомов в соединении и разделить на молекулярную массу вещества:
ω = (Ar × N) / M
Формулы для нахождения выхода продукта реакции
Под выходом продукта реакции (ᶯ) подразумевается отношение массы (объёма, количества) вещества, полученного на практике, к теоретически возможному (рассчитанному по уравнению реакции). Единица измерения – доля, а проценты — если результат умножить на 100 !
Для его вычисления, в зависимости от условия задачи, используются следующие формулы:
ᶯ=(mпракт./mтеорет.) × 100%
ᶯ=(Vпракт./Vтеорет.) × 100%
ᶯ=(nпракт./nтеорет.) × 100%
Попрактиковать решение задач и знание формул возможно в приложении «ХиШник». Оно содержит в себе каталог заданий, которые, в свою очередь, разделены по темам и уровням сложности. Если вы дали неверный ответ, то приложение не просто уведомит об этом, а предложит правильный алгоритм решения. Также в нём есть раздел для подготовки к ОГЭ и ЕГЭ, в котором собраны типовые задания.
Знание расчётных формул – это ключевой момент при решении задач. Главное, понимать их, а не бездумно заучивать. Так как они будут использоваться не только в школьных задачах, на ЕГЭ и ОГЭ, но и в дальнейшей жизни, даже если ваша профессиональная сфера будет далека от химии.