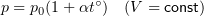Основные формулы молекулярной физики
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
В кодификаторе ЕГЭ нет тем, непосредственно относящихся к содержанию данного листка. Однако без этого вводного материала дальнейшее изучение молекулярной физики невозможно.
Введём основные величины молекулярной физики и соотношения между ними.
— масса вещества,
— объём вещества,
— плотность вещества (масса единицы объёма). Отсюда
— число частиц вещества (атомов или молекул).
— масса частицы вещества. Тогда
— концентрация вещества (число частиц в единице объёма),
. Отсюда
Что получится, если умножить на
? Произведение массы частицы на число частиц в единице объёма даст массу единицы объёма, т. е. плотность. Формально:
Итак,
Массы и размеры частиц невообразимо малы по нашим обычным меркам. Например, масса атома водорода порядка г, размер атома порядка
см. Из-за столь малых значений масс и размеров число частиц в макроскопическом теле огромно.
Оперировать столь грандиозными числами, как число частиц, неудобно. Поэтому для измерения количества вещества используют специальную единицу — моль.
Один моль — это количество вещества, в котором содержится столько же атомов или молекул, сколько атомов содержится в граммах углерода. А в
граммах углерода содержится примерно
атомов. Стало быть, в одном моле вещества содержится
частиц. Это число называется постоянной Авогадро:
моль
.
Количество вещества обозначается . Это число молей данного вещества.
Что получится, если умножить на
? Число молей, умноженное на число частиц в моле, даст общее число частиц:
Масса одного моля вещества называется молярной массой этого вещества и обозначается (
= кг/моль). Ясно, что
Как найти молярную массу химического элемента? Оказывается, для этого достаточно заглянуть в таблицу Менделеева! Нужно просто взять атомную массу (число нуклонов) данного элемента — это будет его молярная масса, выраженная в г/моль. Например, для алюминия
, поэтому молярная масса алюминия равна
г/моль или
кг/моль.
Почему так получается? Очень просто. Молярная масса углерода равна г/моль по определению. В то же время ядро атома углерода содержит
нуклонов. Выходит, что каждый нуклон вносит в молярную массу
г/моль. Поэтому молярная масса химического элемента с атомной массой
оказывается равной
г/моль.
Молярная масса вещества, молекула которого состоит из нескольких атомов, получается простым суммированием молярных масс. Так, молярная масса углекислого газа равна
г/моль
кг/моль.
Будьте внимательны с молярными массами некоторых газов! Так, молярная масса газообразного водорода равна г/моль, поскольку его молекула состоит из двух атомов
. То же касается часто встречающихся в задачах азота и кислорода
Вместе с тем, наиболее частый персонаж задач — гелий
— является одноатомным газом и имеет молярную массу
г/моль, предписанную таблицей Менделеева.
Ещё раз предостережение: при расчётах не забывайте переводить молярную массу в кг/моль! Если ваш ответ отличается от правильного на три порядка, то вы наверняка сделали именно эту, очень распространённую ошибку 
Что получится, если умножить на
? Масса частицы, умноженная на число частиц в моле, даст массу моля, т. е. молярную массу:
Благодарим за то, что пользуйтесь нашими публикациями.
Информация на странице «Основные формулы молекулярной физики» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать необходимые и поступить в ВУЗ или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из данного раздела.
Публикация обновлена:
09.03.2023
Все формулы взяты в строгом соответствии с Федеральным институтом педагогических измерений (ФИПИ)
2.1 МОЛЕКУЛЯРНАЯ ФИЗИКА
2.1.1 Модели строения газов, жидкостей и твердых тел
Газ
Газ — это агрегатное состояние вещества, в котором составляющие его атомы и молекулы почти свободно и хаотически движутся в промежутках между столкновениями. Во время столкновения молекулы резко меняют скорость и направление своего движения. Время столкновения молекул намного меньше промежутка времени между двумя столкновениями.
Объем, занимаемый газом, значительно сильнее зависит от давления и температуры, чем объем жидкостей и твердых тел. Газ можно сжать так, что его объем уменьшится в несколько раз. Это значит, что расстояние между молекулами намного больше размеров самих молекул. На таких расстояниях молекулы очень слабо притягиваются друг к другу. По этой причине газы не имеют собственной формы и постоянного объема. Нельзя заполнить газом, например, половину бутылки или стакана. В отличие от жидкостей и твердых тел газы не образуют свободной поверхности и заполняют весь доступный им объем.
Газообразное состояние — самое распространенное состояние вещества Вселенной (межзвездное вещество, туманности, звезды, атмосферы планет). По химическим свойствам газы и их смеси очень разнообразны — от малоактивных инертных газов до взрывчатых смесей.
Давление газа. Беспрерывно и хаотически двигаясь, молекулы газа сталкиваются не только друг с другом, но и со стенками сосуда, в котором находится газ. Молекул в газе много, потому и число их ударов очень велико. Например, число ударов молекул воздуха, находящегося в комнате, о поверхность площадью 1 см2 за 1 с, выражается двадцатитрехзначным числом. Хотя сила удара одной молекулы мала, но действие всех молекул на стенки сосуда значительно, оно и составляет давление газа. Итак, давление газа на стенки сосуда и на помещенное в газ тело вызывается ударами молекул газа.
Жидкость
Жидкость — вещество в состоянии, промежуточном между твердым и газообразным. Это агрегатное состояние вещества, в котором молекулы (или атомы) связаны между собой настолько, что это позволяет ему сохранять свой объем, но недостаточно сильно, чтобы сохранять и форму.
Свойства жидкостей. Жидкости легко меняют свою форму, но сохраняют объем. В обычных условиях они принимают форму сосуда, в котором находятся.
Строение жидкостей. Свойства жидкостей объясняются тем, что промежутки между их молекулами малы: молекулы в жидкостях упакованы так плотно, что расстояние между каждыми двумя молекулами меньше размеров молекул. Оно заключается в следующем. Молекула жидкости колеблется около положения временного равновесия, сталкиваясь с другими молекулами из ближайшего окружения. Время от времени ей удается совершить «прыжок», чтобы покинуть своих соседей из ближайшего окружения и продолжать совершать колебания уже среди других соседей. Поскольку расстояния между молекулами жидкости малы, то попытка уменьшить объем жидкости приводит к деформации молекул, они начинают отталкиваться друг от друга, чем и объясняется малая сжимаемость жидкости. Текучесть жидкости объясняется тем, что «прыжки» молекул из одного оседлого положения в другое происходят по всем направлениям с одинаковой частотой. Внешняя сила не меняет заметным образом число «прыжков» в секунду, она лишь задает их преимущественное направление, чем и объясняется текучесть жидкости и то, что она принимает форму сосуда.
Твердое тело. Кристаллические и аморфные тела
Твердое тело — агрегатное состояние вещества, характеризующееся постоянством формы и характером движения атомов, которые совершают малые колебания около положений равновесия.
Кристаллические тела. Твердое тело в обычных условиях трудно сжать или растянуть. Для придания твердым телам нужной формы или объема на заводах и фабриках их обрабатывают на специальных станках: токарных, строгальных, шлифовальных. В отсутствие внешних воздействий твердое тело сохраняет свою форму и объем.
Это объясняется тем, что притяжение между атомами (или молекулами) у них больше, чем у жидкостей (и тем более газов). Оно достаточно, чтобы удержать атомы около положений равновесия.
Молекулы или атомы большинства твердых тел, таких, как лед, соль, алмаз, металлы, расположены в определенном порядке. Такие твердые тела называют кристаллическими. Хотя частицы этих тел и находятся в движении, движения эти представляют собой колебания около определенных точек (положений равновесия). Твердое тело сохраняет свою форму и объем.
Кроме того, в отличие от жидкостей, точки положений равновесия атомов или ионов твердого тела, будучи соединенными, располагаются в вершинах правильной пространственной решетки, которая называется кристаллической. Положения равновесия, относительно которых происходят тепловые колебания частиц, называются узлами кристаллической решетки.
Монокристалл — твердое тело, частицы которого образуют единую кристаллическую решетку (одиночный кристалл).
Анизотропия монокристаллов. Одним из главных свойств монокристаллов, которым они отличаются от жидкостей и газов, является анизотропия их физических свойств. Поданизотропией понимают зависимость физических свойств от направления в кристалле. Анизотропными являются механические свойства (например, известно, что слюду легко расслоить в одном направлении и очень трудно — в перпендикулярном), электрические свойства (электропроводность многих кристаллов зависит от направления), оптические свойства (явление двойного лучепреломления, и дихроизма — анизотропии поглощения; так, например, монокристалл турмалина «окрашен» в разные цвета — зеленый и бурый, в зависимости от того, с какой стороны на него посмотреть).
Поликристалл — твердое тело, состоящее из беспорядочно ориентированных монокристаллов. Поликристаллическими являются большинство твердых тел, с которыми мы имеем дело в быту — соль, сахар, различные металлические изделия. Беспорядочная ориентация сросшихся микрокристалликов, из которых они состоят, приводит к исчезновению анизотропии свойств.
Аморфные тела — это твердые тела, для которых характерно неупорядоченное расположение частиц в пространстве.
В этих телах молекулы (или атомы) колеблются около хаотически расположенных точек и, подобно молекулам жидкости, имеют определенное время оседлой жизни. Но, в отличие от жидкостей, время это у них очень велико. У аморфных тел нет определенной температуры, плавления. Этим они отличаются от кристаллических тел, которые при повышении температуры переходят в жидкое состояние не постепенно, а скачком (при вполне определенной температуре — температуре плавления). Все аморфные тела изотропны, т. е. имеют одинаковые физические свойства по разным направлениям. При ударе они ведут себя как твердые тела — раскалываются, а при очень длительном воздействии — текут.
2.1.2 Тепловое движение атомов и молекул вещества — процесс хаотичного (беспорядочного) движения частиц, образующих вещество.
2.1.3 Взаимодействие частиц вещества
Природа этого взаимодействия — электрическая. Молекула состоит из заряженных частиц — электронов и ядер. Заряженные частицы одной молекулы при соответствующих расстояниях взаимодействуют (притягиваются или отталкиваются) с заряженными частицами других молекул. На расстояниях, превышающих 2-3 диаметра молекул, результирующая сила взаимодействия определяется силами притяжения. Вклад последних по мере уменьшения расстояния между молекулами сначала растет, затем убывает. Силы взаимодействия обращаются в нуль, когда расстояние между молекулами становится равным сумме радиусов молекул. Дальнейшее уменьшение расстояния приводит к перекрыванию электронных оболочек, что вызывает быстрое нарастание сил отталкивания.
2.1.4 Диффузия — явление, при котором происходит взаимное проникновение молекул одного вещества между молекулами другого.
Броуновское движение — беспорядочное тепловое движение частиц.
2.1.5 Модель идеального газа в МКТ: частицы газа движутся хаотически и не взаимодействуют друг с другом
Идеальный газ — это теоретическая модель газа, в которой пренебрегают размерами и взаимодействиями частиц газа и учитывают лишь их упругие столкновения.
Предполагается, что внутренняя энергия идеального газа определяется лишь кинетической энергией его частиц (т. е. потенциальной энергией взаимодействия молекул пренебрегают).
В простейшей модели газа молекулы рассматриваются как очень маленькие твердые шарики, обладающие массой. Движение отдельных молекул подчиняется законам механики Ньютона.В современной физике эту модель используют также для описания ансамблей любых слабовзаимодействующих частиц. Модель идеального газа справедлива для реальных классических газов при достаточно высоких температурах и разрежениях, когда среднее расстояние между молекулами много больше размеров самих молекул. В этом случае силами притяжения можно пренебречь. Силы же отталкивания проявляются лишь при столкновении друг с другом в течение ничтожно малых интервалов времени.
2.1.6 Связь между давлением и средней кинетической энергией поступательного теплового движения молекул идеального газа (основное уравнение МКТ):
Основное уравнение молекулярно-кинетической теории устанавливает связь между давлением идеального газа и средней кинетической энергией его молекул.
2.1.7 Абсолютная температура:
T = t° + 273K
Температура — физическая величина, характеризующая тепловое состояние тел (характеристика теплового равновесия системы).
2.1.8 Связь температуры газа со средней кинетической энергией поступательного теплового движения его частиц:
2.1.9 Уравнение p = nkT — зависимость давления газа от абсолютной температуры Т и концентрации его молекул.
2.1.10 Модель идеального газа в термодинамике:
Уравнение состояния идеального газа — это зависимость между параметрами идеального газа — давлением р, объемом V и абсолютной температурой Т, определяющими его состояние.
Выражение для внутренней энергии Уравнение Менделеева–Клапейрона (применимые формы записи):
Выражение для внутренней энергии одноатомного идеального газа (применимые формы записи):
2.1.11 Закон Дальтона для давления смеси разреженных газов:
2.1.12 Изопроцессы в разреженном газе с постоянным числом частиц N (с постоянным количеством вещества ν):
- Закон Бойля-Мориотта — для данной массы произведение давления газа на его объем постоянно, если температура газа не меняется.
- Закон Шарля — давление р данной массы газа при постоянном объеме пропорционально температуре.
- Закон Гей-Люссака — при постоянном давлении р объем V идеального газа меняется линейно с температурой.
Графическое представление изопроцессов на pV-, pT- и VT- диаграммах
2.1.13 Насыщенные и ненасыщенные пары
Насыщенный пар — пар, находящийся в динамическом равновесии со своей жидкостью.
Ненасыщенный пар — пар, не находящийся в состоянии равновесия со своей жидкостью, называется ненасыщенным.
При динамическом равновесии масса жидкости в закрытом сосуде не изменяется, хотя жидкость продолжает испаряться. Точно так же не изменяется и масса насыщенного пара над этой жидкостью, хотя пар продолжает конденсироваться.
Качественная зависимость плотности и давления насыщенного пара от температуры, их независимость от объёма насыщенного пара
Давление насыщенного пара. При сжатии насыщенного пара, температура которого поддерживается постоянной, равновесие сначала начнет нарушаться: плотность пара возрастет, и вследствие этого из газа в жидкость будет переходить больше молекул, чем из жидкости в газ; продолжаться это будет до тех пор, пока концентрация пара в новом объеме не станет прежней, соответствующей концентрации насыщенного пара при данной температуре (и равновесие восстановится). Объясняется это тем, что число молекул, покидающих жидкость за единицу времени, зависит только от температуры.
Итак, концентрация молекул насыщенного пара при постоянной температуре не зависит от его объема.
Поскольку давление газа пропорционально концентрации его молекул, то и давление насыщенного пара не зависит от занимаемого им объема. Давление р0, при котором жидкость находится в равновесии со своим паром, называют давлением насыщенного пара.
При сжатии насыщенного пара большая его часть переходит в жидкое состояние. Жидкость занимает меньший объем, чем пар той же массы. В результате объем пара при неизменной его плотности уменьшается.
Зависимость давления насыщенного пара от температуры. Для идеального газа справедлива линейная зависимость давления от температуры при постоянном объеме. Применительно к насыщенному пару с давлением р0 эта зависимость выражается равенством:
Так как давление насыщенного пара не зависит от объема, то, следовательно, оно зависит только от температуры.
Влажность воздуха — это количество граммов водяного пара, содержащееся в 1 м3 воздуха при данных условиях, т. е. это плотность водяного пара р, выраженная в г/м3.
2.1.14 Относительная влажность (φ) — это отношение абсолютной влажности воздуха р к плотности ρо насыщенного пара при той же температуре:
Под парциальным давлением (Pпара) понимают давление водяного пара, которое он производил бы, если бы все другие газы в атмосферном воздухе отсутствовали.
2.1.15 Изменение агрегатных состояний вещества: испарение и конденсация, кипение жидкости
Испарение — это переход вещества из жидкого состояния в газообразное (пар), происходящее со свободной поверхности жидкости.
Кипение — это интенсивный переход жидкости в пар, происходящий с образованием пузырьков пара по всему объему жидкости при определенной температуре.
В отличие от испарения, которое происходит при любой температуре жидкости, другой вид парообразования — кипение — возможен лишь при совершенно определенной (при данном давлении) температуре — температуре кипения.
Конденсация — переход вещества из газообразного состояния (пара) в жидкое или твердое состояние.
2.1.16 Изменение агрегатных состояний вещества: плавление и кристаллизация
Плавление — переход вещества из твердого кристаллического состояния в жидкое.
Чтобы расплавить твердое кристаллическое тело, его нужно нагреть до определенной температуры, т. е. подвести тепло.
Температура плавления вещества — температура, при которой вещество плавится.
Обратный процесс — переход из жидкого состояния в твердое — происходит при понижении температуры, т. е. тепло отводится.
Кристаллизация — переход вещества из жидкого состояния в твердое.
Температура кристаллизации — температура, при которой вещество кристаллизуется.
2.1.17 Преобразование энергии в фазовых переходах
Плавление и кристаллизация
Как уже было сказано ранее, это два взаимообратных процесса. Во время плавления для разрушения связей между структурными единицами необходима энергия. Поэтому, чтобы тело перешло в жидкое состояние, ему требуется энергия. Поэтому в результате подвода тепла внутренняя энергия тела увеличивается.
Во время процесса кристаллизации происходит обратный процесс — молекулы становятся в узлы кристаллической решетки, для этого температуру тела уменьшают, поэтому внутренняя энергия так же уменьшается.
Испарение и конденсация
Когда жидкости передается достаточное количество энергии, она переходит в газообразное состояние. Это значит, что внутренняя энергия тела увеличивается. В момент конденсации жидкость наоборот отдает энергию, следовательно, внутренняя энергия тела уменьшается.
Во время процессов кристаллизации и конденсации внутренняя энергия структурных единиц уменьшается, а при испарении и плавлении — увеличивается.
По теме: методические разработки, презентации и конспекты
Бинарный урок по химии и физике «Основные понятия химии и физики» (брейн-ринг)
Тип урока: обобщающий, бинарный, с элементами ИКТФорма урока: брейн-рингЦель: повторение и обощение знаний об основных химических и физических понятиях.Задачи: актуализация знаний учащихсяобощен…
Подготовка к ЕГЭ по физике в 11 классе,презентация на тему «Молекулярная физика»
…
формулы физики МКТ и ТЕРМОДИНАМИКА
ВСЕ — формулы физики МКТ и ТЕРМОДИНАМИКА…
Основные понятия по физике за 7 класс
Список понятий по физике за 7 класс….
Основные понятия по физике за 8 класс
Основные понятия по физике за 8 класс…
Интерактивный сборник тестов по физике «Молекулярная физика. Термодинамика»
Тестовые задания созданы в программе MS Excel 2007 и предназначены для проверки знаний по теме «Молекулярная физика. Термодинамика» для студентов 1 курса (учащихся 10 класса). Тесты можно применять на…
Дидактический пакет по проектированию образовательного процесса по физике в 10 классе на примере раздела «Молекулярная физика. Термодинамика».
Дидактический пакет по проектированию образовательного процесса по физике в 10 классе на примере раздела «Молекулярная физика. Термодинамика»….
Молекулярная физика Основные формулы
1. Основы молекулярно-кинетической теории. Газовые законы
1.1 Количество вещества
m — масса;
μ — молярная масса вещества;
N — число молекул;
NA = 6,02·1023 моль-1 — число Авогадро
1.2 Основное уравнение молекулярно-кинетической теории идеального газа
p — давление идеального газа;
m — масса одной молекулы;
n = N/V — концентрация молекул;
V — объем газа;
N — число молекул;

1.3 Средняя квадратичная скорость молекул идеального газа
k = 1,38·10-23 Дж/К — постоянная Больцмана;
R = kNA = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
T = t+273 — абсолютная температура;
t — температура по шкале Цельсия.
1.4 Средняя кинетическая энергия молекулы одноатомного газа
1.5 Давление идеального газа
n — концентрация молекул;
k — постоянная Больцмана;
T — абсолютная температура.
1.6 Закон Бойля-Мариотта
p — давление;
V — объем газа.
1.7 Закон Шарля
p0 — давление газа при 0 °С;
α = 1/273 °C-1 — температурный коэффициент давления.
1.8 Закон Гей-Люссака
V0 — объем газа при 0 °С.
1.9 Уравнение Менделеева-Клапейрона
1.10 Объединенный закон газового состояния (уравнение Клапейрона)
1.11 Закон Дальтона
pi — парциальное давление i-й компоненты смеси газов.
2. Основы термодинамики
2.1 Внутренняя энергия идеального одноатомного газа
ν — количество вещества;
R = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
T — абсолютная температура.
2.2 Элементарная работа, совершаемая газом,
при изменении объема на бесконечно малую величину dV
p — давление газа.
При изменении объема от V1 до V2
2.3 Первый закон термодинамики
ΔQ — количество подведенной теплоты;
ΔA — работа, совершаемая веществом;
ΔU — изменение внутренней энергии вещества.
2.4 Теплоемкость идеального газа
ΔQ — количество переданной системе теплоты на участке процесса;
ΔT — изменение температуры на этом участке процесса.