Применение веществ в быту и промышленности. ЕГЭ по химии.
Ниже представлены вещества, применение которых на ЕГЭ по химии спрашивается наиболее часто
| Нитрат натрия Нитрат калия Нитрат аммония |
Азотсодержащие удобрения (селитры). |
| Фосфат кальция Гидрофосфат кальция Суперфосфат |
Фосфорные удобрения |
| Оксид кремния (IV) | Производство керамических изделий. |
| Пальмитат натрия/калия Стеарат натрия/калия |
Мыла Натриевые соли высших карбоновых кислот – твердые мыла, а калиевые соли высших карбоновых кислот – жидкие мыла. |
| Сера | Используется при производстве резины. Для этого серу нагревают (вулканизируют) с каучуком. |
| Гидрокарбонат натрия. | Твердое вещество, использующееся в качестве разрыхлителя теста, а также в качестве чистящего средства. |
| Карбонат аммония | Используется как разрыхлитель теста благодаря тому, что при нагревании образует газообразные продукты разложения в соответствии с уравнением: (NH4)2CO3 => 2NH3 + CO2 + H2O |
| Этановая (уксусная) кислота | Используется для консервирования овощей. Концентрированные растворы вызывают ожоги. |
| Активированный уголь | Твердое вещество черного цвета используется в качестве поглотителя (адсорбента) в фильтрах, а также как лекарственное средство при различных видах отравлений. |
| Этанол (этиловый спирт). C2H5OH |
Основной компонент алкогольных напитков, может быть использован в качестве топлива. Жидкость со специфическим запахом. |
| Глицерин | Используется в парфюмерии и пищевой промышленности. |
| Ацетон | Распространенный растворитель. |
| Тетрахлорид углерода CCl4 | Растворитель. |
| Аммиак | Сырье для получения удобрений (нитратов калия, натрия, аммония). Сырье для получения азотной кислоты. |
| Аммиак раствор | Используется как компонент стеклоочистительных жидкостей, жидкость с резким запахом. В аптечке – нашатырный спирт, применяется для приведения в чувство человека, потерявшего сознание. |
| Озон O3 | Дезинфекция (очистка) воды. |
| Хлор Cl2 | Дезинфекция (очистка) воды. |
| Ацетилен C2H2 | Используется для сварки и резки металла благодаря тому, что при горении ацетилена развивается крайне высокая температура – около 3000 оС |
| Метан | Основной компонент природного газа. Горючее для газовых плит. |
| Лимонная кислота | Используется для удаления накипи с внутренней поверхности чайника. |
| Пероксид водорода | Используется в качестве антисептика (дезинфицирующего средства) при обработке небольших ран и порезов. |
| Хлоропрен (2-хлорбутадиен-1,3) Изопрен (2-метилбутадиен-1,3) Бутадиен (дивинил) |
Сырье для производства каучука. |
| Йод | Спиртовой раствор данного вещества используется для дезинфекции мелких порезов и царапин. |
| Анилин | Производство красителей |
Фосфат натрия, характеристика, свойства и получение, химические реакции.
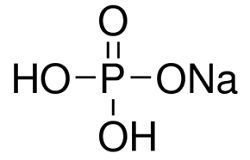
Фосфат натрия – неорганическое вещество, имеет химическую формулу Na3PO4.
Краткая характеристика фосфата натрия
Физические свойства фосфата натрия
Получение фосфата натрия
Химические свойства фосфата натрия
Химические реакции фосфата натрия
Применение и использование фосфата натрия
Краткая характеристика фосфата натрия:
Фосфат натрия – неорганическое вещество бесцветного либо белого цвета, соль щелочного металла натрия и ортофосфорной кислоты.
Фосфат натрия представляет собой бесцветные кристаллы.
Химическая формула фосфата натрия Na3PO4.
Хорошо растворяется в воде, с которой образует кристаллогидраты Na3PO4·0,5H2O, Na3PO4·H2O и Na3PO4·12H2O. Водный раствор имеет сильнощелочную реакцию из-за гидролиза по аниону.
Не растворим в этаноле.
Обладает гигроскопичностью.
В пищевой промышленности используется 3 типа фосфатов натрия, согласно степени замещения атомов водорода:
– добавка Е339(i) – ортофосфат натрия 1-замещенный с химической формулой NaH2PO4;
– добавка Е339(ii) – ортофосфат натрия 2-замещенный с химической формулой Na2HPO4;
– добавка Е339(iii) – ортофосфат натрия 3-замещенный с химической формулой Na3PO4.
Физические свойства фосфата натрия:
| Наименование параметра: | Значение: |
| Химическая формула | Na3PO4 |
| Синонимы и названия иностранном языке | sodium phosphate (англ.)
натрий фосфорнокислый трёхзамещенный (устар. рус.) натрия ортофосфат (рус.) тринатрий фосфат (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные тетрагональные кристаллы |
| Цвет | бесцветный, белый |
| Вкус | —* |
| Запах | без запаха |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2536 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,536 |
| Температура кипения, °C | — |
| Температура плавления, °C | 1340 |
| Гигроскопичность | гигроскопичен |
| Молярная масса, г/моль | 163,94067 |
| Растворимость в воде при 25 °C, г/100 мл | 14,5 |
* Примечание:
— нет данных.
Получение фосфата натрия:
Фосфат натрия получается в результате следующих химических реакций:
- 1. взаимодействием карбоната натрия и ортофосфорной кислоты:
2H3PO4 + 3NaCO3 → 2Na3PO4 + 3CO2 + 3H2O.
- 2. взаимодействием гидроксида натрия и ортофосфорной кислоты:
H3PO4 + 3NaOH → Na3PO4 + 3H2O.
Химические свойства фосфата натрия. Химические реакции фосфата натрия:
Химические свойства фосфата натрия аналогичны свойствам фосфатов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция фосфата натрия с нитратом серебра:
3AgNO3 + Na3PO4 → Ag3PO4 + 3NaNO3.
В результате реакции образуются ортофосфат серебра и нитрат натрия.
2. реакция фосфата натрия и нитрата хрома:
Cr(NO3)3 + Na3PO4 → CrPO4 + 2NaNO3.
В результате реакции образуются ортофосфат хрома и нитрат натрия.
3. реакция фосфата натрия и нитрата галлия:
Ga(NO3)3 + Na3PO4 → GaPO4 + 3NaNO3.
В результате реакции образуются ортофосфат галлия и нитрат натрия.
4. реакция фосфата натрия и хлорида алюминия:
AlCl3 + Na3PO4 → AlPO4 + 3NaCl.
В результате реакции образуются ортофосфат алюминия и хлорид натрия.
5. реакция фосфата натрия и хлорида кальция:
2Na3PO4 + 3CaCl2 → Ca3(PO4)2 + 6NaCl.
В результате реакции образуются ортофосфат кальция и хлорид натрия.
6. реакция фосфата натрия и хлорида бария:
2Na3PO4 + 3BaCl2 → Ba3(PO4)2 + 6NaCl.
В результате реакции образуются ортофосфат бария и хлорид натрия.
7. реакция фосфата натрия и сульфата железа:
3FeSO4 + 2Na3PO4 → Fe3(PO4)2 + 3Na2SO4 (t = 60-80 oС).
В результате реакции образуются ортофосфат железа и сульфат натрия. Фосфат натрия используется в виде разбавленного раствора.
8. реакция фосфата натрия и сульфата лития:
2Na3PO4 + 3Li2SO4 → 2Li3PO4 + 3Na2SO4.
В результате реакции образуются ортофосфат лития и сульфат натрия.
9. реакция фосфата натрия и сульфата магния:
2Na3PO4 + 3MgSO4 → Mg3(PO4)2 + 3Na2SO4.
В результате реакции образуются ортофосфат магния (который выпадает в осадок) и сульфат натрия. Реакция уменьшения жесткости воды.
10. реакция фосфата натрия и гидрокарбоната кальция:
2Na3PO4 + 3Ca(HCO3)2 → Ca3(PO4)2 + 6NaHCO3.
В результате реакции образуются ортофосфат кальция (который выпадает в осадок) и гидрокарбонат натрия. Реакция уменьшения жесткости воды.
11. реакция фосфата натрия, алюминия и воды:
2Al + 2Na3PO4 + 8H2O → 2Na[Al(OH)4] + 2Na2HPO4 + 3H2 (to).
В результате реакции образуются тетрагидроксоалюминат (III) натрия, гидроортофосфат натрия и водород. Фосфат натрия используется в виде концентрированного раствора. Реакция протекает при кипении.
12. реакция фосфата натрия, цинка и воды:
Zn + 2Na3PO4 + 4H2O → Na2[Zn(OH)4] + 2Na2HPO4 + H2 (to).
В результате реакции образуются тетрагидроксоцинкат (III) натрия, гидроортофосфат натрия и водород. Фосфат натрия используется в виде концентрированного раствора. Реакция протекает при кипении.
13. реакция термического разложения кристаллогидрата фосфата натрия:
Na3PO4•12H2O → Na3PO4 + 12H2O (t = 200 оС).
В результате реакции термического разложения додекагидрата фосфата натрия образуются фосфат натрия и вода. Реакция протекает в вакууме.
14. реакция фосфата натрия с азотной кислотой:
Na3PO4 + 3HNO3 ⇄ 3NaNO3 + H3PO4.
В результате химической реакции образуются нитрат натрия и ортофосфорная кислота. Реакция носит обратимый характер.
Аналогично проходят реакции фосфата натрия и с другими сильными минеральными кислотами.
15. реакция термического разложения фосфата натрия:
2Na3PO4 → 3Na2O + P2O5 (tо).
В результате реакции термического разложения фосфата натрия образуются оксид натрия и оксид фосфора.
Применение и использование фосфата натрия:
Фосфат натрия используется во множестве отраслей промышленности и для бытовых нужд:
– для уменьшения жесткости воды,
– в пищевой промышленности как разрыхлитель для теста (при взаимодействии с пищевой содой) и эмульгатор для плавленого сыра, колбасы, сгущённого молока,
– как пищевая добавка Е339,
– в стекольной промышленности для обесцвечивания стекла при его плавке,
– как составной компонент зубных паст и некоторых косметических препаратов.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
фосфат натрия реагирует кислота 1 2 3 4 5 вода соль гидролиз цинка
уравнение реакций соединения масса взаимодействие масса фосфата натрия
реакции
Коэффициент востребованности
4 546
Определение и формула
Фосфат натрия Na3PO4– средняя соль ортофосфорной кислоты H3PO4 и гидроксида натрия NaOH. Пищевая добавка с индексом Е542, принадлежит к группе эмульгаторов, регуляторов pH и веществ против слеживания.
Синонимы
Ортофосфат натрия, тринатрийфосфат, натрий фосфорнокислый
Формула
Na3PO4
Свойства фосфата натрия
Физические свойства
| Свойство | Описание |
|---|---|
| Внешний вид | Кристаллическое вещество белого цвета |
| Молярная масса | 163,941 г/моль |
| Плотность | 2,536 г/см3 |
| Температура плавления | 1340°С |
| Cтандартная мольная энтальпия образования при 298К ΔGDelta G °298, кДж/моль | -1922,8 |
| Cтандартная мольная энергия Гиббса образования при 298 К ΔDelta кДж/моль | -1819 |
| Стандартная мольная энтропия при 298 К S°298, Дж/(моль•К) | 224,7 |
| Растворимость в воде, 100 г | при 0°С — 5,4 при 25°С — 14,5 при 100°С — 94,6 |
Химические свойства
В водных растворах гидролизуется по аниону:
Na3P04 + H2O = Na2HP04 + Na0H.
Раствор имеет щелочную реакцию.
При взаимодействии с кислотами образует кислые соли:
Na3P04 + HСl = Na2HP04 + NaCl,
Na3P04 + H2SO4 = NaH2P04 + Na2SO4.
Вступает в реакции обмена с образованием нерастворимых фосфатов:
2Na3P04 + 3CaCl2 = 6NaCl + 2Ca3(P04)2↓,
Na3P04 + AlCl3 = 3NaCl + AlP04↓,
Na3P04 + 3AgNO3 = 6NaCl + Ag3P04↓.
Последняя реакция является качественной реакцией на растворимые фосфаты щелочных металлов и аммония. При добавлении к их раствором раствора нитрата серебра AgNO3 выпадает осадок фосфата серебра Ag3P04 желтого цвета. А натрий можно определить окрашиванию пламени в желтый цвет.
Получение химического соединения
Лабораторные способы получения
Фосфат натрия получают взаимодействием фосфорной кислоты с гидроксидом или карбонатом натрия:
H3PO4 + 3NaOH = Na3PO4 + 3H2O;
2H3PO4 + 3Na2CO3 =2Na3PO4 + 3H2O + 3CO2↑.
Получение фосфата натрия в промышленности
В промышленности фосфат натрия получают в два этапа.
Сначала взаимодействием кальцинированной соды Na2CO3 с фосфорной кислотой H3PO4 получают гидрофосфат натрия Na2HP04:
Н3Р04 + Na2C03 = Na2HP04 + С02↑+ Н20,
а затем взаимодействием едкого натра NaOH с полученным гидрофосфатом натрия Na2HP04 получают фосфат натрия Na3PO4:
Na2HP04 + Na0H = Na3P04 + H20.
После охлаждения нейтрализованных растворов до 30°С фосфат натрия кристаллизуются в виде Na3PO4·12H2O. Он плавится при 70°С. Чтобы получить безводный фосфат натрия, кристаллогидрат прокаливают 2 часа при температуре 120°С, а затем 30 мин при температуре 800°С.
Применение
Фосфат натрия в быту используют как чистящее средство, так как он прекрасно отмывает жир. Благодаря этому свойству он также входит в состав моющих средств. Кроме того, фосфат натрия смягчает воду, переводя соли жесткости в нерастворимые фосфаты:
3Ca(HCO3)2 + 2Na3P04 = 6NaHCO3 + Ca3(P04)2↓,
3Mg(HCO3)2 + 2Na3P04 = 6NaHCO3 + Mg3(P04)2↓.
Применяется он также и в стекольной промышленности для получения оптических стекол.
В строительстве фосфат натрия используют для упрочнения бетона. Его добавка увеличивает также влагостойкость бетона, так как он становится менее пористым.
В медицине фосфат натрия изредка применяют как слабительное и средство от изжоги.
В пищевой промышленности он известен как пищевая добавка Е339(iii). Фосфат натрия используют в качестве эмульгатора, стабилизатора, влагоудерживающего агента. Добавляют его в майонезы и кетчупы, плавленные сыры и хлебобулочные изделия, правда чаще применяют гидрофосфат (пищевая добавка Е339(i)) и дигидрофосфат натрия (пищевая добавка Е339(iii)). Фосфатом натрия обрабатывают куриные окорочка, мясо и рыбу, чтобы удержать воду и сохранить вес.
Относится к малоопасным веществам (4 класс опасности), но при передозировке в пищевых продуктов приводит к расстройствам пищеварения, а у детей нередко вызывает возбуждение и гиперактивность.
Пример решения задачи
Сколько фосфата натрия получится при нейтрализации фосфорной кислотой 240 г едкого натра?
Решение.
240 г – х г
H3PO4 + 3NaOH = Na3PO4 + 3H2O.
3 моля – 1 моль
3 * (23+16+1) = 120 г
3 * 23+31+4 * 16 = 164 г
Составляем пропорцию:
120 г NaOH – 164 г Na3PO4,
240 г NaOH – х г Na3PO4.
Отсюда:
х= (240 * 164)/120 = 328 г.
Ответ: 328 г.
Тест по теме «Фосфат натрия»
Фосфат натрия (Е399) широко используется во многих промышленных сферах, как влагоудерживатель, кислотный регулятор, эмульгатор, закрепитель структуры. Формула вещества изменяется, в зависимости от используемых компонентов и реакций. Отсюда изменена водность, название и тип (замещаемой или незамещаемый). Рассмотрим: что такое фосфат натрия, формулы, способы получения, свойства, где применяется, как влияет на здоровье.
Содержание
- Что такое фосфат натрия
- Виды тринатрийфосфата
- Формула и свойства фосфата натрия
- Химические реакции, свойства
- Получение и производство фосфата натрия
- Лабораторный способ
- Промышленный
- Сферы применения фосфата натрия
- Фармацевтика
- Пищевая индустрия
- Изготовление бытовой химии
- Стекольное производство
- Строительство
- Смягчение воды
- Влияние на здоровье
- Польза
- Вред
- В каких продуктах содержится фосфат натрия
- Тип пищевой добавки
- Класс опасности и токсичности
- Первая помощь
- Хранение и транспортировка
- Где купить, сколько стоит фосфат натрия, расфасовка
- Отзывы
- Заключение
Что такое фосфат натрия
Фосфат натрия – это синтетическое кристаллизованное вещество белогопрозрачного оттенка, являющееся средней солью щелочного гидроксида натрия и ортофосфорной кислоты (пищевая добавка Е399).
Дополнительные названия:
- ортофосфат натрия;
- натрий фосфорнокислый;
- натриевый ортофосфат;
- тринатрийфосфат;
- триполифосфат натрия;
- пищевая добавка Е399.
Основная сфера использования ортофосфат натрия – продуктовая, фармацевтическая, в качестве противослеживающегося вещества, эмульгатора, щелочного регулятора.
Виды тринатрийфосфата
Фосфат натрия бывает замещенным (зам.)не замещенным, 1-12-ти водным (вод.), образованным под влиянием различных компонентов и факторов
Na3PO4
- Na3PO4 – натриевый 3-зам. ортофосфат, ортофосфатный Na;
- Na3PO4 * 12H2O – 12-ти вод. фосфорнокислый 3-зам. Na, додекагидрат фосфат Na;
- Na3PO4 * H2O – 1-но вод. фосфорнокислый 3-зам. Na, фосфатный моногидрат Na;
- Na3PO4 * 0,5H2O – 0,5-вод. фосфорнокислый 3-зам. Na, полугидрат фосфата натрия.
NaH2PO4
- NaH2PO4 * 2H2O – 2-х вод. 1-но зам. фосфорнокислый Na, натриевый дигидратдигидрофосфат;
- NaH2PO4 * H2O – 1-но водная 1-но замещенная натриевая фосфорная кислота, моногидратдигидрофосфат Na;
- NaH2PO4 – 1-но зам. натриевая кислота, безводный дигидрофосфат Na.
Na2HPO4
- Na3PO4 * 12H2O – 12-ти вод. 2-х зам. натриевая фосфорная кислота, додекагидрат гидрофосфат Na;
- Na2HPO4 – 2-х зам. фосфорнокислая кислота Na, безводная форма гидрофосфата Na;
- Na3PO4 * 7H2O – 7-ми вод., 2-х зам. фосфорнокислый Na, гептагидрат, натриевый гидрофосфат;
- Na3PO4 * 2H2O – 2-х вод., 2-х зам. натриевая фосфорная кислота, дигидрат гидрофосфат Na.
Вещества оказывают полезное воздействие на организм человека при отсутствии противопоказаний к применению.
Формула и свойства фосфата натрия
Формула фосфата натрия:
Na3PO4
- Агрегатное состояние: твердое гранулированное, кристаллизованное.
- Запах: отсутствует.
- Вид: гранулы, кристаллы белогопрозрачного оттенка, измельченный порошок.
- Температура плавления: 1340°С.
- Масса (гмоль): 163,941.
- Энтропия Дж/(моль•К): 224, 7.
- Энергия кДж/моль: 1819.
- Энтальпия кДж/моль: 1922,8.
- Плотность: 2,536 г/см3.
- Растворимость (на 100 гмл): 0°С – 5, при 25°С – 14.
- Гигроскопичность: высокая.
- Способность к гидролизу: создает щелочную среду.
Структурная формула фосфата натрия
Фосфат натрия устойчив к термическим изменениям, высоким температурам, под воздействием которых плавится, не разлагаясь на другие вещества.
Химические реакции, свойства
Натриевый гидроксид (NaOH) + кислота ортофосфорная (H3PO4) взаимодействуют, приводя к реакции, образовывающей фосфат натрия (Na3PO4). Растворение в Н2О активирует анионный гидролиз 3 ступени.
1-я ступень:
- Na3PO4 ↔ 3Na+ + PO43-;
- 3Na+ + PO43- + HOH ↔ HPO42- + 3Na+ + OH—;
- Na3PO4 + HOH ↔ Na2HPO4 + NaOH.
2-я:
- Na2HPO4 ↔ 2Na+ + H2PO4—;
- 2Na+ + H2PO4— + HOH ↔ NaHPO4 + 2Na+ + OH—;
- Na2HPO4 + HOH ↔ NaHPO4 + NaOH.
3-я:
- NaHPO4 ↔ Na+ + PO43-;
- Na+ + PO43- + HOH ↔ H3PO4 + Na+ + OH—;
- NaHPO4 + HOH ↔ H3PO4 + NaOH.
Другие уравнения:
- анионный гидролиз тринатрийфосфата с образованием щелочной реакции в Н2О: Na3PО4 + H2O = Na2HPО4 + NaОH;
- образование кислых солей при контакте с кислотами: Na3PО4 + H2SO4 = NaH2PО4 + Na2SO4 и Na3PО4 + HСl = Na2HPО4 + NaCl;
- обменная реакция, формирующая фосфаты не растворимого типа:2Na3PО4 + 3CaCl2 = 6NaCl + 2Ca3(PО4)2↓; Na3PО4 + AlCl3 = 3NaCl + AlPО4↓; Na3PО4 + 3AgNO3 = 6NaCl + Ag3PО4↓
Качественная реакция:
Na3PО4 + 3AgNO3 = 6NaCl + Ag3PО4↓
При добавлении AgNO3 (серебряного нитрата) осаждается желтый серебряный фосфат (Ag3PО4). Na определяется, путем пожелтения огня.
Получение и производство фосфата натрия
Синтезирование ортофосфата натрия выполняют лабораторно (небольшими партиями) и промышленно (крупными).
Лабораторный способ
Незначительное количество ортофосфата натрия добывают, путем взаимодействия натриевого карбоната/гидроксида с кислотой (ортофосфорной):
H3PO4 + 3NaOH = Na3PO4 + 3H2O
2H3PO4 + 3Na2CO3 =2Na3PO4 + 3H2O + 3CO2↑
Промышленный
Крупные партии гранулированного тринатрийфосфата добывают в 2 этапа:
- Н3РО4 + Na2CО3 = Na2HPО4 + СО2↑+ Н2О
- Na2HPО4 + NaОH = Na3PО4 + H2О
Растворы охлаждают до 30°С. Вещество преобразуется в Na3PO4 * 12H2O (плавящийся при 70°С), кристаллизуется. Для получения безводной формы, его в течение 120 минут прокалывают при 120°С, затем еще полчаса при 800°С.
Сферы применения фосфата натрия
Медицинская и пищевая отрасли – самые востребованные для применения фосфата натрия. Его также добавляют в бытовую химию, стройматериалы, благодаря свойствам. Рассмотрим подробно:
Фармацевтика
Добавка Е399 в медицинских препаратах используется, как основное вещество для приготовления антацидных и противозапорных медикаментов. В качестве дополнительного – для нормализации щелочного, кислотного, минерального уровня.
Слабительные
Принцип действия основывается на удержании влаги в 12-ти перстной кишке. За счет этого улучшается перистальтика и стимулируется выведение фекалий. Лекарства выпускают, в виде жидкости для разовой клизмы, например: «Энема Клин», «Fleet Enema». Медикаменты изготовлены из одинаковых компонентов в разных пропорциях.
Кишечные
Ортофосфат натрия выпускаются в форме таблеток и растворов для экстренной кишечной чистки накануне хирургической терапии, толстокишечнойаноректальной манометрии, рентгеноскопии, колоноскопии. Например: «Флит фосфо-сода» распространенный в России и зарубежные: «OsmoPrep», «Visicol», «Phosphate Laxative».
Раствор фосфата натрия
Антацидные
Препараты, направленные на нормализацию кишечной флоры. Назначаются при неправильной выработке желудочного сока. Избавляют от изжоги, язвы, гастрита, гастроэзофагеальной рефлюксной болезни, желудочных болей. Но, специалисты стараются минимизировать использование препаратов данной группы. Воздействуя на пищеварительный тракт, вещество может нанести больше вреда, чем пользы т.к. передозировка кислотой способна обжечь желудок, кишечник приводя к обострению или формированию заболеваний. Употребляйте только по назначению врача!
Внутривенные растворы
На территории РФ внутривенные растворы с фосфатом натрия местного производства не зарегистрированы. Существуют только зарубежные медикаменты, используемые для нормализации кислотно-щелочного, минерального кровяного баланса. Препараты запрещаются для введения беременнымкормящим грудью женщинам, поскольку транспортируются кровеносной системой, проникают в молоко и вредят плодуребенку.
Пищевая индустрия
В продуктовой индустрии ортофосфат натрия классифицируется, как пищевая добавка Е339, «ГОСТ Р 52823-2007». Условия распространяются только на 1-но, 2-х, 3-х замещаемые монофосфаты. Используются, как: стабилизатор, влагоудерживатель, кислотный регулятор, текстуратор, комплексообразователь, эмульгатор при изготовлении спиртных напитков, сладких/хлебобулочных, рыбных, мясных, молочных изделий, полуфабрикатов, консерв.
Изготовление бытовой химии
Фосфат натрия широко используется для изготовления бытовых чистящих средств. Хорошо справляется с жирами, налетом, растворяя их кислотным влиянием. Работая с концентратами защищайте руки резиновыми перчатками. Регулярный контакт со средствами вызывает сухость кожи, раздражение. На чувствительной дерме, кислота может оставить ожоги.
Стекольное производство
При помощи фосфата натрия изготавливают оптическое стекло.
Строительство
Технические сорта ортофосфата натрия снижают пористость бетона, улучшая его устойчивость к влаге, прочность.
Смягчение воды
Ортофосфат натрия применяется для смягчения воды. Эффект достигается, путем преобразования жестких солей в нерастворимые фосфаты.
Влияние на здоровье
Пищевая добавка Е399 считается безопасной. Разрешается, даже для изготовления детских молочныхбезмолочных смесей в России, Украине, во всех странах Евросоюза.
Польза
Фосфорные и натриевые соли легко расщепляются организмом, участвуют в растворении жиров и углеводов, помогая пище лучше усваиваться, образовывать необходимое количество энергии, нормализуют стул. Натриевые ионы улучшают минеральный и кислотно-щелочной баланс. При отсутствии передозировки не угрожают, а помогают организму в повседневной деятельности.
Вред
Навредить ортофосфат натрия может при передозировке и заболеваниях ЖКТ (на стадии обострения). Обычно данные состояния сопутствуют друг другу. Для стабилизации тринатривого фосфата в организме, употребляйте кальцийсодержащие продукты. Они помогут избежать сердечно-сосудистых болезней, спровоцированных передозировкой. Также чрезмерное потребление грозит возникновением остеопороза, повреждением зубной эмали, замедлением роста костной ткани. Особенно опасно проявление у детей т.к. тормозит физическое развитие.
В некоторых странах натриевый ортофосфат запрещен или ограничен, из-за загрязнения сточных вод, в результате производства бытовой химии.
В каких продуктах содержится фосфат натрия
Натриевый триполифосфат обладает эмульгирующими, разрыхляющими, стабилизирующими свойствами. Содержится в:
- ликероводочных товарах;,
- хлебобулочных изделиях, печенье;
- фабрично подготовленном мясе, рыбе;
- колбасных, копченых продуктах;
- консервах;
- сырах;
- супах, вермишели, пюре быстрого приготовления;
- густых соусах, заправках;
- концентрированном бульоне;
- сливках, промышленном молоке.
Съедобный Е399 может быть измельченным до порошкообразного состояния или гранулированным. Это дает возможность использовать его, в качестве разрыхлителя и соли-плавителя (для приготовления плавленых сырков).
Тип пищевой добавки
Фосфат натрия (пищевая добавка Е339) – разрыхлитель, влагоудерживатель, стабилизатор вкусацвета, эмульгатор, регулятор кислотности, текстурообразователь, усиливающий антиоксидантные свойства других веществ. Используется во многих промышленных сферах, особенно строительной, медицинской и пищевой. Пожаробезопасен, не взрывоопасен.
Класс опасности и токсичности
Фосфат натрия внесен в Регистр Росстандарта 03.02.2016 г. информационно-аналитическим центром «Безопасность веществ и материалов» ФГУП «ВНИИ СМТ». Присвоен 4 класс опасности (малотоксичная по степени воздействия на организм продукция), сигнальное слово: осторожно!
- фосфат натрия вреден при передозировке. Вызывает нарушения пищеварительного тракта, сердечные патологии (в исключительно редких случаях);
- пыль пищевой добавки Е399 раздражает слизистые органов зрения, дыхательных путей, дерму;
- выброс отходов в водосток загрязняет окружающую среду.
Предприятиям минимизировать утилизацию отходов в сточные воды, с целью экологической сохранности. Сотрудникам, контактирующим в тринатрийфосфатом работать в перчатках и респираторах для защиты органов зрения, дыхания, поверхности кожи от мелких частиц кислоты (пыли).
Первая помощь
При возникновении: першения в горле, головных болей, сухости в ротовой полости, кашле, общей слабости (в результате воздействия тринатрийфосфата) тщательно промыть пораженную область, пить много воды, обеспечить покой, принять активированный уголь. По необходимости обратиться за врачебной помощью. При отравлении пероральным путем рвоту не вызывать!
При попадании в глаза, режущих ощущениях, жжении: в течение 15 минут промывать широко раскрытые органы зрения под проточной водой. При контакте с носовой слизистой – тщательно промыть нос водой. С кожей – вымыть поверхность кожи с гигиеническим средством.
Обязательно обратиться к врачу при: рвоте, болях в зоне пищевода, расстройстве кишечника, красноте глаз!
Хранение и транспортировка
Хранить в хорошо вентилируемом сухом помещении при комнатной температуре, не превышающей 25°С, в упаковке производителя. Транспортировать сырье любым удобным способом в упаковке производителя (синтетических или бумажных мешках с внутренним вкладышем, защищающим от влаги).
Где купить, сколько стоит фосфат натрия, расфасовка
Приобрести фосфат натрия можно у завода производителя или дистрибьютора, через интернет, при личной встрече в необходимом количестве. Мелкие дилеры обеспечат доставку мешков Е399, объемом 1, 5, 10, 25 кг удобным и выгодным Вам способом.
Крупным предприятиям можно там же заказать нужный объем сырья и забрать покупку, объемом от 100 кг можно самостоятельно, воспользоваться доставкой от завода, курьером, почтовой службой.
Стоимость технических сортов натриевого фосфата колеблется в пределах 40-80 рубкг. Цена пищевого, используемого в фармацевтике – 200-400 руб, зависимо от ступеней замещения, объема заказа. В качестве бонуса постоянным крупным клиентам, производитель предоставляет сырье по заниженной цене.
Отзывы
Ангелина 38 лет.
Чтобы сэкономить на лекарствах (у меня частые запоры) купила пищевой фосфат натрия. При возникновении проблемы принимаю дозу на кончике ножа. Эффект, практически не отличается от таблеток. Улучшает стул, не влияет на общее самочувствие. Единственный недостаток – нельзя принимать часто, иначе возникает расстройство кишечника.
Владимир 65 лет.
Для собственного хлебного цеха приобрел 100 кг фосфата натрия. Хорошо разрыхляет хлеб, булочки, улучшает вкус, консистенцию.
Диана 28 лет.
Часто мучает изжога. Принимала фосфат натрия вместо таблеток, как «шипучку». В целом довольна. Жаль, что нельзя принимать при беременности.
Заключение
Фосфат натрия не взрывается, не самовоспламеняется. В целом безопасен для человека, но загрязняет окружающую среду, поэтому его использование ограничено. Можно применять для приготовления пищи (в промышленных) масштабах, употреблять медикаменты на основе фосфата натрия, но с осторожностью. Регулярное потребление влечет передозировку, влияющую на функциональность пищеварительного тракта, сердечную деятельность. Работая на производстве защищайте слизистые глаз, органов дыхания, кожу. То же касается применения концентрированных чистящих средств. Кислота легко поражает дерму, дыхательные пути, вызывая симптомы от дискомфорта до раздражения, требующего врачебной помощи.
Читайте также:
- Нитрит натрия (Е250): что это, свойства, вредно или нет, использование
- Карбонат натрия (кальцинированная сода): свойства, применение, реакции
- Сульфит натрия: описание, вред и польза, формула, получение, реакции
- Альгинат натрия (Е401): свойства, инструкция по применению
Сайт предоставляет информацию в справочных целях, только для ознакомления. Поставить диагноз и назначить адекватное лечение может только врач! Медикаменты и народные средства должны назначаться специалистом, так как имеют противопоказания и побочные действия! Посещение и консультации квалифицированного специалиста строго обязательны!
Загрузка…
Химические свойства фосфата натрия — формула, получение, использование в пищевой промышленности
Содержание
-
1. Что такое фосфат натрия
-
1.1. Формула фосфата натрия
-
2. Применение фосфата натрия
-
3. Вред фосфата натрия
-
4. Видео
Внедрение инновационных технологий в промышленный сектор не возможно без применения химических соединений, необходимых для образа жизни современного Homo sapiens. Исходя из того, что потребность в фосфатах взрослого человека составляет около 1150 мг/сутки, нет ничего плохого при использовании соединений фосфата натрия для производства продуктов питания.
Что такое фосфат натрия
Фосфаты – важный элемент аденозинтрифосфорной кислоты, обеспечивающей энергетический баланс в организме человека. Термин «ортофосфат натрия» объединяет класс солей из электролиза натриевого гидроксида и ортофосфорной кислоты H3PO4 в реакции с NaCl или NaOH, используемых как регулятор кислотности, стабилизатор, эмульгатор и влагоудерживающий компонент. Дигидрофосфат принадлежит к группе соединений антиоксидантов, употребляемых в роли пищевой добавки Е339.
Формула фосфата натрия
Среди распространенных формул натриевого фосфата, которые применяют в промышленности, выделяют:
- Ортофосфат Na3PO4 с водой H2O (а также додекагидрат, тринатрийфосфат). Добавку употребляют в энергетике,производстве абразивных моющих средств, порошков,технической отрасли для обработки технологического оборудования, получения защитного покрытия на металл. Дигидрат распространенный в фармацевтике.
- Динатрийфосфат NaH2PO4 – химическое вещество, которое предотвращает слипание продуктов порошкообразной консистенции. Его второе название – натрия гидрофосфат или гидроортофосфат. Это белый порошок с высокой степенью гигроскопичности, обладающий хорошей растворимостью.
- Дигидрофосфат NaH2PO4 плюс H2O – монофосфат, моногидрат или замещенный водный, устойчивый к высоким температурам.
Применение фосфата натрия
Sodium Phosphate применяется как антикристаллизатор. Он сохраняет цвет продукта при термической обработке, делая его структуру мягкой и нежной. Химические свойства вещества позволяют избежать прогоркания, окисления продукции, получить устойчивость к разложению, Предоставляется возможность купить Na3PO4 с молярной массой 162,93 г/моль у производителя, принимая за единицу измерения объема продажи 1 кг.
Применение фосфата натрия (добавка Е339) распространено при производстве:
- молочной продукции, включая, сгущенное молоко, сухие сливки;
- кондитерских изделиях, хлебобулочных изделий;
- колбасных, мясных продуктов;
- ломтевых, плавленых сыров (как соль-плавитель);
- сухих супов и сухих бульонов;
- пастообразных соусов, разрыхлителей, чая в пакетиках.
Вред фосфата натрия
Натрий фосфорнокислый (фосфорный) относится к IV классу опасности (малоопасное вещество) и обладает высокой ступенью чистоты. С массовыми природными компонентами его структурная формула содержит вредные химически синтезированные соединения. Избыточное употребление дигидрофосфата в добавке е339 может повлиять на пищеварение и стать причиной вымывания кальция из костной ткани – в этом вред фосфата натрия.
Видео
Вред соединения для организма человека нельзя рассматривать сквозь призму ежедневного рациона питания. Пищевые добавки, превышающие ГОСТом допустимую норму, как минимум, небезопасны для здоровья. Из видео видно, что добавка Е339 способна увеличить сроки хранения, усилить влияние антиоксидантов. Na3PO4 замещает калий при выпечке продукции.
Химия в домашней колбасе. Нитрит натрия, фосфаты и цитраты.
Внимание! Информация, представленная в статье, носит ознакомительный характер. Материалы статьи не призывают к самостоятельному лечению. Только квалифицированный врач может поставить диагноз и дать рекомендации по лечению, исходя из индивидуальных особенностей конкретного пациента.
Нашли в тексте ошибку? Выделите её, нажмите Ctrl + Enter и мы всё исправим!
Применение
веществ
Органика
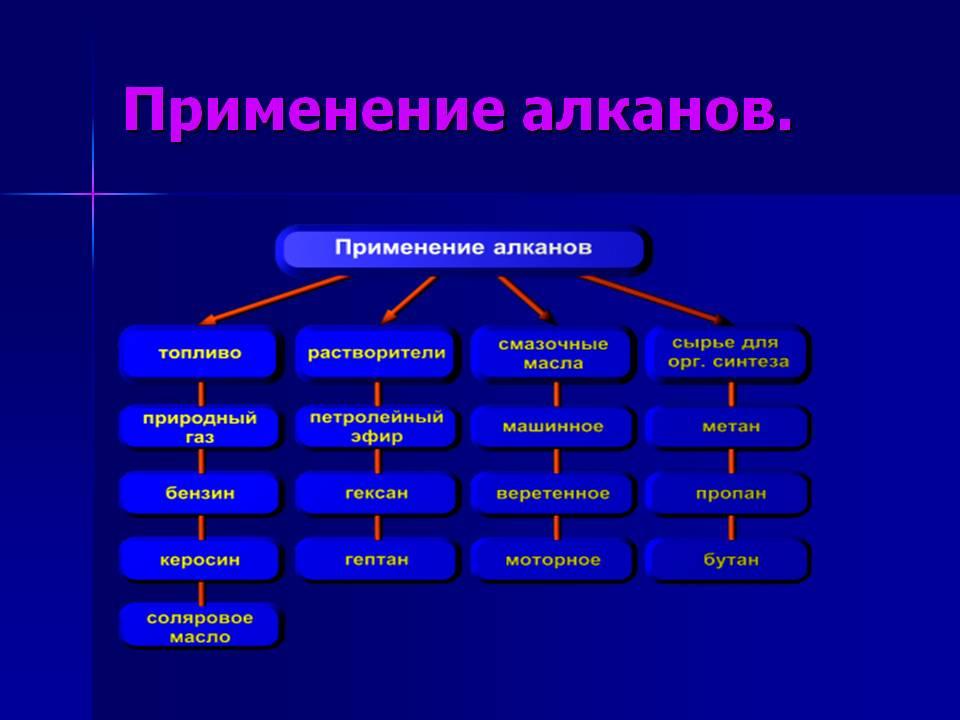
Алканы
Алканы
используются при изготовлении каучука,
синтетических тканей, пластмасс,
поверхностно-активных веществ.
Пропан,
бутан – исп-ся в качестве заправки
баллонов для тушения пожаров в сжиженном
виде
Пропан-бутановая
— смесь в зажигалках
Пропан
— баллоны для дачи
Алканы-газы
– в качестве пропеллентов для изготовления
аэрозолей
СН4
– горючее для газовых плит
С5-С19
– бензин, керосин, смеси для розжига,
топливо
С20
и далее – свечи
С₁₈Н₃₈
до С₃₅Н₇₂ (парафин) — Изготовление
вазелинового масла (смесь жидких
алканов), вазелина (смесь жидких и твёрдых
алканов), свечей, моющих средств, лаков,
эмалей, мыла. В качестве пропитки спичек.
Использование при производстве
органических кислот. В качестве пропитки
упаковочной бумаги. Производство
жевательных резинок
Хлорпроизводные
алканов — изготовление спиртов, альдегидов,
кислот, РАСТВОРИТЕЛИ
Алкены
Циклоалканы
Циклопропан
– анестетик
Циклопентан
— добавка к моторному топливу для
повышения качества.
Циклогексан
используется для синтеза полупродуктов
при производстве синтетических волокон
нейлона и капрона, для получения
циклогексанола, циклогексанона,
адипиновой кислоты, а также в качестве
растворителя.
Алкины
Ацетилен
– газовая сварка, получение технического
карбона; прим-ся в автономных светильниках
и при производстве ракетного топлива
Алкадиены
Синтез
каучуков => пол-е резины, эбонита (не
проводит эл. ток, исп-ся для изоляции),
пвх и т.д.
Бензол
Применяется
в синтезе современных отхаркивающих
средств, препаратов для лечения кожных
заболеваний и других лекарств. В малых
количествах практически не обладает
токсичностью. Применяется в качестве
исходного реагента для синтеза. Он
эффективно растворяет смолы, масла,
жиры, йод и серу.
Бензойная
кислота
Снижает
активность ферментов в структуре
микробов их
Проявляет
дезинфицирующие свойства.
Это
качество нашло активное применение
бензойной кислоты и с успехом используется
для изготовления лекарственных составов
от кашля, отхаркивающих и антисептических
средств
Получение
фунгицид, применяющихся в сельском
хозяйстве для защиты разнообразных
культурных растений.
Консервавнт
Толуол
Лакокрасочные
материалы
Лаки
Краски
РАСТВОРИТЕЛЬ
полимеров
Спирты
—
В
органическом синтезе.
— Биотопливо,
добавки в топливо, ингредиент тормозной
жидкости, гидравлических жидкостей.
—
Растворители.
— Сырье для производства
ПАВ, полимеров, пестицидов, антифризов,
взрывчатых и отравляющих веществ,
бытовой химии.
— Душистые вещества
для парфюмерии. Входят в состав
косметических и медицинских средств.
—
Основа алкогольных напитков, растворитель
для эссенций; сахарозаменитель (маннит
и т.п.); краситель (лютеин), ароматизатор
(ментол).
Этиленгликоль
Производство
теплоносителей и охлаждающих жидкостей,
задачами которых является теплопередача
и теплоотвод соответственно. Производство
пластиковых бутылок. Производство
синтетических волокон. Производство
гидравлических жидкостей. Изготовление
лекарственных средств.
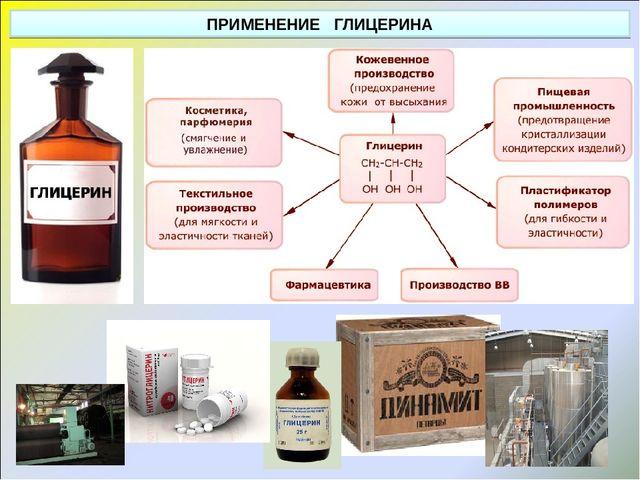
Глицерин
Фенол
АНТИСЕПТИКИ,
лекарства, заменители сахара, красители,
клеи, фенолформальдегидная смола
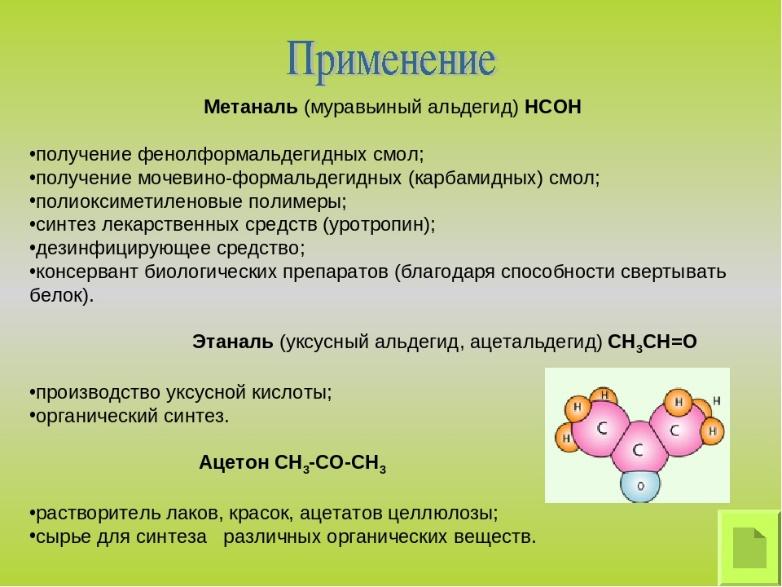
Альдегиды
и ацетон
Альдегиды
нашли широкое применение в качестве
сырья для синтеза различных продуктов.
Так, из формальдегида (крупнотоннажное
производство) получают различные смолы
(фенол-формальдегидные и т.д.), лекарственные
препараты (уротропин); ацетальдегид —
сырье для синтеза уксусной кислоты,
этанола, различных производных пиридина
и т.д. Многие альдегиды (масляный, коричный
и др.) используют в качестве ингредиентов
в парфюмерии
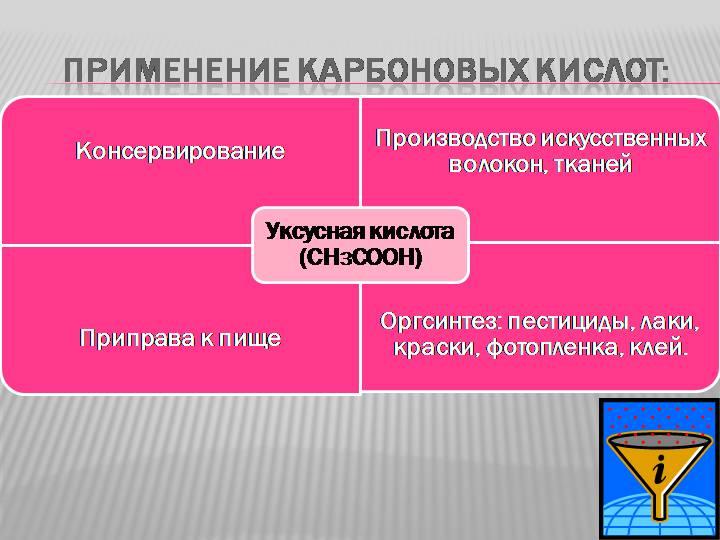
Карб
кислоты
Стеарат/пальмитат
натрия – мыло
Амины
Нитросоединения
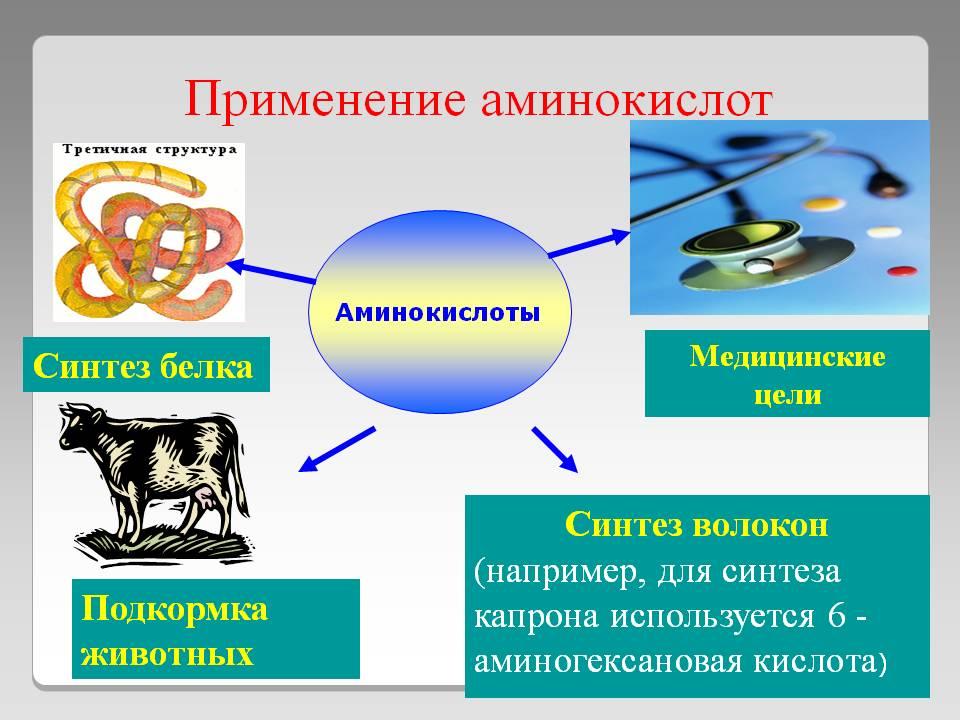
Аминокислоты
Жиры
Неорганика
Нитраты
– азотсодержащие удобрения
Фосфат,
гидрофосфат кальция; суперфосфат –
фосфорные удобрения
SiO2
– керамика, стекло
S
– резина
NaHCO3
– разрыхлитель теста, чистящее средство
(NH4)2CO3
– разрыхлитель теста
С
акт. – поглотитель в фильтрах и при
отравлениях
ССl4
– растворитель
NH3
– пол-е удобрений, пол-е азотной к-ты
NH3*H2O
– стеклоочистительные ж-ти и при потере
сознания
O3
– Дезинфекция воды; обнаруживание KI
с крахмалом
Cl2
– Дезинфекция воды; обнаруживание KI
с крахмалом
Лимонная
кислота – удвление накипи с внутр.
пов-ти чайника
H2O2
– антисептик для ран
I2
— антисептик для ран; обнар-е крахмала
Фосфат натрия представляет собой неорганическую соль , имеющая в химической формуле Na 3 PO 4 . Его также называют тринатрийфосфатом (TSP) или трехосновным фосфатом натрия, потому что он полностью лишен способности отдавать ионы водорода H + .
Когда он упоминается во множественном смысле, фосфаты натрия, он относится ко всему набору солей, гидратированных или негидратированных, возникающих в результате электростатических взаимодействий между Na + и PO 4 3- . Некоторые из этих солей даже состоят из пирофосфатов натрия или неорганических полимеров, которые содержат PO 4 3- в качестве мономера.
Стекло для часов с кристаллами фосфата натрия. Источник: Ондржей Мангл
Вот почему, если не указано иное, оно всегда будет относиться к Na 3 PO 4, а не к NaH 2 PO 4 , Na 2 HPO 4 , Na 4 P 2 O 7 или любой другой соли.
На изображении выше показан внешний вид фосфата натрия, который имеет белые кристаллы, похожие на обычную или поваренную соль, или приобретается в виде аморфного белого порошка. Na 3 PO 4 способен образовывать различные гидраты, среди которых Na 3 PO 4 · 12H 2 O наиболее коммерциализирован.
Он находит применение в основном в пищевой промышленности, в моющих средствах, спортивных добавках и служит гиперосмотическим слабительным.
Химическая структура
Основные ионы фосфата натрия. Источник: Smolamj через Википедию.
Та же формула Na 3 PO 4 показывает, что на каждый анион PO 4 3- приходится три катиона Na + . Эти ионы можно увидеть на изображении выше. Обратите внимание, что PO 4 3- имеет тетраэдрическую геометрию, а его атомы кислорода несут резонансный отрицательный заряд, который притягивает Na + из окружающей среды.
Точно так же формула Na 3 PO 4 указывает на то, что это безводная соль, поэтому в его кристаллах нет молекул воды. В результате электростатического притяжения между Na + и PO 4 3- образуется белый треугольный кристалл. Его ионная связь такова, что Na 3 PO 4 имеет температуру плавления 1583 ºC, что значительно выше, чем у некоторых солей.
И Na +, и PO 4 3- представляют собой ионы, которые могут быть сильно гидратированы без отрицательного влияния на стабильность кристаллов.
По этой причине гидраты также могут кристаллизоваться; однако его температуры плавления ниже, чем у безводной соли, поскольку межмолекулярные водородные связи в воде разделяют ионы и ослабляют их взаимодействие. У Na 3 PO 4 · 12H 2 O, например, его температура плавления составляет 73,4 ºC, что намного ниже, чем у Na 3 PO 4 .
свойства
Внешность
Он может иметь вид определенных белых кристаллов или порошка или гранул одного цвета. Все физические величины, указанные ниже, относятся только к безводной соли Na 3 PO 4 .
Температура плавления
1583 ºC
Точка кипения
100 ºC
Растворимость воды
14,5 г / 100 мл при 25 ºC, поэтому он считается хорошо растворимым в воде. Однако он нерастворим в органических растворителях, таких как этанол и сероуглерод.
плотность
2,536 г / см 3 при 17,5 ° С.
стабильность
Это гигроскопичное твердое вещество. Поэтому его необходимо хранить таким образом, чтобы не подвергать его воздействию влаги.
pH
Это сильнощелочная соль. Например, его 0,1% водный раствор уже имеет pH 11,5. Это свойство можно использовать в качестве добавки в моющие средства.
Синтез
Как производится или синтезируется фосфат натрия? Для этого мы начинаем с фосфорной кислоты H 3 PO 4 или фосфатной соли двухосновной кислоты NaH 2 PO 4 .
В подавляющем большинстве синтезов предпочтителен H 3 PO 4 . Таким образом, H 3 PO 4 реагирует с основанием, которое нейтрализует его три OH-группы, с учетом того, что эту кислоту также можно записать как PO (OH) 3 .
Предпочтительным основанием является гидроксид натрия NaOH (в Германии), но также возможно (и дешевле) использовать карбонат натрия или кальцинированную соду Na 2 CO 3 (в США). Уравнения для обеих реакций нейтрализации:
Na 2 CO 3 + H 3 PO 4 → Na 2 HPO 4 + CO 2 + H 2 O
Na 2 HPO 4 + NaOH → Na 3 PO 4 + H 2 O
Обратите внимание, что при использовании Na 2 CO 3 получается не Na 3 PO 4 , а Na 2 HPO 4 , который потребует последующей нейтрализации. Поскольку реакционная среда является водной, Na 3 PO 4 · 12H 2 O кристаллизуется , поэтому ее необходимо прокалить, чтобы удалить содержащуюся в ней воду и, таким образом, получить безводную соль.
Na 3 PO 4 · 12H 2 O характеризуется «сплавлением» кристаллов в компактную массу, которую трудно сломать. Чем меньше размер ваших кристаллов, тем быстрее они будут прокалены.
Приложения
Продукты
Фосфат натрия используется как шипучий агент для расширения булочек с корицей или пирожных. Источник: Pixabay.
При использовании фосфата натрия неизбежно смешивание Na 3 PO 4 или Na 3 PO 4 · 12H 2 O, поскольку последний является наиболее продаваемым гидратом. Например, любой из двух вносит безвредные ионы (теоретически) в продукты, в которые они добавляются, обогащая их фосфатами и одновременно повышая их соленость.
В соль для мяса включен Na 3 PO 4 · 12H 2 O, чтобы они дольше оставались свежими во время хранения. Точно так же его добавляют в качестве эмульгатора, чтобы смесь масла и воды не «разрезалась», а, скорее, оставалась единой; и как регулятор pH, поскольку он помогает снизить кислотность продуктов (в том числе злаков).
Кроме того, его используют для сгущения некоторых томатных соусов, а также для выпечки тортов или хлеба (верхнее изображение). Последнее связано с тем, что Na 3 PO 4 · 12H 2 O имеет свойство выделять водяной пар, что увеличивает размер пор в мучном тесте и его объем.
Моющие средства
Фосфат натрия достаточно щелочной, чтобы омылять некоторые жиры или масла, с которыми он контактирует. Его щелочность затем используется для улучшения действия моющих средств, если обезжириваемая поверхность неметаллическая, поскольку они могут испортить ее.
Однако производство моющих средств, обогащенных фосфатами, сократилось из-за эвтрофикации озер и рек и, как следствие, распространения водорослей, покрывающих их поверхности.
Он также использовался для изготовления дезинфицирующего средства: Na 3 PO 4 · 1/4 NaOCl · 11H 2 O, которое получают с использованием гипохлорита натрия, NaOCl, вместо NaOH или Na 2 CO 3 для нейтрализации H 3. ПО 4 .
целебный
Na 3 PO 4 вызывает дефекацию, действуя как гиперосмотическое слабительное, необходимое для очищения толстой кишки до того, как пациенту будет сделана колоноскопия. С другой стороны, он также использовался (добавлялся) в энергетических добавках.
Ссылки
- Шивер и Аткинс. (2008). Неорганическая химия . (Четвертое издание). Мак Гроу Хилл.
- Национальный центр биотехнологической информации. (2019). Тринатрийфосфат. База данных PubChem. CID = 24243. Получено с: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Тринатрийфосфат. Получено с: en.wikipedia.org
- Курран М.П. и Плоскер Г.Л. (2004). Раствор фосфата натрия для перорального применения: обзор его использования в качестве очищающего средства для кишечника. DOI: 10.2165 / 00003495-200464150-00009
- Кори Уилан. (22 декабря 2017 г.). Фосфат натрия. Получено с: healthline.com
- Джейкобс, Джоэл Б. Табороси, Стив. (2019). Процесс производства тринатрийфосфата. Получено с: freepatentsonline.com
- МэриЭнн Маркс. (2018). Почему в нашу пищу добавляют тринатрийфосфат (TSP)? Получено с: theingredientguru.com