1. Фосфор и его соединения
2.
Открытие фосфора
В 1669 Хеннинг Бранд при нагревании
смеси белого песка и выпаренной мочи
получил светящееся в темноте вещество,
названное сначала «холодным огнём».
Вторичное название
«фосфор» происходит
от греческих
слов «фос» — свет
и «феро» — несу.
3.
Строение атома фосфора,
электронно-графическая и электронная формулы
4.
Возможные степени окисления фосфора
Степень окисления
-3
0
Примеры веществ
Ca3P2, Mg3P2 , РН3
Р, Р4
+3
Р2О3, Н3РО3
+5
Р2O5 , H₃PO₄ , HPO3, H4P2O7,Na3РO4
5.
6.
Физические свойства фосфора
АЛЛОТРОПНЫЕ МОДИФИКАЦИИ ФОСФОРА:
1. Белый фосфор Р4 (табл. 18 с.104)
-молекулярная решетка ЯД !!!
2.Красный фосфор Рп — атомная решетка. Не
ядовит!
3.Черный фосфор Р – атомная решетка.
7.
Аллотропные модификации
фосфора
БЕЛЫЙ
ФОСФОР
КРАСНЫЙ
ФОСФОР
ЧЕРНЫЙ
ФОСФОР
8.
Получение фосфора
1. Метод Веллера:
1500⸰
Ca3(PO4)2 + 5C + 3SiO2 → 2P↑ + 5CO ↑ + 3CaSiO3.
Пары
белого
фосфора
9. Химические свойства фосфора
Химическая активность фосфора значительно
выше, чем у азота. Химические свойства фосфора
во многом определяются его аллотропной
модификацией. Белый фосфор очень активен, в
процессе перехода к красному и чёрному фосфору
химическая активность резко снижается.
1) Фосфор легко окисляется кислородом:
4P + 5O2 → 2P2O5,
4P + 3O2 → 2P2O3.
10. Химические свойства фосфора
Взаимодействует со многими простыми
веществами — галогенами, серой, некоторыми
металлами, проявляя окислительные и
восстановительные свойства не
взаимодействует с H2:
2) с металлами — окислитель, образует
фосфиды:
2P + 3Ca → Ca3P2.
2P + 3Mg → Mg3P2.
3) с неметаллами — восстановитель:
2P + 3S → P2S3,
2P + 3Cl2 → 2PCl3.
11. Химические свойства фосфора
4) Взаимодействует с водой, при этом
диспропорционирует ( 700-800°C, кат.Pt? Cu):
4Р + 6Н2О → РН3 + 3Н3РО2 (фосфатная кислота).
5) Взаимодействие со щелочами
В растворах щелочей диспропорционирование
происходит в большей степени:
4Р + 3KOH + 3Н2О → РН3 + 3KН2РО2.
6) Сильные окислители превращают фосфор в
фосфорную кислоту:
3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO;
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O.
7) Реакция окисления также происходит при
поджигании спичек, в качестве окислителя выступает
бертолетова соль:
• 6P + 5KClO3 → 5KCl + 3P2O5
ПРИМЕНЕНИЕ!!!
12.
Соединения фосфора
1. Фосфиды- соединения фосфора с металлами ( Ca3P2)
2. Фосфин -соединение с водородом( РН3).
Ядовитый бесцветный газ с запахом чеснока. Образуется при разложении
органических соединений. Окисление кислородом-«блуждающие огни»
3.Оксиды
Р2О3 или Р4О6
Триоксид дифосфора,
Оксид фосфора (III)-
Р2О5 или Р4О10
Пентаоксид дифосфора,
Оксид фосфора (V)-
Белое кристаллическое
вещество, реагирует с водой
Белое кристаллическое
вещество, реагирует с водой
Р2О3+ 3Н2О= 2Н3РО3
Р2О5+ 3Н2О= 2Н3РО4
Фосфористая (фосфоновая) кислота
Соли-фосфиты
Фосфорная (ортофосфорная)
кислота
13.
Р2О5- кислотный оксид
Взаимодействует:
1) с водой, образуя при этом различные кислоты
Р2О5 + Н2О = 2HPO3 метафосфорная
Р2О5 + 2Н2О = Н4Р2О7 пирофосфориая (дифосфорная)
Р2О5 + ЗН2О = 2H3PO4 ортофосфорная
2) с основными и амфотерными оксидами, образуя фосфаты
Р2О5 + ЗВаО = Ва3(PO4)2
в) со щелочами, образуя средние и кислые соли
Р2О5 + 6NaOH = 2Na3PO4 + ЗН2О
Р2О5 + 4NaOH = 2Na2HPO4 + Н2О
Р2О5 + 2NaOH = 2NaH2PO4 + Н2О
14.
Р2О5- водоотнимающий реагент
Фосфорный ангидрид отнимает у других веществ не
только гигроскопическую влагу, но и химически
связанную воду. Он способен даже дегидратировать
оксокислоты:
Р2О5 + 2HNО3 = 2HPO3 + N2О5
Р2О5 + 2НСlО4 = 2HPO3 + Сl2О7
Это используется для получения ангидридов кислот.
15.
Р2О5- кислотный оксид
+5
H₃PO₄
+5
Р2О5
Ортофосфорная кислота
+5
HPO3
Метафосфорная кислота
+5
H4P2O7
Пирофосфорная кислота
16.
Физические свойства
ортофосфорной кислоты
При обычной температуре безводная Н3РO4
представляет собой прозрачное кристаллическое
вещество, очень гигроскопичное и легкоплавкое
(t. пл. 42°С).
Смешивается с водой в любых соотношениях.
17.
Получение
ортофосфорной кислоты
Исходным сырьем для промышленного получения Н3РO4 служит
природный фосфат Са3(РO4)2:
I. Са3(РO4)2 → Р → Р2O5 → Н3РO4
1) Са3(РО4)2 + 5С + 2SiO2 = 2P + 5CO + Ca3Si2O7
2) 4Р + 5О2 = 2Р2О5
3) Р2О5 + 3Н2О = 2Н3РО4.
II. Обменное разложение фосфорита серной кислотой
Са3(РO4)2 + 3H2SO4 = 2Н3РO4 + 3CaSO4
Получаемая по этому способу кислота загрязнена сульфатом кальция.
III. Окисление фосфора азотной кислотой (лабораторный способ):
ЗР + 5HNO3 + 2Н2О = ЗН3РO4 + 5NO↑
18. Химические свойства ортофосфорной кислоты
• Н3РО4
Изменяет
окраску
Индикатора???
Металлы до Н
Основные и амфотерные
оксиды
Основания
Соли
19. Ортофосфорная кислота и её свойства
Диссоциация ортофосфорной кислоты
1.
дигидрофосфат -ион
2.
гидрофосфат -ион
3.
фосфат -ион
20. Ортофосфорная кислота и её свойства
Допишите уравнения реакций
Н3РО4+Са=
Н3РО4+СаО=
Н3РО4+Са(ОН)2=
Н3РО4+СаСО3=
21. Качественная реакция на фосфат — ионы
• K3PO4+3AgNO3=Ag3PO4↓+3KNO3
при этом выпадает
жёлтый осадок
нитрата серебра
22.
Соли ортофосфорной кислоты
Н3РO4 как 3-основная кислота образует 3 типа солей,
которые имеют большое практическое значение.
Анион соли
Растворимость в
воде
Примеры солей
Фосфаты
PO43-
большинство
нерастворимо
(кроме фосфатов
щелочных Me и
аммония)
Na3РO4;
Са3(РO4)2
Гидрофосфаты
HPO42-
растворимы
Na2НРO4;
СаНРО4
Дигидрофосфаты
Н2РO4-
очень хорошо
растворимы
NaH2PO4;
Са(Н2РO4)2
Название
23.
Производство
спичек
Моющие
Фосфорная
средства
кислота
Ядохимикаты
Р
Пищевые
добавки Медицина
Удобрения
Взрывчатые
вещества
Скачать материал

Скачать материал


- Сейчас обучается 40 человек из 30 регионов




- Сейчас обучается 431 человек из 67 регионов


Описание презентации по отдельным слайдам:
-
1 слайд
Не нужен университет,
Ни Кембридж, и ни Оксфорд,
Чтобы узнать: латинской «Р»
Обозначают … -
2 слайд
План урока
Паспортные данные фосфора
Станция историческая
Станция «Аллотропные модификации»
Станция геологическая
Станция химическая
Станция здоровья
Станция прикладная
Станция поэтическая
Станция контрольная -
3 слайд
Паспортные данные фосфора
Перечислите элементы V группы.
Охарактеризуйте фосфор по положению
в периодической системе химических элементов
Д.И. Менделеева.
Опишите электронное строение атома фосфора.
В чем сходство и различие в строении атомов азота
и фосфора?
Назовите возможные степени окисления фосфора.
Напишите формулу его высшего оксида, укажите его характер.
Напишите формулу гидроксида фосфора, укажите его характер.
Напишите формулу летучего водородного соединения фосфора.
У какого элемента сильнее выражены неметаллические свойства: а) азот, фосфор, мышьяк; б) кремний, фосфор, сера? -
4 слайд
Станция историческая
Фосфор впервые получил в 1669 г. алхимик из Гамбурга Хеннинг Бранд. Подобно другим алхимикам, он пытался получить философский камень. Однажды ему пришло в голову выпарить воду из мочи, которая
в большом количестве скапливалась в ямах около солдатских казарм. Он смешал полученный сухой остаток с углем
и песком, прокалил и… в реторте оказалось удивительное, светящееся в темноте вещество, которое он назвал «холодным огнем».
Свое название фосфор получил
за способность светиться в темноте
(греч. фосфор означает «светоносный»). -
5 слайд
К.В. Шееле
(1742–1786)
Вскоре Ю. Ган и К Шееле доказали, что
в костях содержится много фосфора.
Немного позже Ж. Пруст и М. Клапрот, исследуя различные природные соединения, доказали, что фосфор широко распространен в земной коре, главным образом в виде фосфата кальция.Антуан Лоран
Лавуазье
В начале 70-х гг. XVIII в. великий французский ученый А. Лавуазье, сжигая фосфор в замкнутом объеме воздуха, доказал, что фосфор – самостоятельный химический элемент.
В 1799 г. было доказано, что соединения фосфора необходимы для нормального развития растений.
Бриджмен
В 1847 г. немецкий химик Шретер получил красный фосфор. В 1934 г. американский ученый Бриджмен выделил черный фосфор. Впоследствии были выделены фиолетовый и коричневый фосфор. -
6 слайд
«Да! Это была собака, огромная, черная как смоль… Из ее отверстой пасти вырывалось пламя, глаза метали искры, по морде и загривку переливался мерцающий огонь. Ни в чьем воспаленном мозгу не могло бы возникнуть видение более страшное, более омерзительное, чем это адское существо, выскочившее на нас из тумана… Его огромная пасть все еще светилась голубоватым пламенем, глубоко сидящие дикие глаза были обведены огненными кругами. Я дотронулся до этой светящейся головы и, отняв руку, увидел, что мои пальцы тоже засветились в темноте. «Фосфор», – сказал я».
Изучите аллотропные модификации фосфора
и найдите ошибку в тексте. Заполните таблицу. -
7 слайд
Аллотропные модификации фосфора
-
8 слайд
Станция «Аллотропные модификации»
Фосфор
Белый
фосфор
Красный
фосфор
Черный
фосфор -
9 слайд
Белый фосфор
Наиболее распространен белый, или желтый, фосфор. Белый фосфор имеет молекулярную решетку, в узлах которой находятся тетраэдрические молекулы Р4.
Это очень реакционноспособное, мягкое воскообразное вещество бледно-желтого цвета, с неприятным чесночным запахом, растворимое в сероуглероде и бензоле,
нерастворимое в воде. Очень ядовит. Воспламеняется при трении, обладает уникальной способностью светиться в темноте за счет медленного окисления.
Температура плавления – 44оС. В лаборатории его хранят под слоем воды. Смертельная доза– 0,1 г. -
10 слайд
Красный фосфор
Аморфный темно-малиновый порошок без запаха. Менее активен, чем белый фосфор, нерастворим в воде
и сероуглероде, не светится в темноте
и не самовоспламеняется, абсолютно безвреден. Температура возгорания – 260оС. -
11 слайд
Черный фосфор
Ромбическая модификация
Кубическая модификация
Имеет атомную кристаллическую решетку.
По внешним признакам черный фосфор напоминает графит, имеет металлический блеск, обладает электропроводностью
и теплопроводностью, довольно твердый.
Наименее активный из всех модификаций. -
12 слайд
Схема получения красного и черного фосфоров
-
13 слайд
Станция геологическая
Фосфор встречается в природе только в связанном состоянии. Массовая доля фосфора в земной коре – около 0,12%.
Важнейшие минералы:
Сa3(PO4)2 – фосфорит;
3Сa3(PO4)2∙Ca(OH)2 – гидроксиапатит;
3Сa3(PO4)2∙CaF2 – фторапатит.
В 1806 г. Ф. Велер предложил получение фосфора
из фосфата кальция, песка и угля. Расставьте коэффициенты в уравнении реакции с электронным балансом: -
14 слайд
Станция химическая
Взаимодействие с активными металлами:
Mg + P →
Взаимодействие с кислородом:
Р + О2 →
Взаимодействие с бертолетовой солью:
Р + KClO3 → Р2О5 + KClДопишите уравнения реакций. Какую роль выполняет фосфор в этих реакциях? Составьте электронный баланс к данным реакциям.
-
15 слайд
Станция здоровья
По содержанию в организме человека фосфор относится к макроэлементам (w(Р) = 0,95%).
Фосфор входит в состав костной, нервной
и мозговой тканей, крови, молока.
Фосфором богаты яйца, мясо, молоко, хлеб.
Почти все важнейшие физиологические процессы, происходящие в организме человека, связаны с превращениями соединений фосфора.Следите за своим здоровьем!
-
16 слайд
Станция прикладная
Более половины объема мирового производства фосфора перерабатывается
в соединения, используемые
в синтетических моющих средствах.
Соединения фосфора используют для получения антикоррозионных добавок
к маслам и горючему для автомобилей.
Сульфиды фосфора стали необходимы
в сражении с ржавчиной в металлургии.
Фосфор используется при производстве спичек.
Фосфор нужен для получения фосфористой бронзы. -
17 слайд
Станция поэтическая
Я светоносный элемент.
Я спичку вам зажгу в момент.
Сожгут меня – и под водой
Я сразу стану кислотой.Запишите уравнения реакций, о ко-
торых идет речь в этом стихотворе-
нии. -
18 слайд
Знаете ли вы, что…
пшеница при среднем урожае из почвы берет в год 72 кг азота и 30 кг фосфора?
исследования Луны показали присут-ствие там фосфора (w(Р) = 0,08%)?
каждый из нас носит в себе 4,5 кг фосфора в виде химических соединений?
свыше 85% содержащегося в организме фосфора приходится на долю костной ткани?
в Амстердаме в 1730 г. 31 г фосфора стоил около 80 золотых рублей? -
-
20 слайд
Станция контрольная
1. Сколько электронов в атоме фосфора находится на внешнем энергетическом уровне?
1) 2 ;2) 3; 3) 5; 4) 15.
2. Число нейтронов в ядре атома 31Р:
1) 5;2) 15;3) 16;4) 31.
3. Максимальная степень окисления фосфора в соединениях равна:
1) +6; 2) +5;3) +3;4) +4.
4. При взаимодействии фосфора с активными металлами образуются соединения, в которых его степень окисления равна:
1) -3;2) 0;3) +3;4) +5.
5. Среди перечисленных элементов V группы типичным неметаллом является:
1) фосфор;2) мышьяк;3) сурьма;4) висмут.
6. В соединениях РН3, Р205, Н3Р03 фосфор имеет степени окисления, соответственно равные:
1) +3; +5; -3; 2) -3; +5; +3;3) -3; +3; +5;4) +3; -5; -3.
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
6 156 999 материалов в базе
- Выберите категорию:
- Выберите учебник и тему
- Выберите класс:
-
Тип материала:
-
Все материалы
-
Статьи
-
Научные работы
-
Видеоуроки
-
Презентации
-
Конспекты
-
Тесты
-
Рабочие программы
-
Другие методич. материалы
-
Найти материалы
Материал подходит для УМК
Другие материалы






Рейтинг:
5 из 5
- 21.11.2021
- 781
- 49

Рейтинг:
5 из 5
- 21.11.2021
- 1466
- 96

Вам будут интересны эти курсы:
-
Курс повышения квалификации «Химия окружающей среды»
-
Курс профессиональной переподготовки «Химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Основы туризма и гостеприимства»
-
Курс повышения квалификации «Организация научно-исследовательской работы студентов в соответствии с требованиями ФГОС»
-
Курс повышения квалификации «Нанотехнологии и наноматериалы в биологии. Нанобиотехнологическая продукция»
-
Курс повышения квалификации «История и философия науки в условиях реализации ФГОС ВО»
-
Курс повышения квалификации «Особенности подготовки к сдаче ОГЭ по химии в условиях реализации ФГОС ООО»
-
Курс профессиональной переподготовки «Организация менеджмента в туризме»
-
Курс профессиональной переподготовки «Биология и химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Организация маркетинга в туризме»
-
Курс повышения квалификации «Современные образовательные технологии в преподавании химии с учетом ФГОС»
-
Курс профессиональной переподготовки «Корпоративная культура как фактор эффективности современной организации»
-
Курс профессиональной переподготовки «Техническое сопровождение технологических процессов переработки нефти и газа»
-
Курс профессиональной переподготовки «Организация системы учета и мониторинга обращения с отходами производства и потребления»
1
ФОСФОР И ЕГО СОЕДИНЕНИЯ Учитель химии МОУ лицея 6 Дробот Светлана Сергеевна
2
Содержание Строение атома фосфора Аллотропные модификации фосфора Нахождение в природе Химические свойства фосфора Получение фосфора Фосфин Оксид фосфора (V) Оксид фосфора (V) Ортофосфорная кислота Соли фосфорной кислоты Источники информации Загадки
3
Строение атома фосфора Элемент VA группы имеет электронную формулу 1s 2 2s 2 2p 6 3s 2 3p 3. Фосфор – неметалл. Наиболее характерные степени окисления: +5, +3, 0, -3. Оксиды Э 2 О 5 и Э 2 О 3 имеют кислотные свойства. Летучее водородное соединение – фосфин PH 3.
4
Аллотропные модификации фосфора Белый фосфор обладает молекулярной кристаллической решеткой; это вещество желтоватого цвета с чесночным запахом. В парах имеет состав Р 4.На воздухе воспламеняется при 18ºС. При хранении на свету переходит в красный. В воде нерастворим, зато хорошо растворим в сероуглероде, бензоле и других органических растворителях. Он весьма ядовит: 0,1 г белого фосфора – смертельная доза для человека.
5
Противоядием при отравлении фосфором служит 2% раствор медного купороса, который следует давать больному через 5 минут по чайной ложке до появления рвоты. Горящий фосфор не только причиняет очень сильные ожоги, но и вызывает отравление тканей, прилежащих к месту ожога, вследствие чего заживление идет крайне медленно. При ожогах фосфором противоядием служит мокрая повязка, пропитанная 5% раствором медного купороса. В связи с тем, что белый фосфор легко окисляется и воспламеняется, его хранят под водой.
6
Красный фосфор – порошок со слабо выраженной кристаллической структурой и поэтому названный аморфным, темно- красного цвета, имеет атомную решетку, весьма гигроскопичен (легко поглощает воду), но в воде нерастворим; нерастворим он и в сероуглероде. Красный фосфор получается при длительном нагревании белого фосфора без доступа воздуха при 450ºС. В отличие от белого – не ядовит, запаха не имеет, воспламеняется при ºС.
7
Фиолетовый и черный фосфор также получают из белого при высоких давлении и температуре. Черный фосфор обладает металлическим блеском, проводит электричество и тепло. Следовательно, у фосфора в незначительной степени проявляются металлические свойства
8
Нахождение в природе Фосфор — составная часть растительных и животных белков. У растений фосфор сосредоточен в семенах, у животных — в нервной ткани, мышцах, скелете. Организм человека содержит около 1,5 кг фосфора: 1,4 кг – в костях, 130 г – в мышцах и 13 г в нервной ткани. Содержание фосфора в организме человека составляет приблизительно 1% от массы тела. Суточное потребление фосфора человеком – около 2 г.
9
В природе фосфор находится в связанном виде. Важнейшие минералы: апатит и фосфорит Ca 3 (PO 4 ) 2. Известно много разновидностей апатита, из которых наиболее распространен фторапатит 3Ca 3 (PO 4 ) 2 · CaF 2.
10
Химические свойства фосфора В химическом отношении белый фосфор сильно отличается от красного. Белый фосфор легко окисляется и самовоспламеняется на воздухе, поэтому его хранят под водой. Красный фосфор не воспламеняется на воздухе, но воспламеняется при нагревании свыше 240ºС. При окислении белый фосфор светится в темноте – происходит непосредственное превращение химической энергии в световую.
11
Фосфор соединяется со многими простыми веществами – кислородом, галогенами, серой и некоторыми металлами, проявляя окислительные и восстановительные свойства. 1. С кислородом. При горении фосфора образуется белый густой дым. Белый фосфор самовоспламеняется на воздухе, а красный горит при поджигании. Фосфор сгорает в кислороде ослепительно ярким пламенем. 4P + 3O 2(недостат) 2P 2 O 3 (P 4 O 6 ) 4P + 5O 2(избыток) 2P 2 O 5 (P 4 O 10 )
12
2. С галогенами. С элементами, обладающими большей, чем у фосфора, электроотрицательностью, фосфор реагирует очень энергично. Если в сосуд с хлором внести красный фосфор, то через несколько секунд он самовоспламеняется в хлоре. При этом обычно получается хлорид фосфора (III). 4P + 6Cl 2(недостат) 4PCl 3 4P + 10Cl 2(избыток) 4PCl 5
13
3. С серой при нагревании. 4P + 6S 2P 2 S 3 4P + 10S 2P 2 S 5 4. Фосфор окисляет при нагревании почти все металлы, образуя фосфиды: 2P + 3Ca Ca 3 P 2 Фосфиды металлов легко гидролизуются водой. Ca 3 P 2 + 6H 2 O 2PH 3+ 3Ca(OH) 2
14
5. Красный фосфор окисляется водой при температуре около 800ºС в присутствии катализатора – порошка меди: 2P + 8H 2 O 2H 3 PO 4 + 5H 2 6. Концентрированная серная кислота окисляет при нагревании фосфор: t 2P + 5H 2 SO 4(к) 5SO 2 + 2H 3 PO 4 + 2H 2 O 7. Азотная кислота при нагревании окисляет фосфор t P + 5HNO 3(к) 5NO 2 + H 3 PO 4 + H 2 O 3P + 5HNO 3(разб) + 2H 2 O 5NO + 3H 3 PO 4
15
Получение фосфора Фосфор может быть получен нагреванием смеси фосфорита, угля и песка в электропечи. Уравнение легче составить, если представить протекание в две стадии: 1) Ca 3 (PO 4 ) 2 + 3SiO 2 P 2 O 5 + 3CaSiO 3 2) P 2 O 5 + 5C 2P + 5CO ________________________________________ Ca 3 (PO 4 ) 2 + 5C + 3SiO 2 2P + 3CaSiO 3 + 5CO
16
Фосфин Фосфор в степени окисления -3 образует водородное соединение фосфин PH 3, аналогичное аммиаку. Эта степень окисления менее характерна для фосфора, чем для азота. Фосфин – ядовитый газ с чесночным запахом, может быть получен из фосфида цинка действием кислот или воды: Zn 3 P 2 + 6HCl 2PH 3 + 3ZnCl 2 Основные свойства фосфина слабее, чем у аммиака: PH 3 + HCl PH 4 Cl
17
Соли фосфония в водных растворах неустойчивы: PH H 2 O PH 3 + H 3 O + Фосфин имеет восстановительные свойства (низшая степень окисления фосфора), горит на воздухе (самовоспламеняется): 2PH 3 + 4O 2 P 2 O 5 + 3H 2 O или PH 3 + 2O 2 H 3 PO 4 Фосфин окисляется очень многими окислителями PH 3 + 8HNO 3(к) 8NO 2 + H 3 PO 4 + 4H 2 O Фосфид цинка используется в качестве зооцида для борьбы с грызунами.
18
Оксид фосфора (V) Оксид фосфора(V) P 2 O 5 (или P 4 O 10 ) образуется при горении фосфора на воздухе. 4Р + 5О 2 2Р 2 О 5 Твердое кристаллическое вещество Р 2 О 5 гигроскопично и используется как водоотнимающее средство. 1. При взаимодействии с водой оксид фосфора(V) образует на холоду метафосфорную кислоту НРО 3, имеющую полимерное строение: P 2 O 5 + H 2 O 2HPO 3
19
или при нагревании ортофосфорную кислоту Н 3 РО 4. P 2 O 5 + 3H 2 O 2H 3 PO 4 2. Как кислотный оксид, вступает в реакции с основными оксидами: P 2 O 5 + 3CaO Ca 3 (PO 4 ) 2 3. С щелочами: P 2 O 5 +3Ca(OH) 2 Ca 3 (PO 4 ) 2 + 3H 2 O
20
Ортофосфорная кислота В промышленности фосфорную кислоту получают действием серной кислоты на фосфорит: Ca 3 (PO 4 ) 2 + 3H 2 SO 4 3CaSO 4 + 2H 3 PO 4 Ортофосфорная кислота представляет собой кристаллическое вещество (tпл = 42ºС), растворимое в воде. Как трехосновная кислота средней силы диссоциирует ступенчато. Она вступает во многие реакции, характерные для кислот.
21
Химические свойства фосфорной кислоты 1.С металлами, стоящими в ряду напряжения металлов до водорода: 3Mg + 2H 3 PO 4 Mg 3 (PO 4 ) 2 + 3H 2 2.С основными оксидами: 3CaO + 2H 3 PO 4 Сa 3 (PO 4 ) 2 + 3H 2 O 3.С основаниями и аммиаком: H 3 PO 4 + NaOH NaH 2 PO 4 + H 2 O H 3 PO 4 + 2NaOH Na 2 HPO 4 + 2H 2 O H 3 PO 4 + 3NaOH Na 3 PO 4 + 3H 2 O H 3 PO 4 + NH 3 (NH 4 ) 2 HPO 4
22
4.С солями слабых кислот: 2H 3 PO 4 + 3Na 2 CO 3 2Na 3 PO 4 + 3H 2 O + 3CO 2 5.При нагревании постепенно превращается в метафосфорную кислоту: t 2H 3 PO 4 H 4 P 2 O 7 + H 2 O t дифосфорная кислота H 4 P 2 O 7 2HPO 3 + H 2 O метафосфорная кислота
23
6.При действии раствора нитрата серебра появляется желтый осадок: H 3 PO 4 + 3AgNO 3 Ag 3 PO 4 + 3HNO 3 желтый осадок Это качественная реакция на фосфорную кислоты и её соли – фосфаты.
24
Соли фосфорной кислоты Различают средние соли — фосфаты (Na 3 PO 4 ) и кислые соли — гидрофосфаты (Na 2 HPO 4 ) и дигидрофосфаты (NaH 2 PO 4 ). Растворимы в воде фосфаты и гидрофосфаты щелочных металлов и аммония. Все дигидрофосфаты растворимы в воде. Фосфорная кислота вытесняется более сильными кислотами из её солей: Сa 3 (PO 4 ) 2 + 3H 2 SO 4 3CaSO 4 + 2H 3 PO 4 конц.
25
26
Источники информации 1. Рябов М.А., Линко Р.В. Общая и неорганическая химия. Конспект лекций. М.: Издательство Российского университета дружбы народов, Пузаков С.А., Попков В.А. Пособие по химии для поступающих в вузы. Учебное пособие. М.: Высшая школа, Хомченко Г.П. Пособие по химии для поступающих в вузы. – М.: ООО «Издательство Новая Волна», 2002.
27
4. Потапов В.М., Чертков И.Н. Строение и свойства органических веществ. Пособие для учащихся 10 кл. – М.: Просвещение, Оганесян Э.Т. Руководство по химии поступающим в вузы. Справочное пособие. М.: Высшая школа, Иванова Р.Г., Осокина Г.Н. Изучение химии в 9-10 классах. Книга для учителя. – М.: Просвещение, Ахметов Н.С. Общая и неорганическая химия. Учебник для вузов. М.: Высшая школа, 2005.
28
Предупреждаю вас заранее: Я непригоден для дыхания! Но все как будто бы не слышат И постоянно мною дышат. Элементом мысли являюсь я, Плохо растениям без меня, В производстве спичек необходим, В аллотропные формы вхожу один. Загадки
29
Открыт он в виде массы, похожей так на воск, И в темноте светился, как свет далёких звёзд. Алхимик был в ударе, а как же тут не быть – Камень философский попробуй–ка добыть! Но радость с огорчением рядышком идёт, Здоровья и богатства камень не даёт. Так был ли это камнем светящийся тот воск? Подумайте, ребята, вопрос не так уж прост. Загадка
Презентация «Фосфор и его соединения»
Подписи к слайдам:
Фосфор и его соединения
- Фосфор Р +15)2е)8е)5е 15р,15е,16п степени окисл -3,0,+3,+5
- ( белый,
- красный,
- чёрный)
- Решётки
- ( молекулярная Р4,
- атомная.
- атомная.)
Аллотропные модификации фосфора
- Чёрный фосфор
- Красный фосфор
- Белый фосфор
Химические свойства фосфора
- Горение фосфора
Оксиды фосфора
Взаимодействие оксида фосфора(V) с водой
Фосфорные кислоты
Свойства ортофосфорной кислоты
- Н3РО4
- Металлы до Н
- Основные и амфотерные
- оксиды
- Основания
- Соли
- Н3РО4+Са=
- Н3РО4+СаО=
- Н3РО4+Са(ОН)2=
- Н3РО4+СаСО3=
- Изменяет
- окраску
- индикатора
Фосфорная кислота и её свойства
Качественная реакция на фосфат ион- ионы серебра
- K3PO4+3AgNO3=Ag3PO4↓+3KNO3
- при этом выпадает жёлтый осадок нитрата серебра
Слайд 1Фосфор и его соединения
9 класс, базовый уровень по химии О.С. Габриеляна
Храбалова
Ольга Сергеевна
учитель химии
МБОУ СШ №7 им. А.П. Гайдара
г. Арзамас

Слайд 2Станция «Историческая»
Гамбургский алхимик
Хеннинг Бранд
1669 год
«Фосфор» —
от греческого «светоносный»

Слайд 3Порядковый номер – 15
Период – 3
Группа – V
Низшая СО —
3
Высшая СО + 5
Станция «Анатомическая»

Слайд 6Твердое вещество с металлическим блеском,
жирное на ощупь, похожее на графит,
полупроводник,
малоактивен, практически негорюч

Слайд 7Взаимодействует с металлами
2Р + 3Са =
Са3Р2 (фосфид кальция)
P + 3Na = Na3P (фосфид натрия)
Станция «Химическая»

Слайд 8Горит в кислороде
4Р + 5О2 = 2
Р2О5
оксид фосфора (V)

Слайд 9Получение фосфора
нагреванием смеси фосфорита, угля и
песка в электропечи:
Ca3(PO4)2 + C
+ SiO2 → P4 + CaSiO3 + CO

Слайд 10Соединения фосфора
Фосфин
Оксид фосфора (V)
Ортофосфорная кислота

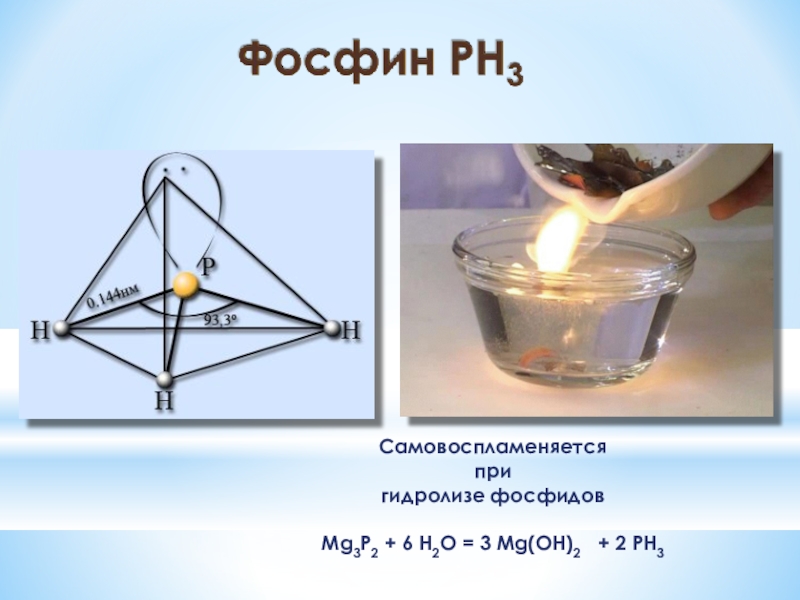
Слайд 11Самовоспламеняется
при
гидролизе фосфидов
Mg3P2 + 6 H2O = 3 Mg(OH)2
+ 2 PH3
Слайд 12Белый гигроскопичный порошок, хорошо растворяется в воде, является кислотным оксидом.

Слайд 13Кислотный оксид Р2О5
Химические свойства
1) с водой
Р2О5 + 3 Н2О =
2Н3РО4
(ортофосфорная кислота)
Р2О5 + Н2О = 2НРО3
(метафосфорная кислота)
Р2О5 + 2 Н2О = Н4Р2О7
(пирофосфорная кислота)

Слайд 14Кислотный оксид Р2О5
Химические свойства
2) с основными оксидами
Р2О5 + 3 СаО =
Са3 (РО4)3
3) со щелочами
Р2О5 + 6 Nа ОН = 2 Nа3РО4 + 3 Н2О

Слайд 16Ортофосфорная кислота Н3РО4
Физические свойства
Белые прозрачные кристаллы,
не ядовита
Кислота средней силы
С
водой смешивается в любых соотношениях.
Тплав. = 42 0С, плавиться без разложения, при умеренном нагревании разлагается.
Окислительные свойства не проявляет (отличие от Н2SO4 (конц.), НNO3)

Слайд 17Ортофосфорная кислота Н3РО4
Химические свойства
Н3РО4 проявляет все свойства кислот
Реагирует:
1) со
щелочами: NaOH, КОН
2) с основными оксидами: Li2O, Na2O
3) c солями: К2СО3
4) с металлами не реагирует !!! ?
(см. Таблицу растворимости)

Слайд 18Ортофосфорная кислота Н3РО4
Химические свойства
Некоторые реакции с металлами протекают в очень
разбавленных растворах:
2 Н3РО4 (разб) + 3 Мg = Мg3(РО4 )2↓ + 3Н2↑

Слайд 19Качественная реакция
на фосфат-ион РО43-
РО43- + 3 Ag+
= Ag3РО4 ↓ (желтый фосфат серебра)
Полученный осадок растворяется в сильных кислотах.
По этому признаку его можно отличить от других нерастворимых солей серебра желтого цвета – AgI, AgBr
AgCl – белого цвета

Слайд 20Качественная реакция на фосфат-ион
РО43- + 3 Ag+ = Ag3PO4↓

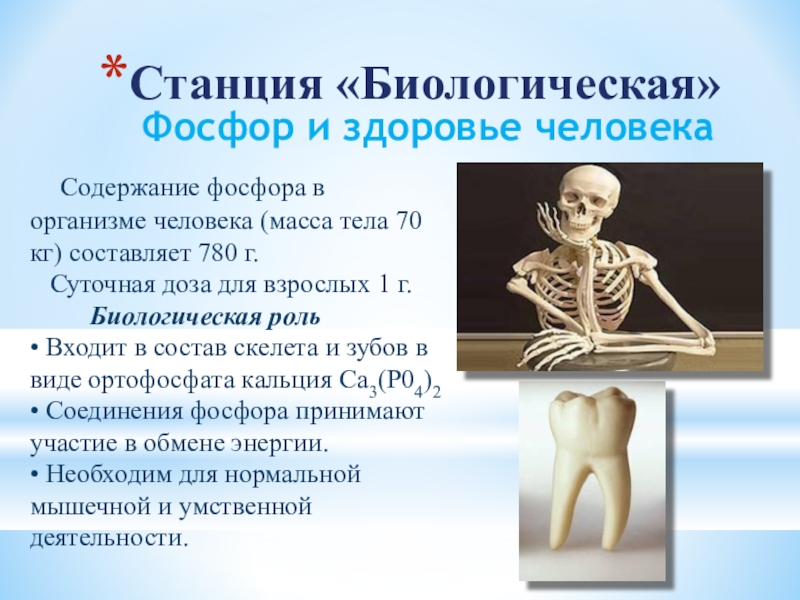
Слайд 22Фосфор и здоровье человека
Содержание фосфора в организме человека (масса
тела 70 кг) составляет 780 г.
Суточная доза для взрослых 1 г.
Биологическая роль
• Входит в состав скелета и зубов в виде ортофосфата кальция Са3(Р04)2
• Соединения фосфора принимают участие в обмене энергии.
• Необходим для нормальной мышечной и умственной деятельности.
Станция «Биологическая»
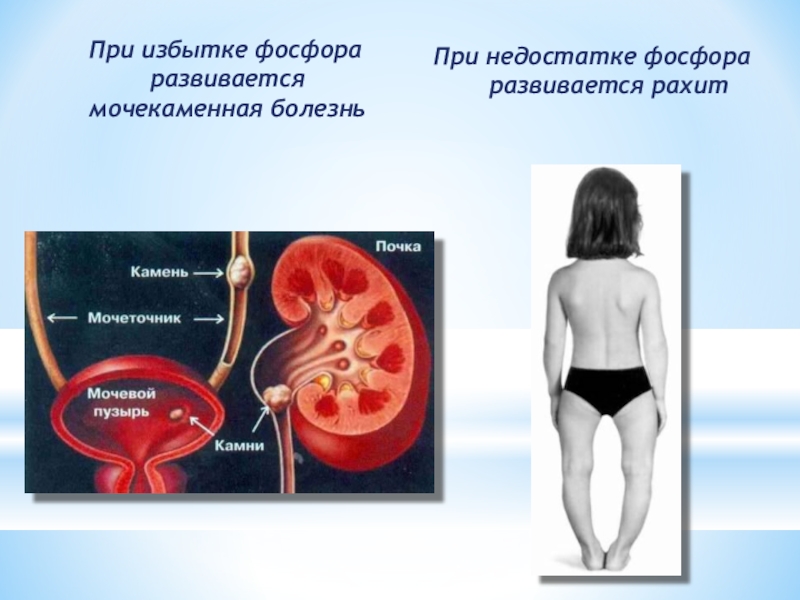
Слайд 24 При избытке фосфора развивается мочекаменная болезнь
При недостатке фосфора развивается
рахит
Слайд 25Осторожно – фосфор!
Летальная доза Р4 равна 60 мг.
Большую опасность представляют
ожоги, возникающие при горении фосфора, из-за выделения большого количества тепла при взаимодействии образующегося при горении Р2О5 с влагой кожи.

Слайд 26Применение
Производство спичек
Производство
минеральных удобрений
Производство
инсектицидов

Слайд 27Дана схема превращений:
Для второй реакции составьте электронный баланс, укажите окислитель и
восстановитель. Процессы окисления и восстановления.
7-ю реакцию запишите в ионном виде.

Слайд 28Домашнее задание
§ 28 упр. 1-3
Составить сказку, или кроссворд

Фосфор и его соединения
История открытия
Считается, что фосфор открыл в 1669 году алхимик из Гамбурга Хеннинг Бранд. Он был разорившимся купцом и пытался разбогатеть с помощью алхимии.
Предполагая, что физиологические продукты могут содержать «первичную материю», которая считалась основой философского камня, Бранд заинтересовался человеческой мочей.
История открытия
Он собрал около тонны мочи из солдатских казарм и выпаривал ее до образования сиропообразной жидкости. Эту жидкость он вновь дистиллировал и получил тяжелое красное «уринное масло», которое перегонялось с образованием твердого остатка. Нагревая последний, без доступа воздуха, он заметил образование белого дыма, оседавшего на стенках сосуда и ярко светившего в темноте.
Бранд назвал полученное им вещество фосфором, что в переводе с греческого означает «светоносец».
И лишь 1777 году К.В. Шееле разработал способ получения фосфора из рога и костей животных.
Природные соединения
Из-за большой химической активности встречается в природе только в виде соединений.
Важнейшими минералами фосфора являются:
Фосфорит
Фторапатит
Апатиты
Хлорапатит
Са 3 (РО 4 ) 2
Са 3 (РО 4 ) 2 • СаF 2
Са 3 (РО 4 ) 2 •СаCl 2
Природные соединения
Крупнейшее месторождение апатитов находится на Кольском полуострове, в районе Хибинских гор.
Залежи фосфоритов находятся в районе гор Каратау.
Нахождение в природе
Фосфор входит в состав всех живых организмов. А именно он встречается в соединениях:
1. Белковых веществ, содержащихся в генеративных органах растений;
2. Нервной и костной тканей организмов животных и человека;
3. Мозговых клеток.
Получение
Фосфор производят в электрических печах, восстанавливая апатит углем в присутствии кремнезема:
Ca 3 (PO 4 ) 2 +3SiO 2 +5C=3CaSiO 3 +5CO+P 2
Пары фосфора при этой температуре почти полностью состоят из молекул Р2, которые при охлаждении конденсируются в молекулы Р4.
Печь для добывания фосфора
Важнейшие соединения
Н 3 РО 4 фосфорная кислота
Р 2 О 5 оксид фосфора (V)
Аллотропные модификации фосфора
Физические свойства
- Элементарный фосфор в обычных условиях представляет собой несколько устойчивых аллотропических модификаций; вопрос аллотропии фосфора сложен и до конца не решён. Обычно выделяют четыре модификации простого вещества — белый, красный, черный и металлический фосфор.
Характеристика вещества
1)Физическое состояние
Белый фосфор
Красный фосфор
Кристаллическое вещество
2)Твёрдость
Порошкообразное вещество
Небольшая -можно резать ножом (под водой)
3) Цвет
Черный фосфор
Кристаллическое вещество
Белый
4)Запах
5)Плотность (в г/см3)
Выше чем у белого фосфора
Красный
Чесночный
1,8
Черный
Не обладает
6)Растворимость в воде
Не обладает
2,3
Не растворяется
7)Температура плавления (в 0 С)
2,7
Не растворяется
44
8)Свечение
Не растворяется
В темноте светится
9)Действие на организм
260
280
Не светится
Сильный яд
Не светится
Не ядовит
Не ядовит
Аллотропные модификации
Горение белого фосфора
Хранение белого фосфора
- Белый фосфор окисляется кислородом уже при обычных условиях, а в тонкоизмельченном состоянии самовоспламеняется, поэтому его хранят под водой. Окисление фосфора сопровождается свечением. Химическая энергия непосредственно превращается в световую .
Химические свойства
В химических реакциях проявляет окислительно-восстановительную двойственность .
Как окислитель взаимодействует со многими металлами , образуя фосфиды .
Фосфор непосредственно с водородом не реагирует .
Как восстановитель взаимодействует с более электроотрицательными неметаллами .
При недостатке кислорода или при комнатной температуре окисляется до оксида фосфора (III).
При сгорании фосфора в кислороде или на воздухе образуется оксид фосфора (V).
Химические свойства
При длительном нагревании белого фосфора без доступа воздуха он желтеет и постепенно превращается в красный фосфор. При нагревании красного фосфора в тех же условиях он превращается в пар, при конденсации которого образуется белый фосфор.
Фосфор проявляет окислительные и восстановительные свойства.
Фосфор – восстановитель:
5О 2 (изб.) + 4Р = 2Р 2 О 5
3О 2 (недост.) + 4Р = 2Р 2 О 3
3Сl 2 + 2P = 2PCl 3 PСl 3 + Cl 2 = PCl 5
3P + 5HNO 3 + 2H 2 O = 3H 3 PO 4 + 5NO
4P + 16H 2 O = 4H 3 PO 4 + 10H 2
Фосфор – окислитель:
2Р + 3Mg = Mg 3 P 2
Оксид фосфора (V)
Р 2 О 5 – белый порошок, очень гигроскопичен (самый эффективный осушитель).
Является типичным кислотным оксидом .
Взаимодействует с основаниями и основными оксидами .
Оксиду фосфора (V) соответствует ортофосфорная кислота .
Физические свойства P 2 O 5
Белый, рыхлый порошок, гигроскопичный. Хранят в герметически закрытых сосудах.
Химические свойства P 2 O 5
Проявляет свойства кислотного оксида.
1) реагирует с водой:
P 2 O 5 + H 2 O 2HPO 3
P 2 O 5 + 3H 2 O t 2H 3 PO 4
2) реагирует с основными оксидами:
P 2 O 5 + 3К 2 O 2К 3 РО 4
3) реагирует с основаниями:
P 2 O 5 + 6NaOH 2Na 3 РО 4 + 3H 2 O
Ортофосфорная кислота
Получение .
t
↔
2
3
О
Н
Р
═
Н
О
+
О
Р
3
4
5
2
2
Взаимодействие оксида фосфора (V) с водой при нагревании.
Этим способом получают чистую фосфорную кислоту, которую используют в пищевой промышленности как добавку к безалкогольным напиткам.
Ортофосфорная кислота
Получение .
t
)
═
2
3
3
↓
SO 4
H
PO 4
Ca
(
+
↔
SO 4
H
+
PO 4
Ca
2
2
3
3
КОНЦ.
Вытеснение природных фосфатов более сильной кислотой при нагревании.
Фосфорная кислота, полученная переработкой природных фосфатов, идёт на производство минеральных удобрений.
Ортофосфорная кислота
Ортофосфорная кислота –
- Как трехосновная кислота, диссоциирует ступенчато .
- кристаллическое ,
- нелетучее ,
- твердое ,
- бесцветное вещество.
Н 3 РО 4 ↔ Н + + Н 2 РО 4 ― (дигидрофосфат-ион)
Н 2 РО 4 ― ↔ Н + + НРО 4 2― (гидрофосфат-ион)
НРО 4 2 ― ↔ Н + + РО 4 2― (фосфат-ион)
- Фосфаты почти всех металлов в воде не растворимы.
Дигидрофосфаты всех металлов хорошо растворимы в воде.
Гидрофосфаты по растворимости занимают промежуточное положение.
- Все нерастворимые в воде фосфаты растворяются в растворах сильных кислот.
- Смешивается с водой в любых отношениях.
- Проявляет все свойства кислот.
- Не является сильной в водном растворе.
Круговорот фосфора в природе
Применение фосфора
Применение фосфора
Около 80% от всего производства белого фосфора идет на синтез чистой ортофосфорной кислоты. Она используется для получения полифосфатов натрия (их применяют для снижения жесткости питьевой воды) и пищевых фосфатов. Оставшаяся часть белого фосфора расходуется для создания дымообразующих веществ и зажигательных смесей.
Полифосфат натрия
Применение фосфора: спички
Первые фосфорные спички – с головкой из белого фосфора – были созданы лишь 1827 г. Такие спички загорались при трении о любую поверхность, что нередко приводило к пожарам. Кроме того, белый фосфор очень ядовит. Описаны случаи отравления фосфорными спичками как из-за неосторожного обращения, так и с целью самоубийства: для этого достаточно было съесть несколько спичечных головок. Вот почему на смену фосфорным спичкам пришли безопасные, которые верно служат нам и по сей день. Промышленное производство безопасных спичек началось в Швеции в 60-х гг. XIX века.
Применение фосфора: спички
Зажигательная поверхность спичечного коробка покрыта смесью красного фосфора и порошка стекла. В состав спичечной головки входят окислители (PbO 2 , KСlO 3 , BaCrO 4 ) и восстановители (S, Sb 2 S 3 ). При трении от зажигательной поверхности смесь, нанесенная на спичку, воспламеняется.
Применение фосфора
Немало ортофосфорной кислоты потребляет пищевая промышленность . Дело в том, что на вкус разбавленная ортофосфорная кислота очень приятна и небольшие ее добавки в мармелады, лимонады и сиропы заметно улучшают их вкусовые качества. Этим же свойством обладают и некоторые соли фосфорной кислоты. Гидрофосфаты кальция, например, с давних пор входят в хлебопекарные порошки, улучшая вкус булочек и хлеба.
Применение фосфора
Интересны и другие применения ортофосфорной кислоты в промышленности. Например, было замечено, что пропитка древесины самой кислотой и ее солями делают дерево негорючим. На этой основе сейчас производят огнезащитные краски, негорючие фосфодревесные плиты, негорючий фосфатный пенопласт и другие строительные материалы.
Необходим ли фосфор человеку?
Значение фосфора
Фосфор является основой скелета человека и зубов.
Живые организмы не могут обходиться без фосфора.
Значение фосфора состоит в том, что сахара и жирные кислоты не могут быть использованы клетками в качестве источников энергии без предварительного фосфорилирования.
Целый ряд соединений фосфора используют в качестве лекарственных препаратов.
Биологическая роль фосфора
- Суточная потребность для взрослого человека 1 грамм
- Входит в состав скелета
- Входит в состав зубной ткани
- Соединения фосфора принимают участие в обмене энергии
- Необходим для нормальной мышечной и умственной деятельности
Реакция организма на недостаток и избыток фосфора
- Недостаток фосфора
- Избыток фосфора
Развивается заболевание рахит, снижается умственная и мышечная деятельность.
Развивается мочекаменная болезнь, соединения фосфора высоко токсичны (летальная доза 60 мг.).
Презентацию на тему «Фосфор»
можно скачать абсолютно бесплатно на нашем сайте. Предмет
проекта: Химия. Красочные слайды и иллюстрации помогут вам
заинтересовать своих одноклассников или аудиторию.
Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад — нажмите на
соответствующий текст под плеером. Презентация
содержит 29 слайд(ов).
Слайд 1
МУНИЦИПАЛЬНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ «СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА №22»
Слайд 2
«Элемент жизни и мысли» (А.Е. Ферсман)
Фосфор
Слайд 3
Цели урока: А. Образовательные Способствовать формированию умения учащихся давать сравнительную характеристику элементов с помощью периодической систему Д.И. Менделеева. (на примере азота и фосфора) 2. Продолжить формирование понятия аллотропия (на примере аллотропных модификаций фосфора) 3. Продолжить формирование умения учащихся давать характеристику окислительно-восстановительных свойств элементов на основании строения атомов этих элементов. (на примере фосфора) 4. Познакомить учащихся с биологическим значением фосфора в жизни растений , животных и человека
Слайд 4
Б . Развивающие 1. Способствовать формированию навыков логического мышления (умения сравнивать, обобщать, делать выводы) 2. Способствовать формированию навыков работы с различными источниками информации (учебником, дополнительной литературой и т. д. ) 3. Способствовать формированию критичности мышления. В. Воспитательные 1. Формирование устойчивой положительной мотивации к изучению химии 2.
Слайд 5
В. Воспитательные 1. Формирование устойчивой положительной мотивации к изучению химии 2. Формирование здоровьесберегающей компетенции: позитивно относиться к своему здоровью;
Слайд 6
Этапы урока: I. Орг. Момент II. Мотивационный этап III. Актуализация знаний учащихся IV.Изучение нового материала V. Первичное закрепление и проверка усвоения знаний VI. Подведение итогов урока, рефлексия VII. Домашнее задание
Слайд 7
I. Организационный момент II. Мотивационный этап. (Просмотр видеофрагмента ) III. Актуализация знаний учащихся IV.Изучение нового материала (самостоятельное заполнение таблицы по сравнительной характеристике азота и фосфора на основании их положения в Периодической системе Д.И. Менделеева)
Слайд 8
I. Сравнительная характеристика элементов азота и фосфора
Слайд 12
Слайд 13
Слайд 15
II. Аллотропия фосфора (н.у.стр.159-160)
Слайд 16
Аллотропные видоизменения фосфора
Белый фосфор (Р4)
Слайд 18
Аллотропия фосфора
Слайд 19
III. Химические свойства фосфора
Слайд 20
Слайд 21
Слайд 22
Слайд 23
в земной коре – 0,1%, важнейшие минералы – фосфорит (Са5(РО4)3(ОН,СО3)), апатит (Са5(РО4)3(F,Cl)); в растительности – в белках семян; в животных организмах: в белках молока, крови, мозговой и нервных тканях, в костях (3Са3(РО4)2 · Ca(OH)2 и 3Са3(РО4)2 · CaСO3 · Н2О), в ДНК, РНК (хранят и передают наследственную информацию), АТФ (отвечает за энергетический обмен )
Нахождение в природе
Слайд 24
Биологическое значение фосфора
Организм человека содержит около 1,5 кг фосфора: 1,4 кг – в костях, 130 г – в мышцах и 13 г в нервной ткани. Содержание фосфора в организме человека составляет приблизительно 1% от массы тела. Суточное потребление фосфора человеком – около 2 г. Продукты, содержащие фосфор: СЫР ЧЕДДЕР 100 г — 40% рекомендуемой суточной нормы СЕМЕНА ПОДСОЛНУХА 30 г — 21% ЦЫПЛЯТА 100 г — 20% ЯЙЦА 2 штуки (100 г) — 17% ГОВЯЖЬЯ ПЕЧЕНЬ 100 г — 29%
Слайд 25
Тест «Фосфор»
1. Атом фосфора по сравнению с атомом азота имеет: а) большее число электронов на внешнем уровне б) больший радиус атома в) меньшее число энергетических уровней г) меньшее число электронов 2. Для фосфора характерны степени окисления: а) -3, +2,+5 в) +1, +3, +5 б) -3, +3,+5 г) -2, +3, +5 3. Белый фосфор в отличие от азота … а)обладает заметной электрической проводимостью б)химически высоко реакционноспособен в)не встречается в природе в свободном состоянии г)хорошо растворим в воде
Слайд 26
4.Фосфор, как и азот, входит … а) в состав всех минеральных солей б) в состав всех живых организмов в) в состав воздуха г) царской водки 5.Какая из аллотропных модификаций фосфора наименее реакционноспособна? а)Белый фосфор б)Черный фосфор в)Красный фосфор г)Фосфор так же, как и азот, не имеет аллотропных модификаций
Слайд 27
6. Укажите верное утверждение: а) белый и красный фосфор ядовиты б) белый фосфор неядовит, красный ядовит в) белый фосфор ядовит, красный неядовит г) ни белый, ни красный фосфор не ядовиты 7. При горении фосфора образуется: а) фосфин б) оксид фосфора (V) в) фосфорная кислота г) фосфид металла
Слайд 28
Ответы на тест. 1.б 2.б 3.б 4.в 5.в 6.б
Слайд 29
Домашнее задание:
параграф 27 + конспект урока, задание 2, 3(письменно) , повторить 24-26 Вопросы для творческих работ: Зачем человеку фосфор? Появление благодатного огня : чудо или мистификация?













































































