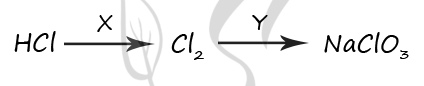Тренажер задания 31 из ЕГЭ по химии галогенов, задачи на неорганическую химию (мысленный эксперимент) из экзамена ЕГЭ по химии, задания 31 по химии галогенов с текстовыми решениями и ответами.
- Вещество, полученное на аноде при электролизе расплава иодида натрия с инертными электродами, выделили и ввели во взаимодействие с сероводородом. Газообразный продукт последней реакции растворили в воде и к полученному раствору добавили хлорное железо. Образовавшийся осадок отфильтровали и обработали горячим раствором гидроксида натрия. Напишите уравнения описанных реакций.
I2 + H2S = 2HI↑ + S↓
2HI + 2FeCl3 = I2 + 2FeCl2 + 2HCl
3I2 + 6NaOH (гор.) = NaIO3 + 5NaI + 3H2O
- Вещество, полученное на аноде при электролизе раствора иодида натрия с инертными электродами, ввели в реакцию с калием. Продукт реакции нагрели с концентрированной серной кислотой и выделившийся газ пропустили через горячий раствор хромата калия. Напишите уравнения описанных реакций.
I2 + 2K = 2KI
8KI + 5H2SO4(конц.) = 4I2↓ + H2S↑ + 4K2SO4 + 4H2O или
8KI + 9H2SO4 (конц.) = 4I2↓ + H2S↑ + 8KHSO4 + 4H2O
3H2S + 2K2CrO4 + 2H2O = 2Cr(OH)3 + 3S + 4KOH
- Хлорная вода имеет запах хлора. При подщелачивании запах исчезает, а при добавлении соляной кислоты – становится более сильным, чем был ранее. Напишите уравнения описанных реакций.
Cl2 + H2O ↔ HCl + HClO
HCl + NaOH = NaCl + H2O
HClO + NaOH = NaClO + H2O
NaClO + 2HCl = NaCl + Cl2 + H2O
- Бесцветные газы выделяются при выдерживании концентрированной кислоты, как с хлоридом натрия, так и с иодидом натрия. При пропускании этих газов через водный раствор аммиака образуются соли. Напишите уравнения описанных реакций.
H2SO4(конц.) + NaCl(тверд.) = NaHSO4 + HCl↑
9H2SO4(конц.) + 8NaI(тверд.) = 8NaHSO4 + 4I2↓ + H2S + 4H2O
NH4OH + HCl = NH4Cl + H2O
NH4OH + H2S = NH4HS + H2O
- При термическом разложении соли А в присутствии диоксида марганца образовались бинарная соль Б и газ, поддерживающий горение и входящий в состав воздуха, при нагревании этой соли без катализатора образуются соль Б и соль кислородсодержащей кислоты. При взаимодействии соли А с соляной кислотой выделяется жёлто-зелёный газ (простое вещество) и образуется соль Б. соль Б окрашивает пламя в фиолетовый цвет, при её взаимодействии с раствором нитрата серебра выпадает осадок белого цвета. Напишите уравнения описанных реакций.
4KClO3 KCl + 3KClO4
KClO3 + 6HCl = KCl + 3Cl2↑+ 3H2O
KCl + AgNO3 = AgCl↓ + KNO3
6) При добавлении раствора кислоты А к диоксиду марганца происходит выделение ядовитого газа жёлто-зелёного газа. Пропустив выделившийся газ через горячий раствор едкого кали, получают вещество, которое используется при изготовлении спичек и некоторых других зажигательных составов. При термическом разложении последнего в присутствии диоксида марганца образуется соль, из которой при взаимодействии с концентрированной серной кислотой можно получить исходную кислоту А, и бесцветный газ , входящий в состав атмосферного воздуха. Напишите уравнения описанных реакций.
4HCl + MnO2 = MnCl2 + Cl2↑ + 2H2O
3Cl2 + 6KOH(гор.) = 5KCl + KClO3 + 3H2O
H2SO4(конц.) + NaCl(тверд.) = NaHSO4 + HCl↑
7) Йод нагрели с избытком фосфора, и продукт реакции обработали небольшим количеством воды. Газообразный продукт реакции полностью нейтрализовали раствором едкого натра и добавили в полученный раствор нитрат серебра. Напишите уравнения описанных реакций.
3I2 + 3P = 2PI3
PI3 + 3H2O = H3PO3 + 3HI
HI + NaOH = NaI + H2O
NaI + AgNO3 = AgI↓ + NaNO3

H2SO4(конц.) + NaCl(тверд.) = NaHSO4 + HCl↑
16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
Cl2 + 2NaOH(хол.) = NaCl + NaClO + H2O
NaClO + 2HI = NaCl + I2 + H2O
9) Через раствор бромида натрия пропустили газ, выделяющийся при взаимодействии соляной кислоты с перманганатом калия. После окончания реакции раствор выпарили, остаток растворили в воде и подвергли электролизу с графитовыми электродами. Газообразные продукты реакции смешали друг с другом и осветили. В результате произошел взрыв. Напишите уравнения описанных реакций.
16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
2NaBr + Cl2 = 2NaCl + Br2
H2 + Cl2 = 2HCl
10) К пиролюзиту осторожно прибавили раствор соляной кислоты, и выделившийся газ пропустили в химический стакан, наполненный холодным раствором едкого кали. После окончания реакции стакан накрыли картонкой и оставили, при этом стакан освещали солнечные лучи; через некоторое время в стакан внесли тлеющую лучинку, которая ярко вспыхнула. Напишите уравнения описанных реакций.
4HCl + MnO2 = MnCl2 + Cl2↑ + 2H2O
Cl2 + 2KOH(хол.) = KCl + KClO + H2O
2KClO = 2KCl + O2
C + O2 = CO2
11) Вещество, выделяющееся на катоде и аноде при электролизе раствора йодида натрия с графитовыми электродами, реагируют друг с другом. Продукт реакции взаимодействуют с концентрированной серной кислотой с выделением газа, который пропустили через раствор гидроксида калия. Напишите уравнения описанных реакций.
I2 + H2 = 2HI
8HI + H2SO4 (конц.) = 4I2↓ + H2S↑ + 4H2O или
2HI + H2SO4 (конц.) = I2↓ + SO2↑ + 2H2O
а) H2S + 2KOH = K2S + 2H2O
H2S + K2S = 2KHS или
б) SO2 + 2KOH = K2SO3 + 2H2O
K2SO3 + SO2 + H2O = 2KHSO3
12) К оксиду свинца (IV) при нагревании добавили концентрированную соляную кислоту. Выделяющийся газ пропустили через нагретый раствор едкого кали. Раствор охладили, соль кислородсодержащей кислоты отфильтровали и высушили. При нагревании полученной соли с соляной кислотой выделяется ядовитый газ, а при нагревании её в присутствии диоксида марганца – газ, входящий в состав атмосферы. Напишите уравнения описанных реакций.
4HCl + PbO2 = PbCl2 + Cl2↑ + 2H2O
3Cl2 + 6KOH(гор.) = 5KCl + KClO3 + 3H2O
KClO3 + 6HCl = KCl + 3Cl2 + 3H2O
13) Йод обработали концентрированной азотной кислотой при нагревании. Продукт реакции осторожно нагрели. Образовавшийся при оксид вступил в реакцию с угарным газом. Выделившееся простое вещество растворили в теплом растворе гидроксида калия. Напишите уравнения описанных реакций.
I2 + 10HNO3 → 2HIO3 + 10NO2 + 4H2O
2HIO3 → I2O5 + H2O
I2O5 + 5CO → I2 + 5CO2
3I2 + 6KOH(гор.) = 5KI + KIO3 + 3H2O
14) Раствор иодида калия обработали избытком хлорной воды, при этом сначала наблюдали образование осадка, а затем – его полное растворение. Образовавшуюся при этом йодсодержащую кислоту выделили из раствора, высушили и осторожно нагрели. полученный оксид прореагировал с угарным газом. Напишите уравнения описанных реакций.
2KI + Cl2 = 2KCl + I2
I2 + 5Cl2 + 6H2O = 10HCl + 2HIO3
2HIO3 I2O5 + H2O
I2O5 + 5CO = I2 + 5CO2
15) Йод обработали хлорноватой кислотой. Продукт реакции осторожно нагрели. продукт реакции осторожно нагрели. Образующийся оксид реагирует с угарным газом с образованием двух веществ – простого и сложного. Простое вещество растворяется в теплом щелочном растворе сульфита натрия. Напишите уравнения описанных реакций.
I2 + 2HClO3 = 2HIO3 + Cl2
2HIO3 → I2O5 + H2O
I2O5 + 5CO → I2 + 5CO2
I2 + Na2SO3 + 2NaOH = 2NaI + Na2SO4 + H2O
16) Перманганат калия обработали избытком раствора соляной кислоты, образовался раствор и выделился газ. Раствор разделили на две части: к первой добавили гидроксид калия, а ко второй – нитрат серебра. Выделившийся газ прореагировал газ прореагировал с гидроксидом калия при охлаждении. Напишите уравнения описанных реакций.
16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
MnCl2 + 2KOH = Mn(OH)2↓ + 2KCl
KCl + AgNO3 = AgCl↓ + KNO3
Cl2 + 2KOH(хол.) = KCl + KClO + H2O
17) Расплав хлорида натрия подвергли электролизу. Газ, выделившийся на аноде, прореагировал с водородом с образованием нового газообразного вещества с характерным запахом. Его растворили в воде и обработали расчетным количеством перманганата калия, при этом образовался газ желто-зеленого цвета. Это вещество вступает при охлаждении с гидроксидом натрия. Напишите уравнения описанных реакций.
Cl2 + H2 = 2HCl
16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
Cl2 + 2NaOH(хол.) = NaCl + NaClO + H2O
18) Перманганат калия обработали концентрированной соляной кислотой. Выделившийся при этом газ собрали, а к реакционной массе по каплям прибавили раствор гидроксида калия до прекращения выделения осадка. Собранный газ пропустили через горячий раствор гидроксида калия, при этом образовалась смесь двух солей. Раствор выпарили, твердый остаток прокалили в присутствии катализатора, после чего в твердом остатке осталась одна соль. Напишите уравнения описанных реакций.
16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
MnCl2 + 2KOH = Mn(OH)2↓ + 2KCl
3Cl2 + 6KOH(гор.) = 5KCl + KClO3 + 3H2O
Тематический тест на химию водорода и галогенов.
Задание №1
Из предложенного списка простых веществ выберите те, которые являются газами при обычных условиях. Число верных ответов может быть любым.
1) йод
2) хлор
3) фтор
4) бром
5) водород
Решение
Ответ: 235
Задание №2
Из предложенного списка простых веществ выберите те, которые являются твердыми при обычных условиях. Число верных ответов может быть любым.
1) водород
2) хлор
3) йод
4) фтор
5) бром
Решение
Ответ: 3
Задание №3
Из предложенного списка простых веществ выберите те, которые не являются газами при обычных условиях. Число верных ответов может быть любым.
1) бром
2) водород
3) фтор
4) йод
5) хлор
Решение
Ответ: 14
Задание №4
Из предложенного списка соединений выберите те, в которых атомы водорода находятся в низшей степени окисления. Число верных ответов может быть любым.
- 1. NaHCO3
- 2. KHS
- 3. CaH2
- 4. Fe(OH)SO4
- 5. NH3
Решение
Ответ: 3
Задание №5
Из предложенного списка соединений выберите те, в которых атомы водорода находятся в высшей степени окисления. Число верных ответов может быть любым.
- 1. LiNH2
- 2. NaH
- 3. BaH2
- 4. RbHS
- 5. NH4Cl
Решение
Ответ: 145
Задание №6
Из предложенного списка соединений выберите те, в которых атомы галогенов находятся в высшей степени окисления. Число верных ответов может быть любым.
- 1. KClO
- 2. Mg(ClO4)2
- 3. NaBrO3
- 4. KIO4
- 5. Cl2O5
Решение
Ответ: 24
Задание №7
Из предложенного списка соединений выберите те, в которых атомы галогенов не находятся в высшей степени окисления. Число верных ответов может быть любым.
- 1. Ca(ClO4)2
- 2. HBrO3
- 3. NF3
- 4. NH4Cl
- 5. I2O5
Решение
Ответ: 2345
Задание №8
Из предложенного списка соединений выберите те, в которых атомы галогенов находятся в степени окисления +1. Число верных ответов может быть любым.
- 1. NF3
- 2. PBr3
- 3. Ca(ClO)Cl
- 4. HClO2
- 5. S2Cl2
Решение
Ответ: 3
Задание №9
Из предложенного списка соединений выберите те, в которых атомы галогенов находятся в степени окисления +5. Число верных ответов может быть любым.
- 1. PCl5
- 2. KClO3
- 3. FeCl2
- 4. KBrO3
- 5. I2O5
Решение
Ответ: 245
Задание №10
Из предложенного списка соединений выберите те, в которых атомы галогенов находятся в степени окисления -1. Число верных ответов может быть любым.
- 1. NH4I
- 2. Cl2
- 3. BF3
- 4. S2Br2
- 5. Ca(ClO)Cl
Решение
Ответ: 1345
[adsp-pro-3]
Задание №11
Из предложенного списка оксидов выберите два, с которыми может взаимодействовать водород.
- 1. Al2O3
- 2. FeO
- 3. MgO
- 4. NiO
- 5. Na2O
Решение
Ответ: 24
Задание №12
Из предложенного списка оксидов выберите два, с которыми не может взаимодействовать водород.
- 1. CuO
- 2. Fe2O3
- 3. Cu2O
- 4. Cs2O
- 5. SO2
Решение
Ответ: 45
Задание №13
Из предложенного списка оксидов выберите два, с которыми может взаимодействовать водород.
- 1. P2O5
- 2. MgO
- 3. Li2O
- 4. ZnO
- 5. Fe3O4
Решение
Ответ: 45
Задание №14
Из предложенного списка оксидов выберите два, с которыми не может взаимодействовать водород.
- 1. PbO
- 2. H2O
- 3. BaO
- 4. ZnO
- 5. FeO
Решение
Ответ: 23
Задание №15
Из предложенного списка оксидов выберите два, с которыми может взаимодействовать водород.
- 1. CO
- 2. CaO
- 3. SrO
- 4. Rb2O
- 5. Cu2O
Решение
Ответ: 15
Задание №16
Из предложенного списка веществ выберите два, с которыми может взаимодействовать водород.
1) хлор
2) железо
3) вода
4) литий
5) ртуть
Решение
Ответ: 14
Задание №17
Из предложенного списка веществ выберите два, с которыми может взаимодействовать фтор.
1) фторид серы(VI)
2) хлорид фосфора(V)
3) фтороводород
4) бромоводород
5) фторид алюминия
Решение
Ответ: 24
Задание №18
Из предложенного списка веществ выберите два, с которыми может взаимодействовать хлор.
1) хлорид серебра
2) азот
3) хлорид железа(II)
4) сероводород
5) хлорид магния
Решение
Ответ: 34
Задание №19
Из предложенного списка веществ выберите два, с которыми может взаимодействовать бром.
1) азот
2) едкое кали
3) азотная кислота
4) бромид железа(III)
5) фосфор
Решение
Ответ: 25
Задание №20
Из предложенного списка веществ выберите два, с которыми может взаимодействовать йод.
1) бромоводород
2) гашеная известь
3) песок
4) едкий натр
5) аргон
Решение
Ответ: 24
[adsp-pro-3]
Задание №21
Из предложенного списка веществ выберите два, с которыми не может взаимодействовать водород.
1) оксид натрия
2) оксид цинка
3) оксид меди(II)
4) оксид бария
5) оксид хрома(II)
Решение
Ответ: 14
Задание №22
Из предложенного списка веществ выберите два, с которыми не может взаимодействовать хлор.
1) алмаз
2) водород
3) хлорид меди(I)
4) кислород
5) бромоводород
Решение
Ответ: 14
Задание №23
Из предложенного списка веществ выберите два, с которыми не может взаимодействовать бром.
1) алюминий
2) оксид цинка
3) гидроксид рубидия
4) фосфор
5) кислород
Решение
Ответ: 25
Задание №24
Из предложенного списка веществ выберите два, с которыми не может взаимодействовать йод.
1) бромид калия
2) йодид меди(I)
3) йодид хрома(II)
4) водород
5) едкое кали
Решение
Ответ: 12
Задание №25
Из предложенного списка веществ выберите два, с которыми может взаимодействовать хлор.
1) нитрат меди
2) серная кислота
3) азотная кислота
4) сероводородная кислота
5) йодоводородная кислота
Решение
Ответ: 45
Задание №26
Из предложенного списка веществ выберите два, с которыми может взаимодействовать водород.
1) литий
2) платина
3) ртуть
4) цезий
5) песок
Решение
Ответ: 14
Задание №27
Из предложенного списка веществ выберите два, с которыми не может взаимодействовать хлор.
1) бромид цинка
2) йодид никеля
3) хлорид фосфора(III)
4) фторид натрия
5) бертолетова соль
Решение
Ответ: 45
Задание №28
Из предложенного списка веществ выберите два, с которыми может взаимодействовать бром.
1) сера
2) оксид азота(IV)
3) негашеная известь
4) вода
5) неон
Решение
Ответ: 14
Задание №29
Из предложенного списка веществ выберите два, с которыми не может взаимодействовать йод.
1) сульфат магния
2) гидроксид цезия
3) фосфат натрия
4) гидроксид стронция
5) едкий натр
Решение
Ответ: 13
Задание №30
Из предложенного списка веществ выберите два, с которыми не может взаимодействовать водород.
1) железная окалина
2) поташ
3) негашеная известь
4) сажа
5) угарный газ
Решение
Ответ: 23
[adsp-pro-3]
Задание №31
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) хлорид алюминия + бром
2) нитрат магния + хлор
3) бромид свинца(II) + хлор
4) фторид калия + сера
5) бромид цинка + йод
Решение
Ответ: PbBr2 + Cl2 = PbCl2 + Br2
Задание №32
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) бертолетова соль + бромат калия
2) поваренная соль + нитрат серебра
3) йод + кислород
4) хлорид фосфора(III) + йод
5) хлорид натрия + бром
Решение
Ответ: NaCl + AgNO3 = AgCl + NaNO3
Задание №33
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) хлор + кислород
2) бром + азот
3) литий + водород
4) йод + кислород
5) водород + песок
Решение
Ответ: 2Li + H2 = 2LiH
Задание №34
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) гидроксид алюминия + водород
2) гидроксид натрия + кислород
3) гидроксид калия + поваренная соль
4) гидроксид цезия + йод
5) гидроксид лития + азот
Решение
Ответ: 6CsOH + 3I2 = 5CsI + CsIO3 + 3H2O
Задание №35
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) серная кислота + хлор
2) азотная кислота + водород
3) фосфорная кислота + бром
4) сероводородная кислота + бром
5) плавиковая кислота + бром
Решение
Ответ: H2S + Br2 = 2HBr + S
Задание №36
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) соляная кислота + сульфид меди(II)
2) плавиковая кислота + фторид серебра
3) бромоводородная кислота + гашеная известь
4) йодоводородная кислота + медь
5) хлороводородная кислота + серебро
Решение
Ответ: Ca(OH)2 + 2HBr = CaBr2 + 2H2O
Задание №37
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) хлорид натрия + фосфор
2) бромид калия + сера
3) фторид лития + цинк
4) хлорат калия + сера
5) бромат калия + бром
Решение
Ответ: 2KClO3 + 3S = 2KCl + 3SO2
Задание №38
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) хлорид фосфора(III) + хлор
2) бромид кремния(IV) + бром
3) йодид железа(II) + йод
4) хлорид натрия + бром
5) бромид цинка + йод
Решение
Ответ: PCl3 + Cl2 = PCl5
Задание №39
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) хлорид натрия + вода
2) бромид калия + вода
3) гидрид лития + вода
4) иодид серебра + вода
5) хлорид цезия + вода
Решение
Ответ: LiH + H2O = LiOH + H2
Задание №40
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) алмаз + бром
2) азот + хлор
3) аргон + йод
4) фосфор + йод
5) железо + водород
Решение
Ответ: 2P + 3I2 = 2PI3
[adsp-pro-3]
Задание №41
В заданной схеме превращений
CuSO4 CuI
Y
Веществами X и Y являются соответственно
1) хлорид меди(I)
2) йодид свинца
3) хлороводород
4) хлорид меди(II)
5) йодид натрия
Решение
Ответ: 54
Задание №42
В заданной схеме превращений
MnO2 X
KClO3
Веществами X и Y являются соответственно
1) хлорид марганца(IV)
2) калий
3) едкое кали
4) оксид калия
5) хлор
Решение
Ответ: 53
Задание №43
В заданной схеме превращений
X Br2
Y
Веществами X и Y являются соответственно
1) бромат калия
2) нитрат калия
3) бромид фосфора(V)
4) фосфор
5) бромид натрия
Решение
Ответ: 53
Задание №44
В заданной схеме превращений
X Y
X
Веществами X и Y являются соответственно
1) бромид калия
2) бром
3) бромоводород
4) бромат калия
5) бертолетова соль
Решение
Ответ: 24
Задание №45
В заданной схеме превращений
KClO3 X
Y
Веществами X и Y являются соответственно
1) перхлорат калия
2) кислород
3) оксид хлора(V)
4) хлорид калия
5) хлор
Решение
Ответ: 45
Задание №46
В заданной схеме превращений
Fe3O4 Fe
FeCl2
Веществами X и Y являются соответственно
1) хлороводород
2) водород
3) хлор
4) хлорид натрия
5) хлорат калия
Решение
Ответ: 21
Задание №47
В заданной схеме превращений
X Y
CuBr2
Веществами X и Y являются соответственно
1) йодид калия
2) йодид стронция
3) йод
4) йодид меди(I)
5) йодид меди(II)
Решение
Ответ: 34
Задание №48
В заданной схеме превращений
KOH X
P2O5
Веществами X и Y являются соответственно
1) бертолетова соль
2) поваренная соль
3) фосфорная кислота
4) фосфор
5) кислород
Решение
Ответ: 14
Задание №49
В заданной схеме превращений
AgF KF
HF
Веществами X и Y являются соответственно
1) нитрат калия
2) йодид калия
3) азотная кислота
4) кремниевая кислота
5) водород
Решение
Ответ: 23
Задание №50
В заданной схеме превращений
KI X
NaIO3
Веществами X и Y являются соответственно
1) кислород
2) едкий натр
3) углекислый газ
4) йод
5) йодоводород
Решение
Ответ: 42
[adsp-pro-3]
Задание №51
Запишите уравнение взаимодействия между водородом и цезием. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2Cs + H2 = 2CsH
Задание №52
Запишите уравнение взаимодействия между водородом и кальцием. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: Ca + H2 = CaH2
Задание №53
Запишите уравнение взаимодействия между водородом и хлором. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: H2 + Cl2 = 2HCl
Задание №54
Запишите уравнение взаимодействия между водородом и оксидом железа(III). В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: Fe2O3 + 3H2 = 2Fe + 3H2O
Задание №55
Запишите уравнение взаимодействия между водородом и оксидом меди(I). В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: Cu2O + H2 = 2Cu + H2O
Задание №56
Запишите уравнение взаимодействия между фтором и кремнием. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: Si + 2F2 = SiF4
Задание №57
Запишите уравнение взаимодействия между избытком хлора и фосфором. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2P + 5Cl2 = 2PCl5
Задание №58
Запишите уравнение взаимодействия между недостатком хлора и фосфором. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2P + 3Cl2 = 2PCl3
Задание №59
Запишите уравнение взаимодействия между хлором и железом. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2Fe + 3Cl2 = 2FeCl3
Задание №60
Запишите уравнение взаимодействия между хлором и медными опилками. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: Cu + Cl2 = CuCl2
[adsp-pro-3]
Задание №61
Запишите уравнение взаимодействия между хлором и холодным раствором едкого натра. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2NaOH + Cl2 = NaCl + NaClO + H2O
Задание №62
Запишите уравнение взаимодействия между хлором и горячим раствором гидроксида цезия. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 6CsOH + 3Cl2 = 5CsCl + CsClO3 + 3H2O
Задание №63
Запишите уравнение взаимодействия между бромом и алюминием. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2Al + 3Br2 = 2AlBr3
Задание №64
Запишите уравнение взаимодействия между избытком брома и фосфором. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2P + 5Br2 = 2PBr5
Задание №65
Запишите уравнение взаимодействия между бромом и горячим раствором гашеной извести.
Решение
Ответ: 6Ca(OH)2 + 6Br2 = 5CaBr2 + Ca(BrO3)2 + 6H2O
Задание №66
Запишите уравнение взаимодействия между бромом и йодидом алюминия. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2AlI3 + 3Br2 = 2AlBr3 + 3I2
Задание №67
Запишите уравнение взаимодействия между хлором и раствором сероводорода. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: H2S + 4Cl2 + 4H2O = H2SO4 + 8HCl
Задание №68
Запишите уравнение взаимодействия между бромом и раствором сероводорода. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: H2S + Br2 = S + 2HBr
Задание №69
Запишите уравнение взаимодействия между йодом и медью. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2Cu + I2 = 2CuI
Задание №70
Запишите уравнение взаимодействия между избытком йода и фосфором. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2P + 3I2 = 2PI3
[adsp-pro-3]
Задание №71
Запишите уравнение взаимодействия между бертолетовой солью и избытком концентрированной соляной кислоты.
Решение
Ответ: KClO3 + 6HCl = KCl + 3Cl2 + 3H2O
Задание №72
Запишите уравнение взаимодействия между бертолетовой солью и фосфором. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 5KClO3 + 6P = 5KCl + 3P2O5
Задание №73
Запишите уравнение каталитического разложения хлората натрия. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2NaClO3 = 2NaCl + 3O2
Задание №74
Запишите уравнение термического разложения бертолетовой соли. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 4KClO3 = KCl + 3KClO4
Задание №75
Запишите уравнение взаимодействия между хлоратом калия, оксидом хрома(III) и едким кали при сплавлении. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: KClO3 + Cr2O3 + 4KOH = KCl + 2K2CrO4 + 2H2O
Задание №76
Запишите уравнение взаимодействия между перманганатом калия и концентрированной соляной кислотой. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Задание №77
Запишите уравнение взаимодействия между оксидом марганца(IV) и бромоводородной кислотой. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: MnO2 + 4HBr = MnBr2 + Br2 + 2H2O
Задание №78
Запишите уравнение взаимодействия между дихроматом калия и концентрированной соляной кислотой при нагревании. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: K2Cr2O7 + 14HCl = 2KCl + 2CrCl3 + 3Cl2 + 7H2O
Задание №79
Запишите уравнение взаимодействия между перекисью водорода и йодидом калия в присутствии серной кислоты. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2KI + H2O2 + H2SO4 = K2SO4 + I2 + 2H2O
Задание №80
Запишите уравнение взаимодействия между йодидом калия и раствором медного купороса. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 4KI + 2CuSO4 = 2K2SO4 + 2CuI + I2
[adsp-pro-3]
Задание №81
Запишите уравнение взаимодействия между йодидом натрия и раствором хлорного железа. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2NaI + 2FeCl3 = 2FeCl2 + I2 + 2NaCl
Задание №82
Запишите уравнение взаимодействия между твердой поваренной солью и концентрированной серной кислотой при нагревании. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2NaCl + H2SO4 = Na2SO4 + 2HCl
или
NaCl + H2SO4 = NaHSO4 + HCl
Задание №83
Запишите уравнение взаимодействия между твердым бромидом калия и концентрированной серной кислотой при нагревании. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2KBr + 2H2SO4 = K2SO4 + SO2 + Br2 + 2H2O
Задание №84
Запишите уравнение взаимодействия между твердым йодидом калия и концентрированной серной кислотой при нагревании. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 8KI + 5H2SO4 → 4K2SO4 + H2S + 4I2 + 4H2O
Задание №85
Запишите уравнение взаимодействия кварцевого песка и избытка плавиковой кислоты. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: SiO2 + 4HF = SiF4 + 2H2O
Задание №86
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) водород Б) хлор В) негашеная известь |
1) калий, фосфор, вода 2) стронций, сера, кислород 3) цинк, натрий, ксенон 4) соляная кислота, вода, углекислый газ |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 214
Задание №87
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) плавиковая кислота Б) соляная кислота В) азотная кислота |
1) едкий натр, медь, сера 2) гидроксид цезия, нитрат серебра, оксид алюминия 3) гидроксид рубидия, оксид свинца(II), кварц 4) гашеная известь, азот, фосфорная кислота |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 321
Задание №88
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) поваренная соль Б) бертолетова соль В) бром |
1) фосфор, азот, вода 2) нитрат серебра, серная кислота (конц.), фтор 3) сера, графит, соляная кислота 4) железо, водород, вода |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 234
Задание №89
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) гидрид кальция Б) фторид серебра В) йодид лития |
1) хлор, вода, бром 2) фосфат калия, хлор, бром 3) соляная кислота, нитрат бария, медь 4) вода, аргон, хлор |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 132
Задание №90
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) бромид лития Б) йодид калия В) фторид аммония |
1) нитрат магния, едкое кали, гашеная известь 2) нитрат свинца, фторид серебра, сульфат меди 3) нитрат калия, сульфат алюминия, цинк 4) нитрат серебра, хлор, фосфат натрия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 421
[adsp-pro-3]
Задание №91
Рассчитайте суммарный объем газов (н.у.), которые выделятся при полном разложении смеси 12,6 г дихромата аммония и 24,5 г бертолетовой соли в присутствии катализатора. Ответ приведите в литрах и округлите до сотых.
Решение
Ответ: 7,84
Пояснение:
Запишем уравнения реакций:
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O (I)
2KClO3 = 2KCl + 3O2 (II)
ν((NH4)2Cr2O7) = m/M = 12,6 / 252 = 0,05 моль
Исходя из уравнения реакции (I):
ν(N2) = ν((NH4)2Cr2O7) = 0,05 моль
ν(KClO3) = m/M = 24,5 / 122,5 = 0,2 моль
Исходя из уравнения реакции (II):
ν(O2) = 3⋅ν(KClO3)/2 = 3⋅0,2/2 = 0,3 моль
Рассчитаем суммарное количество молей азота и кислорода:
ν(N2+O2) = ν(N2) + ν(O2) = 0,05 моль + 0,3 моль = 0,35 моль
Тогда,
V(N2+O2) = ν(N2+O2) ⋅ Vm = 0,35⋅22,4 = 7,84 л
Задание №92
Вычислите массу воды, необходимую для реакции с 21 г гидрида кальция. Ответ приведите в граммах и округлите до целых.
Решение
Ответ: 18
Задание №93
Определите массовую долю хлорида калия в растворе, полученном при пропускании 2,24 л хлора через 280 г горячего 20%-ного раствора едкого кали. Ответ приведите в процентах и округлите до десятых.
Решение
Ответ: 4,3
Задание №94
Навеску йода массой 12,7 г смешали с 28 г железных опилок и нагревали до прекращения реакции. Полученную смесь обработали 300 мл воды, осадок отделили. Вычислите массовую долю вещества в полученном растворе. Ответ приведите в процентах и округлите до сотых.
Решение
Ответ: 4,91
Пояснение:
Йод, в отличие от других галогенов окисляет железо до степени окисления +2. То есть протекает реакция:
Fe + I2 = FeI2
ν(I2) = m/M = 12,7/254 = 0,05 моль
ν(Fe) = m/M = 28/56 = 0,5 моль
В избытке железо, поэтому считаем количество продукта (йодида железа) по йоду:
ν(FeI2) = ν(I2) = 0,05 моль
Йодид железа не реагирует с водой, а просто растворяется в ней. Поэтому осадок в условии задачи – это просто непрореагировавшее железо.
Таким образом, после добавления воды мы просто получаем водный раствор йодида железа (II).
Рассчитаем массу йодида железа (II):
m(FeI2) = ν ⋅ M = 0,05 ⋅ 310 = 15,5 г
Тогда, масса полученного раствора будет равна:
mр-ра(FeI2) = m(FeI2) + m(H2O) = 15,5 г + 300 г = 315,5 г,
а массовая доля йодида железа будет составлять:
ω(FeI2) = 100 ⋅ m(FeI2) /mр-ра(FeI2) = 100% ⋅ 15,5/315,5 = 4,91 %
Задание №95
Навеску бертолетовой соли обработали избытком концентрированной соляной кислоты. Объем выделившегося газа составил 6,72 л. Рассчитайте объем кислорода, который можно получить при каталитическом разложении такой же навески исходного вещества. Ответ приведите в литрах и округлите до сотых.
Решение
Ответ: 3,36
Задание №96
Навеску бертолетовой соли массой 2,45 г полностью разложили в присутствии катализатора. Полученный твердый остаток смешали с 100 г 8,5% раствора нитрата серебра. Определите суммарную массовую долю солей в полученном растворе. Ответ приведите в процентах и округлите до сотых.
Решение
Ответ: 7,22
Задание №97
Навеску смеси железных и алюминиевых опилок массой 8,3 г нагревали в токе хлора до прекращения реакции. Полученный твердый остаток растворили в воде и обработали избытком раствора питьевой соды. Рассчитайте объем выделившегося газа, если массовая доля алюминия в исходной смеси равна 32,53. Ответ приведите в литрах и округлите до сотых.
Решение
Ответ: 13,44
Задание №98
При взаимодействии навески оксида меди(II) и избытка водорода при нагревании образовался твердый остаток. Данное вещество нагревали в токе хлора, полученный продукт растворили в 100 мл воды. При пропускании в раствор сероводорода выпало 9,6 г осадка. Определите массовую долю кислоты в растворе над осадком. Ответ приведите в процентах и округлите до десятых.
Решение
Ответ: 6,8
Задание №99
Вычислите объем хлора, необходимый для полного окисления 100 мл 5%-ного раствора сульфида натрия (плотность 1,05 г/см3). Ответ приведите в литрах и округлите до целых.
Решение
Ответ: 6
Задание №100
Рассчитайте массу простого вещества, образующегося при взаимодействии 160 г 10% раствора сульфата меди и 200 мл 20% раствора йодида калия (плотность 1,15 г/см3). Ответ приведите в граммах и округлите до десятых.
Решение
Ответ: 12,7
[adsp-pro-10]
Галогены.
Хлор. Соединения хлора.
- Хлор — простое вещество
Получение.
- В промышленности хлор получают электролизом расплава или раствора хлорида натрия:
2NaCl 2Na + Cl2↑
2NaCl + 2H2O H2↑ + 2NaOH + Cl2↑
- В лаборатории хлор получают взаимодействием соляной кислоты с сильными окислителями, например:
MnO2 + 4HCl = MnCl2 + Cl2↑ + 2H2O
2KMnO4 + 16HCl = 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O
KClO3 + 6HCl = KCl + 3Cl2↑ + 3H2O
K2Cr2O7 + 14HCl = 2CrCl3 + 2KCl + 3Cl2↑ + 7H2O
Химические свойства. Свободный хлор реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов. Хлор проявляет сильные окислительные свойства в реакциях как с простыми веществами – неметаллами и металлами, так и со сложными веществами:
- С неметаллами
Cl2 + H2 = 2HCl 3Cl2+ 2P = 2PCl3 5Cl2 + 2P = 2PCl5
2Cl2 + Si = SiCl4 2Cl2 + C (кокс) + 2H2O (пар)= CO2 + 4HCl
- С металлами
Cl2 + 2Na = 2NaCl Cl2 + Mg = MgCl2 3Cl2 + 2Fe = 2FeCl3
- Со сложными веществами
Cl2 + H2O↔ HCl + HClO (хлорная вода)
2Cl2 + 2H2O = 4HCl + O2 (на свету или кип.)
Сl2 + 2NaOH(хол.) = NaCl + NaClO + H2O
3Cl2 + 6NaOH(гор.) = 5NaCl + NaClO3 + 3H2O
2Сl2 + 2Са(OH)2 (хол.) = СaCl2 + Сa(ClO)2 + 2H2O хлорная известь
Cl2 + 2NaI = 2NaCl + I2 Cl2 + H2S = S + 2HCl
Cl2 + 3H2O2 = 2HCl + 2H2O + O2
Cl2 + H2O + Na2SO3 = 2HCl + Na2SO4
- Соединения хлора.
- Хлороводород. Хлороводород получают действием концентрированной соляной кислоты на твердый хлорид натрия:
H2SO4(конц.) + NaCl(тверд.) = NaHSO4 + HCl↑
Хлороводород получают также прямым взаимодействием простых веществ: Cl2 + H2 2HCl
- Кислоты.
Соляная кислота. В химических реакциях соляная кислота проявляет все свойства сильных кислот: взаимодействует с металлами, стоящими в ряду напряжений левее водорода, с оксидами (основными, амфотерными), основаниями, амфотерными гидроксидами и солями:
2HCl + Fe = FeCl2 + H2
2HCl + CaO = CaCl2 + H2O
6HCl + Al2O3 = 2AlCl3 + 3H2O
HCl + NaOH = NaCl + H2O
2HCl + Cu(OH)2 = CuCl2 + 2H2O
2HCl + Zn(OH)2 = ZnCl2 + 2H2O
HCl + NaHCO3 = NaCl + CO2↑ + H2O
HCl + AgNO3 = AgCl↓ + HNO3 (качественная реакция на галогенид-ионы)
6HCl(конц.) + 2HNO3(конц.) = 3Cl2 + 2NO + 4H2O
Кислородсодержащие кислоты:
HClO HClO2 HClO3 HClO4
Хлорноватистая хлористая хлорноватая хлорная
усиление кислотных свойств
2HClO 2HCl + O2 HClO + 2HI = HCl + I2 + H2O
HClO + H2O2 = HCl + H2O + O2
- Соли.
Соли соляной кислоты – хлориды.
AgCl + 2(NH3∙ H2O) = [Ag(NH3)2]Cl + 2H2O
2AgCl 2Ag + Cl2
Соли кислородсодержащих кислот.
|
Кислота |
название солей |
|
HClO |
гипохлориты |
|
HClO2 |
хлориты |
|
HClO3 |
Хлораты |
|
HClO4 |
перхлораты |
NaClO + 2HCl = NaCl + Cl2 + H2O
Ca(ClO)2 + H2SO4 = CaSO4 + 2HCl + O2
Ca(ClO)2 + CO2 + H2O = CaCO3 + 2HCl + 2O2
Ca(ClO)2 + Na2CO3 = CaCO3 + 2NaClO
Ca(ClO)2 CaCl2 + O2
4KClO3 3KClO4 + KCl
Бертолетова соль
2KClO3 2KCl + 3O2↑
KClO4 2O2 + KCl
III. Бром. Соединения брома. По химической активности бром занимает промежуточное положение между хлором и иодом.
Br2 + H2 = 2HBr 3Br2 + 2Fe = 2FeBr3
Br2 + H2O = НBr + НBrO – бромная вода
3Br2 + 6NaOH(конц.) = 5NaBr + NaBrO3 + 3H2O при нагревании
Br2 + 2NaOH(конц.) = NaBr + NаBrO + H2O без нагревания
3Br2 + 3Na2CO3 = 5NaBr + NaBrO3 + 3CO2
3Br2 + S + 4H2O = 6HBr + H2SO4
Br2 + SO2 + 2H2O = 2HBr + H2SO4
Br2 + 2NaI = 2NaBr + I2 Br2 + H2S = S + 2HBr
4Br2 + Na2S2O3 + 10NaOH = 2Na2SO4 + 8NaBr + 5H2O
14HBr + K2Cr2O7 = 2KBr + 2CrBr3 + 3Br2 + 7H2O
4HBr + MnO2 = MnBr2 + Br2 + 2H2O
2HBr + H2O2 = Br2 + 2H2O
2KBr + 2H2SO4 (конц.) = 4K2SO4 + 4Br2 + SO2 + 2H2O
2KBrO3 3O2 + 2KBr
2KBrO4O2 + 2KBrO3 (до 275°С)
KBrO4 2O2 + KBr (выше 390°С)
IV. Йод. Соединения йода.
Йод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании.
3I2 + 3P = 2PI3 I2 + H2 = 2HI I2 + Fe = FeI2
Йод практически в воде не растворим и не способен ее окислять даже при нагревании; по этой причине не существует «йодной воды».
3I2 + 6NaOH(гор.) = 5NaI + NaIO3 + 3H2O
I2 + 2NaOH(хол) =NaI + NaIO + H2O
3I2 + 10HNO3(разб) = 6HIO3 + 10NO + 2H2O
I2 + 10HNO3(конц.)= 2HIO3 + 10NO2 + 4H2O
I2 + 5NaClO + 2NaOH = 5NaCl + 2NaIO3 + H2O
I2 + 5Cl2 + 6H2O = 10HCl + 2HIO3
I2 + Na2SO3 + 2NaOH = 2NaI + Na2SO4 + H2O
2HI + 2FeCl3 = I2 + 2FeCl2 + 2HCl
2HI + Fe2(SO4)3 = 2FeSO4 + I2 + H2SO4
2HI + NO2 = I2 + NO + H2O
2HI + S = I2 + H2S
8KI + 5H2SO4 (конц.) = 4K2SO4 + 4I2 + H2S + 4H2Oили
8KI + 9H2SO4(конц.) = 4I2↓ + H2S↑ + 8KHSO4 + 4H2O
KI + 3H2O + 3Cl2 = HIO3 + KCl + 5HCl
10KI + 8H2SO4 + 2KMnO4 = 5I2 + 2MnSO4 + 6K2SO4 + 8H2O
6KI + 7H2SO4 + K2Cr2O7 = Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
2KI + H2SO4 + H2O2 = I2 + K2SO4 + 2H2O
2KI + Fe2(SO4)3 = I2 + 2FeSO4 + K2SO4
2KI + 2CuSO4 + K2SO3 + H2O = 2CuI + 2K2SO4 + H2SO4
2HIO3 I2O5 + H2O
2HIO3 + 10HCl = I2 + 5Cl2 + 6H2O
2HIO3 + 5Na2SO3 = 5Na2SO4 + I2 + H2O
2HIO3 + 5H2SO4 + 10FeSO4 = Fe2(SO4)3 + I2 + 6H2O
I2O5 + 5CO I2 + 5CO2
2KIO3 3O2 + 2KI
2KIO3 + 12HCl(конц.) = I2 + 5Cl2 + 2KCl + 6H2O
KIO3+ 3H2SO4 + 5KI = 3I2 + 3K2SO4 + 3H2O
KIO3 + 3H2O2 = KI + 3O2 + 3H2O
2KIO4 O2 + 2KIO3
5KIO4+ 3H2O + 2MnSO4 = 2HMnO4 + 5KIO3 + 2H2SO4
Галогены.
1. Вещество, полученное на аноде при электролизе расплава иодида натрия с инертными электродами, выделили и ввели во взаимодействие с сероводородом. Газообразный продукт последней реакции растворили в воде и к полученному раствору добавили хлорное железо. Образовавшийся осадок отфильтровали и обработали горячим раствором гидроксида натрия. Напишите уравнения описанных реакций.
2. Вещество, полученное на аноде при электролизе раствора иодида натрия с инертными электродами, ввели в реакцию с калием. Продукт реакции нагрели с концентрированной серной кислотой и выделившийся газ пропустили через горячий раствор хромата калия.Напишите уравнения описанных реакций.
3. Хлорная вода имеет запах хлора. При подщелачивании запах исчезает, а при добавлении соляной кислоты – становится более сильным, чем был ранее. Напишите уравнения описанных реакций.
4. Бесцветные газы выделяются при выдерживании концентрированной кислоты, как с хлоридом натрия, так и с иодидом натрия. При пропускании этих газов через водный раствор аммиака образуются соли.Напишите уравнения описанных реакций.
5. При термическом разложении соли А в присутствии диоксида марганца образовались бинарная соль Б и газ, поддерживающий горение и входящий в состав воздуха, при нагревании этой соли без катализатора образуются соль Б и соль кислородсодержащей кислоты. При взаимодействии соли А с соляной кислотой выделяется жёлто-зелёный газ (простое вещество) и образуется соль Б. соль Б окрашивает пламя в фиолетовый цвет, при её взаимодействии с раствором нитрата серебра выпадает осадок белого цвета.Напишите уравнения описанных реакций.
6) При добавлении раствора кислоты А к диоксиду марганца происходит выделение ядовитого газа жёлто-зелёного газа. Пропустив выделившийся газ через горячий раствор едкого кали, получают вещество, которое используется при изготовлении спичек и некоторых других зажигательных составов. При термическом разложении последнего в присутствии диоксида марганца образуется соль, из которой при взаимодействии с концентрированной серной кислотой можно получить исходную кислоту А, и бесцветный газ , входящий в состав атмосферного воздуха. Напишите уравнения описанных реакций.
7) Йод нагрели с избытком фосфора, и продукт реакции обработали небольшим количеством воды. Газообразный продукт реакции полностью нейтрализовали раствором едкого натра и добавили в полученный раствор нитрат серебра. Напишите уравнения описанных реакций.

9) Через раствор бромида натрия пропустили газ, выделяющийся при взаимодействии соляной кислоты с перманганатом калия. После окончания реакции раствор выпарили, остаток растворили в воде и подвергли электролизу с графитовыми электродами. Газообразные продукты реакции смешали друг с другом и осветили. В результате произошел взрыв.Напишите уравнения описанных реакций.
10) К пиролюзиту осторожно прибавили раствор соляной кислоты, и выделившийся газ пропустили в химический стакан, наполненный холодным раствором едкого кали. После окончания реакции стакан накрыли картонкой и оставили, при этом стакан освещали солнечные лучи; через некоторое время в стакан внесли тлеющую лучинку, которая ярко вспыхнула. Напишите уравнения описанных реакций.
11) Вещество, выделяющееся на катоде и аноде при электролизе раствора йодида натрия с графитовыми электродами, реагируют друг с другом. Продукт реакции взаимодействуют с концентрированной серной кислотой с выделением газа, который пропустили через раствор гидроксида калия.Напишите уравнения описанных реакций.
12) К оксиду свинца (IV) при нагревании добавили концентрированную соляную кислоту. Выделяющийся газ пропустили через нагретый раствор едкого кали. Раствор охладили, соль кислородсодержащей кислоты отфильтровали и высушили. При нагревании полученной соли с соляной кислотой выделяется ядовитый газ, а при нагревании её в присутствии диоксида марганца – газ, входящий в состав атмосферы. Напишите уравнения описанных реакций.
13)Йод обработали концентрированной азотной кислотой при нагревании. Продукт реакции осторожно нагрели. Образовавшийся при оксид вступил в реакцию с угарным газом. Выделившееся простое вещество растворили в теплом растворе гидроксида калия. Напишите уравнения описанных реакций.
14) Раствор иодида калия обработали избытком хлорной воды, при этом сначала наблюдали образование осадка, а затем – его полное растворение. Образовавшуюся при этом йодсодержащую кислоту выделили из раствора, высушили и осторожно нагрели. полученный оксид прореагировал с угарным газом. Напишите уравнения описанных реакций.
15) Йод обработали хлорноватой кислотой. Продукт реакции осторожно нагрели. продукт реакции осторожно нагрели. Образующийся оксид реагирует с угарным газом с образованием двух веществ – простого и сложного. Простое вещество растворяется в теплом щелочном растворе сульфита натрия. Напишите уравнения описанных реакций.
16) Перманганат калия обработали избытком раствора соляной кислоты, образовался раствор и выделился газ. Раствор разделили на две части: к первой добавили гидроксид калия, а ко второй – нитрат серебра. Выделившийся газ прореагировал газ прореагировал с гидроксидом калия при охлаждении. Напишите уравнения описанных реакций.
17) Расплав хлорида натрия подвергли электролизу. Газ, выделившийся на аноде, прореагировал с водородом с образованием нового газообразного вещества с характерным запахом. Его растворили в воде и обработали расчетным количеством перманганата калия, при этом образовался газ желто-зеленого цвета. Это вещество вступает при охлаждении с гидроксидом натрия.Напишите уравнения описанных реакций.
18) Перманганат калия обработали концентрированной соляной кислотой. Выделившийся при этом газ собрали, а к реакционной массе по каплям прибавили раствор гидроксида калия до прекращения выделения осадка. Собранный газ пропустили через горячий раствор гидроксида калия, при этом образовалась смесь двух солей. Раствор выпарили, твердый остаток прокалили в присутствии катализатора, после чего в твердом остатке осталась одна соль.Напишите уравнения описанных реакций.
17) Расплав хлорида натрия подвергли электролизу. Газ, выделившийся на аноде, прореагировал с водородом с образованием нового газообразного вещества с характерным запахом. Его растворили в воде и обработали расчетным количеством перманганата калия, при этом образовался газ желто-зеленого цвета. Это вещество вступает при охлаждении с гидроксидом натрия.Напишите уравнения описанных реакций.
18) Перманганат калия обработали концентрированной соляной кислотой. Выделившийся при этом газ собрали, а к реакционной массе по каплям прибавили раствор гидроксида калия до прекращения выделения осадка. Собранный газ пропустили через горячий раствор гидроксида калия, при этом образовалась смесь двух солей. Раствор выпарили, твердый остаток прокалили в присутствии катализатора, после чего в твердом остатке осталась одна соль.Напишите уравнения описанных реакций.
Галогены.
1) 2NaI 2Na + I2
на катоде на аноде
I2 + H2S = 2HI↑ + S↓
2HI + 2FeCl3 = I2 + 2FeCl2+ 2HCl
I2 + 6NaOH (гор.) = NaIO3 + 5NaI + 3H2O
2) 2NaI + 2H2O 2H2 + 2NaOH + I2
на катоде на аноде
I2 + 2K = 2KI
8KI + 8H2SO4(конц.) = 4I2↓ + H2S↑ + 4K2SO4 + 4H2Oили
8KI + 9H2SO4(конц.) = 4I2↓ + H2S↑ + 8KHSO4 + 4H2O
3H2S + 2K2CrO4 + 2H2O = 2Cr(OH)3 + 3S + 4KOH
3) Cl2 + H2O ↔HCl + HClO
HCl + NaOH = NaCl+ H2O
HClO + NaOH = NaClO+ H2O
NaClO + 2HCl = NaCl + Cl2 + H2O
4) H2SO4(конц.) + NaCl(тверд.) = NaHSO4 + HCl↑
9H2SO4(конц.) + 8NaI(тверд.) = 8NaHSO4 + 4I2↓ + H2S + 4H2O
NH4OH + HCl = NH4Cl + H2O
NH4OH + H2S = NH4HS + H2O
5) 2KClO3 2KCl + 3O2↑
4KClO3KCl + 3KClO4
KClO3 + 6HCl = KCl + 3Cl2↑+ 3H2O
KCl + AgNO3 = AgCl↓ + KNO3
6) 4HCl + MnO2 = MnCl2 + Cl2↑ + 2H2O
3Cl2 + 6KOH(гор.) = 5KCl + KClO3 + 3H2O
2KClO3 2KCl + 3O2↑
H2SO4(конц.) + NaCl(тверд.) = NaHSO4 + HCl↑
7) 3I2 + 2P = 2PI3
PI3 + 3H2O = H3PO3 + 3HI
HI + NaOH = NaI + H2O
NaI + AgNO3 = AgI↓ + NaNO3

16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
Cl2 + 2NaOH(хол.) = NaCl + NaClO + H2O
NaClO + 2HI = NaCl + I2 + H2O
9) 16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
2NaBr + Cl2 = 2NaCl + Br2
2NaCl + 2H2O 2H2 + 2NaOH + Cl2
на катоде на аноде
H2 + Cl2 = 2HCl
10) 4HCl+ MnO2 = MnCl2 + Cl2↑ + 2H2O
Cl2 + 2KOH(хол.) = KCl + KClO + H2O
2KClO3 2KCl + 3O2↑
C + O2 = CO2
11) 2NaI + 2H2O 2H2 + 2NaOH + I2
на катоде на аноде
I2 + H2 = 2HI
8HI + H2SO4(конц.) = 4I2↓ + H2S↑ + 4H2Oили
2HI + H2SO4(конц.) = I2↓ + SO2↑ + 2H2O
а) H2S + 2KOH = K2S + 2H2O
H2S + K2S = 2KHSили
б) SO2 + 2KOH = K2SO3 + 2H2O
K2SO3 + SO2 + H2O = 2KHSO3
12) 4HCl+ PbO2 = PbCl2 + Cl2↑ + 2H2O
3Cl2 + 6KOH(гор.) = 5KCl + KClO3 + 3H2O
KClO3 + 6HCl = KCl + 3Cl2 + 3H2O
2KClO3 2KCl + 3O2↑
13) I2 + 10HNO32HIO3 + 10NO2 + 4H2O
2HIO3 I2O5 + H2O
I2O5 + 5CO I2 + 5CO2
3I2 + 6KOH(гор.) = 5KI + KIO3 + 3H2O
14) 2KI + Cl2 = 2KCl + I2
I2 + 5Cl2 + 6H2O = 10HCl + 2HIO3
2HIO3 I2O5 + H2O
I2O5 + 5CO = I2 + 5CO2
15) I2+ 2HClO3 = 2HIO3 + Cl2
2HIO3 I2O5 + H2O
I2O5 + 5CO I2 + 5CO2
I2 + Na2SO3 + 2NaOH = 2NaI + Na2SO4 + H2O
16) 16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
MnCl2 + 2KOH = Mn(OH)2↓ + 2KCl
KCl + AgNO3 = AgCl↓ + KNO3
Cl2 + 2KOH(хол.) = KCl + KClO + H2O
17) 2NaCl 2Na + CL2
на катоде на аноде
Cl2 + H2 = 2HCl
16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
Cl2 + 2NaOH(хол.) = NaCl + NaClO + H2O
18) 16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
MnCl2 + 2KOH = Mn(OH)2↓ + 2KCl
3Cl2 + 6KOH(гор.) = 5KCl + KClO3 + 3H2O
2KClO3 2KCl + 3O2↑
14821. Какая масса иода выделится при взаимодействии 0,5 моль иодида калия с необходимым количеством хлора? (Запишите число с точностью до десятых.)

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 14821.
14816. При растворении сульфида железа(II) в избытке соляной кислоты выделилось 2,8 л (н.у.) газа. Чему равна масса сульфида железа(II)?

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 14816.
14815. Масса газа, выделившегося при обработке избытком хлороводородной кислоты 3 моль сульфида натрия, равна _____ г.

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 14815.
14814. Какая масса брома выделится при взаимодействии 0,3 моль бромида калия с избытком хлора?

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 14814.
14799. Карбонат кальция массой 10 г обработали избытком хлороводородной кислоты. Определите массу хлорида кальция, образовавшегося в результате этой реакции. (Запишите число с точностью до десятых.)

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 14799.
Для вас приятно генерировать тесты, создавайте их почаще
Задание № 1 (Тестовая часть):
Установите соответствие между названием вещества и реагентами, с каждым из которых оно может взаимодействовать.
А) азот
Б) цинк
В) бром
Г) кальций
Формулы реагентов:
1) O2, HCl, H2SiO4
2) H2, Mg, Ca(OH)2
3) MnCl2, N2, O2
4) O2, Ca, Li
5) NaOH, O2, CuSO4.
Решение:
Данное задание входит в тестовую часть в качестве вопроса № 8, который требует знаний химических свойств простых и сложных веществ в неорганической химии.
Учитывая, что этот урок посвящен теме «Галогены», предлагаю вспомнить и изучить свойства этой группы элементов, которые находятся в VII A группе.
Итак, начнем: первый элемент в списке — азот.
Азот.
N2 — это неметалл, входит в состав воздуха, является бесцветным газом, без запаха, реагирует:
— с литием на воздухе (без нагревания) с образованием азида лития (Li3N);
— с кальцием (при нагревании), в итоге можно получить Ca3N2;
— с кислородом (электрический разряд, около 3000 С) — образуется NO.
Подходит пункт 4.
Цинк.
Далее идет цинк, это переходный металл (его соединения проявляют амфотерные свойства), достаточно хрупкий, в чистом виде имеет серебристо — белый цвет, реагирует:
— с растворами кислот (HCl) — происходит замещение цинка на водород в кислоте. Однако, с кремниевой кислотой реакция не идет;
— с щелочами (NaOH), образуя гидроксоцинкаты;
— с сульфатом меди (выделяется чистая медь и сульфат цинка).
Выбираем пункт 5.
Бром.
Бром — это галоген, который проявляет кислотные свойства, является дымящей красно — коричневой жидкостью, токсичен; реагирует:
— с водородом;
— с металлами (Ca, Mg);
— с щелочами (Ca(OH)2), причем в этой реакции образуются соли брома — CaBr2 и Ca(BrO)2.
Подходит вариант 2.
Кальций.
Последний химический элемент в списке — кальций, это активный металл, который активно реагирует:
— с неметаллами (галогены, O2, H2, N2);
— с водой;
— с кислотами;
— с солями (замещение катиона более слабого металла, по сравнению с кальцием).
Здесь подходит вариант 3.
Ответ: 4523.
Задание № 2 (Тестовая часть):
Установите соответствие между реагирующими веществами и продуктами, которые преимущественно образуются при взаимодействии этих веществ.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА:
А) Cl2 и KOH (хол. р-р)
Б) Cl2 и KOH (гор. р-р)
В) KClO3 → (t C)
Г) KClO3 → (t, MnO2)
ПРОДУКТЫ РЕАКЦИИ:
1) KCl и H2O;
2) KCl, KClO и H2O;
3) KCl, KClO2 и H2O;
4) KCl, KClO3 и H2O;
5) KCl и O2;
6) KCl и KClO4.
Решение:
Это задание № 9 тестовой части ЕГЭ по Химии, в котором нужно установить исходные вещества в соответствии с продуктами реакции.
1) Cl2 и KOH (хол. р-р) → KCl + KClO + H2O (хлорид калия, гипохлорит калия, вода).
2) Cl2 и KOH (гор. р-р) → KCl, KClO3 и H2O (хлорид калия, хлорат калия (бертолетова соль), вода).
3) KClO3 → (t C) → термическое разложение (400 С) бертолетовой соли приводит к образованию KClO4 и KCl (перхлората калия, хлорида калия).
4) KClO3 → (t, MnO2) → термическое каталитическое разложение (200 С) хлората калия образует KCl и O2 (хлорид калия и кислород).
Ответ: 2465.
Задание № 3 (Тестовая часть):
Задана следующая схема превращения веществ:
I2 → (X)→KI→ (Y)→I2
Определите, какие из указанных веществ являются веществами X и Y.
1) KOH;
2) KCl;
3) Cl2;
4) HCl;
5) KClO4.
Решение:
Первая реакция проста на первый взгляд, нам нужно из чистого йода получить йодид калия. Однако, это не простая реакция соединения или замещения, это ОВР — йод меняет свою степень окисления с 0 до -1 в присутствии щелочи:
I2 + 2KOH (разб.) = KI + KIO + H2O (0 C)
Так как это задание достаточно легкое, здесь не указаны условия протекания этой реакции, и не сказано, какие вещества дополнительно образуются в качестве продуктов реакции. Поэтому, первое звено цепочки решено, вещество X = KOH.
Следующая реакция — как из йодида калия получить чистый йод. Эта реакция знакома многим — галогены вытесняют более слабые галогены из сложных веществ (реакция замещения). В данном случае нам нужен галоген, который стоит в 7А подгруппе выше йода; это может быть бром, хлор, фтор; из вариантов ответа подходит хлор. Вещество Y = Cl2.
2KI + Cl2 = 2KCl + I2
Ответ: 13
Задание № 4 (Тестовая часть):
Установите соответствие между реагентами и схемами превращения элемента хлора.
РЕАГЕНТЫ:
А) хлор и аммиак
Б) хлористая кислота и бромоводород
В) хлорноватистая кислота и сернистый ангидрид
Г) хлор и бромоводород
СХЕМЫ ПРЕВРАЩЕНИЯ:
1) Cl0 → Cl+1;
2) Cl0 → Cl-1;
3) Cl+1 → Cl0;
4) Cl+3 → Cl-1;
5) Cl+7 → Cl-1;
6) Cl+1 → Cl-1.
Решение:
Данное задание относится в 21 вопросу в ЕГЭ, для его выполнения необходимо знать химические реакции и изменение степеней окисления.
Итак, первые исходные вещества — хлор и аммиак, эту реакцию я уже писала в теме «Аммиак».
8NH3 + 3Cl2 = N2 + 6NH4Cl — степень окисления хлора: Cl0 → Cl-1
Вторая пара веществ — хлористая кислота и бромоводород;
Хлористая кислота (HClO2) в свободном виде не выделена, существует только в растворах, способна вступать в реакции
— с щелочами,
— с галогеноводородами (HCl, HI, HBr)
Реакция между этими реагентами выглядит так:
HClO2 + 4HBr = HCl + 2Br2 + 2H2O — степень окисления хлора: Cl+3 → Cl-1
Следующие реагенты — хлорноватистая кислота и сернистый ангидрид.
Хлорноватистая кислота (HClO) в свободном виде не выделена, слабая кислота, разлагается на свету, сильный окислитель, реагирует:
— с галогеноводородами;
— с гидратом аммиака (NH3 * H2O);
— с щелочами.
Это нестандартная реакция между кислотой и кислотным оксидом, поэтому ее надо запомнить:
HClO + SO2 + H2O = HCl + H2SO4 — степень окисления хлора: Cl+1 → Cl-1
Четвертая пара продуктов реакции — хлор и бромоводород; это простая реакция замещения, в результате которой хлор вытесняет бром и встает на его место, образуя хлороводород и выделяется бром:
Cl2 + 2HBr = 2HCl + Br2 — степень окисления хлора: Cl0 → Cl-1
Ответ: 2462
Задание № 5 (Тестовая часть):
Установите соответствие между названием вещества и возможным электролитическим способом его получения:
НАЗВАНИЕ ВЕЩЕСТВА:
А) кислород
Б) фтор
В) калий
Г) водород
ПОЛУЧЕНИЕ ЭЛЕКТРОЛИЗОМ:
1) раствора AuCl3
2) раствора CuBr2
3) расплава NaF
4) расплава KCl
5) раствора KF.
Решение:
Для начала хочу акцентировать внимание на некоторых важных особенностях процессов электролиза в растворах и расплавах:
1) Щелочные металлы (K, Na) выделяются в чистом виде в процессе электролиза ТОЛЬКО в расплаве (на катоде);
2) Металлы (в растворе), стоящие в ряду активности
ДО H2 (K, Li, Na, Ca) → выделяется H2,
ДО H2 (Al, Zn, Cr, Fe, Ni, Sn, Pb) → возможно выделение Ме и H2,
ПОСЛЕ H2 (Сu, Ag, Au, Pt, Hg) → выделяется Ме;
3) Галогены в процессе электролиза выделяются на аноде в чистом виде (кроме фтора);
4) Кислородсодержащие анионы и фтор в процессе электролиза выделяют кислород.
Итак, кислород выделяется в результате электролиза раствора KF;
— фтор выделяется в расплаве NaF;
— калий в результате электролиза расплава KCl;
— водород — в процессе электролиза раствора KF.
Ответ: 5345
Задание № 6 (Тестовая часть):
Установите соответствие между формулой соли и типом ее гидролиза.
ФОРМУЛА СОЛИ:
А) FeCl3
Б) BaS
В) KF
Г) ZnSO4
ТИП ГИДРОЛИЗА:
1) по катиону
2) по аниону
3) по катиону и по аниону
4) гидролиз не происходит
Решение:
Вопросы по теме «Гидролиз» являются достаточно легкими, нужно только знать силу кислот и оснований, а также принцип процесса нейтрализации.
Первое вещество — хлорид железа (III), это соль, которая образована слабым основанием и сильной кислотой, гидролиз по катиону, среда кислая;
Второе вещество — сульфид бария, эта соль образована сильным основанием и слабой кислотой, гидролиз по аниону, среда щелочная;
Третье вещество — фторид калия, она образована сильным основанием и слабой кислотой (плавиковая кислота (HF) несмотря на наличие самого электроотрицательного неметалла в составе, сильной кислотой не является), гидролиз по аниону, среда щелочная;
Далее по списку — сульфат цинка, здесь соль образована слабым основанием и сильной кислотой, гидролиз по катиону, среда кислая.
Ответ: 1221
Задание № 7 (Часть 2):
Для выполнения заданий 30, 31 используйте следующий перечень веществ: нитрат калия, йодид калия, хлорид бария, серная кислота, йод, фторид серебра. Допустимо использование водных растворов веществ.
30. Из предложенного перечня веществ выберите вещества, между которыми окислительно — восстановительная реакция протекает с выделением ядовитого газа с неприятным запахом. В этой реакции наблюдается образование осадка темного цвета.
31. Из предложенного перечня веществ выберите среднюю соль и вещество, которое вступает с ней в реакцию ионного обмена с образованием творожистого осадка желтого цвета.
Решение:
30. В условии даны два эффекта реакции ОВР — выделение ядовитого газа с неприятным запахом и образование темного осадка.
Учитывая, что здесь не сказано о цвете газа, у нас есть выбор из двух бесцветных газов — аммиака и сероводорода, но среди веществ в задании нет соединений азота, поэтому берем H2S.
К тому же, выпал осадок темного цвета — темных осадков много, среди них чистый йод, который выделяется при взаимодействии солей йода с сильными кислотами.
В итоге пишем реакцию:
8KI + 5H2SO4 = 4I2↓ + 4K2SO4 + 4H2O + H2S↑ — я сразу уравняла ее и не стану оформлять электронный баланс, так как ученик сдающий ЕГЭ знает, как это делать.
31. В этом задании нужно выбрать среднюю соль и вещество, в итоге должен образоваться творожистый осадок желтого цвета.
Нам даны несколько солей, среди которых
— йодид калия и нитрат калия, которые не дают осадков (так как все соли калия растворимы);
— хлорид бария, который может давать осадки, но не желтого цвета;
— фторид серебра — то вещество, которое нам нужно (соль йодид серебра представляет собой желтый творожистый осадок):
KI + AgF = AgI↓ + KF — осталось оформить ее в ионно — обменном виде и задание готово.
Задание № 8 (Часть 2):
Для выполнения заданий 30, 31 используйте следующий перечень веществ: гидроксид магния, аммиак, хлорид железа (III), фосфат кальция, хлор, бромид калия. Допустимо использование водных растворов веществ.
30. Из предложенного перечня веществ выберите вещества, между которыми протекает окислительно — восстановительная реакция с изменением цвета и выделением газа.
31. Из предложенного перечня веществ выберите среднюю соль и вещество, водный раствор которого вступает с этой солью в реакцию ионного обмена.
Решение:
30. В данном задании есть два газа, которые идеально подходят к параметрам условия — аммиак и хлор; они реагируют друг с другом с выделением чистого азота и хлорида аммония:
3Cl2 + 8NH3 = N2 + 6NH4Cl — в этой реакции происходит изменение цвета (хлор — желто-зеленый газ, азот — бесцветный).
31. Для решения этого задания рассмотрим все вещества:
— гидроксид магния (нерастворимое вещество), не подходит;
— фосфат кальция (нерастворимое вещество), не подходит;
— бромид калия (растворимое вещество), не подходит (все соли калия растворимы!);
— хлорид железа (III) (растворимое вещество), подходит — при взаимодействии с основанием дает осадок в виде гидроксида железа (III).
Но вот вопрос — разве в перечне есть основание? Есть — это гидроксид аммония (NH4OH, или NH3 * H2O).
Если внимательно прочитать условие, то там написано «Допустимо использование водных растворов веществ», этим мы и воспользуемся (водный раствор аммиака это и есть гидроксид аммония):
FeCl3 + 3NH3 * H2O = 3NH4Cl + Fe(OH)3 ↓ — выделяется бурый осадок гидроксида железа (III).
!Не забывай про правильное оформление ионно — обменного процесса
На сегодня все!
Для выполнения заданий 29,30 используйте следующий перечень веществ:
нитрит натрия, серная кислота, иодид натрия, гидроксид калия, нитрат магния. Допустимо использование водных растворов веществ.
6881. Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция с выпадением осадка и выделением газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций. Составьте электронный баланс, укажите окислитель и восстановитель в этой реакции.

Возможна следующая реакция:
2Nal + 2NaNO2 + 2H2SO4 = I2↓ + 2NO↑ + 2Na2SO4 + 2H2O
Один из возможных вариантов реакции: 8NaI + 5H2SO4 → 4I2 + H2S + 4H2O + 4Na2SO4
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке
При обращении указывайте id этого вопроса — 6881.
6883. Бромоводородную кислоту нейтрализовали карбонатом калия. Полученный раствор подвергли электролизу. Газ, выделившийся на катоде, пропустили при нагревании над оксидом меди(II). Образовавшееся твёрдое вещество растворили в концентрированной азотной кислоте.
Напишите уравнения четырёх описанных реакций.

1) 2HBr + K2CO3 = 2KBr + H2O + CO2↑
2) 2KBr + 2H2O = (ϟ) 2KOH + H2↑ + Br2
3) CuO + H2 = (t°) Cu + H2O
4) Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке
При обращении указывайте id этого вопроса — 6883.
6894. Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) Na2O
Б) HBr
В) S
Г) Cu
РЕАГЕНТЫ
1) KOH, O2, HNO3
2) FeO, BaS, Cl2
3) CO, HCl, Br2
4) AgNO3, Cl2, HNO3
5) H2O, ZnO, NO2

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке
При обращении указывайте id этого вопроса — 6894.
6896. Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) Ca(ClO)2
2) NaOH(р-р. 10 °C)
3) Br2
4) AlCl3
5) NaOH(р-р. 100 °C)

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке
При обращении указывайте id этого вопроса — 6896.
6940. Из предложенного перечня типов реакций выберите два типа, к которым можно отнести взаимодействие брома с раствором гидроксида натрия.
1. обратимая2. реакция диспропорционирования3. каталитическая4. реакция нейтрализации5. гомогенная

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке
При обращении указывайте id этого вопроса — 6940.
Для вас приятно генерировать тесты, создавайте их почаще
Офицерова Нина Викторовна
Тест по теме «Галогены»
Тест по теме «Галогены» предназначен для контроля знаний учащихся по данной теме. Тест составлен в 4 вариантах.
Авторы учебника: «Химия» 9 класс И. И. Новошинкий, Н. С. Новошинская
Виды заданий: на выбор ответа, продолжить запись, записать уравнения химических реакций.
Тест позволяет проверить знания учащихся по строению атомов галогенов, сравнению окислительно-восстановительных свойств атомов, физических и химических свойствах простых веществ и их соединений,
взаимной активности галогенов в химической реакции.
В тесте предусмотрены вопросы о применении галогенов и их соединений в быту, использовании их в промышленности, роли галогенов в физиологических процессах организма человека. Предложены задания, где предусматривается правильный выбор с дальнейшей записью химического уравнения.
Вариант 1
1. Является галогеном:
А) Mn; б) S; в) Na; г) Cl.
2. Число валентных электронов на внешнем энергетическом уровне атомов галогенов:
А) 8; б) 7; в) 1; г) 5.
3. Распределение электронов по слоям 2, 7 соответствует атому:
А) F; б) Cl; в) Br; г) I.
4. В ряду F2-Cl2-Br2-I2 температура кипения:
А) уменьшается;
Б) возрастает;
В) не изменяется;
Г) изменяется незакономерно.
5. Обладает наиболее интенсивной окраской:
А) F2; б) Cl2; в) Br2; г) I2.
6. Реакция галогена с металлом является:
А) окислительной;
Б) окислительно-восстановительной;
В) не окислительно-восстановительной;
Г) восстановительной.
7. Химическая активность галогенов возрастает в присутствии:
А) Н2О; б) S;
В) металлов;
Г) других галогенов.
8. Хлор взаимодействует со всеми веществами триады:
А) Na, H2, I2;
Б) Fe, H2O, H2;
В) K, NaF, H2;
Г) H2O, H2, S.
9. Возможно взаимодействие:
А) NaCl + Br2;
Б) NaBr + Cl2;
В) NaCl + I2;
Г) NaBr + I2.
10. Используется для производства фреонов:
А) F2; б) Cl2; в) Br2; г) I2.
11. Водный раствор хлороводорода изменяет окраску лакмуса на:
А) фиолетовую;
Б) синюю;
В) красную;
Г) желтую.
12. Соляная кислота взаимодействует со всеми веществами триады:
А) Cu, CuO, Cu 2;
Б) NaBr, Ca, NaOH;
В) Zn, ZnO, Zn 2;
Г) NaCl, Na2O, метиловый оранжевый.
13. Выберите вещества, взаимодействующие с Br2:
Zn, ZnO, лакмус, NaCl, H2O, NaI, H2.
Напишите уравнения реакций.
Вариант 2
1. Не является галогеном:
А) F; б) I; в) Re; г) Cl.
2. Обладает большим радиусом:
А) F; б) I; в) Br; г) Cl.
3. Структура валентного уровня атомов галогенов:
А) Ns 2 Np 5; б) 3 S 23 P 5; в) Ns 2 Np 6; г) Ns 2 Np 7.
4. При комнатной температуре является твердым веществом:
А) F2; б) Cl2; в) Br2; г) I2.
5. Раствор хлора в воде — это:
А) хлороводород;
Б) соляная кислота;
В) хлорная кислота;
Г) хлорная вода.
6. Продукт взаимодействия железа с хлором:
А) хлорид железа ;
Б) оксид железа ;
В) хлорид железа ;
Г) бромид железа .
7. Наиболее активно взаимодействует с водой:
А) I2; б) F2; в) Br2; г) Cl2.
8. Бром взаимодействует со всеми веществами триады:
А) NaI, H2О, K;
Б) FeО, H2O, КОН;
В) Аl, NaF, H2;
Г) H2O, KCl, Na.
9. Возможно взаимодействие:
А) NaF + Br2;
Б) NaCl + Br2;
В) NaCl + I2;
Г) NaI + Br2.
10. Получают из морских водорослей:
А) F2; б) Cl2; в) Br2; г) I2.
11. Является более сильной кислотой:
А) НF; б) НCl; в) НBr; г) НI.
12. Соляная кислота взаимодействует со всеми веществами триады:
А) Fe, FeO, Fe 2;
Б) ZnO, Hg, NaOH;
В) Na, Zn, Au;
Г) NaCl, NaBr, NaF.
13. Выберите вещества, взаимодействующие с Сl2:
K, H2O, NaI, H2, Cu, NaF, N2.
Напишите уравнения реакций.
Вариант 3
1. Галогенами называются элементы подгруппы:
А) VIа; б) VIIa; в) VIIIa; г) VIIб.
2. Галогены объединены в одну подгруппу, потому что:
А) строение внешнего энергетического уровня атомов одинаковое;
Б) неметаллы;
В) валентность равна 1;
Г) химические свойства одинаковы.
3. Электронная формула
1 S 22 S 22 P 63 S 23 P 5
Соответствует атому:
А) F; б) Cl; в) Br; г) I.
4. Молекулы галогенов состоят из числа атомов:
А) 1; б) 2; в) 3; г) 4.
5. Обладает наибольшей температурой плавления:
А) F2; б) Cl2; в) Br2; г) I2.
6. Наиболее активно взаимодействует с натрием:
А) F2; б) Cl2; в) Br2; г) I2.
7. Используют для обеззараживания воды:
А) F2; б) Cl2; в) Br2; г) I2.
8. Йод взаимодействует со всеми веществами триады:
А) N2, H2, Br2;
Б) NaCl, H2O, H2;
В) K, H2O, H2;
Г) H2O, H2S, KF.
9. Возможно взаимодействие:
А) NaCl + F2;
Б) NaCl + Br2;
В) NaBr + I2;
Г) NaCl + I2.
10. Промышленный способ получения хлороводорода:
A) H2 + Cl2 = 2HCl;
Б) 2NaCl + H2SO4 = 2HCl + Na2SO4;
В) Cl2 + H2O = HCl + HClO;
Г) 2NaCl + F2 = 2NaF + Cl2.
11. Плотность хлороводорода больше плотности воздуха в число раз:
А) 1,25; б) 2,5; в) 3; г) 5,2.
12. Соляная кислота взаимодействует не со всеми веществами триады:
А) Cа, CаO, Cа 2;
Б) Na, Na2O, NaOH;
В) Zn, ZnO, Zn 2;
Г) Сu, CuO, метиловый оранжевый.
13. Выберите вещества, взаимодействующие с HBr:
Zn, ZnO, лакмус, NaOH, H2O, NaI, Cu, CuO.
Напишите уравнения реакций.
Вариант 4
1. Галогены — это:
А) типичные неметаллы;
Б) переходные элементы;
В) типичные металлы.
2. Валентные электроны прочнее связаны с ядром в атоме:
А) F; б) Cl; в) Br; г) I.
3. Конфигурация валентных электронов в атоме фтора:
А) 2 S 2; б) 2 S 22 P 5; в) 2 P 5; г) 1 S 22 S 22 P 5.
4. При комнатной температуре — жидкость:
А) F2; б) Cl2; в) Br2; г) I2.
5. Обладает наименьшей плотностью:
А) F2; б) Cl2; в) Br2; г) I2.
6. Более сильный окислитель:
А) F2; б) Cl2; в) Br2; г) I2.
7. Наименее активно взаимодействует с водородом:
А) F2; б) Cl2; в) Br2; г) I2.
8. Хлор взаимодействует со всеми веществами триады:
А) К, H2О, NaI;
Б) Fe, HCl, H2;
В) K, NaF, H2О;
Г) H2O, H2S, КF.
9. Взаимодействие невозможно:
А) NaCl + Br2;
Б) NaBr + Cl2;
В) NaI + Cl2;
Г) NaI + Br2.
10. Используется в медицине для обеззараживания ран:
А) F2; б) Cl2; в) Br2; г) I2.
11. Лабораторный способ получения хлороводорода:
А) Н2 + Сl2 = 2HCl;
Б) 2NaCl + H2SO4 = Na2SO4 + 2HCl;
В) Cl2 + H2O = HCl + HClO;
Г) 2NaCl + F2 = 2NaF + Cl2.
12. Соляная кислота взаимодействует не со всеми веществами триады:
А) Cu, CuO, Cu 2;
Б) Na, Ca, NaOH;
В) Zn, ZnO, Zn 2;
Г) NaОН, Na2O, метиловый оранжевый.
13. Выберите вещества, взаимодействующие с НBr:
Zn, Zn 2, Cu, Na2О, NaOH, H2O, NaI, H2.
Напишите уравнения реакций.
1. Галогены находятся в главной подгруппе группы номер
A) 7
B) 2
C) 1
D) 5
E) 8
2.Степень окисления элемента равна нулю, а валентность – единице в молекуле
A) Н2О
B) F2
C) NH3
D) HCl
E) N2
3. Максимальный объем хлороводорода, который можно получить из 260 г хлорида натрия, содержащего 10% примесей, равен (в литрах, при н.у.):
A) 22,4
B) 112
C) 89,6
D) 38,3
E) 44,8
4.Соляная кислота вступает в реакцию с оксидом:
A) кремния (IV)
B) углерода (II)
C) цинка
D) азота (II)
E) углерода (IV)
5. Для полного осаждения серебра из 170 г 1%-ного раствора AgNO3 потребовалось 100 мл иодоводородной кислоты. Молярность раствора HI равна
A) 1М
B) 0,01М
C) 10М
D) 0,1М
E) 1,1М
6.При растворении в соляной кислоте 10,4 г смеси железа и магния выделилось 6,72 л водорода (н.у.). Масса железа в смеси
A) 6,7 г
B) 5 г
C) 4,4 г
D) 5,6 г
E) 3 г
7.При получении хлороводорода, бромоводорода, йодоводорода из простых веществ в сосудах равного объема через 24 с образуется по 15,34 г этих газов. Скорость реакции
A) Выше для йодоводорода
B) Выше для хлороводорода
C) Ниже для хлороводорода
D) Одинакова
E) Выше для бромоводорода
8.Даны: а) MgCl2 б) J2 в) HClO г) NaClO4 д) KClO3
Ряд веществ с окислительно-восстановительной двойственностью
A) в, г, д
B) а, в, г
C) б, в, д
D) а, б, д
E) б, в, г
9. Смешали 10 мл 0,1М галогеноводородной кислоты и раствор, содержащий избыток нитрата серебра (I). На фильтре собрали 0,188 г осадка. Формула галогеноводорода, который был в исходной кислоте
A) HBr
B) HI
C) HF
D) HCl
E) HAt
10. При взаимодействии 4,48 л фтора (н.у.) с водой, получается масса О2 равная
A) 1,2 г
B) 2 г
C) 3,2 г
D) 2,4 г
E) 1,6 г
11. Растворимость хлорида натрия при 20о С равна 36 г на 100 г воды. Массовая доля (в %) вещества в насыщенном растворе составляет
A) 56,3 B) 36,0 C) 42,0 D) 61,3 E) 26,5
12.Формула самой сильной кислоты
A) HF B) HClO C) HClO2 D) HClO4
E) HClO3
13. Реакция взаимодействия хлорида бария идет до конца с
A) Нитратом калия B) Соляной кислотой
C) Сульфатом натрия D) Азотной кислотой
E) Хлоридом натрия
14. Имеется хлорид элемента III группы, в котором элемент проявляет высшую валентность и содержит 79,68% хлора. Относительная атомная масса элемента и химический знак
A) 11 В
B) 70 Ga
C) 45 Sc
D) 27 Al
E) 56 Fe
15.Для получения хлора в лаборатории используют реакцию:
A) Разложение KClO3
B) HCl + Al →
C) HCl + MnO2 →
D) NaCl + H2SO4(конц.) →
E) Гидролиз AlCl3
16. Растворяют смесь хлора и брома в холодной воде и получают
A) HClO3, HBr
B) HClO, HBr
C) HCl, HBr
D) HCl, HBrO
E) HCl, HBrO3
17.Объем газа, который выделится при обработке 60 г железа 450 г 22% раствором хлороводородной кислоты, составляет (н.у.)
A) 24 л
B) 22 л
C) 43 л
D) 12 л
E) 23 л
18. Плотность жидкого брома составляет 3,102 г/мл. Его масса (в граммах) в склянке объемом 0,2 л равна
A) 620,4 г
B) 155,1 г
C) 224 г
D) 310,2 г
E) 336 г
19.Количество вещества хлора, необходимое для приготовления 2 л 1%-ной соляной кислоты с плотностью 1,18 г/мл, равно
A) 0,323 моль
B) 0,232 моль
C) 0,646 моль
D) 0,121 моль
E) 0,464 моль
20.Хлороводород, полученный из 585 г хлорида натрия ( в присутствии H2 SO4 (к) при комнатной температуре), растворили в воде массой 1460 г. Массовая доля HCl (%) в растворе равна
A) 20
B) 25
C) 30
D) 10
E) 15
21.Хлор в промышленности получают по схеме
A) Ca(OCl)2 + HCl →
B) NaCl + F2 →
C) KMnO4 + HCl →
D) NaCl p-p →Электролиз→
E) MnO2 + HCl →
22.Для полного перевода в раствор 10,6 г карбоната натрия израсходовано 36,5 г раствора хлороводородной кислоты. Массовая доля вещества в растворе кислоты
A) 30%
B) 10%
C) 20%
D) 50%
E) 40%
23. Приготовлено 3,318 л 10%-ной хлороводороодной кислоты с плотностью 1,1 г/мл. Объем растворенного газа (в литрах, н.у.)
A) 224 л
B) 336 л
C) 448 л
D) 44,8 л
E) 22,4 л
24.В MgCl2 и AlBr3 тип гибридизации соответственно
A) sp3 и sp2
B) sp и sp3
C) sp2 и sp3
D) sp и sp2
E) sp и s2p
25. NaCl называют
A) Поваренная соль
B) Медный купорос
C) Гипс
D) Мел
E) Пирит
26. Вода горит в присутствии
A) J2
B) Br2
C) F2
D) Cl2
27. Объем хлороводорода (н.у.), который можно получить из 6,5 г поваренной соли, содержащей 10% примесей, равен (в л)
A) 2,24
B) 2,49
C) 5,6
D) 0,56
E) 1,12
E) H2
28.В схеме превращений
Br2 →1→ KBrO3 →2→ Br2 →3→NaBrO3 →4→ NaBr
участие щелочи необходимо на стадии
A) 2, 3
B) 3, 4
C) 1, 2
D) 1, 3
E) 2, 4
29. Верное утверждение
A) реагируя с железом, хлор образует хлорид железа (III) (нагревание, избыток хлора)
B) хлор в природе встречается в основном в свободном виде
C) высшая степень окисления хлора в соединениях +5
D) при н.у. хлор – желто-зеленая жидкость с резким запахом
E) в соединениях с кислородом хлор проявляет отрицательную степень окисления
30. Соль, которая не диссоциирует
A) AgCl
B) LiCl
C) NaCl
D) CsCl
E) KCl
31. Электроотрицательность атомов галогенов возрастает в ряду:
A) F, I, Cl, Br
B) F, Br, I, Cl
C) I, Cl, Br, F
D) I, Br, Cl, F
E) F, Cl, Br, I
32 Хлор не может вступать в реакцию с:
A) NaOH
B) HF
C) H2O
D) HBr
E) HI
Ответы к тесту по теме Галогены
1A 2B 3C 4C 5D 6D7B8C 9A 10C 11 E 12D 13C 14D 15D 16 17A 18A19A 20A 21D 22 C23A 24D 25A 26C 27A 28D 29A 30A31C 32B
Галогены и соединения галогенов в формате ЕГЭ
Часть 1
А 1. Число нейтронов в ядре атома 37Cl равно
-
20
-
17
-
37
-
19
А 2. В ряду F— Cl – Br – I
-
Увеличивается число электронов на внешнем энергетическом уровне
-
Увеличиваются окислительные свойства элементов
-
Уменьшается высшая степень окисления элементов
-
Увеличиваются восстановительные свойства элементов
А 3. Верны ли следующие суждения о галогенах
А) Из всех галогенов йод – наиболее электроотрицательный элемент.
Б) Электронная конфигурация внешнего уровня всех атомов галогенов ns2np5
1) Верно только А
2) Верно только Б
3) Верны оба суждения
4) Оба суждения неверны
А 4. Полярная ковалентная связь образуется между атомами в соединении
-
KCl
-
F2
-
BF3
-
BaF2
А 5. Степень окисления хлора в Ba(ClO3)2 равна
-
+ 1
-
+ 3
-
+ 5
-
+ 7
А 6. Кристаллическая решетка галогенов
-
Атомная
-
Ионная
-
Молекулярная
-
Металлическая
А 7. В перечне кислот А) Фтороводородная Б) Хлорноватистая В) Соляная Г) Хлорная
Д) Хлористая Е) Бромоводородная сильными кислотами не являются
1) А Б Д
2) А В Д
3) Б Г Е
4) А Г Е
А 8. Верны ли следующие суждения о свойствах железа?
А) При взаимодействии железа с разбавленной хлороводородной кислотой образуется хлорид железа (II)
Б) При взаимодействии железа с концентрированной хлороводородной кислотой образуется хлорид железа (III)
1) Верно только А
2) Верно только Б
3) Верны оба суждения
4) Оба суждения неверны
А 9. Формула высшего оксида хлора
-
Cl2O
-
Cl2O3
-
Cl2O5
-
Cl2O7
А 10. С соляной кислотой взаимодействует
-
NaHCO3
-
Hg
-
SiO2
-
S
А 11. Раствор бромида натрия вступает в реакцию с
-
AgNO3
-
HNO3
-
KNO3
-
Cu(NO3)2
А 12. В схеме превращений Fe + X1 = FeCl3, FeCl3 + X2 = FeCl2 веществами «Х1» и «Х2» являются
-
Cl2 и HCl
-
HCl и H2
-
HCl и Zn
-
Cl2 и Fe
А 13. Верны ли следующие суждения о галогенпроизводных углеводородов
А) Связь углерод – галоген более полярна, чем связь углерод – водород
Б) При переходе от фтора к йоду энергия связи уменьшается
1) Верно только А
2) Верно только Б
3) Верны оба суждения
4) Оба суждения неверны
А 14. С бромоводородом может реагировать
-
Метан
-
Полиэтилен
-
Пропан
-
Изобутилен
А 15. В ходе реакции этанола с соляной кислотой в присутствии серной кислоты образуется
-
Этилен
-
Хлорэтан
-
1,2 – дихлорэтан
-
Хлорвинил
А 16. Как с йодом, так и с хлороводородом может реагировать кислота
-
Бензойная
-
Пропионовая
-
Пальмитиновая
-
Линолевая
А 17. При действии концентрированного водного раствора щелочи на монобромалканы при нагревании преимущественно образуются
-
Алканы
-
Алкены
-
Спирты
-
Альдегиды
А 18. В схеме превращений этанол →Х → бутан веществом Х является
-
Бутанол – 1
-
Бромэтан
-
Этан
-
Этилен
А 19. Взаимодействие цинка с соляной кислотой относится к реакциям
-
Обмена
-
Соединения
-
Разложения
-
Замещения
А 20. С наименьшей скоростью происходит взаимодействие метана с
-
Фтором
-
Йодом
-
Бромом
-
Хлором
А 21. В системе: 4HCl(г) + O2(г) ↔ 2Cl2(г) + 2H2O(г) +Q, смещению химического равновесия в сторону исходных веществ способствует
-
Увеличение концентрации O2
-
Повышение температуры
-
Повышение давления
-
Понижение температуры
А 22. Наиболее сильным электролитом является
-
HF
-
HCl
-
HBr
-
HI
А 23. Молекулярному уравнению реакции KBr + AgNO3 = AgBr + KNO3 соответствует сокращенное ионное уравнение
-
K+ + NO3— = KNO3
-
K+ + Br — + Ag + + NO3— = AgBr + K+ + NO3 –
-
Ag+ + Br— = AgBr
-
K+ + 3NO — = KNO3
А 24. Кислую реакцию среды имеет водный раствор
-
Хлорида натрия
-
Хлорида калия
-
Хлорида кальция
-
Хлорида цинка
А 25. Хлор является и окислителем, и восстановителем в реакции с
-
Fe
-
H2
-
KOH
-
CH4
А 26. К 575 г 20%- ного раствора поваренной соли добавили 115 г воды. Рассчитайте массу воды в полученном растворе.
1) 575
2) 600
3) 300
4) 125
А 27 В соответствии с термохимическим уравнением реакции 2Cl2O7= 2Cl2+ 7O2 + 570кДж при разложении 36,6 г оксида хлора(VII) выделится теплота в количестве
-
570 кДж
-
5114кДж
-
11400кДж
-
57кДж
А 28. Какой объем бромоводорода (н.у.) необходимо ввести во взаимодействие с избытком раствора перманганата калия, чтобы масса выделившегося брома составила 8 г?
1) 2,24
2) 3,6
3) 22,4
4) 67,2
Часть 2
В 1. Установите соответствие между формулой вещества и его принадлежностью к определенному классу (группе) неорганических соединений
Химическая формула
|
Класс (группа) |
|
|
А) HClO3 |
1) Кислота |
|
Б) HBr |
2) Щелочь |
|
В) AlI3 |
3) Средняя соль |
|
Г) [Ag(NH3)2]Cl |
4) Кислая соль |
|
5)Комплексная соль |
|
|
6)Двойная соль |
В 2. Установите соответствие между схемой химической реакции и изменением степени окисления окислителя
Схема реакции
|
Изменение степени окисления |
|
|
А) Cl2 + H2O → HCl + HClO |
1) Cl0 →Cl-1 |
|
Б) Cl2 + KOH → KClO3 + KCl + H2O |
2) Cl0→ Cl+1 |
|
В) HClO → HCl + HClO3 |
3) Cl+5→ Cl-1 |
|
Г) KClO3 → KCl + O2 |
4) Cl+1 → Cl-1 |
|
5)Cl +5 → Cl0 |
|
|
6)O-2 → O0 |
В 3. Установите между формулой соли и продуктами электролиза ее водного раствора на инертных электродах
Формула соли
|
Продукты электролиза |
|
|
А) CuBr2 |
1) металл, галоген |
|
Б) CaCl2 |
2) гидроксид металла, водород, галоген |
|
В) FeCl2 |
3) металл, кислород |
|
Г) NaF |
4)металл, водород, галоген |
|
5)водород, кислород |
|
|
6)металл, кислота, кислород |
В 4. Установите соответствие между формулой соли и типом ее гидролиза
Формула соли
|
Тип гидролиза |
|
|
А) FeCl2 |
1) по катиону |
|
Б) KF |
2) по аниону |
|
В) NH4Cl |
3) по катиону и аниону |
|
Г) NaI |
4) гидролиз не происходит |
В 5. Установите соответствие между исходными веществами и продуктами реакции
Исходные вещества
|
Продукты реакции |
|
|
А) Fe + Cl2→ |
1) FeCl2 |
|
Б) Fe + HCl→ |
2) FeCl3 |
|
В) FeO + HCl→ |
3) FeCl2 + H2 |
|
Г) Fe2O3 + HCl→ |
4) FeCl3 + H2 |
|
5)FeCl2 + H2O |
|
|
6)FeCl3 + H2O |
В 6. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции
Вещества
|
Признаки реакции |
|
|
А) HCl + Na2CO3 Б) HCl + AgNO3 В) KI + AgNO3 Г) HCl + Ca(NO3)2 |
1) выделение бесцветного газа 2) видимых признаков не наблюдается 3) образования белого осадка 4) образование черного осадка 5) образование желтого осадка |
В 7. Как с хлором, так и с хлороводородом реагируют
-
Пропен
-
Ацетилен
-
3- хлопропин
-
Бензол
-
Метилбензол
-
2- метилбутан
В 8. Бромоводород может реагировать с
-
Фенолом
-
Этанолом
-
Этаналем
-
Этиленгликолем
-
Стеариновой кислотой
-
Глицерином
В 9. Анилин взаимодействует с
-
Гидроксидом калия
-
Бромом
-
Толуолом
-
Соляной кислотой
-
Бромоводородом
-
Метаном
Часть 3
С 1. Используя метод электронного баланса, составьте уравнение реакции:
K2Cr2O7 + HCl → Cl2 + KCl +… + …
Определите окислитель и восстановитель.
С 2. Вещество, полученное на аноде при электролизе расплава йодида натрия с инертными электродами, выделили и ввели во взаимодействие с сероводородом. Газообразный продукт последней реакции растворили в воде и к полученному раствору добавили хлорное железо. Образовавшийся осадок отфильтровали и обработали горячим раствором гидроксида натрия. Составьте уравнения четырех описанных реакций.
С 3. Напишите уравнения, с помощью которых можно осуществить следующие превращения:
Cl2, свет Br2
гексан → бензол → этилбензол → Х1 → винилбензол → Х2
С 4. Хлор, выделившийся при взаимодействии 43,5 г оксида марганца (IV) с 36%-ным раствором HCl объемом 250 мл и плотностью 1,18 г/мл, полностью поглощен горячим раствором гидроксида калия массой 900 г с массовой долей 28%. Определите массовую долю хлората калия в полученном растворе.
С 5. При взаимодействии одного и того же количества алкена с различными галогеноводородами образуется соответственно 7,85 г хлорпроизводного и 12,3 г бромпроизводного. Определите молекулярную формулу алкена.
Ответы
№
Вопроса
ЧастьА
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
|
|
ответ |
1 |
4 |
2 |
3 |
3 |
3 |
1 |
1 |
4 |
1 |
1 |
4 |
3 |
4 |
2 |
4 |
3 |
2 |
4 |
2 |
2 |
4 |
3 |
4 |
3 |
1 |
4 |
2 |
№
Вопроса
Часть В
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
|
cответ |
А Б В Г 1 1 3 5 |
А Б В Г 1 1 4 3 |
А Б В Г 1 2 4 5 |
А Б В Г 1 2 3 4 |
А Б В Г 2 3 5 6 |
А БВГ 1 3 5 2 |
1,2,3 |
2, 4, 6 |
2,4,5 |
С1. K2Cr2O7 +14 HCl = 3 Cl2 + 2 KCl + 2 CrCl3 + 7 H2O
C2
|
C3 |
|
|
C6H5-CH=CH2 + KCl + H2O
|
С 4. Массовая доля хлората калия равна 2,2%
С 5. Молекулярная формула алкена C3H6
Источники материала
-
Горбунцова С.В. Тесты и ЕГЭ по основным разделам школьного курса. – М.:Вако, 2006.
-
Доронькин В.Н., Бережная А.Г. и др. Химия. Подготовка к ЕГЭ. Тематические тесты базовый и повышенный уровни 10-11 классы. – Ростов-на Дону: «Легион», 2011
-
Доронькин В.Н., Бережная А.Г. и др. Химия. Тематические тесты для подготовки к ЕГЭ. Задания высокого уровня сложности.- Ростов-на Дону: «Легион», 2012
-
Солдатова Т.М. Уроки химии с применением информационных технологий.
Неметаллы. – М.: «Планета», 2011.
-
WWW. fipi. ru
Здесь представлены материалы теста на тему «Галогены и соединения галогенов в формате ЕГЭ», которые могут быть просмотрены в онлайн режиме или же их можно бесплатно скачать.
Предмет теста: Химия (все классы). Также здесь Вы найдете подборку тестов на схожие темы, что поможет в еще лучшей подготовке к тестированию.
1 вариант
1. Среди галогенов – простых веществ — твердым является
- фтор
- хлор
- бром
- иод.
2. О фторе нельзя сказать, что он
- самый активный;
- самый электроотрицательный;
- самый агрессивный;
- самый легкий элемент.
3. Наиболее ярко выражены восстановительные свойства у
- фтора
- хлора
- брома
- иода.
4. Из галогенов как отравляющее вещество в боевых действиях был применен впервые
- фтор
- хлор
- бром
- иод.
5. Степень окисления хлора в соединении Са (ОСl)2
- -1
- +1
- +3
- +5
6. Сила галогеноводородных кислот возрастает в ряду
- НСl, НВr, НI;
- НI, НВr, НСl;
- НВr, НI, НСl;
- НI, НСl, НВr.
7. При сливании растворов бромида калия и нитрата серебра образуется осадок
- белого цвета;
- желтоватого цвета;
- желтого цвета;
- оранжевого цвета.
8. Смешали два раствора, содержащие равные массы хлорида натрия и нитрата серебра по 20 г каждого. Масса выпавшего осадка равна
- 16,8 г
- 33,6 г
- 48,8 г
- 97,7 г
9. Фтор взаимодействует с водой по уравнению _____________________
10. Хлор взаимодействует с горячим раствором гидроксида калия по уравнению ____________________________________________________
2 вариант
1. Среди галогенов – простых веществ — жидким является
- фтор
- хлор
- бром
- иод.
2. Электронную формулу внешнего энергетического уровня, общую для всех атомов галогенов, можно записать в виде
- ns2np2
- ns2np3
- ns2np4
- ns2np5.
3. Наиболее ярко выражены окислительные свойства у
- фтора
- хлора
- брома
- иода.
4. С какими из перечисленных веществ хлор не взаимодействует?
- Водой;
- раствором хлорида натрия;
- раствором бромида натрия;
- раствором щелочи.
5. Наиболее сильной из кислот является
- НСlО
- НСlО2
- НСlО3
- НСlО4
6. Раствор фтора в воде получить нельзя, так как
- фтор не растворяется в воде;
- фтор разлагает воду; фтор частично растворяется в воде;
- фтор вытесняет из воды водород.
7. При сливании растворов иодида натрия и нитрата серебра образуется осадок
- белого цвета;
- желтоватого цвета;
- желтого цвета;
- оранжевого цвета.
8. В раствор, полученный при пропускании 11,2 л газообразного хлороводорода в 100 см3 воды, поместили 13 г цинка. Объем выделившегося газа равен (при н. у.)
- 22,4 л
- 11,2 л
- 5,6 л
- 4,48 л.
9. Хлор в лаборатории получают при взаимодействии соляной кислоты с оксидом марганца (IV) по уравнению ______________________________________
10. Хлор взаимодействует с холодным раствором гидроксида калия по уравнению ______________________________________________________________________________
Тема «Галогены»
(решения и ответы)
1 вариант
|
Вариант |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Ответ |
4 |
4 |
4 |
2 |
2 |
1 |
2 |
1 |
t
9. 2F2 + 2H2O = 4HF + O2 10. 3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
2 вариант
| Вариант | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Ответ | 3 | 4 | 1 | 2 | 4 | 2 | 3 | 4 |
9. 4HCl + MnO2 = MnCl2 + Cl2 + 2H2O 10. Cl2 + 2KOH = KCl + KClO + H2O
Вопросы 1–8 оцениваются 1 баллом, вопросы 9–10 – 2 баллами.
Максимальное количество баллов – 12.
Шкала перевода баллов в отметку:
10–12 баллов — «5», 7–9 баллов — «4», 4–6 баллов — «3».
Пройти тестирование по 10 заданиям
Пройти тестирование по всем заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Из предложенного перечня веществ выберите два вещества, с каждым из которых железо реагирует без нагревания.
1) хлорид цинка
2) сульфат меди(II)
3) концентрированная азотная кислота
4) разбавленная соляная кислота
5) оксид алюминия
Запишите в поле ответа номера выбранных веществ.
Источник: Демонстрационная версия ЕГЭ—2017 по химии
2
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует медь.
1) хлорид цинка (р-р)
2) сульфат натрия (р-р)
3) разбавленная азотная кислота
4) концентрированная серная кислота
5) оксид алюминия
Запишите в поле ответа номера выбранных веществ.
3
Из предложенного перечня растворов выберите два раствора, в которых протекает химическая реакция.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных растворов.
Источник: РЕШУ ЕГЭ, Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 1.
4
Из предложенного перечня веществ выберите два вещества, с каждым из которых йод не реагирует, в отличие от хлора.
1) алюминий
2) железо
3) бромид магния
4) бромид натрия
5) фторид натрия
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ, Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 2.
5
Из предложенного перечня выберите две пары веществ, которые взаимодействуют с водой при обычной температуре.
1) кислород и сера
2) фтор и калий
3) кремний и кальций
4) железо и медь
5) натрий и барий
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
Пройти тестирование по этим заданиям