Скачать материал

Скачать материал


- Сейчас обучается 430 человек из 67 регионов


- Сейчас обучается 30 человек из 23 регионов


- Сейчас обучается 40 человек из 30 регионов


Описание презентации по отдельным слайдам:
-
-
2 слайд
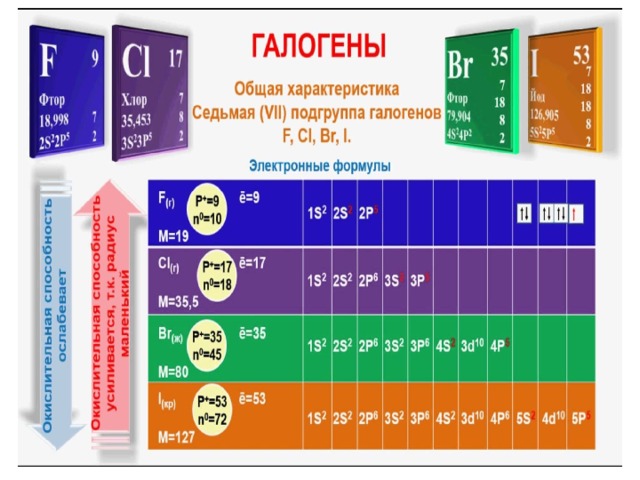
Химия элементов VII группы главной подгруппы
Фтор
В свободном состоянии фтор впервые получен французским химиком А. Муассаном в 1886 г.
Нахождение в природе. Из солей фтора наиболее распространен в природе флюорит (плавиковый шпат) СаF2. Фтор в виде фторида кальция входит также в состав апатита. 3Са3(РО4}2*СаF2 (или Са5(РО4)3F). -
3 слайд
Фтор
Физические свойства. В обычных условиях фтор представляет собой бесцветный, обладающий резким запахом газ, который в толстых слоях окрашен в зеленовато-желтый цвет. При 181,1С фтор переходит в жидкое состояние, а при 219,6 С затвердевает. Растворимость фтора не изучена, так как он разрушает почти все растворители. -
4 слайд
Фтор
На внешнем электронном слое атома фтора находится 7 электронов (s2р5). Так как этот слой расположен ближе к ядру, чем у атомов хлора, брома и иода, фтор сильнее всех галогенов притягивает электроны. Этим объясняется его исключительно высокая химическая активность.
Фтор не имеет d-уровня, поэтому не может иметь более одного неспаренного электрона и проявлять другие валентные состояния, кроме единицы -
5 слайд
Фтор
Получение. Свободный фтор из-за высокой реакционной способности выделить очень непросто. Получают его в небольших количествах электролизом расплава дифторида калия КF*НF в свинцовой аппаратуре (образовавшийся на внутренней поверхности стенок электролизера фторид свинца РbF2 предохраняет аппарат от разрушения). -
6 слайд
Фтороводород
Фтороводород — газ с резким запахом. При 19,9С он переходит в жидкое состояние, а при 83,1 С затвердевает. Жидкий фтороводород смешивается с водой в любых соотношениях, Раствор фтороводорода в воде называется фтороводородной или плавиковой кислотой.
плавиковая кислота относится к слабым кислотам.
В присутствии сильных кислот в ней растворяются многие редкие металлы, которые в других кислотах не растворяются (титан, цирконий, ниобий, тантал и др.). -
7 слайд
Фтороводород
Фтороводород и плавиковая кислота реагируют с диоксидом кремния с образованием летучего соединения SiF4:
SiO2 + 4 НF = SiF4 + 2 Н2О
Получают фтороводород действием концентрированной серной кислоты на плавиковый шпат СаF2:
СаF2 + Н2SO4 = СаSO4 + 2 НF
Кислородсодержащих кислот фтор не образует, хотя соединения фтора с кислородом известны -
8 слайд
Хлор
Хлор был открыт шведским химиком К. В. Шееле в 1774 г.
Нахождение в природе. Из-за высокой активности хлор в свободном состоянии в природе не встречается. Широко известны его природные соединения — хлориды щелочных и щелочноземельных металлов, наиболее распространенными из которых являются каменная (поваренная) соль NаС1, сильвинит — смесь хлоридов калия и натрия — и карналлит КС1*МgC12*6Н2О. Как примеси к названным минералам встречаются хлориды других металлов. Значительное количество хлоридов различиях металлов содержится в морской воде. -
9 слайд
Физические свойства
При обычных условиях хлор — газ желто-зеленого цвета с резким запахом, ядовит. Он в 2,5 раза тяжелее воздуха. В 1 объеме воды при 20С растворяется около 2 объемов хлора. Такой раствор называется хлорной водой. При атмосферном давлении хлор при 34С переходит в жидкое состояние, а при 101 С затвердевает. -
10 слайд
Химические свойства
На внешнем электронном уровне атома хлора находятся 7 электронов (s2p5), поэтому он легко присоединяет электрон, образуя анион Сl . Благодаря наличию незаполненного d-уровня в атоме хлора могут появляться 1, 3, 5 и 7 неспаренных электронов, поэтому в кислородсодержащих соединениях он может иметь степень окисления +1, +3, +5 и +7. -
11 слайд
Химические свойства
0н хорошо взаимодействует с металлами:
2 Fе + 3 С12 = 2 FеС13 (хлорид железа (III)
Cu + С12 = СuС12 (хлорид меди (II)Н2 + С12 = 2 НСl (хлороводород)
2 S + С12 = S2Cl2 (хлорид серы (1))
Si + 2 С12 = SiС14 (хлорид кремния.(IV))
2 Р + 5 С12 = 2 РС15 (хлорид фосфора (V))
При растворении хлора в воде образуется две кислоты: хлороводородная, или соляная, и хлорноватистая:
С12 + Н2О = НСl + НСlO -
12 слайд
Химические свойства
При взаимодействии хлора с холодными растворами щелочей образуются соответствующие соли этих кислот:
С12 + 2 NaOН = NaС1 + NaClО + Н2О
3 С12 + 6 NаОН = 5 NаСl + NаС1O3 + 3 Н2О
3 С12 + 6 КОН = 5 КСl + КС1O3 + 3 Н2О
2 FеС12 + С12 = 2 FеС13
Н2SO3 + С12 + Н2О = Н2SО4 + 2 НСl -
13 слайд
Получение
МпО2 + 4 НСl = МпС12 + С12 + 2 Н2О
2 КМпО4 + 16 НСl = 2 КС1 + 2 МnС12 + 5 С12 + 8 Н2О
КС1O3 + 6 НСl = КС1 + 3 С12 + 3 Н2О
При электролизе расплава хлорида щелочного металла на катоде выделяется щелочной металл, а на аноде — хлор:
2 Nа + 2е = 2 Nа
2 Сl 2е = Сl2 -
14 слайд
Хлороводород
NаСl + H2SО4 = NаНSO4 + НСl
2 NаСl + Н2SO4 = Nа2SO4 + 2 НСl
Н2 + Сl2 = 2 НС1
Раствор хлороводорода в воде называется соляной кислотой. Это сильная кислота, она реагирует со всеми металлами, стоящими в ряду напряжений левее водорода, с основными и амфотерными оксидами, основаниями и солями:
Fе + 2 НС1 = FеС12 + Н2 -
15 слайд
Хлороводород
СuО + 2 НСl = СuСl2 + Н2О
ZnO + 2 НСl = ZnС12 + Н2О
Fе(ОН)3 + 3 НСl = FеСl3 + 3 H2О
АgNО3 + НСl = АgCl + НNО3
Nа2СO3 + 2 НCl = 2 NаСl + Н2О + СО2 -
16 слайд
Кислородные соединения хлора
Хлор образует четыре кислородсодержащие кислоты: хлорнотистую, хлористую, хлорноватую и хлорную.
Хлорноватистая кислота НСlO
При сильном освещении :НСlO = HСl + O
2 НСlO = 2 Н2О + Сl2O
Cl2О можно считать ангидридом хлорноватистой кислотыПри нагревании хлорноватистая кислота разлагается с образованием двух кислот — соляной и хлорноватой : 3 НСlO = 2 НСl + НСlO3
-
17 слайд
Кислородные соединения хлора
Хлористая кислота НСlO2
Это слабая, неустойчивая кислота, очень сильный окислитель в кислой среде. При взаимодействии ее с соляной кислотой выделяется хлор:
НСlO2 + 3 НС1 = Сl2 + 2 Н2О
Хлорноватая кислота НСlO3 образуется при действии на ее соли —х л о р а т ы — серной кислоты. Это очень неустойчивая кислота, очень сильный окислитель. Может существовать только в разбавленных растворах. -
18 слайд
НСlO3 + 6 НВr = НСl + 3 Вr2 + 3 Н2О
КСlO3 + 6 НСl = КСl + 3 Сl2 + 3 Н2О
2 КСlО3 = 2 КСl + 3 O2
4 КСlO3 = КСl + 3 КСlO4
При обработке перхлоратов концентрированной серной кислотой можно получить хлорную кислоту:
КСlO4 + Н2SO4 = КНSO4 + НСlO4
Это самая сильная кислота. Она наиболее устойчива из всех кислород содержащих кислот хлора, однако безводная кислота при нагревании, встряхивании или контакте с восстановителями может разлагаться со взрывом. -
19 слайд
Бром
Бром был открыт в 1826 г. французским химиком А. Ж. Баларом.
Нахождение в природе. В свободном состоянии бром в природе не встречается. Он не образует также самостоятельных минералов, а его соединения (в большинстве случаев со щелочными металлами) являются примесями хлорсодержащих минералов, таких, как каменная соль, сильвинит и карналит. -
20 слайд
Бром. Физические свойства
Бром — легколетучая красно-бурая жидкость с неприятным, удушливым запахом. Кипит при 58,8С и затвердевает при 7,3 С. В 1 л воды при 20 С растворяется 35 г брома. -
21 слайд
Бром. Химические свойства
По химическим свойствам бром напоминает хлор. На внешнем электронном уровне его атома находится 7 электронов (s2p5), поэтому он легко присоединяет электрон, образуя ион Br. Благодаря наличию незаполненного d-уровня бром может иметь 1, 3, 5 и 7 неспаренных электронов и в кислородсодержащих соединениях проявляет степень окисления +1, +3, +5 и +7. -
22 слайд
Бром. Химические свойства
Подобно хлору бром взаимодействует с металлами и неметаллами:
2 Al + 3 Вr2 = 2 AlBr3 (бромид алюминия)
Н2 + Вr2 = 2 НВr (бромоводород)
2 Р + 3 Br2 = 2 РВr3 (бромид фосфора (III))
Вr2 + Н2О НВr + НВrО
Вr2 + 2 NаОН = NaBr + NаВrО + Н2О
С6Н6 + Вr2 = С6H5Br + НВr
Н2SO3 + Вr2 + Н2О = Н2SО4 + 2 НВr
Н2S + Вr2 = 2 НBr + S -
23 слайд
Получение
В лабораторных условиях бром получают действием на различные окислители бромоводородной кислоты или ее солей в сернокислотной среде:
2 КМnO4 + 16 НВr = 2 КВr + 2 МnВr2 + 5 Вr2 + 8 Н2О
КСlO3 + 6 НВr = КСl + 3 Вr2 + 3 Н2O
2 КМnO4 + 10 КBr + 8 Н2SO4 = 6 К2SО4 + 2 МnSO4 + 5 Вr2 + 8 Н2О
В промышленности бром получают действием хлора на различные бромиды:
2 КВr + Сl2 = 2 КСl + Вr2 -
24 слайд
Бром. Химические свойства
Свободный от брома бромоводород получают взаимодействием трибромида фосфора с водой:
РВr3 + 3 Н2О = Н3РО3 + 3 НВr -
25 слайд
Бром. Химические свойства
Кислородные соединения брома аналогичны кислородным соединениям хлора, но кислоты являются более слабыми электролитами и более слабыми окислителями. Кроме бромата калия КВrО3, который применяется в аналитической химии и лабораторной практике, они практического значения не имеют. -
26 слайд
Иод
Иод был открыт французским химиком-селитроваром Б. Куртуа в 1811 г.
Нахождение в природе. Соединения иода самостоятельных залежей не образуют, а встречаются в виде примесей к минералам хлора. Соли иода содержится в водах буровых скважин. Заметные количества иода входят в состав некоторых морских водорослей, вола которых может быть использована как сырье для получения этого элемента. -
27 слайд
Физические свойства
Иод представляет собой твердое темно-серое кристаллическое вещество со слабым металлическим блеском. При медленном нагревании он легко возгоняется, образуя фиолетовые пары. При быстром нагревании иод при 114С плавится, а при 183 С кипит. Он хорошо растворим в органических растворителях и водном растворе КI. -
28 слайд
Химические свойства
По химическим свойствам иод похож на хлор и бром, однако менее активен. С водородом он реагирует только при нагревании, причем реакция протекает не до конца:
I2 + Н2 = 2 НI (иодовород)
При нагревании иод взаимодействует c фосфором:
2 Р+ 3I2 = 2 РI3 (иодид фосфора (III)) -
29 слайд
Химические свойства
В присутствии воды, играющей роль катализатора, иод интенсивно, почти со взрывом, реагирует с алюминием:
2 Аl + 3I2 = 2 АlI3 (иодид алюминия)
С водой иод почти не реагирует, а со щелочью реагирует аналогично хлору и брому:
I2 + 2 КОН = КI + КIO3 + Н2О
3I2 + 6 КОН = 5 КI + КIO3 + 3 Н2О -
30 слайд
Химические свойства
Иод обладает окислительными cвойcтвами, которые проявляет в присутствии сильных воccтанователей. Он легко взаимодействует c сернистой кислотой и сероводородом:
Н2SO3 + I2 + Н2О = Н2SО4 + 2 НI
Н2S + I2 = 2 НI + S -
31 слайд
Получение
2 КМnО4 + 16 НI = 2 КI + 2 MnI2 + 5I2 + 8 Н2О
КВrО3 + 6 НI = КВr + 5 I2 + 3 Н2О
2 FеC3 + 2 НI = 2 FeCl2 + I2 + 2 НСl
2 СuSO4 + 4 НI = 2 СuI + 2 Н2SO4 + I2
В промышленности иод получают действием хлора на иодиды:
2 КI + СI2 = 2 КCl + I2 -
32 слайд
Иодоводород
Иодоводород — это бесцветный, с резким запахом газ, который при 35,4С превращается в жидкость, а при 50,8 С затвердевает. В 1 л воды растворяется около 500 л иодоводорода, образуя иодоводородную кислоту. Среди бескислородных кислот это наиболее сильная кислота. Она значительно сильнее соляной и даже бромоводородной кислот. -
33 слайд
Иодоводород
Иодоводородная кислота — очень сильный восстановитель, поэтому окисляется даже кислородом воздуха, вследствие чего раствор ее окрашивается в бурый цвет:
4 НI + O2 = 2 Н2О + 2 I2РI3 + 3 Н2О = Н3РО3 + 3 HI
2 КI + 2 Н2SO4 = К2SО4 + SO2 + I2 + 2 Н2О
8 КI + 4 Н2SO4 = 3 К2SO4 + К2S + 4I2 + 4 Н2О
Кислородные соединения иода аналогичны кислородным соединениям брома. Слабые кислоты НIO, НIO3 и НIO4 являются также слабыми окислителями. Они находят применение только в лабораторной практике.
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
6 153 421 материал в базе
- Выберите категорию:
-
Выберите учебник и тему
- Выберите класс:
-
Тип материала:
-
Все материалы
-
Статьи
-
Научные работы
-
Видеоуроки
-
Презентации
-
Конспекты
-
Тесты
-
Рабочие программы
-
Другие методич. материалы
-
Найти материалы
Материал подходит для УМК
Другие материалы





Тема урока: «Решение комбинированных задач».
- Учебник: «Химия. Профильный уровень», Габриелян О.С., Лысова Г.Г.
- Тема: Практическая работа № 6. Решение экспериментальных задач по неорганической химии
Рейтинг:
5 из 5
- 17.10.2019
- 593
- 11



Вам будут интересны эти курсы:
-
Курс повышения квалификации «Химия окружающей среды»
-
Курс профессиональной переподготовки «Химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Нанотехнологии и наноматериалы в биологии. Нанобиотехнологическая продукция»
-
Курс повышения квалификации «Организация практики студентов в соответствии с требованиями ФГОС педагогических направлений подготовки»
-
Курс повышения квалификации «Организация практики студентов в соответствии с требованиями ФГОС медицинских направлений подготовки»
-
Курс повышения квалификации «Особенности подготовки к сдаче ОГЭ по химии в условиях реализации ФГОС ООО»
-
Курс профессиональной переподготовки «Биология и химия: теория и методика преподавания в образовательной организации»
-
Курс профессиональной переподготовки «Организация деятельности секретаря руководителя со знанием английского языка»
-
Курс повышения квалификации «Современные образовательные технологии в преподавании химии с учетом ФГОС»
-
Курс повышения квалификации «Мировая экономика и международные экономические отношения»
-
Курс профессиональной переподготовки «Риск-менеджмент организации: организация эффективной работы системы управления рисками»
-
Курс профессиональной переподготовки «Техническое сопровождение технологических процессов переработки нефти и газа»
-
Курс профессиональной переподготовки «Организация системы учета и мониторинга обращения с отходами производства и потребления»
-
Курс профессиональной переподготовки «Информационная поддержка бизнес-процессов в организации»
Слайд 1
Государственное бюджетное профессиональное образовательное учреждение Департамента здравоохранения города Москвы “Медицинский колледж №5” (ГБПОУ ДЗМ “МК №5”ОП1) Презентация на тему: «Галогены» Вид занятия: лекция дисциплина ОУДп.02. ХИМИЯ Специальность34.02.01 Сестринское дело (базовая подготовка) Преподаватель Субботина Е.В. Москва 2020
Слайд 2
Изучив эту тему, Вы будете Знать: 1.Строение атомов элементов подгруппы кислорода 2.Физические свойства галогенов 3.Химические свойства элемен галогенов 4.Способы получения галогенов 5.Круговорот углерода в природе Уметь: 1.соотносить строение веществ, их свойства и применение на примере наиболее часто используемых элементов. 2.использовать химические знания в повседневной жизни. 3 решать практические задачи по теме
Слайд 3
Содержание учебного занятия 1 .Физические свойства галогенов 3 .Химические свойства галогенов 4 .Способы получения галогенок 5 .Применение галогенов
Слайд 4
Физические свойства Такие простые химические вещества, как галогены, состоят из двух атомов; Если рассматривать галогены в обычных условиях, то следует знать, что фтор и хлор, находятся в газообразном состоянии, тогда как бром является жидким веществом, а йод и астат относятся к твердым веществам.
Слайд 5
У галогенов температура плавления, кипения и плотность повышаются с увеличением атомной массы. Также при этом и меняется их окраска, она становиться более темной. При каждом увеличении порядкового номера, уменьшается химическая активность, электроотрицательность и более слабыми становятся неметаллические свойства. Галогены обладают способностью образовывать соединения между собой, как например BrCl. Так же важно запомнить то, что галогены относятся к довольно таки токсичным химическим веществам.
Слайд 6
Химические свойства хлора Взаимодействие хлора с простыми веществами ( Cl выступает в роли сильного окислителя): с водородом (реакция протекает только при наличии света):Cl 2 +H 2 = 2HCl с металлами с образованием хлоридов:Cl 2 0 +2Na 0 = 2Na +1 Cl -1 3Cl 2 0 +2Fe 0 = 2Fe +3 Cl 3 -1 с неметаллами, менее электроотрицательными, чем хлор:Cl 2 0 +S 0 = S 3Cl 2 0 +2P 0 = 2P +3 Cl 3 -1 с азотом и кислородом хлор не реагирует непосредственно.
Слайд 7
Взаимодействие хлора со сложными веществами : Одной из самых известных реакций хлора со сложными веществами есть взаимодействие хлора с водой. Она протекает в два этапа: На первом этапе происходит образование двух кислот: соляной и хлорноватистой:Cl 2 0 +H 2 O ↔ HCl -1 +HCl +1 O На втором этапе хлорноватистая кислота разлагается с выделением атомарного кислорода, который окисляет воду (убивая микроорганизмы) + подвергает отбеливающему действию ткани, окрашенные органическими красителями, если их опустить в хлорную воду:HClO = HCl+[O] — реакция идет на свету
Слайд 8
С кислотами хлор не взаимодействует. Взаимодействие хлора с основаниями : на холоде:Cl 2 0 +2NaOH = NaCl -1 +NaCl +1 O+H 2 O при нагревании:3Cl 2 0 +6KOH = 5KCl -1 +KCl +5 O 3 +3H 2 O с бромидами металлов:Cl 3 +2KBr = 2KCl+Br 2 ↓ с йодидами металлов:Cl 2 +2KI = 2KCl+I 2 ↓ с фторидами металлов хлор не реагирует, по причине их более высокой окислительной способности, нежели у хлора. Хлор «охотно» вступает в реакции с органическими веществами: Cl 2 +CH 4 → CH 3 Cl+HCl Cl 2 +C 6 H 6 → C 6 H 5 Cl+HCl
Слайд 9
Способы получения галогенов Хлор: В лаборатории хлор получают действием концентрированной HCl на различные окислители при нагревании. В роли окислителей могут выступать оксид марганца, перманганат калия, бертолетова соль: 4HCl -1 +Mn +4 O 2 = Mn +2 Cl 2 +Cl 2 0 ↑+2H 2 O 2KMn +7 O 4 +16HCl -1 = 2KCl+2Mn +2 Cl 2 +5Cl 2 0 ↑+8H 2 O .
Слайд 10
Бром: Все промышленные способы получения брома из соляных растворов основаны на его вытеснении хлором из бромидов: MgBr 2 + Cl 2 = MgCl 2 + Br 2 Йод: Йод может быть получен аналогично хлору окислением HI различными окислителями. В промышленности его обычно получают из иодидов, действуя на их растворы хлором. Таким образом, получение иода основано на окислении его ионов, причем в качестве окислителя применяется хлор.
Слайд 11
Фтор: 2K 2 MnF 6 + 4SbF 5 → 4KSbF 6 + 2MnF 3 + F 2 ↑ Астат: Получают облучением металлических висмута или тория α-частицами высокой энергии с последующим отделением астата соосаждением , экстракцией, хроматографией или дистилляцией.
Слайд 12
Применение галогенов Фтор: Широко применяют как фторирующий агент при получении различных фторидов (SF 6 , BF 3 , WF 6 и других), в том числе и соединений инертных газов ксенона ( Xe ) и криптона ( Kr ). Гексафторид урана UF 6 применяется для разделения изотопов урана (U). Фтор используют в производстве тефлона , других фторопластов, фторкаучуков, фторсодержащих органических веществ и материалов, которые широко применяют в технике, особенно в тех случаях, когда требуется устойчивость к агрессивным средам, высокой температуре и т. п.
Слайд 13
Хлор: Применяют в производстве хлорсодержащих органических соединений (60-75%), неорганических веществ (10-20%), для отбелки целлюлозы и тканей (5-15%), для санитарных нужд и обеззараживания (хлорирования) воды
Слайд 14
Бром: Бром применяют при получении ряда неорганических и органических веществ, в аналитической химии. Соединения брома используют в качестве топливных добавок, пестицидов, ингибиторов горения, а также в фотографии. Широко известны содержащие бром лекарственные препараты. Следует отметить, что расхожее выражение: “врач прописал бром по столовой ложке после еды” означает, разумеется, лишь то, что прописан водный раствор бромида натрия (или калия), а не чистый бром. Успокаивающее действие бромистых препаратов основано на их способности усиливать процессы торможения в центральной нервной системе.
Слайд 15
Йод: Йод применяют для получения высокочистого титана ( Ti ), циркония ( Zr ), гафния ( Hf ), ниобия ( Nb ) и других металлов (так называемое иодидное рафинирование металлов). При иодидном рафинировании исходный металл с примесями переводят в форму летучих иодидов, а затем полученные иодиды разлагают на раскаленной тонкой нити. Нить изготовлена из заранее очищенного металла, который подвергают рафинированию. Ее температуру подбирают такой, чтобы на нити могло происходить разложение только иодида очищаемого металла, а остальные иодиды оставались в паровой фазе. Используют иод и в иодных лампах накаливания, имеющих вольфрамовую спираль и характеризующихся большим сроком службы. Как правило, в таких лампах пары иода находятся в среде тяжелого инертного газа ксенона ( Xe ) (лампы часто называют ксеноновыми) и реагируют с атомами вольфрама (W), испаряющимися с нагретой спирали. Образуется летучий в этих условиях иодид, который рано или поздно оказывается вновь вблизи спирали. Происходит немедленное разложение иодида, и освободившийся вольфрам (W) вновь оказывается на спирали. Иод применяют также в пищевых добавках, красителях, катализаторах, в фотографии, в аналитической химии.
Слайд 16
Используют иод и в иодных лампах накаливания, имеющих вольфрамовую спираль и характеризующихся большим сроком службы. Как правило, в таких лампах пары иода находятся в среде тяжелого инертного газа ксенона (Xe) (лампы часто называют ксеноновыми) и реагируют с атомами вольфрама (W), испаряющимися с нагретой спирали. Образуется летучий в этих условиях иодид, который рано или поздно оказывается вновь вблизи спирали. Происходит немедленное разложение иодида, и освободившийся вольфрам (W) вновь оказывается на спирали. Иод применяют также в пищевых добавках, красителях, катализаторах, в фотографии, в аналитической химии.
Слайд 17
тест
Слайд 18
1,К каким электронным семействам относят элементы-неметаллы? p- элементам s- элементам d- элементам 2.Какой химический элемент-неметалл является биогенным? гелий углерод кремний 3.В оксидах неметаллов связь между атомами: ковалентная неполярная ковалентная полярная ионная
Слайд 19
4.Самый тугоплавкий оксид неметалла: оксид фосфора(5) оксид кремния(4) оксид магния 5.Как изменяется интенсивность окраски галогенов с возрастанием заряда ядра? фтор-светло-зеленый,хлор-желто-зеленый, бром-красно-бурый бром-светло-зеленый,фтор-желто-зеленый, хлор-красно-бурый хлор-желто-зеленый, бром-светло-зеленый, фтор-желто-красный 6. Вода это: оксид кислота основание
Слайд 20
7.Фосфор имеет следующие аллотропные видоизменения: белый, красный, зеленый, черный белый, красный, фиолетовый, зеленый белый, красный, фиолетовый, черный 8. В санитарно-гигиенических исследованиях для обнаружения в воздухе сероводорода пользуются реакцией с: раствором щелочи раствором соляной кислотой растворимыми солями свинца 9. Какой объем займут 20 кг хлора при нормальных условиях: 6,3 6,5 5,6
Слайд 21
10.Какие массы соли и воды требуются для приготовления 500 г 3% -ного раствора. 20, 485 485, 15 15, 485
Слайд 22
рефлексия что понравилось на уроке? что было непонятно? что было сложным? Сегодня я узнал… Сегодня я понял Сегодня я научился Сегодня я смог Сегодня меня удивило
Слайд 23
Домашнее задание Изучить конспект по теме занятия.
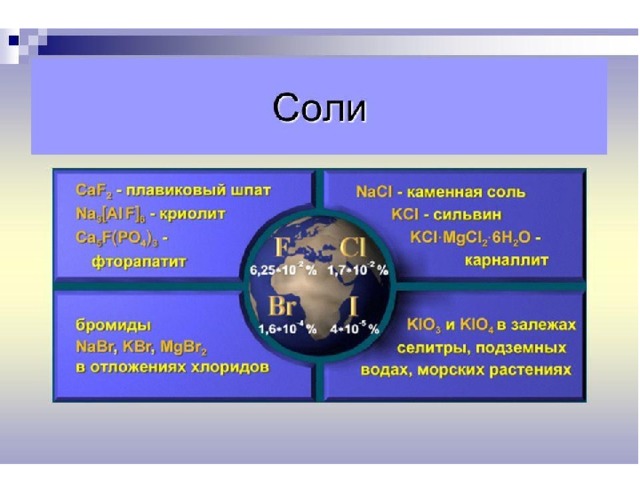
1. Галогены VII группа
«Рождающие соли»
2. Строение атома галогена
Хлорная вода
Бромная вода
3. Характеристика элементов
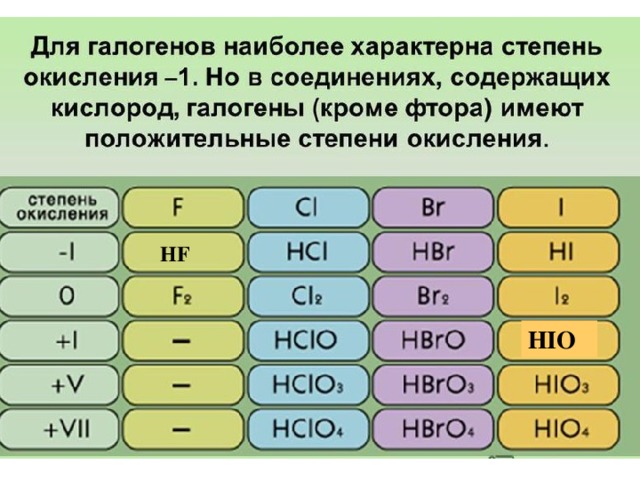
• Галогены являются очень сильными окислителями.
• Фтор в химических реакциях проявляет только окислительные
свойства, и для него характерна степень окисления
-1 в соединениях.
• Все остальные галогены могут проявлять ещё и
восстановительные свойства при взаимодействии с более
электроотрицательными элементами, такими как кислород, азот,
принимая значения степени окисления +1, +3, +5
или +7.
4. Простые вещества – галогены
Простые вещества состоят их
двух атомов!
С ростом молекулярной массы,
увеличиваются Ткип, Тпл: F2 и
Cl2– газы, Br2 – жидкость, I2 –
твердое вещество.
Астатин
5. Открытие галогенов
Французский химик. Впервые
получил фтор в свободном виде в
1886 г., за что был удостоен
Нобелевской премии. Название
фторос, что в переводе с греческого
значит «разрушающий», было дано
из-за большой токсичности фтора.
Анри Муассан
1852–1907 гг.
Шведский химик. Открыл хлор
в 1774 г. Такое название хлор
получил благодаря цвету простого
вещества, в переводе с греческого
хлорос значит «жёлто-зелёный».
Карл Шееле
1852–1907 гг.
6. Открытие галогенов
Французский химик. Открыл бром
в 1826 г. В переводе с греческого
бромос значит «зловонный», что
в действительности соответствует
невыносимому запаху простого
вещества брома.
Антуан Баларом
1802–1876 гг.
Французский учёный. В 1811 г.
получил йод. Своё название йод
получил за свою фиолетовую
окраску (в переводе с греческого
«иодэс» означает фиолетовый).
Бернар Куртуа
1777–1838 гг.
7. Diapositivo 7
Характеристика простых веществ
Вещество
Агрегатное
состояние
при
обычных
условиях
Цвет
Фтор
F2
Газ, не
сжижается
при обычной
температуре
Запах
Температу
ра
плавления
˚С
Температу
ра кипения
˚С
Светложёлтый
Резкий,
раздражающ
ий
-220
-188
Хлор
Cl2
Газ,
сжижающийс
я при
обычной
температуре
Жёлтозелёный
Резкий,
удушливый
-101
-34
Бром
Br2
Жидкость
Буроватокоричневый
Резкий,
зловонный
-7
+58
Твёрдое
вещество
Чёрнофиолетовый
с
металлическ
им отблеском
Резкий
+113,5
+186
Иод
I2
8. Diapositivo 8
Химические свойства простых веществ
Н2 + F2 = 2HF
H2 + Cl2 =2HCl
H2 + Br2 = 2HBr
H2 + I2 =2HI
Галогеноводороды — бесцветные газы, с резким запахом, токсичны.
Растворы этих газов – сильные кислоты, кроме HF. Степень диссоциации,
а, следовательно, и сила кислот, увеличиваются от плавиковой к
йодоводородной.
9. Diapositivo 9
Химические свойства галогенов
Химические свойства простых веществ
Взаимодействие галогенов с металлами и неметаллами:
2Ag + F2 = 2AgF
2Fe + 3Cl2 = 2FeCl3
Cu + Br2 = CuBr2
2Al +3I2 = 2AlI3
P + Br2 = PBr5
10. Diapositivo 10
Химические свойства простых веществ
Взаимодействие галогенов со сложными веществами:
Cl2 + 2NaBr = 2NaCl + Br2
Cl2 + 2KI = 2KCl + I2
2F2 + 2H2O = 4HF + O2
Вода горит в атмосфере фтора. С бромом и йодом не взаимодействует,
но медлянно взаимодействует с хлором. Если опустить в сосуд с
хлорной водой лакмусовую бумажку, она медлянно покраснеет, а
затем обесцветится. Хлор – разрушает красители.
Под действием света хлорноватистая кислота разлагается.
Таким образом, на свету суммарная реакция необратима.
11. Diapositivo 11
Химические свойства простых веществ
Взаимодействие галогенов со сложными веществами:
12. Diapositivo 12
Химические свойства простых веществ
Взаимодействие галогенов со сложными веществами:
13. Получение галогенов
CaF2 → Ca + F2↑
2NaCl → 2Na + Cl2↑
NaCl + H2O → Cl2↑ + H2↑ + NaOH
MnO2 + HCl = MnCl2 + Cl2↑ + 2H2O
2KBr + Cl2 = 2KCl + Br2
2NaI + Cl2 = 2NaCl + I2
Ввиду того, что галогены
из-за высокой
реакционной
способности в природе
не встречаются в
свободном состоянии,
их получают из их
соединений.
14. Diapositivo 14
Применение брома и фтора
2AgBr = 2Ag + Br2↑
Бром имеет важное значение для
организма человека. Его соединения
регулируют
процессы возбуждения и торможения
центральной нервной системы.
Бромид серебра используется для
примения чб пленки.
15. Diapositivo 15
Применение хлора
В организм хлор
поступает в основном
в виде хлорида
натрия (поваренной
соли). Хлорид натрия
обеспечивает
нормальный обмен
веществ, рост волос.
В организме
взрослого человека
содержится около
200 грамм хлорида
натрия, причём
45 грамм растворено
в крови.
16. Diapositivo 16
Применение йода
Спиртовой раствор йода широко
применяют в медицине для дезинфекции.
Пятна йода легко смываются содой или
спиртом.
Недостаток йода в организме может
привести к заболеваниям щитовидной
железы.
Йод окрашивает крахмал в синий цвет. Это
его качественная реакция.
17. Diapositivo 17
Галогеноводороды. Нахождение в природе.
• Самыми распространёнными среди галогенов
являются хлор,
который составляет 0,19% от массы земной коры, и
фтор — 0,03%.
• Ввиду большой реакционной способности
галогенов, в природе встречаются они только ввиде
соединений.
• Хлор чаще всего встречается в виде соединений в
составе минералов:
галита (каменная или поваренная соль), сильвина,
сильвинита и карналлита.
• Природные минералы фтора — флюорит
(плавиковый шпат), криолит, фторопатит и др.
• Соединения брома и
йода по большей части
концентрируются
в морских и подземных
водах, накапливаются в
морских водорослях.
18. Diapositivo 18
Галогеноводородные кислоты.
Качественные реакции.
• При взаимодействии хлоридов (и самой соляной
кислоты)
с нитратом серебра образуется белый творожистый
осадок хлорида серебра.
• При взаимодействии бромоводородной кислоты и
её солями и йодоводородной кислоты и её солями с
нитратом серебра также образуются осадки, но
только жёлтого цвета, которые различаются
оттенками.
• Для определения ионов фтора чаще всего
используют растворимые соли кальция, в
результате реакции образуется нерастворимое
вещество фторид кальция:
Ca2+ + 2F- = CaF2↓
• Взаимодействие фтороводородной кислоты с
оксидом кремния:
SiO2+4HF = SiF4↑ + 2H2O
Ag+ + Cl- = AgCl↓
Ag+ + Br- = AgBr↓
19. Diapositivo 19
Получение хлороводорода
Хлороводород. Получение
В промышленности:
H2 + Cl2 = 2HCl
20. Diapositivo 20
Хлороводород. Получение
В лаборатории:
NaCl + H2SO4 = NaHSO4 + HCl
В лаборатории используют концентрированную серную кислоту и
твердую поваренную соль.
При слабом нагревании процесс останавливается на стадии
образовании кислой соли – гидросульфата натрия.
Рекомендовано использовать 70% серную кислоту, иначе она
начнет пенится.
21. Diapositivo 21
Раствор хлороводода – кислота.
Соляная кислота — это бесцветная
жидкость, которая дымится на воздухе.
Соляная кислота тяжелее воды.
Процесс переваривания пищи
невозможен без содержания в желудке
0,2% соляной кислоты.
В 1л воды растворяется около 450 л HCl
Если закрыть пробкой с трубкой склянку
и перевернуть ее, а трубку опустить в
воду. То, как только попадут первые
капли воды, они поглотят весь газ HCl.
В склянке образуется разряжение и
вода с силой врывается внутрь и бьет
фонтаном. Если добавить лакмус в воду,
фонтан будет красным.
Самая большая концентрация
соляной кислоты – 40 %. Дальше,
она теряет хлороводород и
дымится.
22. Diapositivo 22
Химические свойства соляной кислоты
Химические свойства соляной кислоты .
Взаимодействие с металлами:
6HCl + 2Al = 2AlCl3 + 3H2↑
Взаимодействие с основными оксидами:
2HCl + CaO = CaCl2 + H2O
Взаимодействие с основаниями:
HCl + NaOH = NaCl + H2O
Взаимодействие с солями:
2HCl + K2CO3 = 2KCl + H2O + CO2↑
Цель урока (любого занятия) с
использованием презентации “Галогены”:
Развивать познавательный интерес на основе
межпредметных связей с формированием
метапредметных знаний, умений, навыков.
Задачи:
познавательные: сформировать представления
о галогенах, их физических и химических
свойствах и областях применения; акцентировать
внимание учащихся о возможностях интеграции
знаний из курсов химии, физики, истории,
литературы, географии; продолжить формирование
умения работать с дополнительной литературой;
развивающие: развивать умения выделять
главное, существенное, сравнивать, обобщать,
находить практическое применение своим знаниям;
способствовать развитию эмоциональных качеств
личности, формированию коммуникативных и
рефлексивно-оценочных умений;
воспитывающие: формировать потребности в
познавательной деятельности и ценностное
отношение к знаниям.
Работа с презентацией
Презентация «Галогены» может быть
использована учителем химии в учебном процессе в
качестве учебного электронного тематического
пособия:
- на уроках химии при объяснении нового и
закреплении пройденного материала по теме
«Химия простых веществ. Галогены»; - во внеклассной работе — на факультативных
занятиях и кружках; - при индивидуальных занятиях с учащимися;
- при подготовке учащихся к практическим работам
по получению, собиранию и обнаружению различных
веществ.
Так, например, объяснение нового материала на
уроке «Галогены» можно провести на основе
беседы с учащимися. Учитель может построить ее на
повторяющемся вопросе — что вам известно о:?
И далее следуют наводящие вопросы учителя
(подготовленные заранее, в зависимости от
специфики класса следует подбирать вопросы с
различной дифференциацией). Учитель, по своему
усмотрению, может перефразировать вопросы,
изменить их последовательность, сократить их
общий объем. Ответы учащихся учитель дополняет
своим рассказом и показом соответствующих
слайдов. Объяснение нового материала можно
провести и по другой схеме: показ слайда
(слайдов), затем рассказ учителя с элементами
беседы; либо — сначала рассказ учителя, затем
показ слайда (слайдов) и беседа с учащимися (если
она уместна).
Учитель может приостановить презентацию для
показа демонстрационных опытов, либо
видеоопытов, работы с электронной доской, а затем
возобновить работу с ней.
Для большей заинтересованности учащихся в
получении знаний по теме и активизации их на
уроке учитель предлагает им выполнить заранее
домашнее задание творческого характера. Задание
в виде вопросов, кроссвордов предлагается всему
классу, либо оно распределяется по группам
класса. Учащиеся должны подготовить ответы на
вопросы.
Вопросы, например, такие:
1. Кто и как открыл йод? В какое историческое
время это было?
2. Как распознать бесцветные растворы
галогенидов?
3. Что интересного вам известно о хлоре и йоде?
Где применяются эти два вещества?
Повторение пройденного материала по теме
«Химия простых веществ. Галогены» учитель
может провести также на основе презентации. Если
возникают затруднения при ответах учащихся, то
есть возможность вернуться к рассмотрению
данного вопроса на основе соответствующего
слайда. Наличие гиперссылок облегчат поиск
нужного слайда.
Использовать презентацию «Галогены» могут
и учащиеся при дистанционном обучении, при
выполнении домашних заданий, подготовке к
контрольным и практическим работам,
самопроверке своих знаний по теме, т.е. с помощью
данной презентации можно повысить
самостоятельный поиск знаний учащимися, что
особенно актуально при переходе школ на ФГОС
второго поколения.
В приложении собран материал, который позволит
подготовиться к итоговой аттестации в формате
ГИА и ЕГЭ. В случае затруднений всегда можно
вернуться к презентации.
Наличие такого электронного пособия, как
презентация «Галогены» в кабинете химии,
дает возможность учителю сократить время на
подготовку к уроку, повысить заинтересованность
учащихся в изучении темы, повысить уровень
обученности и качества знаний учащихся.
Приложение 1
Приложение 2
Положение галогенов в ПСХЭ
Группы элементов
Пери –
оды
VIII
VII
VI
V
IV
III
II
I
Н
Не
2
1
1
Галогены
1,00797
4.0026
Гелий
Водород
N
Ве
О
F
Nе
С
Li
В
6
3
9
5
7
8
4
10
2
15,9994
18,9984
12,01115
10,811
20,183
14,0067
9,0122
6.939
Неон
Фтор
Литий
Углерод
Кислород
Азот
Бериллий
Бор
Ar
Al
S
P
Si
Cl
Мg
Na
18
17
15
14
17
13
12
11
3
39,948
32,064
35,453
30,9738
28,086
24,312
26,9815
22,9898
Аргон
Фосфор
Кремний
Магний
Хлор
Сера
Натрий
Алюминий
Мn
Fe
21
Ti
25
Sc
22
V
23
27
Cr
Со
28
Ni
Сa
26
24
К
19
20
4
44,956
55,847
51,996
47,90
58,71
58,9332
44,956
50,942
39,102
40,08
Никель
Кобальт
Железо
Калий
Хром
Ванадий
Титан
Скандий
Кальций
Марганец
Кr
Se
Zn
30
Ge
Сu
Br
29
As
Ga
36
31
34
32
33
35
63,546
65,37
83,80
79,904
78,96
74,9216
72,59
26,9815
Криптон
Германий
Бром
Медь
Цинк
Селен
Галлий
Мышьяк
46
Pd
Rh
45
43
44
42
Мо
41
Zr
40
Nb
Ru
Тс
Sr
Rb
Y
39
38
37
5
101,07
92,906
[ 99 ]
91,22
102,905
106,4
95,94
88,905
87,62
85,47
Родий
Стронций
Ниобий
Рубидий
Рутений
Технеций
Палладий
Цирконий
Молибден
Иттрий
Xe
48
Sn
In
Ag
47
Тe
Сd
Sb
I
51
50
53
54
52
49
107,868
112,40
114,82
78,96
131,30
126,9044
121,75
118,69
Сурьма
Кадмий
Теллур
Серебро
Ксенон
Олово
Йод
Индий
Re
73
Та
74
W
75
78
76
77
Ir
Рt
Оs
Hf
Cs
La
57
72
Ва
56
55
*
6
180,948
192,2
178.49
190,2
183.85
195,09
186,2
138,81
137.34
132,905
Иридий
Тантал
Вольфрам
Барий
Гафний
Рений
Платина
Осмий
Цезий
Лантан
Вi
Ро
Pb
ТI
Аu
79
At
Hg
80
Rn
85
83
86
84
82
81
200,59
196,967
204,37
[ 222 ]
210
[ 210 ]
207,19
208,980
Свинец
Полоний
Радон
Ртуть
Висмут
Золото
Таллий
Астат
104
106
Sg
108
105
Db
Bh
Hs
109
Мt
Rf
89
Ас
Fr
Rа
107
88
87
7
**
[ 263 ]
[ 265 ]
[ 266 ]
[ 262 ]
[ 261 ]
[ 262 ]
[ 223 ]
138,81
[ 226 ]
Борий
Дубний
Сиборгий
Мейтнерий
Хассий
Резерфордий
Радий
Франций
Актиний
R 2 O 3
Высшие
оксиды
R 2 О
RO
R 2 O 5
RO 3
RO 2
R 2 O 7
RO 4
RH 4
RH 3
RH 2
ЛВС
RH
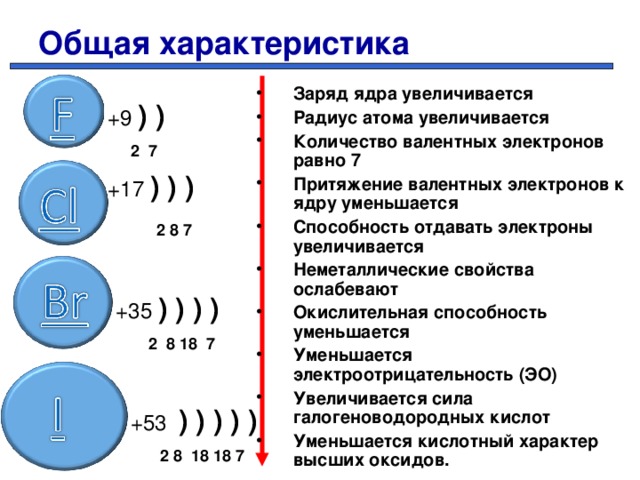
Общая характеристика
- Заряд ядра увеличивается
- Радиус атома увеличивается
- Количество валентных электронов равно 7
- Притяжение валентных электронов к ядру уменьшается
- Способность отдавать электроны увеличивается
- Неметаллические свойства ослабевают
- Окислительная способность уменьшается
- Уменьшается электроотрицательность (ЭО)
- Увеличивается сила галогеноводородных кислот
- Уменьшается кислотный характер высших оксидов.
+9 ) )
2 7
+17 ) ) )
2 8 7
+35 ) ) ) )
2 8 18 7
+53 ) ) ) ) )
2 8 18 18 7
История открытия фтора
В 1886 году французский химик А. Муассан, используя электролиз жидкого фтороводорода, охлажденного до температуры –23°C (в жидкости должно содержаться немного фторида калия, который обеспечивает ее электропроводимость), смог на аноде получить первую порцию нового, газа. В первых опытах для получения фтора А. Муассан использовал очень дорогой электролизер, изготовленный из платины и иридия. При этом каждый грамм полученного фтора «съедал» до 6 г платины.
2HF→H 2 ↑ + F 2 ↑
Анри Муассан
(1852 – 1907 г.)
История открытия хлора
В 1774 году шведский аптекарь К. Шееле открыл хлор. «Я поместил смесь черной магнезии с муриевой кислотой в реторту, к горлышку которой присоединил пузырь, лишенный воздуха, и поставил ее на песчаную баню. Пузырь наполнился газом, который имел желто-зеленый цвет и пронзительный запах».
В 1807 году английский химик Гемфри Дэви получил тот же газ. Он пришел к выводу, что получил новый элемент и назвал его «хлорин» (от «хлорос» — желто-зеленый).
В 1812 году Гей-Люссак дал газу название хлор.
Карл Вильгельм Шееле
(1742 – 1786 г.)
MnO 2 + 4HCl Cl 2 + MnCl 2 + 2H 2 O
История открытия брома
В 1825 году французский химик А.Ж.Балар при изучении маточных рассолов выделил темно-бурую жидкость, который он назвал — «мурид» (от латинского слова muria, означающего «рассол»). Комиссия Академии, проверив это сообщение, подтвердила открытие Балара и предложила назвать элемент бромом (от «бромос», с греческого «зловонный»). Балар писал: «Точь-в-точь как ртуть есть единственный металл, который имеет жидкую фазу при комнатной температуре, бром есть единственный жидкий неметалл» .
Антуан Жером Балар (1802 – 1876 г.)
2NaBr + Cl 2 → 2NaCl + Br 2
История открытия йода
В 1811 году французский химик Бернар Куртуа открыл йод путём перегонки маточных растворов от азотнокислого кальция с серной кислотой Чтобы другие химики могли изучать новое вещество, Б. Куртуа подарил его (фармацевтической фирме в Дижоне.
В 1813 году Ж.-Л.Гей-Люссак подробно изучил этот элемент и дал ему современное название. Название «иод» происходит от греческого слова «иодэс» — «фиолетовый» (по цвету паров).
Бернар Куртуа (1777 – 1838 г. )
2 NaI + 2 H 2 SO 4 = I 2 + SO 2 + Na 2 SO 4 + 2 H 2 O
История открытия астата
В 1869 г Д.И.Мендеелеев предсказал его существование и возможность открытия в будущем (как «эка-иод»).
Впервые астат был получен искусственно в 1940 г. открыт Д.Корсоном, К.Маккензи и Э.Сегре (Калифорнийский университет в Беркли). Для синтеза изотопа 211 At они облучали висмут альфа-частицами.
Астат является наиболее редким элементом среди всех, обнаруженных в природе. В поверхностном слое земной коры толщиной 1,6 км содержится всего 70 мг астата.
209 83 Bi + 4 2 He → 211 85 At + 2 1 0 n
Эрст Сегре
(1914 – 1985 г.)
Нахождение галогенов в природе
Фотография
Характеристика минерала
Химический состав
Цвет
CaF 2 (флюорит)
Бесцветный,
желтый, голубой, фиолетовый
Плотность
Твердость
3,4—4,9 г/см 3
3,3
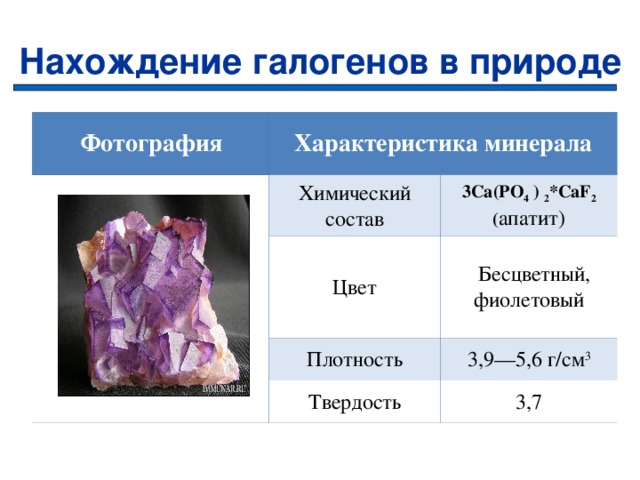
Нахождение галогенов в природе
Фотография
Характеристика минерала
Химический состав
Цвет
3 Ca(PO 4 ) 2 *CaF 2 ( апатит)
Бесцветный,
фиолетовый
Плотность
Твердость
3,9—5,6 г/см 3
3,7
Нахождение галогенов в природе
Фотография
Характеристика минерала
Химический состав
Цвет
Na С l (галит)
Бесцветный, красный, желтый, синий, голубой
Плотность
Твердость
2,2—2,3 г/см 3
2,5
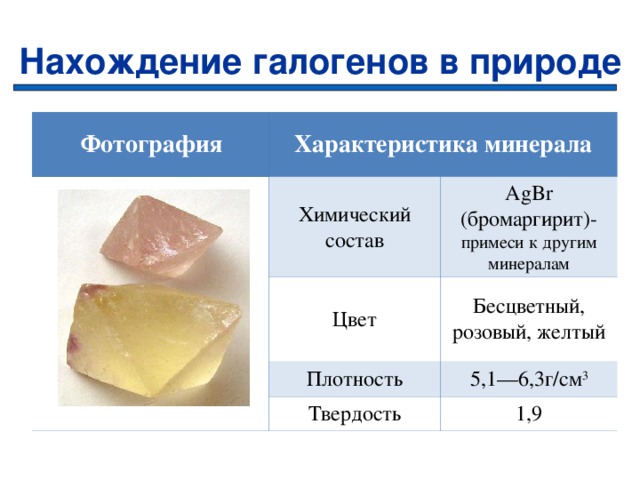
Нахождение галогенов в природе
Фотография
Характеристика минерала
Химический состав
Цвет
AgBr ( бромаргирит ) — примеси к другим минералам
Бесцветный, розовый, желтый
Плотность
Твердость
5,1—6,3г/см 3
1,9
Нахождение галогенов в природе
Фотография
Характеристика минерала
Химический состав
Цвет
AgI ( йодаргирит ) — примесь к другим минералам
Бесцветный, красный, желтый
Плотность
Твердость
5,8—7,1 г/см 3
1,7
ФТОР
Периоды
Ряды
Группы элементов
VI
VII
V
IV
VIII
II
III
I
I
1
Фтор/Fluorum (F)
Внешний вид простого вещества
Бледно-жёлтый газ. Очень ядовит.
Электронная конфигурация
[He] 2s 2 2p 5
ЭО (по Полингу)
4 (САМЫЙ ЭО ЭЛЕМЕНТ)
Степень окисления
− 1 (ВСЕГДА)
Плотность
(при −189 °C)
1,108 г/см ³
Температура плавления
53,53К
Температура кипения
85,01 К
II
2
III
3
4
IV
5
V
6
7
VI
8
F 2
9
10
VII
16
ХЛОР
Периоды
Ряды
Группы элементов
VII
VI
V
IV
VIII
II
III
I
1
I
Хлор / Chlorum (Cl)
Внешний вид простого вещества
Газ жёлто-зеленого цвета с резким запахом. Ядовит .
Электронная конфигурация
[Ne] 3s 2 3p 5
ЭО (по Полингу)
3,16
Степень окисления
+7, +6, +5, +4, +3, +1, −1
Плотность
(при −33.6 °C)
1,56 г/см ³
Температура плавления
172.2 К
Температура кипения
238.6 К
II
2
III
3
4
IV
5
V
6
7
VI
8
Cl 2
9
10
VII
БРОМ
Периоды
Ряды
Группы элементов
II
VIII
IV
V
VI
III
I
VII
1
I
Бром / Bromum (Br)
Внешний вид простого вещества
Электронная конфигурация
Красно-бурая жидкость с резким запахом
ЭО (по Полингу)
[Ar] 3d 10 4s 2 4p 5
Степень окисления
2,96
Плотность
+7, +5, +3, +1, -1
Температура плавления
3,12 г/см³
Температура кипения
265,9 К
331,9 К
II
2
3
III
4
IV
5
6
V
7
VI
8
Br 2
9
10
VII
ЙОД
Периоды
Ряды
Группы элементов
II
VIII
IV
V
VI
III
I
VII
1
I
Ио́д / Iodum (I)
Внешний вид простого вещества
Электронная конфигурация
Черно-фиолетовые кристаллы с металлическим блеском
ЭО (по Полингу)
[Kr] 4d 10 5s 2 5p 5
Степень окисления
2,66
Плотность
+7, +5, +3, +1, -1
Температура плавления
4,93г/см³
Температура кипения
386,7 К
457,5 К
II
2
3
III
4
IV
5
6
V
7
VI
8
I 2
9
10
VII
АСТАТ
Периоды
Ряды
Группы элементов
II
VIII
IV
V
VI
III
I
VII
1
I
Аста́т / Astatium (At)
Внешний вид простого вещества
Электронная конфигурация
Нестабильные чёрно-синие кристаллы
ЭО (по Полингу)
[Xe] 4f 14 5d 10 6s 2 6p 5
Степень окисления
2,2
Плотность
+7, +5, +3, +1, −1
Температура плавления
Предположительно 6, 4 г/см³
Температура кипения
517 К
582 К
II
2
3
III
4
IV
5
6
V
7
VI
8
At 2
9
10
VII
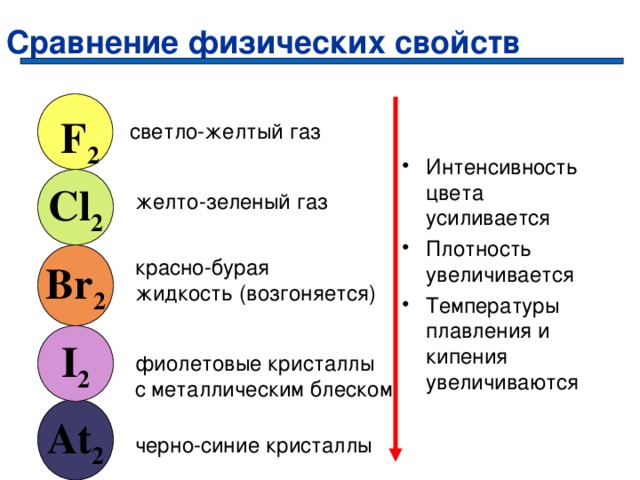
Сравнение физических свойств
F 2
светло-желтый газ
- Интенсивность цвета усиливается
- Плотность увеличивается
- Температуры плавления и кипения увеличиваются
Cl 2
желто-зеленый газ
Br 2
красно-бурая
жидкость (возгоняется)
I 2
фиолетовые кристаллы
с металлическим блеском
At 2
черно-синие кристаллы
Возгонка йода
Кристаллический йод обладает способностью при нагревании переходить из твердого состояния в газообразное , минуя жидкое ( возгонка ), превращаясь в фиолетовые пары.
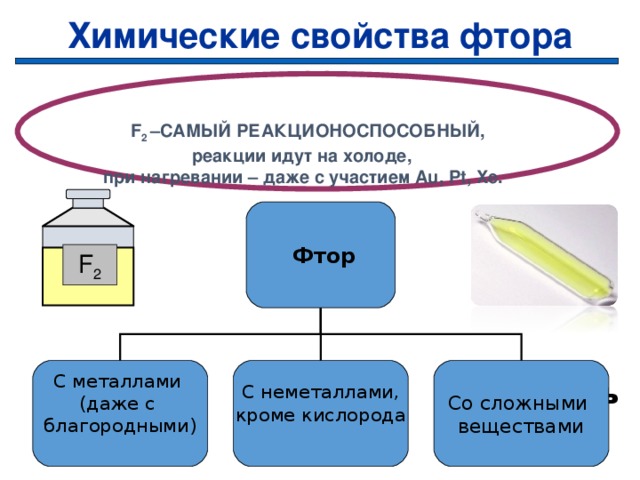
Химические свойства фтора
F 2 –САМЫЙ РЕАКЦИОНОСПОСОБНЫЙ , реакции идут на холоде, при нагревании – даже с участием Au, Pt, Xe.
Фтор
F 2
С неметаллами,
кроме кислорода
Со сложными
веществами
С металлами
(даже с
благородными)
Проверить
23
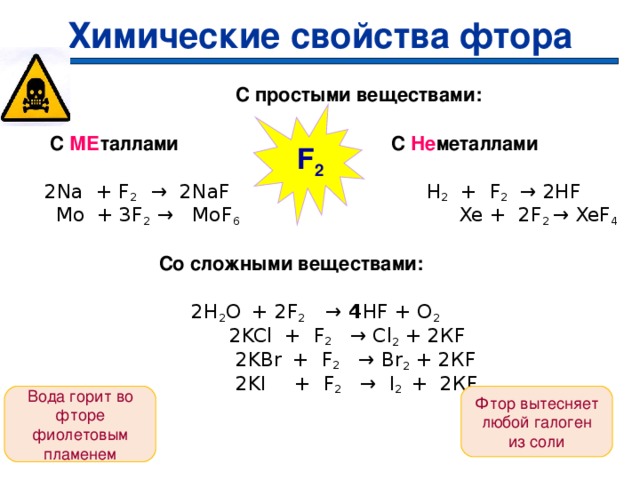
Химические свойства фтора
С простыми веществами:
С МЕ таллами С Не металлами
2Na + F 2 → 2NaF H 2 + F 2 → 2HF
Mo + 3F 2 → MoF 6 Xe + 2F 2 → XeF 4
Со сложными веществами:
2 H 2 O + 2F 2 → 4 HF + O 2
2KCl + F 2 → Cl 2 + 2К F
2KBr + F 2 → Br 2 + 2К F
2KI + F 2 → I 2 + 2К F
F 2
Фтор вытесняет любой галоген из соли
Вода горит во фторе фиолетовым пламенем
23
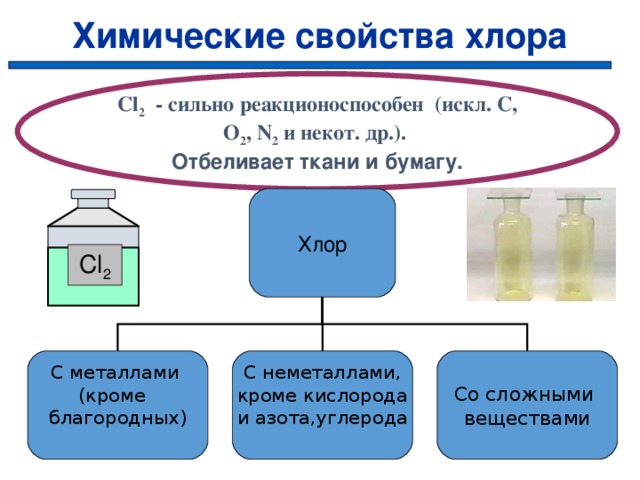
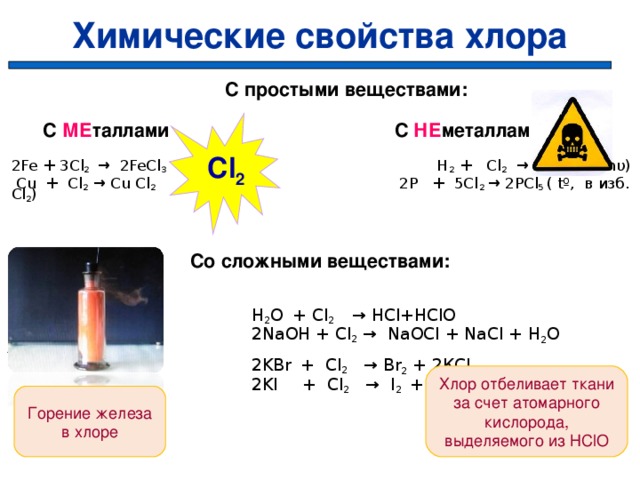
Химические свойства хлора
Cl 2 — сильно реакционоспособен (искл. C, O 2 , N 2 и некот. др.).
Отбеливает ткани и бумагу.
Хлор
Cl 2
Со сложными
веществами
С металлами
(кроме
благородных)
С неметаллами,
кроме кислорода
и азота,углерода
Химические свойства хлора
С простыми веществами:
С МЕ таллами С НЕ металлами
2Fe + 3Cl 2 → 2FeCl 3 H 2 + Cl 2 → 2HCl (tº, hυ)
Cu + Cl 2 → Cu Cl 2 2P + 5Cl 2 → 2PCl 5 ( tº, в изб. Сl 2 )
Со сложными веществами:
H 2 O + Cl 2 → HCl+HClO
2NaOH + Cl 2 → NaOCl + NaCl + H 2 O жавелевая вода
2KBr + Cl 2 → Br 2 + 2КCl
2KI + Cl 2 → I 2 + 2КCl
Cl 2
Хлор отбеливает ткани за счет атомарного кислорода, выделяемого из Н ClO
Горение железа в хлоре
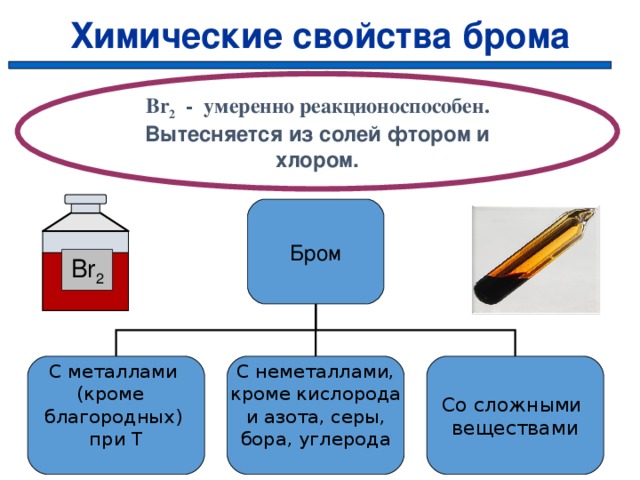
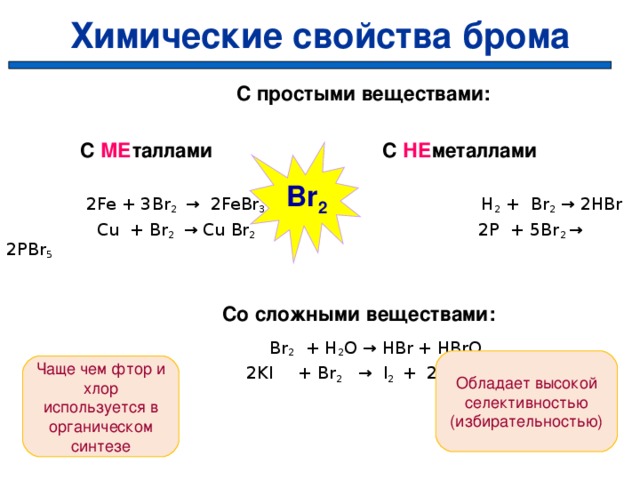
Химические свойства брома
Br 2 — умеренно реакционоспособен.
Вытесняется из солей фтором и хлором.
Бром
Br 2
Со сложными
веществами
С неметаллами,
кроме кислорода
и азота, серы,
бора, углерода
С металлами
(кроме
благородных)
при Т
Химические свойства брома
С простыми веществами:
С МЕ таллами С НЕ металлами
2Fe + 3 Br 2 → 2Fe Br 3 H 2 + Br 2 → 2HBr
Cu + Br 2 → Cu Br 2 2P + 5Br 2 → 2PBr 5
Со сложными веществами:
Br 2 + H 2 O → HBr + HBrO
2KI + Br 2 → I 2 + 2К Br
Br 2
Обладает высокой селективностью (избирательностью)
Чаще чем фтор и хлор используется в органическом синтезе
27
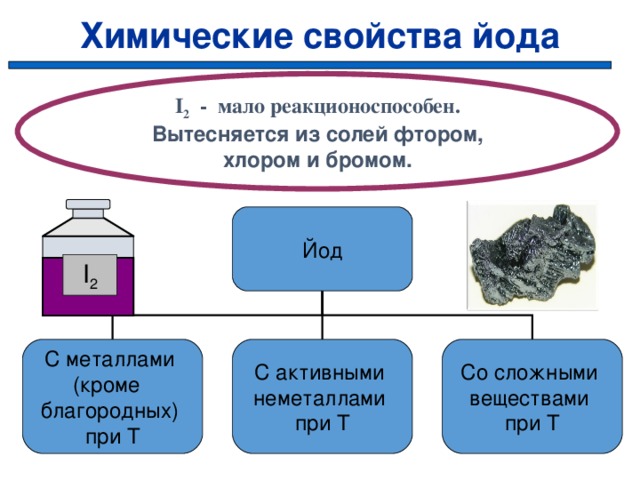
Химические свойства йода
I 2 — мало реакционоспособен.
Вытесняется из солей фтором, хлором и бромом.
Йод
I 2
Со сложными
веществами
при Т
С металлами
(кроме
благородных)
при Т
С активными
неметаллами
при Т
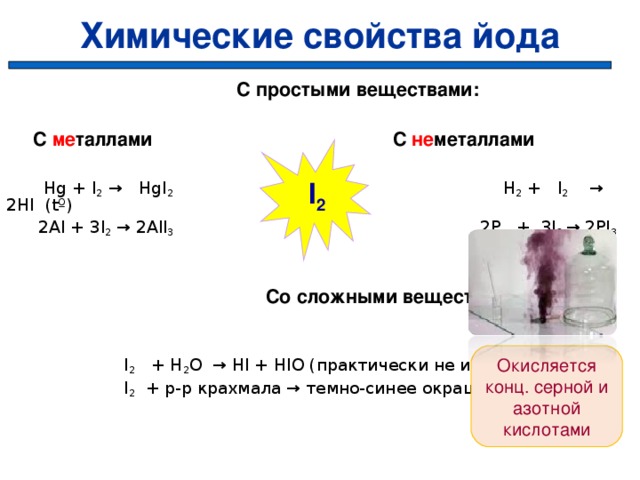
Химические свойства йода
С простыми веществами:
С ме таллами С не металлами
Hg + I 2 → HgI 2 H 2 + I 2 → 2HI (tº)
2Al + 3I 2 → 2AlI 3 2P + 3I 2 → 2PI 3
Со сложными веществами:
I 2 + H 2 O → HI + HIO (практически не идет)
I 2 + р-р крахмала → темно-синее окрашивание
I 2
Окисляется конц. серной и азотной кислотами
29
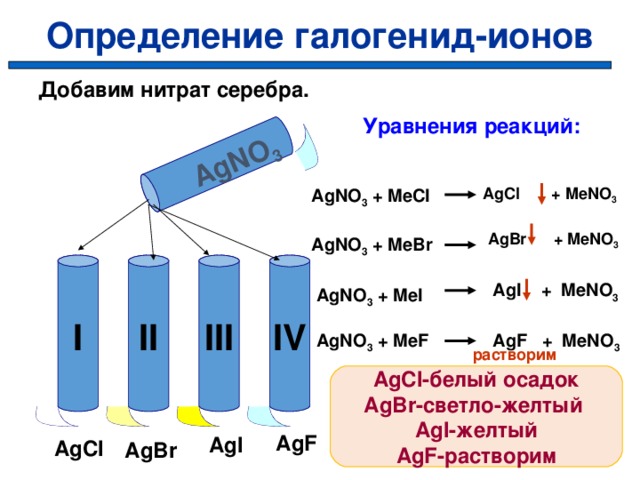
Определение галогенид-ионов
AgNO 3
Добавим нитрат серебра.
Уравнения реакций:
AgCl + MeNO 3
AgNO 3 + MeCl
AgBr + MeNO 3
AgNO 3 + MeBr
I
IV
III
II
AgI + MeNO 3
AgNO 3 + MeI
AgNO 3 + MeF
AgF + MeNO 3
растворим
AgCl -белый осадок
AgBr -светло-желтый
AgI -желтый
AgF -растворим
AgF
AgI
AgCl
AgBr
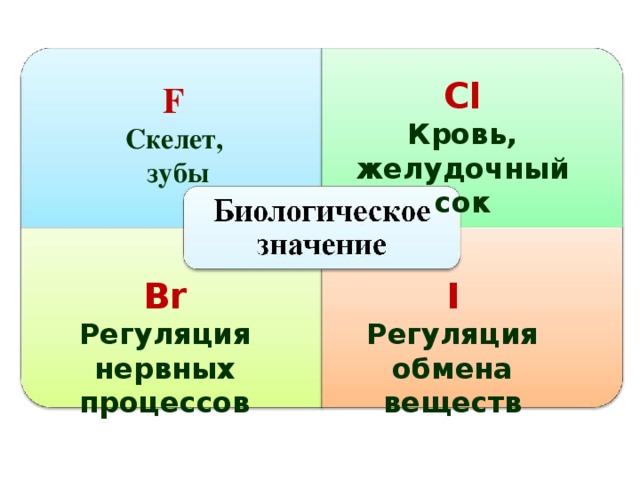
С l
Кровь, желудочный сок
F
Скелет,
зубы
Br
I
Регуляция нервных процессов
Регуляция обмена веществ
31
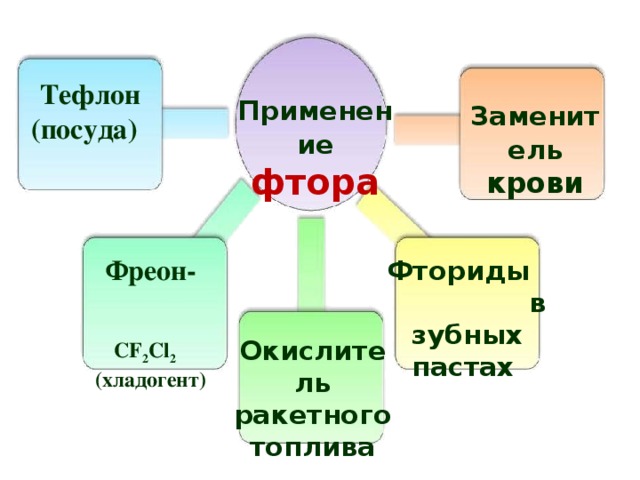
Тефлон
(посуда)
Применение фтора
Заменитель крови
Фреон-
CF 2 Cl 2
(хладогент)
Фториды в зубных пастах
Окислитель ракетного топлива
31
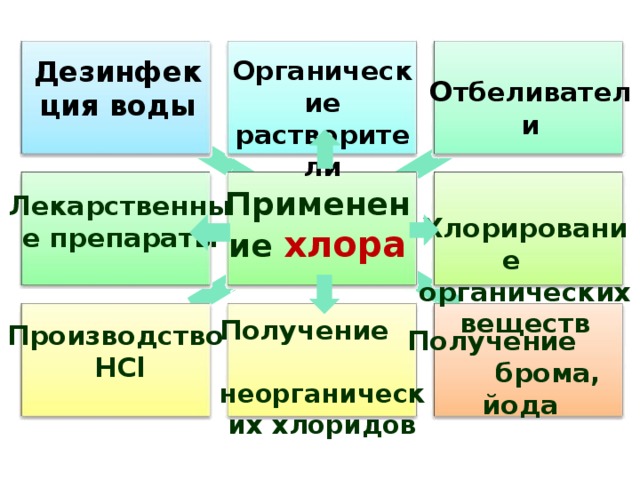
Дезинфекция воды
Органические растворители
О тбеливатели
Хлорирование органических веществ
Применение хлора
Лекарственные препараты
Получение неорганических хлоридов
Производство
HCl
Получение брома, йода
31
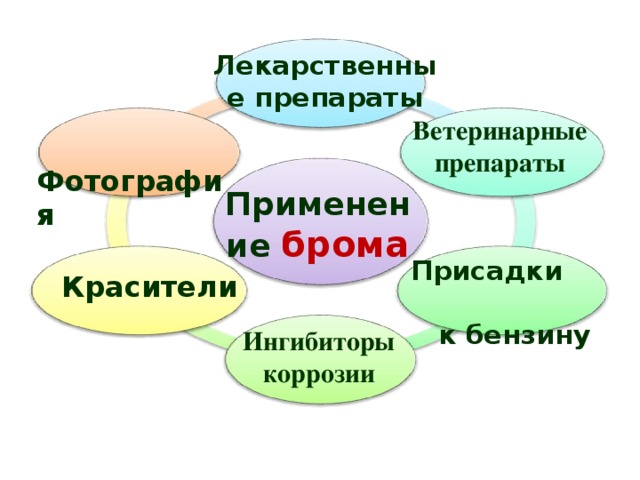
Лекарственные препараты
Ветеринарные препараты
Фотография
Применение брома
Присадки к бензину
Красители
Ингибиторы
коррозии
31
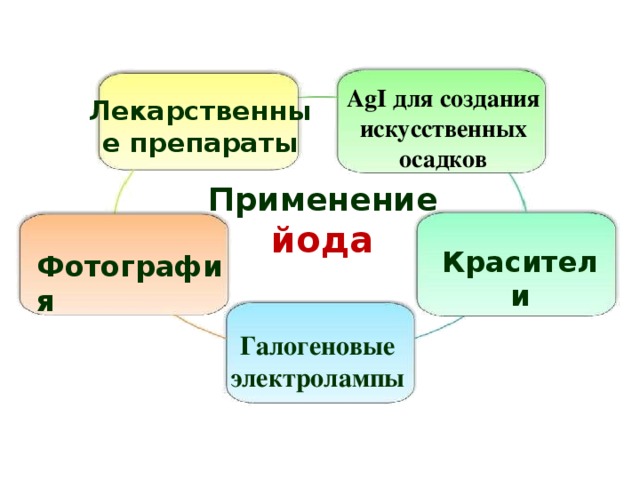
AgI для создания искусственных осадков
Лекарственные препараты
Применение йода
Красители
Фотография
Галогеновые
электролампы
31
HF
НIO
Домашнее задание
- Составьте кроссворд Ключевым словом является слово «ГАЛОГЕНЫ».
Презентация на тему: «Галогены и их соединения»
Оценка 4.8
Предлагаемый материал представляет собой презентацию о изучаемых в школьном курсе химических веществах, их соединениях. Дан материал об общей характеристике свойствах (физических, химических), способах получения, а также о применении данных веществ и их соединений. Материал может быть использован как при изучении нового материала, так и при его повторении.
Материалы на данной страницы взяты из открытых истончиков либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.
Галогены
- Учитель химии МБОУ СОШ села Индерка Сосновоборского района Пензенской области
- Абдряхимова Гузяль Зиннятовна
- Галогены – элементы VIIА – группы. Галогены – типичные неметаллы. Общее название подгруппы «галогены», т.е. «рождающие соли».
- Галогены.
- Строение и свойства атомов.
- F )2 )7
- Cl )2 )8 )7
- Br )2 ) 8)18 )7
- I )2 )8 )18 )18 )7
- At )2 )8 )18 ) 32) 18)7
- Общая формула – ns2np5
Строение и свойства атомов.
- Галогены: фтор F, хлор Cl, бром Br, йод I, астат At (редко встречающийся в природе) – типичные неметаллы. Их атомы содержат на внешнем энергетическом уровне семь электронов, и им недостает лишь одного электрона, чтобы завершить его. Атомы этих элементов при взаимодействии с металлами принимают электрон от атомов металлов. При этом возникает ионная связь и образуются соли.
- Галогены – очень сильные окислители. Фтор в химических реакциях проявляет только окислительные свойства, и для него характерна степень окисления -1. Остальные галогены могут проявлять и восстановительные свойства при взаимодействии с более электроотрицательными элементами – фтором, кислородом, азотом, при этом степени их окисления могут принимать значения +1, +3, +5, +7. восстановительные свойства галогенов усиливаются от хлора к йоду, что связано с ростом радиусов их атомов: атомы хлора примерно вдвое меньше, чем у йода.
- Галогены в природе.
Галогены – простые вещества.
- Все галогены существуют в свободном состоянии в виде двухатомных молекул с ковалентной неполярной химической связью между атомами. В твердом состоянии F2, Cl2, Br2, I2 имеют молекулярные кристаллические решетки, что и подтверждается их физическими свойствами.
- Физические свойства галогенов.
Химические свойства галогенов.
- Взаимодействие с металлами.
- Zn0 + F20→ Zn+2F2-1
- Взаимодействие с водородом.
- H2 + Г2 →2НГ
- Взаимодействие с растворами солей.
- Cl2 + 2NaBr→ 2NaCl + Br2
Открытие галогенов.
- Фтор в свободном виде получил впервые в 1866 г. Французский химик Анри Муассан, который был удостоен Нобелевской премии. Свое название элемент получил от греч. фторос – разрушающий.
- Хлор открыт химиком К. Шееле в 1774 г. Элемент получил название за свой цвет ( от греч. хлорос – желто — зеленый).
- Бром открыт в 1826 г. Французским химиком А. Баларом. Элемент назван так за свой запах (греч. бромос – зловонный).
- Йод получен в 1811 г. французским ученым Б. Куртуа, а название получил за цвет своих паров (греч. иодэс – фиолетовый).
Карл Вильгельм Шееле
(1742 — 1786)
- Шведский химик. В 1772 г. Установил, что воздух состоит из кислорода и азота. Открыл и получил много неорганических веществ (кислород, хлор, фтороводородная, глицерин и др.)
- Выводы:
- При движении по группе сверху вниз:
- Увеличивается атомный радиус.
- Уменьшается электроотрицательность.
- Окислительные свойства уменьшаются, а восстановительные свойства увеличиваются.
- Уменьшаются неметаллические свойства, возрастают металличность.
Литература
- http://ru.wikipedia.org/wiki/Галоид
- http://www.xumuk.ru/encyklopedia/909.html
- http://dic.academic.ru/dic.nsf/enc_colier/483/
- Учебник «Химия 9класс», О.С.Габриелян, Дрофа, Москва.










































![ФТОР Периоды Ряды Группы элементов VI VII V IV VIII II III I I 1 Фтор/Fluorum (F) Внешний вид простого вещества Бледно-жёлтый газ. Очень ядовит. Электронная конфигурация [He] 2s 2 2p 5 ЭО (по Полингу) 4 (САМЫЙ ЭО ЭЛЕМЕНТ) Степень окисления − 1 (ВСЕГДА) Плотность (при −189 °C) 1,108 г/см ³ Температура плавления 53,53К Температура кипения 85,01 К II 2 III 3 4 IV 5 V 6 7 VI 8 F 2 9 10 VII 16](https://fsd.multiurok.ru/html/2017/02/10/s_589e03f2c2249/img15.jpg)
![ХЛОР Периоды Ряды Группы элементов VII VI V IV VIII II III I 1 I Хлор / Chlorum (Cl) Внешний вид простого вещества Газ жёлто-зеленого цвета с резким запахом. Ядовит . Электронная конфигурация [Ne] 3s 2 3p 5 ЭО (по Полингу) 3,16 Степень окисления +7, +6, +5, +4, +3, +1, −1 Плотность (при −33.6 °C) 1,56 г/см ³ Температура плавления 172.2 К Температура кипения 238.6 К II 2 III 3 4 IV 5 V 6 7 VI 8 Cl 2 9 10 VII](https://fsd.multiurok.ru/html/2017/02/10/s_589e03f2c2249/img16.jpg)
![БРОМ Периоды Ряды Группы элементов II VIII IV V VI III I VII 1 I Бром / Bromum (Br) Внешний вид простого вещества Электронная конфигурация Красно-бурая жидкость с резким запахом ЭО (по Полингу) [Ar] 3d 10 4s 2 4p 5 Степень окисления 2,96 Плотность +7, +5, +3, +1, -1 Температура плавления 3,12 г/см³ Температура кипения 265,9 К 331,9 К II 2 3 III 4 IV 5 6 V 7 VI 8 Br 2 9 10 VII](https://fsd.multiurok.ru/html/2017/02/10/s_589e03f2c2249/img17.jpg)
![ЙОД Периоды Ряды Группы элементов II VIII IV V VI III I VII 1 I Ио́д / Iodum (I) Внешний вид простого вещества Электронная конфигурация Черно-фиолетовые кристаллы с металлическим блеском ЭО (по Полингу) [Kr] 4d 10 5s 2 5p 5 Степень окисления 2,66 Плотность +7, +5, +3, +1, -1 Температура плавления 4,93г/см³ Температура кипения 386,7 К 457,5 К II 2 3 III 4 IV 5 6 V 7 VI 8 I 2 9 10 VII](https://fsd.multiurok.ru/html/2017/02/10/s_589e03f2c2249/img18.jpg)
![АСТАТ Периоды Ряды Группы элементов II VIII IV V VI III I VII 1 I Аста́т / Astatium (At) Внешний вид простого вещества Электронная конфигурация Нестабильные чёрно-синие кристаллы ЭО (по Полингу) [Xe] 4f 14 5d 10 6s 2 6p 5 Степень окисления 2,2 Плотность +7, +5, +3, +1, −1 Температура плавления Предположительно 6, 4 г/см³ Температура кипения 517 К 582 К II 2 3 III 4 IV 5 6 V 7 VI 8 At 2 9 10 VII](https://fsd.multiurok.ru/html/2017/02/10/s_589e03f2c2249/img19.jpg)