30 октября 2022
В закладки
Обсудить
Жалоба
Цвета осадков и газов в неорганической химии
Для сдачи ОГЭ необходимо знать и предсказывать по формуле цвет осадка или газа, а также характерные запахи, которыми обладают газы. В данном документе собраны необходимые данные по этому вопросу.
Осадки бывают разных цветов и разной консистенции. Все это является частью описания признака реакции.
Задание 13 ОГЭ по химии.
priznaki-him-r.pdf
Автор: Фрундина Дарья Андреевна, учитель химии.
Таблицы качественных реакций
21-Дек-2013 | комментариев 9 | Лолита Окольнова
Вопросы части С объединяют знание всех тем химии. В случае Задания С2 ЕГЭ по химии — знание всех классов неорганических веществ и их качественных реакции.
Дается конкретный химический эксперимент, ход которого нужно описать химическими реакциями.
Для таких реакции обычно предлагаются какие-то внешние проявления — выделения газа, выпадение осадка или изменение окраски раствора.
Таблица качественных реакций для газов
| Описание | Формула |
Реакции |
| Бурый газ |
NO2 |
1) N2 + 2O2 = 2NO2 2) взаимодействие металлов с азотной кислотой (концентрированной) 3) разложение нитратов |
| Запах тухлых яиц |
H2S |
Взаимодействие активных металлов с концентрированной серной кислотой: |
|
Газ с резким запахом. Растворимый в воде |
SO2 |
1) взаимодействие серасодежащих веществ с кислородом
2) взаимодействие некоторых металлов с концентрированной серной кислотой |
| Газ с резким характерным запахом, растворимый в воде |
NH3 |
1) N2 + 3H2 = 2NH3 2) обменные реакции солей аммония |
| Газ, не поддерживающий горение, малорастворимый в воде, не ядовитый |
N2 |
1) горение азотсодержащих веществ; NH4NO2 = N2 + 2H2O |
|
Газы, поддерживающие горение: (для NO2 – бурый цвет) |
O2 O3 NO2 |
3C + 2O3 = 3CO2 С + 2NO2 = CO2 + 2NO |
Таблица качественных реакций для щелочных металлов:
Т.к. все соединения щелочных металлов хорошо растворимы в воде, то их определяют по цвету пламени:
(указан так же цвет пламени некоторых щелочно-земельных металлов)
|
желто-зеленое |
фиолетовое |
кирпично-красное |
ярко-красное |
желтое |
карминово-красное |
|
Ba2+ |
K+ |
Са2+ |
Li+ |
Na+ |
Sr2+ |
Таблица качественных реакций
— цвета осадков
|
Осадки белого цвета |
Качественная реакция |
|
Белый творожистый нерастворимый в воде; нерастворимый в HNO3 |
Ag+ + Cl— → AgCl↓ качественная реакция на соли серебра; качественная реакция на хлорид-ионы; |
|
Белый осадок нерастворимый в кислотах |
Ba2+ + SO4 -2 → BaSO4↓ качественная реакция на соли бария; качественная реакция на сульфат-ионы; |
|
Белый осадок образуется при пропускании газа без цвета с резким запахом через известковую воду; растворяется при пропускании избытка газа; растворяется в кислотах |
Сa(OH)2 + SO2 = CaSO3↓ + H2O
|
|
Белый осадок образуется при добавлении щелочи; растворяется в избытке щелочи |
Al3+ + 3OH— = Al(OH)3↓ Zn2+ + 2OH— = Zn(OH)2↓
|
|
Белый осадок образуется при пропускании газа без цвета и запаха через известковую воду; растворяется при пропускании избытка газа; растворяется в кислотах |
Сa(OH)2 + CO2 = CaCO3↓ + H2O
CaCO3 + 2H+ → CO2↑ + H2O + Ca2+ |
|
Осадок светло-желтого цвета (осадок кремового цвета) образуется при приливании AgNO3; нерастворим в HNO3; |
Ag+ + Br— → AgBr↓ качественная реакция на бромид-ионы; (качественная реакция на соли серебра); |
|
Осадок желтого цвета образуется при приливании AgNO3; нерастворим в HNO3; |
Ag+ + I— → AgJ↓ качественная реакция на иодид-ионы; (качественная реакция на соли серебра); |
|
Осадок желтого цвета образуется при приливании AgNO3; растворим в кислотах; |
3Ag+ + PO43- → Ag3PO4↓ |
|
Осадки коричневых цветов |
Качественная реакция |
|
Осадок бурого цвета образуется при взаимодействии с растворами щелочей; |
Fe3+ +3OH— → Fe(OH)3↓ качественная реакция на соли железа |
|
Осадки синих и зеленых цветов |
Качественная реакция |
|
Осадки зеленого цвета |
Fe2+ +2OH— → Fe(OH)2↓ |
|
Осадок голубого цвета (осадок синего цвета) образуется при взаимодействии с растворами щелочей |
Cu2+ +2OH— → Cu(OH)2↓ качественная реакция на соли меди (II) |
|
Осадок синего цвета образуется при взаимодействии с раствором красной кровяной и желтой кровяной соли |
3Fe2+ + 2[Fe(CN)6]3- → Fe3[Fe(CN)6]2↓ качественная реакция на соли железа (II) — с красной кровяной солью; 4Fe3+ + 3[Fe(CN)6]-4 → Fe4[Fe(CN)6]3↓ качественная реакция на соли железа (III) — с желтой кровяной солью; |
|
Осадки черного цвета |
Качественная реакция |
|
Осадок черного цвета Образуется при взаимодействии с сульфидами или с H2S |
Fe2+ + S2- → FeS↓ Ni2+ + S2- → NiS↓ Cu2+ + S2- → CuS↓ Pb2+ + S2- → PbS↓ Hg2+ + S2- → HgS↓ Ag+ + S2- → Ag2S↓ качественная реакция на сульфид-ионы |
Обсуждение: «Таблицы качественных реакций»
(Правила комментирования)
Газообразные вещества

4.3
Средняя оценка: 4.3
Всего получено оценок: 497.
4.3
Средняя оценка: 4.3
Всего получено оценок: 497.
Соединение, находящееся в одном из основных агрегатных состояний, при котором составные частицы слабо связаны между собой, называется газом или газообразным веществом. Частицы газа движутся хаотично и в некоторых случаях могут переходить в жидкое и твёрдое состояния.
Получение
Существуют вещества, которые при нормальных условиях сохраняются в газообразном агрегатном состоянии. Их можно разделить на две группы:
- простые – азот, кислород, хлор;
- сложные – аммиак, метан, углекислый газ.
Газы выделяют из атмосферы или природного газа путём окисления и адсорбции примесей.
Образованию газообразного состояния веществ способствует изменение нормальных условий. Жидкие или твёрдые вещества нагревают, тем самым разрушая химические связи и высвобождая отдельные молекулы в воздух. Например, жидкая вода при нагревании легко превращается в водяной пар, а твёрдый йод выделяет фиолетовые пары.
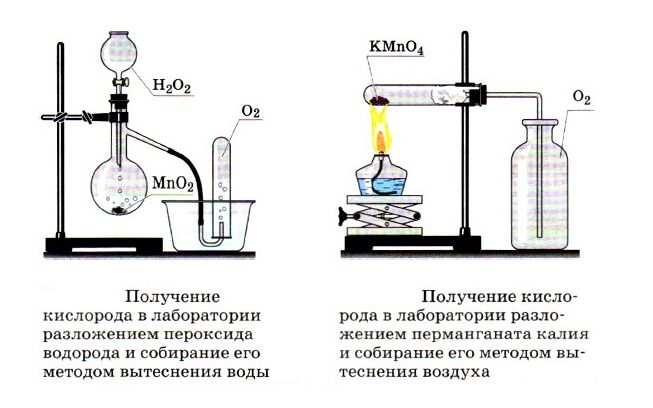
В лабораториях газ получают путём разложения (сжигания) сложных веществ или реакцией жидких и твёрдых соединений. Способы получения некоторых газов:
- водорода:
Zn + 2HCl = ZnCl2 + H2↑;
- кислорода:
2KMnO4 = K2MnO4 + MnO2 + О2↑;
- углекислого газа:
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑;
- аммиака:
NH4Cl + NaOH = NaCl + H2O + NH3↑.
Полученный газ обнаруживают разными способами. Например, пропускают через жидкость и наблюдают за изменением цвета, прозрачности (известковое молочко мутнеет в присутствии углекислого газа). Некоторые газы поддерживают горение или, наоборот, тушат тлеющую лучину.
Физические свойства
Молекулы газообразного вещества постоянно движутся, а расстояние между ними значительно превышает их диаметр. Благодаря такому расположению частиц газы не имеют формы, легко смешиваются и сжимаются.
Газообразные соединения приобретают форму сосуда, в котором находятся. Ударяясь о стенки сосуда с определённой скоростью, газы создают давление. Чем интенсивнее молекулы воздействуют на сосуд, тем выше давление.
Различные газообразные соединения смешиваются между собой в любых пропорциях. Природный газ – это смесь метана, водорода, сероводорода, углекислого газа, азота, гелия. Атмосфера состоит из смесей простых и сложных газообразных веществ – азота, кислорода, водорода, углекислого газа, водяного пара.
При сжатии объём газов становится значительно меньше. Например, объём кислорода уменьшается в 200 раз.
Описание некоторых газообразных веществ представлено в таблице.
|
Газ |
Формула |
Физические свойства |
Нахождение в природе |
|
Водород |
Н2 |
Самый лёгкий газ, легче воздуха в 14,5 раз. Не имеет вкуса, запаха, цвета. Плохо растворяется в воде (18,8 мл/100 г), но хорошо растворяется в металлах, особенно в палладии. Сжижается при -252,76°C |
В земной коре – 1 %, незначительное количество в атмосфере. Большая часть водорода присутствует в виде соединений |
|
Кислород |
О2 |
Не имеет вкуса, цвета, запаха. Немного тяжелее воздуха. Плохо растворяется в воде (4,9 мл/100 г) и спирте (2,78 мл/100 г), но хорошо растворяется в жидком серебре. Сжижается при -182,98°C |
47 % земной коры состоит из кислорода. Моря и пресные водоёмы содержат 85 % кислорода. В атмосфере – 20 % |
|
Азот |
N2 |
Бесцветный газ без запаха. Плохо растворим в воде (2,3 мл/100 г). Атомы азота связаны тройной трудно разрываемой связью. Сжижается при -195,8°C |
В атмосфере – 78 %. Один из наиболее распространённых элементов, найденных за пределами Земли. Входит в состав белков |
|
Хлор |
Cl2 |
Жёлто-зелёный газ с запахом. Легко сжижается уже при -34°C. При давлении в 0,8 МПа и комнатной температуре становится жидким. Плохо растворяется в воде (1,48 мл/100 г), хорошо растворяется в бензоле и хлороформе |
Наиболее распространённый галоген. В природе встречается только в составе минералов |
|
Углекислый газ |
CO2 |
Бесцветный газ, не имеющий запаха при малых концентрациях. В большом количестве имеет кислый запах. В 1,5 раза тяжелее воздуха. Кристаллизуется при -78,3°С. Жидкое состояние получают при комнатной температуре и давлении в 6 МПа |
В атмосфере содержится меньше 1 % |
|
Аммиак |
NH3 |
Бесцветный газ с резким запахом. В два раза тяжелее воздуха. Хорошо растворяется в воде |
Образуется путём разложения азотсодержащих веществ |
За счёт свободного движения молекул газ равномерно распространяется в ограниченном пространстве. Такое явление называется диффузией. Яркий пример диффузии – распространение запахов. При приготовлении пищи на кухне запах постепенно распространяется по всей квартире.
Что мы узнали?
Газ – вещество, состоящее из хаотично движущихся частиц – молекул или атомов. Газообразные соединения можно получить выделением из атмосферы путём адсорбции и окисления. Также газ получают из жидких и твёрдых веществ путём изменения условий или взаимодействием простых и сложных веществ. Газы не имеют формы, легко смешиваются между собой и равномерно распределяются в закрытом пространстве. Наиболее распространённый газ в атмосфере – азот. Самый лёгкий газ.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Ксения Гультяева
10/10
-
Ваня Бор
9/10
-
Хадиша Битабарова
10/10
-
Сергей Ефремов
6/10
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 497.
А какая ваша оценка?
Опасности подстерегают на каждом шагу, исключением не являются газы, используемые человеком во многих сферах деятельности. Отравление газом губительно для человека в большинстве случаев, антидоты ко многим видам еще не придуманы или не найдены. Легче всего предупредить отравление удушливым газом, чем спасти человека после.
Один из самых опасных газов – хлор, он является не только удушающим, но и раздражающим. Это вещество обжигает слизистую оболочку носоглотки, что делает дыхание затруднительным. Сам газ выглядит как туман желто-зеленого цвета, что со стороны смотрится странно. Во времена Второй мировой его использовали как оружие против солдат в окопах, ведь он стелется по земле. Кроме того, в безводной среде газ не вызывает коррозии, при малейшем содержании влаги он становится чрезвычайно агрессивным и коррозийным.
Защита против этого газа существует – противогаз. Только подобные приспособления способны оградить от отравления удушливым хлором. Прочие вещи, вроде респираторов, пусть и с фильтрами, не способны защитить человека полностью от какого-либо газа. Угольные фильтры задерживают только часть отравляющих веществ. При работе с концентрированным хлором рекомендуется использовать полноценную химическую защиту.

Главный редактор, заведующий хирургическим отделением
Задать вопрос
Врач-хирург высшей квалификационной категории, доктор медицинских наук, профессор кафедры общей хирургии АГМУ.
Содержание
- Окись углерода. Угарный газ
- Бытовой газ
- Сернистый ангидрид
- Фосген
- Смертельные газы: список, классификация, свойства
- Токсичные природные газы
- Химическое оружие
- Смертельные газы: список
- Самое доступное вещество
- С горьким запахом миндаля
- Самый токсичный газ: VX
- Отравляющий газ GB
- Самый популярный отравляющий газ
- Самое опасное вещество
- Список отравляющих газов
- Зарин
- Иприт
- Люизит
- Сероводород
- Угарный газ
- Фосген
- Синильная кислота
- Основы оказания первой помощи при отравлении угарным газом
- Симптомы отравления угарным газом
- Чем опасно отравление угарным газом
- Первая доврачебная помощь пострадавшему
- Основы сердечно-легочной реанимации
- Из чего состоит первая медицинская помощь
- Из чего состоит лечение в стационаре
- Опасные удушливые газы в повседневной жизни
- Окись углерода. Угарный газ
- Бытовой газ
- Сернистый ангидрид
- Фосген
Окись углерода. Угарный газ
Этот газ знаком всем и каждому, выделяется он при сгорании веществ, в состав которых входит углерод. Столкнуться с ним достаточно просто: выхлоп автомобиля, открытая горячая спираль на отопительных приборах с большим количеством пыли, открытый огонь. Вещество относится к удушливым газам, все из-за особого взаимодействия с кровью человека.
Как известно, эритроциты в крови человека переносят по сосудам к клеткам кислород, а из них углекислый газ. Формулы угарного и углекислого газов похожи, но не идентичны, все дело в лишнем атоме кислорода. Из-за этой особенности угарный газ гораздо прочнее прилипает к эритроцитам и вытесняет собой углекислый. Отравиться CO2 очень легко, если дело не дошло до летального исхода, то избавиться от симптомов просто: достаточно подышать свежим воздухом. При сильном отравлении нужно дышать уже концентрированным кислородом. Главным симптомом отравления можно назвать удушье, именно из-за него большинство людей и гибнут при пожаре, еще до получения ожогов. Угарный газ может послужить причиной смерти не только при пожаре, но и при проживании в плохо проветриваемых помещениях.
Газ достаточно распространенный, ведь примерно 70 % воздуха состоит из него. Он не имеет вкуса, запаха и цвета. Но тем не менее отравиться этим веществом достаточно просто. Намеренно вдыхать или употреблять внутрь концентрированный азот – чистое самоубийство.
Негативное влияние на организм человека следующее:
- Поражение ЦНР. Молекулы удушливого газа попадают в нейронные связи и нервные клетки, тем самым нарушая их работу. Эти нарушения приводят к сбою активности мозга, неправильной работе сердца и легких.
- Растворение в жировой ткани человека. Этот процесс вызывает сильную интоксикацию всего организма.
Все эти процессы только часть общего влияния на организм, они проявляются на протяжении 10 минут, что позволяет быстро сориентироваться и оказать помощь пострадавшему.
Бытовой газ
С ним люди сталкиваются каждый день при приготовлении еды или отоплении. Бытовой газ делится на два вида: баллонный и магистральный. К магистральному относится метан, он легче воздуха. К баллонным газам принято относить пропан и бутан, они тяжелее воздуха, потому оседают на землю. Все это разновидности не имеют цвета, запаха и вкуса, а для того, чтобы обеспечить проявление утечки вещества, добавляются дополнительные соединения, дающие неприятный запах.
Сернистый ангидрид
Этот газ тяжелее воздуха в несколько раз, оседает к земле и при температуре ниже 10 градусов переходит в жидкое состояние. Сернистый ангидрид достаточно опасен и при употреблении вызывает сбои в работе дыхательной системы. Это газ с резким запахом, идентифицировать его легко, он воняет серой.
Фосген
Во времена Первой мировой фосген сыграл печальную роль. Он служил химическим оружием: в виде удушливого газа его использовали против простых солдат. В то время еще не существовало нормальной химической защиты, а образования многих солдат не хватало для того, чтобы противостоять опасности. Газ имеет сильный и резкий запах, поражающий дыхательные системы человека и животных. Именно при вдыхании этого вещества происходит ожог слизистой оболочки. Это газ с удушливым запахом, от которого слезятся глаза.
Фосген можно встретить даже сейчас в виде отравы для кротов и прочих мелких грызунов, досаждающих дачникам. Не рекомендуется травить этим веществом именно кротов, их норы могут быть соединены с подвальными помещениями, в связи с чем могут пострадать люди. В малых концентрациях он не опасен.
Среди реакций, при которых вырабатывается фосген, самая неожиданная и опасная на операционном столе. Газ может образоваться при хлороформном наркозе из соединений веществ наркоза и кислорода из воздуха. В такой ситуации доктора будут вынуждены перенести операцию и оказать первую помощь человеку.
Для того чтобы избежать сильных отравлений газом, которые чреваты летальным исходом, рекомендуется использовать химическую защиту и соблюдать при работе с удушливыми газами все требования безопасности. При отравлении следует немедленно доставить человека на свежий воздух и вызвать скорую помощь. Некоторые виды отравлений не очень опасны, но злоупотреблять правилами не стоит, последствия фатальны для организма.
Смертельные газы: список, классификация, свойства
Во всем мире большое количество людей ежегодно умирает в результате вдыхания токсичных газов, встречающихся в различных сферах деятельности.
Эти газы обнаруживаются не только в промышленных условиях, но и в природе: они часто не имеют запаха, не имеют цвета и не могут быть обнаружены человеческими чувствами. Что делает их все более опасными, так это то, что вдыхание этих веществ часто может вызвать легочную и сердечную недостаточность. Кроме того, газы еще используются и в качестве оружия.
Токсичные природные газы
Наиболее распространенными токсичными газами, обнаруженными в нефтегазовой промышленности, являются диоксид серы (SO2), сероводород (H2S), оксид углерода (CO), бензол (C6H6) и инертные газы, такие как азот (N) и диоксид углерода (CO2). Токсичные газы могут быть опасными для жизни при низкой концентрации, а ряд других является ядовитыми. Например, H2S, широко распространенный в нефтегазовой промышленности, характеризуется резким запахом тухлых яиц. Это считается серьезной опасностью, так как он нейтрализует кислород и вызывает удушье. Токсичные газы также могут быть легковоспламеняющимися, что означает, что обнаружение становится очень важным для защиты от материального ущерба. В большинстве случаев это часто упускают из виду как серьезную опасность. Помимо вдыхания, газы на производстве ведут к промышленным пожарам и взрывам.
Кроме того, опасность для человека представляет оксид углерода. Он является продуктом горения органических веществ и при наличии в воздухе более 1,2 % угарный газ смертелен.
Химическое оружие
События в мире последних лет привели к возрождению интереса к химическому оружию. Его часто называют бомбой для бедных, оно требует относительно небольших инвестиций, может вызывать серьезные психологические и физические последствия и разрушения.
Смертельные газы: список
Как правило, перечень этих отравляющих веществ удобнее всего составлять, исходя из того, какое токсикологическое воздействие они оказывают.
- Группа нервно-паралитических газов представлена зарином и VX.
- К кожно-нарывным относятся люизит, иприт. представлены фосгеном, хлором, дифосгеном.
- К слезоточивым относят бромбензилцианид, хлорацетофенон.
- Группа газов общего воздействия представлена синильной кислотой, хлорцианом.
- К раздражающим относятся адамсит, CR, CS.
- К психотомиметическим — BZ, LSD-25.
Самое доступное вещество
Хлор – это газ, который является легкодоступным промышленным химикатом, используемым в мирных целях, в том числе в качестве отбеливателя бумаги и ткани, для производства пестицидов, каучука и растворителей, а также для уничтожения бактерий в питьевой воде и в бассейнах. Это прекрасный пример химического вещества двойного назначения. Несмотря на его двойную природу, использование хлора в качестве химического оружия все еще запрещено Конвенцией о запрещении химического оружия (КХО).
Газообразный хлор желто-зеленого цвета и имеет сильный запах, похожий на отбеливатель. Как и фосген, это удушающий агент, который препятствует дыханию и повреждает ткани организма. Он может легко находиться под давлением и охлаждаться до жидкого состояния, чтобы его можно было транспортировать и хранить. Этот смертельный газ быстро распространяется и остается близко к земле, потому что он тяжелее воздуха. Хотя он менее смертоносен, чем другие химические вещества, но очень опасен, потому что его легко изготовить и замаскировать.
С горьким запахом миндаля
Газ синильной кислоты также имеет двоякое применение: в химическом производстве и в качестве отравляющего вещества. Однако малая стойкость и отсутствие кумулятивных свойств привели к тому, что его использование в качестве химического оружия было прекращено. Еще одно название этого вещества – цианистый водород. Отличается характерным запахом горького миндаля. Вызывает тканевую гипоксию и поражение центральной нервной системы, острую сердечную недостаточность и остановку сердца.
Самый токсичный газ: VX
VX относится к фосфорорганическим соединениям и классифицируется как нервно-паралитический агент, поскольку влияет на передачу нервных импульсов. Он не имеет запаха и вкуса в чистом виде и выглядит как коричневатая маслянистая жидкость.
Разработанный в Великобритании в начале 1950-х, этот смертельный газ особенно эффективен, потому что он является постоянным агентом: как только он выпущен в атмосферу, он медленно испаряется. При обычных погодных условиях VX может сохраняться в течение нескольких дней на поверхности, в то время как в очень холодных условиях его действие может длиться месяцами. Пары VX тяжелее воздуха.
VX также является быстродействующим агентом. Симптомы могут появиться только через несколько секунд после воздействия. Они включают слюноотделение, сужение зрачков и стеснение в груди. Как и другие нервные агенты, VX воздействует на фермент (ацетилхолинэстеразу), который действует как «выключатель» организма для желез и мышц. Смерть вызывается удушьем или сердечной недостаточностью. Смертельная концентрация газа в зависимости от того, вдыхается он или подпадает на кожу, составляет 70-100 мкг/кг.
Отравляющий газ GB
Это вещество больше известно под названием зарин. В сентябре 2013 года ООН подтвердила, что атака с применением химического оружия с использованием специально разработанных ракет, которые распространяли газ зарин по повстанцам в пригороде сирийской столицы, произошла месяцем ранее. Генеральный секретарь ООН Пан Ги Мун заявил, что это наиболее значимое подтвержденное применение химического оружия против мирного населения с тех пор, как Саддам Хусейн использовал его в Халабдже в 1988 году.
Газ зарин является летучим, но токсичным агентом нервно-паралитического действия, созданный на основе фосфора. Одной капли размером с булавочную головку достаточно, чтобы быстро убить взрослого человека. Это бесцветная жидкость без запаха сохраняет агрегатное состояние при комнатной температуре, но быстро испаряется при нагревании. После освобождения он быстро распространяется в окружающей среде. Как и в случае с VX, симптомы включают головную боль, слюноотделение и выделение слез с последующим постепенным параличом мышц и возможную смерть.
Зарин был разработан в 1938 году в Германии, когда ученые исследовали пестициды. Культ Аум Синрике использовал его в 1995 году в токийском метро. Хотя атака вызвала массовую панику, она убила только 13 человек, потому что агент был распылен в жидкой форме. Чтобы максимизировать потери, зарин должен быть не только газом, но и его частицы должны быть достаточно маленькими, чтобы могли легко всасываться через слизистую оболочку легких, но достаточно тяжелыми, чтобы они не выдыхались.
Самый популярный отравляющий газ
Горчичный газ (иприт), также известный как серая горчица, получил свое название от запаха гнилой горчицы или чеснока и лука. Он относится к группе блистерных агентов, которые воздействуют на глаза, дыхательные пути и кожу, сначала как раздражитель, а затем как яд для клеток организма. Когда кожа подвергается воздействию, она краснеет и горит в течение нескольких часов, прежде чем появляются большие волдыри, которые вызывают сильные рубцы и боль. Глаза будут опухать, слезиться, а через несколько часов после воздействия возможна слепота. При вдыхании или проглатывании у жертв этого смертельного газа появляются чихание, хрипота, кашель с кровью, боль в животе и рвота.
Однако воздействие горчичного газа не всегда смертельно. Когда он был впервые использован в Первой мировой войне, он убил только 5 % людей, подвергшихся воздействию. Из-за своих свойств он стал популярным химическим оружием, которое использовалось в обеих мировых войнах, во время гражданской войны в Йемене и ирано-иракской войне.
Наряду с ужасными физическими эффектами горчичный газ является химически стабильным и очень стойким. Его пары более чем в шесть раз тяжелее воздуха и остаются на земле в течение нескольких часов. Это сделало его особенно полезным для отравления траншей противника. Он остается токсичным в течение одного или двух дней при средних погодных условиях и от недель до месяцев в очень холодных условиях. Более того, стойкость может быть увеличена путем загущения агента: растворения его в нелетучих растворителях. Это создает значительные проблемы для защиты, дезактивации и лечения.
Вероятность его использования вынуждает войска противника носить полную защитную экипировку, тем самым снижая их эффективность. Но защитное снаряжение не всегда срабатывает. Например, противогазов часто недостаточно. Во время ирано-иракской войны горчичный газ просачивался через маски, когда бороды молодых иранцев, обязательные к ношению, нарушали герметичность масок. Горчичный газ также легко проникает через одежду, обувь или другие материалы.
Самое опасное вещество
По сей день газ фосген считается одним из самых опасных из существующих видов химического оружия. Впервые он был использован в сочетании с газообразным хлором 19 декабря 1915 года, когда Германия сбросила 88 тонн газа на британские войска, в результате чего 120 человек погибли и 1069 человек пострадали. Во время Первой мировой войны на него приходилось 80 % всех химических смертей. Хотя он не так токсичен, как зарин или VX, его гораздо проще приготовить, что делает его более доступным.
Фосген является промышленным химическим веществом, используемым в производстве пластмасс и пестицидов. Он является удушающим агентом, который воздействует на легочную ткань. Первые вероятные симптомы, такие как кашель, удушье, стеснение в груди, тошнота и иногда рвота возникают через несколько минут после воздействия.
При комнатной температуре это почти бесцветный, хотя и смертельный газ, который пахнет свежескошенной травой в низких концентрациях. Он не воспламеняется и испаряется при нагревании, что делает его летучим. Но плотность его паров более чем в три раза превышает плотность воздуха, что означает, что он будет задерживаться в низменных областях, включая траншеи.
Список отравляющих газов
Отравляющий газ – это токсическое химическое вещество, которое вызывает интоксикацию организма и поражение внутренних органов и систем. Попадает через дыхательную систему, кожу, желудочно-кишечный тракт.
Список отравляющих газов в зависимости от их токсикологического воздействия:
- Нервно-паралитические – угарный газ, зарин.
- Кожно-нарывные – люизит, иприт.
- Удушающие – фосген, дифосген, хлор.
- Слезоточивые – бромбензилцианид, хлорацетофенон.
- Общего воздействия – синильная кислота, хлорциан.
- Раздражающие – адамсит, CR, CS.
- Психотомиметические – BZ, LSD-25.
Рассмотрим наиболее опасные газы, механизм их поражения, признаки отравления у человека.
Зарин
Зарин – ядовитое жидкое вещество, которое при температуре 20 °C быстро испаряется и оказывает нервно-паралитическое действие на организм человека. В состоянии газа он бесцветен и без запаха, наиболее опасен при вдыхании.
Симптомы проявляются сразу при попадании в дыхательные пути. Первые признаки отравления – затрудненное дыхание, сужение зрачка.
- раздражение слизистой носа, жидкие выделения;
- слюнотечение, рвота;
- сдавливание в груди;
- одышка, посинение кожи;
- спазм бронхов и усиленное образование в них слизи;
- отек легких;
- сильные спазмы и боли в животе.
При попадании в организм паров зарина высокой концентрации происходит сильное поражение головного мозга через 1-2 минуты. Человек не может контролировать физиологические функции организма – непроизвольные дефекация и мочеиспускание. Появляются конвульсии, судороги. Развивается кома с последующей остановкой сердца.
Иприт
Иприт – горчичный газ. Это химическое соединение кожно-нарывного действия. В жидком виде вещество имеет запах горчицы. В организм попадает двумя путями – воздушно-капельным и при контакте жидкости с кожей. Имеет свойство накапливаться. Признаки отравления ядом проявляются через 2-8 часов.
Симптомы интоксикации газом при вдыхании:
- поражение слизистой глаз;
- слезотечение, светобоязнь, ощущение песка в глазах;
- сухость и жжение в носу, затем отек носоглотки с гнойным выделением;
- ларингит, трахеит;
- бронхит.
Если жидкость попадет в глаза, это вызовет слепоту. При тяжелой степени отравления ипритом развивается пневмония, смерть наступает на 3-4-й день от удушья.
Симптомы отравления газом при попадании на кожу – покраснение с последующим образованием пузырьков, содержащих серозную жидкость, кожные поражения, язвы, некрозы. Газ разрушает клеточные оболочки, нарушает углеводный обмен, частично разрушает ДНК и РНК.
Люизит
Люизит – сильнейшее ядовитое вещество, пары которого способны проникать через костюм химической защиты и противогаз. Представляет собой жидкость коричневого цвета, имеет резкий запах. Газ относится к кожно-нарывным отравляющим средствам. Действует на организм мгновенно и не имеет латентного периода.
Симптомы отравления газом при поражении кожных покровов развиваются в течение 5 минут:
- боль и жжение в месте контакта;
- воспалительные изменения;
- болезненное покраснение;
- образование пузырей, они быстро вскрываются;
- появление эрозий, заживают несколько недель;
- в тяжелых случаях при попадании больших концентраций люизита образуются глубокие язвы.
Симптомы при вдыхании газа:
- поражение слизистой носоглотка, трахеи, бронхов;
- жидкость из носа;
- чихание, кашель;
- головная боль;
- тошнота, рвота;
- потеря голоса;
- чувство давления в груди, одышка.
Сильно чувствительна к ядовитому газу слизистая глаз. Она становится красной, отекают веки, усиливается слезотечение. Человек испытывает чувство жжения в глазах. При попадании жидкого люизита в ЖКТ у пострадавшего начинается обильное слюнотечение и рвота. Присоединяются резкие боли в брюшной полости. Поражаются внутренние органы, резко падает артериальное давление.
Сероводород
Сероводород – это бесцветный газ с резким запахом тухлых яиц. В больших концентрациях вещество очень токсично. Попадая в организм при вдыхании, развиваются симптомы общей интоксикации – головная боль, головокружение, слабость. Сероводород быстро всасывается в кровь и воздействует на центральную нервную систему.
Признаки отравления газом:
- во рту металлический вкус;
- паралич нерва, отвечающего за обоняние, поэтому пострадавший сразу же перестает ощущать любые запахи;
- поражение дыхательных путей, отек легких;
- сильные судороги;
- кома.
Высокое содержание газа во вдыхаемом воздухе приводит к мгновенной смерти.
Угарный газ
Угарный газ – бесцветное отравляющее вещество, легче воздуха. Попадая в организм через дыхательные пути, быстро всасывается в кровь и связывается с гемоглобином. Так блокируется транспортировка кислорода во все клетки, наступает кислородное голодание, останавливается клеточное дыхание.
Симптомы отравления угарным газом:
- головокружение и головная боль;
- учащенное дыхание и сердцебиение, одышка;
- шум в ушах;
- нарушение остроты зрения, мерцание в глазах;
- покраснение кожи;
- тошнота, рвота.
При тяжелом отравлении наблюдаются судороги. Нарастают симптомы, предшествующие коме – падение АД, резкая слабость, потеря сознания. При отсутствии медицинской помощи смерть наступает через 1 час.
Фосген
Фосген – бесцветный газ, отличается запахом прелого сена. Вещество опасно при вдыхании, первые признаки интоксикации проявляются через 4-8 часов. При высоких концентрациях смерть наступает через 3 секунды. Газ, попадая в легкие, разрушает их, вызывая моментальный отек.
Симптомы на разных стадиях отравления:
- Отек легких начинает развиваться в латентном периоде, когда пострадавший не подозревает об отравлении. Первые сигналы со стороны организма – сладкий, приторный привкус во рту, тошнота. Иногда бывает рвота. Человек чувствует першение в горле, зуд и жжение в носоглотке. Возникает кашлевой рефлекс, нарушаются дыхание и пульс.
- После скрытого периода состояние пострадавшего резко ухудшается. Появляется сильный кашель, человек начинает задыхаться. Синеют кожные покровы и губы.
- Стадия прогрессирующего ухудшения – сильное давление в грудной клетке, приводящее к удушью, частота дыхания увеличивается 70 в минуту (норма 18). В легких образуется много жидкости и слизи из-за разложения альвеол. Человек отхаркивает мокроту с кровью. Дыхание становится невозможным. 50% ОЦК (объем циркулирующей крови) переходит в легкие, и увеличивает их. Масса одного легкого может составлять 2,5 кг (норма 500-600 г).
В тяжелых случаях смерть через 10-15 минут. При отравлении газом средней тяжести летальный исход наступает через 2-3 суток. Выздоровление может произойти через 2-3 недели после отравления, но такое бывает редко из-за присоединения инфекции.
Синильная кислота
Синильная кислота бесцветная, легкая и подвижная жидкость с выраженным запахом. Она блокирует цепь продвижения кислорода по тканям, вызывая тканевую гипоксию. Газ влияет на нервную систему, нарушая иннервацию органов.
Симптомы отравления со стороны дыхания:
- одышка;
- в начале развития клинической картины частое дыхание;
- при сильной интоксикации – угнетение дыхания и его остановка.
Признаки со стороны сердца:
- замедление ударов сердца;
- повышение АД;
- спазм сосудов;
- по мере нарастания симптомов – падение давления, учащение пульса, острая сердечно-сосудистая недостаточность, остановка сердца.
Отравляющие газы – это сильные быстродействующие вещества. Чтобы спасти человека, необходимы экстренные реанимационные мероприятия. При благоприятном исходе пострадавший нуждается в длительном реабилитационном лечении.
Основы оказания первой помощи при отравлении угарным газом
Отравление угарным газом является опасным патологическим состоянием, которое несет угрозу для жизни и здоровья человека. От быстроты и правильности оказания первой помощи зависит, выживет пострадавший, или нет. В этой статье описывается первая помощь при отравлении угарным газом, основные симптомы и признаки этого состояния.
Симптомы отравления угарным газом
Признаки отравления угарным газом развиваются быстро. Степень их проявления зависит от количества и концентрации вдыхаемого CO (угарного газа), и времени, проведенного в задымленной среде.
Ниже представлены основные симптомы и признаки отравления угарным газом легкой и средней степени тяжести:
- Сильная головная боль, головокружение. Боль может иметь пульсирующий характер, и локализироваться в височной области. При сильной интоксикации боль острая, и разлитая по всей поверхности головы.
- Резь в глазах, слезотечение развиваются вследствие раздражения конъюнктивы глаз дымом.
- Тошнота и рвота. Рвота наблюдается на высоте головной боли, она не приносит облегчения, так как возникает вследствие раздражения рвотного центра, который локализируется в головном мозге.
- Ощущение шума в ушах, и видение мушек, пятен, мерцающих точек перед глазами.
- Тахикардия – учащенное сердцебиение (пульс). Частота сердечных сокращений может быть выше 100.
- Снижение артериального кровяного давления (гипотония).
- Отдышка. Из-за нехватки кислорода, человек начинает учащенно дышать.
При отравлении тяжелой степени, к вышеуказанным симптомам присоединяются:
- Нарушение сознания. Из-за нарушенного кровоснабжения головного мозга, человек начинает постепенно «загружаться», и впадать в сопор, а затем – в кому. Он перестает отвечать на вопросы, реагировать на раздражители.
- Генеральные судороги всего тела, которые происходят на фоне угнетенного сознания. На фоне судорог, может происходить произвольная дефекация и мочевыделение.
- Нарушение дыхания и пульса. При сильном отравлении продуктами горения, человек начинает дышать поверхностно и не ритмично, не регулярно. Пульс становится очень частым (около 130 уд/мин.), слабым.
Чем опасно отравление угарным газом
CO по своей химической структуре похож на железо (основной компонент гемоглобина, белка, который транспортирует кислород в ткани всего организма). Вследствие отравления угарным газом, гемоглобин перерождается на карбоксигемоглобин, и обеспечение всего организма кислородом нарушается. Это приводит к стойкой гипоксии. На нехватку кислорода в первую очередь реагирует головной мозг, почки сердечнососудистая система.
Своевременное оказание первой помощи при отравлении угарным газом может предотвратить следующие осложнения:
- Смерть головного мозга и отказ внутренних органов.
- Острая почечная недостаточность.
- Анемия.
- Острый инфаркт миокарда.
- Отек головного мозга.
- Геморрагический инсульт (кровоизлияние в ткани головного мозга).
- Пневмония (воспаление легких)
Первая доврачебная помощь пострадавшему
Оказание доврачебной помощи при отравлении угарным газом может проводиться людьми без медицинского образования в домашних условиях, или в любом другом месте, где произошло отравление. Чтобы помочь пострадавшему нужно знать, что делать при отравлении угарным газом и в какой последовательности выполнять действия.
Если вы стали свидетелем отравления человека СО, не нужно теряться. От ваших действий зависит его жизнь. Соберитесь и сосредоточьтесь. Ниже в списке детально расписано, что делать и как оказать первую помощь при отравлении угарным газом:
- Выведите, или вынесите пострадавшего из задымленного помещения. Во время его перемещения не забывайте о своей безопасности. Прикройте рот и нос влажной тканью, или марлевой повязкой, это делается в качестве профилактики дальнейшего попадания CO2
- После того как отравляющий газ перестал отравлять вас и пострадавшего человека, немедленно вызовите скорую медицинскую помощь. При этом вам следует детально рассказать диспетчеру о том, что произошло, назвать, по возможности, максимально точное свое месторасположение, и описать состояние отравившегося человека. Возможно, диспетчер даст вам какие-то рекомендации, придерживайтесь их.
- Если отравившийся без сознания, вам следует положить его набок. В таком положении риск западения языка минимален.
- Пострадавшему следует обеспечить свободный поток свежего воздуха, кислорода. Расстегните его рубашку, галстук. Если вы находитесь в помещении откройте нараспашку все окна и шторы.
- Если у вас есть с собой нашатырный спирт, дайте его понюхать отравившемуся человеку. Этот спирт может помочь вернуть его в сознание.
- Если человек не потерял сознание, напоите его сладким горячим чаем, кофе, дайте ему воды. Так вы сможете повысить его артериальное давление, побороть гипотонию.
- При отсутствии дыхания и пульса, нужно начинать сердечно-легочную реанимацию (о ней подробно написано в следующем разделе статьи).
Вышеуказанная неотложная помощь при отравлении угарным газом поможет человеку выжить до приезда бригады скорой помощи.
Обратите внимание, что такую помощь вам следует проводить при отсутствии непосредственной опасности для вашей жизни.
Основы сердечно-легочной реанимации
Сердечно-легочная реанимация состоит из непрямого массажа сердца, искусственного дыхания и внутривенного введения лекарств, стимулирующих сокращение миокарда (адреналин, атропин). В бытовых условиях, при оказании доврачебной помощи, лекарства никакие лекарства не вводятся.
Обратите внимание, что перед проведением реанимации, нужно убедиться, что у человека не бьется сердце и отсутствует дыхание. Пульс лучше всего проверять на аорте (крупном кровеносном сосуде, который проходит на переднебоковой поверхности шеи), а дыхание слушать, приложив ухо к грудной клетке.
Если вы оказываете помощь самостоятельно, и помочь некому, при выполнении сердечно-легочной реанимации следует делать только непрямой массаж сердца. Для этого положите одну кисть на другую, и нажимайте ими на среднюю треть грудины человека. Локти при этом должны быть прямыми. Продавливать грудную клетку следует на 3-4 см. Частота надавливаний на грудную клетку – 100/мин.
Ритмичность реанимации похожа на темп песни «Staying alive» группы Bee Gees. Данную музыкальную композицию используют при обучении основам СЛР (сердечно-легочной реанимации) в медицинских университетах и колледжах.
Если вас двое, можно добавить в реанимационные мероприятия искусственное дыхание. Для этого откройте рот человеку, рукой, или марлей, очистите его от лишнего содержимого (рвотных масс, крови, обломков зубов). Затем проводите вдохи рот в рот через марлю или ткань. Через каждые 15 нажимов на грудную клетку, нужно делать 2 вдоха.
Через каждую минуту следует проводить быстрый контроль наличия пульса на аорте и дыхания. Если они не появились – продолжайте делать реанимацию до приезда медицинской бригады. Меняйтесь местами каждые 5 минут, так вы сохраните силы.
Из чего состоит первая медицинская помощь
Первая медицинская помощь (ПМП) оказывается бригадой медиков, которая приехала на вызов. Она проводится в безопасном и не задымленном помещении, или в машине скорой помощи. Медики измеряют пульс, артериальное давление, сатурацию крови (насыщенность крови кислородом), оценивают общее состояние больного, собирают у него и окружающих анамнез.
Перед транспортировкой пострадавшего в стационар, врачи стабилизируют его состояние. ПМП состоит из:
- Оксигенотерапии. Человеку одевается маска, через которую подается кислородная увлажненная смесь.
- Внутривенного введения растворов. Это необходимо для снятия интоксикации от отравляющего газа, поднятия артериального кровяного давления. Может вводится Реополиглюкин, Реосорбилакт, Глюкоза, Трисоль, Дисоль, Физиологический раствор.
- Введения кортикостероидов, которые поднимут давление, и помогут избежать отека головного мозга.
- При наличии судорожного синдрома, внутривенно вводятся противосудорожные препараты (магнезия, сибазон).
- Реанимации, которая проводится по жизненным показателям.
После стабилизации состояния больного, бригада скорой помощи отвозит его в ближайшее отделение интенсивной терапии и реанимации, а котором продолжается лечение.
Из чего состоит лечение в стационаре
Основным методом лечения при отравлении чадным газом является пребывание пострадавшего в гипербарической барокамере. С помощью этого оборудования, происходит выведение из организма карбоксигемоглобина, который мешает полноценному снабжению кислородом всех тканей организма.
В стационаре продолжается внутривенное введение растворов для детоксикации организма. Объем медицинской больничной помощи зависит от степени поражения человека, сопутствующих травмах, ожогов кожи. Пациенту вводятся антибактериальные препараты, которые предупреждают развитие воспаления легких. Пациент постоянно получает кислородные смеси. Длительность госпитализации зависит от состояния пострадавшего.
Отравиться чадным газом может каждый. Знание элементарных правил оказания первой доврачебное помощи может спасти жизнь человеку, который находится рядом с вами. Во время ее оказания, вы должны быть уверены в своей безопасности, пребывать не в задымленном помещении. Пострадавшему следует немедленно вызвать скорую медицинскую помощь, которая стабилизирует состояние больного, и отвезет его в отделение интенсивной терапии.
Опасные удушливые газы в повседневной жизни
Опасности подстерегают на каждом шагу, исключением не являются газы, используемые человеком во многих сферах деятельности. Отравление газом губительно для человека в большинстве случаев, антидоты ко многим видам еще не придуманы или не найдены. Легче всего предупредить отравление удушливым газом, чем спасти человека после.
Один из самых опасных газов – хлор, он является не только удушающим, но и раздражающим. Это вещество обжигает слизистую оболочку носоглотки, что делает дыхание затруднительным. Сам газ выглядит как туман желто-зеленого цвета, что со стороны смотрится странно. Во времена Второй мировой его использовали как оружие против солдат в окопах, ведь он стелется по земле. Кроме того, в безводной среде газ не вызывает коррозии, при малейшем содержании влаги он становится чрезвычайно агрессивным и коррозийным.
Вам будет интересно: Конокрад — это. История понятия
Защита против этого газа существует – противогаз. Только подобные приспособления способны оградить от отравления удушливым хлором. Прочие вещи, вроде респираторов, пусть и с фильтрами, не способны защитить человека полностью от какого-либо газа. Угольные фильтры задерживают только часть отравляющих веществ. При работе с концентрированным хлором рекомендуется использовать полноценную химическую защиту.
Окись углерода. Угарный газ
Этот газ знаком всем и каждому, выделяется он при сгорании веществ, в состав которых входит углерод. Столкнуться с ним достаточно просто: выхлоп автомобиля, открытая горячая спираль на отопительных приборах с большим количеством пыли, открытый огонь. Вещество относится к удушливым газам, все из-за особого взаимодействия с кровью человека.
Как известно, эритроциты в крови человека переносят по сосудам к клеткам кислород, а из них углекислый газ. Формулы угарного и углекислого газов похожи, но не идентичны, все дело в лишнем атоме кислорода. Из-за этой особенности угарный газ гораздо прочнее прилипает к эритроцитам и вытесняет собой углекислый. Отравиться CO2 очень легко, если дело не дошло до летального исхода, то избавиться от симптомов просто: достаточно подышать свежим воздухом. При сильном отравлении нужно дышать уже концентрированным кислородом. Главным симптомом отравления можно назвать удушье, именно из-за него большинство людей и гибнут при пожаре, еще до получения ожогов. Угарный газ может послужить причиной смерти не только при пожаре, но и при проживании в плохо проветриваемых помещениях.
Газ достаточно распространенный, ведь примерно 70 % воздуха состоит из него. Он не имеет вкуса, запаха и цвета. Но тем не менее отравиться этим веществом достаточно просто. Намеренно вдыхать или употреблять внутрь концентрированный азот – чистое самоубийство.
Негативное влияние на организм человека следующее:
- Поражение ЦНР. Молекулы удушливого газа попадают в нейронные связи и нервные клетки, тем самым нарушая их работу. Эти нарушения приводят к сбою активности мозга, неправильной работе сердца и легких.
- Растворение в жировой ткани человека. Этот процесс вызывает сильную интоксикацию всего организма.
Все эти процессы только часть общего влияния на организм, они проявляются на протяжении 10 минут, что позволяет быстро сориентироваться и оказать помощь пострадавшему.
Бытовой газ
С ним люди сталкиваются каждый день при приготовлении еды или отоплении. Бытовой газ делится на два вида: баллонный и магистральный. К магистральному относится метан, он легче воздуха. К баллонным газам принято относить пропан и бутан, они тяжелее воздуха, потому оседают на землю. Все это разновидности не имеют цвета, запаха и вкуса, а для того, чтобы обеспечить проявление утечки вещества, добавляются дополнительные соединения, дающие неприятный запах.
Сернистый ангидрид
Этот газ тяжелее воздуха в несколько раз, оседает к земле и при температуре ниже 10 градусов переходит в жидкое состояние. Сернистый ангидрид достаточно опасен и при употреблении вызывает сбои в работе дыхательной системы. Это газ с резким запахом, идентифицировать его легко, он воняет серой.
Фосген
Во времена Первой мировой фосген сыграл печальную роль. Он служил химическим оружием: в виде удушливого газа его использовали против простых солдат. В то время еще не существовало нормальной химической защиты, а образования многих солдат не хватало для того, чтобы противостоять опасности. Газ имеет сильный и резкий запах, поражающий дыхательные системы человека и животных. Именно при вдыхании этого вещества происходит ожог слизистой оболочки. Это газ с удушливым запахом, от которого слезятся глаза.
Фосген можно встретить даже сейчас в виде отравы для кротов и прочих мелких грызунов, досаждающих дачникам. Не рекомендуется травить этим веществом именно кротов, их норы могут быть соединены с подвальными помещениями, в связи с чем могут пострадать люди. В малых концентрациях он не опасен.
Среди реакций, при которых вырабатывается фосген, самая неожиданная и опасная на операционном столе. Газ может образоваться при хлороформном наркозе из соединений веществ наркоза и кислорода из воздуха. В такой ситуации доктора будут вынуждены перенести операцию и оказать первую помощь человеку.
Для того чтобы избежать сильных отравлений газом, которые чреваты летальным исходом, рекомендуется использовать химическую защиту и соблюдать при работе с удушливыми газами все требования безопасности. При отравлении следует немедленно доставить человека на свежий воздух и вызвать скорую помощь. Некоторые виды отравлений не очень опасны, но злоупотреблять правилами не стоит, последствия фатальны для организма.
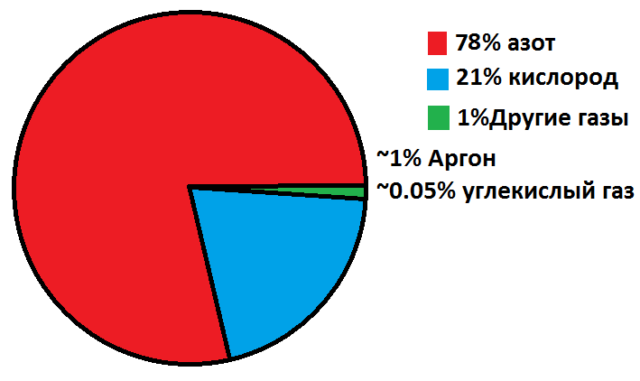
Азот — неметаллический элемент Va группы периодической таблицы Д.И. Менделеева. Составляет 78% воздуха. Входит в состав
белков, являющихся важной частью живых организмов.
Температура кипения азота составляет -195,8 °C. Однако быстрого замораживания объектов, которое часто демонстрируют в
кинофильмах, не происходит. Даже для заморозки растения нужно продолжительное время, это связано с низкой теплоемкостью
азота.

Общая характеристика элементов Va группы
От N к Bi (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Азот, фосфор и мышьяк являются неметаллами, сурьма — полуметалл, висмут — металл.

Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np3:
- N — 2s22p3
- P — 3s23p3
- As — 4s24p3
- Sb — 5s25p3
- Bi — 6s26p3
Основное и возбужденное состояние азота
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на p-подуровень. Однако с азотом ситуация иная. Поскольку азот находится во втором периоде, то
3ий уровень у него отсутствует, а значит распаривание электронов на s-подуровне невозможно — возбужденное состояние у азота отсутствует.
Сравнивая возможности перемещения электронов у азота и фосфора, разница становится очевидна.

Природные соединения
В природе азот встречается в виде следующих соединений:
- Воздух — во вдыхаемом нами воздухе содержится 78% азота
- Азот входит в состав нуклеиновых кислот, белков
- KNO3 — индийская селитра, калиевая селитра
- NaNO3 — чилийская селитра, натриевая селитра
- NH4NO3 — аммиачная селитра (искусственный продукт, в природе не встречается)
Селитры являются распространенными азотными удобрениями, которые обеспечивают быстрый рост и развитие растений, повышают урожайность. Однако,
следует строго соблюдать правила их применения, чтобы не превысить допустимые концентрации.

Получение
В промышленности азот получают путем сжижения воздуха. В дальнейшем путем испарения из сжиженного воздуха получают азот.
Применяют и метод мембранного разделения, при котором через специальный фильтр из сжатого воздуха удаляют кислород.

В лаборатории методы не столь экзотичны. Чаще всего получают азот разложением нитрита аммония
NH4NO2 → (t) N2 + H2O
Также азот можно получить путем восстановления азотной кислоты активными металлами.
HNO3(разб.) + Zn → Zn(NO3)2 + N2 + H2O

Химические свойства
Азот восхищает — он принимает все возможные для себя степени окисления от -3 до +5.

Молекула азота отличается большой прочностью из-за наличия тройной связи. Вследствие этого многие реакции эндотермичны: даже горение
азота в кислороде сопровождается поглощением тепла, а не выделением, как обычно бывает при горении.

- Реакция с металлами
- Реакция с неметаллами
Без нагревания азот взаимодействует только с литием. При нагревании реагирует и с другими металлами.
N2 + Li → Li3N (нитрид лития)
N2 + Mg → (t) Mg3N2
N2 + Al → (t) AlN
Важное практическое значение имеет синтез аммиака, который применяется в дальнейшим при изготовлении удобрений, красителей, лекарств.
N2 + H2 ⇄ (t, p) NH3
Аммиак
Бесцветный газ с резким едким запахом, раздражающим слизистые оболочки. Раствор концентрацией 10% аммиака применяется в медицинских целях,
называется нашатырным спиртом.

Получение
В промышленности аммиак получают прямым взаимодействием азота и водорода.
N2 + H2 ⇄ (t, p) NH3
В лабораторных условиях сильными щелочами действуют на соли аммония.
NH4Cl + NaOH → NH3 + NaCl + H2O
Химические свойства
Аммиак проявляет основные свойства, окрашивает лакмусовую бумажку в синий цвет.
- Реакция с водой
- Основные свойства
- Восстановительные свойства
Образует нестойкое соединение — гидроксид аммония, слабое основание. Оно сразу же распадается на воду и аммиак.
NH3 + H2O ⇄ NH4OH
Как основание аммиак способен реагировать с кислотами с образованием солей.
NH3 + HCl → NH4Cl (хлорид аммония)
NH3 + HNO3 → NH4NO3 (нитрат аммония)

Поскольку азот в аммиаке находится в минимальной степени окисления -3 и способен только ее повышать, то аммиак проявляет выраженные
восстановительные свойства. Его используют для восстановления металлов из их оксидов.
NH3 + FeO → N2↑ + Fe + H2O
NH3 + CuO → N2↑ + Cu + H2O
Горение аммиака без катализатора приводит к образованию азота в молекулярном виде. Окисление в присутствии катализатора сопровождается
выделением NO.
NH3 + O2 → (t) N2 + H2O
NH3 + O2 → (t, кат) NO + H2O

Соли аммония
Получение
NH3 + H2SO4 → NH4HSO4 (гидросульфат аммония, избыток кислоты)
3NH3 + H3PO4 → (NH4)3PO4
Химические свойства
Помните, что по правилам общей химии, если по итогам реакции выпадает осадок, выделяется газ или образуется вода — реакция идет.
- Реакции с кислотами
- Реакции с щелочами
- Реакции с солями
- Реакция гидролиза
- Реакции разложения
NH4Cl + H2SO4 → (NH4)2SO4 + HCl↑
В реакциях с щелочами образуется гидроксид аммония — NH4OH. Нестойкое основание, которое легко распадается на воду и аммиак.
NH4Cl + KOH → KCl + NH3 + H2O
(NH4)2SO4 + BaCl2 = BaSO4↓ + NH4Cl
В воде ион аммония подвергается гидролизу с образованием нестойкого гидроксида аммония.
NH4+ + H2O ⇄ NH4OH + H+
NH4OH ⇄ NH3 + H2O
NH4Cl → (t) NH3↑ + HCl↑
(NH4)2CO3 → (t) NH3↑ + H2O + CO2↑
NH4NO2 → (t) N2↑ + H2O
NH4NO3 → (t) N2O↑ + H2O
(NH4)3PO4 → (t) NH3↑ + H3PO4

Оксид азота I — N2O
Закись азота, веселящий газ — N2O — обладает опьяняющим эффектом. Несолеобразующий оксид. При н.у. является бесцветным газом с приятным
сладковатым запахом и привкусом. В медицине применяется в больших концентрациях для ингаляционного наркоза.

Получают N2O разложением нитрата аммония при нагревании:
NH4NO3 → N2O + H2O
Оксид азота I разлагается на азот и кислород:
N2O → (t) N2 + O2
Оксид азота II — NO
Окись азота — NO. Несолеобразующий оксид. При н.у. бесцветный газ, на воздухе быстро окисляется до оксида азота IV.
Получение
В промышленных масштабах оксид азота II получают при каталитическом окислении аммиака.
NH3 + O2 → (t, кат) NO + H2O
В лабораторных условиях — в ходе реакции малоактивных металлов с разбавленной азотной кислотой.
Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
Химические свойства
На воздухе быстро окисляется с образованием бурого газа — оксида азота IV — NO2.
NO + O2 → NO2

Оксид азота III — N2O3
При н.у. жидкость синего цвета, в газообразной форме бесцветен. Высокотоксичный, приводит к тяжелым ожогам кожи.

Получение
Получают N2O3 в две стадии: сначала реакцией оксида мышьяка III с азотной кислотой (две реакции, в которых образуется смесь оксидов азота), затем
охлаждением полученной смеси газов до температуры — 36 °C.
As2O3 + HNO3 + H2O → H3AsO4 + NO↑
As2O3 + HNO3 + H2O → H3AsO4 + NO2↑
При охлаждении газов образуется оксид азота III.
NO + NO2 → N2O3
Химические свойства
Является кислотным оксидом. соответствует азотистой кислоте — HNO2, соли которой называются нитриты (NO2—).
Реагирует с водой, основаниями.
H2O + N2O3 → HNO2
NaOH + N2O3 → NaNO2 + H2O
Оксид азота IV — NO2
Бурый газ, имеет острый запах. Ядовит.

Получение
В лабораторных условиях данный оксид получают в ходе реакции меди с концентрированной азотной кислотой. Также NO2 выделяется при
разложении нитратов.
Cu + HNO3(конц) → Cu(NO3)2 + NO2 + H2O

Cu(NO3)2 → (t) CuO + NO2 + O2
Pb(NO3)2 → (t) PbO + NO2 + O2
Химические свойства
Проявляет высокую химическую активность, кислотный оксид.
- Окислительные свойства
- Реакции с водой и щелочами
Как окислитель NO2 ведет себя в реакциях с фосфором, углеродом и серой, которые сгорают в нем.
NO2 + C → CO2 + N2
NO2 + P → P2O5 + N2
Окисляет SO2 в SO3 — на этой реакции основана одна из стадий получения серной кислоты.
SO2 + NO2 → SO3 + NO
Оксид азота IV соответствует сразу двум кислотам — азотистой HNO2 и азотной HNO3. Реакции с
водой и щелочами протекают по одной схеме.
NO2 + H2O → HNO3 + HNO2
NO2 + LiOH → LiNO3 + LiNO2 + H2O
Если растворение в воде оксида проводить в избытке кислорода, образуется азотная кислота.
NO2 + H2O + O2 → HNO3

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.