Большинство органических соединений имеют молекулярное строение. Атомы в веществах с молекулярным типом строения всегда образуют только ковалентные связи друг с другом, что наблюдается и в случае органических соединений. Напомним, что ковалентным называется такой вид связи между атомами, который реализуется за счет того, что атомы обобществляют часть своих внешних электронов с целью приобретения электронной конфигурации благородного газа.
По количеству обобществлённых электронных пар ковалентные связи в органических веществах можно разделить на одинарные, двойные и тройные. Обозначаются данные типы связей в графической формуле соответственно одной, двумя или тремя чертами:
Кратность связи приводит к уменьшении ее длины, так одинарная С-С связь имеет длину 0,154 нм, двойная С=С связь – 0,134 нм, тройная С≡С связь – 0,120 нм.
Типы связей по способу перекрывания орбиталей
Как известно, орбитали могут иметь различную форму, так, например, s-орбитали имеют сферическую, а p-гантелеобразную форму. По этой причине связи также могут отличаться по способу перекрывания электронных орбиталей:
• ϭ-связи – образуются при перекрывании орбиталей таким образом, что область их перекрывания пересекается линией, соединяющей ядра. Примеры ϭ-связей:
• π-связи – образуются при перекрывании орбиталей, в двух областях – над и под линией соединяющей ядра атомов. Примеры π-связей:
Как узнать, когда в молекуле есть π- и ϭ-связи?
При ковалентном типе связи ϭ-связь между любыми двумя атомами есть всегда, а π-связь имеет только в случае кратных (двойных, тройных) связей. При этом:
- Одинарная связь – всегда является ϭ-связью
- Двойная связь всегда состоит из одной ϭ- и одной π-связи
- Тройная связь всегда образована одной ϭ- и двумя π-связями.
Укажем данные типы связей в молекуле бутин-3-овой кислоты:
Гибридизация орбиталей атома углерода
Гибридизацией орбиталей называют процесс, при котором орбитали, изначально имеющие разные формы и энергии смешиваются, образуя взамен такое же количество гибридных орбиталей, равных по форме и энергии.
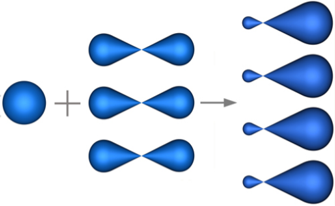
Так, например, при смешении одной s- и трех p-орбиталей образуются четыре sp3-гибридных орбитали:
В случае атомов углерода в гибридизации всегда принимает участие s-орбиталь, а количество p-орбиталей, которые могут принимать участие в гибридизации варьируется от одной до трех p-орбиталей.
Как определить тип гибридизации атома углерода в органической молекуле?
В зависимости от того, со скольким числом других атомов связан какой-либо атом углерода, он находится либо в состоянии sp3, либо в состоянии sp2, либо в состоянии sp-гибридизации:
| Количество атомов, с которыми связан атом углерода | Тип гибридизации атома углерода | Примеры веществ |
| 4 атома | sp3 | CH4 – метан |
| 3 атома | sp2 | H2C=CH2 – этилен |
| 2 атома | sp | HC≡CH — ацетилен |
Потренируемся определять тип гибридизации атомов углерода на примере следующей органической молекулы:
- Первый атом углерода связан с двумя другими атомами (1H и 1C), значит он находится в состоянии sp-гибридизации.
- Второй атом углерода связан с двумя атомами – sp-гибридизация
- Третий атом углерода связан с четырьмя другими атомами (два С и два Н) – sp3-гибридизация
- Четвертый атом углерода связан с тремя другими атомами (2О и 1С) – sp2-гибридизация.
Радикал. Функциональная группа
Под термином радикал, чаще всего подразумевают углеводородный радикал, являющийся остатком молекулы какого-либо углеводорода без одного атома водорода.
Название углеводородного радикала формируется, исходя из названия соответствующего ему углеводорода заменой суффикса –ан на суффикс –ил.
| Формула углеводорода | Название углеводорода | Формула радикала | Название радикала |
| CH4 | метан | -CH3 | метил |
| C2H6 | этан | -С2Н5 | этил |
| C3H8 | пропан | -С3Н7 | пропил |
| СnН2n+2 | …ан | -СnН2n+1 | … ил |
Функциональная группа — структурный фрагмент органической молекулы (некоторая группа атомов), который отвечает за её конкретные химические свойства.
В зависимости того, какая из функциональных групп в молекуле вещества является старшей, соединение относят к тому или иному классу.
R – обозначение углеводородного заместителя (радикала).
Радикалы могут содержать кратные связи, которые тоже можно рассматривать как функциональные группы, поскольку кратные связи вносят вклад в химические свойства вещества.
Если в молекуле органического вещества содержится две или более функциональных группы, такие соединения называют полифункциональными.
Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Типы связей в молекулах органических веществ
Одна из характеристик химических связей — тип перекрывания орбиталей атомов в молекуле.
По характеру перекрывания различают σ-(сигма) и π‑(пи) связи.
σ-Связь — это связь, в которой перекрывание орбиталей происходит вдоль оси, соединяющей ядра атомов.
σ-Связь может быть образована любыми типами орбиталей (s, p, d, гибридизованными).
σ-Связь — это основная связь в молекуле, которая преимущественно образуется между атомами.
Между двумя атомами возможна только одна σ-связь.
Виды σ-связей
π-Связь — это связь, в которой перекрывание орбиталей происходит в плоскости, перпендикулярной оси, соединяющей ядра атомов, сверху и снизу от оси связи.
π-Связь образуется при перекрывании только р- (или d) орбиталей, перпендикулярных линии связи и параллельных друг другу.
π-Связь является дополнительной к σ-связи, она менее прочная и легче разрывается при химических реакциях.
| Одинарная связь
С–С, С–Н, С–О |
Двойная связь
С=С, С=О |
Тройная связь
С≡С, С≡N |
| σ-связь | σ-связь + π-связь | σ-связь + две π-связи |
Гибридизация атомных орбиталей углерода
Электронная формула атома углерода в основном состоянии:
+6С 1s22s22p2
+6С 1s 2s
2p
В возбужденном состоянии: один электрон переходит с 2s-подуровня на 2р-подуровень.
+6С* 1s22s12p3
+6С* 1s2 2s1
2p3
Таким образом, в возбужденном состоянии углерод содержит четыре неспаренных электрона, может образовать четыре химические связи и проявляет валентность IV в соединениях.
При образовании четырех химических связей атомом углерода происходит гибридизация атомных орбиталей.
Гибридизация атомных орбиталей — это выравнивание электронной плотности атомных орбиталей разного типа с образованием новых, молекулярных орбиталей, форма и энергия которых одинаковы.
В гибридизацию вступают атомные орбитали с небольшой разницей в энергии (как правило, орбитали одного энергетического уровня). В зависимости от числа и типа орбиталей, участвующих в гибридизации, для атома углерода возможны sp3, sp2 и sp-гибридизация.
sp3-Гибридизация
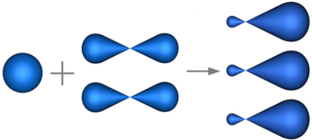
В sp3-гибридизацию вступают одна s-орбиталь и три p-орбитали. При этом образуются четыре sp3-гибридные орбитали:
Изображение с портала orgchem.ru
Четыре sp3-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в состоянии sp3-гибридизации направлены в пространстве под углом 109о 28’ друг к другу, что соответствует тетраэдрическому строению.
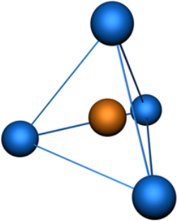
Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода. Валентный угол Н–С–Н в метане равен 109о 28’
Молекулам линейных алканов с большим числом атомов углерода соответствует зигзагообразное расположение атомов углерода.
Например, пространственное строение н-бутана
sp2-Гибридизация
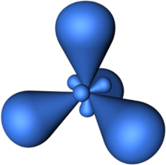
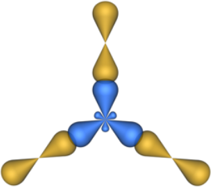
В sp2-гибридизацию вступают одна s-орбиталь и две p-орбитали. Одна p-орбиталь не гибридизуется:
Три sp2-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому три sp2-гибридные орбитали атома углерода направлены в пространстве под углом 120о друг к другу, что соответствует плоскому строению (треугольник).
При этом негибридная р-орбиталь располагается перпендикулярно плоскости, в которой расположены три гибридные sp2— орбитали.
Изображение с портала orgchem.ru
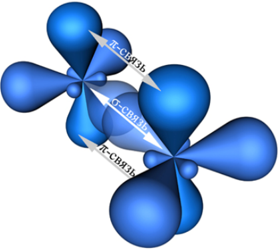
Например, молекула этилена C2H4 имеет плоское строение. Сигма-связь между атомами углерода образуется за счет перекрывания sp2-гибридных орбиталей. Пи-связь между атомами углерода образуется за счет перекрывания негибридных р-орбиталей.
Модель молекулы этилена:
sp-Гибридизация
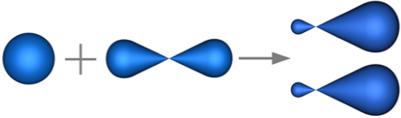
В sp-гибридизацию вступают одна s-орбиталь и одна p-орбиталь. Две p-орбитали не вступают в гибридизацию:
Две sp-гибридные орбитали атома углерода направлены в пространстве под углом 180о друг к другу, что соответствует линейному строению.
Изображение с портала orgchem.ru
При этом две р-орбитали располагаются перпендикулярно друг другу и перпендикулярно линии, на которой расположены гибридные орбитали.
Например, молекула ацетилена имеет линейное строение.
Гомология
Гомологи́ческий ряд — ряд химических соединений одного структурного типа (например, алканы или алифатические спирты — спирты жирного ряда), отличающихся друг от друга по составу на определенное число повторяющихся структурных единиц — так называемую гомологическую разность. Гомо́логи — вещества, входящие в один и тот же гомологический ряд.
Простейший пример гомологического ряда — алканы (общая формула СnH2n+2): метан CH4, этан C2H6, пропан С3H8 и т. д.; гомологической разностью этого ряда является метиленовое звено —СН2—.
То есть каждый класс имеет гомологический ряд и все вещества в этом ряду будут является гомологами друг другу.
Гибридизация
Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам.
sp3 — Гибридизация — гибридизация, в которой участвуют атомные орбитали одного s— и трех p—электронов
Четыре sp3—гибридные орбитали симметрично ориентированны в пространстве под углом 109°28′ (рис. 2).
Пространственная конфигурация молекулы, центральный атом которой образован sp3 —гибридными орбиталями —тетраэдр.
Тетраэдрическая пространственная конфигурация молекулы, центральный атом которой образован sp3—гибридными орбиталями
Однако не всегда пространственная конфигурация молекулы соответствует тетраэдру, это зависит от числа атомов в молекуле. Рассмотрим подобный случай на примере молекул воды и аммиака. NH3. Валентность атома азота — III, его пять электронов внешнего уровня занимают четыре орбитали, значит, тип гибридизации — sp3, но только три орбитали принимают участие в образовании химической связи. Тетраэдр без одной вершины превращается в пирамиду. Поэтому у молекулы аммиака форма молекулы пирамидальная, угол связи искажается до 107°30′. Аналогичные рассуждения о строении молекулы воды (H2O) приводят нас к тому, что кислород находится в sp3 гибридном состоянии, а форма молекулы — угловая, угол связи составляет 104°27′.
представлена модель молекулы метана (CH4), в которой атом углерода подвергается sp3—гибридизации.
sp2—Гибридизация — гибридизация, в которой участвуют атомные орбитали одного s— и двух p—электронов
В результате гибридизации образуются три гибридные sp2 орбитали, расположенные в одной плоскости под углом 120° друг к другу
Пространственная конфигурация молекулы, центральный атом которой включает в себя sp2—гибридные орбитали, представлена на рисунке:
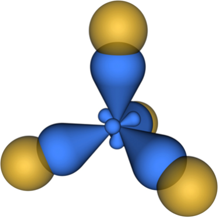
Этот тип гибридизации наблюдается, например в молекуле BCl3.
Модель этой молекулы изображена на рисунке:
Модель молекулы BCl3
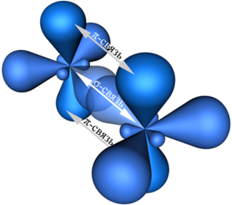
Примеры соединений, в которых наблюдается sp2—гибридизация: SO3, BCl3, BF3, AlCl3, CO32-, NO3—. Кроме того, sp2—гибридизация характерна для всех этиленовых углеводородов (алкенов) (общая формула CnH2n), карбоновых кислот и ароматических углеводородов (аренов) и других органических соединений: C2H4 (этилен), C4H8, C6H12, C6H6 (бензол), C8H10, C9H12, CH3COOH, C6H5OH (фенол), СH2O (формальдегид), C5H9NO4 (глутаминовая кислота) и др. Атомы углерода, находящиеся во втором валентном состоянии (sp2—гибридизация) связаны друг с другом двойными химическими связями. При sp2—гибридизации атом углерода образует три σ—связи и одну π—связь с соседними атомами углерода представлена на рисунке:
sp — Гибридизация (линейная)
Одна s— и одна р—орбиталь смешиваются, образуя две равноценные sp—орбитали, расположенные под углом 180°, т.е. на одной оси.
Гибридные sp—орбитали участвуют в образовании двух s—связей. Две р—орбитали не гибридизованы и расположены во взаимно перпендикулярных плоскостях.
p—Орбитали образуют в соединениях две p—связи.
Для простоты изображения пространственного строения sp—атома обычно рисуют р—орбитали в форме электронных облаков, а гибридные орбитали изображают прямыми линиями.
Углерод в sp—гибридном состоянии присутствует:
-
в соединениях с тройной связью
в соединениях типа R2C=C=CR2.
в условии
в решении
в тексте к заданию
в атрибутах
Категория:
Атрибут:
Всего: 90 1–20 | 21–40 | 41–60 | 61–80 | 81–90
Добавить в вариант
Задания Д19 № 308
Для предельных одноатомных спиртов характерна(-о):
1) sр3-гибридизация атомов углерода
2) наличие водородных связей между молекулами
3) взаимодействие с гидроксидом меди (II)
4) реакция гидрирования
5) реакция полимеризации
6) реакция этерификации
Задания Д18 № 350
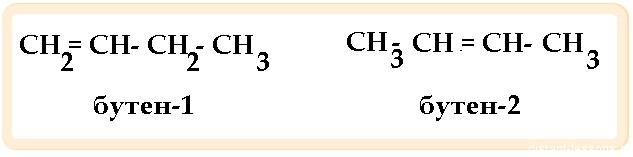
Для бутина-1 справедливы утверждения:
1) молекула содержит одну сигма-связь
2) вступает в реакции галогенирования
3) обесцвечивает раствор перманганата калия
4) все атомы углерода находятся в состоянии sр2-гибридизации
5) является изомером бутадиена-1,3
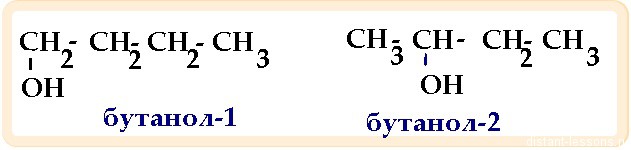
6) при гидратации в присутствии солей ртути (II) образует бутанол-1
Задания Д19 № 480
И для этиленгликоля, и для глицерина характерна(-о):
1) sp-гибридизация атомов углерода
2) хорошая растворимость в воде
3) образование водородных связей с молекулами воды
4) взаимодействие с гидроксидом меди (II)
5) обесцвечивание бромной воды
6) взаимодействие с водородом
Задания Д18 № 608
Для бутина-1 справедливы утверждения:
1) молекула содержит две -связи
2) реагирует с аммиачным раствором оксида серебра
3) взаимодействует с раствором перманганата калия
4) все атомы углерода находятся в состоянии sp-гибридизации
5) не является изомером дивинила
6) при гидратации в присутствии солей ртути (II) образует бутаналь
Задания Д19 № 609
Для метилового спирта характерна(-о):
1) sр3-гибридизация атома углерода
2) плохая растворимость в воде
3) взаимодействие с медью
4) взаимодействие с водородом
5) реакция этерификации
6) реакция с оксидом меди (II)
Задания Д13 № 630
Атом углерода функциональной группы пропановой кислоты находится в состоянии гибридизации
1)
2)
3)
4)
Задания Д19 № 652
И для глицерина и для этилового спирта характерна(-о):
1) sp3-гибридизация атомов углерода
2) плохая растворимость в воде
3) наличие водородных связей между молекулами
4) возможность окисления перманганатом калия
5) взаимодействие с бромной водой
6) взаимодействие с свежеосажденным гидроксидом меди (II)
Задания Д13 № 716
В карбонильной группе атом углерода находится в состоянии гибридизации
1)
2)
3)
4)
Задания Д18 № 737
Для метилциклопентана справедливы утверждения:
1) является изомером гексана
2) может вступать в реакцию галогенирования на свету
3) может вступать в реакцию полимеризации
4) является изомером гексена-2
5) все атомы находятся в состоянии sp3-гибридизации
6) обесцвечивает водный раствор перманганата калия
Задания Д19 № 781
Для фенола характерна(-о):
1) sр2-гибридизация атомов углерода
2) двойная связь между углеродом и кислородом
3) реакция с гидроксидом натрия
4) реакция с бромоводородом
5) взаимодействие с формальдегидом
6) взаимодействие с углекислым газом
Задания Д18 № 823
Для метилциклогексана справедливы утверждения:
1) при нагревании с катализатором образует толуол
2) способен к реакциям дегидрирования
3) взаимодействует с хлором
4) все атомы углерода находятся в состоянии -гибридизации
5) является изомером гексана
6) не окисляется кислородом
Задания Д19 № 953
Для фенола характерна(-о):
1) sp2-гибридизация атомов углерода
2) жидкое агрегатное состояние (н. у.)
3) реакция с бромом
4) реакция гидрогалогенирования
5) взаимодействие с формальдегидом
6) взаимодействие с углекислым газом
Для фенола характерна(-о):
1) sp2-гибридизация атомов углерода
2) газообразное агрегатное состояние (н. у.)
3) реакция с азотной кислотой
4) реакция гидрогалогенирования
5) взаимодействие с гидроксидом натрия
6) взаимодействие с метаном
Для циклогексана справедливы утверждения:
1) при нагревании с катализатором образует толуол
2) реакция гидрирования протекает довольно легко
3) взаимодействует с бромом
4) все атомы углерода находятся в состоянии sp3-гибридизации
5) является изомером гексана
6) молекула не является плоской
Для фенола характерна(-о):
1) sp2-гибридизация атомов углерода
2) хорошая растворимость в воде
3) реакция с хлором
4) реакция гидратации
5) взаимодействие с гидроксидом калия
6) взаимодействие с метаном
И для ацетилена, и для толуола характерна(-о):
1) реакция полимеризации
2) sp2-гибридизация атомов углерода в молекуле
3) окисление перманганатом калия
4) реакция галогенирования
5) наличие — и
-связей в молекулах
6) высокая растворимость в воде
Для бутина-1 справедливы утверждения:
1) молекула содержит одну -связь
2) способен к реакции гидрирования
3) взаимодействует с бромной водой
4) все атомы углерода находятся в состоянии sр2-гибридизации
5) является изомером дивинила
6) при гидратации в присутствии солей ртути (II) образует бутаналь
Для фенола характерна(-о):
1) sp2-гибридизация атомов углерода
2) хорошая растворимость в воде
3) реакция с хлором
4) реакция дегидратации
5) взаимодействие с гидроксидом натрия
6) взаимодействие с бензолом
Для циклопентана справедливы утверждения:
1) является газообразным веществом
2) не вступает в реакцию разложения
3) взаимодействует с хлором
4) является изомером пентена-1
5) все атомы углерода находятся в состоянии sp2-гибридизации
6) не растворим в воде
Для пропаналя характерна(-о):
1) sр-гибридизация атомов углерода
2) изменение окраски индикатора
3) восстановительные свойства
4) взаимодействие с гидроксидом меди (II)
5) взаимодействие с аммиачным раствором оксида серебра (I)
6) взаимодействие с карбоновыми кислотами
Всего: 90 1–20 | 21–40 | 41–60 | 61–80 | 81–90
Гомология
Гомологи́ческий ряд — ряд химических соединений одного структурного типа (например, алканы или алифатические спирты — спирты жирного ряда), отличающихся друг от друга по составу на определенное число повторяющихся структурных единиц — так называемую гомологическую разность. Гомо́логи — вещества, входящие в один и тот же гомологический ряд.
Простейший пример гомологического ряда — алканы (общая формула СnH2n+2): метан CH4, этан C2H6, пропан С3H8 и т. д.; гомологической разностью этого ряда является метиленовое звено —СН2—.
То есть каждый класс имеет гомологический ряд и все вещества в этом ряду будут является гомологами друг другу.
Гибридизация
Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам.
sp3 — Гибридизация — гибридизация, в которой участвуют атомные орбитали одного s— и трех p—электронов
Четыре sp3—гибридные орбитали симметрично ориентированны в пространстве под углом 109°28′ (рис. 2).
Пространственная конфигурация молекулы, центральный атом которой образован sp3 —гибридными орбиталями —тетраэдр.
Тетраэдрическая пространственная конфигурация молекулы, центральный атом которой образован sp3—гибридными орбиталями
Однако не всегда пространственная конфигурация молекулы соответствует тетраэдру, это зависит от числа атомов в молекуле. Рассмотрим подобный случай на примере молекул воды и аммиака. NH3. Валентность атома азота — III, его пять электронов внешнего уровня занимают четыре орбитали, значит, тип гибридизации — sp3, но только три орбитали принимают участие в образовании химической связи. Тетраэдр без одной вершины превращается в пирамиду. Поэтому у молекулы аммиака форма молекулы пирамидальная, угол связи искажается до 107°30′. Аналогичные рассуждения о строении молекулы воды (H2O) приводят нас к тому, что кислород находится в sp3 гибридном состоянии, а форма молекулы — угловая, угол связи составляет 104°27′.
представлена модель молекулы метана (CH4), в которой атом углерода подвергается sp3—гибридизации.
sp2—Гибридизация — гибридизация, в которой участвуют атомные орбитали одного s— и двух p—электронов
В результате гибридизации образуются три гибридные sp2 орбитали, расположенные в одной плоскости под углом 120° друг к другу
Пространственная конфигурация молекулы, центральный атом которой включает в себя sp2—гибридные орбитали, представлена на рисунке:
Этот тип гибридизации наблюдается, например в молекуле BCl3.
Модель этой молекулы изображена на рисунке:
Модель молекулы BCl3
Примеры соединений, в которых наблюдается sp2—гибридизация: SO3, BCl3, BF3, AlCl3, CO32-, NO3—. Кроме того, sp2—гибридизация характерна для всех этиленовых углеводородов (алкенов) (общая формула CnH2n), карбоновых кислот и ароматических углеводородов (аренов) и других органических соединений: C2H4 (этилен), C4H8, C6H12, C6H6 (бензол), C8H10, C9H12, CH3COOH, C6H5OH (фенол), СH2O (формальдегид), C5H9NO4 (глутаминовая кислота) и др. Атомы углерода, находящиеся во втором валентном состоянии (sp2—гибридизация) связаны друг с другом двойными химическими связями. При sp2—гибридизации атом углерода образует три σ—связи и одну π—связь с соседними атомами углерода представлена на рисунке:
sp — Гибридизация (линейная)
Одна s— и одна р—орбиталь смешиваются, образуя две равноценные sp—орбитали, расположенные под углом 180°, т.е. на одной оси.
Гибридные sp—орбитали участвуют в образовании двух s—связей. Две р—орбитали не гибридизованы и расположены во взаимно перпендикулярных плоскостях.
p—Орбитали образуют в соединениях две p—связи.
Для простоты изображения пространственного строения sp—атома обычно рисуют р—орбитали в форме электронных облаков, а гибридные орбитали изображают прямыми линиями.
Углерод в sp—гибридном состоянии присутствует:
-
в соединениях с тройной связью $H{color{red}C} equiv {color{red}C}H, R{color{red}C} equiv {color{red}C} R, R{color{red}C}equiv {color{red}N} $
в соединениях типа R2C=C=CR2
Строение органических соединений
28-Май-2013 | комментария 2 | Лолита Окольнова
Вопрос A13 ЕГЭ по химии —
Теория строения органических соединений: гомология и изомерия. Взаимное влияние атомов в молекулах. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Темы, которые нужно знать:
- Номенклатура ИЮПАК
- Органическая химия
- Алканы
- Алкены
- Циклоалканы
- Алкины
- Алкадиены
- Бензол и его гомологи
Эти вопросы входят в анализ строения каждого класса веществ в органической химии, но в данном вопросе нам нужно свести все эти знания воедино. Давайте рассмотрим каждое определение, каждый пункт этого вопроса, исходя из знаний строения всех органических веществ.
Изомеры и гомологи
Не вдаваясь в сложные формулировки, давайте определим, что такое гомологи и изомеры.
Гомологи — относятся к одному классу веществ (например, алканы). Это значит, что у них:
- Одинаковая общая формула (на примере алканов — (СnH2n+2) и
- Схожие химические свойства, которые определяются одинаковым строением веществ.
- Гомологи отличаются друг от друга на одну или несколько -CH2— групп
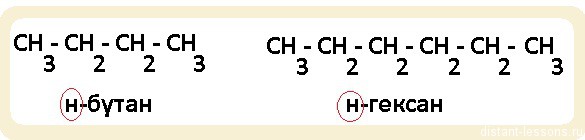
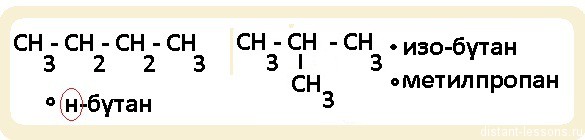
Обратите внимание, именно н-бутан и н-гексан будут относится к гомологам. Если мы возьмем н-алкан (линейная молекула) и разветвленный алкан, то, хотя у них будет одна и та же общая формула (СnH2n+2), по химическим свойствам они будут несколько различаться, т.к. разветвленное строение этих органических соединений будет оказывать влияние на направление протекания реакций.
Изомеры —химические соединения, одинаковые по составу и молекулярной массе, но различающиеся по строению и свойствам (химическим и физическим)
Виды изомерии:
- Структурная изомерия — (изомерия углеродного скелета)
- Межклассовая изомерия — характерна для соединений, имеющих одинаковую общую формулу, но принадлежащих к разным классам (и следовательно, иемющим разные химические и физические свойства)
- Изомерия положения кратной связи — вид изомерии, характерный для соединений с количеством атомов углерода больше 3-х и имеющих двойные или тройные связи:
- Изомерия положения функциональной группы -вид изомерии, характерный для кислород- и азотсодержащих органических соединений:
- Пространственная изомерия — в школьном курсе подготовки к ЕГЭ рассматривают пространственную цис-транс-изомерию алкенов. Этот вид изомерии характерен для симметричных относительно двойной связи алкенов:
Виды химической связи в органической химии
Т.к. органическая химия — это химия соединений углерода, то основным видом химической связи является ковалентная химическая связь.
- В углеводородах эта связь — ковалентная малополярная;
- В кислород-, азот- и серасодержащих органических соединениях — ковалентная полярная;
- В случаях алкоголятов или солей органических кислот — ионная (CH3COONa например).
Как и в неорганических соединениях, в органических вид химической связи определяют исходя из строения вещества.
Когда ковалентная связь -С-С- или -C-H разрывается, образуются частицы — радикалы. Это частицы, имеющие один электрон: (СH3• — метил ). Называют их соответственно классу соединения с окончанием -ил.
Тип гибридизации атомов в органических соединениях
Как образуется гибридизация атомных орбиталей в молекуле мы подробно рассматривали при изучении каждого класса органических соединений, здесь мы рассмотрим практическое применение этих знаний.
На что нужно обратить внимание:
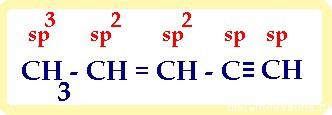
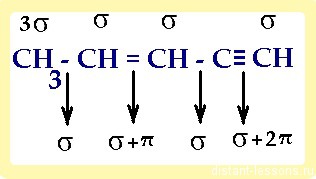
1) в молекуле, имеющей не только один вид связи, каждый атом имеет свой тип гибридизации:
2) если нужно посчитать суммы s -и π-связей, то нужно учитывать не только связи -С-С-, но и -С-H:
итого: 10 сигма- и 3 π-связей
Давайте систематизируем все эти вопросы по классам углеводородов
| Класс соединения | Общая формула | Тип гибридизации атомов С | Виды изомерии |
| Алканы | СnH2n+2 | Sp3 |
углеродного скелета |
| Алкены | СnH2n | Sp3 и Sp2 |
углеродного скелета положения кратной связи пространственная изомерия межклассовая |
| Алкины | СnH2n-2 | Sp и Sp3 |
углеродного скелета положения кратной связи межклассовая |
| Циклоалканы | СnH2n | Sp3 | углеродного скелета, межклассовая (циклоалкалканы изомерны алкенам) |
| Алкадиены | СnH2n-2 | Sp2 и Sp3 |
углеродного скелета положения кратной связи межклассовая |
| Бензол и его гомологи | СnH2n-6 | Sp2 и (Sp3 — в боковой цепи) | углеродного скелета (в боковых цепях) |
| Алифатические спирты | СnH2n+1OH | Sp3 | углеродного скелета положения функциональной группы межклассовая — (спирты изомерны простым эфирам) |
| Ароматические спирты | СnH2n-7OH | Sp2 и (Sp3 — в боковой цепи) |
углеродного скелета положения функциональной группы межклассовая |
| Простые эфиры | СnH2n+1O | Sp3 | углеродного скелетамежклассовая (простыеэфиры изомерны спиртам) |
| Альдегиды и кетоны | СnH2nO | Sp2 (-С=O) и Sp3 | углеродного скелета — альдегиды изомерны кетонам |
| Кислоты | СnH2n+1COOH | Sp2 (-С=O) и Sp3 |
углеродного скелета положения функциональной группы межклассовая |
| Сложные эфиры | СnH2n+1COO | Sp2 (-С=O) и Sp3 |
углеродного скелета межклассовая |
Какое бы задание вам не попалось, все сводится к определению строения органического соединения, поэтому чтобы не ошибиться, рисуйте структурные формулы данных соединений, а уже из этого вы определите и тип связи, и гибридизацию, и виды изомерии.
Кстати, ответы на наши примеры вопросов:
А13 первый вариант: изомером гексена-2 не является гексадиен-1, 3 Ответ: 4)
А 13 второй вариант: только Sp2 гибридизация — в молекуле бутадиена Ответ: 4)
А 13 третий вариант: гомологами являются: пропан и пентан Ответ: 1)
[TESTME 50]
Обсуждение: «Строение органических соединений»
(Правила комментирования)
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
ТИПЫ СВЯЗЕЙ
Связи между атомами углерода в органических цепях бывают одинарные, двойные и тройные.
СИГМА И ПИ-СВЯЗИ.
Сигма-связь – это связь, в которой перекрывание орбиталей происходит ВДОЛЬ ОСИ, соединяющей ядра атомов.
Может быть образована всеми типами орбиталей (s,p,d).
Основная связь в молекуле, они более прочные и образуют скелет молекулы.
Между двумя атомами в химической частице возможна только одна σ-связь.
Пи-связь – это связь, в которой перекрывание орбиталей происходит в плоскости, перпендикулярной оси, соединяющей ядра атомов, сверху и снизу от оси связи.
Пи-связь- дополнительная к сигма-связи, она менее прочная и легче разрывается при химических реакциях.
ГИБРИДИЗАЦИЯ
изменение формы электронных облаков
sp3 — гибридизация
sp3 — гибридизация
sp2 — гибридизация
sp-гибридизация
ЭЛЕКТРОННЫЕ ЭФФЕКТЫ ЗАМЕСТИТЕЛЕЙ
Нуклеофилы — анионы или молекулы, имеющие неподеленную пару с участками молекул, на которые сосредоточен эффективный положительный заряд.
Электрофилы — анионы или молекулы, имеющие неподеленую пару электронов, взаимодействующие с участками молекул, на которые сосредоточен эффективный отрицательный заряд.
Индуктивный эффект — смещение электронной плотности σ – связи, происходящие вследствии различия электроотрицательностей.
Заместители вызывают поляризацию не только «своей», но и соседних σ-связей. Этот вид передачи влияния атомов называют индуктивным эффектом (/-эффект).
Из-за слабой поляризуемости σ-связи индуктивный эффект затухает через три-четыре связи в цепи.
Его действие наиболее сильно проявляется по отношению к атому углерода, соседнему с тем, у которого находится заместитель.
Направление индуктивного эффекта заместителя оценивается сравнением с атомом водорода, индуктивный эффект которого принят за нуль.
Графически результат /-эффекта изображают стрелкой, совпадающей с положением валентной черточки и направленной острием в сторону более электроотрицательного атома.
Отрицательный индуктивный эффект (-/-эффект).Такие заместители в целом понижают электронную плотность системы, их называют электроноакцепторными. К ним относится большинство функциональных групп: OH, NH₂, COOH, NO₂ и катионных групп, например -NH₃⁺.
Положительный индуктивный эффект (+/-эффект). Заместитель, смещающий по сравнению с атомом водорода электронную плотность σ-связи в сторону атома углерода цепи, проявляет положительный индуктивный эффект (+/-эффект).Такие заместители повышают электронную плотность в цепи (или кольце) и называются электронодонорными. К их числу относятся алкильные группы, находящиеся у sр2-гибридизированного атома углерода, и анионные центры в заряженных частицах, например -О-.
Мезомерный эффект — смещение электронной плотности в сопряженных системах с участием π-связей или неподеленных электронных пар
Заместитель, повышающий электронную плотность в сопряженной системе, проявляет положительный мезомерный эффект (+М- эффект). +М-Эффектом обладают заместители, включающие атомы с неподеленной парой электронов (например, аминогруппа в молекуле анилина) или целым отрицательным зарядом.
Заместитель, понижающий электронную плотность в сопряженной системе, проявляет отрицательный мезомерный эффект (-М- эффект). -М-Эффектом в сопряженной системе обладают атомы кислорода или азота, связанные двойной связью с атомом углерода.
Смещение электронной плотности обозначается изогнутой стрелкой, начало которой показывает, какие электроны смещаются, а конец — связь или атом, к которым они смещаются.
Мезомерный эффект, в отличие от индуктивного, передается по системе сопряженных связей на значительно большее расстояние.
Тесты ЕГЭ ФИПИ 2015 по теме «Гибридизация электронных облаков»






















![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)







