Большинство органических соединений имеют молекулярное строение. Атомы в веществах с молекулярным типом строения всегда образуют только ковалентные связи друг с другом, что наблюдается и в случае органических соединений. Напомним, что ковалентным называется такой вид связи между атомами, который реализуется за счет того, что атомы обобществляют часть своих внешних электронов с целью приобретения электронной конфигурации благородного газа.
По количеству обобществлённых электронных пар ковалентные связи в органических веществах можно разделить на одинарные, двойные и тройные. Обозначаются данные типы связей в графической формуле соответственно одной, двумя или тремя чертами:
Кратность связи приводит к уменьшении ее длины, так одинарная С-С связь имеет длину 0,154 нм, двойная С=С связь – 0,134 нм, тройная С≡С связь – 0,120 нм.
Типы связей по способу перекрывания орбиталей
Как известно, орбитали могут иметь различную форму, так, например, s-орбитали имеют сферическую, а p-гантелеобразную форму. По этой причине связи также могут отличаться по способу перекрывания электронных орбиталей:
• ϭ-связи – образуются при перекрывании орбиталей таким образом, что область их перекрывания пересекается линией, соединяющей ядра. Примеры ϭ-связей:
• π-связи – образуются при перекрывании орбиталей, в двух областях – над и под линией соединяющей ядра атомов. Примеры π-связей:
Как узнать, когда в молекуле есть π- и ϭ-связи?
При ковалентном типе связи ϭ-связь между любыми двумя атомами есть всегда, а π-связь имеет только в случае кратных (двойных, тройных) связей. При этом:
- Одинарная связь – всегда является ϭ-связью
- Двойная связь всегда состоит из одной ϭ- и одной π-связи
- Тройная связь всегда образована одной ϭ- и двумя π-связями.
Укажем данные типы связей в молекуле бутин-3-овой кислоты:
Гибридизация орбиталей атома углерода
Гибридизацией орбиталей называют процесс, при котором орбитали, изначально имеющие разные формы и энергии смешиваются, образуя взамен такое же количество гибридных орбиталей, равных по форме и энергии.
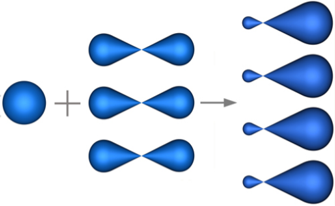
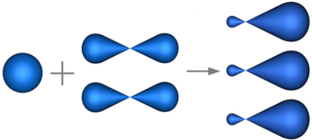
Так, например, при смешении одной s- и трех p-орбиталей образуются четыре sp3-гибридных орбитали:
В случае атомов углерода в гибридизации всегда принимает участие s-орбиталь, а количество p-орбиталей, которые могут принимать участие в гибридизации варьируется от одной до трех p-орбиталей.
Как определить тип гибридизации атома углерода в органической молекуле?
В зависимости от того, со скольким числом других атомов связан какой-либо атом углерода, он находится либо в состоянии sp3, либо в состоянии sp2, либо в состоянии sp-гибридизации:
| Количество атомов, с которыми связан атом углерода | Тип гибридизации атома углерода | Примеры веществ |
| 4 атома | sp3 | CH4 – метан |
| 3 атома | sp2 | H2C=CH2 – этилен |
| 2 атома | sp | HC≡CH — ацетилен |
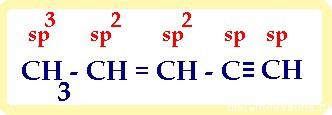
Потренируемся определять тип гибридизации атомов углерода на примере следующей органической молекулы:
- Первый атом углерода связан с двумя другими атомами (1H и 1C), значит он находится в состоянии sp-гибридизации.
- Второй атом углерода связан с двумя атомами – sp-гибридизация
- Третий атом углерода связан с четырьмя другими атомами (два С и два Н) – sp3-гибридизация
- Четвертый атом углерода связан с тремя другими атомами (2О и 1С) – sp2-гибридизация.
Радикал. Функциональная группа
Под термином радикал, чаще всего подразумевают углеводородный радикал, являющийся остатком молекулы какого-либо углеводорода без одного атома водорода.
Название углеводородного радикала формируется, исходя из названия соответствующего ему углеводорода заменой суффикса –ан на суффикс –ил.
| Формула углеводорода | Название углеводорода | Формула радикала | Название радикала |
| CH4 | метан | -CH3 | метил |
| C2H6 | этан | -С2Н5 | этил |
| C3H8 | пропан | -С3Н7 | пропил |
| СnН2n+2 | …ан | -СnН2n+1 | … ил |
Функциональная группа — структурный фрагмент органической молекулы (некоторая группа атомов), который отвечает за её конкретные химические свойства.
В зависимости того, какая из функциональных групп в молекуле вещества является старшей, соединение относят к тому или иному классу.
R – обозначение углеводородного заместителя (радикала).
Радикалы могут содержать кратные связи, которые тоже можно рассматривать как функциональные группы, поскольку кратные связи вносят вклад в химические свойства вещества.
Если в молекуле органического вещества содержится две или более функциональных группы, такие соединения называют полифункциональными.
Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Типы связей в молекулах органических веществ
Одна из характеристик химических связей — тип перекрывания орбиталей атомов в молекуле.
По характеру перекрывания различают σ-(сигма) и π‑(пи) связи.
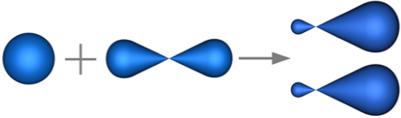
σ-Связь — это связь, в которой перекрывание орбиталей происходит вдоль оси, соединяющей ядра атомов.
σ-Связь может быть образована любыми типами орбиталей (s, p, d, гибридизованными).
σ-Связь — это основная связь в молекуле, которая преимущественно образуется между атомами.
Между двумя атомами возможна только одна σ-связь.
Виды σ-связей
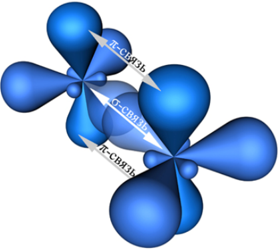
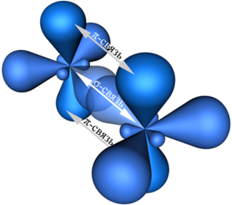
π-Связь — это связь, в которой перекрывание орбиталей происходит в плоскости, перпендикулярной оси, соединяющей ядра атомов, сверху и снизу от оси связи.
π-Связь образуется при перекрывании только р- (или d) орбиталей, перпендикулярных линии связи и параллельных друг другу.
π-Связь является дополнительной к σ-связи, она менее прочная и легче разрывается при химических реакциях.
| Одинарная связь
С–С, С–Н, С–О |
Двойная связь
С=С, С=О |
Тройная связь
С≡С, С≡N |
| σ-связь | σ-связь + π-связь | σ-связь + две π-связи |
Гибридизация атомных орбиталей углерода
Электронная формула атома углерода в основном состоянии:
+6С 1s22s22p2
+6С 1s 2s
2p
В возбужденном состоянии: один электрон переходит с 2s-подуровня на 2р-подуровень.
+6С* 1s22s12p3
+6С* 1s2 2s1
2p3
Таким образом, в возбужденном состоянии углерод содержит четыре неспаренных электрона, может образовать четыре химические связи и проявляет валентность IV в соединениях.
При образовании четырех химических связей атомом углерода происходит гибридизация атомных орбиталей.
Гибридизация атомных орбиталей — это выравнивание электронной плотности атомных орбиталей разного типа с образованием новых, молекулярных орбиталей, форма и энергия которых одинаковы.
В гибридизацию вступают атомные орбитали с небольшой разницей в энергии (как правило, орбитали одного энергетического уровня). В зависимости от числа и типа орбиталей, участвующих в гибридизации, для атома углерода возможны sp3, sp2 и sp-гибридизация.
sp3-Гибридизация
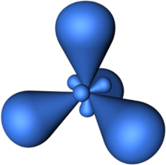
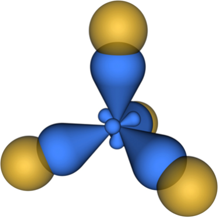
В sp3-гибридизацию вступают одна s-орбиталь и три p-орбитали. При этом образуются четыре sp3-гибридные орбитали:
Изображение с портала orgchem.ru
Четыре sp3-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
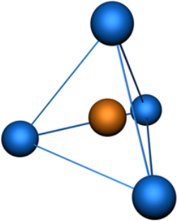
Поэтому четыре гибридные орбитали углерода в состоянии sp3-гибридизации направлены в пространстве под углом 109о 28’ друг к другу, что соответствует тетраэдрическому строению.
Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода. Валентный угол Н–С–Н в метане равен 109о 28’
Молекулам линейных алканов с большим числом атомов углерода соответствует зигзагообразное расположение атомов углерода.
Например, пространственное строение н-бутана
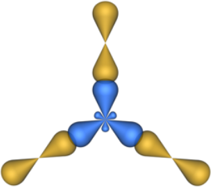
sp2-Гибридизация
В sp2-гибридизацию вступают одна s-орбиталь и две p-орбитали. Одна p-орбиталь не гибридизуется:
Три sp2-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому три sp2-гибридные орбитали атома углерода направлены в пространстве под углом 120о друг к другу, что соответствует плоскому строению (треугольник).
При этом негибридная р-орбиталь располагается перпендикулярно плоскости, в которой расположены три гибридные sp2— орбитали.
Изображение с портала orgchem.ru
Например, молекула этилена C2H4 имеет плоское строение. Сигма-связь между атомами углерода образуется за счет перекрывания sp2-гибридных орбиталей. Пи-связь между атомами углерода образуется за счет перекрывания негибридных р-орбиталей.
Модель молекулы этилена:
sp-Гибридизация
В sp-гибридизацию вступают одна s-орбиталь и одна p-орбиталь. Две p-орбитали не вступают в гибридизацию:
Две sp-гибридные орбитали атома углерода направлены в пространстве под углом 180о друг к другу, что соответствует линейному строению.
Изображение с портала orgchem.ru
При этом две р-орбитали располагаются перпендикулярно друг другу и перпендикулярно линии, на которой расположены гибридные орбитали.
Например, молекула ацетилена имеет линейное строение.
12 сентября 2022
В закладки
Обсудить
Жалоба
Памятка по органической химии
Таблица.
pm-h.doc
pm-h.pdf
Класс | Химические свойства | Способы получения
Алканы
Алкены
Алкины
Алкадиены
Арены
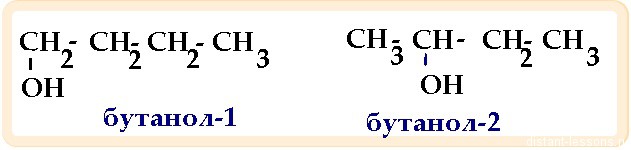
Предельные одноатомные спирты
Многоатомные спирты
Альдегиды
Предельные одноосновные карбоновые кислоты
Моносахариды
Дисахариды
Полисахариды
Амины
Аминокислоты
Белки
Автор: Столярова В.А.
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания,
берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта
готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием
сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом
администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта
и представлены на сайте исключительно для ознакомления. Авторские права на материалы
принадлежат их законным авторам. Частичное или полное копирование материалов сайта без
письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой
зрения авторов.
- Взрослым: Skillbox, Хекслет, Eduson, XYZ, GB, Яндекс, Otus, SkillFactory.
- 8-11 класс: Умскул, Лектариум, Годограф, Знанио.
- До 7 класса: Алгоритмика, Кодланд, Реботика.
- Английский: Инглекс, Puzzle, Novakid.
Связи в молекулах органических веществ и их типы. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа
Кратность химической связи – это количество химических связей между двумя атомам, образованными парами электронов. Химические связи, образованные несколькими электронными парами, называются кратными. Если в образовании связей между двумя атомами участвует только одна электронная пара, то такая связь называется одинарной. Если больше, то различают следующие виды:
- двойную связь;
- тройную связь;
- четырехкратную связь;
- пятикратную связь.
В органической химии также существуют соединения с двумя многократными связями.
Гомолитический и гетеролитический разрыв ковалентной химической связи
В органических соединениях существуют все типы химических связей: ионный, ковалентный, водородный. Почти все органические соединения состоят из молекул, атомы которых соединены ковалентной связью.
Ковалентная связь – это связь между атомами неметаллических элементов, которая образуется за счет общих электронных пар. При ковалентной связи образуется общая электронная пара, для которой каждый из атомов предоставляет по одному электрону.
Чтобы органические вещества вступали в реакцию друг с другом, необходимо разорвать атомные связи в молекулах.
Гомолитический разрыв ковалентной связи – это такой разрыв связи между атомами, где общая электронная пара равномерно распределяет электроны между двумя атомами (например, атомами углерода).
Образовавшиеся обломки, так называемые радикалы, содержат нечетные электроны, поэтому они очень активны и быстро вступают в реакции. Гомолитический разрыв происходит под воздействием света, обладающего большой энергией, в основном в газовой фазе или в неполярных растворителях.
Гетеролитический разрыв ковалентной связи – это такой разрыв связи между атомами, где валентные электроны переносятся на один из двух атомов (например, углерода) и образуются два иона с противоположными зарядами. Молекула расщепляется на один положительно заряженный карбкатион и один отрицательно заряженный карбанион. Гетеролитический разрыв связей происходит в основном в полярных растворителях.
Понятие о функциональной группе
Функциональная группа – это структурный фрагмент молекулы, обуславливающий её химические свойства и принадлежность к определенному классу органических веществ. Функциональная группа соединена с родоначальной структурой, то есть структурой, составляющей основу соединения: главную карбоновую цепь, цикл и т.п. Тип родоначальной структуры оказывает влияние на химическую активность функциональной группы.
Распространены такие функциональные группы:
гидроксильная (спирты и фенолы)
–ОH
С2Н5ОН (этанол), С6Н5ОН (фенол);
альдегидная (альдегиды)

карбоксильная (карбоновые кислоты)

аминогруппа (амины)
–NH2
C2H5-NH2 (этиламин, аминоэтан);
аминогруппа + карбоксил (аминокислоты)

галогены (галогенпроизводные)
–F, –Cl, –Br, –I
С2Н5Сl (хлороэтан).
sp³-, sp²-, sp-гибридизация орбиталей атомов углерода
Гибридизация орбиталей – это процесс смешивания атомных орбиталей определенного атома с образованием такого же количества новых гибридных орбиталей, которым присуща одинаковая форма и выраженная пространственная направленность. Гибридизация атомных орбиталей происходит, в частности, при возникновении ковалентной связи между атомами.
Для валентных орбиталей возбужденного атома углерода возможны три типа гибридизации.
sp-гибридизация представляет собой композицию одной s- и одной р-орбиталей, при которой появляются две sp-гибридизированные орбитали в форме неправильной восьмерки, симметрично расположенной под валентным углом 180°.
Валентный угол – это угол между осями связи – воображаемыми линиями, проходящими через ядра химически соединенных атомов.
Связи, образованные с участием электронов валентных орбиталей, также размещаются под углом 180°, что приводит к линейной форме молекулы. Такой тип гибридизации реализуется в молекулах углеводородов с тройными связями, например, в молекуле этина (старое название ацетилен) НС≡СН и его гомологов.
sp²-гибридизация – комбинация одной s- и двух р-орбиталей, при которой образовываются три sp²-гибридизированные связи, размещенные под углом 120°. Поэтому фрагмент молекулы, в котором связи образованы за счет sp²-гибридизированных орбиталей, принимает форму правильного треугольника. Например, возбужденный атом углерода С* (2s¹2p³) находится в состоянии sp²-гибридизации в молекуле этилена (Н₂С=СН₂) и в других органических соединениях, содержащих фрагменты цепи с двойными связями (С=С<).
Три гибридизированные орбитали каждого атома углерода образуют три связи: две с атомами водорода (С–Н) и одна с соседним атомом углерода (С–С), а негибридизированные р-орбитали образуют ещё одну дополнительную связь между атомами углерода.
Sp³-гибридизация
– комбинация четырех орбиталей (одной s- и трех р-), при которой четыре гибридизированные орбитали симметрично ориентированы в пространстве к четырем вершинам воображаемого тетраэдра, то есть под валентным углом 109°28`.
Такое размещение гибридизированных орбиталей центрального атома образовывает тетраэдрическую форму молекул. Это очень характерно для насыщенных соединений четырехвалентного углерода: СН₄, СCl₄, C₂H₆ и других алканов.
- Взрослым: Skillbox, Хекслет, Eduson, XYZ, GB, Яндекс, Otus, SkillFactory.
- 8-11 класс: Умскул, Лектариум, Годограф, Знанио.
- До 7 класса: Алгоритмика, Кодланд, Реботика.
- Английский: Инглекс, Puzzle, Novakid.
Строение органических соединений
28-Май-2013 | комментария 2 | Лолита Окольнова
Вопрос A13 ЕГЭ по химии —
Теория строения органических соединений: гомология и изомерия. Взаимное влияние атомов в молекулах. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Темы, которые нужно знать:
- Номенклатура ИЮПАК
- Органическая химия
- Алканы
- Алкены
- Циклоалканы
- Алкины
- Алкадиены
- Бензол и его гомологи
Эти вопросы входят в анализ строения каждого класса веществ в органической химии, но в данном вопросе нам нужно свести все эти знания воедино. Давайте рассмотрим каждое определение, каждый пункт этого вопроса, исходя из знаний строения всех органических веществ.
Изомеры и гомологи
Не вдаваясь в сложные формулировки, давайте определим, что такое гомологи и изомеры.
Гомологи — относятся к одному классу веществ (например, алканы). Это значит, что у них:
- Одинаковая общая формула (на примере алканов — (СnH2n+2) и
- Схожие химические свойства, которые определяются одинаковым строением веществ.
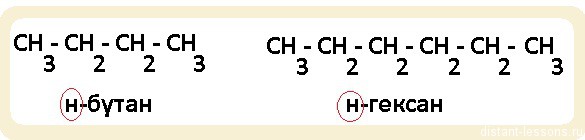
- Гомологи отличаются друг от друга на одну или несколько -CH2— групп
Обратите внимание, именно н-бутан и н-гексан будут относится к гомологам. Если мы возьмем н-алкан (линейная молекула) и разветвленный алкан, то, хотя у них будет одна и та же общая формула (СnH2n+2), по химическим свойствам они будут несколько различаться, т.к. разветвленное строение этих органических соединений будет оказывать влияние на направление протекания реакций.
Изомеры —химические соединения, одинаковые по составу и молекулярной массе, но различающиеся по строению и свойствам (химическим и физическим)
Виды изомерии:
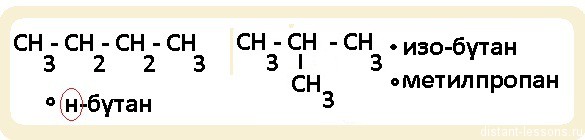
- Структурная изомерия — (изомерия углеродного скелета)
- Межклассовая изомерия — характерна для соединений, имеющих одинаковую общую формулу, но принадлежащих к разным классам (и следовательно, иемющим разные химические и физические свойства)
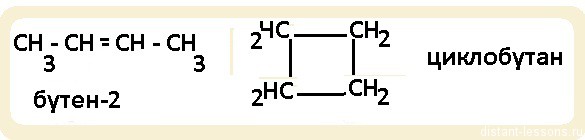
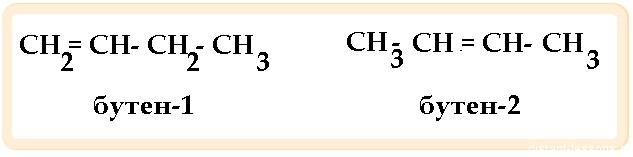
- Изомерия положения кратной связи — вид изомерии, характерный для соединений с количеством атомов углерода больше 3-х и имеющих двойные или тройные связи:
- Изомерия положения функциональной группы -вид изомерии, характерный для кислород- и азотсодержащих органических соединений:
- Пространственная изомерия — в школьном курсе подготовки к ЕГЭ рассматривают пространственную цис-транс-изомерию алкенов. Этот вид изомерии характерен для симметричных относительно двойной связи алкенов:
Виды химической связи в органической химии
Т.к. органическая химия — это химия соединений углерода, то основным видом химической связи является ковалентная химическая связь.
- В углеводородах эта связь — ковалентная малополярная;
- В кислород-, азот- и серасодержащих органических соединениях — ковалентная полярная;
- В случаях алкоголятов или солей органических кислот — ионная (CH3COONa например).
Как и в неорганических соединениях, в органических вид химической связи определяют исходя из строения вещества.
Когда ковалентная связь -С-С- или -C-H разрывается, образуются частицы — радикалы. Это частицы, имеющие один электрон: (СH3• — метил ). Называют их соответственно классу соединения с окончанием -ил.
Тип гибридизации атомов в органических соединениях
Как образуется гибридизация атомных орбиталей в молекуле мы подробно рассматривали при изучении каждого класса органических соединений, здесь мы рассмотрим практическое применение этих знаний.
На что нужно обратить внимание:
1) в молекуле, имеющей не только один вид связи, каждый атом имеет свой тип гибридизации:
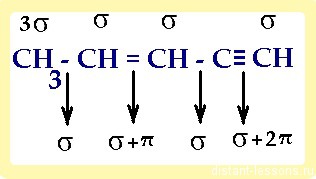
2) если нужно посчитать суммы s -и π-связей, то нужно учитывать не только связи -С-С-, но и -С-H:
итого: 10 сигма- и 3 π-связей
Давайте систематизируем все эти вопросы по классам углеводородов
| Класс соединения | Общая формула | Тип гибридизации атомов С | Виды изомерии |
| Алканы | СnH2n+2 | Sp3 |
углеродного скелета |
| Алкены | СnH2n | Sp3 и Sp2 |
углеродного скелета положения кратной связи пространственная изомерия межклассовая |
| Алкины | СnH2n-2 | Sp и Sp3 |
углеродного скелета положения кратной связи межклассовая |
| Циклоалканы | СnH2n | Sp3 | углеродного скелета, межклассовая (циклоалкалканы изомерны алкенам) |
| Алкадиены | СnH2n-2 | Sp2 и Sp3 |
углеродного скелета положения кратной связи межклассовая |
| Бензол и его гомологи | СnH2n-6 | Sp2 и (Sp3 — в боковой цепи) | углеродного скелета (в боковых цепях) |
| Алифатические спирты | СnH2n+1OH | Sp3 | углеродного скелета положения функциональной группы межклассовая — (спирты изомерны простым эфирам) |
| Ароматические спирты | СnH2n-7OH | Sp2 и (Sp3 — в боковой цепи) |
углеродного скелета положения функциональной группы межклассовая |
| Простые эфиры | СnH2n+1O | Sp3 | углеродного скелетамежклассовая (простыеэфиры изомерны спиртам) |
| Альдегиды и кетоны | СnH2nO | Sp2 (-С=O) и Sp3 | углеродного скелета — альдегиды изомерны кетонам |
| Кислоты | СnH2n+1COOH | Sp2 (-С=O) и Sp3 |
углеродного скелета положения функциональной группы межклассовая |
| Сложные эфиры | СnH2n+1COO | Sp2 (-С=O) и Sp3 |
углеродного скелета межклассовая |
Какое бы задание вам не попалось, все сводится к определению строения органического соединения, поэтому чтобы не ошибиться, рисуйте структурные формулы данных соединений, а уже из этого вы определите и тип связи, и гибридизацию, и виды изомерии.
Кстати, ответы на наши примеры вопросов:
А13 первый вариант: изомером гексена-2 не является гексадиен-1, 3 Ответ: 4)
А 13 второй вариант: только Sp2 гибридизация — в молекуле бутадиена Ответ: 4)
А 13 третий вариант: гомологами являются: пропан и пентан Ответ: 1)
[TESTME 50]
Обсуждение: «Строение органических соединений»
(Правила комментирования)
Гомология
Гомологи́ческий ряд — ряд химических соединений одного структурного типа (например, алканы или алифатические спирты — спирты жирного ряда), отличающихся друг от друга по составу на определенное число повторяющихся структурных единиц — так называемую гомологическую разность. Гомо́логи — вещества, входящие в один и тот же гомологический ряд.
Простейший пример гомологического ряда — алканы (общая формула СnH2n+2): метан CH4, этан C2H6, пропан С3H8 и т. д.; гомологической разностью этого ряда является метиленовое звено —СН2—.
То есть каждый класс имеет гомологический ряд и все вещества в этом ряду будут является гомологами друг другу.
Гибридизация
Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам.
sp3 — Гибридизация — гибридизация, в которой участвуют атомные орбитали одного s— и трех p—электронов
Четыре sp3—гибридные орбитали симметрично ориентированны в пространстве под углом 109°28′ (рис. 2).
Пространственная конфигурация молекулы, центральный атом которой образован sp3 —гибридными орбиталями —тетраэдр.
Тетраэдрическая пространственная конфигурация молекулы, центральный атом которой образован sp3—гибридными орбиталями
Однако не всегда пространственная конфигурация молекулы соответствует тетраэдру, это зависит от числа атомов в молекуле. Рассмотрим подобный случай на примере молекул воды и аммиака. NH3. Валентность атома азота — III, его пять электронов внешнего уровня занимают четыре орбитали, значит, тип гибридизации — sp3, но только три орбитали принимают участие в образовании химической связи. Тетраэдр без одной вершины превращается в пирамиду. Поэтому у молекулы аммиака форма молекулы пирамидальная, угол связи искажается до 107°30′. Аналогичные рассуждения о строении молекулы воды (H2O) приводят нас к тому, что кислород находится в sp3 гибридном состоянии, а форма молекулы — угловая, угол связи составляет 104°27′.
представлена модель молекулы метана (CH4), в которой атом углерода подвергается sp3—гибридизации.
sp2—Гибридизация — гибридизация, в которой участвуют атомные орбитали одного s— и двух p—электронов
В результате гибридизации образуются три гибридные sp2 орбитали, расположенные в одной плоскости под углом 120° друг к другу
Пространственная конфигурация молекулы, центральный атом которой включает в себя sp2—гибридные орбитали, представлена на рисунке:
Этот тип гибридизации наблюдается, например в молекуле BCl3.
Модель этой молекулы изображена на рисунке:
Модель молекулы BCl3
Примеры соединений, в которых наблюдается sp2—гибридизация: SO3, BCl3, BF3, AlCl3, CO32-, NO3—. Кроме того, sp2—гибридизация характерна для всех этиленовых углеводородов (алкенов) (общая формула CnH2n), карбоновых кислот и ароматических углеводородов (аренов) и других органических соединений: C2H4 (этилен), C4H8, C6H12, C6H6 (бензол), C8H10, C9H12, CH3COOH, C6H5OH (фенол), СH2O (формальдегид), C5H9NO4 (глутаминовая кислота) и др. Атомы углерода, находящиеся во втором валентном состоянии (sp2—гибридизация) связаны друг с другом двойными химическими связями. При sp2—гибридизации атом углерода образует три σ—связи и одну π—связь с соседними атомами углерода представлена на рисунке:
sp — Гибридизация (линейная)
Одна s— и одна р—орбиталь смешиваются, образуя две равноценные sp—орбитали, расположенные под углом 180°, т.е. на одной оси.
Гибридные sp—орбитали участвуют в образовании двух s—связей. Две р—орбитали не гибридизованы и расположены во взаимно перпендикулярных плоскостях.
p—Орбитали образуют в соединениях две p—связи.
Для простоты изображения пространственного строения sp—атома обычно рисуют р—орбитали в форме электронных облаков, а гибридные орбитали изображают прямыми линиями.
Углерод в sp—гибридном состоянии присутствует:
-
в соединениях с тройной связью
в соединениях типа R2C=C=CR2.