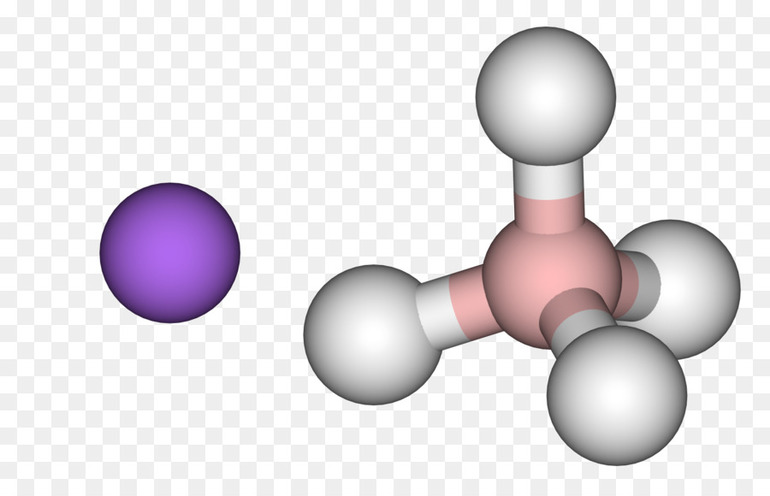
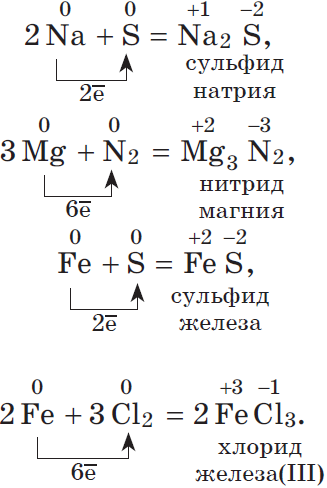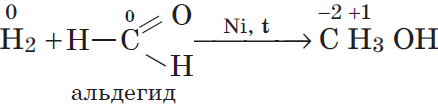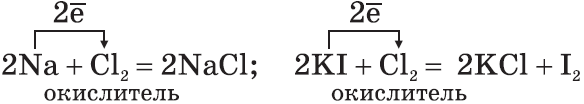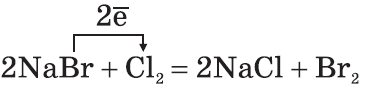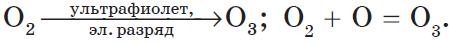1. Положение водорода в периодической системе химических элементов
2. Электронное строение водорода
3. Физические свойства
4. Способы получения
5. Химические свойства
5.1. Взаимодействие с простыми веществами
5.1.1. Взаимодействие с активными металлами
5.1.2. Взаимодействие с серой
5.1.3. Взаимодействие с кремнием
5.1.4. Взаимодействие с азотом
5.1.5. Взаимодействие с углеродом
5.2. Взаимодействие со сложными веществами
5.2.1. Взаимодействие с оксидами металлов
5.2.2. Взаимодействие с органическими веществами
6. Применение водорода
Водородные соединения металлов
1. Способы получения
2. Химические свойства
2.1. Взаимодействие с водой
2.2. Взаимодействие с кислотами
2.3. Взаимодействие с окислителями
Летучие водородные соединения
1. Строение молекулы и физические свойства
2. Способы получения силана
3. Способы получения аммиака
4. Способы получения фосфина
5. Способы получения сероводорода
6. Химические свойства силана
Водород
Положение в периодической системе химических элементов
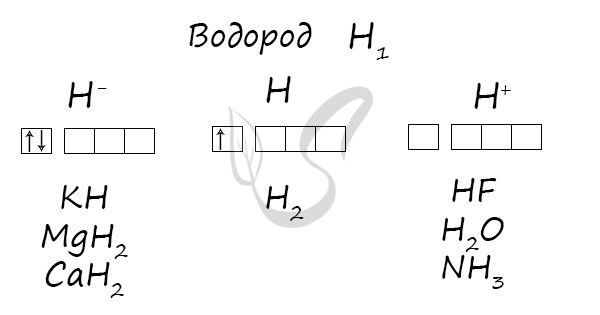
Водород расположен в главной подгруппе I группы и в первом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение водорода
Электронная конфигурация водорода в основном состоянии:
+1H 1s1 1s
Атом водорода содержит на внешнем энергетическом уровне один неспаренный электрон в основном энергетическом состоянии.
Степени окисления атома водорода — от -1 до +1. Характерные степени окисления -1, 0, +1.
Физические свойства
Водород – легкий газ без цвета, без запаха. Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью:
Н–Н
Соединения водорода
Основные степени окисления водорода +1, 0, -1.
Типичные соединения водорода:
| Степень окисления | Типичные соединения |
| +1 | кислоты H2SO4, H2S, HCl и др.
вода H2O и др. летучие водородные соединения (HCl, HBr) кислые соли (NaHCO3 и др.) основания NaOH, Cu(OH)2 основные соли (CuOH)2CO3 |
| -1 | гидриды металлов NaH, CaH2 и др. |
Способы получения
Еще один важный промышленный способ получения водорода — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
СН4 + Н2O → СО + 3Н2
Также возможна паровая конверсия угля:
C0 + H2+O → C+2O + H20
Химические свойства
1. Водород проявляет свойства окислителя и свойства восстановителя. Поэтому водород реагирует с металлами и неметаллами.
1.1. С активными металлами водород реагирует с образованием гидридов:
2Na + H2 → 2NaH
Ca + H2 → CaH2
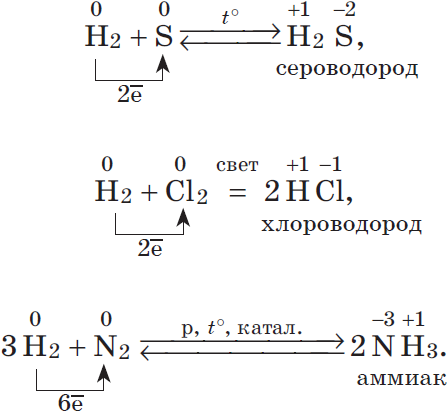
1.2. В специальных условиях водород реагирует с серой с образованием бинарного соединения сероводорода:
H2 + S → H2S
1.3. Водород не реагирует с кремнием.
1.4. С азотом водород реагирует при нагревании под давлением в присутствии катализатора с образованием аммиака:
3Н2 + N2 → 2NH3
1.5. В специальных условиях водород реагирует с углеродом.
C + 2H2 → CH4
1.6. Водород горит, взаимодействует с кислородом со взрывом:
2H2 + O2 → 2H2O
2. Водород взаимодействует со сложными веществами:
2.1. Восстанавливает металлы из основных и амфотерных оксидов. Восстановить из оксида водородом можно металлы, расположенные в электрохимическом ряду напряжений после алюминия. При этом образуются металл и вода.
Например, водород взаимодействует с оксидом цинка с образованием цинка и воды:
ZnO + H2 → Zn + H2O
Также водород восстанавливает медь из оксида меди:
СuO + H2 → Cu + H2O
Водород восстанавливает оксиды некоторых неметаллов.
Например, водород взаимодействует с оксидом азота (I):
N2O + H2 = N2 + H2O
2.2. С органическими веществами водород вступает в реакции присоединения (реакции гидрирования).
Применение водорода
Применение водорода основано на его физических и химических свойствах:
- как легкий газ, он используется для наполнения аэростатов (в смеси с гелием);
- кислородно-водородное пламя применяется для получения высоких температур при сварке металлов;
- как восстановитель используется для получения металлов (молибдена, вольфрама и др.) из их оксидов;
- водород используется для получения аммиака и искусственного жидкого топлива;
- получение твердых жиров (гидрогенизация).
Водородные соединения металлов
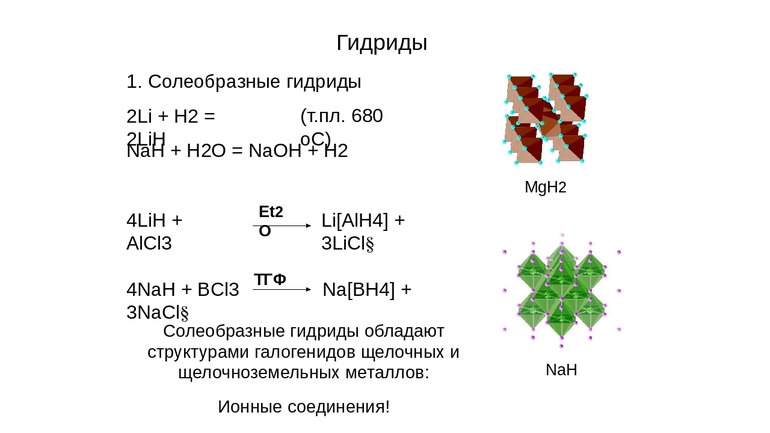
Соединения металлов с водородом — солеобразные гидриды МеНх. Это твердые вещества белого цвета с ионным строением. Устойчивые гидриды образуют активные металлы (щелочные, щелочноземельные и др.).
Способы получения
Гидриды металлов можно получить непосредственным взаимодействием активных металлов и водорода.
Например, при взаимодействии натрия с водородом образуется гидрид натрия:
2Na + H2 → 2NaH
Гидрид кальция можно получить из кальция и водорода:
Ca + H2 → CaH2
Химические свойства
1. Солеобразные гидриды легко разлагаются водой.
Например, гидрид натрия в водной среде разлагается на гидроксид натрия и водород:
NaH + H2O → NaOH + H2
2. При взаимодействии с кислотами гидриды металлов образуют соль и водород.
Например, гидрид натрия реагирует с соляной кислотой с образованием хлорида натрия и водорода:
NaH + HCl → NaCl + H2
3. Солеобразные гидриды проявляют сильные восстановительные свойства и взаимодействуют с окислителями (кислород, галогены и др.)
Например, гидрид натрия окисляется кислородом:
2NaH + O2 = 2NaOH
Гидрид натрия также окисляется хлором:
NaH + Cl2 = NaCl + HCl
Летучие водородные соединения
Соединения водорода с неметаллами — летучие водородные соединения.
Строение и физические свойства
Все летучие водородные соединения — газы (кроме воды).
| CH4 — метан | NH3 — аммиак | H2O — вода | HF –фтороводород |
| SiH4 — силан | PH3 — фосфин | H2S — сероводород | HCl –хлороводород |
| AsH3 — арсин | H2Se — селеноводород | HBr –бромоводород | |
| H2Te — теллуроводород | HI –иодоводород |
Способы получения силана
Силан образуется при взаимодействии соляной кислоты с силицидом магния:
Mg2Si + 4HCl → 2MgCl2 + SiH4
Видеоопыт получения силана из силицида магния можно посмотреть здесь.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поскольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например, аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
2NH4Cl + Са(OH)2 → CaCl2 + 2NH3 + 2Н2O
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например, гидролиз нитрида кальция:
Ca3N2 + 6H2O → ЗСа(OH)2 + 2NH3
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
N2 + 3Н2 ⇄ 2NH3
Процесс проводят при температуре 500-550оС и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непрореагировавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например, фосфин образуется при водном гидролизе фосфида кальция:
Ca3P2 + 6H2O → 3Са(ОН)2 + 2PH3
Или при кислотном гидролизе, например, фосфида магния в соляной кислоте:
Mg3P2 + 6HCl → 3MgCl2 + 2PH3↑
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например, фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
4P + 3KOH + 3H2O → 3KH2PO2 + PH3↑
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например, при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
S + H2 → H2S
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: хлорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
2CrCl3 + 3Na2S + 6H2O → 2Cr(OH)3 + 3H2S↑ + 6NaCl
Химические свойства силана
1. Силан — неустойчивое водородное соединение (самовоспламеняется на воздухе). При сгорании силана на воздухе образуется оксид кремния (IV) и вода:
SiН4 + 2О2 = SiO2 + 2Н2О
Видеоопыт сгорания силана можно посмотреть здесь.
2. Силан разлагается водой с выделением водорода:
SiH4 + 2H2O → SiO2 + 4H2
3. Силан разлагается (окисляется) щелочами:
SiH4 + 2NaOH + H2O → Na2SiO3 + 4H2
4. Силан при нагревании разлагается:
SiH4 → Si + 2H2
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H+), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами.
Например, фосфин реагирует с йодоводородной кислотой:
PH3 + HI → PH4I
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
2PH3 + 4O2 → P2O5 + 3H2O
PH3 + 2O2 → H3PO4
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например, азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
PH3 + 8HNO3 → H3PO4 + 8NO2 + 4H2O
Серная кислота также окисляет фосфин:
PH3 + 3H2SO4 → H3PO4 + 3SO2 + 3H2O
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например, хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например, сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
2H2S + O2 → 2S + 2H2O
В избытке кислорода:
2H2S + 3O2 → 2SO2 + 2H2O
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
Например, азотная кислота окисляет сероводород до молекулярной серы:
H2S + 2HNO3(конц.) → S + 2NO2 + 2H2O
При кипячении сера окисляется до серной кислоты:
H2S + 8HNO3(конц.) → H2SO4 + 8NO2 + 4H2O
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например, оксид серы (IV) окисляет сероводород:
2H2S + SO2 → 3S + 2H2O
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
3H2S + K2Cr2O7 + 4H2SO4 → 3S + Cr2(SO4)3 + K2SO4 + 7H2O
2H2S + 4Ag + O2 → 2Ag2S + 2H2O
Серная кислота окисляет сероводород либо до молекулярной серы:
H2S + H2SO4(конц.) → S + SO2 + 2H2O
Либо до оксида серы (IV):
H2S + 3H2SO4(конц.) → 4SO2 + 4H2O
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов: меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например, сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
H2S + Pb(NO3)2 → PbS + 2HNO3
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Химические свойства прочих водородных соединений
Кислоты образуют в водном растворе: водородные соединения VIA (кроме воды) и VIIA подгрупп.
Прочитать про химические свойства галогеноводородов вы можете здесь.
Вода
Физические свойства
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
Химические свойства
1. Вода реагирует с металлами и неметаллами.
1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода:
2Na + 2H2O → 2NaOH + H2
- с магнием реагирует при кипячении:
Mg + 2H2O → Mg(OH)2 + H2
- алюминий не реагирует с водой, так как покрыт оксидной плёнкой. Алюминий, очищенный от оксидной плёнки, взаимодействует с водой, образуя гидроксид:
2Al + 6H2O = 2Al(OH)3 +3H2
- металлы, расположенные в ряду активности от Al до Н, реагируют с водяным паром при высокой температуре, образуя оксиды и водород:
Fe + 4Н2O → Fe3O4 + 4Н2
- металлы, расположенные в ряду активности от после Н, не реагируют с водой:
Ag + Н2O ≠
2. Вода реагирует с оксидами щелочных и щелочноземельных металлов, образуя щелочи (с оксидом магния – при кипячении):
Н2O + СаО = Са(OH)2
3. Вода взаимодействует с кислотными оксидами (кроме SiO2):
P2O5 + 3H2O = 2H3PO4
4. Некоторые соли реагируют с с водой. Как правило, в таблице растворимости такие соли отмечены прочерком:
Например, сульфид алюминия разлагается водой:
Al2S3 + 6H2O → 2Al(OH)3 + 3H2S
5. Бинарные соединения металлов и неметаллов, которые не являются кислотами и основаниями, разлагаются водой.
Например, фосфид кальция разлагается водой:
Са3Р2 + 6Н2О → 3Са(ОН)2 + 2РН3↑
6. Бинарные соединения неметаллов также гидролизуются водой.
Например, фосфид хлора (V) разлагается водой:
PCl5 + 4H2O → H3PO4 + 5HCl
6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др.).
Водород (лат. hydrogenium = греч. ὕδωρ — вода + γεννάω — рождаю) — самый легкий химический элемент, при обычных условиях — газ
без цвета, запаха и вкуса. В соединении с кислородом образует воду.
Водород — самый распространенный элемент Вселенной, входит в состав всего живого и небесных тел (73% массы Солнца).

Степени окисления
Проявляет степени окисления: -1, 0, +1.
Получение
В промышленности водород получают различными методами:
- Конверсия с водяным паром при t = 1000 °C
- Методом газификации угля, торфа, сланца
- Электролизом водных растворов щелочей
- Каталитическим окислением кислородом (неполное окисление)
CH4 + H2O → CO + H2
C + H2O → CO + H2
H2O → H2↑ + O2↑
CH4 + O2 → CO + H2

Лабораторные методы традиционно отличаются от промышленных своей простотой. В лаборатории водород получают:
- Вытеснением водорода из кислот
- Гидролизом гидридов
- Взаимодействием активных металлов с водой
- Реакцией цинка или алюминия с раствором щелочи
Fe + HCl → FeCl2 + H2↑
CaH2 + H2O → Ca(OH)2 + H2↑
Ca + H2O → Ca(OH)2 + H2↑
Al + NaOH + H2O → Na[Al(OH)4] + H2↑
Химические свойства
- Как восстановитель реагирует с кислородом, галогенами, азотом, серой, оксидами металлов. При комнатной температуре из перечисленных
реакция идет только со фтором. - Как окислитель реагирует с металлами
В реакциях водород проявляет себя как восстановитель и окислитель. Как восстановитель реагирует с элементами, электроотрицательность которых
выше, чем у водорода:
H2 + O2 → (t) H2O
H2 + F2 → HF (со взрывом в темноте)
H2 + Cl2 → (t) HCl (со взрывом только на свету)
H2 + N2 → NH3
H2 + S → H2S
H2 + ZnO → Zn + H2O

Na + H2 → NaH (гидрид натрия)
Mg + H2 → MgH2
Вода
Химические свойства:
- Реакция с металлами
- Реакции с основными и кислотными оксидами
- Гидролиз солей
- Реакция с гидридами активных металлов
- Реакции с C, CO, CH4
- С галогенами
Металлы, стоящие в ряду активности до водорода, вытесняют водород из воды.
K + H2O → KOH + H2
Реагирует с основными оксидами — с образованием оснований (реакция идет, если основание растворимо), и с кислотными оксидами —
с образованием соответствующих кислот. Не забывайте сохранять степени окисления!
CaO + H2O → Ca(OH)2
P2O5 + H2O → H3PO4
Отмечу здесь реакцию двойного гидролиза, которая заключается в гидролизе одной соли по катиону (CrBr3),
а другой — по аниону (Na2CO3).
Na2CO3 + CrBr3 + H2O → Cr(OH)3↓ + CO2 + NaBr
LiH + H2O → LiOH + H2↑
C + H2O → CO + H2
H2O + CO → (кат.) CO2 + H2
H2O + CH4 → (кат.) CO + H2
Cl2 + H2O → HCl + HClO (соляная и хлорноватистая кислоты — без нагревания)
Cl2 + H2O → HCl + HClO3 (соляная и хлорноватая кислоты — при нагревании)

Кристаллогидраты
Кристаллогидраты — кристаллические соединения, содержащие молекулы воды как самостоятельные структурные единицы. Вода, входящая в
состав кристаллогидратов, называется кристаллической. Примеры: CaSO4*2H2O,
Na2SO4*10H2O.
При нагревании кристаллогидраты теряют воду. Одним из наиболее известных кристаллогидратов является медный купорос: CuSO4*5H2O.
Медный купорос имеет характерный голубой цвет, а безводный сульфат меди — белый.

В задачах бывает дана масса медного купороса. Надо помнить о том, что часто в реакции не участвует кристаллическая вода. В таком случае следует
вычесть кристаллизационную воду и найти массу безводного сульфата меди.

Пероксид водорода
Представляет собой бесцветную жидкость с металлическим вкусом. Концентрированные растворы пероксида водорода взрывоопасны.
Получают пероксид водорода в реакции с пероксидами и супероксидами металлов.
K2O2 + H2O → KOH + H2O2
BaO2 + H2SO4 → BaSO4 + H2O2
В разбавленных растворах пероксид водорода легко разлагается:
H2O2 → H2O + O2↑
Также перекись проявляет окислительные свойства:
KCl + H2O2 + H2SO4 → Cl2 + K2SO4 + H2O
Перекисью водорода обрабатывают раневую поверхность. Выделяющийся при разложении атомарный кислород разрушает бактериальные клетки,
предотвращая осложнение в виде бактериальной инфекции.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
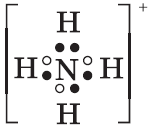
H2 — это элемент IА-группы, порядковый № 1. Заряд атомного ядра +1, потому что в ядре 1 протон. Вокруг ядра вращается всего 1 электрон. До завершения уровня атому не хватает 1 электрона. Завершать энергетический уровень атом водорода может различными способами: образовывать летучие водородные соединения и гидриды.
Оглавление:
- Способы завершения энергетического уровня
- Типы гидридов
- Особенности водородных соединений
H2 — это элемент IА-группы, порядковый № 1. Заряд атомного ядра +1, потому что в ядре 1 протон. Вокруг ядра вращается всего 1 электрон. До завершения уровня атому не хватает 1 электрона. Завершать энергетический уровень атом водорода может различными способами: образовывать летучие водородные соединения и гидриды.
Способы завершения энергетического уровня
Водород — один из немногих химических элементов, который может иметь как положительную, так и отрицательную степень окисления в соединениях. Как, например, бром ( NaBr -1, Br +1 2O ) и хлор ( NaCl -1, HClO3+5):
- Может принимать на внешний уровень один недостающий электрон – атом водорода превращается в ион, заряженный отрицательно. Такая реакция происходит при взаимодействии с металлами, которые в соединениях проявляют только положительную степень окисления. Степень окисления водорода будет равна -1, так как заряд отрицательный. Металлы с H2 создают соединения, которые называются гидридами. Способствует их образованию H2 с самыми активными металлами: щелочными и щелочноземельными. Например: NaH (гидрид натрия), CaH2 (гидрид кальция), LiH (гидрид лития), CuH (гидрид меди).
- Может отдавать один электрон со своего внешнего энергетического уровня — остается только ядро атома водорода, состоящее из протона. Таким образом, H2 образует химические соединения с неметаллами, которые при этом будут проявлять только отрицательную степень окисления. В соединениях с водородом степень окисления неметалла будет низшая. В этом случае водород становится частицей с положительным зарядом иона или степенью окисления +1. Соединения H2 с неметаллами называют летучие водородные соединения. Например: HCl (соляная кислота/хлороводород), NH3 (водородное соединение азота — аммиак), NH4OH (нашатырный спирт), NaHS (гидросульфид натрия).
Помимо способов завершения энергетического уровня, существует классификация гидридов, в соответствии с их характером связи. Они подразделяются на 3 большие группы.
Типы гидридов
Стоит рассмотреть основные группы, поскольку побочные группы (полимерные, интерметаллические и комплексные) являются подвидами основных, а также имеют схожие с ними физические и химические свойства.
Ионные гидриды
Ионные (солеобразные) — соединения H2 с металлами IA и IIA (кроме магния), а также с алюминием. Их главное отличие от двух других видов в том, что они активно реагируют с H2O с образованием щёлочи и выделением H2 в виде газа. Самым ярким представителем ионных гидридов является гидрид натрия.
Физические свойства: белые твёрдые вещества с кристаллической решёткой, содержащей катион (плюс) металла и гидрид-анион (минус) Н–. Проводят электрический ток. Устойчивы при нормальных условиях (н.у.).
Как и любое вещество (химический элемент, простое вещество или химическое соединение), ионные гидриды обладают свойствами. Они проявляются в процессе реакции и влияют на неё. Химические свойства:
- Разлагаются при нагревании еще до достижения своей температуры плавления: CaH2 = Ca + H2↑.
- При растирании на воздухе воспламеняются: CaH2 + O2 = CaO + H2O.
- Реагирует с водой с образованием щелочи и выделением водорода: 2NaH + H2O = 2NaOH + H2↑.
- Являются сильными восстановителями (при t 700-800°С восстанавливают оксиды до металлов), но их использование в лаборатории осложнено, поскольку они с легкостью реагируют с кислородом и влагой воздуха.
Применение: для получения металлов из их оксидов, удаления окалины с поверхности металлических изделий, как ракетное топливо.
Получение: при взаимодействии металлов с водородом при t 200-600°С:
- H2 + 2Na = (300°C) 2NaH;
- H2 + Ca = (600°C) CaH2.
Ковалентные соединения
Ковалентные — гидриды, образованные неметаллами IV, V, VI и VII групп, а также бором. Например, гидрид углерода/метан CH4, силан SiH4, гидрид серы/сероводород H2S.
Физические свойства: газообразные, легко воспламеняются на воздухе.
Ковалентные гидриды во многом отличаются от ионных и металлических. Если последние обладают химическими свойствами, схожими с металлами, то свойства ковалентных следует рассмотреть подробнее. Химические свойства:
- При высоких температурах разлагаются практически необратимо: H2S = (около 400°С) S + H2.
- Сильные восстановители.
- Высокая токсичность.
- B2H6 и SiH4 разлагаются водой с выделением водорода: B2H6 + 6H2O → 2H3BO3 + 6H2.
- Гидриды элементов V-VII групп не разлагаются водой.
Применение: для получения полупроводниковых пленочных покрытий, защитных покрытий на поверхности металлов.
Получение: термическое разложение, восстановление галогенидов.
Существуют многочисленные производные ковалентных гидридов, в которых часть атомов H2 замещена атомами галогенов или металлов.
Магний по своим свойствам и химической связи располагается между ионными и ковалентными гидридами. С водой и водными растворами MgH2 реагирует с выделением H2, но не так энергично, как ионные гидриды.
Соединения железа с водородом крайней неустойчивы и в чистом виде не обнаружены. Формула неустойчивого гидрида железа выглядит так: C5H5Fe.
Металлические соединения
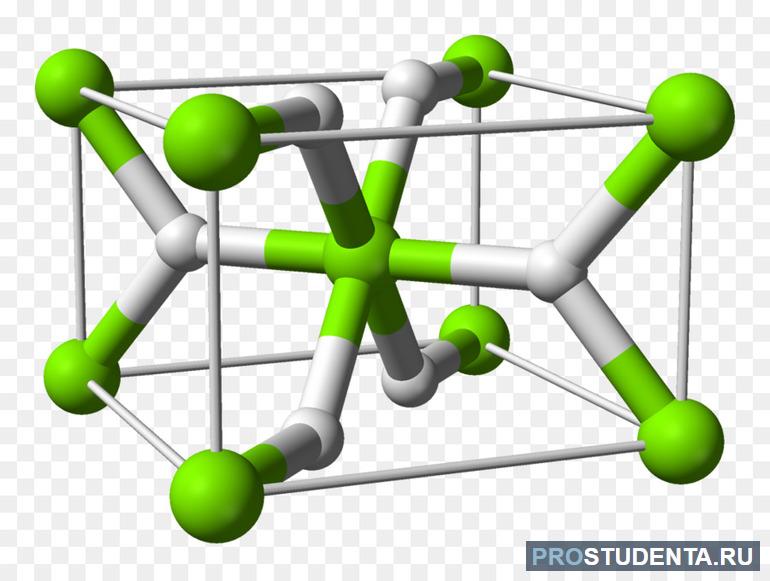
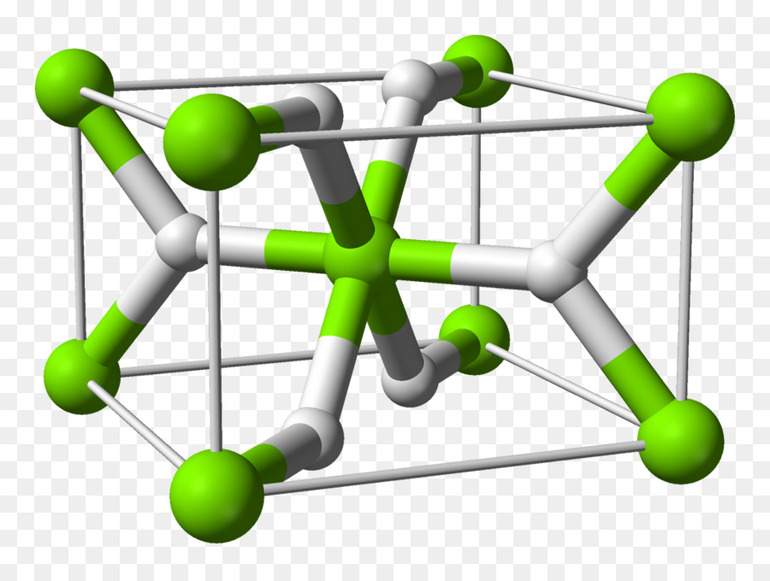
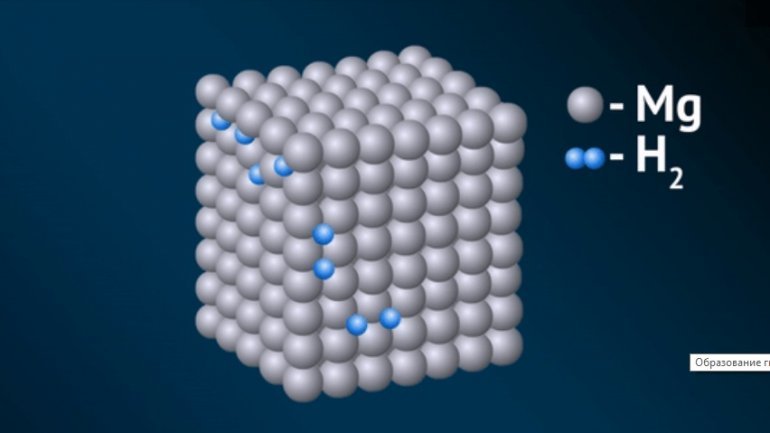
Металлические — соединения переходных металлов. Фактически они являются твёрдым раствором H2 в металле, атомы водорода помещаются в кристаллическую решётку металла. Их образованию всегда способствует адсорбция водорода на поверхности металла.
Физические свойства: представляют собой кристаллические вещества с металлическим блеском. Обладают интенсивной окраской, проявляют металлические или полупроводниковые свойства. Устойчивы на воздухе. С кислородом и водой реагируют медленно. Магнитными, механическими, тепло- и электропроводными свойствами схожи с металлами.
Химическая связь очень прочная.
Применение: применяются в качестве источников водорода особой чистоты (который используется в топливных элементах), также для удаления водорода из газовых смесей.
Получение: реакция металла с водородом при обычной температуре или при нагревании: Ti + H2 = (150-200°С) TiH2.
При взаимодействии H2 с интерметаллическими соединениями, такими как TiFe, LaNi5, можно получить гидриды интерметаллидов TiFeH2, LaNi5H6, которые с высокой скоростью обратимо поглощают водород при атмосферном давлении.
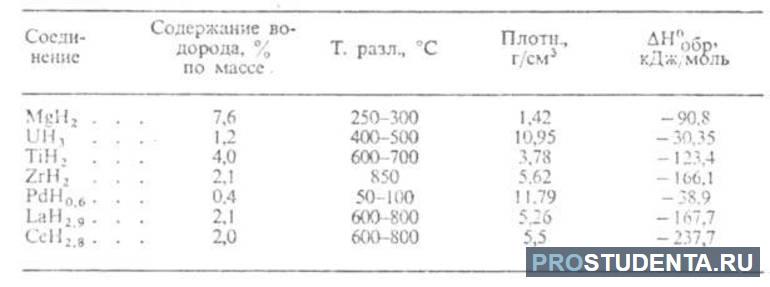
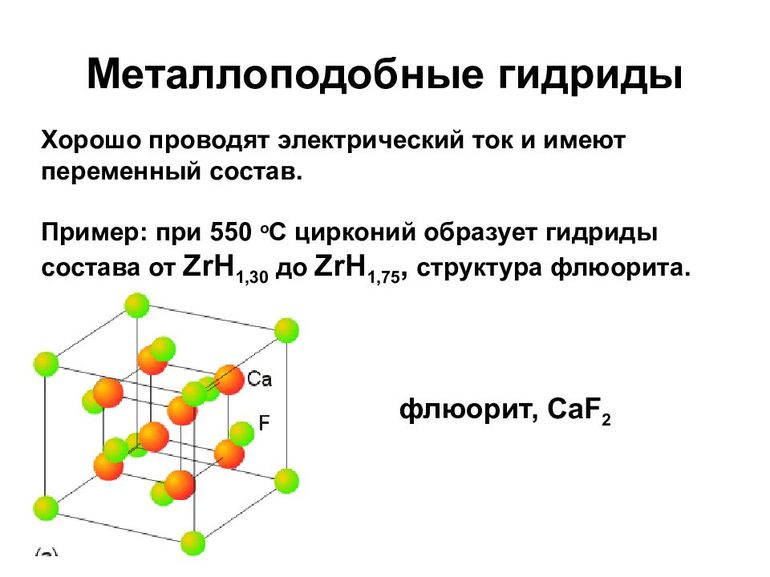
В прикрепленных таблицах указано содержание водорода, температура разложения, плотность и пр., что поможет в более глубоком понимании физических свойств водорода разных типов гидридов.
Особенности водородных соединений
Как и в любом разделе химии, водородные соединения имеют свои исключения. В их числе He, Ne, Ar, Kr, Pm, Os, Ir, Rn, Fr и Ra. Они не образуют бинарные соединения с водородом.
Информация, изложенная выше доказывает то, что химия интереснейший и увлекательный предмет, который стоит потраченного внимания и времени.
Типы и классификация
Вещества, созданные водородом с металлами и неметаллами многобразны. В зависимости от характера полученного соединения, выделяют:
- Простые гидриды — бинарные, в них только 2 элемента, они встречаются чаще всего.
- Со многими переходными металлами (элементы р-подгруппы) водород образует ко́мплексные соединения. Ко́мплексные гидриды металлов (к примеру, боро- или алюмогидриды) вместо атома водорода, имеют алюмогруппу (AlH4) или борогруппу (BH4). Из них натрийборогидрид Na (BH4) и литийалюмогидрид Li (AlH4), будучи сильными восстановителями, нашли применение в лабораторной практике. Кроме этого, Na (BH4) используют для отбеливания бумаги.
- И также есть гидриды интерметаллидов (пример: TiAl или Ti3Al, алюминид титана), в кристаллических решётках которых водород просто растворяется, аккумулируется.
У разных химических элементов строение атомов и молекул отличается. Соответственно, связи в образованных гидридах тоже неодинаковы. Классификация по виду связи определяет полученные вещества, как:
- металлоподобные;
- ионные (солеобразные);
- ковалентные.
Бинарные соединения самые распространённые, есть у всех элементов. Исключения здесь металлы платиновой группы (платиноиды), Au, Ag, Hg, Ti, Cd, In, а также благородные газы. Между этими веществами нет чётко выраженных границ, деление по характеру связи для них немного условно.
К металлическим принадлежат соединения водорода с переходными металлами и редкоземельными элементами. Это, скорее, раствор неметалла в металле, с внедрением атомов в кристаллическую решётку. Характерно для них следующее:
- В основном такие гидриды являются бертоллидами, состав их зависит от способа получения, непостоянен, законам постоянных и кратных отношений не подчиняется.
- В формулах для них указывают предельное содержание водорода.
- В отличие от прочих, они сохраняют исходную металлическую решётку.
- Их вид и физические свойства соответствуют металлам, с которыми они образованы.
- Имеют характе́рный металлический блеск, взаимодействуют с H2O (в жидком или газообразном состоянии), кислородом, при нормальных условиях, но медленно.
- Как и металлы, обладают значительной теплопроводностью и проводимостью.
- При нагревании распадаются на водород и исходный металл.
Образуются в процессе адсорбции водорода на металлической поверхности, диссоциации H2 и диффузного проникновения атомов в металлическую решётку. Поглощение обратимо, но химические связи весьма крепкие.
От металлоподобных, через гидриды меди (CuH, водородистая медь), цинка, ZnH2, водородистый цинк и им подобных, осуществляется переход к полимерам.
Это химические вещества со сложной структурой, в которой присутствуют цепи и полиэдры. Твёрдые, устойчивые, с кристаллическим строением (полимерные гидриды лёгких металлов стабильнее всего), данные соединения распадаются при нагреве на составляющие элементы.
От них, через гидриды бора и галлия — к водородным соединениям с неметаллами. В них водород имеет степень окисления +1.
Соединения с ионным типом связи
Их образует водород с металлами 1А и 2А групп, кроме Mg, а также с Al. Они отчасти показывают свойства соответствующих галогенидов, откуда и появилось второе наименование — солеобразные.
Это химические соединения, такие как гидрид натрия (NaH), кальция (CaH2), лития, с формулой LiH, другие. Для них характерно:
- Получают при высокой температуре и под давлением.
- В этих соединениях, проявляющих, как правило, щелочные свойства, у водорода степень окисления -1. С металлами 1А и 2А групп, такими, как Na, Li, Be, K, Rb, Sr он выступает окислителем, подобно галогенам. Например, гидрид натрия, с химической формулой NaH — в этом соединении ион водорода имеет отрицательный заряд.
- Это кристаллические вещества белого цвета, с ионной решёткой, структура подобна строению соответствующего галогенида.
- При нормальных условиях устойчивы.
- Распад на металл и водород при нагреве, минуя этап плавления (исключением является LiH, его температура плавления 688 градусов Цельсия).
- В расплаве — хорошие проводники, при этом на аноде будет выделяться H2.
- Вспыхивают при растирании на воздухе.
- Все являются сильными восстановителями. Применяются для получения чистых металлов из солей и оксидов, для удаления окалины, коррозии.
- Реагируют с оксидом углерода, формируют соли муравьиной кислоты (формиаты).
- Как и соли, могут участвовать в обменных реакциях, гидролизе.
Солеобразными бывают не только бинарные (простые) соединения водорода. Дигидриды, образуемые добавлением групп бора (BH4) или алюминия (AlH4) к металлу, также имеют ионный тип связи.
Окислительная активность водорода небольшая по сравнению с галогенами. Дополнительный электрон он отдаёт с трудом, при нагреве (реакция проходит с поглощением тепла). Это и обусловливает различие между свойствами ионных гидридов и галогенидов.
По химической природе такие соединения ведут себя как основные. Ионные гидриды обладают высокой химической активностью. Они бурно реагируют с кислородом и H2O в парообразном состоянии.
Но выраженный ионный характер — свойство, проявляемое соединениями кальция, натрия, щелочных и щёлочноземельных элементов. На них проще всего и нагляднее можно показать химию взаимодействий этих веществ:
- С водой: 2NaH + H2O = 2NaOH + H2O.
- С кислородом: NaH + O2 = NaO + H2O.
- Реакция разложения: CaH2 = Ca + H2.
- С оксидами углерода: NaH + CO2 = NaCOOH.
- Кремния: 4NaH + 3SiO2 = 2Na2SiO3 + Si + 2H2.
- Металлов: 4NaH + Fe3O4 = 4NaOH + 3Fe.
- Восстановление: 2NaH + 2SO2 = Na2SO4 + H2S.
- С аммиаком: NaH + NH3 = NaNH2 + H2.
- С кислотами: 2NaH + H2SO4 = Na2SO4 + 2H2.
- Со спиртами: KH + HO-R = KOR + H2.
По свойствам и природе связи промежуточное положение между ионными и ковалентными занимает гидрид магния, с формулой MgH2.
Соли и оксиды калия, кальция, меди и других щелочных и щёлочноземельных металлов образуют с гидридом кислорода (водой) ещё один вид соединений — дигидраты. Это соли серной кислоты (сульфаты), галогениды, оксиды плюс 2 присоединённых молекулы H2O. Формула алебастра — Ca5O4 плюс 2H2O, гипс — CaSO4 плюс 2H2O, в природе они не редкость.
Гидросульфид натрия, NaHS, образует не только дигидрат, NaHS плюс 2H2O, но и тригидрат, с присоединением 3H2O.
Когда связь ковалентна
Это соединения, в которых степень окисления водорода +1, как правило, газы, летучие жидкости. Их водород даёт с неметаллами, а также с германием, алюминием, бериллием, оловом, мышьяком, сурьмой — элементами 4, 5, 6 и 7 групп периодической системы. И также ковалентную связь имеют соединения водорода и бора.
Это могут быть вещества простые, бинарные, такие как метан (CH4), силан (формула SiH4). Сложные тоже имеются, с длинными цепями, многоатомные молекулы — они образуются водородом с кремнием, бором, германием.
Многие из них неустойчивы, так гидрид олова (SnH4) распадается уже при комнатной температуре, а гидрид свинца недолго существует и при отрицательных температурах. Самый простой гидрид бора не существует в природных условиях вообще.
Отличительные свойства:
- Все сильные восстановители, степень окисления водорода +1.
- Проявляют кислотные, а также амфотерные свойства.
- Агрегатное состояние — газ или летучая жидкость, исключения тут гидрид кислорода (вода), азота, фтороводород (плавиковая кислота), те, в которых молекулы полярны и возникает водородная связь. Последние существуют, как нелетучая жидкость или в твёрдом состоянии.
- Электронодефицитные виды, получаемые с элементами главной подгруппы 3 группы, например, гидрид алюминия AlH3 или бериллия, химическая формула BeH2, очень активны и образуют многоатомные, длинные полимерные цепи, с больши́м весом. Такие полимеры — твёрдые вещества.
- При нагреве легко и практически необратимо, разлагаются на элемент и водород H2. Требуется температура от 100 до 300 градусов по Цельсию (для гидрида серы H2S — порядка 400 градусов).
- Чаще всего они имеют высокую токсичность.
- Характерна высокая химическая активность, реакционная способность.
- Получить можно непосредственным взаимодействием элементов, разложением металлических соединений водой, кислотой, восстановлением галогенидов гидридами бора, алюминия, щелочных металлов.
- Высшие гидриды германия, кремния, с общей химической формулой EnH2n+2 — это полимеры, их стабильность тем ниже, чем больше атомный вес и количество атомов элемента.
- Принадлежащие к s-подгруппе хорошо растворяются в воде и проявляют кислотные свойства. Прочие — в незначительной мере, свойства у них основные. Все хорошо растворимы в неполярных органических растворителях.
- При взаимодействии с водой (H2O), выделяется чистый водород (H2) и оксид, с общей химической формулой EO2.
Тяжёлые элементы дают соединения с небольшой устойчивостью.
За счёт водородных связей и способности к донорно-акцепторному взаимодействию, вода (H2O), плавиковая кислота (HF), аммиака (NH3), а частично HCl и H2S, хорошие растворители.
Химические вещества, образованные двумя или более металлов, такие как FeTi, Ca2Ru, Mg2Ni — это интерметаллические соединения. Они хорошо поглощают водород и соединяясь с ним дают гидриды-интерметаллиды.
Содержат атомы железа, магния, меди, кальция, титана, алюминия, редкоземельные элементы. Их легко получить даже с H2 нехимическим (для технических нужд, до 2% примесей). Применяют для хранения водорода и аккумуляторных батарей.
У гидридов много областей применения. Особенно широко используют NaH. С его помощью удаляют термическую окалину с металлов, производят добавки, повышающие октановое число бензина, катализаторы полимеризации. Он необходим при производстве красителей, моющих средств, в качестве мощного восстановителя применяется в металлургии.
В органической химии комплексные водородные соединения применяют уже более 50 лет, для получения особо чистых химических элементов. В химии алкалоидов также широко используют комплексные гидриды металлов. Без них не обходится производство металлокерамики, дегазаторов, многих фармакологических средств.
Азот с водородом образует аммиак, кислород — воду, сера даёт сероводород, в природе постоянно идёт синтез подобных веществ. С миром химии человек пересекается постоянно. Поэтому знания о наиболее распространёных веществах принесут пользу каждому.
Добавил:
Upload
Опубликованный материал нарушает ваши авторские права? Сообщите нам.
Вуз:
Предмет:
Файл:
химия реферат водород.docx
Скачиваний:
12
Добавлен:
22.11.2019
Размер:
42.37 Кб
Скачать
Гидриды
По
внешнему виду и многим физическим
свойствам гидриды похожи на соответствующие
галогениды (белые кристаллические
соединения). Однако, по химическим
свойствам отличаются:
-
Гидриды
– сильные восстановители (за счет
гидрид-иона Н+),
разлагаются водой и кислотами:-
NaH+H2O=NaOH+H2
-
CaH2+2HCl=CaCl2+2H2
-
-
При
нагревании разлагаются:-
2KH=2K+H2
-
-
Бурно
взаимодействуют с кислородом воздуха-
CaH2+O2=CaO
+ H2О
(или Са(ОН)2).
-
Гидриды
рубидия и цезия в сухом воздухе
воспламеняются. При электролизе расплавов
гидридов водород выделяется на аноде.
Пероксид водорода
Пероксид
водорода Н2О2
– нестойкая бесцветная вязкая жидкость,
в 1,5 раза тяжелее воды (плотность
1,45г/см3).
В молекуле пероксида водорода связи
между атомами Н и О полярные, между
атомами О – ковалентная неполярная. В
силу несимметричного расположения
связей Н-О в пространстве молекула Н2О2
полярна. Молекулы Н2О2
сильно ассоциированы за счет образования
водородных связей (больше, чем молекулы
Н2О),
поэтому пероксид водорода – более
плотная и вязкая жидкость, чем вода, с
более высокой температурой кипения
(150,20С).
С водой смешивается в любых соотношениях
, хорошо растворяется также в спирте,
эфире.
Получение
В
лаборатории сначала получают пероксид
бария:
2BaO+O2изб=2BaO2
Затем
его обрабатывают серной кислотой (на
холоду):
BaO2+H2SO4=BaSO4+H2O2
В
промышленности пероксид водорода
получают взаимодействием воды с надсерной
кислотой, которую получают электролизом
50% раствора серной кислоты:
H2S2O8+2H2O=2H2SO4+H2O2
Химические
свойства и применение
Химические
свойства пероксида водорода представлены
в табл.3
Степень
окисления кислорода в молекуле Н2О2-1
является промежуточной, поэтому пероксид
водорода проявляет окислительно-восстановительную
двойственность, но более характерны
для него окислительные свойства.
Таблица
3
«Химические
свойства пероксида водорода»
|
Cвойство |
Химизм |
Примечание |
|
Кислотные |
||
|
Слабые |
Н2О2=Н++НО2—гидропероксид-ион |
K=1,5*10-12 Диссоциация |
|
Взаимодействие |
Ва(ОН)2+Н2О2=ВаО2↓+2Н2О NaOH(ТВ)+Н2О2=Na2O2↓+2H2O |
Пероксиды |
|
Окислительно-восстановительные |
||
|
Разложение |
2H2O2=2H2O+O2↑ 2O-1-2eO20 O-1+e |
Разлагается |
|
Окислительно-восстановительные |
H2O2-1+2H++2e2H2O-2 Примеры: H2O2+KNO2=KNO3+H2O H2O2+2KI=I2+2KOH H2O2+2HI=I2+2H2O H2O2+2KI+H2SO4=I2+K2SO4+2H2O 3H2O2+2NH3=N2+6H2O H2O2+FeSO4+H2SO4=Fe2(SO4)3+2H2O 3H2O2+2CrCl3+10KOH=2K2CrO4+6KCl+8H2O |
Сильный |
|
Восстановительные |
H2O2-1-2eO20+2H+ Или Примеры: 5H2O2+KMnO4+3H2SO4=2MnSO4+5O2+K2SO4+8H2O 3H2O2+K2Cr2O7+4H2SO4=Cr2(SO4)3+3O2+K2SO4+7H2O H2O2+Ag2O=2Ag+O2+H2O 3H2O+KClO3=KCl+3O2+3H2O 3H2O2+2AuCL3=2Au+3O2+6HCl |
Слабый |
Применение
пероксида водорода связано с его
окислительной способностью и безвредностью
продукта его восстановления (вода).
Очень концентрированные (80% и выше)
водные растворы пероксида водорода
используются как окислители ракетных
топлив, для получения перекисных
соединений, инициирования процессов
полимеризации ,в медицине как
дезинфицирующее средство (3%раствор),
как отбеливатель ткани, бумаги, кожи,
мехов, волос, соломы.
ВОДА
Водород
и кислород в молекуле воды находятся в
устойчивых степенях окисления +1 и -2,
поэтому ОВР возможны только при
взаимодействии воды с очень активными
восстановителями и окислителями
Таблица
4
«Химические
свойства воды»
|
Свойство |
Химизм |
Примечание |
|
Кислотно-основные |
||
|
Вода |
H2O=H++OH— H2O+HCl=H3O++Cl— H2O+NH3=OH—+NH4+ |
[H+]=[OH—]=10-7моль/л Проявляет Проявляет |
|
Гидратация |
Na2O+H2O=2NaOH BaO+H2O=Ba(OH)2 SO3+H2O=H2SO4 P2O5+3H2O=2H3PO4 CuSO4+5H2O=CuSO4*5H2O CaCl2+6H2O=CaCl2*6H2O |
При Образуются |
|
Гидратация |
CH2=CH2+H2O=CH3CH2OH CH2=CH-CH3+H2O=CH3CH(OH)CH3 C2H2+H2O=CH3CHO C3H4+H2O=CH3COCH3 |
Органические |
|
Гидролиз солей Бинарных Органических |
CO32-+H2O=HCO3—+OH— Al3++H2O=AlOH2++H+ NH4++F—+H2O=NH3*H2O+HF Al2S3+6H2O=2Al(OH)3↓+3H2S+6NaCl Al4C3+12H2O=4Al(OH)3↓+3CH4↑ CaC2+2H2O=Ca(OH)2+C2H2↑ Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑ Ca3P2+6H2O=3Ca(OH)2+2PH3↑ Mg2Si+4H2O=2Mg(OH)2↓+SiH4 |
Гидролиз Гидролиз Гидролиз Необратимый Совместный |
|
Продукты Галогеналканы Дигалогеналканы галогенпроизводные сложные жиры->глицерин ди- белки->α-аминокислоты нуклеиновые алкоголяты ангидриды азотсодержащие |
||
|
Оскислительно-восстановительные |
||
|
Вода Взаимодействие Взаимодействие Взаимодействие Взаимодействие |
2Na0+2H2+1O=Na+1OH+H20 Ca+2H2O=Ca(OH)2+H2 Zn+H2O=ZnO+H2 3Fe+4H2O=Fe3O4+4H2 2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H C(уголь)+H2O=CO+H2↑ 2P+6H2O=2HPO3+5H2↑ Si NaH+H2O=NaOH+H2↑ CaH2+2H2O=Ca(OH)2+2H2↑ CH4+H2O=CO+3H2↑ 2CH4+O2+2H2O=2CO2+6H2↑ |
При Реакции Промышленные |
|
Вода |
2H2O-2+2F2=4HF+O20 |
Кроме |
|
Внутримолекулярная |
2H2O=2H2+O2 |
СПИСОК
ЛИТЕРАТУРЫ
Литвинова
Т. Н. Химия в задачах для поступающих в
вузы/ Т.Н. Литвинова, Е. Д. Мельникова ,
М. В. Соловьева, Л. Т. Ажипа , Н.К. Выскубова.
– М.:ООО «Издательство Оникс» 2009. – 832
с.:ил.
http://biochem.nm.ru/science/hydrogen.htm
http://chemistryanalysis.info/index.php?/Vodorod-obschaya-harakteristika/
http://temirlan.moy.su/load/2/2/vvipv/18-1-0-18
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
2.3.1. Химические свойства водорода и галогенов.
Химические свойства водорода
Атом водорода имеет электронную формулу внешнего (и единственного) электронного уровня 1s1. С одной стороны, по наличию одного электрона на внешнем электронном уровне атом водорода похож на атомы щелочных металлов. Однако, ему, так же как и галогенам не хватает до заполнения внешнего электронного уровня всего одного электрона, поскольку на первом электронном уровне может располагаться не более 2-х электронов. Выходит, что водород можно поместить одновременно как в первую, так и в предпоследнюю (седьмую) группу таблицы Менделеева, что иногда и делается в различных вариантах периодической системы:
С точки зрения свойств водорода как простого вещества, он, все-таки, имеет больше общего с галогенами. Водород, также как и галогены, является неметаллом и образует аналогично им двухатомные молекулы (H2).
В обычных условиях водород представляет собой газообразное, малоактивное вещество. Невысокая активность водорода объясняется высокой прочностью связи между атомами водорода в молекуле, для разрыва которой требуется либо сильное нагревание, либо применение катализаторов, либо и то и другое одновременно.
Взаимодействие водорода с простыми веществами
с металлами
Из металлов водород реагирует только с щелочными и щелочноземельными! К щелочным металлам относятся металлы главной подгруппы I-й группы (Li, Na, K, Rb, Cs, Fr), а к щелочно-земельным — металлы главной подгруппы II-й группы, кроме бериллия и магния (Ca, Sr, Ba, Ra)
При взаимодействии с активными металлами водород проявляет окислительные свойства, т.е. понижает свою степень окисления. При этом образуются гидриды щелочных и щелочноземельных металлов, которые имеют ионное строение. Реакция протекает при нагревании:
Следует отметить, что взаимодействие с активными металлами является единственным случаем, когда молекулярный водород Н2 является окислителем.
с неметаллами
Из неметаллов водород реагирует только c углеродом, азотом, кислородом, серой, селеном и галогенами!
Под углеродом следует понимать графит или аморфный углерод, поскольку алмаз — крайне инертная аллотропная модификация углерода.
При взаимодействии с неметаллами водород может выполнять только функцию восстановителя, то есть только повышать свою степень окисления:
Взаимодействие водорода со сложными веществами
с оксидами металлов
Водород не реагирует с оксидами металлов, находящихся в ряду активности металлов до алюминия (включительно), однако, способен восстанавливать многие оксиды металлов правее алюминия при нагревании:
c оксидами неметаллов
Из оксидов неметаллов водород реагирует при нагревании с оксидами азота, галогенов и углерода. Из всех взаимодействий водорода с оксидами неметаллов особенно следует отметить его реакцию с угарным газом CO.
Смесь CO и H2 даже имеет свое собственное название – «синтез-газ», поскольку из нее в зависимости от условий могут быть получены такие востребованные продукты промышленности как метанол, формальдегид и даже синтетические углеводороды:
c кислотами
С неорганическими кислотами водород не реагирует!
Из органических кислот водород реагирует только с непредельными, а также с кислотами, содержащими функциональные группы способные к восстановлению водородом, в частности альдегидные, кето- или нитрогруппы.
c солями
В случае водных растворов солей их взаимодействие с водородом не протекает. Однако при пропускании водорода над твердыми солями некоторых металлов средней и низкой активности возможно их частичное или полное восстановление, например:
Химические свойства галогенов
Галогенами называют химические элементы VIIA группы (F, Cl, Br, I, At), а также образуемые ими простые вещества. Здесь и далее по тексту, если не сказано иное, под галогенами будут пониматься именно простые вещества.
Все галогены имеют молекулярное строение, что обусловливает низкие температуры плавления и кипения данных веществ. Молекулы галогенов двухатомны, т.е. их формулу можно записать в общем виде как Hal2.
Галоген |
Физические свойства |
| F2 | Светло-желтый газ с резким раздражающим запахом |
| Cl2 | Желто-зеленый газ с резким удушливым запахом |
| Br2 | Красно-бурая жидкость с резким зловонным запахом |
| I2 | Твердое вещество с резким запахом, образующее черно-фиолетовые кристаллы |
Следует отметить такое специфическое физическое свойство йода, как его способность к сублимации или, иначе говоря, возгонке. Возгонкой, называют явление, при котором вещество, находящееся в твердом состоянии, при нагревании не плавится, а, минуя жидкую фазу, сразу же переходит в газообразное состояние.
Электронное строение внешнего энергетического уровня атома любого галогена имеет вид ns2np5, где n – номер периода таблицы Менделеева, в котором расположен галоген. Как можно заметить, до восьмиэлектронной внешней оболочки атомам галогенов не хватает всего одного электрона. Из этого логично предположить преимущественно окисляющие свойства свободных галогенов, что подтверждается и на практике. Как известно, электроотрицательность неметаллов при движении вниз по подгруппе снижается, в связи с чем активность галогенов уменьшается в ряду:
F2 > Cl2 > Br2 > I2
Взаимодействие галогенов с простыми веществами
Все галогены являются высокоактивными веществами и реагируют с большинством простых веществ. Однако, следует отметить, что фтор из-за своей чрезвычайно высокой реакционной способности может реагировать даже с теми простыми веществами, с которыми не могут реагировать остальные галогены. К таким простым веществам относятся кислород, углерод (алмаз), азот, платина, золото и некоторые благородные газы (ксенон и криптон). Т.е. фактически, фтор не реагирует лишь с некоторыми благородными газами.
Остальные галогены, т.е. хлор, бром и йод, также являются активными веществами, однако менее активными, чем фтор. Они реагируют практически со всеми простыми веществами, кроме кислорода, азота, углерода в виде алмаза, платины, золота и благородных газов.
Взаимодействие галогенов с неметаллами
водородом
При взаимодействии всех галогенов с водородом образуются галогеноводороды с общей формулой HHal. При этом, реакция фтора с водородом начинается самопроизвольно даже в темноте и протекает со взрывом в соответствии с уравнением:
Реакция хлора с водородом может быть инициирована интенсивным ультрафиолетовым облучением или нагреванием. Также протекает со взрывом:
Бром и йод реагируют с водородом только при нагревании и при этом, реакция с йодом является обратимой:
фосфором
Взаимодействие фтора с фосфором приводит к окислению фосфора до высшей степени окисления (+5). При этом происходит образование пентафторида фосфора:
При взаимодействии хлора и брома с фосфором возможно получение галогенидов фосфора как в степени окисления + 3, так и в степени окисления +5, что зависит от пропорций реагирующих веществ:
При этом в случае белого фосфора в атмосфере фтора, хлора или жидком броме реакция начинается самопроизвольно.
Взаимодействие же фосфора с йодом может привести к образованию только триодида фосфора из-за существенно меньшей, чем у остальных галогенов окисляющей способности:
серой
Фтор окисляет серу до высшей степени окисления +6, образуя гексафторид серы:
Хлор и бром реагируют с серой, образуя соединения, содержащие серу в крайне не свойственных ей степенях окисления +1 и +2. Данные взаимодействия являются весьма специфичными, и для сдачи ЕГЭ по химии умение записывать уравнения этих взаимодействий не обязательно. Поэтому три нижеследующих уравнения даны скорее для ознакомления:
Взаимодействие галогенов с металлами
Как уже было сказано выше, фтор способен реагировать со всеми металлами, даже такими малоактивными как платина и золото:
Остальные галогены реагируют со всеми металлами кроме платины и золота:
Реакции галогенов со сложными веществами
Реакции замещения с галогенами
Более активные галогены, т.е. химические элементы которых расположены выше в таблице Менделеева, способны вытеснять менее активные галогены из образуемых ими галогеноводородных кислот и галогенидов металлов:
Аналогичным образом, бром вытесняет серу из растворов сульфидов и сероводорода:
Хлор является более сильным окислителем и окисляет сероводород в его водном растворе не до серы, а до серной кислоты:
Взаимодействие галогенов с водой
Вода горит во фторе синим пламенем в соответствии с уравнением реакции:
Бром и хлор реагируют с водой иначе, чем фтор. Если фтор выступал в роли окислителя, то хлор и бром диспропорционируют в воде, образуя смесь кислот. При этом реакции обратимы:
Взаимодействие йода с водой протекает в настолько ничтожно малой степени, что им можно пренебречь и считать, что реакция не протекает вовсе.
Взаимодействие галогенов с растворами щелочей
Фтор при взаимодействии с водным раствором щелочи опять же выступает в роли окислителя:
Умение записывать данное уравнение не требуется для сдачи ЕГЭ. Достаточно знать факт о возможности такого взаимодействия и окислительной роли фтора в этой реакции.
В отличие от фтора, остальные галогены в растворах щелочей диспропорционируют, то есть одновременно и повышают и понижают свою степень окисления. При этом, в случае хлора и брома в зависимости от температуры возможно протекание по двум разным направлениям. В частности, на холоду реакции протекают следующим образом:
а при нагревании:
Йод реагирует с щелочами исключительно по второму варианту, т.е. с образованием йодата, т.к. гипоиодит не устойчив не только при нагревании, но также при обычной температуре и даже на холоду:
*
Простые вещества — неметаллы.
В простых веществах атомы неметаллов связаны ковалентной неполярной связью. Благодаря этому формируется более устойчивая электронная система, чем у изолированных атомов. При этом образуются одинарные (например, в молекулах водорода $Н_2$, галогенов $F_2, Br_2, I_2$), двойные (например, в молекулах серы $S_2$), тройные (например, в молекулах азота $N_2$) ковалентные связи.
Как вам уже известно, простые вещества — неметаллы могут иметь:
- Молекулярное строение. При обычных условиях большинство таких веществ представляют собой газы ($H_2, N_2, O_2, F_2, Cl_2, O_3$) или твердые вещества ($I_2, P_4, S_8$), и лишь один-единственный бром ($Br_2$) является жидкостью. Все эти вещества имеют молекулярное строение, поэтому летучи. В твердом состоянии они легкоплавки из-за слабого межмолекулярного взаимодействия, удерживающего их молекулы в кристалле, и способны к возгонке.
- Атомное строение. Эти вещества образованы длинными цепями атомов ($Cn, Bn, Sin, Sen, Ten$). Из-за большой прочности ковалентных связей они, как правило, имеют высокую твердость, и любые изменения, связанные с разрушением ковалентной связи в их кристаллах (плавление, испарение), совершаются с большой затратой энергии. Многие такие вещества имеют высокие температуры плавления и кипения, а летучесть их весьма мала.
Многие элементы-неметаллы образуют несколько простых веществ — аллотропных модификаций. Как вы помните, это свойство атомов называют аллотропией. Аллотропия может быть связана и с разным составом молекул ($О_2, О_3$), и с разным строением кристаллов. Аллотропными модификациями углерода являются графит, алмаз, карбин, фуллерен.
Элементы-неметаллы, обладающие свойством аллотропии, обозначены в схеме звездочкой. Так что простых веществ — неметаллов гораздо больше, чем химических элементов — металлов. Вы знаете, что для большинства металлов, за редким исключением (золото, медь и некоторые другие), характерна серебристо-белая окраска. А вот у простых веществ — неметаллов гамма цветов значительно разнообразнее: $P, Se{аморф.}$ — желтые; $Bа{морф.}$ — коричневый; $О{2(ж)}$ — голубой; $Si, As{мет.}$ — серые; $Р_4$ — бледно-желтый; $I{1(г)}$ — фиолетово-черный с металлическим блеском; $Br{2(ж)}$ — бурая жидкость; $Cl{2(г)}$ — желто-зеленый; $F{2(г)}$ — бледно-зеленый; $S{8(т)}$ — желтая.
Несмотря на большие различия в физических свойствах неметаллов, все-таки нужно отметить и некоторые их общие черты. Все газообразные вещества, жидкий бром, а также типичные ковалентные кристаллы — диэлектрики, т.к. все внешние электроны их атомов использованы для образования химических связей. Кристаллы непластичны, и любая деформация вызывает разрушение ковалентных связей. Большинство неметаллов не имеют металлического блеска.
Общие химические свойства неметаллов.
Как мы уже отмечали, для атомов неметаллов, а следовательно, и для образованных ими простых веществ характерны как окислительные, так и восстановительные свойства.
Окислительные свойства простых веществ — неметаллов.
1. Окислительные свойства неметаллов проявляются, в первую очередь, при их взаимодействии с металлами (как вы знаете, металлы — всегда восстановители):
Окислительные свойства хлора $Cl_2$ выражены сильнее, чем у серы, поэтому и металл $Fe$, который имеет в соединениях устойчивые степени окисления $+2$ и $+3$, окисляется им до более высокой степени окисления.
2. Большинство неметаллов проявляют окислительные свойства при взаимодействии с водородом. В результате образуются летучие водородные соединения:
3. Любой неметалл выступает в роли окислителя в реакциях с теми неметаллами, которые имеют более низкое значение электроотрицательности:
Электроотрицательность серы больше, чем у фосфора, поэтому она здесь проявляет окислительные свойства:
Электроотрицательность фтора больше, чем у всех остальных химических элементов, поэтому он проявляет свойства окислителя.
Фтор $F_2$ — самый сильный окислитель из неметаллов, проявляет в реакциях только окислительные свойства.
4. Окислительные свойства неметаллы проявляют и в реакциях с некоторыми сложными веществами.
Отметим, в первую очередь, окислительные свойства неметалла кислорода в реакциях со сложными веществами:
а)${C}↖{-4}H_4+2{O_2}↖{0}→{C}↖{+4}{O_2}↖{-2}+2H_2{O}↖{-2}$
восстановитель ${C}↖{-4}-8{e}↖{-}→{C}↖{+4}|1$
окислитель ${O_2}↖{0}+4{e}↖{-}→2{O}↖{-2}|2$
б)$2{S}↖{+4}O_2+{O_2}↖{0}{→}↖{t°,кат.}2{S}↖{+6}{O_3}↖{-2}$
восстановитель ${S}↖{+4}-2{e}↖{-}→{S}↖{+6}|1$
окислитель ${O_2}↖{0}+4{e}↖{-}→2{O}↖{-2}|2$
Не только кислород, но и другие неметаллы также могут быть окислителями в реакциях со сложными веществами — неорганическими (а, б) и органическими (в, г):
а)$2{Fe}↖{+2}{Cl_2}↖{-1}+{Cl_2}↖{0}=2{Fe}↖{+3}{Cl_3}↖{-1}$
восстановитель ${Fe}↖{+2}-1{e}↖{-}→{Fe}↖{+3}|2$
окислитель ${Cl_2}↖{0}+2{e}↖{-}→2{Cl}↖{-}|1$
Сильный окислитель хлор $Cl_2$ окисляет хлорид железа (II) в хлорид железа (III);
б)$2{K}↖{+1}{I}↖{-1}+{Cl_2}↖{0}={K}↖{+1}{Cl}↖{-1}+{I_2}↖{0}$
восстановитель $2{I}↖{-1}-2{e}↖{-}→{I_2}↖{0}|1$
окислитель ${Cl_2}↖{0}+2{e}↖{-}→2{Cl}↖{-1}|1$
Хлор $Cl_2$ как более сильный окислитель вытесняет иод $I_2$ в свободном виде из раствора иодида калия;
в)${C}↖{-4}H_4+{Cl_2}↖{0}{→}↖{свет}{CH_3}↖{-2}{Cl}↖{-1}+H{Cl}↖{-1}$
восстановитель ${C}↖{-4}-2{e}↖{-}→{C}↖{-2}|1$
окислитель ${Cl_2}↖{0}+2{e}↖{-}→2{Cl}↖{-1}|1$
Галогенирование метана — характерная реакция для алканов;
г)${C}↖{-2}H_2{=}↙{водный р-р}{C}↖{-2}H_2+{Br_2}↖{0}→{C}↖{-1}H_2{Br}↖{-1}-{C}↖{-1}H_2{Br}↖{-1}$
восстановитель ${C}↖{-2}-1{e}↖{-}→{C}↖{-1}|2$
окислитель ${Br_2}↖{0}+2{e}↖{-}→2{Br}↖{-1}|1$
Вы помните, конечно, качественную реакцию на непредельные соединения — обесцвечивание бромной воды.
Восстановительные свойства простых веществ — неметаллов. При рассмотрении реакций неметаллов друг с другом мы уже отмечали, что, в зависимости от значения их электроотрицательности, один из них проявляет свойства окислителя, а другой — свойства восстановителя.
1. По отношению ко фтору все неметаллы (даже кислород) проявляют восстановительные свойства.
2. Разумеется, неметаллы, кроме фтора, служат восстановителями при взаимодействии с кислородом:
В результате реакций образуются оксиды неметаллов: несолеобразующие и солеобразующие кислотные. И хотя галогены непосредственно с кислородом не соединяются, известны их оксиды: ${Cl_2}↖{+1}{O}↖{−2}, {Cl}↖{+4}{O_2}↖{-2}, {Cl_2}↖{+7}{O_7}↖{-2}, {Br_2}↖{+1}{O}↖{-2}, {Br}↖{+4}{O_2}↖{-2}, {I_2}↖{+5}{O_5}↖{-2}$ и др., которые получают косвенным путем.
3. Многие неметаллы могут выступать в роли восстановителя в реакциях со сложными веществами — окислителями:
а)${H_2}↖{0}+{{Cu}↖{+2}O}↙{оксид}{→}↖{t°}{Cu}↖{0}+{H_2}↖{+1}C$
восстановитель ${H_2}↖{0}-2{e}↖{-}→2{H}↖{+1}|1$
окислитель ${Cu}↖{+2}+2{e}↖{-}→{Cu}↖{0}|1$
б)$6{P}↖{0}+5{K{Cl}↖{+5}O_3}↙{соль}{→}↖{t}5K{Cl}↖{-1}+3{P_2}↖{+5}O_5$
восстановитель ${P}↖{0}-5{e}↖{-}→{P}↖{+5}|6$
окислитель ${Cl}↖{+5}+6{e}↖{-}→{Cl}↖{-1}|5$
в)${C}↖{0}+4{H{NO}↖{+5}O_3}↙{кислота}{→}↖{t°}{C}↖{+4}O_2↑+4{N}↖{+4}O_2↑+2H_2O$
восстановитель ${C}↖{0}-4{e}↖{-}→{C}↖{+4}|1$
окислитель ${N}↖{+5}+1{e}↖{-}→{N}↖{+4}|4$
г)
восстановитель ${H_2}↖{0}-2{e}↖{-}→{2H}↖{+}|1$
окислитель ${C}↖{0}+2{e}↖{-}→{C}↖{-2}|1$
Существуют и такие реакции, в которых один и тот же неметалл является одновременно и окислителем, и восстановителем. Это реакции самоокисления-самовосстановления (диспропорционирования):
а)${Cl_2}↖{0}+H_2O⇄H{Cl}↖{-1}+H{Cl}↖{+1}O$
восстановитель ${Cl}↖{0}-1{e}↖{-}→{Cl}↖{+1}|1$
окислитель ${Cl}↖{0}+1{e}↖{-}→{Cl}↖{-1}|1$
б)$3{Cl_2}↖{0}+6KOH=5K{Cl}↖{-1}+K{Cl}↖{+5}O_3+2H_2O$
восстановитель ${Cl}↖{0}-5{e}↖{-}→{Cl}↖{+5}|1$
окислитель ${Cl}↖{0}+1{e}↖{-}→{Cl}↖{-1}|5$
Итак, подведем итоги. Большинство неметаллов могут выступать в химических реакциях как в роли окислителя, так и в роли восстановителя (восстановительные свойства не присущи только фтору $F_2$).
Водородные соединения неметаллов. Общим свойством всех неметаллов является образование летучих водородных соединений, в большинстве из которых неметалл имеет низшую степень окисления.
| Период | Группа | ||||
| III | IV | V | VI | VII | |
| $2$ | ${B_2H_6}↙{диборан}$ | $ {CH_4}↙{метан}$ | $ {NH_3}↙{аммиак}$ | $ {H_2O}↙{вода}$ | $ {HF}↙{фтороводород}$ |
| $3$ | ${SiH_4}↙{силан}$ | $PH_3↙{фосфин}$ | ${H_2S}↙{сероводород}$ | ${HCl}↙{хлороводород}$ | |
| $4$ | ${AsH_3}↙{арсин}$ | ${H_2Se}↙{селеноводород}$ | ${HBr}↙{бромоводород}$ | ||
| $5$ | ${H_3Te}↙{теллуроводород}$ | ${HI}↙{йодоводород}$ |
Среди приведенных формул веществ много таких, свойства, применение и получение которых вы изучали ранее: $CH_4, NH_3, H_2O, H_2S, HCl$.
Известно, что наиболее просто эти соединения можно получить непосредственно взаимодействием неметалла с водородом, т.е. синтезом:
$table 1.H_2+Cl_2=2HCl; 2.N_2+3H_2⇄2NH_3;}$ В промышленности так получают хлороводород и аммиак.
$table 3.C+2H_2=CH_4; 4.2H_2+O_2=2H_2O; 5.H_2+S⇄H_2S;}$ Синтезы метана, воды и сероводорода имеют в основном теоретическое значение.
Все водородные соединения неметаллов образованы ковалентными полярными связями, имеют молекулярное строение и при обычных условиях являются газами, кроме воды (жидкость).
Для водородных соединений неметаллов характерно различное отношение к воде. Метан и силан в ней практически нерастворимы. Аммиак при растворении в воде образует слабое основание — $NH_3·H_2O$.
При растворении в воде сероводорода, селеноводорода, теллуроводорода, а также галогеноводородов образуются кислоты с той же формулой, что и сами водородные соединения: $H_2S, H_2Se, H_2Te, HF, HCl, HBr, HI$.
Если сравнить кислотно-основные свойства водородных соединений, образованных неметаллами одного периода, например, второго ($NH_3, H_2O, HF$) или третьего ($PH_3, H_2S, HCl$), то можно сделать вывод о закономерном усилении их кислотных свойств и, соответственно, ослаблении основных. Это, очевидно, связано с тем, что увеличивается полярность связи Э—Н (где Э — неметалл).
Кислотно-основные свойства водородных соединений неметаллов одной подгруппы также отличаются. Например, в ряду галогеноводородов $HF, HCl, HBr, HI$ прочность связи Э—Н уменьшается, т. к. увеличивается длина связи. В растворах $HCl, HBr, HI$ диссоциируют практически полностью — это сильные кислоты, причем их сила увеличивается от $HF$ к $HI$. При этом $HF$ относится к слабым кислотам, что обусловлено еще одним фактором — межмолекулярным взаимодействием, образованием водородных связей $…Н—F…H—F…$. Атомы водорода связаны с атомами фтора $F$ не только своей молекулы, но еще и соседней.
Обобщая сравнительную характеристику кислотно-основных свойств водородных соединений неметаллов, сделаем вывод об усилении кислотных и ослаблении основных свойств этих веществ по периодам и главным подгруппам с увеличением атомных номеров образующих их элементов.
Кроме рассмотренных свойств, водородные соединения неметаллов в окислительно-восстановительных реакциях всегда проявляют свойства восстановителей, ведь в них неметалл имеет низшую степень окисления.
*
*
Химические свойства водорода.
В свободном состоянии водород существует в виде молекул $H_2$, атомы связаны в молекулу ковалентной неполярной связью.
Водород ($Н$) — самый легкий газ из всех газообразных веществ. Имеет самую высокую теплопроводность и самую низкую температуру кипения (после гелия). Малорастворим в воде. При температуре $–252,8°С$ и атмосферном давлении водород переходит в жидкое состояние.
1. Молекула водорода очень прочная, что делает ее малоактивной:
$H_2=2H – 432$ кДж$.
2. При обычных температурах водород вступает в реакцию с активными металлами:
$Ca+H_2=CaH_2$,
образуя гидрид кальция, и с $F_2$, образуя фтороводород:
$F_2+H_2=2HF$.
3. При высоких температурах получают аммиак:
$N_2+3H_2=2NH_3$.
и гидрид титана (металл в порошке):
$Ti+H_2=TiH_2$.
4. При поджигании водород реагирует с кислородом:
$2H_2+O_2=2H_2O+484 кДж$.
5. Водород обладает восстановительной способностью:
$CuO+H_2=Cu+H_2O$.
Химические свойства галогенов: хлор, бром, йод.
У галогенов наиболее ярко выражены свойства неметаллов.
Внешний энергетический уровень у атомов галогенов содержит семь электронов, что соответствует номеру группы Периодической системы — VII. Два электрона занимают s-орбиталь, пять — $p$-орбитали. Для элементов этой группы при увеличении числа заполненных электронами уровней размер атомов возрастает, а прочность связи с ядром снижается.
Молекулы галогенов двухатомные ($Cl_2, Br_2, I_2$). Галогены — вещества молекулярного строения. Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярной массы этих веществ. Хлор — газ желто-зеленого цвета, бром — красно-коричневая жидкость, йод — твердое вещество серо-фиолетового цвета. Водные растворы галогенов в воде называют хлорной, бромной и йодной водой.
1. Галогены — сильные окислители. Они окисляют простые и сложные вещества:
2. По окислительной активности каждый вышестоящий в Периодической таблице галоген является более сильным по отношению к нижестоящему. Поэтому каждый галоген вытесняет любой нижестоящий из его соединений:
3. Галогены активно реагируют с неметаллами:
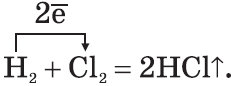
4. Галогены реагируют с водой, образуя атомарный кислород:
$H_2O+Cl_2=2HCl+O; O+O=O_2$.
5. Галогены очень активны в присутствии воды. Так, сухой хлор хранят в железных баллонах, а во влажном хлоре железо быстро ржавеет (совместное действие с водой продуктов реакции — кислоты и атомарного кислорода).
Водный раствор хлороводорода $HCl$ называют соляной, или хлороводородной, кислотой. Ей присущи все свойства кислот. Соляная кислота принимает участие в пищеварении живых организмов. В огромных масштабах соляная кислота используется во многих отраслях промышленности: химической, нефтедобывающей и нефтеперерабатывающей.
*
*
Химические свойства кислорода.
Кислород ($O$) — самый распространенный элемент на Земле. Он находится в атмосфере ($21%$ по объему), в земной коре ($92%$), в гидросфере ($89%$).
Кислород находится в VI группе Периодической системы, в главной подгруппе. Кислород проявляет во всех соединениях валентность II. Это низшая валентность из шести возможных в этой группе.
Кислород образует молекулы O2. Это газ без запаха, цвета и вкуса. Плотность кислорода при $0°С$ и давлении $1$ атм. $1,43$ г/л, что в $1,11$ раза больше плотности воздуха. Кислород малорастворим в воде. При $20°С$ и атмосферном давлении в $100$ объемах воды растворяется $3$ объема $O_2$. Температура кипения кислорода равна $–183°С$; при этой температуре и давлении $1$ атм. кислород превращается в жидкость голубого цвета.
Кислород является одним из самых активных веществ, легко вступающих в химические реакции.
Взаимодействие веществ с кислородом называется реакцией окисления этих веществ. Кислород принимает участие в таких окислительных процессах: горение, дыхание, ржавление металлов, гниение растительных и животных останков.
Реакции окисления, сопровождающиеся выделением теплоты и света, называются реакциями горения:
а) горение простых веществ:
— неметаллов:
$C+O_2=CO_2; S+O_2=SO_2; 4P+5O_2=2P_2O_5;$
— металлов:
$3Fe+2O_2=Fe_3O_4$, или $FeO·Fe_2O_3$.
Эти процессы горения происходят быстро. Возможно и медленное горение — окисление:
$2Cu+O_2=2CuO$;
б) горение сложных веществ:
$2{C_2H_2}↙{ацетилен}+5O_2→4CO_2+2H_2O$
У кислорода есть аллотропная модификация — озон $O_3$. Он образуется под воздействием солнечного излучения или электрического разряда:
Озон обладает запахом свежести. Разный состав молекул кислорода и озона определяет их разные свойства. Молекула озона очень непрочная, легко вступает в химические реакции. Озон проявляет сильные окислительные свойства, разрушает органические вещества (резину), окисляет металлы ($Au, Pt, Ag$):
${Ag+O_3=AgO+O_2↑}↙{text «(с кислородом серебро не реагирует)» }$
Химические свойства серы.
Атомы серы, как и атомы кислорода, имеют на внешнем энергетическом уровне $6{e}↖{-}$, два из них — неспаренные. Однако по сравнению с атомами кислорода атомы серы имеют больший радиус, меньшее значение электроотрицательности, поэтому проявляют восстановительные свойства, образуя соединения со степенями окисления $+2,+4,+6$. По отношению к водороду и металлам сера проявляет окислительные свойства со степенью окисления $–2$.
Сера ($S$) — твердое кристаллическое вещество желтого цвета, имеет молекулярную кристаллическую решетку, легко плавится, в воде нерастворима. Для серы характерна аллотропия. Ромбическая сера $S_8$ — стабильная модификация. Образует кристаллы октаэдрической формы лимонно-желтого цвета с $t°{пл}=112,8°С$. Моноклинная сера имеет игольчатые кристаллы с $t°{пл}=119,3°С$, легко переходит в ромбическую. Пластическая сера имеет линейное строение молекул, темно-коричневый цвет. Ее получают при выливании расплавленной при $160°С$ серы в холодную воду — образуется резиноподобная темно-коричневая масса.
В таблице обобщены химические свойства серы и ее соединений.
Сера и ее соединения.
| Сера | Соединения серы | |
| Оксиды серы | Серная кислота | |
| 1. При обычных условиях — твердое желтое кристаллическое вещество. 2. Горит в кислороде: $S+O_2=SO_2$ (проявляет восстановительные свойства). 3. Взаимодействует с металлами и водородом: $Fe+S=FeS$ $H_2+S=H_2S$ (проявляет окислительные свойства) В природе самородная сера $S$, сульфиды: $FeS_2$ (пирит), $CuS$; сульфаты: $CaSO_4·2H_2O$ (гипс), $Na_2SO_4$ |
1. При обычных условиях $SO_2$ — газ, $SO_3$ — жидкое вещество ($t°*{пл}=16,8°С$). 2. Проявляют свойства кислотных оксидов, взаимодействуя: — с водой: $SO_2+H_2O⇄H_2SO_3$ $SO_3+H_2O=H_2SO_4$ — со щелочами: $SO_2+2NaOH=Na_2SO_3+H_2O$ $SO_3+2NaOH=Na_2SO_4+H_2O$ — с основными оксидами: $SO_3+CaO=CaSO_4$ Получение: 1) оксида серы (IV) а) в промышленности: — горение серы $S+O_2=SO_2$ — обжиг пирита $4FeS_2+11O_2=2Fe_2O_3+8SO_2$ б) в лаборатории: $Na_2SO_3+H_2SO_4=Na_2SO_4+SO_2↑+H_2O$; 2) оксида серы (VI) в промышленности — каталитическое окисление оксида серы (IV): $2SO_2+O_2=2SO_3$ |
1. При обычных условиях — бесцветная тяжелая жидкость ($ρ≈2 г/см^3$), неограниченно растворимая в воде. 2. Сильная двухосновная кислота: $H_2SO_4=H^{+}+HSO_4^{-}⇄2H^{+}+SO_4^{2-}$ 3. Взаимодействует с металлами: $Zn+H_2SO_4=ZnSO_4+H_2↑$ В концентрированной кислоте пассивируются $Al$ и $Fe$. 4. Взаимодействует со щелочами, основаниями и амфотерными гидроксидами: $H_2SO_4+2NaOH=Na_2SO_4+2H_2O$ $H_2SO_4+Cа(OH)_2=CаSO_4+2H_2O$ $3H_2SO_4+2Al(OH)_3=Al_2(SO_4)_3+6H_2O$ 5. Взаимодействует с основными и амфотерными оксидами: $H_2SO_4+CuO=CuSO_4+H_2O$ $H_2SO_4+ZnO=ZnSO_4+H_2O$ 6. Концентрированная кислота гигроскопична:  Получение в промышленности в соответствии со схемой: $FeS_2(или S){→}↖{O_2}SO_2{→}↖{O_2}SO_3{→}↖{H_2O}H_2SO_4$ |
Химические свойства азота.
Азот ($N$) — первый представитель главной подгруппы V группы Периодической системы. Его атомы содержат на внешнем энергетическом уровне пять электронов, из которых три — неспаренные. Значит, атомы азота могут присоединять три электрона, завершая внешний энергетический уровень, и вследствие этого приобретают степени окисления $–3$ в соединениях с водородом (аммиак $NH_3$) и с металлами (нитриды $Li_3N, Mg_3N_2$).
Отдавая свои внешние электроны более электроотрицательным элементам (фтору, кислороду), атомы азота приобретают степени окисления $+3$ и $+5$. Атомы азота проявляют восстановительные свойства в степенях окисления $+1, +2, +4$.
Азот существует в свободном состоянии в виде молекулы $N_2$, атомы связаны прочной ковалентной связью $N≡N$. Азот — бесцветный газ без запаха и вкуса, в атмосфере его содержится $78%$. Азот — составная часть живых организмов.
Важнейшими соединениями азота являются аммиак, азотная кислота и ее соли. Азотная кислота и аммиак производятся в промышленности в больших объемах, т.к. соли ($NH_4NO_3, KNO_3$) являются удобрениями. Азотная кислота используется для получения красителей, пластмасс, взрывчатых веществ, лекарств.
Азот — жизненно важный элемент, поэтому круговорот азота в природе обеспечивает им атмосферу, почву, растительные и живые организмы.
В таблице обобщены химические свойства азота и его соединений.
Азот и его соединения.
| Азот | Соединения азота | ||
| Аммиак | Оксиды азота | Азотная кислота | |
| 1. Очень прочная и поэтому малореакционноспособная молекула. 2. Проявляет окислительные свойства (в реакциях с водородом и металлами): $N_2+3H_2⇄2NH_3$ $N_2+3Mg=Mg_3N_2 3. Проявляет восстановительные свойства (в реакции с кислородом): $N_2+O_2=2NO$ Получение 1. В промышленности ректификацией жидкого воздуха. 2. В лаборатории термическим разложением нитрита аммония: $NH_4NO_2→↖{t°}N_2+2H_2O$ |
1. При н.у. бесцветный, резко пахнущий газ. 2. Взаимодействует с водой, образуя раствор слабого основания: $NH_3+H_2O⇄NH_4^{+}+OH^{–}$ 3. Схема электронного строения иона аммония: 4. Взаимодействует с кислотами: $NH_3+H^{+}=NH_4^+$ 5. Проявляет восстановительные свой ства: $2NH_3+3CuO{→}↖{t°}3Cu+3H_2O+N_2$ $4NH_3+3O_2=2N_2+6H_2O$ $4NH_3+5O_2{→}↖{кат}4NO+6H_2O$ Получение 1. В промышленности: $N_2+3H_2⇄2NH_3+92кДж$ 2. В лаборатории: $2NH_4Cl+Ca(OH)_2=CaCl_2+2NH_3↑+2H_2O$ |
1. Оксид азота (II) окисляется кислородом воздуха при комнатной температуре:
$2NO+O_2=2NO_2$ 2. Оксид азота (IV) взаимодействует с водой в присутствии кислорода: $4NO_2+O_2+2H_2O=4HNO_3$ Образуются при взаимодействии: 1) азота с кислородом при высокой температуре или в условиях электрического разряда: $N_2+O_2=2NO$ 2) аммиака с кислородом в присутствии катализатора: $4NH_3+5O_2{→}↖{кат}4NO+6H_2O;$ 3) меди с азотной кислотой: а) концентрированной: $Cu+4HNO_3=Cu(NO_3)_2+2NO_2↑+2H_2O;$ б) разбавленной: $3Cu+8HNO_3=3Cu(NO_3)_2+2NO↑+4H_2O$ |
1. Неустойчива, разлагается под действием света:
$4HNO_3=2H_2O+4NO_2↑+O_2↑$ 2. Является сильной кислотой, диссоциирует необратимо в водном растворе: $HNO_3+H_2O=H_3O^{+}+NO_3^−$ 3. Взаимодействует с основными оксидами: $CаO+2HNO_3=Cа(NO_3)_2+H_2O$ $CаO+2H^{+}=Cа^{2+}+H_2O$ 4. Взаимодействует с основаниями: $Fe(OH)_3+3HNO_3=Fe(NO_3)_3+3H_2O$ $Fe(OH)*3+3H^{+}=Fe^{3+}+3H_2O$ 5. Реагирует с металлами без выделения водорода и по-разному — в зависимости от концентрации кислоты и активности металла. Получение 1. В промышленности взаимодействием оксида азота (IV) с водой и кислородом: $4NO_2+O_2+2H_2O=4HNO_3$ 2. В лаборатории вытеснением из солей нелетучей кислотой при нагревании: $2NaNO*{3,кр}+H_2SO_4=2HNO_3+Na_2SO_4$ |
Химические свойства фосфора.
Фосфор ($P$) — аналог азота. Однако атом фосфора характеризуется большим радиусом, меньшим значением электроотрицательности и более выраженными восстановительными свойствами. У фосфора реже встречается степень окисления $–3$ (только в фосфидах $Ca_3P_2, Na_3P$), чаще фосфор в соединениях имеет степень окисления $+5$, а вот соединение фосфин ($PH_3$) — тот редкий случай, когда ковалентная связь между атомами разных элементов неполярная, т.к. электроотрицательности фосфора почти одинаковы.
Химический элемент фосфор образует несколько аллотропных модификаций. Рассмотрим два простых вещества фосфора: белый фосфор и красный фосфор. Белый фосфор имеет молекулярную кристаллическую решетку из молекул $P_4$. Он в порошкообразном состоянии воспламеняется, светится в темноте, ядовит. Красный фосфор имеет атомную кристаллическую решетку, окисляется на воздухе медленно, нерастворим, неядовит, не светится. Химические свойства фосфора и его соединений представлены в таблице.
В природе фосфор в свободном виде не встречается — только в виде соединений.
Фосфор также является составной частью тканей организма человека, животных и растений.
Фосфор и его соединения.
| Фосфор | Соединения фосфора | |
| Оксид фосфора (V) | Фосфорная кислота | |
| 1. При обычных условиях может существовать в виде двух аллотропных модификаций: красный и белый.
2. Горит в кислороде: $4P+5O_2=2P_2O_5$ (проявляет восстановительные свойства). Белый фосфор окисляется на воздухе при комнатной температуре: $P_4+3O_2=2P_2O_3$ Получение $2Ca_3(PO_4)_2+10C+6SiO_2=P_4↑+10CO↑+6CaSiO_3–Q$ |
1. При обычных условиях очень гигроскопическое твердое вещество белого цвета.
2. Проявляет свойства кислотных оксидов, взаимодействуя — с водой: $P_2O_5+3H_2O=2H_3PO_4$ — со щелочами: $P_2O_5+6NaOH=2Na_3PO_4+3H_2O$ — с основными оксидами: $P_2O_5+3CaO=Ca_3(PO_4)_2$ Получение Сжигание фосфора в избытке воздуха: $4P+5O_2=2P_2O_5$ |
1. При обычных условиях бесцветное твердое вещество, неограниченно растворимое в воде.
2. Слабая трехосновная кислота: $H_3PO_4⇄H^{+}+H_2PO_4^{-}⇄2H^{+}+HPO_4^{2−}⇄3H^{+}PO_4^{3−}$ 3. Взаимодействует со щелочами, основаниями и амфотерными гидроксидами, а также с аммиаком: $H_3PO_4+3NaOH=Na_3PO_4+3H_2O$ $2H_3PO_4+3CaO=Ca_3(PO_4)_2+3H_2O$ $Ca_3(PO_4)_2+4H_3PO_4=3Ca(H_2PO_4)_2$ 1) по реакции оксида фосфора (V) с водой: $P_2O_5+3H_2O=2H_3PO_4;$ $Ca_3(PO_4)_2+3H_2SO_4{→}↖{t°}3CaSO_4+2H_3PO_4$ |
Химические свойства углерода.
Углерод ($C$) — первый элемент главной подгруппы IV группы Периодической системы. На его высшем энергетическом уровне $4$ электрона, поэтому его атомы могут принимать четыре электрона, приобретая степень окисления $–4$, т.е. проявлять окислительные свойства, и отдавать свои электроны, проявляя восстановительные свойства, приобретая степень окисления $+4$.
О свойствах аллотропных модификаций алмаза и графита мы уже говорили ранее. Химические свойства углерода и его соединений обобщены в таблице.
Углерод — это особый химический элемент. Он — основа многообразия органических соединений, из которых построены все живые организмы на планете.
Углерод и его соединения.
| Углерод | Соединения углерода | |
| Оксид углерода (IV) | Угольная кислота | |
| 1. Имеет аллотропные модификации: алмаз, графит, карбин, фуллерен. 2. Проявляет восстановительные свойства: а) горит в кислороде: $C+O_2=CO_2+Q$ неполное сгорание: $2C+O_2=2CO+Q;$ б) взаимодействует с оксидом углерода (IV), образуя ядовитое вещество — угарный газ: $C+CO_2=2CO;$ в) восстанавливает металлы из их оксидов: $C+2CuO=CO_2+2Cu$ Получение Неполное сжигание метана: $CH_4+O_2=C+2H_2O$ |
1. Газ без запаха, цвета и вкуса, тяжелее воздуха. 2. Кислотный оксид. 3. При растворении взаимодействует с водой: $CO_2+H_2O⇄H_2CO_3$ 4. Реагирует с основаниями (известковая вода при его пропускании мутнеет): $CO2+Ca(OH)_2=CaCO_3↓+H_2O$ 5. Реагирует с основными оксидами: $CO_2+CaO=CaCO_3$ 6. Образуется в реакциях: — горения углерода в кислороде: $C+O_2=CO_2$ — окисления оксида углерода (II): $2CO+O_2=2CO_2$ — сгорания метана: $CH_4+2O_2=CO_2+2H_2O$ — взаимодействия кислот с карбонатами: $CaCO_3+2HCl=CaCl_2+CO_2↑+H_2O$ — термического разложения карбонатов и гидрокарбонатов: $CaCO_3=CaO+CO_2↑$ $2NaHCO_3=Na_2CO_3+CO_2↑+H_2O$ — окислительных биохимических процессов дыхания, гниения |
1. Непрочная молекула. Слабая двухосновная кислота. Равновесие в водном растворе: $CO_2+H_2O⇄H_2CO_3⇄H^{+}+HCO_3^{−}⇄2H^{+}+CO_3^{2−}$ 2. Взаимодействует с растворами щелочей как раствор углекислого газа в воде с образованием кислых (гидрокарбонатов) и средних (карбонатов) солей: $CO_2+NaOH=NaHCO_3$ $CO_2+2NaOH=Na_2CO_3+H_2O$ 3. Вытесняется из солей более сильными кислотами: $CaCO_3+2HCl=CaCl_2+CO_2↑+H_2O$ 4. Соли угольной кислоты подвергаются гидролизу: $2Na^{+}+CO_3^{2−}+H_2O⇄2Na^{+}+HCO_3^{−}+OH^{–}$ $CO_3^{2−}+H_2O⇄HCO_3^{−}+OH^–$ |
Химические свойства кремния.
Кремний ($Si$) — второй представитель главной подгруппы IV группы. По распространенности в природе кремний — второй после кислорода. Наиболее распространенными соединениями кремния являются диоксид кремния $SiO_2$ — кремнезем и силикаты.
Кристаллический кремний имеет структуру алмаза, очень хрупок, относится к тугоплавким веществам. При обычных условиях инертен, что объясняется прочностью его кристаллической решетки. В таблице обобщены химические свойства кремния и его соединений.
Соединения кремния служат основой производства стекла и цемента. Состав оконного стекла: $Na_2O·CaO·6SiO_2$.
Кремний и его соединения.
| Кремний | Соединения кремния | |
| Оксид кремния (IV) | Кремниевая кислота | |
| 1. Обладает полупроводниковыми свойствами. 2. Горит в кислороде: $Si+O_2=SiO_2+Q$ Получение — Восстановление оксида кремния (IV) углеродом (в промышленности): $SiO_2+2C=Si+2CO$ — порошком магния (в лаборатории): $SiO_2+2Mg=Si+2MgO$ |
1. Твердое бесцветное прозрачное вещество, легко затвердевающее в виде стекла. 2. В воде не растворяется и с водой не реагирует. 3. Как кислотный оксид взаимодействует с: а) щелочами: $SiO_2+2NaOH=Na_2SiO_3+H_2O;$ б) основными оксидами: $SiO_2+CaO=CaSiO_3$ 4. Вытесняет из солей летучие кислоты (реакции, лежащие в основе варки стекла): $SiO_2+Na_2CO_3=Na_2SiO_3+CO_2↑$ $SiO_2+CaCO_3=CaSiO_3+CO_2↑$ |
1. Очень слабая двухосновная не растворимая в воде кислота состава $mSiO_2·nH_2O(H_2SiO_3)$ 2. Разлагается уже при несильном нагревании: $H_2SiO_3=SiO_2+H_2O$ 3. Соли кремниевой кислоты (силикаты) подвергаются гидролизу: $4Na^{+}+2SiO_3^{2-}+2H_2O⇄4Na^{+}+Si_2O_5^{2−}+2OH^–$ $2SiO_3^{2-}+2H_2O⇄Si_2O_5^{2−}+2OH^–$ Получение Действие кислот на растворимые силикаты: $Na_2SiO_3+2HCl=2NaCl+H_2SiO_3↓$ |