Применение веществ в быту и промышленности. ЕГЭ по химии.
Ниже представлены вещества, применение которых на ЕГЭ по химии спрашивается наиболее часто
| Нитрат натрия Нитрат калия Нитрат аммония |
Азотсодержащие удобрения (селитры). |
| Фосфат кальция Гидрофосфат кальция Суперфосфат |
Фосфорные удобрения |
| Оксид кремния (IV) | Производство керамических изделий. |
| Пальмитат натрия/калия Стеарат натрия/калия |
Мыла Натриевые соли высших карбоновых кислот – твердые мыла, а калиевые соли высших карбоновых кислот – жидкие мыла. |
| Сера | Используется при производстве резины. Для этого серу нагревают (вулканизируют) с каучуком. |
| Гидрокарбонат натрия. | Твердое вещество, использующееся в качестве разрыхлителя теста, а также в качестве чистящего средства. |
| Карбонат аммония | Используется как разрыхлитель теста благодаря тому, что при нагревании образует газообразные продукты разложения в соответствии с уравнением: (NH4)2CO3 => 2NH3 + CO2 + H2O |
| Этановая (уксусная) кислота | Используется для консервирования овощей. Концентрированные растворы вызывают ожоги. |
| Активированный уголь | Твердое вещество черного цвета используется в качестве поглотителя (адсорбента) в фильтрах, а также как лекарственное средство при различных видах отравлений. |
| Этанол (этиловый спирт). C2H5OH |
Основной компонент алкогольных напитков, может быть использован в качестве топлива. Жидкость со специфическим запахом. |
| Глицерин | Используется в парфюмерии и пищевой промышленности. |
| Ацетон | Распространенный растворитель. |
| Тетрахлорид углерода CCl4 | Растворитель. |
| Аммиак | Сырье для получения удобрений (нитратов калия, натрия, аммония). Сырье для получения азотной кислоты. |
| Аммиак раствор | Используется как компонент стеклоочистительных жидкостей, жидкость с резким запахом. В аптечке – нашатырный спирт, применяется для приведения в чувство человека, потерявшего сознание. |
| Озон O3 | Дезинфекция (очистка) воды. |
| Хлор Cl2 | Дезинфекция (очистка) воды. |
| Ацетилен C2H2 | Используется для сварки и резки металла благодаря тому, что при горении ацетилена развивается крайне высокая температура – около 3000 оС |
| Метан | Основной компонент природного газа. Горючее для газовых плит. |
| Лимонная кислота | Используется для удаления накипи с внутренней поверхности чайника. |
| Пероксид водорода | Используется в качестве антисептика (дезинфицирующего средства) при обработке небольших ран и порезов. |
| Хлоропрен (2-хлорбутадиен-1,3) Изопрен (2-метилбутадиен-1,3) Бутадиен (дивинил) |
Сырье для производства каучука. |
| Йод | Спиртовой раствор данного вещества используется для дезинфекции мелких порезов и царапин. |
| Анилин | Производство красителей |
- Дисциплина: Химия
- Номер вопроса в билете: 26
- Баллы: 1
- Сложность: Базовый
-
Установите соответствие между используемым в быту веществом и способом его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
-
ВЕЩЕСТВО
- А)гидрокарбонат натрия
- Б)этановая кислота
- В)активированный уголь
-
ПРИМЕНЕНИЕ
- 1)используется для консервирования овощей
- 2)используется в качестве поглотителя примесей в фильтрах для воды
- 3)используется и как разрыхлитель теста, и как чистящее вещество
- 4)используется для мытья рук и стирки белья
Баллы: 0 из 1
| Гидрокарбонат натрия | |
|---|---|
 |
|
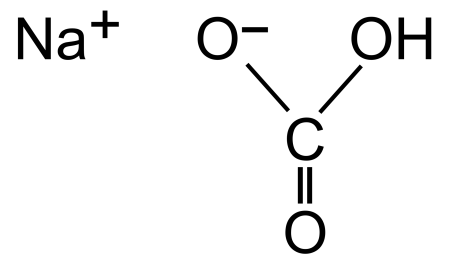 |
|
| Систематическое наименование |
гидрокарбонат натрия |
| Традиционные названия | пищевая (питьевая) сода, сода двууглекислая, двууглекислый натрий, бикарбонат натрия, кислый углекислый натрий |
| Хим. формула | CHNaO₃ |
| Рац. формула | NaHCO3 |
| Состояние | твёрдое |
| Молярная масса | 84,0066 г/моль |
| Плотность | 2,159 г/см³ |
| Т. разл. | 60—200 °C |
| Растворимость в воде | 9,59 г/100 мл |
| ГОСТ | ГОСТ 2156-76 ГОСТ 4201-79 ГОСТ 32802-2014 |
| Рег. номер CAS | 144-55-8 |
| PubChem | 516892 |
| Рег. номер EINECS | 205-633-8 |
| SMILES |
[Na+].OC([O-])=O |
| InChI |
1S/CH2O3.Na/c2-1(3)4;/h(H2,2,3,4);/q;+1/p-1 UIIMBOGNXHQVGW-UHFFFAOYSA-M |
| Рег. номер EC | 205-633-8 |
| Кодекс Алиментариус | E500(ii) |
| RTECS | VZ0950000 |
| ChEBI | 32139 |
| ChemSpider | 8609 |
| ЛД50 | 4220 мг/кг |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Гидрокарбонат натрия (лат. Natrii hydrocarbonas), другие названия: бикарбонат натрия, чайная сада, питьевая или пищевая сода, двууглекислый натрий — неорганическое соединение, натриевая кислая соль угольной кислоты с химической формулой NaHCO3.
В обычном виде — мелкокристаллический порошок белого цвета.
Используется в промышленности, пищевой промышленности, в кулинарии, в медицине как нейтрализатор химических ожогов кожи и слизистых оболочек концентрированными кислотами и для снижения кислотности желудочного сока. Также применяется в буферных растворах.
Содержание
- 1 Химические свойства
- 1.1 Реакция с кислотами
- 2 Термическое разложение
- 3 Получение
- 4 Применение
- 4.1 В химической промышленности
- 4.2 В кулинарии
- 4.3 В медицине
- 4.3.1 Противопоказания к применению в медицинских целях
- 4.4 Пожаротушение
- 4.5 В быту
- 4.6 В транспорте
- 5 Производство
- 6 Хранение
- 7 Безопасность
Химические свойства
Гидрокарбонат натрия — кислая натриевая соль угольной кислоты. Проявляет все свойства соли сильного основания и слабой кислоты. В водных растворах имеет слабощелочную реакцию. В широком диапазоне концентраций в водном растворе pH раствора изменяется незначительно, на этом основано применение раствора вещества в качестве буферного раствора.
Реакция с кислотами
Гидрокарбонат натрия реагирует с кислотами с образованием соответствующей кислоте соли, например, хлорида натрия, сульфата натрия и угольной кислоты, которая в процессе реакции распадается на углекислый газ и воду, при этом углекислый газ выделяется из раствора в виде пузырьков:
- NaHCO3 + HCl → NaCl + H2CO3
- H2CO3 → H2O + CO2↑
- 2NaHCO3 + H2SO4 → Na2SO4 + 2H2O + 2CO2↑
В быту обычно применяется реакция «гашения соды» уксусной кислотой, с образованием ацетата натрия или гашение лимонной кислотой с образование цитрата натрия, реакция с уксусной кислотой:
- NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑
Термическое разложение
При температуре выше 60 °C гидрокарбонат натрия начинает распадаться на карбонат натрия, углекислый газ и воду (процесс разложения наиболее эффективен при 200 °C, при более высоких температурах карбонат натрия начинает распадаться на оксид натрия и углекислый газ):
- 2NaHCO3 →60−200∘C Na2CO3 + H2O + CO2↑
При этом процессе выделения воды в виде водяного пара и углекислого газa масса исходного продукта уменьшается примерно на 37 %.
Получение
В промышленности гидрокарбонат натрия получают аммиачно-хлоридным способом. В концентрированный раствор хлорида натрия, насыщенный аммиаком, под давлением пропускают углекислый газ. В процессе синтеза происходят две реакции:
- NH3 + CO2 + H2O → NH4HCO3
- NH4HCO3 + NaCl → NaHCO3↓ + NH4Cl
В холодной воде гидрокарбонат натрия мало растворим, и его отделяют от охлаждённого раствора фильтрованием, а из полученного после фильтрования раствора хлорида аммония снова получают аммиак, возвращаемый в производство вновь:
- 2NH4Cl + Ca(OH)2 → 2NH3↑ + CaCl2 + 2H2O
Применение
Двууглекислый натрий (бикарбонат) применяется в химической, пищевой, лёгкой, медицинской, фармацевтической промышленности, цветной металлургии, в быту. Зарегистрирован в качестве пищевой добавки E500 (ii), входит в состав пищевой добавки E500.
В химической промышленности
Применяется для производства красителей, пенопластов и других органических продуктов, фторорганических соединений, продуктов бытовой химии, наполнителей в огнетушителях, Реагент для отделения диоксида углерода, сероводорода из газовых смесей, например, отходящих газов топливосжигающих установок. В этом процессе углекислый газ поглощается раствором гидрокарбоната натрия при повышенном давлении и пониженной температуре, далее поглощённый углекислый газ выделяется из раствора при подогреве и снижении давления;
В лёгкой промышленности — в производстве резины для подошв обуви и в производстве искусственных кож, кожевенном производстве при дублении и нейтрализации кожи после кислого дубления, текстильной промышленности при отделке шёлковых и хлопчатобумажных тканей;
В пищевой промышленности — в хлебопечении, производстве кондитерских изделий, приготовлении газированных напитков.
В кулинарии
Основное применение пищевой соды в пищевой промышленности и в быту — кулинария, где применяется, преимущественно, в качестве основного или дополнительного разрыхлителя в составе кислого и пресного теста. При добавлении питьевой соды в кислое тесто происходит реакция с молочной кислотой, продуцированной при заквашивании дрожжевыми микроорганизмами, при этой реакции выделяется углекислый газ, вспучивающий тесто.
При добавлении в пресное тесто углекислый газ выделяется при выпечке из-за термического разложения.
При применении соды в чистом виде важно соблюсти правильную дозировку, так как она оставляет в продукте карбонат натрия, дающий определённый привкус. Порядок замешивания для теста: соду — в муку, кислые компоненты (уксус, кефир и пр.) — в жидкость.
В медицине
Традиционно раствор питьевой соды используется для дезинфекции зубов и дёсен при зубных болях и полости рта и горла, при сильном кашле, ангине, фарингите, а также как общепринятое средство от изжоги и болей в желудке.
Применяется при заболеваниях, сопровождающиеся выраженным ацидозом (при диабете, инфекциях и др), для борьбы с ацидозом при хирургических вмешательствах (назначается 3-5 г. внутрь).
Применяется в качестве антиаритмического средства.
Как антацидное средство (как и все другие щелочи) применяется при язвенной болезни желудка, и двенадцатиперстной кишки, при повышенной кислотности желудочного сока.
Имеются так же данные о применении препарата (в виде капельных и внутривенных вливаний) при гипертонической болезни, симптоматической почечной гипертонии, и хронической почечной недостаточности. Эффект связан с увеличением выделения ионов натрия и хлора и возрастанием осмотического диуреза.
В виде свечей применяется против укачивания при морской и воздушной болезнях
Применяется в качестве отхаркивающего средства, т.к. повышая щелочные резервы крови, сдвигает в щелочную сторону реакцию бронхиальной слизи, делая мокроту менее вязкой.
При ринитах, конъюнктивитах, стоматитах, ларингитах и т.п. применяют для полосканий, промываний, ингаляций 0,5 — 2% р-ры гидрокарбоната натрия.
Применяется внутривенно с целью быстрого устранения метаболического ацидоза во время реанимационных мероприятий, заболеваниях почек.
Нужно иметь ввиду, что в результате применения может возникнуть т.н. кислотный рикошет (при реакции содой с соляной кислотой происходит выделение CO2, который оказывает раздражающее действие на стенку желудка, усиливая выделение гастрина).
В альтернативной медицине питьевая сода иногда заявляется как «лекарство» от рака, однако, никакой экспериментально подтверждённой эффективности применения такого «лечения» не существует.
Противопоказания к применению в медицинских целях
Индивидуальная гиперчувствительность; состояния, сопровождающиеся развитием алкалоза; гипокальциемия, при приеме внутрь усиливает алкалоз и повышает риск развития тетанических судорог, гипохлоремия — снижение концентрации в крови ионов Cl—, в том числе вызванная рвотой, или снижением всасывания в желудочно-кишечном тракте, может привести к тяжёлому алкалозу.
Является источником натрия, тем самым увеличивая объём циркулирующей крови, усугубляя отёки и повышая артериальное давление. Применение при сниженной скорости клубочковой фильтрации может привести к метаболическому алкалозу.
Пожаротушение
Гидрокарбонат натрия вместе с карбонатом аммония используется в качестве наполнителя в огнетушителях с сухим наполнением и в стационарных системах сухого пожаротушения. Это применение обусловлено тем, что от воздействия высокой температуры в очаге горения вещество выделяет углекислый газ, атмосфера которого затрудняет доступ кислорода воздуха в очаг горения.
В быту
Применяется как безопасное для здоровья средство для чистки поверхностей столовой и кухонной посуды, поверхностей кухонных столов, иных поверхностей, соприкасающихся с пищей, путем протирки их с помощью влажной тряпки с сухим порошком питьевой соды.
В транспорте
Применяется для нейтрализации следов электролита — серной кислоты на поверхности пластмассовых корпусов свинцовых аккумуляторов насыщенным водным раствором питьевой соды.
Производство
В Российской Федерации двууглекислый натрий выпускается в соответствии с требованиями и техническими условиями, выпускается на предприятиях АО «Башкирская содовая компания» в г. Стерлитамак, Республика Башкортостан, а также на Крымском содовом заводе в г. Красноперекопск, Крымский полуостров.
Хранение
Гидрокарбонат натрия хранят в закрытых упаковках, в сухом месте вдали от источников огня. Гарантийный срок хранения натрия двууглекислого — 12 месяцев со дня изготовления. Срок годности не ограничен.
Безопасность
Вещество нетоксично, пожаро- и взрывобезопасно.
Имеет солоноватый, мыльный вкус. При попадании пыли вещества на слизистые оболочки глаз и носа вызывает лёгкое раздражение. При частой работе в атмосфере, загрязнённой пылью двууглекислого натрия, может возникнуть раздражение верхних дыхательных путей. Предельно допустимая концентрация пыли бикарбоната натрия в воздухе производственных помещений 5 мг/м3.
- ГОСТ 2156-76. Натрий двууглекислый. Технические условия (с Изменениями № 1, 2, 3, 4).
- ГОСТ 32802-2014. Добавки пищевые. Натрия карбонаты E500. Общие технические условия.
Гидрокарбонат натрия (бытовое название – «питьевая сода») – неорганическое вещество, представляет собой кислую натриевую соль угольной кислоты. Прочие названия — двууглекислый натрий и бикарбонат натрия. Химическая формула соединения — NaHCO3. Внешне гидрокарбонат натрия выглядит как белый порошок с привкусом соли. При попадании на слизистые и в дыхательные пути может вызывать раздражение.
Свойства
Вещество при взаимодействии с водой образует слабый раствор щелочи. Вступая в реакцию с кислотами, питьевая сода образует соли, соответствующие данным кислотам, и выделяет углекислоту. В процессе реакции она распадается на воду и углекислый газ. Такую реакцию можно провести даже в бытовых условиях, если «погасить» соду уксусной эссенцией или раствором лимонной кислоты.
Применение
Пищевая сода востребована в быту, медицине и многих отраслях промышленности:
- химия;
- пищевое производство;
- металлургия;
- производство текстиля;
- фармацевтика.
Вещество входит в состав продуктов как пищевая добавка E500. Применяется в производстве газированных напитков, кулинарных и хлебобулочных изделий. При изготовлении теста в промышленных и бытовых условиях пищевая сода выполняет роль разрыхлителя, благодаря которому выпечка поднимается и получается пышной.
В текстильной промышленности NaHCO3 используют в производстве тканей из шелка и хлопка, при изготовлении резины, искусственной кожи. Благодаря щелочной реакции пищевая сода задействована в процессе дубления натуральной кожи, чтобы нейтрализовать кислоту.
В медицине раствор соды применяют для промывания и полоскания при заболеваниях зубов и десен, верхних дыхательных путей. При приеме внутрь сода действует как антацид, снижая кислотность желудочного сока. Внутривенно раствор соды применяют при метаболическом ацидозе. Средство быстро снижает уровень кальция и калия в плазме крови, повышает содержание натрия. Внутривенное введение также используется при лечении пациентов с передозировкой антидепрессантов, нейролептиков, при отравлениях кокаином.
Гидрокарбонат натрия включают в состав ингаляционных растворов, используют в косметологии и для домашнего ухода за внешностью.
Сода используется в химической индустрии для изготовления средств бытовой химии, красителей, пенопластов, реагентов для пожаротушения.

