Физические свойства
Гидроксид кальция Ca(OH)2 — неорганическое соединение. Белый, при нагревании разлагается без плавления. Проявляет основные свойства.
Относительная молекулярная масса Mr = 74,09; относительная плотность для тв. и ж. состояния d = 2,08.
Способы получения
1. Гидроксид кальция получают в результате взаимодействия гидрида кальция и воды, на выходе образуется водород и гидроксид кальция:
CaH2 + 2H2O = Ca(OH)2↓ + 2H2↑
2. При взаимодействии кальция с водой при комнатной температуре образуется гидроксид кальция и водород:
Ca + 2H2O = Ca(OH)2↓ + H2↑
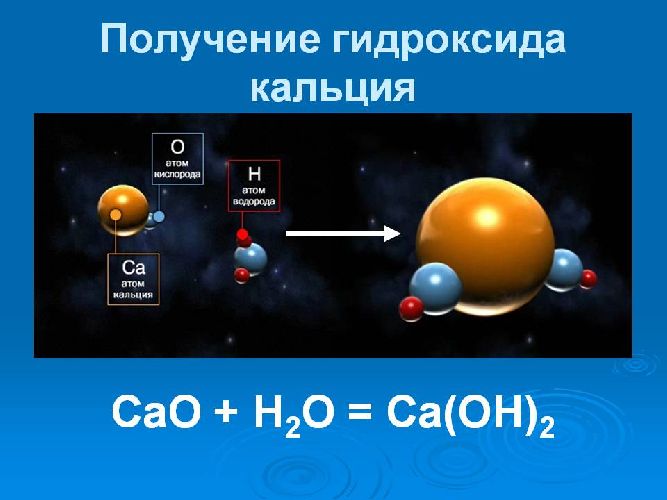
3. Оксид кальция при взаимодействии с водой при комнатой температуре образует гидроксид кальция:
CaO + H2O = Ca(OH)2
Качественная реакция
Качественная реакция на гидроксид кальция — окрашивание фенолфталеина в малиновый цвет.
Химические свойства
1. Гидроксид кальция вступает в реакцию с простыми веществами:
1.1. Холодный гидроксид кальция (суспензия) взаимодействует с хлором и образует гипохлорит кальция, хлорид кальция и воду:
2Ca(OH)2 + 2Cl2 = Ca(ClO)2 + CaCl2 + 2H2O,
если с хлором реагирует горячий гидроксид кальция (суспензия), то в итоге образуется хлорат кальция, хлорид кальция и вода:
Ca(OH)2 + 6Cl2 = Ca(ClO3)2 + 5CaCl2 + 6H2O
2. Гидроксид кальция взаимодействует со сложными веществами:
2.1. Гидроксид кальция реагирует с кислотами:
2.1.1. В результате реакции между гидроксидом кальция и разбавленной соляной кислотой образуется хлорид кальция и вода:
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
2.1.2. Гидроксид кальция взаимодействует с серной кислотой, образуя сульфат кальция и воду:
Ca(OH)2 + H2SO4 = CaSO4↓ + 2H2O
2.1.3. В результате взаимодействия гидроксида кальция и разбавленной фосфорной кислоты образуется фосфат кальция и вода:
3Ca(OH)2 + 2H3PO4 = Ca3(PO4)2↓ + 6H2O,
если с гидроксидом кальция будет взаимодействовать концентрированная фосфорная кислота, то в результате реакции образуется гидрофосфат кальция и вода:
Ca(OH)2 + H3PO4 = CaHPO4↓ + 2H2O
2.1.4. С гидроксидом кальция реагирует сероводородная кислота, образуя гидросульфид кальция и воду:
Ca(OH)2 + 2H2S = Ca(HS)2 + 2H2O
2.2. Гидроксид кальция взаимодействует с оксидами:
2.2.1. В результате взаимодействия гидроксида кальция и углекислого газа образуется карбонат кальция и вода:
Ca(OH)2 + СO2 = CaСO3 + H2O,
если с углекислым газом реагирует карбонат кальция в виде суспензии, то образуется гидрокарбонат кальция в растворе:
Ca(OH)2 + 2СO2 = Ca(HСO3)2
2.2.2. Гидроксид кальция вступает в реакцию с оксидом серы (IV), образуя на выходе сульфит кальция и воду:
Ca(OH)2 + SO2 = CaSO3 + H2O,
если с оксидом серы (IV) взаимодействует гидроксид кальция в виде суспензии, то на выходе происходит образование гидросульфита кальция в растворе:
Ca(OH)2 + 2SO2 = Ca(HSO3)2
2.4. Гидроксид кальция реагирует с солями:
2.4.1. Гидроксид кальция (суспензия) взаимодействует с холодным гипохлоритом натрия, образуя гипохлорит кальция и гидроксид натрия:
Ca(OH)2 + 2NaClO = Ca(ClO)2↓ + 2NaOH
2.5. Гидроксид кальция взаимодействует с пероксидом водорода при 40 — 50º С с образованием пероксида кальция и воды:
Ca(OH)2 + H2O2 = CaO2↓ + 2H2O
3. Гидроксид кальция разлагается при температуре 520 — 580º С, образуя на выходе оксид кальция и воду:
Ca(OH)2 = CaO + H2O
Образовательный портал для подготовки к экзаменам
Химия
Сайты, меню, вход, новости
Задания
Версия для печати и копирования в MS Word
Гидроксид кальция вступает в реакцию с
1)
2)
3)
4)
Спрятать решение
Решение.
Гидроксид кальция это щелочь поэтому она может реагировать с кислотами, амфотерными металлами, их оксидами и гидроксидами, кислотными оксидами, с растворимыми солями при условии признака необратимости реакции. В варианте4 дана кислота, поэтому этот вариант ответа будет правильным.
Спрятать решение
·
·
Гость 13.11.2013 16:44
Как может гидроксид кальция вступать в реакцию с сероводородом, если соли, которая образовалась, нет? В таблице растворимости четко показано что сульфида кальция нет?
Александр Иванов
и сульфид кальция существует.
Гость 28.02.2014 21:33
Разве NO не является несолеобразующим оксидом, не вступающим в реакции?
Александр Иванов
NO — несолеобразующий оксид. И что?
Tatyana Tsybikova 27.12.2016 18:02
почему ответ под номером 4. разве не 2? так как по таблице растворимостей кислот. солей и оснований в воде — всё подходит. кальций растворяется с хлором, а барий растворяется с гидроксидом.
Александр Иванов
именно поэтому реакции и нет
Гидроксид кальция
4.3
Средняя оценка: 4.3
Всего получено оценок: 99.
4.3
Средняя оценка: 4.3
Всего получено оценок: 99.
Гидроксид кальция – химическое вещество имеющее сильное основание. Каковы его особенности и химические свойства рассмотрим в данной статье.
Характеристика гидроксида кальция
Кристаллический гидроксид кальция – это порошок белого цвета, который разлагается при нагревании, но практически нерастворимый в воде. Формула гидроксида кальция – Ca(OH)2 . В ионном виде уравнение образования гидроксида кальция выглядит так:
Гидроксид кальция имеет и другие названия: гашеная известь, известковое молоко, известковая вода
Молярная масса гидроксида кальция составляет 74.09 г/моль. Это значит, что 74,09 г/моль количества вещества гидроксида кальция содержат 6,02*10^23 атомов или молекул этого вещества.
Гидроксид кальция используется для побелки в строительстве, дезинфекции стволов деревьев, в сахарной промышленности, для дублении кож, для получения хлорной извести. Тестообразная смесь гашеной извести с цементом и песком используется в строительстве.
Химические свойства гидроксида кальция
Гидроксид кальция, как и все основания, вступает в реакцию с кислотами:
Ca(OH)2 (гидроксид кальция)+H2SO4 (серная кислота)=CaSo4 (соль – сульфат кальция)+2H2 O (вода).
Гидроксид кальция также способен образовывать соединения с углекислым газом. Раствор этого вещества на воздухе становится мутным, так как гидроксид кальция, подобно другим сильным основаниям, взаимодействует с растворенным в воде углекислым газом:
Ca(OH)2+CO2 (гидроксид кальция)=CaCO3 (карбонат кальция)+H2 O (вода)
При нагревании до 400 градусов гидроксид кальция вступает в реакцию с оксидом углерода:
Ca(OH)2 (гидроксид кальция)+CO (оксид углерода)=CaCO3 (карбонат кальция)+H2 (водород).
Гидроксид кальция может взаимодействовать с солями, в результате чего образуется осадок:
Сa(OH)2 (гидроксид кальция)+Na2 SO3 (сульфит натрия)=CaSO3 (сульфит кальция)+2NaOH (гидроксид натрия).
При температуре 520-580 градусов гидроксид кальция подвержен реакции разложения. В результате образуются оксид кальция и вода:
Ca(OH)2 (гидроксид кальция)=CaO (оксид кальция)+H2 O (вода).
Получение гидроксида кальция происходит при химической реакции оксида кальция (негашеной извести) с водой. Этот процесс получил название «гашение извести». Уравнение реакции гашения извести выглядит следующим образом:
CaO (оксид кальция)+H2 O (вода)=Ca(OH)2 (гидроксид кальция).
Что мы узнали?
Гидроксид кальция – сильное основание, малорастворимое в воде. Как и любой химический элемент он обладает рядом свойств т способен вступать в реакцию с углекислым газом, солями, а также разлагается при высокой температуре. Гидроксид кальция используют в строительстве и промышленности.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
Пока никого нет. Будьте первым!
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 99.
А какая ваша оценка?
Классификация гидроксидов и оснований
Материал по химии
Основания и гидроксиды.
Для того, чтобы разбираться в классификации, сначала нужно понять, что такое основание и чем оно отличается от других веществ. Перечислим несколько оснований:
NaOH – гидроксид натрия
Ca(OH)2 – гидроксид кальция
Fe(OH)2 – гидроксид железа
Все три примера относятся к основаниям, но в названии значится, что это гидроксиды. В чем разница между этими понятиями?
Гидроксиды – это вещества, в состав которых какой-либо элемент имеет связь с гидроксильной группой (‒ОН). Но не все гидроксиды – это основания: кислоты, например, тоже являются гидроксидами.
Классификация гидроксидов и оснований
Основные и ксилотные кидроксиды
Таким образом, все основания – это гидроксиды, но не все гидроксиды – это основания. Ввиду того, что группа гидроксидов очень разнообразна, её принято делить на три подгруппы.
Таб. «Классификация гидроксидов»
|
Гидроксид |
||
|
Основный |
Амфотерный |
Кислотный |
|
В состав входят гидроксогруппа (-ы) и металл в степени окисления «+1» или «+2» за исключением Zn(OH)2, Be(OH)2, Sn(OH)2, Pb(OH)2 |
В состав входят гидроксогруппы и металл в степени окисления «+3» или «+4», а также Zn(OH)2, Be(OH)2, Sn(OH)2, Pb(OH)2 |
В состав входят гидроксогруппа (-ы) и неметалл, либо гидроксогруппа (-ы) и металл в степени окисления «+5», «+6» или «+7» |
|
Общий состав: ЭОН |
Общий состав: ЭОН/НЭО |
Общий состав: НЭО |
|
Примеры: Cr(OH)2 KOH Mg(OH)2 |
Примеры: Cr(OH)3/HCrO2 Mn(OH)4/H2MnO3 Al(OH)3/HAlO2 |
Примеры: HNO3 H3PO4 HMnO4 |
Э – элемент. К основным гидроксидам так же относят гидроксид аммония – NH4OH, хотя правильнее его записывать как гидрат аммония – NH3·H2O.
Амфотерные гидроксиды имеют промежуточный характер между основными и кислотными, поэтому имеют обе формы написания.
Задание в формате ЕГЭ с ответом:
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: амфотерного гидроксида, двухосновного основания, кислотного гидроксида. Запишите соответствующую последовательность цифр.
1) NaOH 2) NH3*H2O 3) HMnO4 4) Be(OH)2 5) KMnO4 6) Na[Al(OH)4] 7) MnO2 Ca(OH)2
9) KOH
Пример задания из КИМ ЕГЭ:
Среди перечисленных веществ выберите три формулы, соответствующие амфотерным гидроксидам:
- H2Cr2O7
- Be(OH)2
- Al(OH)3
- Fe(OH)2
- Ga(OH)3
- H2SO4
Задание по образцу ФИПИ:
Кислотный гидроксид может образовать следующий элемент:
- натрий
- мышьяк
- алюминий
- хлор
- молибден
- цинк
Кислотные гидроксиды образуют неметаллы в любой степени окисления, поэтому подходит мышьяк и хлор, а также металлы в степени окисления +5 и выше, поэтому подходит молибден – он находится в шестой группе Периодической системы, значит, может образовать ион со степенью окисления +6
Перевод формулы амфотерного гидроксида из основной формы в кислотную.
Пример 1.
-
Возьмём любой амфотерный гидроксид: Al(OH)3;
-
Поменяем порядок элементов на кислотную форму (водород → элемент → кислород) без учета индексов основной формы: HAlO;
-
Расставим степени окисления:
-
Молекула должна быть электронейтральной (количество положительных и отрицательных зарядов должно быть равным), для этого кислорода должно быть в два раза больше, поэтому после него ставим индекс «2»: HAlO2
Пример 2.
-
Zn(OH)2;
-
HZnO
-
Согласно этой формуле после кислорода придется поставить индекс «1,5», но индексы могут быть выражены только целыми числами, поэтому сначала приведем количество положительных зарядов к четному значению, домножив элемент с нечетной степенью окисления (водород) на 2, получим формулу: H2ZnO, она пока всё равно не является электронейтральной, сумма её зарядов может быть выражена следующим уравнением: +2+2‒2 = +2, а должно быть = 0
|
+ |
+2 |
‒2 |
|
H2 |
Zn |
O |
|
+2 |
+2 |
‒2 |
|
+4 |
‒2 |
Чтобы количество отрицательных зарядов тоже стало равно четырем, количество кислорода нужно умножить вдвое, поставив после него индекс «2». Получается формула H2ZnO2
Таб. «Общие формулы амфотерных гидроксидов в зависимости от степени окисления металла в них»
|
Степень окисления |
+2 |
+3 |
+4 |
|
Основная формула |
Me(OH)2 |
Me(OH)3 |
Me(OH)4 |
|
Кислотная формула |
H2MeO2 |
HMeO2 |
H2MeO3 |
|
Пример |
H2BeO2 |
HCrO2 |
H2MnO3 |
Me – металл.
Классификация основных гидроксидов (оснований) по количеству гидроксо-групп.
|
Основания |
|
|
Однокислотные |
Двукислотные |
|
LiOH NaOH KOH |
Ca(OH)2 Fe(OH)2 Ba(OH)2 |
Однокислотные основания при диссоциации образуют лишь один гидроксид ион:
LiOH ↔ Li+ + OH‒
NaOH ↔ Na+ + OH‒
Двукислотные основания при диссоциации образуют два гидроксид-иона:
Ca(OH)2 ↔ Ca2+ + 2OH‒
Ba(OH)2 ↔ Ba2+ + 2OH‒
Основные гидроксиды не могут быть трёхкислотными или четырёхкислотными, так как в них металл будет иметь степень окисления «+3» или «+4», а это уже будет не основанием, а амфотерным гидроксидом.
Почему количество гидроксильных групп называется кислотностью? Потому что на нейтрализацию оснований требуется протон водорода из кислоты. Для нейтрализации однокислотных оснований потребуется один протон водорода, а на нейтрализацию двукислотного основания – два протона водорода и так далее. Например:
Молекулярное уравнение (МУ): NaOH + HCl = NaCl + H2O
Полное ионное уравнение (ПИУ): Na+ + OH‒ + H+ + Cl‒ = Na+ + Cl‒ + H2O
Сокращение одинаковых ионов: Na+ + OH‒ + H+ + Cl‒ = Na+ + Cl‒ + H2O
Сокращенное ионное уравнение (СИУ): OH‒ + H+ = H2O
На нейтрализацию однокислотного основания потребовался один протон водорода из соляной кислоты.
Классификация оснований по силе
Основания также можно поделить на сильные и слабые. Сильные диссоциируют очень быстро, даже двухосновные распадаются на ионы на столько быстро, что можно не учитывать ступенчатость этого процесса:
LiOH ↔ Li+ + OH‒
Ba(OH)2 ↔ Ba2+ + 2OH‒
Слабые основания диссоциируют очень медленно, ступенчато:
Fe(OH)2 ↔ FeOH+ + OH‒ (первая ступень)
FeOH+ ↔ Fe2+ + OH‒ (вторая ступень)
Сильные основания растворимы или малорастворимы (исключение: гидроксид аммония будучи растворимым остаётся слабым основанием) и называются щелочами. Слабые основания нерастворимы.
Таб. «Сильные и слабые основания»
|
Основания |
|
|
Сильные (щелочи) |
Слабые |
|
Растворимы |
Нерастворимы (искл. NH4OH) |
|
Гидроксиды металлов IA-подгруппы, а также кальция, стронция и бария |
Все остальные |
|
Примеры: LiOH, NaOH, KOH, CsOH, FrOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 |
Примеры: Mg(OH)2, Fe(OH)2, CuOH, Cr(OH)2, Mn(OH)2, Cu(OH)2 |
| Гидроксид кальция | |
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Гидроксид кальция |
| Химическая формула | Ca(OH)2 |
| Физические свойства | |
| Состояние (ст. усл.) | белые кристаллы |
| Отн. молек. масса | 74.093 а. е. м. |
| Молярная масса | 74.093 г/моль |
| Плотность | 2.211 г/см³ |
| Термические свойства | |
| Температура плавления | 512 °C |
| Химические свойства | |
| Растворимость в воде | 0.185 г/100 мл |
| Классификация | |
| Рег. номер CAS | [1305-62-0] |
Гидрокси́д ка́льция ( Ca(OH)2 , гашёная известь или «пушонка») — химическое вещество, сильное основание. Представляет собой порошок белого цвета, плохо растворимый в воде.
Содержание
- 1 Тривиальные названия
- 2 Получение
- 3 Свойства
- 4 Применение
- 5 См. также
- 6 Примечания
- 7 Источники и литература
Тривиальные названия
- гашёная известь — так как её получают путём «гашения» (то есть взаимодействия с водой) «негашёной» извести (оксида кальция);
Получение
Получают путём взаимодействия оксида кальция (негашёной извести) с водой (процесс получил название «гашение извести»):
CaO + H2O → Ca(OH)2
Эта реакция экзотермическая, идёт с выделением 16 ккал (67 кДж) на моль.
Свойства
Внешний вид — белый порошок, мало растворимый в воде:
| Температура, °C | Растворимость, г Ca(OH)2/100 г H2O |
|---|---|
| 0 | 0,173 |
| 20 | 0,166 |
| 50 | 0,13 |
| 100 | 0,08 |
Гидроксид кальция является довольно сильным основанием, из-за чего водный раствор имеет щелочную реакцию. Растворимость падает с ростом температуры.
Как и все основания, реагирует с кислотами (см. реакция нейтрализации) с образованием соответствующих солей кальция:
- Ca(OH)2 + H2SO4 → CaSO4 + 2H2O,
по этой же причине раствор гидроксида кальция мутнеет на воздухе, так как гидроксид кальция, как и другие сильные основания, реагирует с растворённым в воде углекислым газом:
- Ca(OH)2 + CO2 → CaCO3↓ + H2O
Если продолжить барботацию углекислого газа, выпавший осадок растворится, так как образуется кислая соль — гидрокарбонат кальция:
- CaCO3 + CO2 + H2O → Ca(HCO3)2,
причём при нагревании раствора гидрокарбонат снова разрушается и выпадает осадок карбоната кальция:
- Ca(HCO3)2(t°) → CaCO3↓ + CO2↑ + H2O
Гидроксид кальция реагирует с угарным газом при температуре около 400 °C:
- Ca(OH)2 + CO (t°) → CaCO3 + H2↑
Как сильное основание реагирует с солями, но только если в результате реакции выпадает осадок:
- Ca(OH)2 + Na2SO3→CaSO3↓ + 2NaOH
Применение
- При побелке помещений.
- При побелке деревянных заборов [1] и обмазывании стропил [2] — для защиты от гниения и возгорания.
- Для приготовления известкового строительного раствора. Известь применялась для строительной кладки с древних времён. Смесь обычно приготавливают в такой пропорции: к одной части смеси гидроксида кальция (гашёной извести) с водой добавляют три—четыре части песка (по массе). При этом происходит затвердевание смеси по реакции: Ca(OH)2 + CO2 → CaCO3↓ + H2O. Это экзотермическая реакция, выделение энергии составляет 27 ккал (113 кДж). Как видно из реакции, в ходе её выделяется вода. Это является отрицательным фактором, так как в помещениях, построенных с помощью известкового строительного раствора, долгое время сохраняется повышенная влажность. В связи с этим, а также благодаря ряду других преимуществ перед гидроксидом кальция, цемент практически вытеснил его в качестве связующего строительных растворов.
- Для приготовления силикатного бетона. Состав силикатного бетона одинаков с составом известкового строительного раствора, однако он готовится другим методом — смесь оксида кальция и кварцевого песка обрабатывается не водой, а перегретым (174,5—197,4 °C) водяным паром в автоклаве при давлении 9—15 атмосфер.
- Для устранения карбонатной жёсткости воды (умягчение воды). Реакция идёт по уравнению: Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O.
- Для производства хлорной извести.
- Для производства известковых удобрений.
- Каустификация карбоната натрия и калия.
- Дубление кож.
- Получение других соединений кальция, нейтрализация кислых растворов (в том числе сточных вод производств), получение органических кислот и проч.
- В пищевой промышленности зарегистрирован в качестве пищевой добавки E526.
- Известковая вода — прозрачный раствор гидроксида кальция. Она используется для обнаружения углекислого газа. При взаимодействии с ним она мутнеет, так как образуется нерастворимый карбонат кальция: Ca(OH)2 + CO2 → CaCO3↓ + H2O.
- Известковое молоко — взвесь (суспензия) гидроксида кальция в воде, белая и непрозрачная. Она используется для производства сахара и приготовления смесей для борьбы с болезнями растений, побелки стволов.
- В стоматологии — для дезинфекции корневых каналов зубов.
См. также
- Кальций
- Оксид кальция
- Сульфат кальция
- Карбид кальция
- Пищевые добавки
Примечания
- ↑ Твен, Марк. Приключения Тома Сойера
- ↑ Пример стропильной системы и обрешетки, обработанной давным-давно известью.
Источники и литература
- Монастырев А. Производство цемента, извести. — М., 2007.
- Штарк Йохан, Вихт Бернд. Цемент и известь / пер. с нем. — Киев, 2008.
|
|
В этой статье не хватает ссылок на источники информации.
Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. |

Содержание
- Некоторые распространённые названия
- Получение
- Физические свойства
- Применение
Гидроксид кальция» title=»Известь»>известь, едкая) — химическое вещество с формулой Ca(OH)2, сильное основание. Представляет собой мелкокристаллический порошок белого цвета, малорастворимый в воде.
| Гидроксид кальция | |
|---|---|
| Общие | |
| Систематическое наименование |
Гидроксид кальция |
| Традиционные названия | гашёная (едкая) известь |
| Хим. формула | Ca(OH)2 |
| Рац. формула | HO-Ca-OH |
| Физические свойства | |
| Состояние | белые кристаллы |
| Молярная масса | 74,093 г/моль |
| Плотность | 2,211 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 512 °C |
| • разложения | 580 °C |
| Давление пара | 0 ± 1 мм рт.ст. |
| Химические свойства | |
| Растворимость | |
| • в воде | 0,185 г/100 мл |
| Классификация | |
| Рег. номер CAS | [1305-62-0] |
| PubChem | 6093208 |
| Рег. номер EINECS | 215-137-3 |
| SMILES |
[OH-].[OH-].[Ca+2] |
| InChI |
1S/Ca.2H2O/h;2*1H2/q+2;;/p-2 AXCZMVOFGPJBDE-UHFFFAOYSA-L |
| Кодекс Алиментариус | E526 |
| RTECS | EW2800000 |
| ChEBI | 31341 |
| ChemSpider | 14094 и 21170965 |
| Безопасность | |
| NFPA 704 |
Некоторые распространённые названия
- Гашёная известь — так как её получают путём «гашения» (то есть взаимодействия с водой) «негашеной» извести (оксида кальция).
- Известковое молоко — взвесь (суспензия), образуемая при смешивании избытка гашёной извести с водой. Внешне похожа на молоко.
- Известковая вода — прозрачный бесцветный раствор гидроксида кальция, получаемый при фильтровании или отстаивании известкового молока.
- Известь-пушонка — при гашении негашёной извести ограниченным количеством воды образуется белый рассыпающийся мелкокристаллический пылевидный порошок.
Получение
Получают путём взаимодействия оксида кальция (негашёной извести) с водой (процесс получил название «гашение извести»):
Эта реакция сильно экзотермическая, происходит с выделением 16 ккал на моль (67 кДж на моль).
Физические свойства
| Температура, °C |
Растворимость, г Ca(OH)2/100 г H2O |
|---|---|
| 0 | 0,173 |
| 20 | 0,166 |
| 50 | 0,13 |
| 100 | 0,08 |
По внешнему виду представляет собой белый порошок, малорастворимый в воде. Растворимость в воде падает с ростом температуры.
При нагреве вещества до температуры 512 °C парциальное давление водяного пара, находящегося в равновесии с гидроксидом кальция становится равным атмосферному давлению (101,325 кПа) и гидроксид кальция начинает терять воду, превращаясь в оксид кальция, при температуре 600 °C процесс потери воды практически полностью завершается:
Гидроксид кальция реагирует с оксидом углерода при температуре около 400 °C:
Реагирует с некоторыми солями, но реакция происходит только в том случае, если в результате реакции одно из образующихся веществ плохо растворимое и выпадает в осадок, например:
Применение
- Известковое молоко применяется при побелке стен, заборов, стволов деревьев.
- Для приготовления известкового строительного раствора. Гашёная известь применялась для строительной каменной кладки с древних времён. Такой строительный раствор обычно состоит по массе из одной части гашёной извести и трёх-четырёх частей кварцевого песка. В смесь добавляют воду до получения густой массы. В смеси происходит химическая реакция компонентов с образованием силикатов кальция, в этой реакции выделяется вода. Это является недостатком такого раствора, так как в помещениях, построенных с применением такого раствора, долгое время сохраняется повышенная влажность. В том числе поэтому в современном строительстве цемент практически полностью вытеснил гашёную известь как связующее в строительных растворах.
- Для приготовления силикатного бетона и силикатного кирпича. Состав силикатного бетона аналогичен составу известкового строительного раствора, однако его отвердевание происходит на несколько порядков быстрее, так как смесь гашёной извести и кварцевого песка обрабатывают перегретым (174—197 °C) водяным паром в автоклаве при повышенном давлении 9—15 атмосфер.
- Для устранения карбонатной жёсткости воды (умягчение воды).
- Для производства хлорной извести.
- Для производства известковых удобрений и снижения кислотности кислых почв.
- В производстве методом каустификации соды и поташа.
- При дублении кож.
- Для получения других соединений кальция, нейтрализация кислых растворов (в том числе сточных вод производств), получение органических кислот и проч.
- В пищевой промышленности зарегистрирован в качестве пищевой добавки E526.
- Как реактив качественной реакции на углекислый газ.
- Известковое молоко — суспензия гидроксида кальция в воде используется для рафинирования сахара в сахарном производстве.
- В Латинской Америке в известковом молоке отваривают зёрна кукурузы для размягчения мякины, активизации клейковины и улучшения перевариваемости — т. н. «никстамализация».
- Для приготовления смесей для борьбы с болезнями и вредителями растений, например, входит в состав классического фунгицида — бордоской жидкости.
- В стоматологии для дезинфекции корневых каналов зубов.
- В электротехнике — при устройстве заземления в грунтах с высоким электрическим сопротивлением — в качестве добавки в грунт, для снижения удельного электрического сопротивления грунта.






 Ca(OH)2
Ca(OH)2