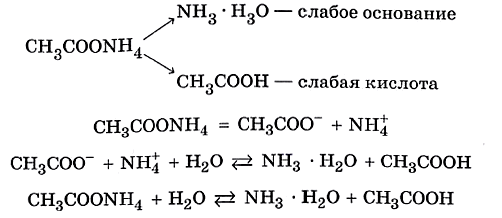Гидролиз (греч. hydor — вода и lysis — разрушение) — процесс расщепления молекул сложных химических веществ за счет
реакции с молекулами воды.
В химии, как и в жизни, разрушается чаще всего нестойкое и слабое (стойкое и сильное выдерживает удар). Запомните, что гидролиз
(вода) разрушает «слабое» — это правило вам очень пригодится.

Любая соль состоит из остатка основания и кислоты. Абсолютно любая:
- NaCl — производное основания NaOH и кислоты HCl
- KNO3 — производное основания KOH и кислоты HNO3
- CuSO4 — производное основания Cu(OH)2 и кислоты H2SO4
- Al3PO4 — производное основания Al(OH)3 и кислоты H3PO4
- Ca(NO2)2 — производное основания Ca(OH)2 и кислоты HNO2
Чтобы успешно решать задания по теме гидролиза и писать реакции, вам следует запомнить, какие основания и кислоты являются
слабыми, а какие — сильными.
При изучении гидролиза я рекомендую ученикам сохранить на гаджет схему, которую вы видите ниже. Для того, чтобы приобрести
нужный опыт — она незаменима. Пользуйтесь ей как можно чаще, подглядывайте в нее и она незаметно окажется в вашем
интеллектуальном составляющем 

По катиону, по аниону или нет гидролиза?
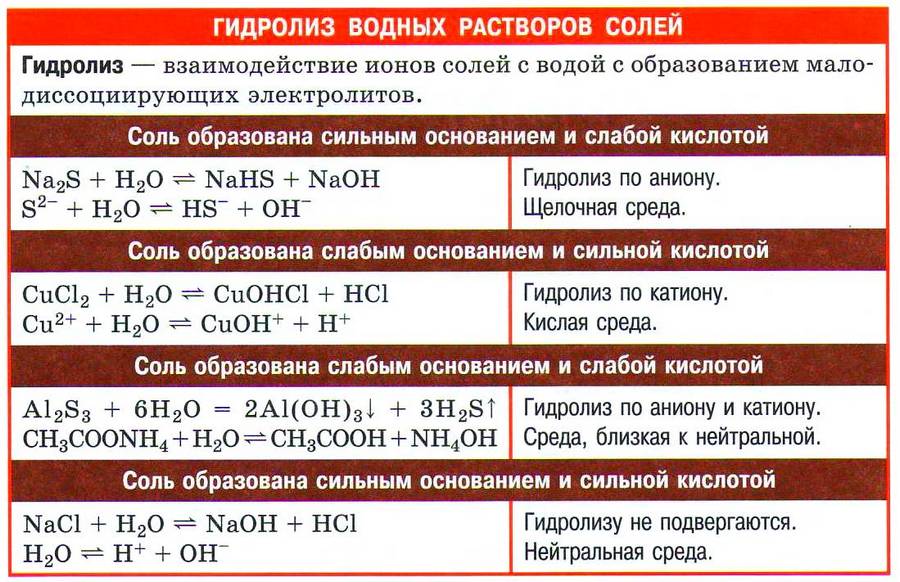
Итак, если в состав соли входит остаток сильного основания и остаток сильной кислоты — гидролиза не происходит. Примеры: NaCl, KBr,
CaSO4. Также гидролиза не происходит, если соль нерастворима (вне зависимости от того, чем она образована): AlPO4,
FeSO3, CaSO3.
Если в состав соли входит остаток слабого основания и остаток сильной кислоты, то гидролиз идет по катиону. Помните, что гидролиз
разрушает слабое, в данном случае — катион. Примеры: AlCl3, MgBr2, Cr2SO4, NH4NO3.
Катион NH4+ и его основание NH4OH , несмотря на растворимость, является слабым, поэтому гидролиз будет идти
по катиону в соли NH4Cl. Замечу также, что Ca(OH)2 считается растворимым основанием, поэтому гидролиза соли CaCl2
не происходит.
Если в состав соли входит остаток сильного основания и остаток слабой кислоты, то гидролиз идет по аниону. Примеры: K3PO4,
NaNO2, Ca(OCl)2, Ba(CH3COO)2, K2SiO3.
Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет и по катиону, и по аниону. Примеры: Mg(NO2)2,
Al2S3, Cr2(SO3)3, CH3COONH4.
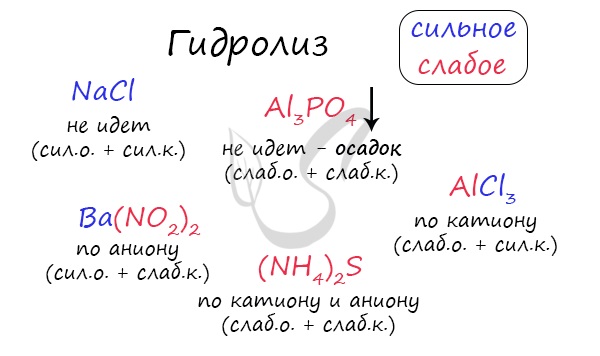
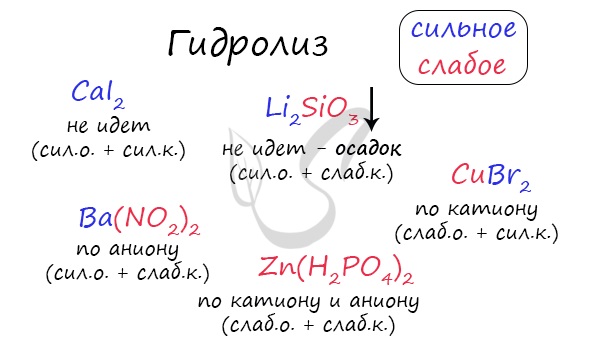
Самостоятельно определите тип гидролиза для CaI2, Li2SiO3, Ba(NO2)2, CuBr2, Zn(H2PO4)2.
Ниже вы найдете решение.
Среда раствора
Среда раствора может быть нейтральной, кислой или щелочной. Определяется типом гидролиза. Некоторые задания могут быть построены так, что, увидев соль,
вы должны будете определить ее тип раствора.
Обрадую вас: если вы усвоили тему гидролиза, сделать это проще простого. В случае, когда гидролиз не идет или идет и по катиону, и по аниону среда
раствора — нейтральная.
Если гидролиз идет по катиону (разрушается остаток основания) среда — кислая, если гидролиз идет по аниону (разрушается остаток кислоты), то среда
раствора будет щелочная. Изучите примеры.
Однако замечу, что в дигидрофосфатах, гидросульфитах и гидросульфатах среда всегда кислая из-за особенностей диссоциации. Примеры:
NH4H2PO4, LiHSO4. В гидрофосфатах среда щелочная из-за того, что константа диссоциации по третьей ступени меньше, чем константа гидролиза. Примеры: K2HPO4, Na2HPO4.

Попробуйте определить среду раствора для соединений из самостоятельного задания, которое вы только что решили.
Ниже будет располагаться решение.

С целью запутать в заданиях часто бывают даны синонимы. Так «среду раствора» могут заменить водородным показателем pH.
Запомните, что кислая среда характеризуется pH < 7. В нейтральной pH = 7. В щелочной pH > 7.
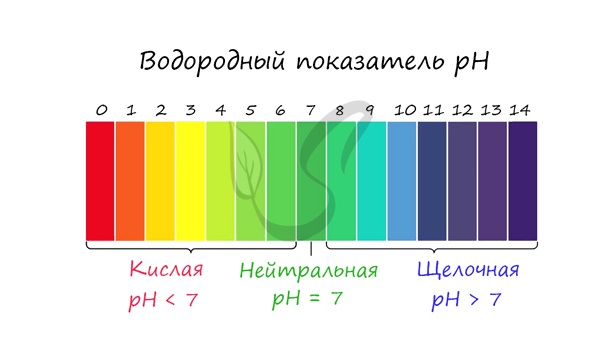
Например, в соли CaCl2 среда раствора будет нейтральной (pH=7), а в растворе AlCl3 — кислой (pH < 7).
Индикаторы (лат. indicator — указатель)
Индикатор — вещество, используемое в химии для определения среды раствора. В зависимости от среды раствора индикатор способен
менять его цвет, что наглядно отражает характер среды в определенный момент времени.
Наиболее известные и широко применяемые индикаторы: лакмус, фенолфталеиновый и метиловый оранжевый. В зависимости от среды
раствора их окраска меняется, что отражает приведенная ниже таблица.

Для тех, кто обладает хорошей зрительной памятью, будет несложно запомнить эту схему. Но что делать аудиалам и кинестетикам? 
От волнения на экзамене такая таблица легко может раствориться и перепутаться в океане мыслей, поэтому своим ученикам я рекомендую
запомнить индикаторы по стихам.
Только представьте, как приятно будет прочитать стих на экзамене, и убедиться в его безошибочности. Это придаст уверенности и поднимет
настроение 
Лакмус
Индикатор лакмус красный
Кислоту укажет ясно.
Индикатор лакмус синий —
Щелочь здесь, не будь разиней!
Когда ж нейтральная среда,
Он фиолетовый всегда.
Фенолфталеин
Фенолфталеиновый
В щелочах малиновый
Несмотря на это —
В кислотах он без цвета.
Метиловый оранжевый
От щелочи я желт как в лихорадке
Я розовею от кислот, как от стыда
И я бросаюсь в воду без оглядки —
Здесь я оранжевый практически всегда!

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Гидролиз
Ключевые слова конспекта: Гидролиз необратимый и обратимый. Гидролиз солей в зависимости от силы кислот и оснований, образующих соль. Роль гидролиза в обмене веществ. Роль гидролиза в энергетическом обмене.
Слово «гидролиз» (от др.-греч. hydor — вода и lysis — разложение) буквально означает «разложение вещества водой».
Гидролиз — реакции обменного взаимодействия веществ с водой, приводящие к их разложению.
Гидролиз бывает необратимым и обратимым.
Если соль образована слабым нерастворимым основанием и слабой летучей кислотой, она существует только в сухом виде, так как в воде полностью разлагается, т. е. подвергается необратимому гидролизу, например:
Al2S3 + 6Н2O = 2Аl(ОН)3↓ + 3H2S↑
Кроме некоторых солей, необратимому гидролизу подвергаются многие бинарные (двухэлементные) соединения — фосфиды, нитриды, силициды, гидриды и т. д. Например:
Zn3P2 + 6Н2O = 3Zn(OH)2↓ + 2PH3↑
Эта реакция лежит в основе применения фосфида цинка в качестве зооцида, т. е. вещества, используемого для борьбы с животными-вредителями, прежде всего грызунами.
В органической химии необратимый гидролиз используется для получения ацетилена карбидным способом:
СаС2 + 2Н2O = Са(ОН)2 + C2H2↑
Результаты опыта, наверное, для вас неожиданны: только во второй пробирке индикаторная бумага показала нейтральную среду, тогда как в первой — щелочную, а в третьей — кислотную. Почему? Объяснить результаты эксперимента нам поможет понятие обратимый гидролиз.
Гидролиз солей происходит вследствие взаимодействия катиона металла или аниона кислотного остатка, входящих в состав соли, с молекулами воды. В результате этого взаимодействия образуется малодиссоциирующее соединение, в водном растворе появляется избыток катионов водорода или гидроксид–анионов, обусловливающих кислотную или щелочную реакцию среды.
Любую соль можно представить как продукт взаимодействия основания с кислотой. Например, карбонат натрия Na2CO3 образован сильным основанием (щёлочью) — гидроксидом натрия NaOH и слабой угольной кислотой Н2СО3.
В зависимости от силы основания и кислоты как электролитов все соли можно разделить на четыре типа. Рассмотрим поведение солей различных типов в водных растворах.
✅ 1. Соли, образованные сильным основанием и слабой кислотой, например карбонат натрия:
Карбонат натрия хорошо растворим в воде и полностью диссоциирует на ионы:
Угольная кислота — слабый электролит. Следовательно, катионы водорода прочно удерживаются карбонат–анионом и с трудом отщепляются в раствор. Верно и обратное: карбонат-анион СО32– легко присоединяет катион водорода Н+, отрывая его у молекулы воды. Карбонат-анион при этом превращается в гидрокарбонат, а от молекулы воды в растворе остаётся анион ОН–:
Мы записали ионное уравнение гидролиза. В результате этого процесса в растворе накапливаются гидроксид-анионы, определяющие щелочную реакцию среды. В данном случае говорят, что идёт гидролиз по аниону.
Молекулярное уравнение гидролиза карбоната натрия имеет вид
✅ 2. Соли, образованные слабым основанием и сильной кислотой. Рассмотрим пример гидролиза хлорида цинка:
В водном растворе хлорид цинка полностью диссоциирует:
Гидролизу подвергается тот ион, который принадлежит слабому электролиту, поэтому данная соль гидролизуется по катиону. Отрывая от молекулы воды гидроксид-анион, катион Zn2+ способствует накоплению в растворе катионов водорода:
Молекулярное уравнение гидролиза легко записать, если в ионном уравнении дописать хлорид-анионы:
Реакцию среды в растворе данной соли определяет наличие катионов Н+: среда кислотная.
✅ 3. Соли, образованные слабым основанием и слабой кислотой. Такие соли подвергаются гидролизу по катиону и по аниону. Катион и анион делят между собой молекулу воды, присоединяя соответственно гидроксид–анион и катион водорода. Например, ацетат аммония:
В растворе ацетата аммония среда нейтральная, поскольку нет избытка ни катионов водорода, ни гидроксид-анионов.
Необратимо гидролизуются и по катиону, и по аниону соли слабого нерастворимого основания и слабой летучей кислоты, что было рассмотрено в начале конспекта.
✅ 4. Не гидролизуются соли, образованные сильным основанием и сильной кислотой. В водном растворе подобных солей катионы металла (щелочного или щёлочноземельного) и анионы кислотного остатка окружены гидратными оболочками, взаимодействия с молекулами воды не происходит, поскольку это не приводит к образованию слабого электролита. Реакция среды в растворе таких солей нейтральная.
Термин «гидролиз» не должен ассоциироваться только с гидролизом солей. Это понятие значительно шире, а гидролиз солей – это лишь небольшая часть химических процессов, связанных с разложением веществ водой.
Реакции разложения органических соединений водой также называются гидролизом. Эти реакции играют исключительно важную роль и в промышленности, и в биологических процессах. В курсе органической химии вы изучали гидролиз сложных эфиров, ди- и полисахаридов, белков и других органических веществ.
Существует особая отрасль деревообрабатывающей промышленности, которая так и называется — гидролизная. Малоценные отходы лесопереработки (щепа, опилки, стружки), содержащие до 50% органического полисахарида целлюлозы, нагревают при повышенном давлении в присутствии серной кислоты (в качестве катализатора). В результате происходит гидролиз целлюлозы с образованием её мономера — глюкозы:
Полученные глюкозо-содержащие сиропы сбраживают и получают гидролизный этиловый спирт:
Важное значение имеют процессы гидролиза в живой природе. Основными компонентами пищи человека являются жиры, белки и углеводы. В пищеварительном тракте они подвергаются гидролизу с образованием аминокислот, глицерина и жирных кислот, глюкозы. Из этих «строительных кирпичиков» организм синтезирует свои собственные белки, жиры и углеводы.
Основу жизненных процессов составляет не только обмен веществ, но и обмен энергии. В энергетическом обмене главную роль играет аденозинтрифосфорная кислота (АТФ). Её молекулы гидролизуются с отщеплением остатков фосфорной кислоты и высвобождением энергии (40—60 кДж/моль):
АТФ + вода —> АДФ + фосфорная кислота + энергия
Энергия расходуется на основной обмен (поддержание температуры, рост клеток, движение и др.).
В ходе обратной реакции выделяемая за счёт окисления органических веществ энергия вновь накапливается в АТФ, которая синтезируется из аденозиндифосфорной кислоты (АДФ):
АДФ + фосфорная кислота + энергия —> АТФ + вода
Следовательно, процессы гидролиза — химический фундамент процессов ассимиляции и диссимиляции, лежащих в основе жизни на Земле.
Конспект урока по химии «Гидролиз». В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
Темы кодификатора ЕГЭ: Гидролиз солей. Среда водных растворов: кислая, основная и щелочная.
Гидролиз – взаимодействие веществ с водой. Гидролизу подвергаются разные классы неорганических и органических веществ: соли, бинарные соединения, углеводы, жиры, белки, эфиры и другие вещества. Гидролиз солей происходит, когда ионы соли способны образовывать с Н+ и ОН— ионами воды малодиссоциированные электролиты.
Гидролиз солей может протекать:
→ обратимо: только небольшая часть частиц исходного вещества гидролизуется.
→ необратимо: практически все частицы исходного вещества гидролизуются.
Для оценки типа гидролиза необходимо рассмотреть соль, как продукт взаимодействия основания и кислоты. Любая соль состоит из металла и кислотного остатка. Металлы соответствует основание или амфотерный гидроксид (с той же степенью окисления, что и в соли), а кислотному остатку — кислота. Например, карбонату натрия Na2CO3 соответствует основание — щелочь NaOH и угольная кислота H2CO3.
Обратимый гидролиз солей
Механизм обратимого гидролиза будет зависеть от состава исходной соли. Можно выделить 4 основных варианта, которые мы рассмотрим на примерах:
1. Соли, образованные сильным основанием и слабой кислотой, гидролизуются ПО АНИОНУ.
Примеры таких солей — CH3COONa, Na2CO3, Na2S, KCN.
Реакция гидролиза:
CH3COONa + HOH ↔ CH3COOH + NaOH
в ионной форме:
CH3COO— + Na+ + HOH ↔ CH3COOH + Na+ + OH—
сокращенное ионное уравнение:
CH3COO— + HOH ↔ CH3COOH + OH—
Таким образом, при гидролизе таких солей в растворе образуется небольшой избыток гидроксид-ионов OH—. Водородный показатель такого раствора рН>7.
Гидролиз солей многоосновных кислот (H2CO3, H3PO4 и т.п.) протекает ступенчато, с образованием кислых солей:
CO32- + HOH ↔ HCO32- + OH—
или в молекулярной форме:
Na2CO3 + HOH ↔ NaHCO3 + NaOH
2 ступень:
HCO3— + HOH ↔ H2CO3 + OH—
или в молекулярной форме:
NaHCO3 + HOH ↔ H2CO3 + NaOH
Продукты гидролиза по первой ступени подавляют вторую ступень гидролиза, в результате вторая ступень гидролиза протекает незначительно.
2. Соли, образованные слабым основанием и сильной кислотой, гидролизуются ПО КАТИОНУ. Пример такой соли: NH4Cl, FeCl3, Al2(SO4)3 Уравнение гидролиза:
NH4+ + HOH ↔ NH3·H2O + H+
или в молекулярной форме:
NH4Cl + HOH ↔ NH3·H2O + HCl
При этом катион слабого основания притягивает гидроксид-ионы из воды, а в растворе возникает избыток ионов Н+. Водородный показатель такого раствора рН<7.
Соли, образованные многокислотными основаниями, гидролизуются ступенчато, образуя катионы основных солей. Например:
I ступень:
Fe3+ + HOH ↔ FeOH2+ + H+
FeCl3 + HOH ↔ FeOHCl2 + HCl
II ступень:
FeOH2+ + HOH ↔ Fe(OH)2+ + H+
FeOHCl2 + HOH ↔ Fe(OH)2Cl+ HCl
III ступень:
Fe(OH)2+ + HOH ↔ Fe(OH)3 + H+
Fe(OH)2Cl + HOH ↔ Fe(OH)3 + HCl
Гидролиз по второй и, в особенности, по третьей ступени практически не протекает при комнатной температуре.
3. Соли, образованные слабым основанием и слабой кислотой, гидролизуются И ПО КАТИОНУ, И ПО АНИОНУ.
Примеры таких солей: CH3COONH4, (NH4)2CO3, HCOONH4,
Уравнение гидролиза:
CH3COO— + NH4+ + HOH ↔ CH3COOH + NH3·H2O
CH3COONH4 + HOH ↔ CH3COOH + NH3·H2O
В этом случае реакция раствора зависит от соотношения констант диссоциации образующихся кислот и оснований. В большинстве случаев реакция раствора будет примерно нейтральной, рН ≅ 7. Точное значение рН зависит от относительной силы основания и кислоты.
4. Гидролиз солей, образованных сильным основанием и сильной кислотой, в водных растворах НЕ ИДЕТ.
Сведем вышеописанную информацию в общую таблицу:
Необратимый гидролиз
Необратимый гидролиз происходит, если при гидролизе выделяется газ, осадок или вода, т.е. вещества, которые при данных условиях не могут взаимодействовать между собой. Необратимый гидролиз является химической реакцией, т.к. реагирующие вещества взаимодействуют практически полностью.
Варианты необратимого гидролиза:
- Гидролиз, в который вступают растворимые соли 2х-валентных металлов (Be2+, Co2+, Ni2+, Zn2+, Pb2+, Cu2+ и др.) с сильным ионизирующим полем (слабые основания) и растворимые карбонаты/гидрокарбонаты. При этом образуются нерастворимые основные соли (гидроксокарбонаты):
2MgCl2 + 2Na2CO3 + H2O = Mg2(OH)2CO3 + 4NaCl + CO2
2МеCl2 + 2Na2CO3 + Н2О = (МеОН)2CO3 + 4NaCl + СО2 (МеII, кроме Fe, Ca,Sr,Ba).
! Исключения: (соли Ca, Sr, Ba и Fe2+) – в этом случае получим обычный обменный процесс:
CaCl2 + Na2CO3 = CaCO3 + 2NaCl,
МеCl2 + Na2CO3 = МеCO3 + 2NaCl (Ме – Fe, Ca, Sr, Ba).
- Взаимный гидролиз, протекающий при смешивании двух солей, гидролизованных по катиону и по аниону. Продукты гидролиза по второй ступени усиливают гидролиз по первой ступени и наоборот. Поэтому в таких процессах образуются не просто продукты обменной реакции, а продукты гидролиза (совместный или взаимный гидролиз).Соли металлов со степенью окисления +3 (Al3+, Cr3+) и соли летучих кислот (карбонаты, сульфиды, сульфиты) при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ (H2S, SO2, CO2):
2AlCl3 + 3K2S +6H2O = 2Al(OH)3 + 3H2S↑ + 6KCl,
2CrCl3 + 3K2CO3 + 3H2O = 2Сr(ОН)3 + 3СO2 + 6KCl,
2МеCl3 + 3Na2CO3 + 3Н2О=2Ме(ОН)3 + 6NaCl + 3СО2 (МеIII),
2МеCl3 + 3Na2SO3 + 3Н2О=2Ме(ОН)3 + 6NaCl + 3SО2 (МеIII),
2МеCl3 + 3Na2S + 3Н2О=2Ме(ОН)3 + 6NaCl + 3H2S (МеIII).
Соли Fe3+ при взаимодействии с карбонатами также при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ:
2FeCl3 + 3K2CO3 + 3H2O = 2Fe(ОН)3 + 3СO2 + 6KCl
! Исключения: при взаимодействии солей трехвалентного железа с сульфидами реализуется окислительно-восстановительная реакция:
2FeCl3 + 3K2S(изб) = 2FeS + S↓ + 6KCl (при избытке сульфида калия)
При взаимодействии солей трехвалентного железа с сульфитами также реализуется окислительно-восстановительная реакция.
Полные уравнения таких реакций выглядят довольно сложно. Поначалу я рекомендую составлять такие уравнения в 2 этапа: сначала составляем обменную реацию без участия воды, затем разлагаем полученный продукт обменной реакции водой. Сложив эти две реакции и сократив одинаковые вещества, мы получаем полное уравнение необратимого гидролиза.
3. Гидролиз галогенангидридов и тиоангидридов происходит также необратимо. Галогенангидриды разлагаются водой по схеме ионного обмена (H+OH—) до соответствующих кислот (в случае водного гидролиза) и солей (в случае щелочного гидролиза). Степень окисления центрального элемента и остальных при этом не изменяется!
SO2Cl2 + 2 H2O = H2SO4 + 2 HCl,
SOCl2 + 2 H2O = H2SO3 + 2HCl,
PCl5 + 4 H2O = H3PO4 + 5HCl,
CrO2Cl2 + 2H2O = H2CrO4 + 2HCl,
PCl5 + 8NaOH = Na3PO4 + 5NaCl + 4H2O,
Галогенангидрид – это соединение, которое получается, если в кислоте ОН-группу заменить на галоген. При гидролизе галогенангидридов кислот образуются соответствующие данным элементам и степеням окисления кислоты и галогеноводородные кислоты.
POCl3 + 3H2O = H3PO4 + 3HCl
Галогенангидриды некоторых кислот:
| Кислота | Галогенангидриды |
| H2SO4 | SO2Cl2 |
| H2SO3 | SOCl2 |
| H2CO3 | COCl2 |
| H3PO4 | POCl3, PCl5 |
Тиоангидриды (сульфангидриды) — так называются, по аналогии с безводными окислами (ангидридами), сернистые соединения элементов (например, Sb2S3, As2S5, SnS2, CS2 и т. п.).
- Необратимый гидролиз бинарных соединений, образованных металлом и неметаллом:
- сульфиды трехвалентных металлов вводе необратимо гидролизуются до сероводорода и и гидроксида металла:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
при этом возможен кислотный гидролиз, в таком случае образуются соль металла и сероводород:
Al2S3 + 6HCl = 2AlCl3 + 3H2S
- гидролиз карбидов приводит к образованию гидроксида металла в водной среде, соли металла в кислой де и соответствующего углеводорода — метана, ацетилена или пропина:
Ca+2C-12 + H2O = Ca+2(OH)2 + C-12H2
Al+34C-43 + 12H2O = 4Al+3(OH)3 + 3C-4H4,
Ca3N2 + H2O =
Ca3P2 + H2O =
Mg2Si + H2O =
- Некоторые соли необратимо гидролизуются с образованием оксосолей:
BiCl3 + H2O = BiOCl + 2HCl,
SbCl3 + H2O = SbOCl + 2HCl.
Алюмокалиевые квасцы:
KAl(SO4)2 + K2S + H2O =
MgCl2 + NaНCO3 + H2O =
ZnSO4 + CsНCO3 + H2O =
CdSO4 + RbНCO3 + H2O =
CaSO4 + Rb2CO3 + H2O =
FeCl2 + Rb2CO3 + H2O =
Количественно гидролиз характеризуется величиной, называемой степенью гидролиза.
Степень гидролиза (α) — отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. В случае необратимого гидролиза α≅1.
Факторы, влияющие на степень гидролиза:
1. Температура
Гидролиз — эндотермическая реакция! Нагревание раствора приводит к интенсификации процесса.
Пример: изменение степени гидролиза 0,01 М CrCl3 в зависимости от температуры:
2. Концентрация соли
Чем меньше концентрация соли, тем выше степень ее гидролиза.
Пример: изменение степени гидролиза Na2CO3 в зависимости от температуры:
По этой причине для предотвращения нежелательного гидролиза хранить соли рекомендуется в концентрированном виде.
3. Добавление к реакционной смеси кислоты или щелочи
Изменяя концентрация одного из продуктов, можно смещать равновесие реакции гидролиза в ту или иную сторону.
Пройти тест по теме Гидролиз:
Здесь вы можете потренироваться в решении тестовых заданий в формате ЕГЭ по теме Гидролиз.
Тренировочные тесты по теме «Гидролиз»( с ответами)
179
Создан на
16 января, 2022 От Admin
Тренажер задания 21
Тренажер задания 21 ЕГЭ по химии
1 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) H2SO4
2) Na2S
3) AICl3
4) CaCl2
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация (моль/л) всех растворов одинаковая.
2 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) KHCO3
2) Ba(NO3)2
3) ZnSO4
4) HCIO3
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация (моль/л) всех растворов одинаковая.
3 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) NaHSO4
2) KClO4
3) CH3COOH
4) KHCO3
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
4 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) KOH
2) NaHCO3
3) H3PO4
4) НCl
Запишите номера веществ в порядке уменьшения значения pH их водных растворов.
5 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) Аl(NO3)3
2) NH3
3) CH3COONH4
4) HClO3
Запишите номера веществ в порядке возрастания значения pН их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
6 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) сульфат железа
2) нитрат бария
3) сульфид натрия
4) азотная кислота
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
7 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) Na2CO3
2) Н3РО4
3) Ва(NO3)2
4) Са(ОН)2
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
8 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) HF
2) HI
3) CaCrO4
4) Cs3PO4
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
9 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) HNO2
2) C2H5COOK
3) H2CrO4
4) Ca(OH)2
Запишите номера веществ в порядке уменьшения значения pH их водных растворов.
10 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) FeBr3
2) НСООNa
3) НВr
4) LiOH
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
Ваша оценка
The average score is 26%
18 марта 2021
В закладки
Обсудить
Жалоба
Гидролиз солей
Конспект по химии.
Гидролиз солей – это обменная реакция между солью и водой, в ходе которой H+ от молекулы воды присоединяется к аниону соли (гидролиз по аниону) или OH— от молекулы воды присоединяется к катиону соли (гидролиз по катиону).
gidroliz_soley.pdf
Автор: Дмитрий Макинский | vk.com/hard_chemistry
Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Согласно теории электролитической диссоциации, в водном растворе частицы растворенного вещества взаимодействуют с молекулами воды. Такое взаимодействие может привести к реакции гидролиза (от греч. hydro — вода, lysis — распад, разложение).
Гидролиз — это реакция обменного разложения вещества водой.
Гидролизу подвергаются различные вещества: неорганические — соли, карбиды и гидриды металлов, галогениды неметаллов; органические — галогеналканы, сложные эфиры и жиры, углеводы, белки, полинуклеотиды.
Водные растворы солей имеют разные значения рН и различные типы сред — кислотную ($рН < 7$), щелочную ($рН > 7$), нейтральную ($рН = 7$). Это объясняется тем, что соли в водных растворах могут подвергаться гидролизу.
Сущность гидролиза сводится к обменному химическому взаимодействию катионов или анионов соли с молекулами воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). А в водном растворе соли появляется избыток свободных ионов $Н^{+}$ или $ОН^{-}$, и раствор соли становится кислотным или щелочным соответственно.
Классификация солей
Любую соль можно представить как продукт взаимодействия основания с кислотой. Например, соль $KClO$ образована сильным основанием $KOH$ и слабой кислотой $HClO$.
В зависимости от силы основания и кислоты можно выделить четыре типа солей.
Рассмотрим поведение солей различных типов в растворе.
1. Соли, образованные сильным основанием и слабой кислотой.
Например, соль цианид калия $KCN$ образована сильным основанием $KOH$ и слабой кислотой $HCN$:
${KOH}↙{text»сильное однокислотное основание»}←KCN→{HCN}↙{text»слабая однокислотная кислота»}$
В водном растворе соли происходят два процесса:
1) незначительная обратимая диссоциация молекул воды (очень слабого амфотерного электролита), которую упрощенно можно записать с помощью уравнения
$H_2O{⇄}↖{←}H^{+}+OH^{-};$
2) полная диссоциация соли (сильного электролита):
$KCN=K^{+}+CN^{-}$
Образующиеся при этих процессах ионы $Н^{+}$ и $CN^{-}$ взаимодействуют между собой, связываясь в молекулы слабого электролита — цианистоводородной кислоты $HCN$, тогда как гидроксид — ион $ОН^{-}$ остается в растворе, обусловливая тем самым его щелочную среду. Происходит гидролиз по аниону $CN^{-}$.
Запишем полное ионное уравнение происходящего процесса (гидролиза):
$K^{+}+CN^{-}+H_2O{⇄}↖{←}HCN+K^{+}+OH^{-}.$
Этот процесс обратим, и химическое равновесие смещено влево (в сторону образования исходных веществ), т.к. вода — значительно более слабый электролит, чем цианистоводородная кислота $HCN$.
$CN^{-}+H_2O⇄HCN+OH^{-}.$
Уравнение показывает, что:
а) в растворе есть свободные гидроксид-ионы $ОН^{-}$, и концентрация их больше, чем в чистой воде, поэтому раствор соли $KCN$ имеет щелочную среду ($рН > 7$);
б) в реакции с водой участвуют ионы $CN^{-}$, в таком случае говорят, что идет гидролиз по аниону. Другие примеры анионов, которые участвуют в реакции с водой:
| $HCOO^{–}, CH_3COO^{–}, NO_2^{–}$ | от слабых кислот — муравьиной $HCOOH$, уксусной $CH_3COOH$, азотистой $HNO_2$ |
| $S^{2-}, CO_3^{2-}, SO_3^{2-}, PO_4^{3-}$ | от слабых кислот — сероводородной $H_2S$, угольной $H_2CO_3$, сернистой $H_2SO_3$, ортофосфорной $H_3PO_4$ |
Рассмотрим гидролиз карбоната натрия $Na_2CO_3$.
${NaOH}↙{text»сильное однокислотное основание»}←Na_2CO_3→{H_2CO_3}↙{text»слабая двухосновная кислота»}$
Происходит гидролиз соли по аниону $CO_3^{2-}$.
Полное ионное уравнение гидролиза:
$2Na^{+}+CO_3^{2-}+H_2O{⇄}↖{←}HCO_3^{-}+2Na^{+}+OH^{-}.$
Сокращенное ионное уравнение гидролиза:
$CO_2^{2-}+H_2O⇄HCO_3^{-}+OH^{-}.$
Продукты гидролиза — кислая соль $NaHCO_3$ и гидроксид натрия $NaOH$.
Среда водного раствора карбоната натрия — щелочная ($рН > 7$), потому что в растворе увеличивается концентрация ионов $ОН^{-}$. Кислая соль $NaHCO_3$ тоже может подвергаться гидролизу, который протекает в очень незначительной степени, и им можно пренебречь.
Подведем итог тому, что вы узнали о гидролизе по аниону:
а) по аниону соли, как правило, гидролизуются обратимо;
б) химическое равновесие в таких реакциях сильно смещено влево;
в) реакция среды в растворах подобных солей щелочная ($рН > 7$);
г) при гидролизе солей, образованных слабыми многоосновными кислотами, получаются кислые соли.
2. Соли, образованные сильной кислотой и слабым основанием.
Рассмотрим гидролиз хлорида аммония $NH_4Cl$.
${NH_3·H_2O}↙{text»слабое однокислотное основание»}←NH_4Cl→{HCl}↙{text»сильная одноосновная кислота»}$
В водном растворе соли происходят два процесса:
1) незначительная обратимая диссоциация молекул воды (очень слабого амфотерного электролита), которую упрощенно можно записать с помощью уравнения:
$H_2O{⇄}↖{←}H^{+}+OH^{-}$
2) полная диссоциация соли (сильного электролита):
$NH_4Cl=NH_4^{+}+Cl^{-}$
Образующиеся при этом ионы $OH^{-}$ и $NH_4^{+}$ взаимодействуют между собой с получением $NH_3·H_2O$ (слабый электролит), тогда как ионы $Н^{+}$ остаются в растворе, обусловливая тем самым его кислотную среду.
Полное ионное уравнение гидролиза:
$NH_4^{+}+Cl^{-}+H_2O{⇄}↖{←}H^{+}+Cl^{-}NH_3·H_2O$
Процесс обратим, химическое равновесие смещено в сторону образования исходных веществ, т.к. вода $Н_2О$ — значительно более слабый электролит, чем гидрат аммиака $NH_3·H_2O$.
Сокращенное ионное уравнение гидролиза:
$NH_4^{+}+H_2O⇄H^{+}+NH_3·H_2O.$
Уравнение показывает, что:
а) в растворе есть свободные ионы водорода $Н^{+}$, и их концентрация больше, чем в чистой воде, поэтому раствор соли имеет кислотную среду ($рН < 7$);
б) в реакции с водой участвуют катионы аммония $NH_4^{+}$; в таком случае говорят, что идет гидролиз по катиону.
В реакции с водой могут участвовать и многозарядные катионы: двухзарядные $М^{2+}$ (например, $Ni^{2+}, Cu^{2+}, Zn^{2+}…$), кроме катионов щелочноземельных металлов, трехзарядные $М^{3+}$ (например, $Fe^{3+}, Al^{3+}, Cr^{3+}…$).
Рассмотрим гидролиз нитрата никеля $Ni(NO_3)_2$.
${Ni(OH)_2}↙{text»слабое двухкислотное основание»}←Ni(NO_3)_2→{HNO_3}↙{text»сильная одноосновная кислота»}$
Происходит гидролиз соли по катиону $Ni^{2+}$.
Полное ионное уравнение гидролиза:
$Ni^{2+}+2NO_3^{-}+H_2O{⇄}↖{←}NiOH^{+}+2NO_3^{-}+H^{+}$
Сокращенное ионное уравнение гидролиза:
$Ni^{2+}+H_2O⇄NiOH^{+}+H^{+}.$
Продукты гидролиза — основная соль $NiOHNO_3$ и азотная кислота $HNO_3$.
Среда водного раствора нитрата никеля кислотная ($рН < 7$), потому что в растворе увеличивается концентрация ионов $Н^{+}$.
Гидролиз соли $NiOHNO_3$ протекает в значительно меньшей степени, и им можно пренебречь.
Подведем итог тому, что вы узнали о гидролизе по катиону:
а) по катиону соли, как правило, гидролизуются обратимо;
б) химическое равновесие реакций сильно смещено влево;
в) реакция среды в растворах таких солей кислотная ($рН < 7$);
г) при гидролизе солей, образованных слабыми многокислотными основаниями, получаются основные соли.
3. Соли, образованные слабым основанием и слабой кислотой.
Вам, очевидно, уже ясно, что такие соли подвергаются гидролизу и по катиону, и по аниону.
Катион слабого основания связывает ионы $ОН^{-}$ из молекул воды, образуя слабое основание; анион слабой кислоты связывает ионы $Н^{+}$ из молекул воды, образуя слабую кислоту. Реакция растворов этих солей может быть нейтральной, слабокислотной или слабощелочной. Это зависит от констант диссоциации двух слабых электролитов — кислоты и основания, которые образуются в результате гидролиза.
Например, рассмотрим гидролиз двух солей: ацетата аммония $NH_4(CH_3COO)$ и формиата аммония $NH_4(HCОO)$:
1) ${NH_3·H_2O}↙{text»слабое однокислотное основание»}←NH_4(CH_3COO)→{CH_3COOH}↙{text»сильная одноосновная кислота»};$
2) ${NH_3·H_2O}↙{text»слабое однокислотное основание»}←NH_4(HCOO)→{HCOOH}↙{text»слабая одноосновная кислота»}.$
В водных растворах этих солей катионы слабого основания $NH_4^{+}$ взаимодействуют с гидроксидионами $ОН^{-}$ (напомним, что вода диссоциирует $H_2O⇄H^{+}+OH^{-}$), а анионы слабых кислот $CH_3COO^{-}$ и $HCOO^{-}$ взаимодействуют с катионами $Н^{+}$ с образованием молекул слабых кислот — уксусной $CH_3COOH$ и муравьиной $HCOOH$.
Запишем ионные уравнения гидролиза:
1) $CH_3COO^{-}+NH_4^{+}+H_2O⇄CH_3COOH+NH_3·H_2O;$
2) $HCOO^{-}+NH_4^{+}+H_2O⇄NH_3·H_2O+HCOOH.$
В этих случаях гидролиз тоже обратимый, но равновесие смещено в сторону образования продуктов гидролиза — двух слабых электролитов.
В первом случае среда раствора нейтральная ($рН = 7$), т.к. $К_Д(СН_3COOH)=К+Д(NH_3·H_2O)=1.8·10^{-5}$. Во втором случае среда раствора слабокислотная ($pH < 7$), т.к. $К_Д(HCOOH)=2.1·10^{-4}$ и $К_Д(NH_3·H_2O) < К_Д(HCOOH)$ ($К_Д$ — константа диссоциации).
Как вы уже заметили, гидролиз большинства солей является обратимым процессом. В состоянии химического равновесия гидролизована лишь часть соли. Однако некоторые соли полностью разлагаются водой, т.е. их гидролиз является необратимым процессом.
В таблице «Растворимость кислот, оснований и солей в воде» вы найдете примечание: «в водной среде разлагаются» — это значит, что такие соли подвергаются необратимому гидролизу. Например, сульфид алюминия $Al_2S_3$ в воде подвергается необратимому гидролизу, т. к. появляющиеся при гидролизе по катиону ионы $Н^{+}$ связываются образующимися при гидролизе по аниону ионами $ОН^{-}$. Это усиливает гидролиз и приводит к образованию нерастворимого гидроксида алюминия и газообразного сероводорода:
$Al_2S_3+6H_2O=2Al(OH)_3↓+3H_2S↑$
Поэтому сульфид алюминия $Al_2S_3$ нельзя получить реакцией обмена между водными растворами двух солей, например хлорида алюминия $AlCl_3$ и сульфида натрия $Na_2S$.
Возможны и другие случаи необратимого гидролиза, их нетрудно предсказать, ведь для необратимости процесса необходимо, чтобы хотя бы один из продуктов гидролиза уходил из сферы реакции.
Подведем итог тому, что вы узнали о гидролизе и по катиону, и по аниону:
а) если соли гидролизуются и по катиону, и по аниону обратимо, то химическое равновесие в реакциях гидролиза смещено вправо;
б) реакция среды при этом или нейтральная, или слабокислотная, или слабощелочная, что зависит от соотношения констант диссоциации образующихся основания и кислоты;
в) соли могут гидролизоваться и по катиону, и по аниону необратимо, если хотя бы один из продуктов гидролиза уходит из сферы реакции.
4. Соли, образованные сильным основанием и сильной кислотой, не подвергаются гидролизу.
К этому выводу, очевидно, вы пришли сами.
Рассмотрим поведение в растворе хлорида калия $KCl$.
${KOH}↙{text»сильное однокислотное основание»}←KCl→{HCl}↙{text»сильная одноосновная кислота»}.$
Соль в водном растворе диссоциирует на ионы ($KCl=K^{+}+Cl^{–}$), но при взаимодействии с водой слабый электролит образоваться не может. Среда раствора нейтральная ($рН=7$), т.к. концентрации ионов $Н^{+}$ и $ОН^{-}$ в растворе равны, как в чистой воде.
Другими примерами подобных солей могут быть галогениды, нитраты, перхлораты, сульфаты, хроматы и дихроматы щелочных металлов, галогениды (кроме фторидов), нитраты и перхлораты щелочноземельных металлов.
Следует также отметить, что реакция обратимого гидролиза полностью подчиняется принципу Ле Шателье. По этому гидролиз соли можно усилить (и даже сделать необратимым) следующими способами:
а) добавить воды (уменьшить концентрацию);
б) нагреть раствор, при этом усиливается эндотермическая диссоциация воды:
$H_2O⇄H^{+}+OH^{-}-57$ кДж,
а значит, увеличивается количество $Н^{+}$ и $ОН^{–}$, которые необходимы для осуществления гидролиза соли;
в) связать один из продуктов гидролиза в труднорастворимое соединение или удалить один из продуктов в газовую фазу; например, гидролиз цианида аммония $NH_4CN$ будет значительно усиливаться за счет разложения гидрата аммиака с образованием аммиака $NH_3$ и воды $Н_2О$:
$NH_4^{+}+CN^{-}+H_2O⇄NH_3·H_2O+HCN.$
$NH_3{↑}↖{⇄}H_2$
Гидролиз солей
| Соли, не подвергающиеся гидролизу | Соли, подвергающиеся гидролизу | ||
| обратимо со смещением равновесия | необратимо | ||
| влево | вправо | ||
| $←$ | ${⇄}↖{←}$ | ${⇄}↖{→}$ | ${↑,↓}↖{→}$ |
| $C+C$ | $C+Cл$ | $Cл+C$ | $Cл+Cл$ |
| гидролиз по аниону — среда раствора щелочная (рН > 7) | гидролиз по катиону — среда раствора кислотная (рН < 7) | гидролиз по катиону и аниону — среда раствора зависит от констант диссоциации образующихся при гидролизе основания и кислоты (нейтральная, слабощелочная, слабокислотная) |
Условные обозначения:
| $C$ | катион | сильных | оснований | $↓$ нерастворимое соединение |
| анион | кислот | |||
| $Cл$ | катион | слабых | оснований | $↑$ летучее соединение |
| анион | кислот |
Гидролиз можно подавить (значительно уменьшить количество подвергающейся гидролизу соли), действуя следующим образом:
а) увеличить концентрацию растворенного вещества;
б) охладить раствор (для ослабления гидролиза растворы солей следует хранить концентрированными и при низких температурах);
в) ввести в раствор один из продуктов гидролиза; например, подкислять раствор, если его среда в результате гидролиза кислотная, или подщелачивать, если щелочная.
Значение гидролиза
Гидролиз солей имеет и практическое, и биологическое значение. Еще в древности в качестве моющего средства использовали золу. В золе содержится карбонат калия $K_2CO_3$, который в воде гидролизуется по аниону, водный раствор приобретает мылкость за счет образующихся при гидролизе ионов $ОН^{-}$.
В настоящее время в быту мы используем мыло, стиральные порошки и другие моющие средства. Основной компонент мыла — это натриевые и калиевые соли высших жирных карбоновых кислот: стеараты, пальмитаты, которые гидролизуются.
Гидролиз стеарата натрия $С_{17}Н_{35}COONa$ выражается следующим ионным уравнением:
$C_{17}H_{35}COO^{-}+H_2O⇄C_{17}H_{35}COOH+OH^{-}$,
т.е. раствор имеет слабощелочную среду.
В состав же стиральных порошков и других моющих средств специально вводят соли неорганических кислот (фосфаты, карбонаты), которые усиливают моющее действие за счет повышения рН среды.
Соли, создающие необходимую щелочную среду раствора, содержатся в фотографическом проявителе. Это карбонат натрия $Na_2CO_3$, карбонат калия $K_2CO_3$, бура $Na_2B_4O_7$ и другие соли, гидролизующиеся по аниону.
Если кислотность почвы недостаточна, у растений появляется болезнь — хлороз. Ее признаки — пожелтение или побеление листьев, отставание в росте и развитии. Если $рН_{почвы} > 7.5$, то в нее вносят удобрение сульфат аммония $(NH_4)_2SO_4$, которое способствует повышению кислотности благодаря гидролизу по катиону, проходящему в почве:
$NH_4^{+}+H_2O⇄NH_3·H_2O$
Неоценима биологическая роль гидролиза некоторых солей, входящих в состав нашего организма. Например, в состав крови входят соли гидрокарбонат и гидрофосфат натрия. Их роль заключается в поддержании определенной реакции среды. Это происходит за счет смещения равновесия процессов гидролиза:
$HCO_3^{-}+H_2O⇄H_2CO_3+OH^{-}$
$HPO_4^{2-}+H_2O⇄H_2PO_4^{-}+OH^{-}$
Если в крови избыток ионов $Н^{+}$, они связываются с гидроксид-ионами $ОН^{-}$, и равновесие смещается вправо. При избытке гидроксид-ионов $ОН^{-}$ равновесие смещается влево. Благодаря этому кислотность крови здорового человека колеблется незначительно.
Другой пример: в составе слюны человека есть ионы $HPO_4^{2-}$. Благодаря им в полости рта поддерживается определенная среда ($рН=7-7.5$).
Men+ + H-OH MeOH(n-1)+ + H+
Написав формулу образовавшейся частицы, тут же обсуждаем, что это за частица, будет ли она иметь заряд и какой, приходим к выводу, что, как правило, это гидроксокатион. А что останется от молекулы воды? Какую реакцию водного раствора обуславливает избыток этих частиц? Какова будет реакция индикатора? А теперь проверим нашу гипотезу (следует демонстрация опыта).
Теперь школьники могут самостоятельно сделать вывод:
Гидролиз по катиону приводит к образованию гидроксокатионов и ионов водорода (среда раствора кислая).
Отмечаем, что только иногда, при n=1, вместо гидроксокатионов получаем молекулы слабого основания.
А может ли гидроксокатион вступить в реакцию со следующей молекулой воды? Сообщаем, что это будет вторая ступень гидролиза, и что каждая следующая ступень протекает в тысячи раз слабее, чем предыдущая, что даже первая ступень протекает обычно на доли процента. Поэтому, как правило, рассматривается только первая ступень гидролиза.
Гидролиз по аниону разбираем аналогично, записываем уравнение:
Ann– + H-OH HAn(n-1)– + OH–
Подводим учеников к выводу:
Гидролиз по аниону приводит к образованию гидроанионов и гидроксид-ионов (среда раствора щелочная).
Совместный гидролиз. Из самого названия следует, что в этом случае в растворе протекают две выше рассмотренные реакции. Предлагаем школьникам проанализировать их и сделать вывод о реакции среды. Опровергаем (можно экспериментом) представление о том, что среда будет нейтральной. Одинаковое число ионов водорода и гидроксид-ионов только на бумаге. На самом деле здесь протекают две независимые обратимые реакции, и каких ионов в растворе окажется больше, зависит от степени протекания каждой реакции. А это, в свою очередь, зависит от того, что слабее, кислота или основание. Если слабее основание, то в большей степени будет протекать гидролиз по катиону и среда раствора будет кислой. Если слабее основание – наоборот. Как исключение, возможен случай, когда среда будет почти нейтральной, но это только исключение.
Одновременно обращаем внимание учащихся на то, что связывание гидроксид-ионов и ионов водорода в воду приводит к уменьшению их концентрации в растворе. Предлагаем вспомнить принцип Ле Шателье и подумать, как это повлияет на равновесие. Подводим их к выводу, что при совместном гидролизе степень его протекания будет значительно выше, и, в отдельных случаях, это может привести к полному гидролизу.
Полный гидролиз. Для полного протекания гидролиза нужно, чтобы соль была образована очень слабой кислотой и очень слабым основанием. Кроме того, желательно, чтобы один из продуктов гидролиза, уходил из сферы реакции в виде газа. (Малорастворимые вещества, остающиеся в контакте с раствором, вообще говоря, не уходят из сферы реакции, поскольку все равно, сколько то растворимы.) Поэтому полному гидролизу подвергаются обычно соли газообразных или неустойчивых кислот: сероводородной, угольной, отчасти сернистой. К ним примыкают вещества, которые в обычном понимании уже не являются солями: нитриды, фосфиды, карбиды, ацетилениды, бориды. Полностью гидролизуются также алкоголяты.
Если вернуться к обычным солям, то полностью гидролизующиеся соли (карбонаты, сульфиды алюминия, хрома(III), железа(III)) нельзя получить реакциями обмена в водных растворах. Вместо ожидаемых продуктов в результате реакции мы получим продукты гидролиза. Гидролиз осложняет протекание многих других реакций обмена. Так, при взаимодействии карбоната натрия с сульфатом меди в осадок обычно выпадает основной карбонат меди (CuOH)2CO3.
В таблице растворимости для полностью гидролизующихся солей стоит прочерк. Однако прочерк может стоять по другим причинам: вещество не изучено, разлагается в ходе окислительно-восстановительной реакции, и т.п. Некоторые прочерки в таблице растворимости вызывают удивление. Так. сульфид бария хорошо известен и растворим (как и сульфиды других щелочноземельных металлов). Гидролиз этих солей протекает только по аниону.
Алгоритм написания уравнений гидролиза.
Когда школьники поняли суть реакции гидролиза, даем (а лучше составляем вместе с ними) алгоритм написания уравнений гидролиза.
Рассмотрим его на конкретных примерах.
1. Определяем тип гидролиза. На этом этапе школьники могут написать уравнение диссоциации соли. Можно дать им “правило цепочки”: цепочка рвется по слабому звену, гидролиз идет по иону слабого электролита.
Пример 1. Гидролиз сульфата меди(II):
CuSO4 = Cu2+ + SO42–
Соль образована катионом слабого основания (подчеркиваем) и анионом сильной кислоты. Гидролиз по катиону.
2. Пишем ионное уравнение гидролиза, определяем среду
Cu2+ + H-OH CuOH+ + H+;
образуется катион гидроксомеди(II) и ион водорода, среда кислая
3. Составляем молекулярное уравнение. Надо учитывать, что составление такого уравнения есть некоторая формальная задача. Из положительных и отрицательных частиц находящихся в растворе, мы составляем нейтральные частицы, существующие только на бумаге. В данном случае мы можем составить формулу (CuOH)2SO4, но для этого наше ионное уравнение мы должны мысленно умножить на два. Получаем:
2CuSO4 + 2H2O (CuOH)2SO4 + H2SO4
Обращаем внимание, что продукт реакции относится к группе основных солей. Названия основных солей, как и названия средних, следует составлять из названия аниона и названия катиона, в данном случае соль назовем сульфат гидроксомеди(II). (Приставка “ди” не нужна, не говорим же мы “сульфат динатрия”). Называть эту соль “гидроксосульфат меди”, на наш взгляд, значит нарушать всю логику номенклатуры солей. Разве есть в растворе, или в узлах кристаллической решетки частица “гидроксосульфат”? Нет! А катион гидроксомеди есть. В дальнейшем этот подход распространяется на номенклатуру комплексных солей.
Пример 2. Гидролиз ортофосфата рубидия.
1. Определяем тип гидролиза.
Rb3PO4 = 3Rb+ + PO43–
Рубидий – щелочной металл, его гидроксид сильное основание, фосфорная кислота, особенно по своей третьей стадии диссоциации, отвечающей образованию фосфатов – слабая кислота. Гидролиз по аниону.
2. Пишем ионное уравнение гидролиза, определяем среду
PO43– + H-OH HPO42– + OH–
Продукты: гидрофосфат-ион и гидроксид-ион среда щелочная.
3. Составляем молекулярное уравнение.
Rb3PO4 + H2O Rb2HPO4 + RbOH
Получили кислую соль – гидрофосфат рубидия.
Пример 3. Ацетат алюминия
1. Определяем тип гидролиза.
Al(CH3COO)3 = Al3+ + 3CH3COO–
Соль слабого основания и слабой кислоты – совместный гидролиз.
2. Ионные уравнения гидролиза, среда.
Al3+ + H-OH AlOH2+ + H+;
CH3COO– + H-OH CH3COOH + OH–
Учитывая, что гидроксид алюминия очень слабое основание, предположим, что гидролиз по катиону будет протекать в большей степени, чем по аниону, следовательно, в растворе будет избыток ионов водорода и среда будет кислая.
Не стоит пытаться составлять здесь “суммарное» уравнение реакции. Обе реакции обратимы, никак друг с другом не связаны, и такое суммирование бессмысленно.
3. Составляем молекулярное уравнение.
Al(CH3COO)3 + H2O AlOH(CH3COO)2 + CH3COOH
Тоже как формальное упражнение, для тренировки в составлении формул солей и их номенклатуре. Полученную соль назовем ацетат гидроксоалюминия.
Факторы, влияющие на степень гидролиза.
Поскольку гидролиз обратимая реакция, то на состояние равновесия гидролиза влияют температура, концентрации участников реакции, добавки посторонних веществ. Если в реакции не участвуют газообразные вещества, практически не влияет давление. Исключается из рассмотрения вода, так как ее концентрация в водных растворах практически постоянна (~55 моль/л). Так для наших примеров 1 и 2 выражения констант равновесия (констант гидролиза) имеют вид:
и
Температура. Поскольку реакция гидролиза эндотермическая, то повышение температуры смещает равновесие в системе вправо, степень гидролиза возрастает.
Концентрация продуктов гидролиза. В соответствии с принципом Ле Шателье, повышение концентрации ионов водорода (для примера 1) приведет к смещению равновесия влево. Степень гидролиза будет уменьшаться. Также будет влиять увеличение концентрации гидроксид-ионов для реакции рассмотренной в примере 2.
Концентрация соли. Рассмотрение этого фактора приводит к парадоксальному выводу: равновесие в системе смещается вправо, в соответствии с принципом Ле Шателье, но степень гидролиза уменьшается. Понять это помогает константа равновесия. Да, при добавлении соли, то есть фосфат-ионов (пример 2), равновесие будет смещаться вправо, концентрация гидрофосфат и гидроксид-ионов будет возрастать. Но из рассмотрения константы равновесия этой реакции ясно, что для того, чтобы увеличить концентрацию гидроксид-ионов вдвое, нам надо концентрацию фосфат-ионов увеличить в 4 раза! Ведь значение константы должно быть неизменным. А это значит, что степень гидролиза, под которой можно понимать отношение [OH–] / [PO43–], уменьшится вдвое.
Разбавление. Этот фактор означает одновременное уменьшение концентрации всех частиц в растворе (не считая воды). В соответствии с принципом Ле Шателье, такое воздействие приводит к смещению равновесия в сторону реакции, идущей с увеличением числа частиц. Реакция гидролиза протекает (без учета воды!) с увеличением числа частиц. Следовательно при разбавлении равновесие смещается в сторону протекания этой реакции, вправо, степень гидролиза возрастает. К этому же выводу придем из рассмотрения константы гидролиза.
Добавки посторонних веществ могут влиять на положение равновесия в том случае, когда эти вещества реагируют с одним из участников реакции. Так, при добавлении к раствору сульфата меди (пример 1) раствора гидроксида натрия, содержащиеся в нем гидроксид-ионы будут взаимодействовать с ионами водорода. В результате их концентрация уменьшится, и, по принципу Ле Шателье, равновесие в системе сместится вправо, степень гидролиза возрастет. А если к тому же раствору добавить раствор сульфида натрия, то равновесие сместится не вправо, как можно было бы ожидать (взаимное усиление гидролиза) а наоборот, влево, из-за связывания ионов меди в практически нерастворимый сульфид меди.
Практическое применение.
На практике с гидролизом учителю приходится сталкиваться, например при приготовлении растворов гидролизующихся солей (ацетат свинца, например). Обычная “методика”: в колбу наливается вода, засыпается соль, взбалтывается. Остается белый осадок. Добавляем еще воды, взбалтываем, осадок не исчезает. Добавляем из чайника горячей воды – осадка кажется еще больше… А причина в том, что одновременно с растворением идет гидролиз соли, и белый осадок, который мы видим это уже продукты гидролиза – малорастворимые основные соли. Все наши дальнейшие действия, разбавление, нагревание, только усиливают степень гидролиза. Как же подавить гидролиз? Не нагревать, не готовить слишком разбавленных растворов, и поскольку главным образом мешает гидролиз по катиону – добавить кислоты. Лучше соответствующей, то есть уксусной.
В других случаях степень гидролиза желательно увеличить, и чтобы сделать щелочной моющий раствор бельевой соды более активным, мы его нагреваем – степень гидролиза карбоната натрия при этом возрастает.
Важную роль играет гидролиз в процессе обезжелезивания воды методом аэрации. При насыщении воды кислородом, содержащийся в ней гидрокарбонат железа(II) окисляется до соли железа(III), значительно сильнее подвергающегося гидролизу. В результате происходит полный гидролиз и железо отделяется в виде осадка гидроксида железа(III).
На этом же основано применение солей алюминия в качестве коагулянтов в процессах очистки воды. Добавляемые в воду соли алюминия в присутствии гидрокарбонат-ионов полностью гидролизуются и объемистый гидроксид алюминия коагулирует, увлекая с собой в осадок различные примеси.
Гидролиз в заданиях ЕГЭ по химии.
1. Фенолфталеин можно использовать для обнаружения в водном растворе соли
1) ацетата алюминия
2) нитрата калия
3) сульфата алюминия
4) силиката натрия
Фенолфталеин – индикатор на щелочную среду, в которой он принимает малиновую окраску (возможно, для многих камнем преткновения в этом вопросе стало незнание окрасок индикаторов: фенолфталеина, лакмуса, метилоранжа). В растворе соли щелочная среда может возникнуть при гидролизе по аниону.. Анализируем:
1) ацетат алюминия, рассмотрено выше, совместный гидролиз, среда слабокислая;
2) нитрат калия, кислота и основание сильные, гидролиз не идет, среда нейтральная;
3) сульфат алюминия, сильная кислота и слабое основание, гидролиз по катиону, среда кислая;
4) силикат натрия, слабая кислота и сильное основание, гидролиз по аниону, среда щелочная:
SiO32– + H2O HSiO3– + OH – .
Правильный ответ: 4.
2. Среда раствора карбоната калия
1) щелочная 2) кислая 3) нейтральная 4) слабокислая
Рассматриваем аналогично, Правильный ответ: 1.
3. Установите соответствие между формулой соли и ионным уравнением гидролиза этой соли.
|
ФОРМУЛА СОЛИ |
ИОННОЕ УРАВНЕНИЕ |
Пример не слишком удачного вопроса. С одной стороны, трудно на него не ответить, исходя из простого сопоставления формул в левой и правой колонке. Про гидролиз можно при этом ничего не знать. С другой стороны, оба ионных уравнений для катиона меди можно считать правильными. Второе уравнение мы бы назвали суммарным для двух стадий гидролиза, и отметили бы, что степень протекания реакции по нему чрезвычайно мала. Только на основе этого мы выберем первое уравнение.
Окончательный ответ: ВГАБ
4. Установите соответствие между условиями и состоянием химического равновесия процесса гидролиза солей.
|
УСЛОВИЯ СМЕЩЕНИЯ РАВНОВЕСИЯ 1) нагревание раствора |
ХИМИЧЕСКОЕ РАВНОВЕСИЕ А) смещается влево |
Используя установленные выше закономерности, придем к правильному ответу: БААБ
5. Как скажется на состоянии химического равновесия в системе
Zn2+ + H2O ZnOH+ + H+ – Q
1) добавление H2SO4
2) добавление KOH
3) нагревание раствора?
Ответ обоснуйте.
При ответе на этот вопрос надо учитывать, что добавляемые вещества – электролиты. Поставляемые ими ионы могут, как непосредственно влиять на равновесие, так и взаимодействовать с одним из ионов, участвующих в обратимой реакции.
1) добавление H2SO4: H2SO4 =2H+ + SO42– ;
повышение концентрации ионов водорода приводит, по принципу Ле Шателье, к смещению равновесия в системе влево.
2) добавление KOH: KOH= K+ + OH– ; H+ + OH– =H2O;
гидроксид-ионы связывают ионы водорода в малодиссоциирующее вещество, воду. Снижение концентрации ионов водорода приводит, по принципу Ле Шателье, к смещению равновесия в системе вправо.
3) нагревание раствора. По принципу Ле Шателье, повышение температуры приводит к смещению равновесия в сторону протекания эндотермической реакции, т.е. – вправо.
Вопросы для самостоятельной отработки:
1. Между собой водные растворы сульфата и фосфата натрия можно различить с помощью
1) гидроксида натрия
2) серной кислоты
3) фенолфталеина
4) фосфорной кислоты
2. Установите соответствие между названиями солей и средой их растворов.
|
НАЗВАНИЕ СОЛИ 1) нитрит калия |
СРЕДА РАСТВОРА А) кислая |
3.Установите соответствие между формулой соли и способностью этой соли к гидролизу.
|
ФОРМУЛА СОЛИ 1) Zn(CH3COO)2 |
СПОСОБНОСТЬ К ГИДРОЛИЗУ А) гидролиз по катиону |
4. Установите соответствие между веществом и продуктами его гидролиза.
|
НАЗВАНИЕ СОЛИ |
ПРОДУКТЫ ГИДРОЛИЗА |
|
А) сульфид алюминия |
1) Zn(OH)Cl и HCl |
|
Б) карбонат натрия |
2) Al(OH)3 и H2S |
|
В) хлорид цинка |
3) Ca(OH)2 и C2H2 |
|
Г) карбид кальция |
4) NaHCO3 и NaOH |
Гидролиз
Автор статьи — профессиональный репетитор И. Давыдова (Юдина).
Гидролиз – это взаимодействие ионов растворенного вещества с молекулами воды:
X++H2O ↔ XOH+H+
Y—+H2O ↔ HY+OH—
Для нерастворимых веществ гидролиз не идет.
(На самом деле не бывает совершенно нерастворимых соединений, лишь вещества с очень низкой растворимостью. Но при сдаче экзамена за школьный курс растворимостью в таких случаях мы пренебрегаем.)
Сильные кислоты и основания в водных растворах в значительной степени диссоциированны:
NaOH ↔ Na+ + OH—
H2SO4 ↔ H+ + HSO4—
Это означает, что катионам щелочей и анионам сильных кислот выгодно существовать в растворе в виде ионов.
Для слабых кислот диссоциация происходит намного слабее. Например, в растворе азотистой кислоты значительно больше молекул, чем ионов, образовавшихся в результате диссоциации. Слабым электролитам выгоднее существовать в недиссоциированной форме.
Таким образом, гидролиз протекает по слабому (аниону слабой кислоты или катиону слабого основания).
1) Соль образована сильными основанием и кислотой:
NaCl, Ba(NO3)2, RbClO4 и т.д.
Гидролиз не идет, среда нейтральная, pH = 7, [H+]=[OH—] окраска индикаторов: фенолфталеин – бесцветный, лакмус фиолетовый – фиолетовый, метиловый оранжевый – оранжевый.
2) Соль образована сильным основанием и слабой кислотой:
NaF, K3PO4, (CH3COO)2Ba.
Гидролиз описывается уравнением:
F—+H2O ↔ HF+OH—. В результате гидролиза по аниону возрастает концентрация гидроксид-ионов в растворе, среда щелочная, pH > 7, [H+] < [OH—] окраска индикаторов: фенолфталеин – малиновый, лакмус фиолетовый — синий, метиловый оранжевый – желтый.
3) Соль образована слабым основанием и сильной кислотой:
NH4NO3, CuCl2, FeSO4.
Гидролиз описывается уравнением:
NH4+ + H2O ↔ H++ NH4OH.
В результате гидролиза по катиону возрастает концентрация протонов водорода в растворе, среда кислая, pH < 7, [H+] > [OH—] окраска индикаторов: фенолфталеин – бесцветный, лакмус фиолетовый — красный, метиловый оранжевый –розовый.
4) Соль образована слабым основанием и слабой кислотой:
NH4F, (CH3COO)2Cu, Ni(NO2)2.
Гидролиз описывается уравнениями:
F— + H2O ↔ HF + OH—, и
H+ + OH— ↔ H2O.
Гидролиз идет и по катиону, и по аниону, среда нейтральная, pH = 7, [H+]=[OH—] окраска индикаторов: фенолфталеин – бесцветный, лакмус фиолетовый – фиолетовый, метиловый оранжевый – оранжевый.
4а) Полный гидролиз – один из видов гидролиза и по катиону, и по аниону. Вещества, разлагающиеся в воде, необратимо гидролизуются:
Al2S3 + 6H2O → 2Al(OH)3 + 3H2S
Если в реакции обмена должно образоваться вещество, отмеченное в таблице растворимостей «?» или «-», в результате образуется смесь продуктов его гидролиза:
3Na2S + 2AlCl3 + 6H2O → 6NaCl + 2Al(OH)3 + 3H2S↑.
Таким образом, гидролизу подвержены только растворимые соли (или разлагающиеся водой, в этом случае гидролиз необратим), среду определяет «сильный» — катион сильного основания или анион сильной кислоты, а гидролиз идет по слабому.
Благодарим за то, что пользуйтесь нашими публикациями.
Информация на странице «Гидролиз» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из данного раздела.
Публикация обновлена:
09.03.2023