Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Согласно теории электролитической диссоциации, в водном растворе частицы растворенного вещества взаимодействуют с молекулами воды. Такое взаимодействие может привести к реакции гидролиза (от греч. hydro — вода, lysis — распад, разложение).
Гидролиз — это реакция обменного разложения вещества водой.
Гидролизу подвергаются различные вещества: неорганические — соли, карбиды и гидриды металлов, галогениды неметаллов; органические — галогеналканы, сложные эфиры и жиры, углеводы, белки, полинуклеотиды.
Водные растворы солей имеют разные значения рН и различные типы сред — кислотную ($рН < 7$), щелочную ($рН > 7$), нейтральную ($рН = 7$). Это объясняется тем, что соли в водных растворах могут подвергаться гидролизу.
Сущность гидролиза сводится к обменному химическому взаимодействию катионов или анионов соли с молекулами воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). А в водном растворе соли появляется избыток свободных ионов $Н^{+}$ или $ОН^{-}$, и раствор соли становится кислотным или щелочным соответственно.
Классификация солей
Любую соль можно представить как продукт взаимодействия основания с кислотой. Например, соль $KClO$ образована сильным основанием $KOH$ и слабой кислотой $HClO$.
В зависимости от силы основания и кислоты можно выделить четыре типа солей.
Рассмотрим поведение солей различных типов в растворе.
1. Соли, образованные сильным основанием и слабой кислотой.
Например, соль цианид калия $KCN$ образована сильным основанием $KOH$ и слабой кислотой $HCN$:
${KOH}↙{text»сильное однокислотное основание»}←KCN→{HCN}↙{text»слабая однокислотная кислота»}$
В водном растворе соли происходят два процесса:
1) незначительная обратимая диссоциация молекул воды (очень слабого амфотерного электролита), которую упрощенно можно записать с помощью уравнения
$H_2O{⇄}↖{←}H^{+}+OH^{-};$
2) полная диссоциация соли (сильного электролита):
$KCN=K^{+}+CN^{-}$
Образующиеся при этих процессах ионы $Н^{+}$ и $CN^{-}$ взаимодействуют между собой, связываясь в молекулы слабого электролита — цианистоводородной кислоты $HCN$, тогда как гидроксид — ион $ОН^{-}$ остается в растворе, обусловливая тем самым его щелочную среду. Происходит гидролиз по аниону $CN^{-}$.
Запишем полное ионное уравнение происходящего процесса (гидролиза):
$K^{+}+CN^{-}+H_2O{⇄}↖{←}HCN+K^{+}+OH^{-}.$
Этот процесс обратим, и химическое равновесие смещено влево (в сторону образования исходных веществ), т.к. вода — значительно более слабый электролит, чем цианистоводородная кислота $HCN$.
$CN^{-}+H_2O⇄HCN+OH^{-}.$
Уравнение показывает, что:
а) в растворе есть свободные гидроксид-ионы $ОН^{-}$, и концентрация их больше, чем в чистой воде, поэтому раствор соли $KCN$ имеет щелочную среду ($рН > 7$);
б) в реакции с водой участвуют ионы $CN^{-}$, в таком случае говорят, что идет гидролиз по аниону. Другие примеры анионов, которые участвуют в реакции с водой:
| $HCOO^{–}, CH_3COO^{–}, NO_2^{–}$ | от слабых кислот — муравьиной $HCOOH$, уксусной $CH_3COOH$, азотистой $HNO_2$ |
| $S^{2-}, CO_3^{2-}, SO_3^{2-}, PO_4^{3-}$ | от слабых кислот — сероводородной $H_2S$, угольной $H_2CO_3$, сернистой $H_2SO_3$, ортофосфорной $H_3PO_4$ |
Рассмотрим гидролиз карбоната натрия $Na_2CO_3$.
${NaOH}↙{text»сильное однокислотное основание»}←Na_2CO_3→{H_2CO_3}↙{text»слабая двухосновная кислота»}$
Происходит гидролиз соли по аниону $CO_3^{2-}$.
Полное ионное уравнение гидролиза:
$2Na^{+}+CO_3^{2-}+H_2O{⇄}↖{←}HCO_3^{-}+2Na^{+}+OH^{-}.$
Сокращенное ионное уравнение гидролиза:
$CO_2^{2-}+H_2O⇄HCO_3^{-}+OH^{-}.$
Продукты гидролиза — кислая соль $NaHCO_3$ и гидроксид натрия $NaOH$.
Среда водного раствора карбоната натрия — щелочная ($рН > 7$), потому что в растворе увеличивается концентрация ионов $ОН^{-}$. Кислая соль $NaHCO_3$ тоже может подвергаться гидролизу, который протекает в очень незначительной степени, и им можно пренебречь.
Подведем итог тому, что вы узнали о гидролизе по аниону:
а) по аниону соли, как правило, гидролизуются обратимо;
б) химическое равновесие в таких реакциях сильно смещено влево;
в) реакция среды в растворах подобных солей щелочная ($рН > 7$);
г) при гидролизе солей, образованных слабыми многоосновными кислотами, получаются кислые соли.
2. Соли, образованные сильной кислотой и слабым основанием.
Рассмотрим гидролиз хлорида аммония $NH_4Cl$.
${NH_3·H_2O}↙{text»слабое однокислотное основание»}←NH_4Cl→{HCl}↙{text»сильная одноосновная кислота»}$
В водном растворе соли происходят два процесса:
1) незначительная обратимая диссоциация молекул воды (очень слабого амфотерного электролита), которую упрощенно можно записать с помощью уравнения:
$H_2O{⇄}↖{←}H^{+}+OH^{-}$
2) полная диссоциация соли (сильного электролита):
$NH_4Cl=NH_4^{+}+Cl^{-}$
Образующиеся при этом ионы $OH^{-}$ и $NH_4^{+}$ взаимодействуют между собой с получением $NH_3·H_2O$ (слабый электролит), тогда как ионы $Н^{+}$ остаются в растворе, обусловливая тем самым его кислотную среду.
Полное ионное уравнение гидролиза:
$NH_4^{+}+Cl^{-}+H_2O{⇄}↖{←}H^{+}+Cl^{-}NH_3·H_2O$
Процесс обратим, химическое равновесие смещено в сторону образования исходных веществ, т.к. вода $Н_2О$ — значительно более слабый электролит, чем гидрат аммиака $NH_3·H_2O$.
Сокращенное ионное уравнение гидролиза:
$NH_4^{+}+H_2O⇄H^{+}+NH_3·H_2O.$
Уравнение показывает, что:
а) в растворе есть свободные ионы водорода $Н^{+}$, и их концентрация больше, чем в чистой воде, поэтому раствор соли имеет кислотную среду ($рН < 7$);
б) в реакции с водой участвуют катионы аммония $NH_4^{+}$; в таком случае говорят, что идет гидролиз по катиону.
В реакции с водой могут участвовать и многозарядные катионы: двухзарядные $М^{2+}$ (например, $Ni^{2+}, Cu^{2+}, Zn^{2+}…$), кроме катионов щелочноземельных металлов, трехзарядные $М^{3+}$ (например, $Fe^{3+}, Al^{3+}, Cr^{3+}…$).
Рассмотрим гидролиз нитрата никеля $Ni(NO_3)_2$.
${Ni(OH)_2}↙{text»слабое двухкислотное основание»}←Ni(NO_3)_2→{HNO_3}↙{text»сильная одноосновная кислота»}$
Происходит гидролиз соли по катиону $Ni^{2+}$.
Полное ионное уравнение гидролиза:
$Ni^{2+}+2NO_3^{-}+H_2O{⇄}↖{←}NiOH^{+}+2NO_3^{-}+H^{+}$
Сокращенное ионное уравнение гидролиза:
$Ni^{2+}+H_2O⇄NiOH^{+}+H^{+}.$
Продукты гидролиза — основная соль $NiOHNO_3$ и азотная кислота $HNO_3$.
Среда водного раствора нитрата никеля кислотная ($рН < 7$), потому что в растворе увеличивается концентрация ионов $Н^{+}$.
Гидролиз соли $NiOHNO_3$ протекает в значительно меньшей степени, и им можно пренебречь.
Подведем итог тому, что вы узнали о гидролизе по катиону:
а) по катиону соли, как правило, гидролизуются обратимо;
б) химическое равновесие реакций сильно смещено влево;
в) реакция среды в растворах таких солей кислотная ($рН < 7$);
г) при гидролизе солей, образованных слабыми многокислотными основаниями, получаются основные соли.
3. Соли, образованные слабым основанием и слабой кислотой.
Вам, очевидно, уже ясно, что такие соли подвергаются гидролизу и по катиону, и по аниону.
Катион слабого основания связывает ионы $ОН^{-}$ из молекул воды, образуя слабое основание; анион слабой кислоты связывает ионы $Н^{+}$ из молекул воды, образуя слабую кислоту. Реакция растворов этих солей может быть нейтральной, слабокислотной или слабощелочной. Это зависит от констант диссоциации двух слабых электролитов — кислоты и основания, которые образуются в результате гидролиза.
Например, рассмотрим гидролиз двух солей: ацетата аммония $NH_4(CH_3COO)$ и формиата аммония $NH_4(HCОO)$:
1) ${NH_3·H_2O}↙{text»слабое однокислотное основание»}←NH_4(CH_3COO)→{CH_3COOH}↙{text»сильная одноосновная кислота»};$
2) ${NH_3·H_2O}↙{text»слабое однокислотное основание»}←NH_4(HCOO)→{HCOOH}↙{text»слабая одноосновная кислота»}.$
В водных растворах этих солей катионы слабого основания $NH_4^{+}$ взаимодействуют с гидроксидионами $ОН^{-}$ (напомним, что вода диссоциирует $H_2O⇄H^{+}+OH^{-}$), а анионы слабых кислот $CH_3COO^{-}$ и $HCOO^{-}$ взаимодействуют с катионами $Н^{+}$ с образованием молекул слабых кислот — уксусной $CH_3COOH$ и муравьиной $HCOOH$.
Запишем ионные уравнения гидролиза:
1) $CH_3COO^{-}+NH_4^{+}+H_2O⇄CH_3COOH+NH_3·H_2O;$
2) $HCOO^{-}+NH_4^{+}+H_2O⇄NH_3·H_2O+HCOOH.$
В этих случаях гидролиз тоже обратимый, но равновесие смещено в сторону образования продуктов гидролиза — двух слабых электролитов.
В первом случае среда раствора нейтральная ($рН = 7$), т.к. $К_Д(СН_3COOH)=К+Д(NH_3·H_2O)=1.8·10^{-5}$. Во втором случае среда раствора слабокислотная ($pH < 7$), т.к. $К_Д(HCOOH)=2.1·10^{-4}$ и $К_Д(NH_3·H_2O) < К_Д(HCOOH)$ ($К_Д$ — константа диссоциации).
Как вы уже заметили, гидролиз большинства солей является обратимым процессом. В состоянии химического равновесия гидролизована лишь часть соли. Однако некоторые соли полностью разлагаются водой, т.е. их гидролиз является необратимым процессом.
В таблице «Растворимость кислот, оснований и солей в воде» вы найдете примечание: «в водной среде разлагаются» — это значит, что такие соли подвергаются необратимому гидролизу. Например, сульфид алюминия $Al_2S_3$ в воде подвергается необратимому гидролизу, т. к. появляющиеся при гидролизе по катиону ионы $Н^{+}$ связываются образующимися при гидролизе по аниону ионами $ОН^{-}$. Это усиливает гидролиз и приводит к образованию нерастворимого гидроксида алюминия и газообразного сероводорода:
$Al_2S_3+6H_2O=2Al(OH)_3↓+3H_2S↑$
Поэтому сульфид алюминия $Al_2S_3$ нельзя получить реакцией обмена между водными растворами двух солей, например хлорида алюминия $AlCl_3$ и сульфида натрия $Na_2S$.
Возможны и другие случаи необратимого гидролиза, их нетрудно предсказать, ведь для необратимости процесса необходимо, чтобы хотя бы один из продуктов гидролиза уходил из сферы реакции.
Подведем итог тому, что вы узнали о гидролизе и по катиону, и по аниону:
а) если соли гидролизуются и по катиону, и по аниону обратимо, то химическое равновесие в реакциях гидролиза смещено вправо;
б) реакция среды при этом или нейтральная, или слабокислотная, или слабощелочная, что зависит от соотношения констант диссоциации образующихся основания и кислоты;
в) соли могут гидролизоваться и по катиону, и по аниону необратимо, если хотя бы один из продуктов гидролиза уходит из сферы реакции.
4. Соли, образованные сильным основанием и сильной кислотой, не подвергаются гидролизу.
К этому выводу, очевидно, вы пришли сами.
Рассмотрим поведение в растворе хлорида калия $KCl$.
${KOH}↙{text»сильное однокислотное основание»}←KCl→{HCl}↙{text»сильная одноосновная кислота»}.$
Соль в водном растворе диссоциирует на ионы ($KCl=K^{+}+Cl^{–}$), но при взаимодействии с водой слабый электролит образоваться не может. Среда раствора нейтральная ($рН=7$), т.к. концентрации ионов $Н^{+}$ и $ОН^{-}$ в растворе равны, как в чистой воде.
Другими примерами подобных солей могут быть галогениды, нитраты, перхлораты, сульфаты, хроматы и дихроматы щелочных металлов, галогениды (кроме фторидов), нитраты и перхлораты щелочноземельных металлов.
Следует также отметить, что реакция обратимого гидролиза полностью подчиняется принципу Ле Шателье. По этому гидролиз соли можно усилить (и даже сделать необратимым) следующими способами:
а) добавить воды (уменьшить концентрацию);
б) нагреть раствор, при этом усиливается эндотермическая диссоциация воды:
$H_2O⇄H^{+}+OH^{-}-57$ кДж,
а значит, увеличивается количество $Н^{+}$ и $ОН^{–}$, которые необходимы для осуществления гидролиза соли;
в) связать один из продуктов гидролиза в труднорастворимое соединение или удалить один из продуктов в газовую фазу; например, гидролиз цианида аммония $NH_4CN$ будет значительно усиливаться за счет разложения гидрата аммиака с образованием аммиака $NH_3$ и воды $Н_2О$:
$NH_4^{+}+CN^{-}+H_2O⇄NH_3·H_2O+HCN.$
$NH_3{↑}↖{⇄}H_2$
Гидролиз солей
| Соли, не подвергающиеся гидролизу | Соли, подвергающиеся гидролизу | ||
| обратимо со смещением равновесия | необратимо | ||
| влево | вправо | ||
| $←$ | ${⇄}↖{←}$ | ${⇄}↖{→}$ | ${↑,↓}↖{→}$ |
| $C+C$ | $C+Cл$ | $Cл+C$ | $Cл+Cл$ |
| гидролиз по аниону — среда раствора щелочная (рН > 7) | гидролиз по катиону — среда раствора кислотная (рН < 7) | гидролиз по катиону и аниону — среда раствора зависит от констант диссоциации образующихся при гидролизе основания и кислоты (нейтральная, слабощелочная, слабокислотная) |
Условные обозначения:
| $C$ | катион | сильных | оснований | $↓$ нерастворимое соединение |
| анион | кислот | |||
| $Cл$ | катион | слабых | оснований | $↑$ летучее соединение |
| анион | кислот |
Гидролиз можно подавить (значительно уменьшить количество подвергающейся гидролизу соли), действуя следующим образом:
а) увеличить концентрацию растворенного вещества;
б) охладить раствор (для ослабления гидролиза растворы солей следует хранить концентрированными и при низких температурах);
в) ввести в раствор один из продуктов гидролиза; например, подкислять раствор, если его среда в результате гидролиза кислотная, или подщелачивать, если щелочная.
Значение гидролиза
Гидролиз солей имеет и практическое, и биологическое значение. Еще в древности в качестве моющего средства использовали золу. В золе содержится карбонат калия $K_2CO_3$, который в воде гидролизуется по аниону, водный раствор приобретает мылкость за счет образующихся при гидролизе ионов $ОН^{-}$.
В настоящее время в быту мы используем мыло, стиральные порошки и другие моющие средства. Основной компонент мыла — это натриевые и калиевые соли высших жирных карбоновых кислот: стеараты, пальмитаты, которые гидролизуются.
Гидролиз стеарата натрия $С_{17}Н_{35}COONa$ выражается следующим ионным уравнением:
$C_{17}H_{35}COO^{-}+H_2O⇄C_{17}H_{35}COOH+OH^{-}$,
т.е. раствор имеет слабощелочную среду.
В состав же стиральных порошков и других моющих средств специально вводят соли неорганических кислот (фосфаты, карбонаты), которые усиливают моющее действие за счет повышения рН среды.
Соли, создающие необходимую щелочную среду раствора, содержатся в фотографическом проявителе. Это карбонат натрия $Na_2CO_3$, карбонат калия $K_2CO_3$, бура $Na_2B_4O_7$ и другие соли, гидролизующиеся по аниону.
Если кислотность почвы недостаточна, у растений появляется болезнь — хлороз. Ее признаки — пожелтение или побеление листьев, отставание в росте и развитии. Если $рН_{почвы} > 7.5$, то в нее вносят удобрение сульфат аммония $(NH_4)_2SO_4$, которое способствует повышению кислотности благодаря гидролизу по катиону, проходящему в почве:
$NH_4^{+}+H_2O⇄NH_3·H_2O$
Неоценима биологическая роль гидролиза некоторых солей, входящих в состав нашего организма. Например, в состав крови входят соли гидрокарбонат и гидрофосфат натрия. Их роль заключается в поддержании определенной реакции среды. Это происходит за счет смещения равновесия процессов гидролиза:
$HCO_3^{-}+H_2O⇄H_2CO_3+OH^{-}$
$HPO_4^{2-}+H_2O⇄H_2PO_4^{-}+OH^{-}$
Если в крови избыток ионов $Н^{+}$, они связываются с гидроксид-ионами $ОН^{-}$, и равновесие смещается вправо. При избытке гидроксид-ионов $ОН^{-}$ равновесие смещается влево. Благодаря этому кислотность крови здорового человека колеблется незначительно.
Другой пример: в составе слюны человека есть ионы $HPO_4^{2-}$. Благодаря им в полости рта поддерживается определенная среда ($рН=7-7.5$).
Темы кодификатора ЕГЭ: Гидролиз солей. Среда водных растворов: кислая, основная и щелочная.
Гидролиз – взаимодействие веществ с водой. Гидролизу подвергаются разные классы неорганических и органических веществ: соли, бинарные соединения, углеводы, жиры, белки, эфиры и другие вещества. Гидролиз солей происходит, когда ионы соли способны образовывать с Н+ и ОН— ионами воды малодиссоциированные электролиты.
Гидролиз солей может протекать:
→ обратимо: только небольшая часть частиц исходного вещества гидролизуется.
→ необратимо: практически все частицы исходного вещества гидролизуются.
Для оценки типа гидролиза необходимо рассмотреть соль, как продукт взаимодействия основания и кислоты. Любая соль состоит из металла и кислотного остатка. Металлы соответствует основание или амфотерный гидроксид (с той же степенью окисления, что и в соли), а кислотному остатку — кислота. Например, карбонату натрия Na2CO3 соответствует основание — щелочь NaOH и угольная кислота H2CO3.
Обратимый гидролиз солей
Механизм обратимого гидролиза будет зависеть от состава исходной соли. Можно выделить 4 основных варианта, которые мы рассмотрим на примерах:
1. Соли, образованные сильным основанием и слабой кислотой, гидролизуются ПО АНИОНУ.
Примеры таких солей — CH3COONa, Na2CO3, Na2S, KCN.
Реакция гидролиза:
CH3COONa + HOH ↔ CH3COOH + NaOH
в ионной форме:
CH3COO— + Na+ + HOH ↔ CH3COOH + Na+ + OH—
сокращенное ионное уравнение:
CH3COO— + HOH ↔ CH3COOH + OH—
Таким образом, при гидролизе таких солей в растворе образуется небольшой избыток гидроксид-ионов OH—. Водородный показатель такого раствора рН>7.
Гидролиз солей многоосновных кислот (H2CO3, H3PO4 и т.п.) протекает ступенчато, с образованием кислых солей:
CO32- + HOH ↔ HCO32- + OH—
или в молекулярной форме:
Na2CO3 + HOH ↔ NaHCO3 + NaOH
2 ступень:
HCO3— + HOH ↔ H2CO3 + OH—
или в молекулярной форме:
NaHCO3 + HOH ↔ H2CO3 + NaOH
Продукты гидролиза по первой ступени подавляют вторую ступень гидролиза, в результате вторая ступень гидролиза протекает незначительно.
2. Соли, образованные слабым основанием и сильной кислотой, гидролизуются ПО КАТИОНУ. Пример такой соли: NH4Cl, FeCl3, Al2(SO4)3 Уравнение гидролиза:
NH4+ + HOH ↔ NH3·H2O + H+
или в молекулярной форме:
NH4Cl + HOH ↔ NH3·H2O + HCl
При этом катион слабого основания притягивает гидроксид-ионы из воды, а в растворе возникает избыток ионов Н+. Водородный показатель такого раствора рН<7.
Соли, образованные многокислотными основаниями, гидролизуются ступенчато, образуя катионы основных солей. Например:
I ступень:
Fe3+ + HOH ↔ FeOH2+ + H+
FeCl3 + HOH ↔ FeOHCl2 + HCl
II ступень:
FeOH2+ + HOH ↔ Fe(OH)2+ + H+
FeOHCl2 + HOH ↔ Fe(OH)2Cl+ HCl
III ступень:
Fe(OH)2+ + HOH ↔ Fe(OH)3 + H+
Fe(OH)2Cl + HOH ↔ Fe(OH)3 + HCl
Гидролиз по второй и, в особенности, по третьей ступени практически не протекает при комнатной температуре.
3. Соли, образованные слабым основанием и слабой кислотой, гидролизуются И ПО КАТИОНУ, И ПО АНИОНУ.
Примеры таких солей: CH3COONH4, (NH4)2CO3, HCOONH4,
Уравнение гидролиза:
CH3COO— + NH4+ + HOH ↔ CH3COOH + NH3·H2O
CH3COONH4 + HOH ↔ CH3COOH + NH3·H2O
В этом случае реакция раствора зависит от соотношения констант диссоциации образующихся кислот и оснований. В большинстве случаев реакция раствора будет примерно нейтральной, рН ≅ 7. Точное значение рН зависит от относительной силы основания и кислоты.
4. Гидролиз солей, образованных сильным основанием и сильной кислотой, в водных растворах НЕ ИДЕТ.
Сведем вышеописанную информацию в общую таблицу:
Необратимый гидролиз
Необратимый гидролиз происходит, если при гидролизе выделяется газ, осадок или вода, т.е. вещества, которые при данных условиях не могут взаимодействовать между собой. Необратимый гидролиз является химической реакцией, т.к. реагирующие вещества взаимодействуют практически полностью.
Варианты необратимого гидролиза:
- Гидролиз, в который вступают растворимые соли 2х-валентных металлов (Be2+, Co2+, Ni2+, Zn2+, Pb2+, Cu2+ и др.) с сильным ионизирующим полем (слабые основания) и растворимые карбонаты/гидрокарбонаты. При этом образуются нерастворимые основные соли (гидроксокарбонаты):
2MgCl2 + 2Na2CO3 + H2O = Mg2(OH)2CO3 + 4NaCl + CO2
2МеCl2 + 2Na2CO3 + Н2О = (МеОН)2CO3 + 4NaCl + СО2 (МеII, кроме Fe, Ca,Sr,Ba).
! Исключения: (соли Ca, Sr, Ba и Fe2+) – в этом случае получим обычный обменный процесс:
CaCl2 + Na2CO3 = CaCO3 + 2NaCl,
МеCl2 + Na2CO3 = МеCO3 + 2NaCl (Ме – Fe, Ca, Sr, Ba).
- Взаимный гидролиз, протекающий при смешивании двух солей, гидролизованных по катиону и по аниону. Продукты гидролиза по второй ступени усиливают гидролиз по первой ступени и наоборот. Поэтому в таких процессах образуются не просто продукты обменной реакции, а продукты гидролиза (совместный или взаимный гидролиз).Соли металлов со степенью окисления +3 (Al3+, Cr3+) и соли летучих кислот (карбонаты, сульфиды, сульфиты) при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ (H2S, SO2, CO2):
2AlCl3 + 3K2S +6H2O = 2Al(OH)3 + 3H2S↑ + 6KCl,
2CrCl3 + 3K2CO3 + 3H2O = 2Сr(ОН)3 + 3СO2 + 6KCl,
2МеCl3 + 3Na2CO3 + 3Н2О=2Ме(ОН)3 + 6NaCl + 3СО2 (МеIII),
2МеCl3 + 3Na2SO3 + 3Н2О=2Ме(ОН)3 + 6NaCl + 3SО2 (МеIII),
2МеCl3 + 3Na2S + 3Н2О=2Ме(ОН)3 + 6NaCl + 3H2S (МеIII).
Соли Fe3+ при взаимодействии с карбонатами также при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ:
2FeCl3 + 3K2CO3 + 3H2O = 2Fe(ОН)3 + 3СO2 + 6KCl
! Исключения: при взаимодействии солей трехвалентного железа с сульфидами реализуется окислительно-восстановительная реакция:
2FeCl3 + 3K2S(изб) = 2FeS + S↓ + 6KCl (при избытке сульфида калия)
При взаимодействии солей трехвалентного железа с сульфитами также реализуется окислительно-восстановительная реакция.
Полные уравнения таких реакций выглядят довольно сложно. Поначалу я рекомендую составлять такие уравнения в 2 этапа: сначала составляем обменную реацию без участия воды, затем разлагаем полученный продукт обменной реакции водой. Сложив эти две реакции и сократив одинаковые вещества, мы получаем полное уравнение необратимого гидролиза.
3. Гидролиз галогенангидридов и тиоангидридов происходит также необратимо. Галогенангидриды разлагаются водой по схеме ионного обмена (H+OH—) до соответствующих кислот (в случае водного гидролиза) и солей (в случае щелочного гидролиза). Степень окисления центрального элемента и остальных при этом не изменяется!
SO2Cl2 + 2 H2O = H2SO4 + 2 HCl,
SOCl2 + 2 H2O = H2SO3 + 2HCl,
PCl5 + 4 H2O = H3PO4 + 5HCl,
CrO2Cl2 + 2H2O = H2CrO4 + 2HCl,
PCl5 + 8NaOH = Na3PO4 + 5NaCl + 4H2O,
Галогенангидрид – это соединение, которое получается, если в кислоте ОН-группу заменить на галоген. При гидролизе галогенангидридов кислот образуются соответствующие данным элементам и степеням окисления кислоты и галогеноводородные кислоты.
POCl3 + 3H2O = H3PO4 + 3HCl
Галогенангидриды некоторых кислот:
| Кислота | Галогенангидриды |
| H2SO4 | SO2Cl2 |
| H2SO3 | SOCl2 |
| H2CO3 | COCl2 |
| H3PO4 | POCl3, PCl5 |
Тиоангидриды (сульфангидриды) — так называются, по аналогии с безводными окислами (ангидридами), сернистые соединения элементов (например, Sb2S3, As2S5, SnS2, CS2 и т. п.).
- Необратимый гидролиз бинарных соединений, образованных металлом и неметаллом:
- сульфиды трехвалентных металлов вводе необратимо гидролизуются до сероводорода и и гидроксида металла:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
при этом возможен кислотный гидролиз, в таком случае образуются соль металла и сероводород:
Al2S3 + 6HCl = 2AlCl3 + 3H2S
- гидролиз карбидов приводит к образованию гидроксида металла в водной среде, соли металла в кислой де и соответствующего углеводорода — метана, ацетилена или пропина:
Ca+2C-12 + H2O = Ca+2(OH)2 + C-12H2
Al+34C-43 + 12H2O = 4Al+3(OH)3 + 3C-4H4,
Ca3N2 + H2O =
Ca3P2 + H2O =
Mg2Si + H2O =
- Некоторые соли необратимо гидролизуются с образованием оксосолей:
BiCl3 + H2O = BiOCl + 2HCl,
SbCl3 + H2O = SbOCl + 2HCl.
Алюмокалиевые квасцы:
KAl(SO4)2 + K2S + H2O =
MgCl2 + NaНCO3 + H2O =
ZnSO4 + CsНCO3 + H2O =
CdSO4 + RbНCO3 + H2O =
CaSO4 + Rb2CO3 + H2O =
FeCl2 + Rb2CO3 + H2O =
Количественно гидролиз характеризуется величиной, называемой степенью гидролиза.
Степень гидролиза (α) — отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. В случае необратимого гидролиза α≅1.
Факторы, влияющие на степень гидролиза:
1. Температура
Гидролиз — эндотермическая реакция! Нагревание раствора приводит к интенсификации процесса.
Пример: изменение степени гидролиза 0,01 М CrCl3 в зависимости от температуры:
2. Концентрация соли
Чем меньше концентрация соли, тем выше степень ее гидролиза.
Пример: изменение степени гидролиза Na2CO3 в зависимости от температуры:
По этой причине для предотвращения нежелательного гидролиза хранить соли рекомендуется в концентрированном виде.
3. Добавление к реакционной смеси кислоты или щелочи
Изменяя концентрация одного из продуктов, можно смещать равновесие реакции гидролиза в ту или иную сторону.
Пройти тест по теме Гидролиз:
Здесь вы можете потренироваться в решении тестовых заданий в формате ЕГЭ по теме Гидролиз.
Тренировочные тесты по теме «Гидролиз»( с ответами)
179
Создан на
16 января, 2022 От Admin
Тренажер задания 21
Тренажер задания 21 ЕГЭ по химии
1 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) H2SO4
2) Na2S
3) AICl3
4) CaCl2
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация (моль/л) всех растворов одинаковая.
2 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) KHCO3
2) Ba(NO3)2
3) ZnSO4
4) HCIO3
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация (моль/л) всех растворов одинаковая.
3 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) NaHSO4
2) KClO4
3) CH3COOH
4) KHCO3
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
4 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) KOH
2) NaHCO3
3) H3PO4
4) НCl
Запишите номера веществ в порядке уменьшения значения pH их водных растворов.
5 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) Аl(NO3)3
2) NH3
3) CH3COONH4
4) HClO3
Запишите номера веществ в порядке возрастания значения pН их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
6 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) сульфат железа
2) нитрат бария
3) сульфид натрия
4) азотная кислота
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
7 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) Na2CO3
2) Н3РО4
3) Ва(NO3)2
4) Са(ОН)2
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
8 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) HF
2) HI
3) CaCrO4
4) Cs3PO4
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
9 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) HNO2
2) C2H5COOK
3) H2CrO4
4) Ca(OH)2
Запишите номера веществ в порядке уменьшения значения pH их водных растворов.
10 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) FeBr3
2) НСООNa
3) НВr
4) LiOH
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
Ваша оценка
The average score is 26%
Для того, чтобы понять, что такое гидролиз солей, вспомним для начала, как диссоциируют кислоты и щелочи.
Общим между всеми кислотами является то, что при их диссоциации обязательно образуются катионы водорода (Н+), при диссоциации же всех щелочей всегда образуются гидроксид-ионы (ОН−).
В связи с этим, если в растворе, по тем или иным причинам, больше ионов Н+ говорят, что раствор имеет кислую реакцию среды, если ОН− — щелочную реакцию среды.
Если с кислотами и щелочами все понятно, то какая же реакция среды будет в растворах солей?
На первый взгляд, она всегда должна быть нейтральной. И правда же, откуда, например, в растворе сульфида натрия взяться избытку катионов водорода или гидроксид-ионов. Сам сульфид натрия при диссоциации не образует ионов ни одного, ни другого типа:
Na2S = 2Na+ + S2-
Тем не менее, если бы перед вами оказались, к примеру, водные растворы сульфида натрия, хлорида натрия, нитрата цинка и электронный pH-метр (цифровой прибор для определения кислотности среды) вы бы обнаружили необычное явление. Прибор показал бы вам, что рН раствора сульфида натрия больше 7, т.е. в нем явный избыток гидроксид-ионов. Среда раствора хлорида натрия оказалась бы нейтральной (pH = 7), а раствора Zn(NO3)2 кислой.
Единственное, что соответствует нашим ожиданиям – это среда раствора хлорида натрия. Она оказалась нейтральной, как и предполагалось.
Но откуда же взялся избыток гидроксид-ионов в растворе сульфида натрия, и катионов-водорода в растворе нитрата цинка?
Попробуем разобраться. Для этого нам нужно усвоить следующие теоретические моменты.
Любую соль можно представить как продукт взаимодействия кислоты и основания. Кислоты и основания делятся на сильные и слабые. Напомним, что сильными называют те кислоты, и основания, степень диссоциации, которых близка к 100%.
примечание: сернистую (H2SO3) и фосфорную (H3PO4) чаще относят к кислотам средней силы, но при рассмотрении заданий по гидролизу нужно относить их к слабым.
Кислотные остатки слабых кислот, способны обратимо взаимодействовать с молекулами воды, отрывая от них катионы водорода H+. Например, сульфид-ион, являясь кислотным остатком слабой сероводородной кислоты, взаимодействует с ней следующим образом:
S2- + H2O ↔ HS− + OH−
HS−+ H2O ↔ H2S + OH−
Как можно видеть, в результате такого взаимодействия образуется избыток гидроксид-ионов, отвечающий за щелочную реакцию среды. То есть кислотные остатки слабых кислот увеличивают щелочность среды. В случае растворов солей содержащих такие кислотные остатки говорят, что для них наблюдается гидролиз по аниону.
Кислотные остатки сильных кислот, в отличие от слабых, с водой не взаимодействуют. То есть они не оказывают влияния на pH водного раствора. Например, хлорид-ион, являясь кислотным остатком сильной соляной кислоты, с водой не реагирует:
То есть, хлорид-ионы, не влияют на pН раствора.
Из катионов металлов, так же с водой способны взаимодействовать только те, которым соответствуют слабые основания. Например, катион Zn2+, которому соответствует слабое основание гидроксид цинка. В водных растворах солей цинка протекают процессы:
Zn2+ + H2O ↔ Zn(OH) + + H+
Zn(OH) + + H2O ↔ Zn(OH)+ + H+
Как можно видеть из уравнений выше, в результате взаимодействия катионов цинка с водой, в растворе накапливаются катионы водорода, повышающие кислотность среды, то есть понижающие pH. Если в состав соли, входят катионы, которым соответствуют слабые основания, в этом случае говорят что соль гидролизуется по катиону.
Катионы металлов, которым соответствуют сильные основания, с водой не взаимодействуют. Например, катиону Na+ соответствует сильное основание – гидроксид натрия. Поэтому ионы натрия с водой не реагируют и никак не влияют на pH раствора.
Таким образом, исходя из вышесказанного соли можно разделить на 4 типа, а именно, образованные:
1) сильным основанием и сильной кислотой,
Такие соли не содержат ни кислотных остатков, ни катионов металлов, взаимодействующих с водой, т.е. способных повлиять на pH водного раствора. Растворы таких солей имеют нейтральную реакцию среды. Про такие соли говорят, что они не подвергаются гидролизу.
Примеры: Ba(NO3)2, KCl, Li2SO4 и т.д.
2) сильным основанием и слабой кислотой
В растворах таких солей, с водой реагируют только кислотные остатки. Среда водных растворов таких солей щелочная, в отношении солей такого типа говорят, что они гидролизуются по аниону
Примеры: NaF, K2CO3, Li2S и т.д.
3) слабым основанием и сильной кислотой
У таких солей с водой реагируют катионы, а кислотные остатки не реагируют – гидролиз соли по катиону, среда кислая.
Примеры: Zn(NO3)2, Fe2(SO4)3, CuSO4 и т.д.
4) слабым основанием и слабой кислотой.
С водой реагируют как катионы, так и анионы кислотных остатков. Гидролиз солей такого рода идет и по катиону, и по аниону. Нередко такие соли подвергаются необратимому гидролизу.
Что же значит то, что они необратимо гидролизуются?
Поскольку в данном случае с водой реагируют и катионы металла (или NH4+) и анионы кислотного остатка, в раcтворе одновременно возникают и ионы H+, и ионы OH− , которые образуют крайне малодиссоциирующее вещество – воду (H2O).
Это, в свою очередь, приводит к тому, что соли образованные кислотными остатками слабых оснований и слабых кислот не могут быть получены обменными реакциями, а только твердофазным синтезом, либо и вовсе не могут быть получены. Например, при смешении раствора нитрата алюминия с раствором сульфида натрия, вместо ожидаемой реакции:
2Al(NO3)3 + 3Na2S = Al2S3 + 6NaNO3 ( − так реакция не протекает!)
Наблюдается следующая реакция:
2Al(NO3)3 + 3Na2S + 6H2O= 2Al(OH)3↓+ 3H2S↑ + 6NaNO3
Тем не менее, сульфид алюминия без проблем может быть получен сплавлением порошка алюминия с серой:
2Al + 3S = Al2S3
При внесении сульфида алюминия в воду, он также как и при попытке его получения в водном растворе, подвергается необратимому гидролизу.
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
Автор: С.И. Широкопояс https://scienceforyou.ru/
Гидролиз (греч. hydor — вода и lysis — разрушение) — процесс расщепления молекул сложных химических веществ за счет
реакции с молекулами воды.
В химии, как и в жизни, разрушается чаще всего нестойкое и слабое (стойкое и сильное выдерживает удар). Запомните, что гидролиз
(вода) разрушает «слабое» — это правило вам очень пригодится.

Любая соль состоит из остатка основания и кислоты. Абсолютно любая:
- NaCl — производное основания NaOH и кислоты HCl
- KNO3 — производное основания KOH и кислоты HNO3
- CuSO4 — производное основания Cu(OH)2 и кислоты H2SO4
- Al3PO4 — производное основания Al(OH)3 и кислоты H3PO4
- Ca(NO2)2 — производное основания Ca(OH)2 и кислоты HNO2
Чтобы успешно решать задания по теме гидролиза и писать реакции, вам следует запомнить, какие основания и кислоты являются
слабыми, а какие — сильными.
При изучении гидролиза я рекомендую ученикам сохранить на гаджет схему, которую вы видите ниже. Для того, чтобы приобрести
нужный опыт — она незаменима. Пользуйтесь ей как можно чаще, подглядывайте в нее и она незаметно окажется в вашем
интеллектуальном составляющем 

По катиону, по аниону или нет гидролиза?
Итак, если в состав соли входит остаток сильного основания и остаток сильной кислоты — гидролиза не происходит. Примеры: NaCl, KBr,
CaSO4. Также гидролиза не происходит, если соль нерастворима (вне зависимости от того, чем она образована): AlPO4,
FeSO3, CaSO3.
Если в состав соли входит остаток слабого основания и остаток сильной кислоты, то гидролиз идет по катиону. Помните, что гидролиз
разрушает слабое, в данном случае — катион. Примеры: AlCl3, MgBr2, Cr2SO4, NH4NO3.
Катион NH4+ и его основание NH4OH , несмотря на растворимость, является слабым, поэтому гидролиз будет идти
по катиону в соли NH4Cl. Замечу также, что Ca(OH)2 считается растворимым основанием, поэтому гидролиза соли CaCl2
не происходит.
Если в состав соли входит остаток сильного основания и остаток слабой кислоты, то гидролиз идет по аниону. Примеры: K3PO4,
NaNO2, Ca(OCl)2, Ba(CH3COO)2, K2SiO3.
Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет и по катиону, и по аниону. Примеры: Mg(NO2)2,
Al2S3, Cr2(SO3)3, CH3COONH4.
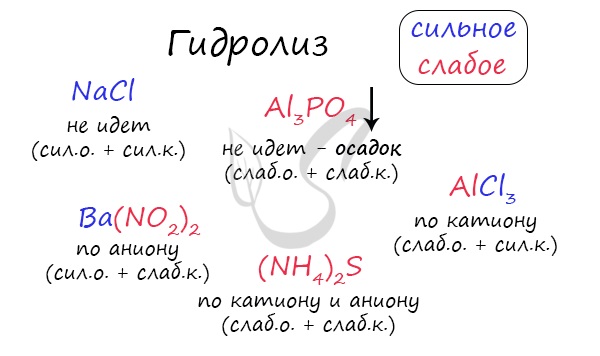
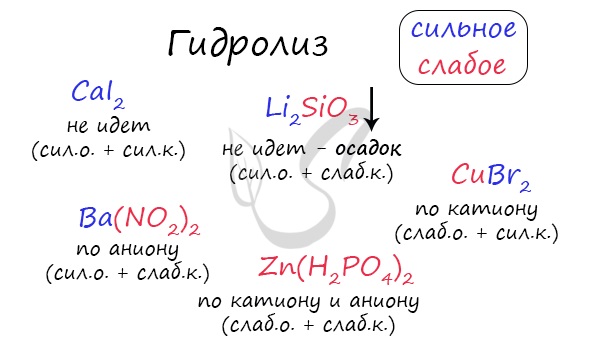
Самостоятельно определите тип гидролиза для CaI2, Li2SiO3, Ba(NO2)2, CuBr2, Zn(H2PO4)2.
Ниже вы найдете решение.
Среда раствора
Среда раствора может быть нейтральной, кислой или щелочной. Определяется типом гидролиза. Некоторые задания могут быть построены так, что, увидев соль,
вы должны будете определить ее тип раствора.
Обрадую вас: если вы усвоили тему гидролиза, сделать это проще простого. В случае, когда гидролиз не идет или идет и по катиону, и по аниону среда
раствора — нейтральная.
Если гидролиз идет по катиону (разрушается остаток основания) среда — кислая, если гидролиз идет по аниону (разрушается остаток кислоты), то среда
раствора будет щелочная. Изучите примеры.
Однако замечу, что в дигидрофосфатах, гидросульфитах и гидросульфатах среда всегда кислая из-за особенностей диссоциации. Примеры:
NH4H2PO4, LiHSO4. В гидрофосфатах среда щелочная из-за того, что константа диссоциации по третьей ступени меньше, чем константа гидролиза. Примеры: K2HPO4, Na2HPO4.

Попробуйте определить среду раствора для соединений из самостоятельного задания, которое вы только что решили.
Ниже будет располагаться решение.

С целью запутать в заданиях часто бывают даны синонимы. Так «среду раствора» могут заменить водородным показателем pH.
Запомните, что кислая среда характеризуется pH < 7. В нейтральной pH = 7. В щелочной pH > 7.
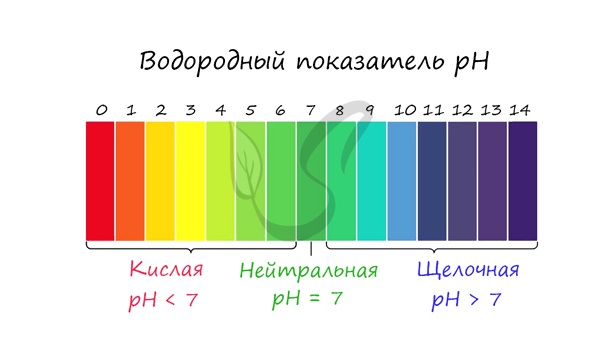
Например, в соли CaCl2 среда раствора будет нейтральной (pH=7), а в растворе AlCl3 — кислой (pH < 7).
Индикаторы (лат. indicator — указатель)
Индикатор — вещество, используемое в химии для определения среды раствора. В зависимости от среды раствора индикатор способен
менять его цвет, что наглядно отражает характер среды в определенный момент времени.
Наиболее известные и широко применяемые индикаторы: лакмус, фенолфталеиновый и метиловый оранжевый. В зависимости от среды
раствора их окраска меняется, что отражает приведенная ниже таблица.

Для тех, кто обладает хорошей зрительной памятью, будет несложно запомнить эту схему. Но что делать аудиалам и кинестетикам? 
От волнения на экзамене такая таблица легко может раствориться и перепутаться в океане мыслей, поэтому своим ученикам я рекомендую
запомнить индикаторы по стихам.
Только представьте, как приятно будет прочитать стих на экзамене, и убедиться в его безошибочности. Это придаст уверенности и поднимет
настроение 
Лакмус
Индикатор лакмус красный
Кислоту укажет ясно.
Индикатор лакмус синий —
Щелочь здесь, не будь разиней!
Когда ж нейтральная среда,
Он фиолетовый всегда.
Фенолфталеин
Фенолфталеиновый
В щелочах малиновый
Несмотря на это —
В кислотах он без цвета.
Метиловый оранжевый
От щелочи я желт как в лихорадке
Я розовею от кислот, как от стыда
И я бросаюсь в воду без оглядки —
Здесь я оранжевый практически всегда!

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Гидролиз солей, теория ЕГЭ по химии
- 11.04.2016
Замечательный теоретический материал по химии, который адаптирован под тему «Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная».
В 2016 году в ЕГЭ по химии это было задание №30.
В начале документа приведена теоретическая база, необходимая для успешного решения заданий этого типа, а затем даны практические заданий (с правильными ответами), на которых вы сможете поупражняться и обрести навык решения заданий такого типа.
Смотреть в PDF:
Или прямо сейчас: cкачать в pdf файле.
Видеоурок: Гидролиз солей
Лекция: Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная

Мы продолжаем изучать закономерности протекания химических реакций. При изучении темы 1.4.5 Электролитическая диссоциация электролитов в водных растворах вы узнали, что при электролитической диссоциации в водном растворе частицы, участвующих в реакции веществ растворяются в воде. Это гидролиз. Ему подвергаются различные неорганические и органические вещества, в частности, соли. Без понимания процесса гидролиза солей, вы не сможете объяснить явления, происходящие в живых организмах.
Сущность гидролиза солей сводится к обменному процессу взаимодействия ионов (катионов и анионов) соли с молекулами воды. В результате образуется слабый электролит – малодиссоциирующее соединение. В водном растворе появляется избыток свободных ионов Н+ или ОН—. Вспомните, диссоциация каких электролитов образует ионы Н+ , а каких ОН—. Как вы догадались, в первом случае мы имеем дело с кислотой, значит водная среда с ионами Н+ будет кислой. Во втором же случае, щелочной. В самой воде среда нейтральная, поскольку она незначительно диссоциируется на одинаковые по концентрации ионы Н+ и ОН—.
Характер среды можно определить с помощью индикаторов. Фенолфталеин обнаруживает щелочную среду и окрашивает раствор в малиновый цвет. Лакмус под действием кислоты становится красным, а под действием щелочи остается синим. Метилоранж — оранжевый, в щелочной среде становится желтым, в кислой среде – розовым. Тип гидролиза зависит от типа соли.

Итак, любую соль представляет собой можно взаимодействие кислоты и основания, которые, как вы поняли, бывают сильными и слабыми. Сильные – это те, чья степень диссоциации α близка к 100%. Следует запомнить, что сернистую (H2SO3) и фосфорную (H3PO4) кислоту чаще относят к кислотам средней силы. При решении задач по гидролизу, данные кислоты необходимо относить к слабым.
Кислоты:
-
Сильные: HCl; HBr; Hl; HNO3; HClO4; H2SO4. Их кислотные остатки с водой не взаимодействуют.
-
Слабые: HF; H2CO3; H2SiO3; H2S; HNO2; H2SO3; H3PO4; органические кислоты. А их кислотные остатки взаимодействуют с водой, забирая у её молекул катионы водорода H+.
Основания:
-
Сильные: растворимые гидроксиды металлов; Ca(OH)2; Sr(OH)2. Их катионы металлов с водой не взаимодействуют.
-
Слабые: нерастворимые гидроксиды металлов; гидроксид аммония (NH4OH). А катионы металлов здесь взаимодействуют с водой.
Исходя из данного материала, рассмотрим типы солей:
-
Соли с сильным основанием и сильной кислотой. К примеру: Ba (NO3)2, KCl, Li2SO4. Особенности: не взаимодействуют с водой, а значит гидролизу не подвергаются. Растворы таких солей имеют нейтральную реакцию среды.
-
Соли с сильным основанием и слабой кислотой. К примеру: NaF, K2CO3, Li2S. Особенности: с водой взаимодействуют кислотные остатки этих солей, происходит гидролиз по аниону. Среда водных растворов — щелочная.
-
Соли со слабым основанием и сильной кислотой. К примеру: Zn(NO3)2, Fe2(SO4)3, CuSO4. Особенности: с водой взаимодействуют только катионы металлов, происходит гидролиз по катиону. Среда — кислая.
-
Соли со слабым основанием и слабой кислотой. К примеру: CH3COONН4, (NН4)2CО3, HCOONН4. Особенности: с водой взаимодействуют как катионы, так и анионы кислотных остатков, гидролиз происходит по катиону и аниону.
Пример гидролиза по катиону и образования кислой среды:
-
Гидролиз хлорида железа FeCl2
FeCl2 + H2O ↔ Fe(OH)Cl + HCl (молекулярное уравнение)
Fe2+ + 2Cl— + H+ + OH— ↔ FeOH+ + 2Cl— + Н+ (полное ионное уравнение)
Fe2+ + H2O ↔ FeOH+ + Н+ (сокращенное ионное уравнение)
Пример гидролиза по аниону и образования щелочной среды:
-
Гидролиз ацетата натрия CH3COONa
CH3COONa + H2O ↔ CH3COOH + NaOH (молекулярное уравнение)
Na+ + CH3COO— + H2O ↔ Na+ + CH3COOH + OH— (полное ионное уравнение)
CH3COO— + H2O ↔ CH3COOH + OH— (сокращенное ионное уравнение)
Пример совместного гидролиза:
- Гидролиз сульфида алюминия Al2S3
Al2S3 + 6H2O ↔ 2Al(OH)3↓+ 3H2S↑
В данном случае мы видим полный гидролиз, который происходит, если соль образована слабым нерастворимым или летучим основанием и слабой нерастворимой или летучей кислотой. В таблице растворимости стоят прочерки на таких солях. Если в ходе реакции ионного обмена образуется соль, которая не существует в водном растворе, то надо написать реакцию этой соли с водой.
Например:
2FeCl3 + 3Na2CO3 ↔ Fe2(CO3)3 + 6NaCl
Fe2(CO3)3 + 6H2O ↔ 2Fe(OH)3 + 3H2O + 3CO2
Складываем эти два уравнения, то что повторяется в левой и правой частях, сокращаем:
2FeCl3 + 3Na2CO3 + 3H2O ↔ 6NaCl + 2Fe(OH)3↓ + 3CO2↑
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
ГИДРОЛИЗ
взаимодействие
ионов соли с водой, в результате которого образуются слабые электролиты.
В зависимости от силы исходной кислоты и исходного основания, гидролиз можно разделить на 4 типа.
СОЛЬ ОБРАЗОВАНА СИЛЬНЫМ ОСНОВАНИЕМ И СЛАБОЙ КИСЛОТОЙ.
ГИДРОЛИЗ ИДЕТ ПО АНИОНУ.
Анион связывает катион водорода, образуя слабый электролит.
Среда раствора щелочная, рН > 7, лакмус окрашивается в растворе этой соли в синий цвет, фенолфталеин в малиновый.
2
СОЛЬ ОБРАЗОВАНА СЛАБЫМ ОСНОВАНИЕМ И СИЛЬНОЙ КИСЛОТОЙ.
ГИДРОЛИЗ ИДЕТ ПО КАТИОНУ.
Катион связывает гидроксид-ион, образуя слабый электролит:
Среда раствора кислая, рН < 7, лакмус окрашивается в растворе этой соли в красный цвет, метилоранж в красный.
3
СОЛЬ ОБРАЗОВАНА СЛАБЫМ ОСНОВАНИЕМ И СЛАБОЙ КИСЛОТОЙ. ГИДРОЛИЗ ИДЕТ И ПО КАТИОНУ, И ПО АНИОНУ.
Катион связывает гидроксид-ион, а анион – катион водорода. Среда раствора — нейтральная, слабощелочная и слабокислая
Это зависит от констант диссоциации слабой кислоты и слабого основания, которые образуются в результате гидролиза.
ПОДВЕРГАЮТСЯ НЕОБРАТИМОМУ (ПОЛНОМУ) ГИДРОЛИЗУ
Такие соли не могут существовать в водных растворах, они полностью разлагаются водой, что отмечается в таблице растворимости солей черточкой.
Гидролиз в этих случаях необратим. Ионные уравнения необратимого гидролиза не записывают.
При взаимодействии водных растворов двух солей не всегда образуются две новые соли. Это объясняется тем, что одна из новых солей полностью гидролизуется с образованием нерастворимого слабого основания и слабой (или летучей) кислоты.
4
СОЛЬ ОБРАЗОВАНА СИЛЬНЫМ ОСНОВАНИЕМ И СИЛЬНОЙ КИСЛОТОЙ.
ГИДРОЛИЗУ НЕ ПОДВЕРГАЮТСЯ.
Катионы и анионы этих солей не связываются с ионами Н+ и ОН– воды, то есть не образует с ними молекул слабых электролитов.
Равновесие диссоциации воды не смещается. Среда растворов этих солей нейтральная, рН = 7,0
ГИДРОЛИЗ СОЕДИНЕНИЙ, НЕ ОТНОСЯЩИХСЯ К СОЛЯМ.
1) БИНАРНЫЕ СОЕДИНЕНИЯ МЕТАЛЛОВ: ФОСФИДЫ, НИТРИДЫ, ГИДРИДЫ, КАРБИДЫ.
При их гидролизе образуется гидроксид металла и водородное соединение неметалла, а из гидрида – водород.
б) карбиды:
карбиды при гидролизе могут образовывать метан (карбид алюминия, бериллия) или ацетилен (карбиды кальция, щелочных металлов):
в) остальные бинарные соединения:
нитриды → аммиак,
фосфиды → фосфин,
силициды → силан.
2) ГАЛОГЕНАНГИДРИДЫ КИСЛОТ.
Галогенангидрид – это соединение, которое получается, если в кислоте ОН-группу заменить на галоген.
Пример:
COCl2 – хлорангидрид угольной кислоты (фосген), которую можно записать как СО(ОН)2
При гидролизе галогенангидридов, а также соединений неметаллов с галогенами — образуются две кислоты.
3. ВЗАИМНЫЙ ГИДРОЛИЗ ДВУХ СОЛЕЙ.
Происходит при попытке получить с помощью обменной реакции солей, которые в водном растворе полностью гидролизованы. При этом происходит взаимный гидролиз – т.е. катион металла связывает ОН-группы, а анион кислоты – Н+
а) Соли металлов со степенью окисления +3 и соли летучих кислот (карбонаты, сульфиды, сульфиты) при их взаимном гидролизе образуется осадок гидроксида и газ:
б) Соли металлов со степенью окисления +2 (кроме кальция, стронция и бария) и растворимые карбонаты также вместе гидролизуются, но при этом образуется осадок ОСНОВНОГО КАРБОНАТА металла:
АЛГОРИТМ НАПИСАНИЯ УРАВНЕНИЙ ГИДРОЛИЗА.
1. Определяем тип гидролиза.
2. Пишут уравнение диссоциации соли.
Как в “правиле цепочки”: цепочка рвется по слабому звену, гидролиз идет по иону слабого электролита.
Пример
Гидролиз сульфата меди(II):
Соль образована катионом слабого основания (подчеркиваем) и анионом сильной кислоты.
Гидролиз по катиону.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА СТЕПЕНЬ ГИДРОЛИЗА.
Гидролиз обратимая реакция, на состояние равновесия гидролиза влияют: температура, концентрации участников реакции, добавки посторонних веществ, давление (если есть газоообразные вещества).
Исключается из рассмотрения вода, так как ее концентрация в водных растворах практически постоянна (~55 моль/л).
Реакция гидролиза эндотермическая → повышение температуры смещает равновесие в системе вправо.
СТЕПЕНЬ ГИДРОЛИЗА ВОЗРАСТАЕТ.
2. КОНЦЕНТРАЦИЯ ПРОДУКТОВ ГИДРОЛИЗА.
В соответствии с принципом Ле Шателье, повышение концентрации продуктов приведет к смещению равновесия влево.
СТЕПЕНЬ ГИДРОЛИЗА БУДЕТ УМЕНЬШАТЬСЯ.
Уменьшение концентрации всех частиц в растворе (не считая воды). В соответствии с принципом Ле Шателье, такое воздействие приводит к смещению равновесия в сторону реакции, идущей с увеличением числа частиц.
Реакция гидролиза протекает (без учета воды!) с увеличением числа частиц. Следовательно, при разбавлении равновесие смещается в сторону протекания этой реакции, вправо.
СТЕПЕНЬ ГИДРОЛИЗА ВОЗРАСТАЕТ.
4. ДОБАВКИ ПОСТОРОННИХ ВЕЩЕСТВ
могут влиять на положение равновесия в том случае, когда эти вещества реагируют с одним из участников реакции.
ХАРАКТЕРИСТИКА ПРОЦЕССА ГИДРОЛИЗА:
1) Процесс гидролиза является обратимым, протекает не до конца, а только до момента РАВНОВЕСИЯ;
2) Процесс гидролиза – обратный для реакции НЕЙТРАЛИЗАЦИИ, следовательно, гидролиз — эндотермический процесс (протекает с поглощением теплоты).
КАК УСИЛИТЬ ПРОЦЕСС ГИДРОЛИЗА
Нагревание – при увеличении температуры равновесие смещается в сторону ЭНДОТЕРМИЧЕСКОЙ реакции – гидролиз усиливается;
Добавление воды – т.к. вода является исходным веществом в реакции гидролиза, то разбавление раствора усиливает гидролиз.
КАК ПОДАВИТЬ (ОСЛАБИТЬ) ПРОЦЕСС ГИДРОЛИЗА
Раствор делают максимально концентрированным (уменьшают количество воды);
Для смещения равновесия влево добавляют один из продуктов гидролиза :
Пример:
КАК ПОДАВИТЬ ГИДРОЛИЗ ХЛОРИДА АЛЮМИНИЯ?
Хлорид алюминия AlCl3 – это соль, образованная слабым основанием и сильной кислотой – гидролизуется по катиону:
Среда – кислая.
Следовательно, для подавления гидролиза необходимо добавить еще кислоты.
Кроме того, следует сделать раствор наиболее концентрированным.
30(П) Тесты ЕГЭ ФИПИ 2015 к теме «Гидролиз расплавов и растворов солей»






![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)














