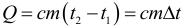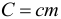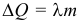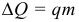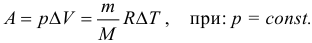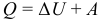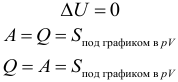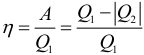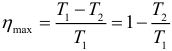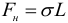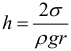в условии
в решении
в тексте к заданию
в атрибутах
Категория:
Атрибут:
Всего: 358 1–20 | 21–40 | 41–60 | 61–80 | 81–100 …
Добавить в вариант
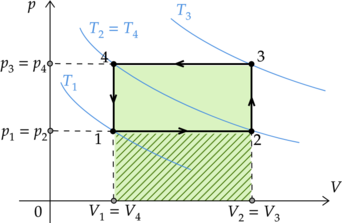
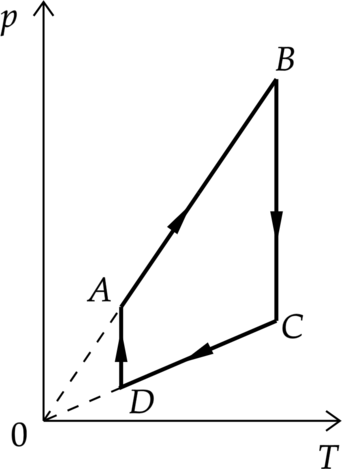
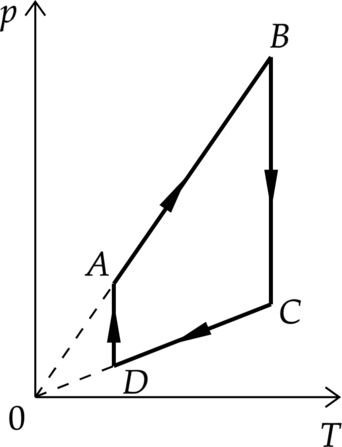
На графиках А и Б приведены диаграммы p−T и p−V для процессов 1−2 и 3−4 (гипербола), проводимых с 1 моль гелия. На диаграммах p – давление, V – объём и T – абсолютная температура газа. Установите соответствие между графиками и утверждениями, характеризующими изображённые на графиках процессы. К каждой позиции первого столбца подберите соответствующую позицию второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
ГРАФИКИ
А)
Б)
УТВЕРЖДЕНИЯ
1) Над газом совершают работу, при этом газ отдаёт положительное количество теплоты.
2) Газ получает положительное количество теплоты, при этом его внутренняя энергия не изменяется.
3) Над газом совершают работу, при этом его внутренняя энергия увеличивается.
4) Газ получает положительное количество теплоты, при этом его внутренняя энергия увеличивается.
Источник: ЕГЭ по физике 2017. Досрочная волна. Вариант 101
В цилиндр с подвижным поршнем накачали ν = 4 моля идеального одноатомного газа при температуре t1 = 70 °C. Накачивание вели так, что давление газа было постоянным. Затем накачку прекратили и дали газу в цилиндре расшириться без теплообмена с окружающей средой до давления p = 1 атм. При этом газ остыл до температуры t2 = 30 °C. Какую суммарную работу совершил газ в этих двух процессах? В исходном состоянии цилиндр был пуст и поршень касался дна.
На рисунке показан график зависимости модуля среднеквадратичной скорости Vср.кв. атомов одноатомного идеального газа от объёма V газа в некотором процессе 1→2. Количество атомов газа в течение этого процесса не изменяется.
На основании анализа представленного графика выберите все верные утверждения.
1) В процессе 1→2 газ совершает положительную работу.
2) В процессе 1→2 внутренняя энергия газа уменьшается.
3) В процессе 1→2 давление p газа возрастает прямо пропорционально объёму V газа.
4) В процессе 1→2 газ отдаёт некоторое количество теплоты окружающим телам.
5) Процесс 1→2 является изобарическим.
В вертикальном цилиндре, закрытом лёгким поршнем, находится этиловый спирт при температуре кипения t = 78 °C. При сообщении спирту количества теплоты Q часть его превращается в пар, который при изобарном расширении совершает работу A. Удельная теплота парообразования спирта L = 846 · 103 Дж/кг, а его молярная масса — 46 · 10-3 кг/моль. Какая часть подведённого к этиловому спирту количества теплоты переходит в работу? Объёмом жидкого этилового спирта пренебречь.
Источник: ЕГЭ по физике 13.07.2020. Основная волна. ЦФО. Часть C. Вариант 1
В вертикальном цилиндре, закрытом лёгким поршнем, находится ацетон при температуре кипения t = 56 °C. При сообщении ацетону количества теплоты Q часть его превращается в пар, который при изобарном расширении совершает механическую работу A. Удельная теплота парообразования ацетона L = 524 · 103 Дж/кг, а его молярная масса M = 58 · 10-3 кг/моль. Какая часть подведённого к ацетону количества теплоты идёт на увеличение внутренней энергии системы? Объёмом жидкого ацетона пренебречь.
Источник: ЕГЭ по физике 13.07.2020. Основная волна. ПФО (Самара). Часть C
В цилиндрическом сосуде, закрытом подвижным поршнем, находится водяной пар и капля воды. С паром в сосуде при постоянной температуре провели процесс a→b→c, pV−диаграмма которого представлена на рисунке. Из приведённого ниже списка выберите все правильные утверждения относительно проведённого процесса.
1) На участке b→c масса пара уменьшается.
2) На участке a→b к веществу в сосуде подводится положительное количество теплоты.
3) В точке с водяной пар является насыщенным.
4) На участке a→b внутренняя энергия капли уменьшается.
5) На участке b→c внутренняя энергия пара уменьшается.
Источник: Демонстрационная версия ЕГЭ—2021 по физике
Два моля идеального одноатомного газа совершают циклический процесс, изображённый на диаграмме (см. рис.). Температура газа в состоянии 2 равна 2000 К. Какое количество теплоты получает газ на участке 2−3 этого циклического процесса? Ответ выразите в килоджоулях и округлите до целого числа.
В некотором процессе 1−2 внешние силы совершили над неизменным количеством идеального газа положительную работу 120 Дж. Внутренняя энергия газа в этом процессе изменилась на 100 Дж.
Из приведённого ниже списка выберите все правильные утверждения относительно проведённого процесса.
1) В результате этого процесса газ отдал количество теплоты окружающим телам ().
2) В результате этого процесса температура газа могла только повыситься.
3) Этот процесс представляет собой замкнутый цикл.
4) Объём газа в этом процессе уменьшился.
5) Объём газа в этом процессе увеличился.
Идеальный одноатомный газ занимал объём 4 л при давлении 300 кПа. Затем газ расширился и стал занимать объём 6 л при давлении 150 кПа. В этом процессе газ совершил работу 550 Дж. Какое количество теплоты получил газ в этом процессе, если масса газа в сосуде неизменна?
В ходе адиабатного процесса идеальный одноатомный газ совершил работу 2493 Дж. В результате температура газа понизилась на 50 °C. Найдите количество вещества этого газа. Ответ запишите в молях.
На рисунке показан циклический процесс изменения состояния 1 моль одноатомного идеального газа. На каком участке цикла изменение внутренней энергии газа равно полученному газом количеству теплоты?
Источник: Демонстрационная версия ЕГЭ—2022 по физике
В ходе некоторого процесса температура 1 моля гелия повышается на 200 К.
В этом процессе удельная теплоёмкость гелия постоянна и равна 4991,3 Дж/(кг · °C). Какую работу совершает гелий в этом процессе?
Ответ выразите в Дж и округлите до целого числа.
Идеальный газ получил количество теплоты 300 Дж и совершил работу 100 Дж. Чему равно изменение внутренней энергии газа? Ответ дайте в джоулях.
Идеальный газ получил количество теплоты 300 Дж и при этом внутренняя энергия газа увеличилась на 100 Дж. Какова работа, совершенная газом? (Ответ дать в джоулях.)
Идеальный газ отдал количество теплоты 300 Дж и при этом внутренняя энергия газа увеличилась на 100 Дж. Какова работа, совершенная газом? (Ответ дать в джоулях.)
Идеальный газ отдал количество теплоты 300 Дж и при этом внутренняя энергия газа уменьшилась на 100 Дж. Какова работа, совершенная газом? (Ответ дайте в джоулях.)
Идеальный газ получил количество теплоты 100 Дж и при этом внутренняя энергия газа уменьшилась на 100 Дж. Какова работа, совершенная газом? (Ответ дать в джоулях.)
Если идеальный газ получил количество теплоты 100 Дж, и при этом внутренняя энергия газа увеличилась на 100 Дж, то какую работу совершил газ в этом процессе? (Ответ дайте в джоулях.)
Если идеальный газ отдал количество теплоты 100 Дж и при этом внутренняя энергия газа уменьшилась на 100 Дж, то какова работа, совершенная газом? (Ответ дайте в джоулях.)
Всего: 358 1–20 | 21–40 | 41–60 | 61–80 | 81–100 …
Изопроцессы в МКТ — это процессы, протекающие в газах с каким-нибудь неизменным параметром. Для начала мы рассмотрим газ, у которого постоянная масса и химический состав. То есть в газе не меняется количество вещества ν . В этом случае мы можем упростить уравнение Менделеева-Клайперона.
Я не буду углубляться в названия газовых законов, вы это прочтете в учебниках. Займемся чистой математикой
Итак, у нас есть некий газ постоянной массы. Основные характеристики его состояния определяются . То есть, если мы будем на этот газ как-то воздействовать, меняя его характеристики, то
Получается, что все три его характеристики связаны. Но можно рассмотреть случаи, когда один из этих компонентов не меняется. это и будут изопроцессы. Посмотрим, как будут выглядеть графики изопроцессов в осях p(V), p(T), V(T).
Теперь рассмотрим график конкретного циклического процесса, представленного на рисунке в координатах V-T :

ВC: Изохора
CD: Изобара
DA: Изотерма

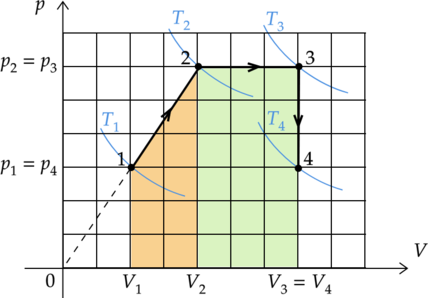
А теперь можно построить этот же циклический процесс на графиках с другими координатами.
Обратите внимание, что значения в эти графики из риунка1 можно перенести только на оси температуры и объема. Значения для давления произвольные, но… ВС — изохора, следовательно, прямая, ей соответствующая, обязательно должна начинаться в нуле в осях Р-Т! В осях P-V изотерма DA — кривая (гипербола)
Разбор некоторых задач →
Задачи с графиками: работа газа и внутренняя энергия
Задачи средней сложности, для решения нужна только внимательность. Никаких «подвохов»- все математически четко и понятно.
Задача 1.
Температура идеального газа в состоянии 1 была . Чему равна температура в состоянии 3 после осуществления процесса 1-2-3, изображенного на диаграмме
?
К.
К задаче 1
Процесс 1-2 – изохорный. Запишем закон Шарля.
Процесс 2-3 – не изотермический, поэтому просто запишем уравнение состояния:
Откуда
Ответ: 1800 К.
Задача 2.
Идеальный одноатомный газ, находящийся при нормальных условиях, переводят из состояния 1 в состояние 2 двумя способами: 1-3-2 и 1-4-2. Найдите отношение количеств теплоты, которые необходимо сообщить 1 кмоль газа в этих двух процессах.
К задаче 2
Рассмотрим переход 1-3-2. Процесс 1-3 – изохора, работа не совершается. Но температура растет, определим, как.
Процесс 3-2 – изобара. Работа в процессе 3-2 равна
Изменение температуры составило . Следовательно, можем определить изменение внутренней энергии:
Теперь найдем общее количество теплоты, переданное газу при таком переходе:
Процесс перехода 1-4-2 отличается только совершенной работой. Определим ее:
Определим отношение количеств теплоты:
Ответ: .
Задача 3.
Идеальный одноатомный газ, взятый в количестве 1 моль, переводят из состояния 1 в состояние 4. Какое количество теплоты сообщили в этом процессе газу? Масса газа во время процесса не меняется.
К задаче 3
Определим сначала изменение внутренней энергии, для этого составим объединенный газовый закон для точек 1 и 4.
Изменение внутренней энергии равно
Теперь определим работу. Работу удобно определить как площадь под кривой процесса. Разобьем эту площадь на удобные «куски» — трапеции.
К задаче 3. Определяем работу
Теперь найдем общее количество теплоты, переданное газу:
Ответ: 1450 Дж.
Задача 4.
На рисунке представлена диаграмма цикла с одноатомным идеальным газом, взятым в количестве 0,3 моль. Участки и
— адиабаты. Определите работу, совершенную газом на участке
.
К задаче 4
Участок по условию – адиабата, то есть передачи тепла газу на этом участке не происходит, следовательно, работа будет совершена за счет «внутренних резервов» — то есть внутренней энергии. Нужно, следовательно, найти, как она изменилась.
Задачу можно решить двумя способами. Во-первых, просто определить температуры в точках и
, это легко сделать из данных графика с помощью уравнения Менделеева-Клапейрона, и затем посчитать
. Но, так как
, а
,то изменение внутренней энергии будет равно
Ответ: 1350 Дж.
Задача 5.
Один моль одноатомного идеального газа расширяется сначала изобарно, а затем по линейному закону, причем прямая линия проходит через начало координат .
. Найдите
, если количество тепла, сообщенное газу на участке 1-2, в 4 раза меньше работы, совершенной на участке 2-3.
К задаче 5
Определим количество тепла, сообщенное газу на участке 1-2, и работу, совершенную на участке 2-3.
Для изобарного процесса 1-2 запишем закон Гей-Люссака:
Откуда
Следовательно, изменение внутренней энергии газа равно
Работа на этом участке равна площади под графиком, под участком 1-2:
Тогда тепло, переданное газу, равно
Теперь рассмотрим процесс 2-3. Нам нужно определить лишь работу газа на этом участке. Площадь под этим участком – трапеция, поэтому
Из подобия треугольников и
запишем:
Тогда
Так как по условию , то
Так как , то
Сократим, что возможно:
Из первой записанной нами формулы (закона Гей-Люссака) следует, что
Тогда
Или
Введем замену :
Понятно, отрицательный корень нас не интересует.
Ответ: .
11. МКТ и Термодинамика (объяснение явлений)
1. Вспоминай формулы по каждой теме
2. Решай новые задачи каждый день
3. Вдумчиво разбирай решения
Термодинамика
На рисунке изображена диаграмма циклического процесса. Выберите из предложенных утверждений два верных:
1) На участке 1–2 внутренняя энергия газа увеличивается.
2) На участке 2–3 газ совершает положительную работу.
3) На участке 3–4 давление газа увеличивается.
4) На участке 2–3 газу сообщили некоторое количество теплоты.
5) Внутренняя энергия газа в состоянии 1 больше, чем внутренняя энергия газа в состоянии 3.
“Досрочная волна 2019 вариант 2”
1) Поскольку на участке 1–2 температура была постоянной, следовательно, внутренняя энергия газа не изменилась.
Утверждение 1 – (color{red}{small text{Неверно}})
2) Поскольку на участке 2–3 объём газа оставался неизменным, следовательно, работа не совершалась.
Утверждение 2 – (color{red}{small text{Неверно}})
3) Поскольку на участке 3–4 температура оставалась постоянной, а объём уменьшился, при этом (pV = const), значит, давление возросло.
Утверждение 3 – (color{green}{small text{Верно}})
4) Поскольку на участке 2–3 объём газа не изменялся, работа не совершалась, но при этом возросла температура, значит, изменение внутренней энергии положительно.
Утверждение 4 – (color{green}{small text{Верно}})
5) Поскольку температура в состоянии 1 меньше, чем в состоянии 3, значит, и внутренняя энергия в состоянии 1 меньше.
Утверждение 5 – (color{red}{small text{Неверно}})
Ответ: 34
На рисунке показан график циклического процесса, проведенного с одноатомным идеальным газом, в координатах (V-T), где (V) — объем газа, (T) — абсолютная температура. Количество вещества газа остается неизменным.
Из приведенного ниже списка выберите два правильных утверждения, характеризующих процессы на графике.
1) Внешние силы в процессе 3-4 совершили над газом большую работу, чем совершил газ в процессе 1-2.
2) Газ за цикл совершает положительную работу.
3) Внутренние энергии газа в состоянии 2 и в состоянии 4 равны.
4) В процссе 4-1 газу было передано положительное количество теплоты.
5) Давление газа в состоянии 3 больше, чем в состоянии 4.
Для более удобной работы перестроим график из координат (V-T) в координаты (p-V):
1) (color{green}{smalltext{Верно }})
Работу газа и работу внешних сил можно найти как площади фигур под графиками этих процессов. По рисунку видно, что площадь под графиком процесса 3-4 больше, чем под графиком процесса 1-2. Значит, работа внешних сил в процессе 3-4 больше, чем работа газа в процессе 1-2.
2) (color{red}{smalltext{Неверно }})
Работа (A_text{ц}), совершенная газом за цикл, равна площади, заключенной внутри кривой 1-2-3-4-1 (только в (pV)-координатах!!!).
Так как объем газа остался неизменным, а его давление уменьшилось, то газ совершил за цикл отрицательную работу.
3) (color{green}{smalltext{Верно }})
Внутренняя энергия газа зависит от его температуры: [U = frac{3}{2}nu RT,] где (nu) — количество вещества газа, (R) — универсальная газовая постоянная.
По графику в (VT)-координатах видно, что (T_2 = T_4). Следовательно, внутренние энергии в состоянии 2 и в состоянии 4 равны.
4) (color{red}{smalltext{Неверно }})
Процесс 4-1 является изохорным (так как (V = const)). Запишем первый закон термодинамики для изохорного процесса: [Q_{4-1} = Delta U_{4-1}] Изменение внутренней энергии газа зависит от изменения его температуры: [Delta U = frac{3}{2}nu RDelta T] По графику видно, что изотерма (T_1) лежит ниже, чем изотерма (T_4). Следовательно, температура газа уменьшается: (Delta T = T_1 — T_4 < 0). Значит, изменение внутренней энергии газа (Delta U_{4-1}) отрицательно. То есть газ не получает теплоту, а отдает ее.
5) (color{red}{smalltext{Неверно }})
По графику в (VT)-координатах видно, что точка 3 и точка 4 лежат на одной изобаре. Следовательно, давление газа в этих состояниях одинаково.
Ответ: 13
В таблице приведена зависимость КПД (eta) идеального цикла Карно от температуры (T_x) его холодильника. Температура нагревателя поддерживается постоянной. [begin{array}{|c|c|c|c|c|c|c|}
hline
T_x,text{ К}& 200& 250& 300& 350& 400& 450\
hline
eta, % &60& 50& 40& 30& 20& 10\
hline
end{array}]
На основании анализа этой таблицы выберите два верных утверждения.
1) КПД цикла убывает при уменьшении температуры холодильника
2) Температура нагревателя равна 1000 К
3) Температура нагревателя равна 500 К
4) При температуре холодильника 0 (^{circ}C) данный цикл будет иметь КПД 100 %
5) При температуре холодильника 150 К данный цикл будет иметь КПД 70 %
1) Из таблицы видно, что при уменьшении температуры холодильника, КПД увеличивается.
Утверждение 1 — (color{red}{smalltext{Неверно }})
2) КПД: [eta=1-dfrac{T_{text{х}}}{ T_{text{н}}}] где (T_text{ х}) — температура холодилньика, (T_text{ н}) — температура нагревателя. Выразим температуру нагревателя [T_{text{н}}=dfrac{T_{text{х}}}{1-eta}=dfrac{200}{1-0,6}=500 text{ К}] Утверждение 2 — (color{red}{smalltext{Неверно }})
3) Утверждение 3 — (color{green}{smalltext{Верно }})
4) КПД 100% будет при температуре 0 К ((-273 ^{circ}C)).
Утверждение 4 — (color{red}{smalltext{Неверно }})
5) КПД: [eta=1-dfrac{T_{text{х}}}{ T_{text{н}}}=1-dfrac{150}{500}=0,7]
Утверждение 5 — (color{green}{smalltext{Верно }})
Ответ: 35
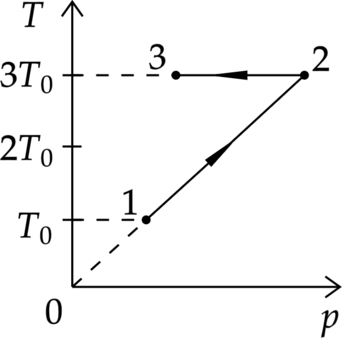
Зависимость температуры 1 моль одноатомного идеального газа от давления показана на рисунке. Выберите из предложенных утверждений два, которые верно отражают результаты этого эксперимента.
1) В процессе 1–2 объём газа увеличился в 3 раза.
2) В процессе 2–3 газ совершал положительную работу.
3) В процессе 2–3 внутренняя энергия газа уменьшалась.
4) В процессе 1–2 газ отдал положительное количество теплоты.
5) В процессе 1–2 концентрация молекул газа не менялась.
“Демоверсия 2019”
1) (color{red}{small text{Неверно}}) В процессе 1–2 объём газа был постоянным. 2) (color{green}{small text{Верно}}) В процессе 2–3 газ расширялся, и значит, совершал положительную работу. (color{red}{small text{Неверно}}) 3) В процессе 2–3 внутренняя энергия газа не изменялась. 4) (color{red}{small text{Неверно}}) В процессе 1–2 газ нагрелся, его внутренняя энергия увеличилась, работа газа была равна нулю, значит, газ получил положительное количество теплоты. 5) (color{green}{small text{Верно}}) В процессе 1–2 объём газа был постоянным, значит, и концентрация молекул газа не менялась.
Ответ: 25
На рисунке показан график циклического процесса, проведённого с одноатомным идеальным газом, в координатах р–Т, где р — давление газа, Т — абсолютная температура газа. Количество вещества газа постоянно.
Из приведённого ниже списка выберите два правильных утверждения по поводу этой ситуации.
1) Газ за цикл совершает положительную работу.
2) В процессе (AB) газ получает положительное количество теплоты.
3) В процессе (BC) внутренняя энергия газа уменьшается.
4) В процессе (CD) над газом совершают работу внешние силы.
5) В процессе (DA) газ изотермически расширяется.
“Основная волна 2020 ”
1) Процессы (AB) и (CD) являются изохорными, работа на этих участках не совершается. Процесс (BC) – изотермическое расширение, процесс (DA) – изотермическое сжатие. Поскольку расширение идёт при большей температуре, а границы изменения объёма в этих процессах одинаковы, то совершаемая газом работа в процессе (BC) больше, чем совершаемая над газом работа в процессе (DA). Таким образом, газ за цикл совершает положительную работу.
Утверждение 1 – (color{green}{small text{Верно}})
2) В процессе (AB) температура газа и его внутренняя энергия увеличиваются, работу газ не совершает, значит, он получает положительное количество теплоты.
Утверждение 2 – (color{green}{small text{Верно}})
3) В процессе (BC) температура и внутренняя энергия газа не изменяются.
Утверждение 3 – (color{red}{small text{Неверно}})
4) В процессе (CD) работа не совершается.
Утверждение 4 – (color{red}{small text{Неверно}})
5) В процессе (DA) газ изотермически сжимается.
Утверждение 5 – (color{red}{small text{Неверно}})
Ответ: 12
На рисунке показан график циклического процесса, проведённого с одноатомным идеальным газом, в координатах (р—Т), где (р) – давление газа, (Т) – абсолютная температура газа. Количество вещества газа постоянно. Из приведённого ниже списка выберите два правильных утверждения, характеризующих процессы на графике.
1) Газ за цикл совершает положительную работу.
2) В процессе (AB) газ получает положительное количество теплоты.
3) В процессе (BC) внутренняя энергия газа уменьшается.
4) В процессе (CD) над газом совершают работу внешние силы.
5) В процессе (DA) газ изотермически расширяется.
“Демоверсия 2018”
1) Процессы (AB) и (CD) являются изохорными, работа на этих участках не совершается. Процесс (BC) – изотермическое расширение, процесс (DA) – изотермическое сжатие. Поскольку расширение идёт при большей температуре, а границы изменения объёма в этих процессах одинаковы, то совершаемая газом работа в процессе (BC) больше, чем совершаемая над газом работа в процессе (DA). Таким образом, газ за цикл совершает положительную работу.
Утверждение 1 – (color{green}{small text{Верно}})
2) В процессе (AB) температура газа и его внутренняя энергия увеличиваются, работу газ не совершает, значит, он получает положительное количество теплоты.
Утверждение 2 – (color{green}{small text{Верно}})
3) В процессе (BC) температура и внутренняя энергия газа не изменяются.
Утверждение 3 – (color{red}{small text{Неверно}})
4) В процессе (CD) работа не совершается.
Утверждение 4 – (color{red}{small text{Неверно}})
5) В процессе (DA) газ изотермически сжимается.
Утверждение 5 – (color{red}{small text{Неверно}})
Ответ: 12
На (pV)-диаграмме изображен процесс перехода одноатомного идеального газа из состояния 1 в состояние 4. Количество вещества газа постоянно.
Из приведенного ниже списка выберите два правильных утверждения, характеризующих процессы на графике.
1) Внутренняя энергия газа в состоянии 2 минимальна.
2) В процессе 3-4 газ получает положительное количество теплоты.
3) Температура газа в состоянии 2 и в состоянии 4 одинакова.
4) Работа, совершенная газом в процессе 2-3, в 2 раза больше работы, совершенной в процессе 1-2.
5) В процессе 3-4 работа внешних сил над газом равна нулю.
1) (color{red}{smalltext{Неверно }})
Внутренняя энергия газа зависит от его температуры: [U = frac{3}{2}nu RT,] где (nu) — количество вещества газа, (R) — универсальная газовая постоянная.
Мысленно проведем изотермы (T_1), (T_2), (T_3) и (T_4). Изотерма (T_2) лежит ”выше” изотермы (T_1). Следовательно, температура газа в состоянии 2 не минимальна: (T_2 > T_1)
2) (color{red}{smalltext{Неверно }})
Процесс 3-4 является изохорным (так как (V = const)). Запишем первый закон термодинамики для изохорного процесса: [Q_{3-4} = Delta U_{3-4}] По рисунку видно, что изотерма (T_4) лежит ”ниже” изотермы (T_3). Следовательно, температура газа уменьшается: (Delta T = T_4 — T_3 < 0). Значит, изменение внутренней энергии (Delta U_{3-4}) отрицательно, и газ не получает положительное количество теплоты, а отдает его.
3) (color{red}{smalltext{Неверно }})
Исходя из обобщенного газового закона, найдем, как соотносится температура (T_4) с температурой (T_2): [frac{p_2V_2}{T_2} = frac{p_3V_3}{T_3} Rightarrow frac{6cdot4}{T_2} = frac{6cdot7}{T_3} Rightarrow T_3 = frac{7}{4}T_2] [frac{p_3V_3}{T_3} = frac{p_4V_4}{T_4} Rightarrow frac{6cdot7}{T_3} = frac{3cdot7}{T_4} Rightarrow T_4 = frac{T_3}{2} Rightarrow T_4 = frac{frac{7}{4}T_2}{2} = frac{7}{8}T_2] [T_4 = frac{7}{8}T_2 neq T_2]
4) (color{green}{smalltext{Верно }})
Работу газа можно вычислить как площадь под графиком процесса (процесс 2-3 — как площадь прямоугольника, процесс 1-2 — как площадь трапеции). [A’_{2-3} = S_{2-3} = 3cdot 6 = 18] [A’_{1-2} = S_{1-2} = frac{3+6}{2}cdot2 = 9] Найдем отношение этих работ: (displaystyle{frac{A’_{2-3}}{A’_{1-2}} = frac{18}{9} = 2})
5) (color{green}{smalltext{Верно }})
Работа газа зависит от изменения его объема: (A’ =pDelta V) По графику видно, что объем газа в процессе 3-4 постоянен. Следовательно, работа газа равна нулю. Следовательно, и работа внешних сил равна нулю: (A_{3-4} = -A’_{3-4} = 0)
Ответ: 45

Курс Глицин. Любовь, друзья, спорт и подготовка к ЕГЭ
Курс Глицин. Любовь, друзья, спорт и подготовка к ЕГЭ
Оглавление:
- Основные теоретические сведения
- Теплоемкость вещества
- Фазовые превращения
- Уравнение теплового баланса
- Работа идеального газа
- Внутренняя энергия
- Первый закон термодинамики
- Первое начало термодинамики и изопроцессы
- Циклы. Тепловые машины
- Второе начало термодинамики
- Рекомендации к решению сложных задач по термодинамике
- Расчет КПД циклов по графику
- Свойства паров. Влажность
- Поверхностное натяжение
Основные теоретические сведения
Теплоемкость вещества
К оглавлению…
Если в результате теплообмена телу передается некоторое количество теплоты, то внутренняя энергия тела и его температура изменяются. Количество теплоты Q, необходимое для нагревания 1 кг вещества на 1 К называют удельной теплоемкостью вещества c. Тогда количество теплоты (энергии) необходимое для изменения температуры некоторого тела массой m можно рассчитать по формуле:
При этом в этой формуле абсолютно не важно в каких единицах подставлена температура, так как нам важно не ее абсолютное значение, а изменение. Единица измерения удельной теплоемкости вещества: Дж/(кг∙К).
- Если t2 > t1, то Q > 0 – тело нагревается (получает тепло).
- Если t2 < t1, то Q < 0 – тело охлаждается (отдает тепло).
Произведение массы тела на удельную теплоемкость вещества, из которого оно изготовлено называется теплоемкостью тела (т.е. просто теплоемкостью без слова «удельная»):
Если в условии задачи сказано про теплоемкость тела, то количество теплоты, отданное или полученное этим телом, можно рассчитать по формуле:
Итак, запомните:
- Удельная теплоемкость обозначается маленькой буквой с, и является характеристикой вещества.
- (Просто) Теплоемкость обозначается большой буквой С, и является характеристикой данного тела.
Напомним, что количество теплоты Q отданное каким–либо источником (нагревателем) рассчитывается по формуле: Q = Pt, где: P – мощность источника, t – время, в течение которого источник отдавал тепло. При решении задач не путайте время работы источника и температуру.
Фазовые превращения
К оглавлению…
Фазой вещества называется однородная система, например, твердое тело, физические свойства которой во всех точках одинаковые. Между различными фазами вещества при обычных условиях существует четко выраженная граница (поверхность) раздела. При изменении внешних условий (температуры, давления, электрических и магнитных полей) вещество может переходить из одной фазы в другую. Такие процессы называются фазовыми превращениями (переходами).
Процесс фазового перехода из жидкого состояния в газообразное (парообразование) или из твердого в жидкое (плавление) может происходить только при сообщении веществу некоторого количества теплоты. Обратные фазовые переходы (конденсация и кристаллизация, или отвердевание) сопровождаются выделением такого же количества теплоты.
Количество теплоты, поступающее в систему или выделяющееся из нее, изменяет ее внутреннюю энергию. Это означает, что внутренняя энергия пара при 100°С больше, чем жидкости при той же температуре. Указанные фазовые переходы идут при постоянных температурах, которые называются соответственно температурой кипения и температурой плавления. Количество теплоты, необходимое для превращения жидкости в пар или выделяемое паром при конденсации, называется теплотой парообразования:
где: r – удельная теплота парообразования. Единица измерения [r] = 1 Дж/кг. Физический смысл удельной теплоты парообразования: она равна количеству теплоты, необходимому для превращения в пар 1 кг жидкости, находящейся при температуре кипения. Превращение жидкости в пар не требует доведение жидкости до кипения. Вода может превратиться в пар и при комнатной температуре. Такой процесс называется испарением.
Количество теплоты, необходимое для плавления тела или выделяемое при кристаллизации (отвердевании), называется теплотой плавления:
где: λ – удельная теплота плавления. Единица измерения [λ] = 1 Дж/кг. Физический смысл удельной теплоты плавления: теплота, необходимая для плавления 1 кг вещества, находящегося при температуре плавления. Удельные теплоты парообразования и плавления называются также скрытыми теплотами, поскольку при фазовых переходах температура системы не меняется, несмотря на то, что теплота к ней подводится.
Обратите внимание: что во время фазовых переходов температура системы не изменяется. А также на то, что сами фазовые переходы начинаются только после достижения необходимой температуры.
Наиболее распространенным источником энергии для нужд человека является топливо – вещество, при сгорании которого выделяется некоторое количество теплоты. Количество теплоты, выделяемое при сгорании топлива массой m, называется теплотой сгорания топлива:
где: q – удельная теплота сгорания (теплотворная способность, калорийность) топлива. Единица измерения [q] = 1 Дж/кг. Физический смысл удельной теплоты сгорания топлива: величина, показывающая, какое количество теплоты выделяется при полном сгорании 1 кг топлива.
Уравнение теплового баланса
К оглавлению…
В соответствии с законом сохранения энергии для замкнутой системы тел, в которой не происходит никаких превращений энергии, кроме теплообмена, количество теплоты, отдаваемое более нагретыми телами, равно количеству теплоты, получаемому более холодными. Теплообмен прекращается в состоянии термодинамического равновесия, т.е. когда температура всех тел системы становится одинаковой. Сформулируем уравнение теплового баланса: в замкнутой системе тел алгебраическая сумма количеств теплоты, отданных и полученных всеми телами, участвующими в теплообмене, равна нулю:
При использовании такой формы записи уравнения теплового баланса, чтобы не сделать ошибку, запомните: когда Вы будете считать теплоту при нагревании или охлаждении тела, нужно из большей температуры вычитать меньшую, чтобы теплота всегда была положительной. Если все теплоты записывать с учетом знака, где «+» соответствует получению энергии телом, а «–» выделению, то уравнение теплового баланса можно записать в виде:
При использовании такой формы записи, нужно всегда от конечной температуры отнимать начальную. При таком подходе знак их разности сам «покажет» отдаёт тело теплоту или получает.
Запомните, что тело поглощает теплоту если происходит:
- Нагревание,
- Плавление,
- Парообразование.
Тело отдает теплоту если происходит:
- Охлаждение,
- Кристаллизация,
- Конденсация,
- Сгорание топлива.
Именно в этой теме, имеет смысл не решать задачи в общем виде, а сразу подставлять числа.
Взаимные превращения механической и внутренней энергии
При неупругих ударах механическая энергия частично или полностью переходит во внутреннюю энергию тел, то есть тела могут нагреваться и плавится. В общем случае изменение механической энергии равно выделяющемуся количеству теплоты.
Работа идеального газа
К оглавлению…
Термодинамика – это наука о тепловых явлениях. В противоположность молекулярно–кинетической теории, которая делает выводы на основе представлений о молекулярном строении вещества, термодинамика исходит из наиболее общих закономерностей тепловых процессов и свойств макроскопических систем. Выводы термодинамики опираются на совокупность опытных фактов и не зависят от наших знаний о внутреннем устройстве вещества, хотя в целом ряде случаев термодинамика использует молекулярно–кинетические модели для иллюстрации своих выводов.
Термодинамика рассматривает изолированные системы тел, находящиеся в состоянии термодинамического равновесия. Это означает, что в таких системах прекратились все наблюдаемые макроскопические процессы. Важным свойством термодинамически равновесной системы является выравнивание температуры всех ее частей.
Если термодинамическая система была подвержена внешнему воздействию, то в конечном итоге она перейдет в другое равновесное состояние. Такой переход называется термодинамическим процессом. Если процесс протекает достаточно медленно (в пределе бесконечно медленно), то система в каждый момент времени оказывается близкой к равновесному состоянию. Процессы, состоящие из последовательности равновесных состояний, называются квазистатическими (или квазистационарными, еще одно название таких процессов — равновесные).
В изобарном процессе работу идеального газа можно рассчитывать по формулам:
Подчеркнем еще раз: работу газа по расширению можно считать по этим формулам только если давление постоянно. Согласно данной формуле, при расширении газ совершает положительную работу, а при сжатии – отрицательную (т.е. газ сопротивляется сжатию и над ним нужно совершать работу чтобы оно состоялось).
Если давление нельзя считать постоянным, то работу газа находят, как площадь фигуры под графиком в координатах (p, V). Очевидно, что в изохорном процессе работа газа равна нулю.
Ввиду того, что работа газа численно равна площади под графиком, становится понятно, что величина работы зависит от того, какой именно процесс происходил, ведь у каждого процесса свой график, а под ним своя площадь. Таким образом, работа зависит не только и не столько от начального и конечного состояний газа, сколько от процесса, с помощью которого конечное состояние было достигнуто.
Внутренняя энергия
К оглавлению…
Одним из важнейших понятий термодинамики является внутренняя энергия тела. Все макроскопические тела обладают энергией, заключенной внутри самих тел. С точки зрения молекулярно–кинетической теории внутренняя энергия вещества складывается из кинетической энергии всех атомов и молекул и потенциальной энергии их взаимодействия друг с другом. В частности, внутренняя энергия идеального газа равна сумме кинетических энергий всех частиц газа, находящихся в непрерывном и беспорядочном тепловом движении. Внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема. Внутренняя энергия одноатомного идеального газа рассчитывается по формулам:
Таким образом, внутренняя энергия U тела однозначно определяется макроскопическими параметрами, характеризующими состояние тела. Она не зависит от того, каким путем было реализовано данное состояние. Принято говорить, что внутренняя энергия является функцией состояния. Это значит, что изменение внутренней энергии не зависит от того, как система была переведена из одного состояния в другое (а зависит лишь от характеристик первоначального и конечного состояний) и всегда, в любых процессах для одноатомного идеального газа определяется выражением:
Обратите внимание: эта формула верна только для одноатомного газа, зато она применима ко всем процессам (а не только к изобарному, как формула для работы). Как видно из формулы, если температура не изменялась, то внутренняя энергия остаётся постоянной.
Первый закон термодинамики
К оглавлению…
Если система обменивается теплом с окружающими телами и совершает работу (положительную или отрицательную), то изменяется состояние системы, то есть изменяются ее макроскопические параметры (температура, давление, объем). Так как внутренняя энергия U однозначно определяется макроскопическими параметрами, характеризующими состояние системы, то отсюда следует, что процессы теплообмена и совершения работы сопровождаются изменением ΔU внутренней энергии системы.
Первый закон (начало) термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом: Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами. Однако, соотношение, выражающее первый закон термодинамики, чаще записывают в немного другой форме:
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами (такая формулировка более удобна и понятна, в таком виде совсем очевидно, что это просто закон сохранения энергии).
Первый закон термодинамики является обобщением опытных фактов. Согласно этому закону, энергия не может быть создана или уничтожена; она передается от одной системы к другой и превращается из одной формы в другую. Важным следствием первого закона термодинамики является утверждение о невозможности создания машины, способной совершать полезную работу без потребления энергии извне и без каких–либо изменений внутри самой машины. Такая гипотетическая машина получила название вечного двигателя (perpetuum mobile) первого рода. Многочисленные попытки создать такую машину неизменно заканчивались провалом. Любая машина может совершать положительную работу A над внешними телами только за счет получения некоторого количества теплоты Q от окружающих тел или уменьшения ΔU своей внутренней энергии.
Адиабатным (адиабатическим) называют процесс, в ходе которого система не обменивается теплотой с окружающей средой. При адиабатном процессе Q = 0. Поэтому: ΔU + A = 0, то есть: A = – ΔU. Газ совершает работу за счет уменьшения собственной внутренней энергии.
Первое начало термодинамики и изопроцессы
К оглавлению…
Для различных изопроцессов можно выписать формулы по которым могут быть рассчитаны полученная теплота Q, изменение внутренней энергии ΔU и работа газа A. Изохорный процесс (V = const):
Изобарный процесс (p = const):
Изотермический процесс (T = const):
Адиабатный процесс (Q = 0):
Если в задаче явно не сказано, что газ одноатомный (или не назван один из инертных газов, например, гелий), то применять формулы из этого раздела нельзя.
Циклы. Тепловые машины
К оглавлению…
Тепловым двигателем называется устройство, способное превращать полученное количество теплоты в механическую работу. Механическая работа в тепловых двигателях производится в процессе расширения некоторого вещества, которое называется рабочим телом. В качестве рабочего тела обычно используются газообразные вещества (пары бензина, воздух, водяной пар). Рабочее тело получает (или отдает) тепловую энергию в процессе теплообмена с телами, имеющими большой запас внутренней энергии. Эти тела называются тепловыми резервуарами.
Реально существующие тепловые двигатели (паровые машины, двигатели внутреннего сгорания и т.д.) работают циклически. Процесс теплопередачи и преобразования полученного количества теплоты в работу периодически повторяется. Для этого рабочее тело должно совершать круговой процесс или термодинамический цикл, при котором периодически восстанавливается исходное состояние.
Общее свойство всех круговых процессов состоит в том, что их невозможно провести, приводя рабочее тело в тепловой контакт только с одним тепловым резервуаром. Их нужно, по крайней мере, два. Тепловой резервуар с более высокой температурой называют нагревателем, а с более низкой – холодильником. Совершая круговой процесс, рабочее тело получает от нагревателя некоторое количество теплоты Q1 > 0 и отдает холодильнику количество теплоты Q2 < 0.
КПД тепловой машины может быть рассчитан по формуле:
где: Q1 – количество теплоты полученное рабочим телом за один цикл от нагревателя, Q2 – количество теплоты переданное рабочим телом за один цикл холодильнику. Работа совершенная тепловой машиной за один цикл:
Коэффициент полезного действия указывает, какая часть тепловой энергии, полученной рабочим телом от «горячего» теплового резервуара, превратилась в полезную работу. Остальная часть (1 – η) была «бесполезно» передана холодильнику. Коэффициент полезного действия тепловой машины всегда меньше единицы (η < 1).
Наибольший КПД при заданных температурах нагревателя T1 и холодильника T2, достигается если тепловая машина работает по циклу Карно. Цикл Карно состоит из двух изотерм и двух адиабат. КПД цикла Карно равен:
Второе начало (второй закон) термодинамики
К оглавлению…
Первый закон термодинамики не устанавливает направление протекания тепловых процессов. Однако, как показывает опыт, многие тепловые процессы могут протекать только в одном направлении. Такие процессы называются необратимыми. Например, при тепловом контакте двух тел с разными температурами тепловой поток всегда направлен от более теплого тела к более холодному. Никогда не наблюдается самопроизвольный процесс передачи тепла от тела с низкой температурой к телу с более высокой температурой. Следовательно, процесс теплообмена при конечной разности температур является необратимым.
Обратимыми процессами называют процессы перехода системы из одного равновесного состояния в другое, которые можно провести в обратном направлении через ту же последовательность промежуточных равновесных состояний. При этом сама система и окружающие тела возвращаются к исходному состоянию.
Необратимыми являются процессы превращения механической работы во внутреннюю энергию тела из–за наличия трения, процессы диффузии в газах и жидкостях, процессы перемешивания газа при наличии начальной разности давлений и т.д. Все реальные процессы необратимы, но они могут сколь угодно близко приближаться к обратимым процессам. Обратимые процессы являются идеализацией реальных процессов.
Первый закон термодинамики не может отличить обратимые процессы от необратимых. Он просто требует от термодинамического процесса определенного энергетического баланса и ничего не говорит о том, возможен такой процесс или нет. Направление самопроизвольно протекающих процессов устанавливает второй закон термодинамики. Он может быть сформулирован в виде запрета на определенные виды термодинамических процессов.
Английский физик У.Кельвин дал в 1851 году следующую формулировку второго закона: В циклически действующей тепловой машине невозможен процесс, единственным результатом которого было бы преобразование в механическую работу всего количества теплоты, полученного от единственного теплового резервуара.
Гипотетическую тепловую машину, в которой мог бы происходить такой процесс, называют «вечным двигателем второго рода». Как уже должно было стать понятно, второе начало термодинамики запрещает существование такого двигателя.
Немецкий физик Р.Клаузиус дал другую формулировку второго закона термодинамики: Невозможен процесс, единственным результатом которого была бы передача энергии путем теплообмена от тела с низкой температурой к телу с более высокой температурой. Следует отметить, что обе формулировки второго закона термодинамики эквивалентны.
Сложные задачи по термодинамике
К оглавлению…
При решении различных нестандартных задач по термодинамике необходимо учитывать следующие замечания:
- Для нахождения работы идеального газа надо построить график процесса в координатах p(V) и найти площадь фигуры под графиком. Если дан график процесса в координатах p(T) или V(T), то его сначала перестраивают в координаты p(V). Если же в условии задаётся математическая зависимость между параметрами газа, то сначала находят зависимость между давлением и объёмом, а затем строят график p(V).
- Для нахождения работы смеси газов используют закон Дальтона.
- При объединении теплоизолированных сосудов не должна изменяться внутренняя энергия всей системы, т.е. на сколько джоулей увеличится внутренняя энергия газа в одном сосуде, на столько уменьшится в другом.
- Вообще говоря, давление и температуру газа можно измерять только в состоянии термодинамического равновесия, когда давление и температура во всех точках сосуда одинаковы. Но бывают ситуации, когда давление одинаково во всех точках, а температура нет. Это может быть следствием разной концентрации молекул в разных частях сосуда (проанализируйте формулу: p = nkT).
- Иногда приходится в задачах по термодинамике использовать знания из механики.
Расчет КПД циклов по графику
К оглавлению…
Задачи данной темы по праву считаются одними из самых сложных задач в термодинамике. Итак, для решения Вам придется, во-первых, перевести график процесса в p(V) – координаты. Во-вторых, надо рассчитать работу газа за цикл. Полезная работа равна площади фигуры внутри графика циклического процесса в координатах p(V). В-третьих, необходимо разобраться, где газ получает, а где отдает теплоту. Для этого вспомните первое начало термодинамики. Внутренняя энергия идеального газа зависит только от его температуры, а работа – от объема. Поэтому, газ получает теплоту, если:
- Увеличиваются и его температура, и объем;
- Увеличивается объем, а температура постоянна;
- Увеличивается температура, а объем постоянен.
Газ отдает теплоту, если:
- Уменьшаются и его температура, и объем;
- Уменьшается объем, а температура постоянна;
- Уменьшается температура, а объем постоянен.
Если один из параметров увеличивается, а другой уменьшается, для того, чтобы понять, отдает газ теплоту или получает ее, необходимо «в лоб» по первому началу термодинамики рассчитать теплоту и посмотреть на ее знак. Положительная теплота – газ ее получает. Отрицательная – отдает.
Первый тип задач. В p(V) – координатах график цикла представляет собой фигуру с легко вычисляемой площадью, и газ получает теплоту в изохорных и изобарных процессах. Применяйте формулу:
Обратите внимание, что в знаменателе стоит только теплота, полученная газом за один цикл, то есть теплота только в тех процессах, в которых газ получал ее.
Второй тип задач. В p(V) – координатах график цикла представляет собой фигуру с легко вычисляемой площадью, и газ отдает теплоту в изохорных и изобарных процессах. Применяйте формулу:
Обратите внимание, что в знаменателе стоит только теплота, отданная газом за один цикл, то есть теплота только в тех процессах, в которых газ отдавал ее.
Третий тип задач. Газ получает теплоту не в удобных для расчета изохорных или изобарных процессах, в цикле есть изотермы или адиабаты, или вообще «никакие» процессы. Применяйте формулу:
Свойства паров. Влажность
К оглавлению…
Любое вещество при определенных условиях может находиться в различных агрегатных состояниях – твердом, жидком и газообразном. Переход из одного состояния в другое называется фазовым переходом. Испарение и конденсация являются примерами фазовых переходов.
Испарением называется фазовый переход из жидкого состояния в газообразное. С точки зрения молекулярно–кинетической теории, испарение – это процесс, при котором с поверхности жидкости вылетают наиболее быстрые молекулы, кинетическая энергия которых превышает энергию их связи с остальными молекулами жидкости. Это приводит к уменьшению средней кинетической энергии оставшихся молекул, то есть к охлаждению жидкости (если нет подвода энергии от окружающих тел).
Конденсация – это процесс, обратный процессу испарения. При конденсации молекулы пара возвращаются в жидкость.
В закрытом сосуде жидкость и ее пар могут находиться в состоянии динамического равновесия, т.е. число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара, это значит, что скорости процессов испарения и конденсации одинаковы. Такую систему называют двухфазной. Пар, находящийся в равновесии со своей жидкостью, называют насыщенным.
Насыщенный пар имеет максимальные: давление, концентрацию, плотность при данной температуре. Они зависят только от температуры насыщенного пара, но не от его объема.
Это означает, что если бы мы сосуд закрыли не крышкой, а поршнем, и после того, как пар стал насыщенным, стали бы его сжимать, то давление, плотность и концентрация пара не изменились бы. Если быть более точным, то давление, плотность и концентрация на небольшое время увеличились бы, и пар стал бы перенасыщенным. Но сразу же часть пара превратилась бы в воду, и параметры пара стали бы прежними. Если поднять поршень, то пар перестанет быть насыщенным. Однако за счёт испарения через некоторое время снова станет насыщенным. Здесь следует учесть, что если воды на дне сосуда нет или её немного, то это испарение может оказаться недостаточным, чтобы пар снова стал насыщенным.
- Фраза: «В закрытом сосуде с водой…» – означает, что над водой насыщенный пар.
- Выпадение росы означает, что пар становится насыщенным.
Абсолютной влажностью ρ называют количество водяного пара, содержащегося в 1 м3 воздуха (т.е. просто плотность водяных паров; из уравнения Клапейрона-Менделеева выражается отношение массы к объему и получается следующая формула):
где: р – парциальное давление водяного пара, М – молярная масса, R – универсальная газовая постоянная, Т – абсолютная температура. Единица измерения абсолютной влажности в СИ [ρ] = 1 кг/м3, хотя обычно используют 1 г/м3.
Относительной влажностью φ называется отношение абсолютной влажности ρ к тому количеству водяного пара ρ0, которое необходимо для насыщения 1 м3 воздуха при данной температуре:
Относительную влажность можно также определить как отношение давления водяного пара р к давлению насыщенного пара р0 при данной температуре:
Испарение может происходить не только с поверхности, но и в объеме жидкости. В жидкости всегда имеются мельчайшие пузырьки газа. Если давление насыщенного пара жидкости равно внешнему давлению (то есть давлению газа в пузырьках) или превышает его, жидкость будет испаряться внутрь пузырьков. Пузырьки, наполненные паром, расширяются и всплывают на поверхность. Этот процесс называется кипением. Таким образом, кипение жидкости начинается при такой температуре, при которой давление ее насыщенных паров становится равным внешнему давлению.
В частности, при нормальном атмосферном давлении вода кипит при температуре 100°С. Это значит, что при такой температуре давление насыщенных паров воды равно 1 атм. Важно знать, что температура кипения жидкости зависит от давления. В герметически закрытом сосуде жидкость кипеть не может, т.к. при каждом значении температуры устанавливается равновесие между жидкостью и ее насыщенным паром.
Поверхностное натяжение
К оглавлению…
Молекулы вещества в жидком состоянии расположены почти вплотную друг к другу. В отличие от твердых кристаллических тел, в которых молекулы образуют упорядоченные структуры во всем объеме кристалла и могут совершать тепловые колебания около фиксированных центров, молекулы жидкости обладают большей свободой. Каждая молекула жидкости, также как и в твердом теле, «зажата» со всех сторон соседними молекулами и совершает тепловые колебания около некоторого положения равновесия. Однако, время от времени любая молекула может скачком переместиться в соседнее вакантное место. Такие перескоки в жидкостях происходят довольно часто; поэтому молекулы не привязаны к определенным центрам, как в кристаллах, и могут перемещаться по всему объему жидкости. Этим объясняется текучесть жидкостей.
Вследствие плотной упаковки молекул сжимаемость жидкостей, то есть изменение объема при изменении давления, очень мала; она в десятки и сотни тысяч раз меньше, чем в газах.
Наиболее интересной особенностью жидкостей является наличие свободной поверхности. Жидкость, в отличие от газов, не заполняет весь объем сосуда, в который она налита. Между жидкостью и газом (или паром) образуется граница раздела, которая находится в особых условиях по сравнению с остальной массой жидкости. Молекулы в пограничном слое жидкости, в отличие от молекул в ее глубине, окружены другими молекулами той же жидкости не со всех сторон. Силы межмолекулярного взаимодействия, действующие на одну из молекул внутри жидкости со стороны соседних молекул, в среднем взаимно скомпенсированы. Любая молекула в пограничном слое притягивается молекулами, находящимися внутри жидкости (силами, действующими на данную молекулу жидкости со стороны молекул газа (или пара) можно пренебречь). В результате появляется некоторая равнодействующая сила, направленная вглубь жидкости. Если молекула переместится с поверхности внутрь жидкости, силы межмолекулярного взаимодействия совершат положительную работу. Наоборот, чтобы вытащить некоторое количество молекул из глубины жидкости на поверхность (то есть увеличить площадь поверхности жидкости), надо затратить положительную работу внешних сил ΔAвнеш, пропорциональную изменению ΔS площади поверхности.
Следовательно, молекулы поверхностного слоя жидкости обладают избыточной по сравнению с молекулами внутри жидкости потенциальной энергией. Потенциальная энергия Ep поверхности жидкости пропорциональна ее площади:
Коэффициент σ называется коэффициентом поверхностного натяжения (σ > 0). Таким образом, коэффициент поверхностного натяжения равен работе, необходимой для увеличения площади поверхности жидкости на единицу при постоянной температуре. В СИ коэффициент поверхностного натяжения измеряется в джоулях на метр квадратный (Дж/м2) или в ньютонах на метр (1 Н/м = 1 Дж/м2).
Из механики известно, что равновесным состояниям системы соответствует минимальное значение ее потенциальной энергии (любое тело всегда стремится скатиться с горы, а не забраться на нее). Отсюда следует, что свободная поверхность жидкости стремится сократить свою площадь. По этой причине свободная капля жидкости принимает шарообразную форму. Жидкость ведет себя так, как будто по касательной к ее поверхности действуют силы, сокращающие (стягивающие) эту поверхность. Эти силы называются силами поверхностного натяжения. Наличие сил поверхностного натяжения делает поверхность жидкости похожей на упругую растянутую пленку. Сила поверхностного натяжения, действующая на участок границы жидкости длиной L вычисляется по формуле:
Таким образом, коэффициент поверхностного натяжения σ может быть определен как модуль силы поверхностного натяжения, действующей на единицу длины линии, ограничивающей поверхность.
Капиллярными явлениями называют подъем или опускание жидкости в трубках малого диаметра – капиллярах. Смачивающие жидкости поднимаются по капиллярам, несмачивающие – опускаются. При этом высота столба жидкости в капилляре:
где: r – радиус капиляра (т.е. тонкой трубки). При полном смачивании θ = 0°, cos θ = 1. В этом случае высота столба жидкости в капилляре станет равной:
При полном несмачивании θ = 180°, cos θ = –1 и, следовательно, h < 0. Уровень несмачивающей жидкости в капилляре опускается ниже уровня жидкости в сосуде, в которую опущен капилляр.