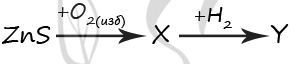
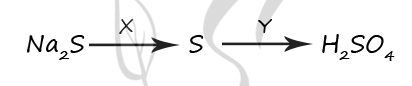
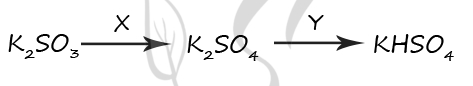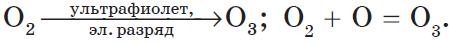7701. Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) ZnH2
2) Zn(OH)2
3) Zn
4) ZnO
5) ZnSO4

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7701.
7141. Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) H2SO4
2) NaNO3(р-р)
3) SO2
4) NaOH
5) H2O2

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7141.
7106. Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) Br2(р-р)
2) NaNO3(р-р)
3) SO2
4) NaOH
5) H2S

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7106.
7036. Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) Br2(р-р)
2) HNO3(конц.)
3) SO2
4) NaOH
5) HCl

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7036.
6826. В заданной схеме превращений
веществами X и Y являются
1) O2
2) HNO3(конц.)
3) Na2O
4) H2O
5) CO

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 6826.
Для вас приятно генерировать тесты, создавайте их почаще
Всего: 19 1–19
Добавить в вариант
Верны ли следующие суждения о галогенах?
А. Среди галогенов наиболее электроотрицательным элементом является йод.
Б. Электронная конфигурация внешнего уровня атомов галогенов ns2np6.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Задания Д2 № 233
Верны ли следующие суждения о свойствах кислорода и серы?
А. Максимальная валентность этих элементов в соединениях равна номеру группы.
Б. При взаимодействии с водородом кислород и сера проявляют окислительные свойства.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Задания Д2 № 448
Верны ли следующие суждения о свойствах серы и хлора?
А. Максимальная валентность серы и хлора в соединениях равна номерам групп в которых они расположены.
Б. В водородных соединениях серы и хлора связь ковалентная полярная.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Задания Д2 № 491
Верны ли следующие суждения об элементах VA группы?
А. С возрастанием заряда ядра электроотрицательность увеличивается.
Б. Общая формула летучего водородного соединения
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Верны ли следующие суждения об элементах VA группы?
А. С возрастанием заряда ядра радиус атома увеличивается.
Б. Общая формула летучего водородного соединения RH3.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Верны ли следующие суждения о соединениях неметаллов?
А. Все оксиды неметаллов являются кислотными
Б. Все водородные соединения неметаллов проявляют кислотные свойства
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Верны ли следующие суждения о соединениях серы и хлора?
А. Высшие оксиды этих элементов проявляют кислотные свойства.
Б. Эти элементы не образуют летучие водородные соединения.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Задания Д2 № 620
Верны ли следующие суждения о галогенах?
А. Хлор в соединениях проявляет как положительную, так и отрицательную степени окисления.
Б. При нормальных условиях иод является жидкостью.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Верны ли следующие утверждения о фосфоре и его соединениях?
А. Фосфор в соединениях может проявлять как положительные, так и отрицательные степени окисления.
Б. Все оксиды фосфора имеют кислотный характер.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Верны ли следующие суждения о галогенах?
А. Все галогены, кроме фтора, вступают с щелочами в реакцию диспропорционирования.
Б. Соединения, в которых галогены проявляют отрицательную степень окисления, являются сильными окислителями.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Верны ли следующие утверждения о галогенах?
А. Простые вещества – сильные окислители.
Б. Благодаря высокой химической активности галогенов все галогеноводо-
родные кислоты – сильные.
1) верно только А
2) верно только Б
3) вырны оба утверждения
4) оба утверждения неверны
Верны ли следующие утверждения о кремнии и его соединениях?
А. Кремний в соединениях проявляет только отрицательную степень окисления.
Б. Высший оксид кремния имеет кислотный характер.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Верны ли следующие утверждения о соединениях халькогенов?
А. Все водородные соединения халькогенов проявляют свойства кислот.
Б. В соединениях низшая степень окисления халькогенов равна − 2.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
В двух пробирках находился раствор сульфида аммония. В первую пробирку добавили раствор вещества Х, а во вторую — раствор вещества Y. В первой пробирке выпал белый осадок и выделился газ, а во второй пробирке образовался тёмный осадок. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1)
2)
3)
4)
5)
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Из предложенного перечня выберите два соединения, в которых присутствует ионная химическая связь.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных соединений.
Источник: Демонстрационная версия ЕГЭ—2017 по химии, Демонстрационная версия ЕГЭ—2020 по химии, Демонстрационная версия ЕГЭ−2019 по химии
Из указанного ряда выберите два элемента, которые в соединениях могут проявлять степень окисления +4. Запишите в поле ответа номера выбранных элементов в порядке возрастания.
Показать
1
Какие из указанных элементов имеют в основном состоянии нечётное число неспаренных электронов? Запишите номера выбранных элементов в порядке возрастания.
2
Из указанного ряда выберите три элемента, принадлежащие одной группе Периодической системы. Расположите их в порядке увеличения электроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Всего: 19 1–19
2018. ХИ. Халькогены. Галогены
(ЕГЭ 4) Из предложенного перечня выберите два вещества, в молекулах которых есть ковалентная неполярная связь.
1) H2SO4
2) S8
3) H2O2
4) CF4
5) HCl
Запишите в поле ответа номера выбранных веществ.
(ЕГЭ 6) .Из предложенного перечня реактивов выберите два, которые способны растворить серу.
1) H2SO4 (разб. р-р)
2) H2SO4 (конц. р-р)
3) HCl (разб. р-р)
4) KOH (конц. р-р)
5) H2O
Запишите в поле ответа номера выбранных веществ.
(ЕГЭ 
1) Na2SO4
2) AlCl3
3) KOH
4) Ca(NO3)2
5) FeCl3
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
|
X |
Y |
(ЕГЭ 9) Дана схема превращений:
H2S ==== S ==== SO2
Из приведённого списка выберите вещества X и Y.
1) H2O
2) H2
3) SO2
4) H2SO4 (конц)
5) H2SO4 (р-р)
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
|
X |
Y |
(ЕГЭ 10) Установите соответствие между исходными веществами и продуктами их взаимодействия:
А) NaOH(гор) + I2 == 1) IBr3
Б) I2 + Br2 == 2) NaF + NaOF + H2O
В) NaOH(гор) + F2 == 3) NaF + H2O + O2
Г) H2S + F2 == 4) S + HF
5) NaIO3 + NaI + H2O
6) реакция не идет
|
А |
Б |
В |
Г |
|
5 |
1 |
3 |
4 |
(ЕГЭ 11) Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать.
|
ФОРМУЛА ВЕЩЕСТВА |
РЕАГЕНТЫ |
||
|
А) S |
1) AgNO3, Na3PO4, Cl2 |
||
|
Б) SO3 |
2) BaO, H2O, KOH |
||
|
В) Zn(OH)2 |
3) H2, Cl2, O2 |
||
|
Г) ZnBr2 |
4) HBr, LiOH, CH3COOH |
||
|
5) H3PO4, BaCl2, CuO |
|||
|
А |
Б |
В |
Г |
(ЕГЭ 22) Установите соответствие между формулой вещества и полуреакцией, протекающей на инертном аноде при электролизе его водного раствора.
ФОРМУЛА ВЕЩЕСТВА ПОЛУРЕАКЦИЯ НА АНОДЕ
А) К2SO4 1) 4OH— – 4e → O2 + 2H2O
Б) H2S 2) S2++ 2e → S0
В) KF 3) 2H2O – 4e → O2 + 4H+
Г) KOH 4) K+ + 1e → K
5) 2F— – 2e → F2
6) 2H+ + 2e → H2
|
А |
Б |
В |
Г |
|
3 |
2 |
3 |
1 |
(ЕГЭ 30) Используя метод электронного баланса, составьте уравнение реакции
K2Cr2O7 + SO2 + … === Cr2(SO4)3 + … + H2O
Определите окислитель и восстановитель.
(ЕГЭ 30) Используя метод электронного баланса, составьте уравнение реакции
FeSO4 + … + H2SO4 === MnSO4 + … + H2O
Определите окислитель и восстановитель.
(ЕГЭ 31) В нагретую концентрированную серную кислоту внесли медную проволоку и выделяющийся газ пропустили через избыток раствора едкого натра. Раствор осторожно выпарили, твердый остаток растворили в воде и нагрели с порошкообразной серой. Непрореагировавшую серу отделили фильтрованием и к раствору прибавили серную кислоту, при этом наблюдали образование осадка и выделение газа с резким запахом. Составьте уравнения четырех описанных реакций.
(ЕГЭ 31) Сернистый газ пропустили через раствор перекиси водорода. Из образовавшегося раствора выпарили воду и к остатку добавили магниевую стружку. Выделившийся газ пропустили через раствор медного купороса. Выпавший осадок черного цвета отделили и подвергли обжигу. Составьте уравнения четырех описанных реакций.
(ЕГЭ 31) Нитрат калия нагрели с порошкообразным свинцом до прекращения реакции. Смесь продуктов обработали водой, а затем полученный раствор отфильтровали. Фильтрат подкислили серной кислотой обработали иодидом калия. Выделившееся простое вещество нагрели с концентрированной азотной кислотой. В атмосфере образовавшегося при этом бурого газа сожгли красный фосфор. Запишите уравнения описанных реакций.
(ЕГЭ 31) Раствор иодида калия обработали избытком хлорной воды, при этом сначала наблюдали образование осадка, а затем его полное растворение. Образующуюся при этом иодосодержащую кислоту выделили из раствора, высушили и осторожно нагрели. Полученный оксид прореагировал с угарным газом. Запишите уравнения описанных реакций.
(ЕГЭ 31) При обжиге некоторого минерала А, состоящего из двух элементов, образуется газ с резким запахом, который обесцвечивает бромную воду с образованием в растворе двух сильных кислот. При взаимодействии вещества Б, состоящего из тех же элементов, что и минерал А, но в другом соотношении, с концентрированной хлороводородной кислотой выделяется ядовитый газ с запахом тухлых яиц. При взаимодействии газов друг с другом образуется вещество желтого цвета и вода. Составьте уравнения четырех описанных реакций.
(ЕГЭ 33) Определите массовые доли (в %) сульфата железа(II) и сульфида алюминия в смеси, если при обработке 25 г этой смеси водой выделился газ, который полностью прореагировал с 960 г 5%-ного раствора сульфата меди.
(ЕГЭ 33) В результате прокаливания смеси сульфата, нитрата и гидрокарбоната натрия массой 24 г выделился газ, объемом 2, 24 л (н.у.). При пропускании этого газа через избыток известковой воды, выпал осадок, массой 5,0 г. Определите массовые доли солей в смеси.
Смесь оксида и пероксида бария обработали избытком серной кислоты. Осадок отфильтровали, высушили и взвесили, его масса составила 46,6 г. К полученному раствору добавили избыток раствора перманганата калия, в результате выделилось 3,36 л газа (н. у.). Рассчитайте массовые доли веществ в исходной смеси.
Решение задач и выполнение упражнений по материалам ЕГЭ по теме «Халькогены»
1. Верны ли следующие суждения о свойствах кислорода и серы?
А. Максимальная валентность этих элементов в соединениях равна номеру группы.
Б. При взаимодействии с водородом кислород и сера проявляют окислительные свойства.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
2. В двух пробирках находился раствор сульфида аммония. В первую пробирку добавили раствор вещества Х, а во вторую — раствор вещества Y. В первой пробирке выпал белый осадок и выделился газ, а во второй пробирке образовался тёмный осадок. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) HCl 2) CuSO4 3) AlCl3 4) NaOH 5) NaCl
3. Из предложенного перечня веществ (перманганат калия, гидрокарбонат калия, сульфит натрия, сульфат бария, гидроксид калия; допустимо использование водных растворов) выберите вещества, между которыми возможна окислительно-восстановительная реакция. Запишите уравнение только одной из возможных окислительно-восстановительных реакций, используя не менее двух веществ из предложенного перечня. Составьте электронный баланс, укажите окислитель и восстановитель.
4. Из предложенного перечня веществ (хлорид меди (II), нитрат натрия, перманганат калия, сульфат натрия, сульфид калия; допустимо использование водных растворов) выберите вещества, между которыми возможна окислительно-восстановительная реакция. Запишите уравнение только одной из возможных окислительно-восстановительных реакций, используя не менее двух веществ из предложенного перечня. Составьте электронный баланс, укажите окислитель и восстановитель.
5. Вычислите массу кислорода (в граммах), необходимого для полного сжигания 6,72 л (н.у.) сероводорода.
6. В результате реакции, термохимическое уравнение которой
Fe + S = FeS + 1200 кДж,
выделилось 480 кДж теплоты. Какая объем масса серы при этом вступила в реакцию?
7. Вычислите массу воды (в граммах), которую следует добавить к 55 г раствора сероводорода с массовой долей 30%, чтобы уменьшить концентрацию раствора до 12%.
Решение задач и выполнение упражнений по материалам ЕГЭ по теме «Халькогены»
1. Верны ли следующие суждения о свойствах кислорода и серы?
А. Максимальная валентность этих элементов в соединениях равна номеру группы.
Б. При взаимодействии с водородом кислород и сера проявляют окислительные свойства.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
2. В двух пробирках находился раствор сульфида аммония. В первую пробирку добавили раствор вещества Х, а во вторую — раствор вещества Y. В первой пробирке выпал белый осадок и выделился газ, а во второй пробирке образовался тёмный осадок. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) HCl 2) CuSO4 3) AlCl3 4) NaOH 5) NaCl
3. Из предложенного перечня веществ (перманганат калия, гидрокарбонат калия, сульфит натрия, сульфат бария, гидроксид калия; допустимо использование водных растворов) выберите вещества, между которыми возможна окислительно-восстановительная реакция. Запишите уравнение только одной из возможных окислительно-восстановительных реакций, используя не менее двух веществ из предложенного перечня. Составьте электронный баланс, укажите окислитель и восстановитель.
4. Из предложенного перечня веществ (хлорид меди (II), нитрат натрия, перманганат калия, сульфат натрия, сульфид калия; допустимо использование водных растворов) выберите вещества, между которыми возможна окислительно-восстановительная реакция. Запишите уравнение только одной из возможных окислительно-восстановительных реакций, используя не менее двух веществ из предложенного перечня. Составьте электронный баланс, укажите окислитель и восстановитель.
5. Вычислите массу кислорода (в граммах), необходимого для полного сжигания 6,72 л (н.у.) сероводорода.
6. В результате реакции, термохимическое уравнение которой
Fe + S = FeS + 1200 кДж,
выделилось 480 кДж теплоты. Какая объем масса серы при этом вступила в реакцию?
7. Вычислите массу воды (в граммах), которую следует добавить к 55 г раствора сероводорода с массовой долей 30%, чтобы уменьшить концентрацию раствора до 12%.
Решайте задания с сайта «Решу ЕГЭ»
Задание 1.
№ 7169, № 7206, № 8994, № 9000
Задание 2.
№ 7161, № 7170, № 7207
Задание 3.
№ 7152, № 7184
Задание 4.
№ 7082, № 7291, № 7300, № 7793, № 7295, № 107
Задание 5.
№ 28797, № 28793
Задание 6.
№ 9439, № 7227, № 7230, № 9410, № 9411, № 9413, № 9422, № 9430
Задание 7.
№ 134, № 650, № 908, № 994, № 10689
Задание 8.
№ 3414, № 3481, № 3565
Задание 9.
№ 6226, № 6501
Задание 17.
№ 4444, № 8035, № 8037, № 8068, № 8507, № 8524
Задание 18.
№ 8116, № 8313
Задание 19.
№ 131, № 303, № 518
Задание 20.
№ 218, № 648
Задание 21.
№ 28912, № 28911
Задание 22.
№ 6278
Задание 23. (обратите внимание)
№ 28986
Задание 24.
№ 6403, № 21072
Задание 25.
№ 7252, № 7256
Задание 27.
№ 6262, № 10404
Задание 28.
№ 6271, № 6436
Задание 29.
№ 15743, № 15748
Задание 30.
№ 16458, № 16481
Задание 31.
№ 4261, № 4556, № 6315
Задание 32.
№ 3975, № 9927
Задание 33.
№ 186, № 6449
Задание 34.
№ 3099
Химические свойства кислорода.
Кислород ($O$) — самый распространенный элемент на Земле. Он находится в атмосфере ($21%$ по объему), в земной коре ($92%$), в гидросфере ($89%$).
Кислород находится в VI группе Периодической системы, в главной подгруппе. Кислород проявляет во всех соединениях валентность II. Это низшая валентность из шести возможных в этой группе.
Кислород образует молекулы O2. Это газ без запаха, цвета и вкуса. Плотность кислорода при $0°С$ и давлении $1$ атм. $1,43$ г/л, что в $1,11$ раза больше плотности воздуха. Кислород малорастворим в воде. При $20°С$ и атмосферном давлении в $100$ объемах воды растворяется $3$ объема $O_2$. Температура кипения кислорода равна $–183°С$; при этой температуре и давлении $1$ атм. кислород превращается в жидкость голубого цвета.
Кислород является одним из самых активных веществ, легко вступающих в химические реакции.
Взаимодействие веществ с кислородом называется реакцией окисления этих веществ. Кислород принимает участие в таких окислительных процессах: горение, дыхание, ржавление металлов, гниение растительных и животных останков.
Реакции окисления, сопровождающиеся выделением теплоты и света, называются реакциями горения:
а) горение простых веществ:
— неметаллов:
$C+O_2=CO_2; S+O_2=SO_2; 4P+5O_2=2P_2O_5;$
— металлов:
$3Fe+2O_2=Fe_3O_4$, или $FeO·Fe_2O_3$.
Эти процессы горения происходят быстро. Возможно и медленное горение — окисление:
$2Cu+O_2=2CuO$;
б) горение сложных веществ:
$2{C_2H_2}↙{ацетилен}+5O_2→4CO_2+2H_2O$
У кислорода есть аллотропная модификация — озон $O_3$. Он образуется под воздействием солнечного излучения или электрического разряда:
Озон обладает запахом свежести. Разный состав молекул кислорода и озона определяет их разные свойства. Молекула озона очень непрочная, легко вступает в химические реакции. Озон проявляет сильные окислительные свойства, разрушает органические вещества (резину), окисляет металлы ($Au, Pt, Ag$):
${Ag+O_3=AgO+O_2↑}↙{text «(с кислородом серебро не реагирует)» }$
Химические свойства серы.
Атомы серы, как и атомы кислорода, имеют на внешнем энергетическом уровне $6{e}↖{-}$, два из них — неспаренные. Однако по сравнению с атомами кислорода атомы серы имеют больший радиус, меньшее значение электроотрицательности, поэтому проявляют восстановительные свойства, образуя соединения со степенями окисления $+2,+4,+6$. По отношению к водороду и металлам сера проявляет окислительные свойства со степенью окисления $–2$.
Сера ($S$) — твердое кристаллическое вещество желтого цвета, имеет молекулярную кристаллическую решетку, легко плавится, в воде нерастворима. Для серы характерна аллотропия. Ромбическая сера $S_8$ — стабильная модификация. Образует кристаллы октаэдрической формы лимонно-желтого цвета с $t°{пл}=112,8°С$. Моноклинная сера имеет игольчатые кристаллы с $t°{пл}=119,3°С$, легко переходит в ромбическую. Пластическая сера имеет линейное строение молекул, темно-коричневый цвет. Ее получают при выливании расплавленной при $160°С$ серы в холодную воду — образуется резиноподобная темно-коричневая масса.
В таблице обобщены химические свойства серы и ее соединений.
Сера и ее соединения.
| Сера | Соединения серы | |
| Оксиды серы | Серная кислота | |
| 1. При обычных условиях — твердое желтое кристаллическое вещество. 2. Горит в кислороде: $S+O_2=SO_2$ (проявляет восстановительные свойства). 3. Взаимодействует с металлами и водородом: $Fe+S=FeS$ $H_2+S=H_2S$ (проявляет окислительные свойства) В природе самородная сера $S$, сульфиды: $FeS_2$ (пирит), $CuS$; сульфаты: $CaSO_4·2H_2O$ (гипс), $Na_2SO_4$ |
1. При обычных условиях $SO_2$ — газ, $SO_3$ — жидкое вещество ($t°{пл}=16,8°С$). 2. Проявляют свойства кислотных оксидов, взаимодействуя: — с водой: $SO_2+H_2O⇄H_2SO_3$ $SO_3+H_2O=H_2SO_4$ — со щелочами: $SO_2+2NaOH=Na_2SO_3+H_2O$ $SO_3+2NaOH=Na_2SO_4+H_2O$ — с основными оксидами: $SO_3+CaO=CaSO_4$ Получение: 1) оксида серы (IV) а) в промышленности: — горение серы $S+O_2=SO_2$ — обжиг пирита $4FeS_2+11O_2=2Fe_2O_3+8SO_2$ б) в лаборатории: $Na_2SO_3+H_2SO_4=Na_2SO_4+SO_2↑+H_2O$; 2) оксида серы (VI) в промышленности — каталитическое окисление оксида серы (IV): $2SO_2+O_2=2SO_3$ |
1. При обычных условиях — бесцветная тяжелая жидкость ($ρ≈2 г/см^3$), неограниченно растворимая в воде. 2. Сильная двухосновная кислота: $H_2SO_4=H^{+}+HSO_4^{-}⇄2H^{+}+SO_4^{2-}$ 3. Взаимодействует с металлами: $Zn+H_2SO_4=ZnSO_4+H_2↑$ В концентрированной кислоте пассивируются $Al$ и $Fe$. 4. Взаимодействует со щелочами, основаниями и амфотерными гидроксидами: $H_2SO_4+2NaOH=Na_2SO_4+2H_2O$ $H_2SO_4+Cа(OH)_2=CаSO_4+2H_2O$ $3H_2SO_4+2Al(OH)_3=Al_2(SO_4)_3+6H_2O$ 5. Взаимодействует с основными и амфотерными оксидами: $H_2SO_4+CuO=CuSO_4+H_2O$ $H_2SO_4+ZnO=ZnSO_4+H_2O$ 6. Концентрированная кислота гигроскопична: 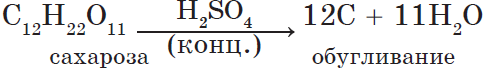 Получение в промышленности в соответствии со схемой: $FeS_2(или S){→}↖{O_2}SO_2{→}↖{O_2}SO_3{→}↖{H_2O}H_2SO_4$ |
VI а группа – халькогены – nS2nP4
1)
8O — H2+1O-2 ,
H2O2-1 ; O+2F2-1
16S — 2;O +2; +4; +6 НеМе О — самый
распространенный хими-
34Se — 2;O +2;
+4; +6 св-ва
ческий эл-т на Земле. O2 и O3;
ромби-
52Te — 2;O +2; +4;
+6 уб-ют
ческая, моноклинная S8, аморфный Se,
84Po — 2;O +2; +4;
+6 ЭО ум-ся
серый Se, неск-ко аллотропный видоизм.
2)
O3 –озон, сильный окислитель – Г, З, Ц
O3 = O + O2. Вдыхание O3 в больших количествах вредно.
3) Сера. В природе FeS2, FeCuS2,
MgS, Na2SO4 . 10H2O, CaSO4 . 2H2O
Встречается не
только в виде соединений, но и в свободном виде.
пирит
халькопирит мирабилит гипс
S нерастворима в H2O, но хорошо растворима в CS2 (сероуглероде)
1. с Ме – сульфиды 2Na+S Na2S
Fe + S = FeS
2.
c НеМе O2, F2, Cl2, Br2 (с N2 не
взаимодействует, нитрид образуется косвенно)
S + O2 SO2 H2
+ S =H2S
3. c кислотами:
S + 4HNO3 = SO2 + 4NO2
+ 2H2O S + 2H2SO4 = 3SO2
+ 2H2O
конц. конц.
4.
с щелочами:
3S
+ 6NaOH 2Na2S + Na2SO3 + 3H2O
Получение FeS2
= FeS + S
4)
Сероводород – H2S – Ц, З тухлых яиц, Яд, растворимый
в H2O
Сильный
восстановитель и слабая кислота:
H2S
+ 6HNO3 SO2 + 6NO2 + 4H2O
·
c Ме:
2H2S + 2Na 2NaHS + H2
·
c основными оксидами:
H2S
+ ZnO ZnS + H2O
·
с солями
H2S
+ Cu(NO3)2 CuS + 2HNO3,
PbS
черный
5H2S +
2KMnO4 + 3H2SO4 = 5S + 2MnSO4 + K2SO4
+ 8H2O
Окисление в водном растворе или при
недостатке O2:
2H2S + O2 = 2H2O +2S
2H2S + 3O2 (изб.) = 2SO2 + 2H2O
Окисляется галогенами в водном растворе:
H2S + 4Cl2 + 4H2O H2SO4
+ 8HCl
H2S + J2 = 2HJ + S
5)
Оксид S(IV) – SO2 – сернистый газ – Г, Ц, резкий З,
кислотный оксид.
H2SO3 – слабая кислота, 2 ряда солей: SO3-2 – сульфиты,
HSO3— — гидросульфиты. SO2 вытесняет слабые кислоты из солей: SO2 + Na2CO3 = CO2 + Na2SO3.
Гидросульфит-ион и SO2 вытесняются более сильными кислотами: Na2CO3 + CH3COOH NaHSO3 +
NaCH3COO
SO2 – вещество с 2-ой окислительно-восстановительной природой, с преобладающей
восстановительной функцией.
SO2
+ J2 + 2H2O 2HJ + H2SO4
SO2 + 2HNO3 (конц.) 2NO2 + H2SO4
2SO2
+ O2 2SO3 ( t, кат.)
SO2 + O3 =
SO3 + O2 (при комн. t)
2K2SO3 + O2 2K2SO4 (во
влажном воздухе)
4K2SO3 (t =
600o) = 3K2SO4 + K2S
Окислитель SO2 + 2H2S
3S + 2H2O (при комн. t)
SO2 + C (t) = S + CO2
Качественные
реакции на SO2:
I.
Обесцвечивание подкисленным раствором KMnO4:
5SO2
+ 2KMnO4 + 2H2O (H+) 2MnO4 +2H2SO4
+K2SO4
II.
Помутнение известковой воды:
Ca(OH)2(изб.)
+ SO2 CaSO3 + H2O
6)
SO3; H2SO4, соли сульфаты (щелочные Ме и NH3 образуют гидросульфаты)
Раствор SO3 в H2SO4(конц.)
Олеум
H2SO4 – Ц, сиропообразная Ж,
H2SO4 реагирует с Ме, до Н в ЭХР
Fe + H2SO4
= FeSO4 + H2
H2SO4 (конц.) — сильный окислитель,
восстанавливается до S+4
или S-2, реже до S, часто выделяется смесь продуктов, например в реакции с Zn – SO2, H2S и S, но основной
продукт — H2S; 4Zn + 5H2SO4 = 4ZnSO4 + H2S + 4H2O
H2SO4 (конц.) на холоде не реагирует с Al, Fe, Cr, при t с Cu, Ag, Hg
Cu + 2H2SO4 (t) CuSO4
+ SO2 + 2H2O
2Fe +
6H2SO4 (t) Fe2(SO4)3
+ 3SO2 + 6H2O
H2SO4(конц.) окисляет НеМе, графит
(С), Р, S
2H2SO4(конц.) + C 2SO2 + CO2 + 2H2O
H2SO4(конц.) + 2P = 3SO2 + 2H3PO4
2H2SO4(конц.) +
S 3SO2 + 2H2O
H2SO4(конц.) реагирует
со сложными веществами:
H2SO4(конц.) +8HJ 4J2 + H2S + 4H2O
H2SO4(конц.) + HBr = Br2 + SO2 + 2H2O
H2SO4(конц.) + H2S S + SO2 + 2H2O
С H2SO4(конц.) органические
вещества обугливаются:
6H2SO4(конц.) + C6H12O6 = 6C
+ 6H2SO4 + H2O
Сульфаты окислительными свойствами не обладают, при t окисляют
вещества
Na2SO4 + 4C(изб.)(t) = Na2S + 4CO
Качественная
реакция на H2SO4 и растворимые соли:
SO42-
+ Ba2+ = BaSO4 (белый)