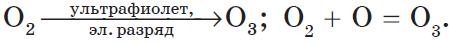Химические свойства кислорода.
Кислород ($O$) — самый распространенный элемент на Земле. Он находится в атмосфере ($21%$ по объему), в земной коре ($92%$), в гидросфере ($89%$).
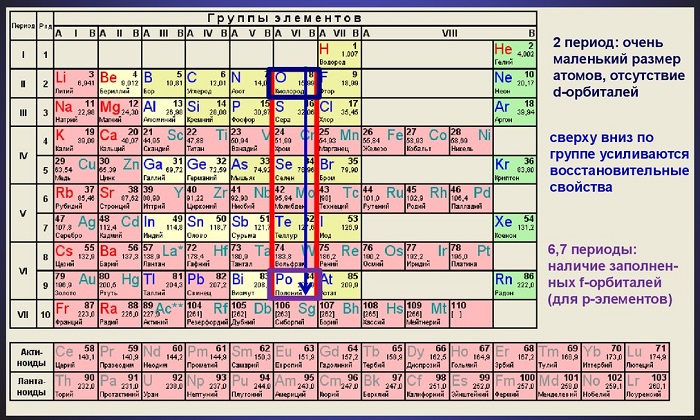
Кислород находится в VI группе Периодической системы, в главной подгруппе. Кислород проявляет во всех соединениях валентность II. Это низшая валентность из шести возможных в этой группе.
Кислород образует молекулы O2. Это газ без запаха, цвета и вкуса. Плотность кислорода при $0°С$ и давлении $1$ атм. $1,43$ г/л, что в $1,11$ раза больше плотности воздуха. Кислород малорастворим в воде. При $20°С$ и атмосферном давлении в $100$ объемах воды растворяется $3$ объема $O_2$. Температура кипения кислорода равна $–183°С$; при этой температуре и давлении $1$ атм. кислород превращается в жидкость голубого цвета.
Кислород является одним из самых активных веществ, легко вступающих в химические реакции.
Взаимодействие веществ с кислородом называется реакцией окисления этих веществ. Кислород принимает участие в таких окислительных процессах: горение, дыхание, ржавление металлов, гниение растительных и животных останков.
Реакции окисления, сопровождающиеся выделением теплоты и света, называются реакциями горения:
а) горение простых веществ:
— неметаллов:
$C+O_2=CO_2; S+O_2=SO_2; 4P+5O_2=2P_2O_5;$
— металлов:
$3Fe+2O_2=Fe_3O_4$, или $FeO·Fe_2O_3$.
Эти процессы горения происходят быстро. Возможно и медленное горение — окисление:
$2Cu+O_2=2CuO$;
б) горение сложных веществ:
$2{C_2H_2}↙{ацетилен}+5O_2→4CO_2+2H_2O$
У кислорода есть аллотропная модификация — озон $O_3$. Он образуется под воздействием солнечного излучения или электрического разряда:
Озон обладает запахом свежести. Разный состав молекул кислорода и озона определяет их разные свойства. Молекула озона очень непрочная, легко вступает в химические реакции. Озон проявляет сильные окислительные свойства, разрушает органические вещества (резину), окисляет металлы ($Au, Pt, Ag$):
${Ag+O_3=AgO+O_2↑}↙{text «(с кислородом серебро не реагирует)» }$
Химические свойства серы.
Атомы серы, как и атомы кислорода, имеют на внешнем энергетическом уровне $6{e}↖{-}$, два из них — неспаренные. Однако по сравнению с атомами кислорода атомы серы имеют больший радиус, меньшее значение электроотрицательности, поэтому проявляют восстановительные свойства, образуя соединения со степенями окисления $+2,+4,+6$. По отношению к водороду и металлам сера проявляет окислительные свойства со степенью окисления $–2$.
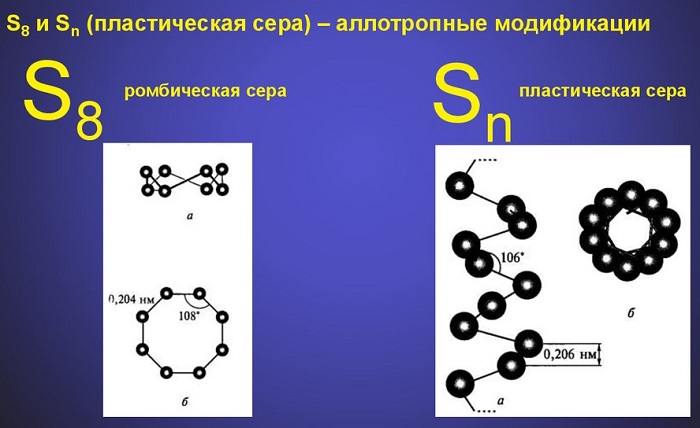
Сера ($S$) — твердое кристаллическое вещество желтого цвета, имеет молекулярную кристаллическую решетку, легко плавится, в воде нерастворима. Для серы характерна аллотропия. Ромбическая сера $S_8$ — стабильная модификация. Образует кристаллы октаэдрической формы лимонно-желтого цвета с $t°{пл}=112,8°С$. Моноклинная сера имеет игольчатые кристаллы с $t°{пл}=119,3°С$, легко переходит в ромбическую. Пластическая сера имеет линейное строение молекул, темно-коричневый цвет. Ее получают при выливании расплавленной при $160°С$ серы в холодную воду — образуется резиноподобная темно-коричневая масса.
В таблице обобщены химические свойства серы и ее соединений.
Сера и ее соединения.
| Сера | Соединения серы | |
| Оксиды серы | Серная кислота | |
| 1. При обычных условиях — твердое желтое кристаллическое вещество. 2. Горит в кислороде: $S+O_2=SO_2$ (проявляет восстановительные свойства). 3. Взаимодействует с металлами и водородом: $Fe+S=FeS$ $H_2+S=H_2S$ (проявляет окислительные свойства) В природе самородная сера $S$, сульфиды: $FeS_2$ (пирит), $CuS$; сульфаты: $CaSO_4·2H_2O$ (гипс), $Na_2SO_4$ |
1. При обычных условиях $SO_2$ — газ, $SO_3$ — жидкое вещество ($t°{пл}=16,8°С$). 2. Проявляют свойства кислотных оксидов, взаимодействуя: — с водой: $SO_2+H_2O⇄H_2SO_3$ $SO_3+H_2O=H_2SO_4$ — со щелочами: $SO_2+2NaOH=Na_2SO_3+H_2O$ $SO_3+2NaOH=Na_2SO_4+H_2O$ — с основными оксидами: $SO_3+CaO=CaSO_4$ Получение: 1) оксида серы (IV) а) в промышленности: — горение серы $S+O_2=SO_2$ — обжиг пирита $4FeS_2+11O_2=2Fe_2O_3+8SO_2$ б) в лаборатории: $Na_2SO_3+H_2SO_4=Na_2SO_4+SO_2↑+H_2O$; 2) оксида серы (VI) в промышленности — каталитическое окисление оксида серы (IV): $2SO_2+O_2=2SO_3$ |
1. При обычных условиях — бесцветная тяжелая жидкость ($ρ≈2 г/см^3$), неограниченно растворимая в воде. 2. Сильная двухосновная кислота: $H_2SO_4=H^{+}+HSO_4^{-}⇄2H^{+}+SO_4^{2-}$ 3. Взаимодействует с металлами: $Zn+H_2SO_4=ZnSO_4+H_2↑$ В концентрированной кислоте пассивируются $Al$ и $Fe$. 4. Взаимодействует со щелочами, основаниями и амфотерными гидроксидами: $H_2SO_4+2NaOH=Na_2SO_4+2H_2O$ $H_2SO_4+Cа(OH)_2=CаSO_4+2H_2O$ $3H_2SO_4+2Al(OH)_3=Al_2(SO_4)_3+6H_2O$ 5. Взаимодействует с основными и амфотерными оксидами: $H_2SO_4+CuO=CuSO_4+H_2O$ $H_2SO_4+ZnO=ZnSO_4+H_2O$ 6. Концентрированная кислота гигроскопична: 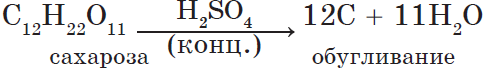 Получение в промышленности в соответствии со схемой: $FeS_2(или S){→}↖{O_2}SO_2{→}↖{O_2}SO_3{→}↖{H_2O}H_2SO_4$ |
Халькогены подготовка к егэ
Кислород
Кислород (лат. Oxygenium) — элемент VIa группы 2 периода периодической таблицы Д. И. Менделеева. Первым открывает группу халькогенов — элементов VIa группы.
Газ без цвета, без запаха, составляет 21% воздуха.
Общая характеристика элементов VIa группы
Общее название элементов VIa группы O, S, Se, Te, Po — халькогены. Халькогены (греч. χαλκος — руда + γενος — рождающий) — входят в состав многих минералов. Например, кислород составляет 50% массы земной коры.
От O к Po (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.
Среди элементов VIa группы O, S, Se — неметаллы. Te, Po — металлы.
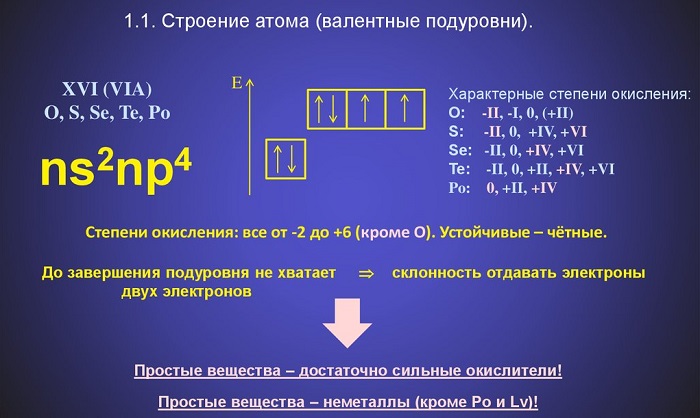
- O — 2s 2 2p 4 S — 3s 2 3p 4 Se — 4s 2 4p 4 Te — 5s 2 5p 4 Po — 6s 2 6p 4
Основное состояние атома кислорода
У атома кислорода (как и атомы азота, фтора, неона) нет возбужденного состояния, так как отсутствует свободная орбиталь с более высоким энергетическим уровнем, куда могли бы перемещаться валентные электроны.
Атом кислорода имеется два неспаренных электрона, максимальная валентность II.
Природные соединения
- Воздух — в составе воздуха кислород занимает 21% (это число пригодится в задачах!) В форме различных минералов в земной коре кислорода содержится около 50% В живых организмов кислород входит в состав органических веществ: белков, жиров, углеводов и нуклеиновых кислот
Получение
В промышленности кислород получают из сжиженного воздуха. Также активно применяются кислородные установки, мембрана которых устроена как фильтр, отсеивающие кислород (мембранная технология).
В лаборатории кислород получают разложением перманганата калия (марганцовки) или бертолетовой соли при нагревании. Применяется реакция каталитического разложения пероксида водорода.
На подводных лодках для получения кислорода применяют следующую реакцию:
Химические свойства
Является самым активным неметаллом после фтора, образует бинарные соединения со всеми элементами кроме гелия, неона, аргона. Чаще всего реакции с кислородом экзотермичны (горение), ускоряются при повышении температуры.
- Реакции с неметаллами
Во всех реакциях, кроме взаимодействия со фтором, кислород проявляет себя в качестве окислителя.
2C + O2 = (t) 2CO (неполное окисление — угарный газ, соотношение 2:1)
C + O2 = (t) CO2 (полное окисление — углекислый газ, соотношение 1:1)
F + O2 → OF2 (фторид кислорода, O +2 )
В реакциях кислорода с металлами образуются оксиды, пероксиды и супероксиды. Реакции с активными металлами идут без нагревания.
Известна реакция горения воды во фторе.
Все органические вещества сгорают с образованием углекислого газа и воды.
При применении катализаторов и особых реагентов в органической химии достигают контролируемого окисления: алканы окисляются до спиртов, спирты — до альдегидов, альдегиды — до кислот.
Процесс можно остановить на любой стадии в зависимости от желаемого результата.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
- Реакции с неметаллами
Газ без цвета, без запаха, составляет 21 воздуха.
Studarium. ru
13.11.2019 13:46:27
2017-05-02 23:17:55
Источники:
Https://studarium. ru/article/172
Сера, подготовка к ЕГЭ по химии » /> » /> .keyword { color: red; } Халькогены подготовка к егэ
Халькогены подготовка к егэ
Халькогены подготовка к егэ
Сера — элемент VIa группы 3 периода периодической таблицы Д. И. Менделеева. Относится к группе халькогенов — элементов VIa группы.
Сера — S — простое вещество имеет светло-желтый цвет. Использовалась еще до нашей эры в составе священных курений при религиозных обрядах.
Основное и возбужденное состояние атома серы
Электроны s — и p-подуровня способны распариваться и переходить на d-подуровень. Как и всегда, количество валентных электронов отражает количество возможных связей у атома.
В разных электронных конфигурациях сера способна принимать валентности: II, IV и VI.
Природные соединения
- FeS2 — пирит, колчедан ZnS — цинковая обманка PbS — свинцовый блеск (галенит), Sb2S3 — сурьмяный блеск, Bi2S3 — висмутовый блеск HgS — киноварь CuFeS2 — халькопирит Cu2S — халькозин CuS — ковеллин BaSO4 — барит, тяжелый шпат CaSO4 — гипс
В местах вулканической активности встречаются залежи самородной серы.
В промышленности серу получают из природного газа, который содержит газообразные соединения серы: H2S, SO2.
Серу можно получить разложением пирита
В лабораторных условиях серу можно получить слив растворы двух кислот: серной и сероводородной.
- Реакции с неметаллами
На воздухе сера окисляется, образуя сернистый газ — SO2. Реагирует со многими неметаллами, без нагревания — только со фтором.
При нагревании сера бурно взаимодействует со многими металлами с образованием сульфидов.
При взаимодействии с концентрированными кислотами (при длительном нагревании) сера окисляется до сернистого газа или серной кислоты.
Сера вступает в реакции диспропорционирования с щелочами.
Сера вступает в реакции с солями. Например, в кипящем водном растворе сера может реагировать с сульфитами с образованием тиосульфатов.
Сероводород — H2S
Бесцветный газ с характерным запахом тухлых яиц. Огнеопасен. Используется в химической промышленности и в лечебных целях (сероводородные ванны).
Сероводород получают в результате реакции сульфида алюминия с водой, а также взаимодействия разбавленных кислот с сульфидами.
Сероводород плохо диссоциирует в воде, является слабой кислотой. Реагирует с основными оксидами, основаниями с образованием средних и кислых солей (зависит от соотношения основания и кислоты).
KOH + H2S = KHS + H2O (гидросульфид калия, избыток кислоты)
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.
Сероводород — сильный восстановитель (сера в минимальной степени окисления S 2- ). Горит в кислороде синим пламенем, реагирует с кислотами.
Качественной реакцией на сероводород является реакция с солями свинца, при котором образуется сульфид свинца.
Оксид серы — SO2
Сернистый газ — SO2 — при нормальных условиях бесцветный газ с характерным резким запахом (запах загорающейся спички).
В промышленных условиях сернистый газ получают обжигом пирита.
В лаборатории SO2 получают реакцией сильных кислот на сульфиты. В ходе подобных реакций образуется сернистая кислота, распадающаяся на сернистый газ и воду.
Сернистый газ получается также в ходе реакций малоактивных металлов с серной кислотой.
С основными оксидами, основаниями образует соли сернистой кислоты — сульфиты.
Химически сернистый газ очень активен. Его восстановительные свойства продемонстрированы в реакциях ниже.
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства (понижать степень окисления).
Сернистая кислота
Слабая, нестойкая двухосновная кислота. Существует лишь в разбавленных растворах.
Диссоциирует в водном растворе ступенчато.
В реакциях с основными оксидами, основаниями образует соли — сульфиты и гидросульфиты.
H2SO3 + KOH = H2O + KHSO3 (соотношение кислота — основание, 1:1)
С сильными восстановителями сернистая кислота принимает роль окислителя.
Как и сернистый газ, сернистая кислота и ее соли обладают выраженными восстановительными свойствами.
Оксид серы VI — SO3
Является высшим оксидом серы. Бесцветная летучая жидкость с удушающим запахом. Ядовит.
В промышленности данный оксид получают, окисляя SO2 кислородом при нагревании и присутствии катализатора (оксид ванадия — Pr, V2O5).
В лабораторных условиях разложением солей серной кислоты — сульфатов.
Является кислотным оксидом, соответствует серной кислоте. При реакции с основными оксидами и основаниями образует ее соли — сульфаты и гидросульфаты. Реагирует с водой с образованием серной кислоты.
SO3 + 2KOH = K2SO4 + 2H2O (основание в избытке — средняя соль)
SO3 + KOH = KHSO4 + H2O (кислотный оксид в избытке — кислая соль)
SO3 — сильный окислитель. Чаще всего восстанавливается до SO2.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
- Реакции с неметаллами
Оксид серы — SO2
CuS — ковеллин.
Studarium. ru
20.11.2017 4:38:13
2017-11-20 04:38:13
Источники:
Https://studarium. ru/article/173
Общая характеристика VIA группы (халькогены). Кислород – характеристика элемента, получение, физические и химические свойства кислорода | Урок 27. Подготовка к ЕГЭ по Химии. Онлайн курсы | EXAMMY » /> » /> .keyword { color: red; } Халькогены подготовка к егэ
Подготовка к ЕГЭ по Химии | Задание 278 из 410
Подготовка к ЕГЭ по Химии | Задание 278 из 410
Урок 27. Общая характеристика VIA группы (халькогены). Кислород – характеристика элемента, получение, физические и химические свойства кислорода
В этом уроке мы рассмотрим общую характеристику VIA группы (халькогены) и подробно остановимся на самом распространенном элементе на Земле — кислороде – дадим характеристику элемента, рассмотрим его получение, физические и химические свойства простых веществ кислорода и озона, а также свойства пероксида водорода.
Просмотр данного видеоурока доступен на тарифе Премиум
Домашнее задание
- 1. Сделайте конспект урока. Выучите все реакции, напишите электронный баланс ко всем ОВР. К реакциям ионного обмена напишите полное и краткое ионное уравнение.
Дополнительные материалы
Остались вопросы? Задайте свой вопрос в сообщество учеников и преподавателей EXAMMY!
Подготовка к ЕГЭ по Химии | Задание 278 из 410
В этом уроке мы рассмотрим общую характеристику VIA группы (халькогены) и подробно остановимся на самом распространенном элементе на Земле — кислороде – дадим характеристику элемента, рассмотрим его получение, физические и химические свойства простых веществ кислорода и озона, а также свойства пероксида водорода.
Дополнительные материалы.
Exammy. ru
01.07.2020 18:04:14
2020-07-01 18:04:14
Источники:
Https://exammy. ru/courses/podgotovka-ege-himiya/halkogeny-kislorod-polychenie-svoistva/
VI а группа – халькогены – nS2nP4
1)
8O — H2+1O-2 ,
H2O2-1 ; O+2F2-1
16S — 2;O +2; +4; +6 НеМе О — самый
распространенный хими-
34Se — 2;O +2;
+4; +6 св-ва
ческий эл-т на Земле. O2 и O3;
ромби-
52Te — 2;O +2; +4;
+6 уб-ют
ческая, моноклинная S8, аморфный Se,
84Po — 2;O +2; +4;
+6 ЭО ум-ся
серый Se, неск-ко аллотропный видоизм.
2)
O3 –озон, сильный окислитель – Г, З, Ц
O3 = O + O2. Вдыхание O3 в больших количествах вредно.
3) Сера. В природе FeS2, FeCuS2,
MgS, Na2SO4 . 10H2O, CaSO4 . 2H2O
Встречается не
только в виде соединений, но и в свободном виде.
пирит
халькопирит мирабилит гипс
S нерастворима в H2O, но хорошо растворима в CS2 (сероуглероде)
1. с Ме – сульфиды 2Na+S Na2S
Fe + S = FeS
2.
c НеМе O2, F2, Cl2, Br2 (с N2 не
взаимодействует, нитрид образуется косвенно)
S + O2 SO2 H2
+ S =H2S
3. c кислотами:
S + 4HNO3 = SO2 + 4NO2
+ 2H2O S + 2H2SO4 = 3SO2
+ 2H2O
конц. конц.
4.
с щелочами:
3S
+ 6NaOH 2Na2S + Na2SO3 + 3H2O
Получение FeS2
= FeS + S
4)
Сероводород – H2S – Ц, З тухлых яиц, Яд, растворимый
в H2O
Сильный
восстановитель и слабая кислота:
H2S
+ 6HNO3 SO2 + 6NO2 + 4H2O
·
c Ме:
2H2S + 2Na 2NaHS + H2
·
c основными оксидами:
H2S
+ ZnO ZnS + H2O
·
с солями
H2S
+ Cu(NO3)2 CuS + 2HNO3,
PbS
черный
5H2S +
2KMnO4 + 3H2SO4 = 5S + 2MnSO4 + K2SO4
+ 8H2O
Окисление в водном растворе или при
недостатке O2:
2H2S + O2 = 2H2O +2S
2H2S + 3O2 (изб.) = 2SO2 + 2H2O
Окисляется галогенами в водном растворе:
H2S + 4Cl2 + 4H2O H2SO4
+ 8HCl
H2S + J2 = 2HJ + S
5)
Оксид S(IV) – SO2 – сернистый газ – Г, Ц, резкий З,
кислотный оксид.
H2SO3 – слабая кислота, 2 ряда солей: SO3-2 – сульфиты,
HSO3— — гидросульфиты. SO2 вытесняет слабые кислоты из солей: SO2 + Na2CO3 = CO2 + Na2SO3.
Гидросульфит-ион и SO2 вытесняются более сильными кислотами: Na2CO3 + CH3COOH NaHSO3 +
NaCH3COO
SO2 – вещество с 2-ой окислительно-восстановительной природой, с преобладающей
восстановительной функцией.
SO2
+ J2 + 2H2O 2HJ + H2SO4
SO2 + 2HNO3 (конц.) 2NO2 + H2SO4
2SO2
+ O2 2SO3 ( t, кат.)
SO2 + O3 =
SO3 + O2 (при комн. t)
2K2SO3 + O2 2K2SO4 (во
влажном воздухе)
4K2SO3 (t =
600o) = 3K2SO4 + K2S
Окислитель SO2 + 2H2S
3S + 2H2O (при комн. t)
SO2 + C (t) = S + CO2
Качественные
реакции на SO2:
I.
Обесцвечивание подкисленным раствором KMnO4:
5SO2
+ 2KMnO4 + 2H2O (H+) 2MnO4 +2H2SO4
+K2SO4
II.
Помутнение известковой воды:
Ca(OH)2(изб.)
+ SO2 CaSO3 + H2O
6)
SO3; H2SO4, соли сульфаты (щелочные Ме и NH3 образуют гидросульфаты)
Раствор SO3 в H2SO4(конц.)
Олеум
H2SO4 – Ц, сиропообразная Ж,
H2SO4 реагирует с Ме, до Н в ЭХР
Fe + H2SO4
= FeSO4 + H2
H2SO4 (конц.) — сильный окислитель,
восстанавливается до S+4
или S-2, реже до S, часто выделяется смесь продуктов, например в реакции с Zn – SO2, H2S и S, но основной
продукт — H2S; 4Zn + 5H2SO4 = 4ZnSO4 + H2S + 4H2O
H2SO4 (конц.) на холоде не реагирует с Al, Fe, Cr, при t с Cu, Ag, Hg
Cu + 2H2SO4 (t) CuSO4
+ SO2 + 2H2O
2Fe +
6H2SO4 (t) Fe2(SO4)3
+ 3SO2 + 6H2O
H2SO4(конц.) окисляет НеМе, графит
(С), Р, S
2H2SO4(конц.) + C 2SO2 + CO2 + 2H2O
H2SO4(конц.) + 2P = 3SO2 + 2H3PO4
2H2SO4(конц.) +
S 3SO2 + 2H2O
H2SO4(конц.) реагирует
со сложными веществами:
H2SO4(конц.) +8HJ 4J2 + H2S + 4H2O
H2SO4(конц.) + HBr = Br2 + SO2 + 2H2O
H2SO4(конц.) + H2S S + SO2 + 2H2O
С H2SO4(конц.) органические
вещества обугливаются:
6H2SO4(конц.) + C6H12O6 = 6C
+ 6H2SO4 + H2O
Сульфаты окислительными свойствами не обладают, при t окисляют
вещества
Na2SO4 + 4C(изб.)(t) = Na2S + 4CO
Качественная
реакция на H2SO4 и растворимые соли:
SO42-
+ Ba2+ = BaSO4 (белый)
Кислород (лат. Oxygenium) — элемент VIa группы 2 периода периодической таблицы Д.И. Менделеева. Первым открывает
группу халькогенов — элементов VIa группы.
Газ без цвета, без запаха, составляет 21% воздуха.

Общая характеристика элементов VIa группы
Общее название элементов VIa группы O, S, Se, Te, Po — халькогены. Халькогены (греч. χαλκος — руда + γενος —
рождающий) — входят в состав многих минералов. Например, кислород составляет 50% массы земной коры.
От O к Po (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.
Среди элементов VIa группы O, S, Se — неметаллы. Te, Po — металлы.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np4:
- O — 2s22p4
- S — 3s23p4
- Se — 4s24p4
- Te — 5s25p4
- Po — 6s26p4
Основное состояние атома кислорода
У атома кислорода (как и атомы азота, фтора, неона) нет возбужденного состояния, так как отсутствует свободная орбиталь с более
высоким энергетическим уровнем, куда могли бы перемещаться валентные электроны.
Атом кислорода имеется два неспаренных электрона, максимальная валентность II.

Природные соединения
- Воздух — в составе воздуха кислород занимает 21% (это число пригодится в задачах!)
- В форме различных минералов в земной коре кислорода содержится около 50%
- В живых организмов кислород входит в состав органических веществ: белков, жиров, углеводов и нуклеиновых кислот
Получение
В промышленности кислород получают из сжиженного воздуха. Также активно применяются кислородные установки, мембрана которых
устроена как фильтр, отсеивающие кислород (мембранная технология).
В лаборатории кислород получают разложением перманганата калия (марганцовки) или бертолетовой соли при нагревании. Применяется реакция
каталитического разложения пероксида водорода.
KMnO4 → K2MnO4 + MnO2 + O2↑
KClO3 → KCl + O2↑
H2O2 → (кат. — MnO2) H2O + O2
На подводных лодках для получения кислорода применяют следующую реакцию:
Na2O2 + CO2 → Na2CO3 + O2↑

Химические свойства
Является самым активным неметаллом после фтора, образует бинарные соединения со всеми элементами кроме гелия, неона, аргона. Чаще всего реакции
с кислородом экзотермичны (горение), ускоряются при повышении температуры.
- Реакции с неметаллами
- Реакции с металлами
- Горение воды
- Окисление органических веществ
- Контролируемое окисление
Во всех реакциях, кроме взаимодействия со фтором, кислород проявляет себя в качестве окислителя.
NO + O2 → (t) NO2
S + O2 → (t) SO2
2C + O2 = (t) 2CO (неполное окисление — угарный газ, соотношение 2:1)
C + O2 = (t) CO2 (полное окисление — углекислый газ, соотношение 1:1)
F + O2 → OF2 (фторид кислорода, O+2)

В реакциях кислорода с металлами образуются оксиды, пероксиды и супероксиды. Реакции с активными металлами идут без нагревания.
Li + O2 → Li2O (оксид)
Na + O2 → Na2O2 (пероксид)
K + O2 → KO2 (супероксид)
Известна реакция горения воды во фторе.
F2 + H2O → HF + O2

Все органические вещества сгорают с образованием углекислого газа и воды.
C3H7 + O2 = CO2 + H2O

При применении катализаторов и особых реагентов в органической химии достигают контролируемого окисления: алканы окисляются
до спиртов, спирты — до альдегидов, альдегиды — до кислот.
Процесс можно остановить на любой стадии в зависимости от желаемого результата.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Продолжаем наше путешествие по группам Периодической таблицы в рамках подготовки к успешной сдачи ЕГЭ по химии. Элементы главной подгруппы шестой группы имеют второе название – халькогены, что означает «рождающие руды». Такое наименование связано с тем, что основные месторождения руд – оксидные или сульфидные.
Это минералы халькозин, халькопирит. Так, сера по распространенности на Земле занимает 15 место, образуя соединения со многими металлами, в том числе и со ртутью. Большинство этих природных соединений – сульфиды: сульфид свинца, сульфид цинка, сульфид меди, сульфид железа. Уникальное месторождение соединения серы – сероводород – вода Черного моря. Так, на глубине 200 метров концентрация сероводорода уже может быть 100мг/л. Это – мертвая среда для всех животных, выжить могут только бактерии. Как раз последние активно используют сероводород. Некоторые для выработки энергии используют реакцию восстановления серы, превращая сульфат-ионы в сероводород, и иные используют реакцию окисления сероводорода с образованием серы.
В природе также встречается и самородная сера. Образуется в результате окисления выделяющегося из земных недр сероводорода. Это особенно частое явление в местах повышенной вулканической активности.
Основное состояние халькогенов – ns2np4 то есть у нас тут 2 неспаренных р-электрона. Степень окисления халькогенов в соединениях, как правило -2 и только в соединениях с кислородом сера, селен и теллур принимают положительные степени окисления +4 и(или) +6. Степень окисления +2 не характерна для халькогенов за исключением полония.
Присутствие двух неспаренных электронов в атоме дает возможность простым веществам образовывать либо кратную связь с двумя атомами в молекуле элемента, либо одинарной связи в цепочечной молекуле. В кислороде пи-связи аналогичны по прочности сигма-связям и образование кратной связи в молекуле энергетически выгоднее, нежели образование цепочечной структуры. Это обусловлено тем, что связанные ван-дер-ваальсовыми силами образуются более прочные и устойчивые виды простых веществ.
В случае серы наибольший энергетический выигрыш дает образование молекулы S8. Идет образование валентного угла между связями в цепи равным почти 90 градусам, за счет перпендикулярно расположенных р-орбиталей. Молекула имеет форму короны.
Кислород. Получение и химические свойства элемента.
В земной коре кислорода порядка 55%, в водной оболочке -86% кислорода. Растворимость кислорода в воде невысока. При нормальных условиях в 100 литрах воды растворяется только 3 литра кислорода. Элемент входит в состав почти всех веществ, из которых построена живая природа. В организме человека порядка 65% этого важного элемента.
В промышленных масштабах кислород получают из воздуха. Методом фракционной перегонки сжиженного воздуха. Хранение кислорода происходит под давлением в 150 атмосфер в стальных баллонах. В лаборатории вещество можно получить путем термического разложения некоторых веществ (к примеру оксидов)
Элемент имеет электронную конфигурацию 1s22sp4 . Ядро атома состоит из восьми протонов и восьми или десяти нейтронов. При стандартных условиях самая термодинамически устойчивая форма элемента – молекулярный кислород – малорастворимый в воде, бесцветный газ без вкуса и запаха.
Химические свойства кислорода в реакциях объяснимы присутствием в атоме двух неспаренных электронов и двух неподеленных электронных пар.
Два неспаренные электроны участвуют в образовании двух ковалентных связей – кратной связи элемент-кислород и одинарной связи из двух атомов элемент-кислород-элемент. Атом кислорода выступает в качестве своеобразного мостика между атомами элементов.
Неподеленные электронные пары дают кислороду возможность выступать донором в соединениях. Прочная связь атомов в молекуле кислорода объясняет большую энергию активации реакций с участием кислорода, а значит реакции при обычных условиях протекают крайне медленно. Что объясняет присутствие катализаторов в реакциях с кислородом. К примеру, в реакциях окисления катализатор – вода.
Высокие значения электроотрицательности атома поясняет его отрицательную степень окисления в любых соединениях за исключением фторидов. То есть кислород выступает везде в роли окислителя и всегда восстанавливается в ходе реакции.
С кислородом реагирую все элементы за исключением благородных газов, галогенов, серебра, золота, платины, отметим, что большинство металлов вступают в реакцию с кислородом только на поверхности и образуют прочную оксидную пленку.
Еще одна модификация кислорода – озон. В переводе с греческого означает «пахнущий». Вы его наверняка ощущали в момент грозы, либо вблизи с работающими электромашинами. Высокая концентрация этого газа есть в воздухе при обработке ультрафиолетовыми и ртутными лампами. В чистом виде это очень ядовитый газ. Реакционная способность озона на порядки выше
сильноозонированного воздуха. Он способен разрушать органические красители. Это сильный окислитель. В реакциях окисления работает только один атом кислорода. Большинство органических веществ воспламеняются в атмосфере озона или даже в обычных условиях окисляет серебро, ртуть, большинство сульфидов.
Его основное применение – дезинфекция, обеззараживание воды, применение в качестве окислителя в синтезах.
Сера. Получение и химические свойства.
Электронная конфигурация серы 1s22s2p63s2p43d10 Основной метод получения – окисление сероводорода, либо в рудной промышленности расплавом перегретым водяным паром и вытеснением на поверхность земли сжатым воздухом. Элемент входит в состав огромного количества белков в том числе альбумина. При разложении белка сера выделяется в виде сероводорода, именно поэтому тухлое яйцо имеет характерный запах сероводорода.
Сера представлена несколькими аллотропными модификациями (аллотропия – частный случай полиморфизма. Существование элемента в виде двух или нескольких простых веществ)
Ромбическая сера – вещество желтого цвета, состоящая из кристаллов S8, синтезируется из кристаллов CS2 Нагревание до 96 градусов по шкале Цельсия ромбическую серу переводит в следующую полиморфную модификацию – моноклинную серу, образовываемую при кристаллизации расплава Последняя представляет собой кольца S8, устойчивые к воздействию до температуры 160 градусов по Цельсию. Выше этого предела происходит разрыв цепей на короткие фрагменты. Вязкость вещества резко снижается. При охлаждении полученного расплава (резком охлаждении) образуется пластическая сера – резиноподобное вещество черного цвета. При этом если эту массу оставить в покое на несколько дней, то мы снова получим ромбическую серу.
Какие реакции характерны для серы? Все твердофазные реакции с этим веществом в обычных условиях не протекают. На холоде сера реагирует с фтором, хлором, ртутью.
А вот в жидкой фазе или в газовой реакционная способность резко увеличивается. Так происходит реакция горения в атмосфере серы цинковой пыли и меди с железом.
При повышении температуры сера вступает в реакцию с водородом с образованием гидрида, с кислородом образует диоксид серы.
Не реагирует с азотом, золотом, платиной и благородными газами.
Основная масса серы идет на производство серной кислоты, еще часть используется в резиновой промышленности. Также важен синтез дисульфида углерода, применяемого в качестве растворителя. Сера важна в сельском хозяйстве и в медицине.
Халькогены — это группа химических элементов, которые размещены в главной подгруппе 6 группы периодической таблицы Менделеева.
Интересно узнать, почему они так названы. А все потому, что в природе они очень часто встречаются в виде соединений с медью (на греческом «chalkos» — медь и «genos» — рожденный).
Описание и общая характеристика
Родоначальник этой группы — кислород. Кроме него сюда входят такие элементы как селен, сера, теллур и полоний.
Среди них: неметаллы — сера и кислород, промежуточные элементы между металлами и неметаллами — теллур и селен, и один металл — полоний.
С уменьшением порядочного номера элементов группы радиус атомов уменьшается, поэтому наименьший радиус имеется у кислорода, а наибольший — у полония.
Строение молекул и физические свойства
Электронная конфигурация атомов этих элементов характеризуется шестью электронами на внешнем энергетическом уровне.
Все халькогены могут проявлять разные степени окисления: для кислорода это -2 и +2 (в соединении с фтором), для атома теллура, а также для селена и серы это +2, +4 и +6.
Для кислорода и серы характерно такое свойство как аллотропия. Так как у них есть два неспаренных электрона, то возможны разные варианты строения простых веществ. Например, в зависимости от того, какую связь образует элемент О (кислород) — двойную или тройную, соответственно различают кислород и озон.
Также образовывать аллотропные вещества может сера, создавая многоатомные циклы и цепи.
Аллотропные модификации элементов имеют также различные физические свойства: такие характеристики как растворимость в воде и температура кипения у озона намного выше, чем у кислорода, а виды многоатомных цепей у серы такие как ромбическая и моноклинная, в отличие от пластической — растворяются в органических жидкостях, но при этом все они не растворяются в воде.
Химические свойства халькогенов
Кислород, как наиболее элетроотрицательный элемент этой группы — может выступать окислителем почти всех простых и некоторых сложных веществ.
Только взаимодействуя со фтором он выступает в качестве восстановителя с положительной степенью окисления. С неметаллами он взаимодействует при довольно высоких температурах.
Так как сера имеет высокую реакционную способность (особенно если она находится в твёрдом агрегатном состоянии, а не в расплаве) — она может соединяться почти со всеми простыми веществами, кроме инертных газов.
Её скорость взаимодействия с водородом и хлором увеличивается с увеличением температуры. Также она может гореть во фторе и окисляться при высоких температурах с образованием оксида серы.
Полоний, селен и теллур хотя и не имеют такой большой реакционной способности, как у двоих предыдущих представителей этой группы элементов, тем не менее — так же могут реагировать почти со всеми простыми веществами. Селениды, полониды и теллуриды металлов именуются наиболее устойчивыми.
Всем халькогенам характерна реакция диспропорционирования (в виде взаимодействия с водой).
Биологическая роль халькогенов
В этой группе есть как элементы, жизненно необходимые, так и те, биологическую роль которых не обнаружили. К первым относится сера, селен и, как ни странно, кислород; ко вторым — теллур и полоний.
Представители первой группы имеют место в составе биомолекул организма человека. Главное значение здесь по праву принадлежит кислороду.
Он окисляет питательные вещества, в результате чего выделяется энергия, необходимая для жизнедеятельности, принимает участие в защитных свойствах организма, также в медицине огромную роль играет его применение при различных заболеваниях, по причине которых у человека нарушаются дыхательные функции.
Другая форма кислорода — озон — используется для обеззараживания воздуха и дезинфекции помещений. Ещё его применяют для очистки питьевой воды. В природе его можно обнаружить в воздухе из-за характерного чувства приятной свежести и некоего запаха.
Теперь поговорим о сере. Она также, как и предыдущий элемент, относится по содержанию в организме к макроэлементам. Чтобы понять её большое значение, достаточно сказать, что она входит в состав таких биомолекул как белки, аминокислоты, гормоны, витамины.
Также её обнаружили в составе костей, в нервной ткани и в каротине волос. Кроме всего этого она некоторым образом участвует и в защитной системе организма, обезвреживая ядовитые соединения.
И последний представитель «полезных» элементов — селен. Хотя его относят к микроэлементам, но для организма он жизненно необходимым.
Селен может выступать в различных соединениях в роли аналога серы, замещая её. Его также обнаружили в составе некоторых ферментов.
Находясь в активном центре одного из них — он участвует в защите клеток от действия пероксида водорода и органических пероксидов. Физиологическая роль этого элемента в процессе жизнедеятельности доказывается его способностью предохранять ткани от некроза. Ещё одна из функций селена — предохранение от отравления кадмием и ртутью.
Поэтому, если обобщить: сера и кислород — жизненно необходимые, селен — физиологически активен, а роль полония и теллура не обнаружена.
Решение задач и выполнение упражнений по материалам ЕГЭ по теме «Халькогены»
1. Верны ли следующие суждения о свойствах кислорода и серы?
А. Максимальная валентность этих элементов в соединениях равна номеру группы.
Б. При взаимодействии с водородом кислород и сера проявляют окислительные свойства.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
2. В двух пробирках находился раствор сульфида аммония. В первую пробирку добавили раствор вещества Х, а во вторую — раствор вещества Y. В первой пробирке выпал белый осадок и выделился газ, а во второй пробирке образовался тёмный осадок. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) HCl 2) CuSO4 3) AlCl3 4) NaOH 5) NaCl
3. Из предложенного перечня веществ (перманганат калия, гидрокарбонат калия, сульфит натрия, сульфат бария, гидроксид калия; допустимо использование водных растворов) выберите вещества, между которыми возможна окислительно-восстановительная реакция. Запишите уравнение только одной из возможных окислительно-восстановительных реакций, используя не менее двух веществ из предложенного перечня. Составьте электронный баланс, укажите окислитель и восстановитель.
4. Из предложенного перечня веществ (хлорид меди (II), нитрат натрия, перманганат калия, сульфат натрия, сульфид калия; допустимо использование водных растворов) выберите вещества, между которыми возможна окислительно-восстановительная реакция. Запишите уравнение только одной из возможных окислительно-восстановительных реакций, используя не менее двух веществ из предложенного перечня. Составьте электронный баланс, укажите окислитель и восстановитель.
5. Вычислите массу кислорода (в граммах), необходимого для полного сжигания 6,72 л (н.у.) сероводорода.
6. В результате реакции, термохимическое уравнение которой
Fe + S = FeS + 1200 кДж,
выделилось 480 кДж теплоты. Какая объем масса серы при этом вступила в реакцию?
7. Вычислите массу воды (в граммах), которую следует добавить к 55 г раствора сероводорода с массовой долей 30%, чтобы уменьшить концентрацию раствора до 12%.
Решение задач и выполнение упражнений по материалам ЕГЭ по теме «Халькогены»
1. Верны ли следующие суждения о свойствах кислорода и серы?
А. Максимальная валентность этих элементов в соединениях равна номеру группы.
Б. При взаимодействии с водородом кислород и сера проявляют окислительные свойства.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
2. В двух пробирках находился раствор сульфида аммония. В первую пробирку добавили раствор вещества Х, а во вторую — раствор вещества Y. В первой пробирке выпал белый осадок и выделился газ, а во второй пробирке образовался тёмный осадок. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) HCl 2) CuSO4 3) AlCl3 4) NaOH 5) NaCl
3. Из предложенного перечня веществ (перманганат калия, гидрокарбонат калия, сульфит натрия, сульфат бария, гидроксид калия; допустимо использование водных растворов) выберите вещества, между которыми возможна окислительно-восстановительная реакция. Запишите уравнение только одной из возможных окислительно-восстановительных реакций, используя не менее двух веществ из предложенного перечня. Составьте электронный баланс, укажите окислитель и восстановитель.
4. Из предложенного перечня веществ (хлорид меди (II), нитрат натрия, перманганат калия, сульфат натрия, сульфид калия; допустимо использование водных растворов) выберите вещества, между которыми возможна окислительно-восстановительная реакция. Запишите уравнение только одной из возможных окислительно-восстановительных реакций, используя не менее двух веществ из предложенного перечня. Составьте электронный баланс, укажите окислитель и восстановитель.
5. Вычислите массу кислорода (в граммах), необходимого для полного сжигания 6,72 л (н.у.) сероводорода.
6. В результате реакции, термохимическое уравнение которой
Fe + S = FeS + 1200 кДж,
выделилось 480 кДж теплоты. Какая объем масса серы при этом вступила в реакцию?
7. Вычислите массу воды (в граммах), которую следует добавить к 55 г раствора сероводорода с массовой долей 30%, чтобы уменьшить концентрацию раствора до 12%.