Задумайтесь! Мы с вами состоит из миллиардов атомов. Все атомы находятся в круговороте, и
все атомы, которыми мы обладаем, в ком-то и где-то находились те 4,5 млрд. лет, которые существует Земля. Они были частями
животных, растений, грибов и бактерий — а сейчас принадлежат нам на короткое время.

С химической точки зрения ответ на вопрос «Жив ли изучаемый объект?» — не представляется возможным. Понятию «жизнь» дано
колоссальное количество определений. Жизнь — это самовоспроизведение с изменением, способ существования белковых тел,
постоянный обмен веществ с внешней средой.
Мы приступаем к изучению неорганических и органических веществ клетки. Начнем с неотъемлемого компонента клетки,
благодаря которому жизнь на Земле в принципе стала возможна — вода.
Вода
Составляет 60-80% массы клетки. Молекула воды обладает уникальным свойством — полярностью, которое возникает из-за
разницы в электроотрицательности (ЭО) между атомами кислорода и водорода (у кислорода ЭО больше).

Поскольку молекула воды полярна, ее называют диполь. Между молекулами воды возникают непрочные водородные связи:
водородная связь начинается от отрицательно заряженного атома кислорода (2δ—) одной молекулы воды и
тянется до положительно заряженного атома водорода другой молекулы воды (δ+)
По отношению к воде все вещества можно подразделить на два типа:
- Гидрофильные (греч. hydro — вода и philéo — люблю) — вещества, которые хорошо растворяются в воде. Гидрофильными
веществами являются сахара, соли, альдегиды, спирты, аминокислоты. - Гидрофобные (греч. hydro — вода и phobos — страх) — вещества, которые не растворяются в воде. Гидрофобными
веществами являются жиры.
Роль воды в клетке трудно переоценить. Ее функции и свойства крайне важны:
- Вода — универсальный растворитель
- Вода — терморегулятор
- Вода — реагент
- Транспортная функция
- Структурная функция
Большинство реакций, которые протекают в клетке, идут в растворе (водной среде). Полярность молекулы воды позволяет
ей быть отличным растворителем для других гидрофильных (полярных) веществ.
Вода может поглощать теплоту при минимальном изменении температуры. Это настоящее «спасение» для клеток: чуть только
температура меняется, вода начинает поглощать избыток тепла, защищая клетку от перегревания. Выделяясь на поверхность
кожи с потом, вода испаряется, поверхность кожи при этом охлаждается.
Она не только создает среду для реакций в клетке, но и сама активно участвует во многих из них. Расщепление питательных
веществ, попавших в клетку, происходит за счет реакции гидролиза (греч. hydro — вода и lysis — расщепление).
Питательные вещества, газы перемещаются по организму с током крови. Вода составляет 90-92% плазмы крови, является ее основным
компонентом. С помощью воды происходит не только доставка веществ к клеткам, но и удаление из организма побочных продуктов
обмена веществ.

Вода придает тканям тургор (лат. turgor — наполнение) — внутреннее осмотическое давление в живой клетке, создающее
напряжение оболочек клеток. Вода составляет от 60 до 95% цитоплазмы, придает клеткам форму. Изменение тургора клеток растений
приводит к перемещениям их частей, раскрытию устьиц, цветков.
Осмотическое давление — избыточное гидростатическое давление на раствор, отделенный от чистого растворителя с
помощью полупроницаемой мембраны.
Главное — понимать суть: если мы поместим живую клетку в гипертонический раствор, то
вода (растворитель) устремится из клетки в раствор (в сторону большей концентрации соли) — это приведет к сморщиванию
клеток.
Если же клетка окажется
в гипотоническом растворе, то вода извне устремится внутрь клетки (опять-таки в сторону большей концентрации солей),
приводя при этом к разбуханию (и возможному разрыву) клетки.

Элементы
Живая клетка — кладезь элементов таблицы Менделеева. Процент содержания различных элементов отличается, в связи с чем все они делятся на
3 группы:
- Биогенные (основные) — C, H, O, N. Входят в состав органических соединений, составляют основную часть клетки
- Макроэлементы (греч. makrós — большой) — составляют десятые и сотые доли в клетке: K, Na, Ca, Mg, Cl, P, S
- Микроэлементы (греч. mikrós — маленький) — составляют тысячные доли в клетке: Zn, Cu, I, Co, Mn, Fe
Процентное содержание элемента не коррелирует с его важностью и биологической значимостью. Так, к примеру, микроэлемент
I играет важную роль в синтезе гормонов щитовидной железы: тироксина, трийодтиронина. За нормальные рост и развитие
организмов отвечают Zn, Mn, Cu.
Благоприятно влияют на сперматозоиды Zn, Ca, Mg, защищая их от оксидативного стресса (окисления). Невозможным становится
нормальное образование эритроцитов без должного уровня Fe и Cu.

Соли
В водной среде клетки соли диссоциируют (распадаются) на положительно заряженные ионы — катионы (Na+, K+,
Ca2+, Mg2+) и отрицательно заряженные — анионы (Cl—, SO42-,
HPO42-, H2PO4—).
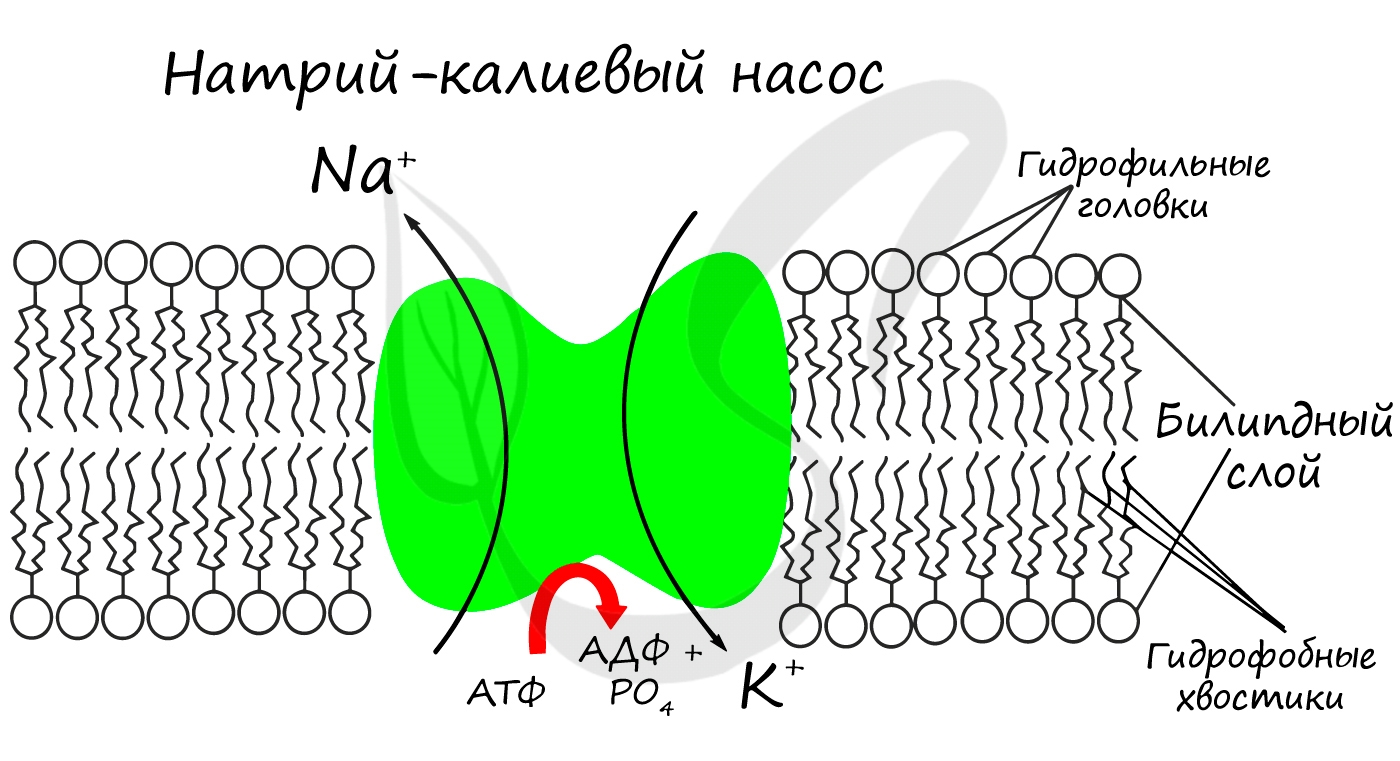
Для процессов возбуждения клетки (нейрона, миоцита — мышечной клетки) внутри клетки должна поддерживаться низкая концентрация ионов Na+ и высокая концентрация ионов K+. В окружающей клетку среде все наоборот: много Na и мало K. В мембране существует
специальный натрий-калиевый насос, который поддерживает необходимое равновесие. Если это
соотношение нарушится, то нейрон не сможет сгенерировать нервный импульс, а клетка мышцы — сократиться.
Соли в клетке и организме выполняют ряд важных функций:
- Участвуют в активации ферментов
- Создают буферные системы (бикарбонтаную, фосфатную, белковую)
- Поддерживают кислотно-щелочное состояние (КЩС)
- Создают осмотическое давление клетки
- Создают мембранный потенциал клеток (натрий-калиевый насос)
- Являются основным минеральным составляющим скелета внутреннего и наружного (у моллюсков)

Мы переходим к органическим компонентам клетки, к которым относятся: жиры, углеводы, белки и нуклеиновые кислоты.
Белки, или пептиды (греч. πεπτος — питательный)
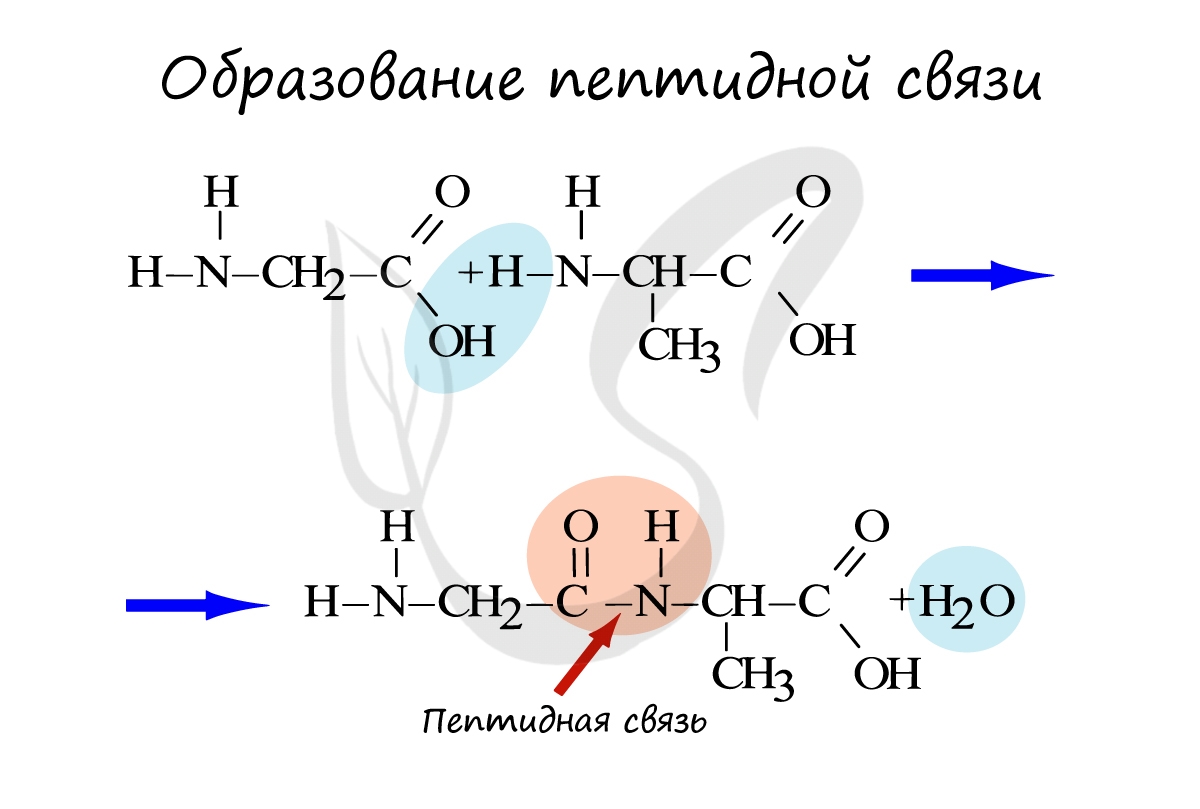
Белки — полимеры, мономерами которых являются аминокислоты. Белки представляют линейную структуру, образованную из
длинной цепи аминокислот, между которыми возникают пептидные связи. Пептидная связь образуется между карбоксильной
группой (COOH) одной аминокислоты и аминогруппой другой аминокислоты (NH2).
Между понятиями пептиды и белки существует определенная разница. Белки состоят из сотен тысяч аминокислот. Пептидами
называют небольшие белки, содержащие до 10 аминокислот. Ими являются некоторые гормоны: окситоцин,
вазопрессин, тиреолиберин — эти пептиды выполняют регуляторную функцию.
Выделяется несколько уровней пространственной организации белка:
- Первичная — полипептидная цепь, в которой аминокислоты расположены линейно
- Вторичная — полипептидная цепь закручивается в спираль, формируется α или β структура
- Третичная — спирали скручиваются в глобулу (лат. globulus — шарик)
- Четвертичная — образуется у сложных белков путем соединения нескольких глобул

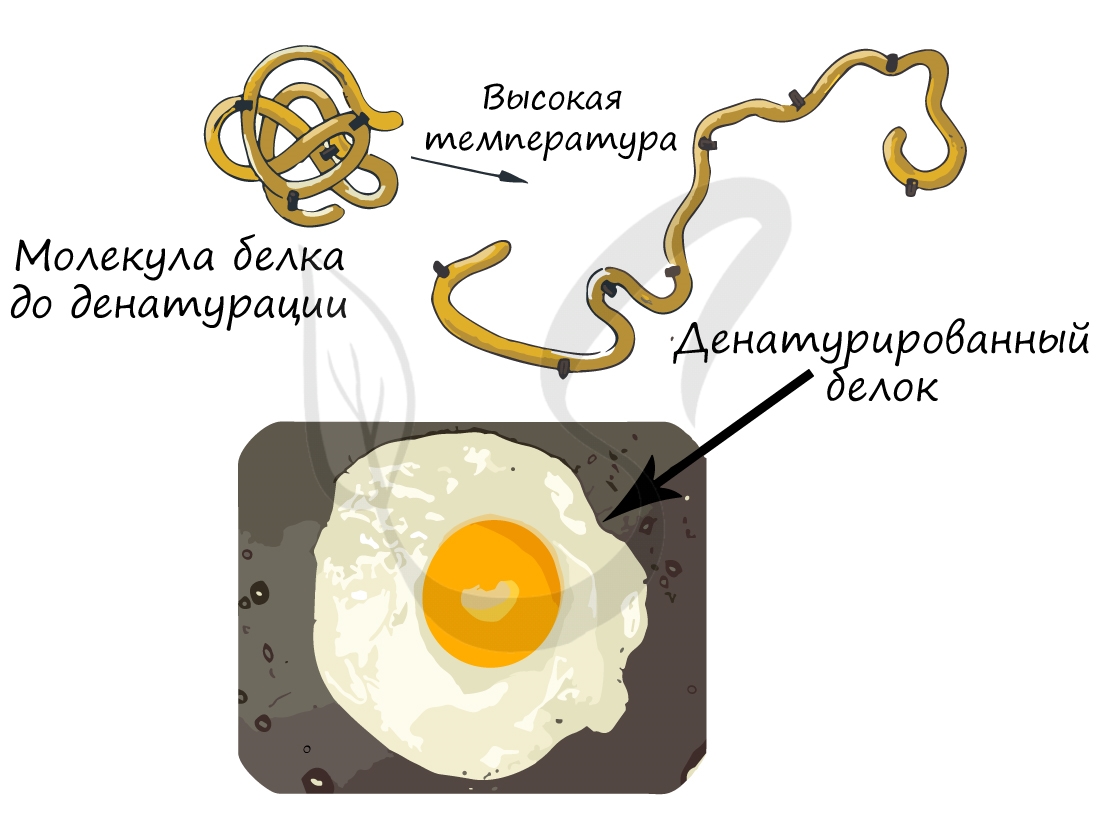
При резком изменении оптимальных для белка условий он подвергается денатурации: при этом происходит переход от
высших структур организации к низшим, или «раскручивание белка». Важно заметить, что аминокислотная последовательность (первичная структура белка) при этом не меняется, однако свойства белка меняются кардинально (теряется его гидрофильность).
Осмелюсь сделать заявление: вы часто начинаете свой день с денатурации белка. Простейший способ провести такой
эксперимент — пожарить яичницу. Заметьте, что изначально яичный белок прозрачный и текучий, но по итогу жарки эти свойства
утрачиваются: он становится непрозрачным и вязким.
Завершаем тему о белках изучением их функций:
- Каталитическая (греч. katalysis — разрушение)
- Строительная
- Регуляторная
- Защитная
- Энергетическая
- Транспортная
- Сократительная
- Рецепторная
Белки — природные катализаторы, ускоряющие реакции в организме в десятки и сотни тысяч раз. Эту роль главным образом
выполняют белки-ферменты (энзимы).
Иногда в состав белков входят так называемые ко-факторы — небелковые соединения,
которые необходимы ферменту для его биологической активности (в роли ко-факторов могут выступать Zn2+,
Mg2+).
Белки входят в состав клеточных мембран. Сложные белки: коллаген, эластин — входят в состав соединительных тканей организма,
придавая им некоторую прочность и эластичность.
Некоторые гормоны, регулирующие обменные процессы в организме, имеют белковое происхождение: инсулин, глюкагон,
адренокортикотропный гормон (АКТГ).
Говоря об этой функции, прежде всего, стоит вспомнить об антителах — иммуноглобулинах, которые синтезируют B-лимфоциты.
Антитела нейтрализуют чужеродные организму антигены (разрушают бактерии).

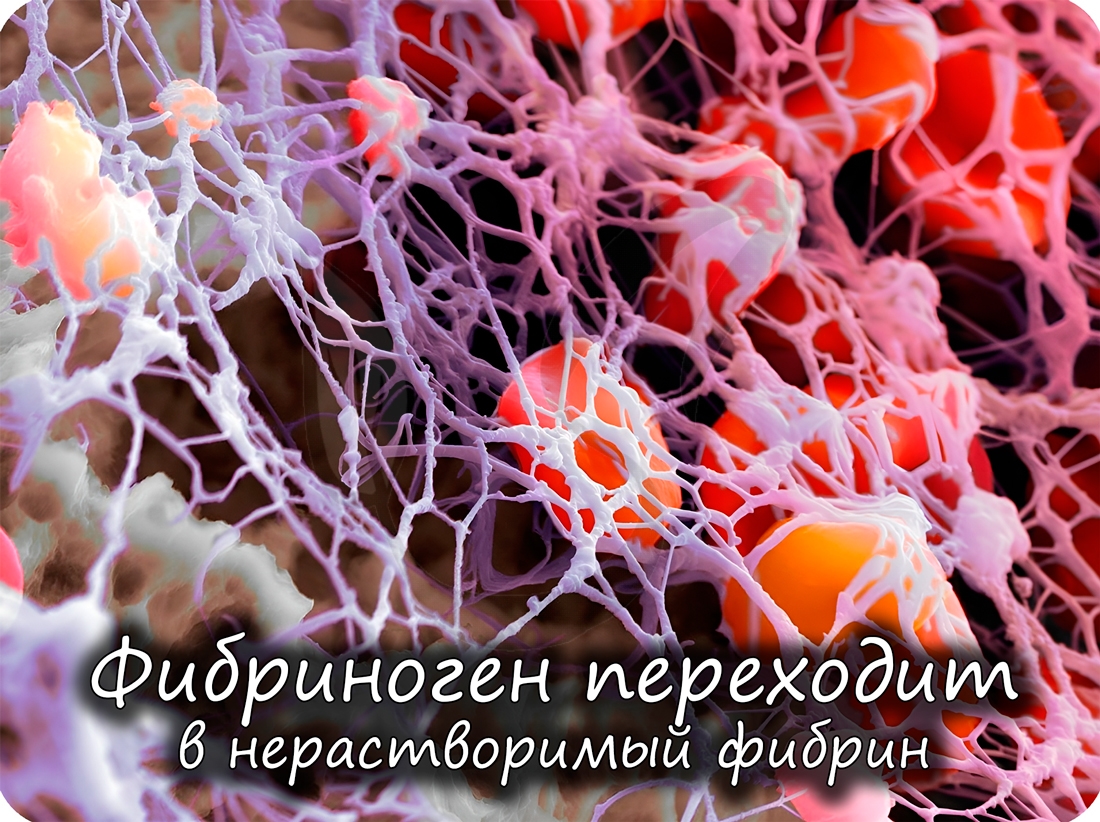
Помимо антител, защитную функцию выполняют
также белки свертывающей системы крови (тромбин и фибриноген): они предохраняют организм от кровопотери.
При недостаточном питании в организме начинают окисляться молекулы белков. При расщеплении 1 г белков выделяется 17,6 кДж энергии.
Некоторые белки крови способны присоединять к себе и переносить различные молекулы. Альбумины участвуют в транспорте
жирных кислот, глобулины — гормонов и некоторых ионов (Fe, Cu). Основной белок эритроцитов — гемоглобин — способен
переносить кислород, углекислый и угарный газы (угарный конечно нежелательно ему переносить, будет отравление)
Двигательные белки, актин и миозин, на уровне саркомера обеспечивают сокращение мышц. При возбуждении мышечной
ткани тонкие нити актина начинают тереться о толстые нити миозина, приводя к сокращению.
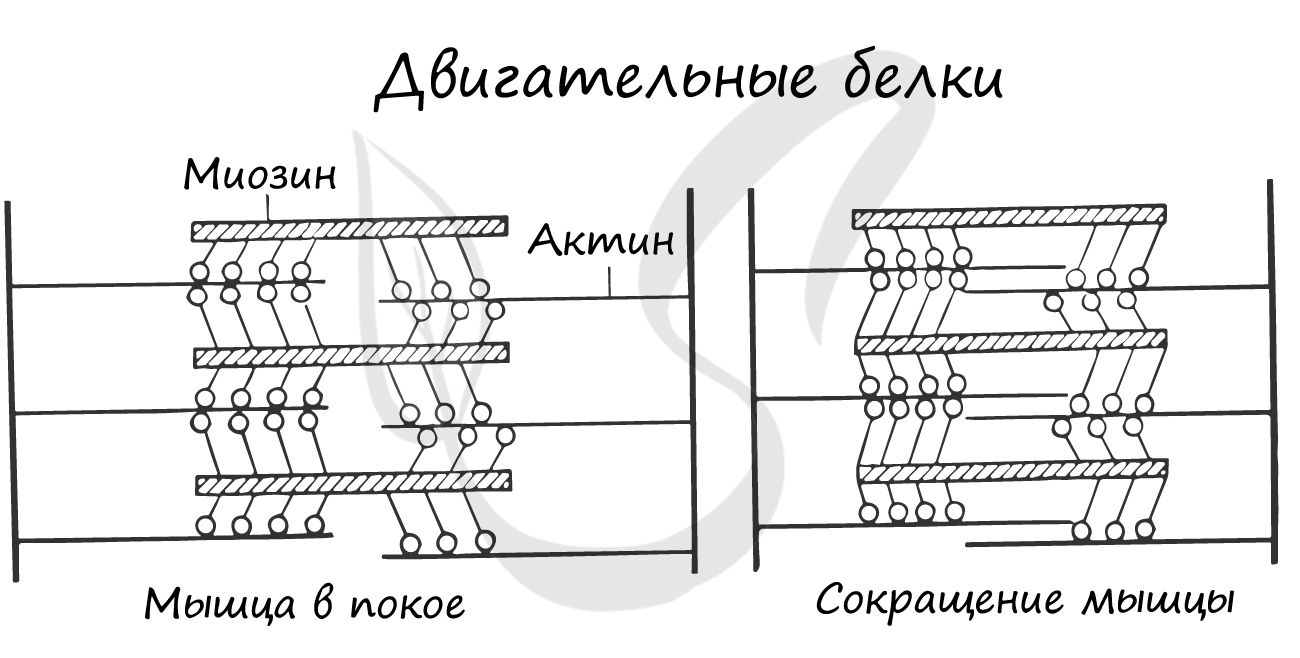
На поверхности мембраны белки образуют многочисленные рецепторы, которые, соединяясь с гормонами, приводят к
изменению обмена веществ в клетке. Таким образом, гормоны реализуют воздействие на клетки органов-мишеней.
Жиры, или липиды (греч. lipos — жир)
С химической точки зрения жиры являются сложными эфирами, образованными трехатомным спиртом глицерином и высшими
карбоновыми кислотами (жирными кислотами). Среди их свойств надо выделить то, что они практически нерастворимы
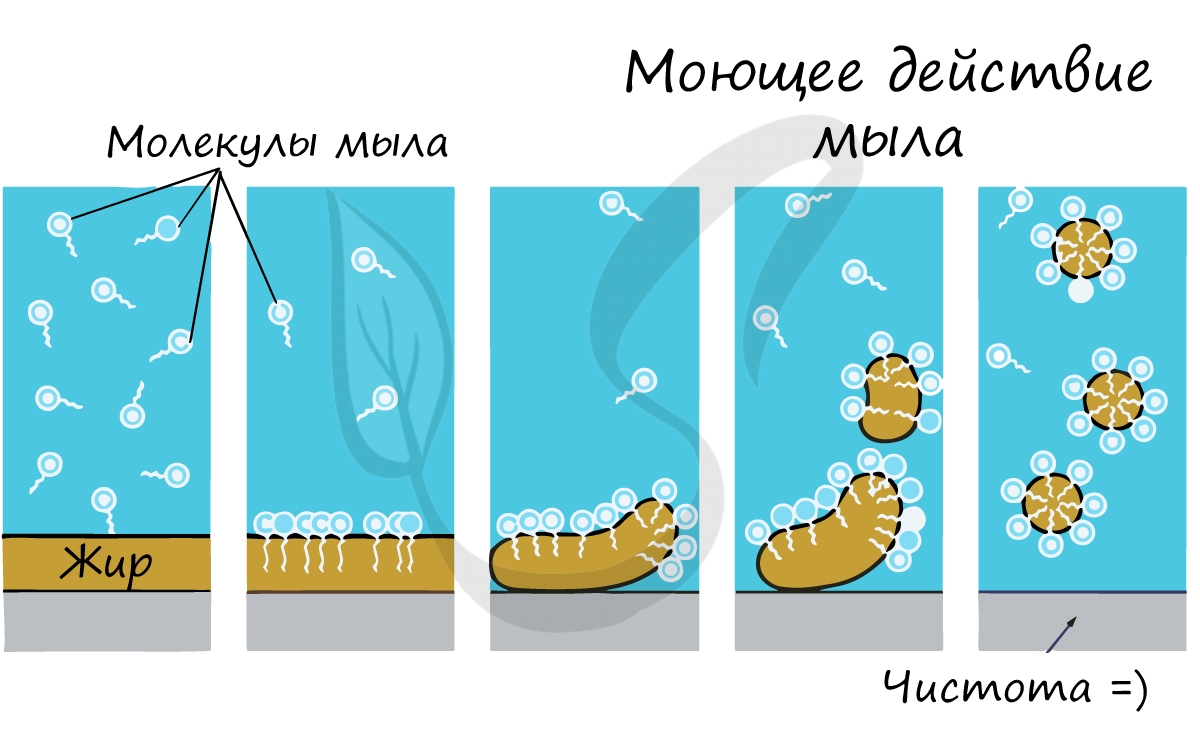
в воде. Вспомните, как тяжело смыть жир с рук водой.
Почему именно мыло смывает жир с рук? Дело в том, что молекула мыла повторяет свойства жира: одна часть ее гидрофобна,
а другая гидрофильна. Мыло соединяется с молекулой жира гидрофобной частью, и вместе они легко смываются водой.
Приступим к изучению функций жиров:
- Энергетическая
- Запасающая
- Структурная
- Терморегуляция
- Гормональная
- Участие в обмене веществ (метаболизме)
При окислении жиров выделяется много энергии: 1 г — 38,9 кДж. Это вдвое больше выделяющейся энергии при расщеплении
1г углеводов.
Жиры имеют способность накапливаться в клетках, расположенных в подкожно-жировой клетчатке, внутренних органах.
Эти запасы являются резервом организма на случай голодания или при недостаточном питании.
В жирах также запасается вода: в 100 г жира содержится 107 мл воды. Многим пустынным животным (верблюдам)
жировые запасы помогают длительное время обходиться без воды.
Жиры входят в состав биологических мембран клеток человека вместе с белками. Из фосфолипидов построены мембраны всех
клеток органов и тканей!
Так, к примеру, холестерин — обязательный компонент мембраны, придает ей определенную жесткость и совершенно необходим
для нормальной жизнедеятельности (заболевания возникают только при нарушении липидного обмена).

Жиры обладают плохой теплопроводностью. Располагаясь в подкожно-жировой клетчатке, они образуют термоизолирующий слой.
Особенно хорошо он развит у ластоногих (моржи и тюлени), китов, защищает их от переохлаждения.
Некоторые гормоны по строению относятся к жирам: половые (андрогены — мужские и эстрогены — женские), гормон
беременности (прогестерон), кортикостероиды.
Производное жира — витамин D — принимает важное участие в обмене кальция и фосфора в организме. Он образуется
в коже под действием ультрафиолетового излучения (солнечного света). При недостатке витамина D возникает заболевание —
рахит.

Углеводы
Представляют собой органические соединения, состоящие из одной или нескольких молекул простых сахаров. Выделяется три основных
класса углеводов:
- Моносахариды (греч. monos — единственный)
- Олигосахариды (греч. ὀλίγος — немногий)
- Полисахариды
Простые сахара, легко растворяющиеся в воде и имеющие сладкий вкус. Моносахариды подразделяются на гексозы (имеют 6 атомов углерода)
— глюкоза, фруктоза, и пентозы (имеют 5 атомов углерода) — рибоза и дезоксирибоза, входящие в состав нуклеиновых кислот.
При гидролизе олигосахариды распадаются на моносахариды. В состав олигосахаридов может входить от 2 до 10 моносахаридных остатков.
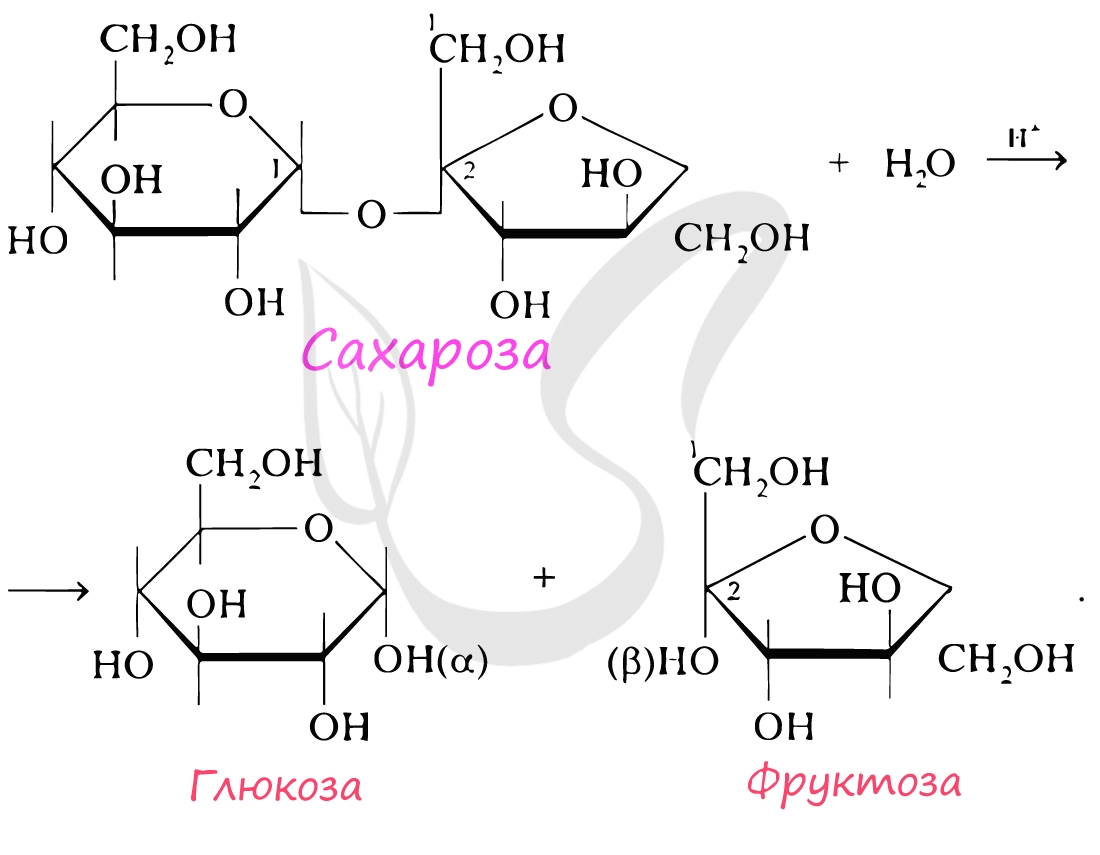
Если в состав олигосахарида входят 2 остатка моносахарида, то его называют дисахарид. К дисахаридам относятся сахароза, лактоза,
мальтоза. При гидролизе сахароза распадается на глюкозу и фруктозу.
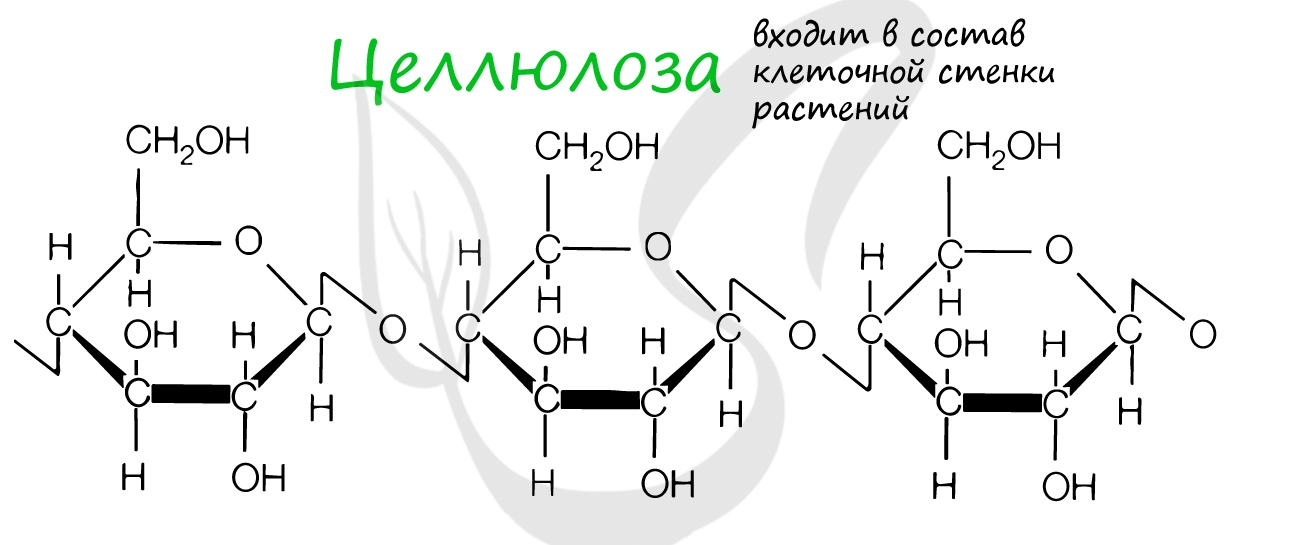
Это биополимеры, в состав которых входят сотни тысяч моносахаридов. Они обладают высокой молекулярной массой,
нерастворимы в воде, на вкус несладкие.
Крахмал, целлюлоза, гликоген, хитин и муреин — все это биополимеры. Давайте вспомним, где они находятся.
Клеточная стенка образована: у растений — целлюлозой, у грибов — хитином, у бактерий — муреином. Запасным питательным
веществом растений является крахмал, животных — гликоген.
Перечислим функции, которые выполняют углеводы:
- Энергетическая
- Запасающая
- Структурная (опорная)
В результате расщепления 1 г углеводов высвобождается 17,6 кДж энергии.
Запасным питательным веществом растений и животных соответственно являются крахмал и гликоген. Расщепление гликогена позволяет
нам оставаться в сознании и быть активными между приемами пищи.
Гликоген представляет собой разветвленную молекулу, состоящую
из остатков глюкозы. За счет больших размеров такая молекула хорошо удерживается в клетке, а ее разветвленность позволяет ферментам
быстро отщеплять множество молекул глюкозы одновременно.
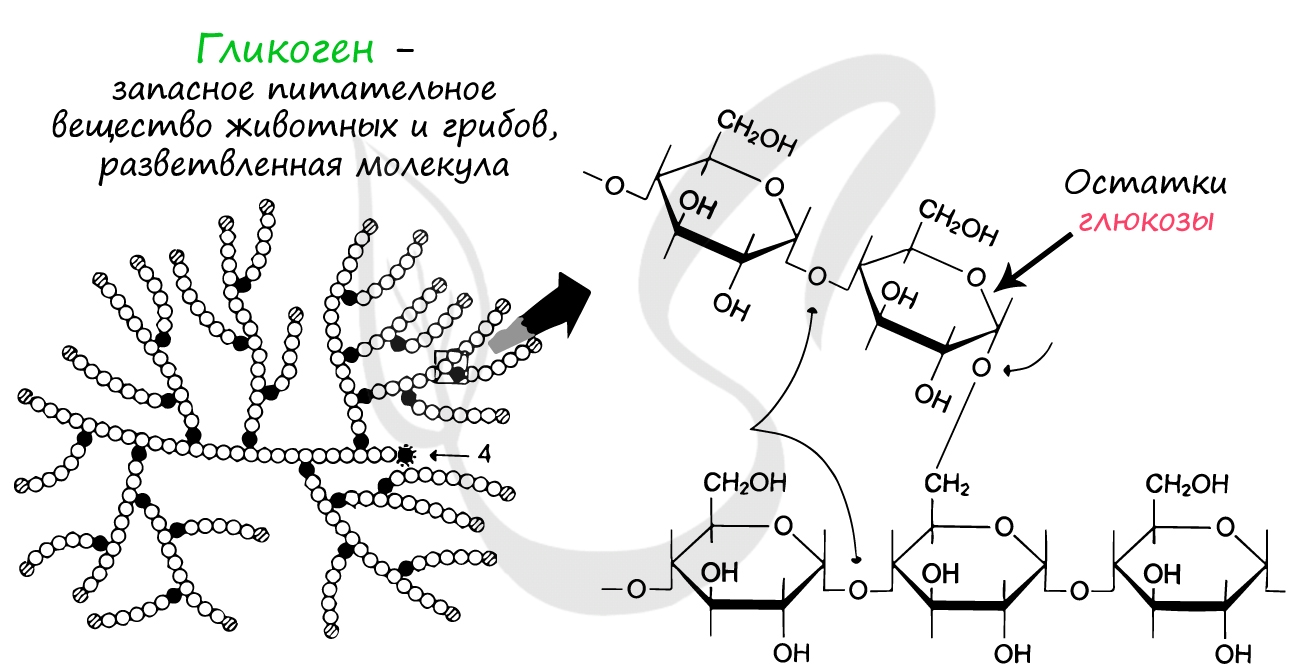
Существуют заболевания, при которых распад
гликогена нарушается: в результате нейроны не получают глюкозы (источника энергии, соответственно не синтезируются и молекулы АТФ). Из-за этого становятся возможны частые потери сознания.
Целлюлоза входит в состав клеточных стенок растений, придавая им необходимую твердость. Хитин образует клеточную стенку
грибов и наружный скелет членистоногих.

Нуклеиновые кислоты (от лат. nucleus — ядро)
Высокомолекулярные органические соединения, представленные двумя видами: ДНК (дезоксирибонуклеиновые кислоты) и РНК
(рибонуклеиновые кислоты). ДНК и РНК — биополимеры, мономером которых является нуклеотид. Запомните, что нуклеотид
состоит из 3 компонентов:
- Азотистое основание
- Остаток сахара
- Остаток фосфорной кислоты — фосфат
Для ДНК характерны следующие азотистые основания: аденин — тимин, гуанин — цитозин; для РНК: аденин — урацил,
гуанин — цитозин. Исходя из принципа комплементарности, данные основания соответствуют друг другу, в результате
чего между ними образуются связи.
Между аденином и тимином образуется 2 водородные связи, а между гуанином и цитозином — 3.
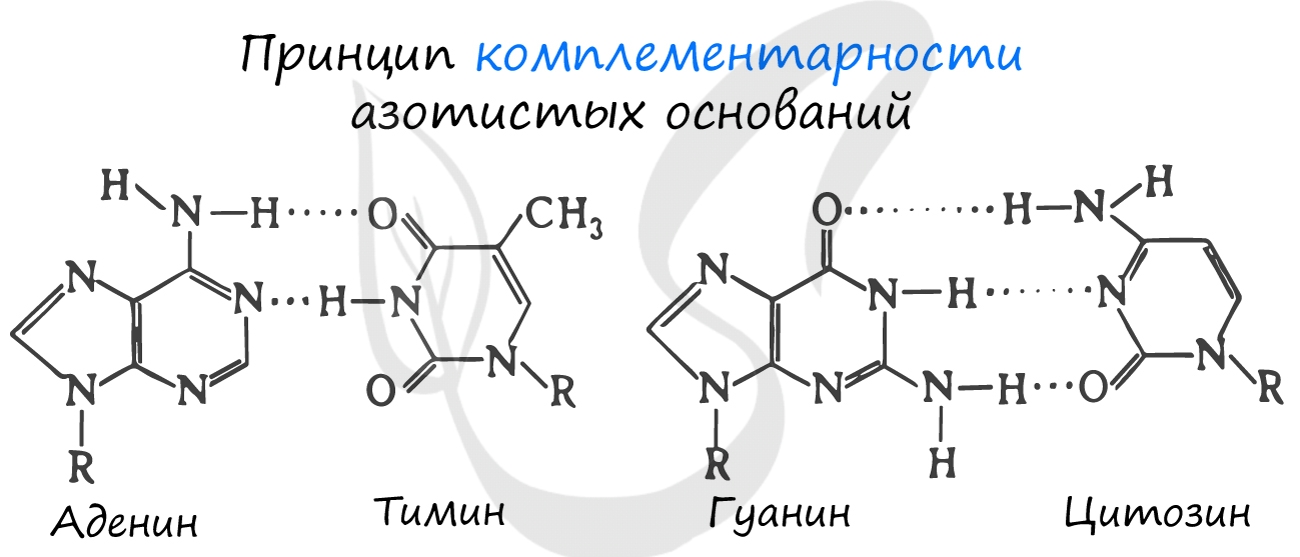
Именно по этой причине количество аденина в молекуле ДНК всегда совпадает с количеством тимина. К примеру, если
в ДНК 20% аденина, то с уверенностью можно сказать, что в ней 20% тимина. Выходит на оставшиеся основания — цитозин
и гуанин — остается 60%, значит, цитозин и гуанин составляют в ДНК 30% каждый. Таким нехитрым образом, зная процент
содержания одного основания, можно подсчитать все остальные.
В ДНК остаток сахара — дезоксирибоза, в РНК — рибоза.
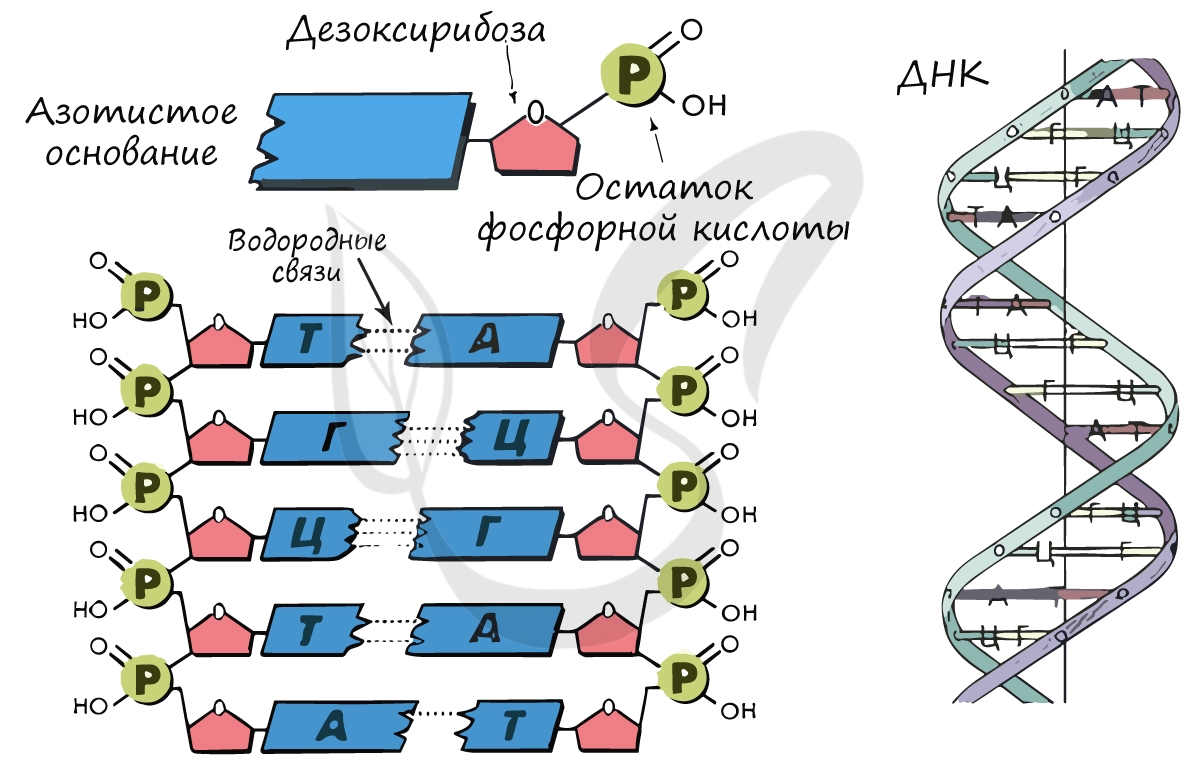
Мы подробно изучили структуру ДНК (дезоксирибонуклеиновой кислоты) — двойной правозакрученной спиральной молекулы. Теперь
настало время детально поговорить об РНК (рибонуклеиновой кислоте). Все виды РНК синтезируются на матрице — ДНК, различают
три вида РНК:
- Рибосомальная РНК (рРНК)
- Информационная РНК (иРНК, син. — матричная РНК, мРНК)
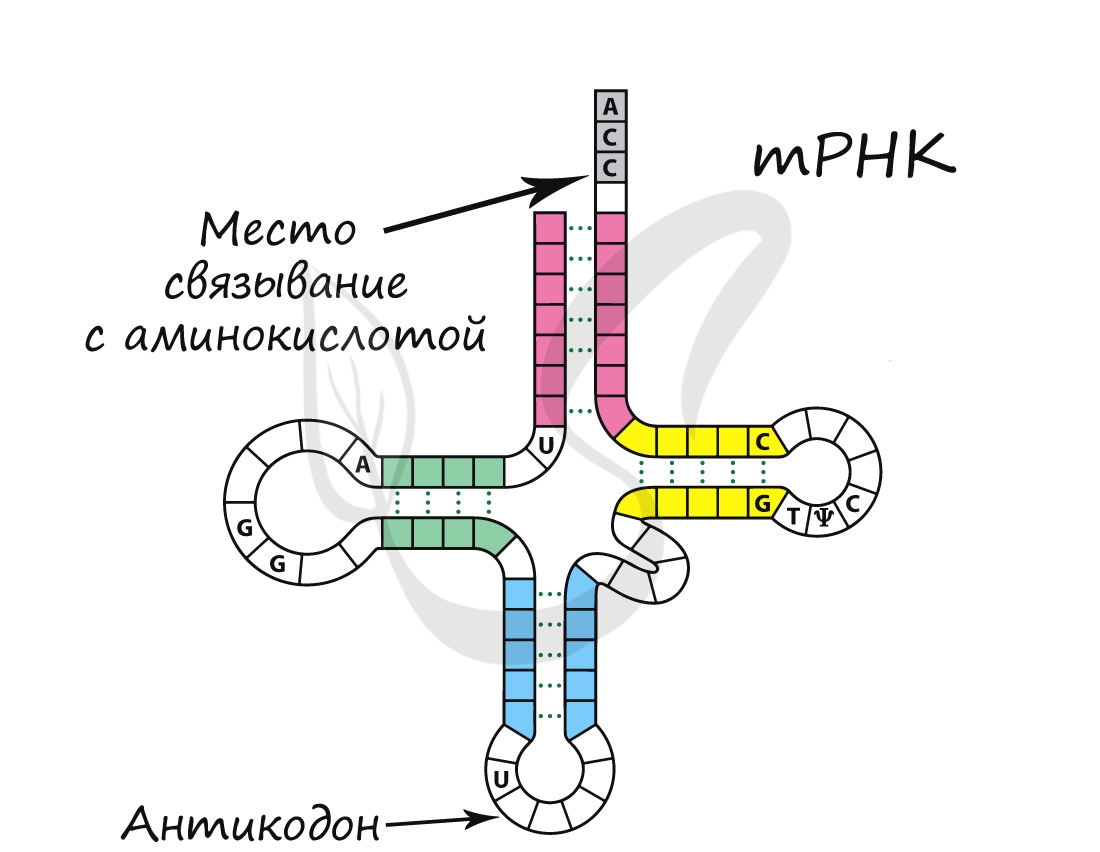
- Транспортная РНК (тРНК)
Синтезируется в ядрышке. рРНК входит в состав
малых и больших субъединиц рибосом. В процентном отношении рРНК составляет 80-90% всей РНК клетки.
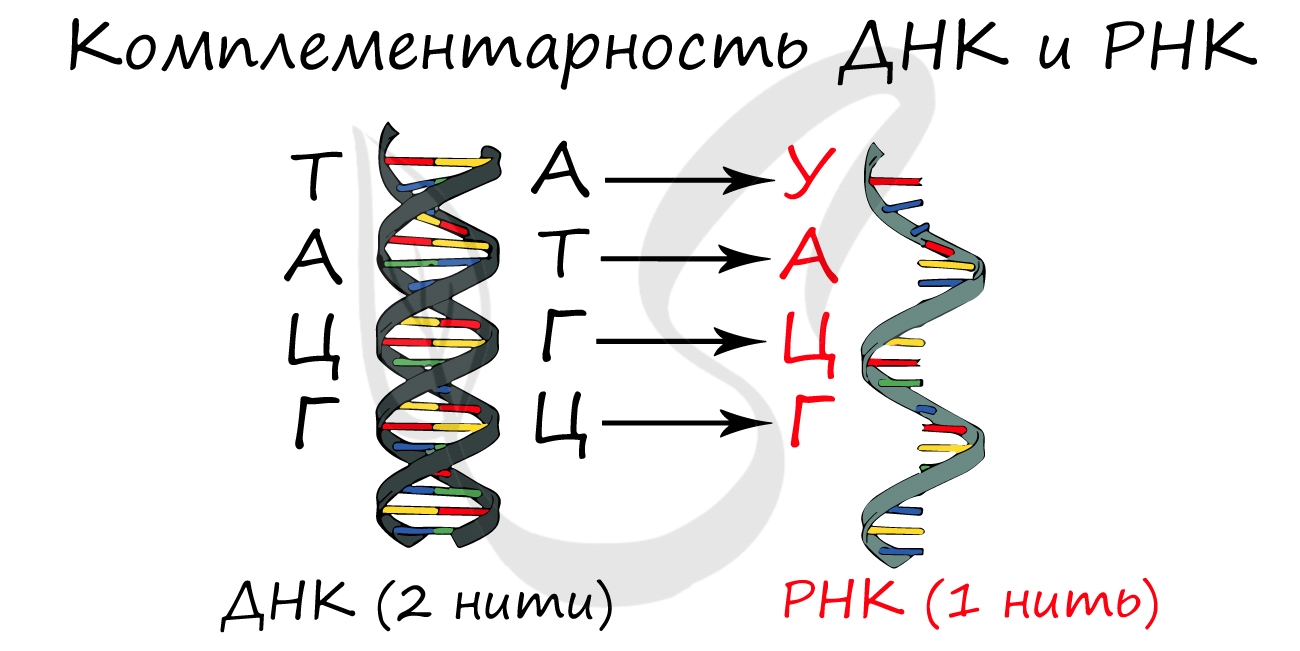
Синтезируется в ядре в ходе процесса транскрипции (лат. transcriptio — переписывание).
Фермент РНК-полимераза строит цепь иРНК по принципу комплементарности с ДНК. Исходя из данного принципа,
гуанин (Г) в молекуле ДНК соединяется с цитозином (Ц) в РНК. Далее соответственно: цитозин (Ц) — гуанин (Г),
аденин (А) — урацил (У), тимин (Т) — аденин (А).
Обеспечивает транспорт аминокислоты к рибосоме во время синтеза белка. Благодаря этому становится возможным
соединение аминокислот друг с другом, образуется белок. тРНК имеет характерную форму клеверного листа.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Белки — это высокомолекулярные соединения (биополимеры), мономерами которых яв
ляются аминокислоты, соединенные пептидными связями.
Аминокислотой называют органическое соединение, имеющее карбоксильную и амино
группу, а также радикал. В природе встречается около 200 аминокислот, которые
различаются взаимным расположением функциональных групп и радикалами, но только 20 из них входят в состав белков. Такие аминокислоты называют протеиногенными.
Не все протеиногенные аминокислоты могут синтези
роваться в организме человека. Аминокислоты, которые
образуются в организме человека в необходимом коли
честве, называют заменимыми (их насчитывается 12),
а аминокислоты, которые не синтезируются и должны
поступать с пищей, — незаменимыми (8). К незамени
мым аминокислотам относят валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин.
Уровни структурной организации белка.
У белков различают первичную, вторичную,третичную и четвертичную структуры.
Первичная структура белка — это последовательность аминокислот, соединенных пептидной связью. Особенности аминокислотного состава белка обусловливают его
пространственную укладку — возникновение вторичной и третичной структур. Изменение
расположения хотя бы одной аминокислоты в первичной структуре влечет за собой измене
ние более высоких структур, а также свойств белка в целом.
Вторичная структура представляет собой упорядоченную пространственную структуру
белковой молекулы в виде спиралей или складок, поддерживаемых водородными связями, которые возникают между атомами кислорода и водорода. Болееменее длинные
участки со вторичной структурой имеют, например, кератины волос и ногтей, фиброин шелка.
Третичная структура белка является
формой пространственной укладки поли
пептидной цепи в виде глобулы (клубка),
поддерживаемой гидрофобными, водород
ными, дисульфидными (S—S) и ионными
связями . Она характерна для
большинства белков организма, напри
мер, миоглобина мышц.
Четвертичная структура — это про
странственная организация нескольких
глобул, которая поддерживается слабы
ми взаимодействиями (гидрофобными,
ионными, водородными и др.).
Четвертичная структура характер
на для гемоглобина и хлорофилла.
По форме молекулы различают фи
бриллярные и глобулярные белки. Первые
из них вытянуты, как, например, колла
ген соединительной ткани или кератины
волос и ногтей. Глобулярные же белки
имеют форму глобулы, как миоглобин
мышц.
Свойства белков.
Одни белки хорошо растворимы в воде, а другие растворяются толь
ко в растворах солей, щелочей, кислот или органических растворителях. Структура молекулы белка и его функциональная активность зависят от условий окружающей среды. Утрата белковой молекулой структуры, вплоть до первичной, называется денатурацией. Денатурация происходит вследствие изменения температуры, рН, атмосферного давления, под действием кислот,
щелочей, солей тяжелых металлов, органических растворителей и др. Обратный процесс восстановления структуры называется ренатурацией, однако он не всегда возможен. Полное разрушение белковой молекулы называется деструкцией
Функции белков:
Белки выполняют в клетке ряд функций: пластическую (строительную), каталитическую (ферментативную), энергетическую, сигнальную (рецепторную), сократительную (двигательную), транспортную, защитную, регуляторную и запасающую.Строительная функция белков связана с их наличи
ем в клеточных мембранах и структурных компонентах клетки. Энергетическая обусловлена тем, что при
расщеплении 1 г белка высвобождается 17,2 кДж энер
гии. Белки — рецепторы мембран принимают участие
в восприятии сигналов окружающей среды и их пе
редаче в клетке, а также в межклеточном узнавании.
Без белков невозможно движение клеток и организмов
в целом. Они составляют основу жгутиков и ресничек,
а также обеспечивают сокращение мышц и перемеще
ние внутриклеточных компонентов. В крови человека
и многих животных белок гемоглобин переносит кисло
род и часть углекислого газа, другие белки транспортируют ионы и электроны. Защитная роль белков связана
с иммунитетом: белок интерферон способен уничтожать
многие вирусы, а белкиантитела участвуют в иммун
ных реакциях. Среди белков и пептидов есть регулято
ры, например, гормон поджелудочной железы, инсулин,
регулирующий концентрацию глюкозы в крови. У неко
торых организмов белки могут откладываться в запас,
как у бобовых в семенах, или у птиц и пресмыкающихся в яйцах.
Insert Flash
ТЕСТ ДОМАШНИЙ
белки жиры углеводы
 |
Строение и функции белков |
Краткий конспект в схемах и таблицах
Подробный конспект
Конспект включает подробное текстовое описание строения, свойств и функций белков в формате ЕГЭ по биологии.
перейти…
Термины по теме
Основные термины по теме «Строение и функции белков».
перейти…
Тестовые задания
Раздел содержит тесты по теме «Строение и функции белков» в формате ЕГЭ для тренировки
перейти…
Список использованных источников
- Биология 11 класс. В.Б. Захаров, С.Г. Мамонтов, Н.И. Сонин, Е.Т. Захарова; Дрофа, 2010
- Биология. Общая биология. Базовый уровень: учебник для 10-11 классов. В.И. Сивоглазов, И.Б. Агафонова, Е.Т. Захарова; Дрофа, 2010
- Биология 10-11 класс. Сухорукова Л.Н., Кучменко В.С., Иванова Т.В.; Сфера, Просвещение
- Использованные рисунки, находящиеся в свободном доступе в Интернете
В видео-уроке использовались фрагменты:
https://www.youtube.com/watch?v=RCGTZw7E7tE
ВикиЧтение
Биология [Полный справочник для подготовки к ЕГЭ]
Лернер Георгий Исаакович
2.3.3. Белки, их строение и функции
Белки – это биологические гетерополимеры, мономерами которых являются аминокислоты. Белки синтезируются в живых организмах и выполняют в них определенные функции.
В состав белков входят атомы углерода, кислорода, водорода, азота и иногда серы. Мономерами белков являются аминокислоты – вещества, имеющие в своем составе неизменяемые части аминогруппу NH2 и карбоксильную группу СООН и изменяемую часть – радикал. Именно радикалами аминокислоты отличаются друг от друга. Аминокислоты обладают свойствами кислоты и основания (они амфотерны), поэтому могут соединяться друг с другом. Их количество в одной молекуле может достигать нескольких сотен. Чередование разных аминокислот в разной последовательности позволяет получать огромное количество различных по структуре и функциям белков.
В белках встречается 20 видов различных аминокислот, некоторые из которых животные синтезировать не могут. Они получают их от растений, которые могут синтезировать все аминокислоты. Именно до аминокислот расщепляются белки в пищеварительных трактах животных. Из этих аминокислот, поступающих в клетки организма, строятся его новые белки.
Структура белковой молекулы. Под структурой белковой молекулы понимают ее аминокислотный состав, последовательность мономеров и степень скрученности молекулы, которая должна умещаться в различных отделах и органоидах клетки, причем не одна, а вместе с огромным количеством других молекул.
Последовательность аминокислот в молекуле белка образует его первичную структуру. Она зависит от последовательности нуклеотидов в участке молекулы ДНК (гене), кодирующем данный белок. Соседние аминокислоты связаны пептидными связями, возникающими между углеродом карбоксильной группы одной аминокислоты и азотом аминогруппы другой аминокислоты.
Длинная молекула белка сворачивается и приобретает сначала вид спирали. Так возникает вторичная структура белковой молекулы. Между СО и NH – группами аминокислотных остатков, соседних витков спирали, возникают водородные связи, удерживающие цепь.
Молекула белка сложной конфигурации в виде глобулы (шарика), приобретает третичную структуру. Прочность этой структуры обеспечивается гидрофобными, водородными, ионными и дисульфидными S-S связями.
Некоторые белки имеют четвертичную структуру, образованную несколькими полипептидными цепями (третичными структурами). Четвертичная структура так же удерживается слабыми нековалентными связями – ионными, водородными, гидрофобными. Однако прочность этих связей невелика и структура может быть легко нарушена. При нагревании или обработке некоторыми химическими веществами белок подвергается денатурации и теряет свою биологическую активность. Нарушение четвертичной, третичной и вторичной структур обратимо. Разрушение первичной структуры необратимо.
В любой клетке есть сотни белковых молекул, выполняющих различные функции. Кроме того, белки имеют видовую специфичность. Это означает, что каждый вид организмов обладает белками, не встречающимися у других видов. Это создает серьезные трудности при пересадке органов и тканей от одного человека к другому, при прививках одного вида растений на другой и т.д.
Функции белков. Каталитическая (ферментативная) – белки ускоряют все биохимические процессы, идущие в клетке: расщепление питательных веществ в пищеварительном тракте, участвуют в реакциях матричного синтеза. Каждый фермент ускоряет одну и только одну реакцию (как в прямом, так и в обратном направлении). Скорость ферментативных реакций зависит от температуры среды, уровня ее рН, а также от концентраций реагирующих веществ и концентрации фермента.
Транспортная – белки обеспечивают активный транспорт ионов через клеточные мембраны, транспорт кислорода и углекислого газа, транспорт жирных кислот.
Защитная – антитела обеспечивают иммунную защиту организма; фибриноген и фибрин защищают организм от кровопотерь.
Структурная – одна из основных функций белков. Белки входят в состав клеточных мембран; белок кератин образует волосы и ногти; белки коллаген и эластин – хрящи и сухожилия.
Сократительная – обеспечивается сократительными белками – актином и миозином.
Сигнальная – белковые молекулы могут принимать сигналы и служить их переносчиками в организме (гормонами). Следует помнить, что не все гормоны являются белками.
Энергетическая – при длительном голодании белки могут использоваться в качестве дополнительного источника энергии после того, как израсходованы углеводы и жиры.
ПРИМЕРЫ ЗАДАНИЙ
Часть А
А1. Последовательность аминокислот в молекуле белка зависит от:
1) структуры гена 3) их случайного сочетания
2) внешней среды 4) их строения
А2. Человек получает незаменимые аминокислоты путем
1) их синтеза в клетках 3) приема лекарств
2) поступления с пищей 4) приема витаминов
А3. При понижении температуры активность ферментов
1) заметно повышается
2) заметно понижается
3) остается стабильной
4) периодически изменяется
А4. В защите организма от кровопотерь участвует
1) гемоглобин 3) фибрин
2) коллаген 4) миозин
А5. В каком из указанных процессов белки не участвуют?
обмен веществ
кодирование наследственной информации
ферментативный катализ
транспорт веществ
А6. Укажите пример пептидной связи:
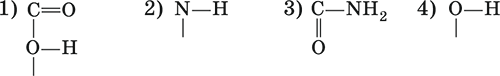
Часть В
В1. Выберите функции, характерные для белков
1) каталитическая 4) транспортная
2) кроветворная 5) рефлекторная
3) защитная 6) фотосинтетическая
В2. Установите соответствие между структурой белковой молекулы и ее особенностями
Часть С
С1. Почему продукты хранят в холодильнике?
С2. Почему продукты, подвергшиеся тепловой обработке, хранятся дольше?
СЗ. Объясните понятие «специфичность» белка, и какое биологическое значение имеет специфичность?
С4. Прочитайте текст, укажите номера предложений, в которых допущены ошибки и объясните их 1) Большая часть химических реакций в организме катализируется ферментами. 2) Каждый фермент может катализировать множество типов реакций. 3) У фермента есть активный центр, геометрическая форма которого изменяется в зависимости от вещества, с которым фермент взаимодействует. 4) Примером действия фермента может быть разложение мочевины уреазой. 5) Мочевина разлагается на двуокись углерода и аммиак, которым пахнет кошачий лоток с песком. 6) За одну секунду уреаза расщепляет до 30 ООО молекул мочевины, в обычных условиях на это потребовалось бы около 3 млн лет.
Данный текст является ознакомительным фрагментом.
Читайте также
Строение и функции ушей
Строение и функции ушей
Уши – орган слуха человека. Кроме этого они выполняют еще одну функцию в организме – участвуют в поддержании равновесия тела. Ухо состоит из трех отделов – наружного уха, среднего уха и внутреннего.
Строение ухаНаружное ухо включает ушную
2.7. Клетка – генетическая единица живого. Хромосомы, их строение (форма и размеры) и функции. Число хромосом и их видовое постоянство. Особенности соматических и половых клеток. Жизненный цикл клетки: интерфаза и митоз. Митоз – деление соматических клеток. Мейоз. Фазы митоза и мейоза. Развитие поло
2.7. Клетка – генетическая единица живого. Хромосомы, их строение (форма и размеры) и функции. Число хромосом и их видовое постоянство. Особенности соматических и половых клеток. Жизненный цикл клетки: интерфаза и митоз. Митоз – деление соматических клеток. Мейоз. Фазы
5.1.2. Строение и функции пищеварительной системы
5.1.2. Строение и функции пищеварительной системы
Основные термины и понятия, проверяемые в экзаменационной работе: Всасывание, органы, пищеварительная система, регуляция пищеварения, строение пищеварительной системы, система органов, ферменты.Пищеварительная система –
5.1.3.Строение и функции дыхательной системы
5.1.3.Строение и функции дыхательной системы
Основные термины и понятия, проверяемые в экзаменационной работе: альвеолы, легких, альвеолярный воздух, вдох, выдох, диафрагма, газообмен в легких и тканях, диффузия, дыхание, дыхательные движения, дыхательный центр, плевральная
5.1.4. Строение и функции выделительной системы
5.1.4. Строение и функции выделительной системы
Основные термины и понятия, проверяемые в экзаменационной работе: вторичная моча, извитые канальцы, капсула, мочевой пузырь, мочеточники, нефрон, первичная моча, почки, признаки заболевания почек, продукты выделения,
5.2.1. Строение и функции опорно-двигательной системы
5.2.1. Строение и функции опорно-двигательной системы
Основные термины и понятия, проверяемые в экзаменационной работе: верхние конечности, грудная клетка, кости (трубчатые, плоские), костная ткань, лицевой череп, мозговой череп, мышцы, надкостница, позвоночный столб, пояса
5.2.2.Кожа, ее строение и функции
5.2.2.Кожа, ее строение и функции
Кожа – один из важнейших органов человека, выполняющих защитную, терморегуляционную, выделительную, рецепторную функции. Ее общая поверхность составляет около 1,5—1,8 м2 . Производными кожи являются волосы, ногти, сальные и потовые железы.
5.2.3. Строение и функции системы органов кровообращения и лимфообращения
5.2.3. Строение и функции системы органов кровообращения и лимфообращения
Основные термины и понятия, проверяемые в экзаменационной работе: аорта, артерии, ацетилхолин, вены, давление крови, капилляры, клапаны (двустворчатые, трехстворчатые, полу лунные, карманные),
5.4.2. Строение и функции центральной нервной системы
5.4.2. Строение и функции центральной нервной системы
Центральная нервная система состоит из спинного и головного мозга.Строение и функции спинного мозга. Спинной мозг взрослого человека – это длинный тяж почти цилиндрической формы. Находится спиной мозг в позвоночном
5.4.3. Строение и функции вегетативной нервной системы
5.4.3. Строение и функции вегетативной нервной системы
Вегетативная нервная система (ВНС) координирует и регулирует деятельность внутренних органов, обмен веществ, гомеостаз. ВНС состоит из симпатического и парасимпатического отделов. Оба отдела иннервируют большинство
5.5. Анализаторы. Органы чувств, их роль в организме. Строение и функции. Высшая нервная деятельность. Сон, его значение. Сознание, память, эмоции, речь, мышление. Особенности психики человека
5.5. Анализаторы. Органы чувств, их роль в организме. Строение и функции. Высшая нервная деятельность. Сон, его значение. Сознание, память, эмоции, речь, мышление. Особенности психики человека
5.5.1 Органы чувств (анализаторы). Строение и функции органов зрения и слуха
Основные
5.5.1 Органы чувств (анализаторы). Строение и функции органов зрения и слуха
5.5.1 Органы чувств (анализаторы). Строение и функции органов зрения и слуха
Основные термины и понятия, проверяемые в экзаменационной работе: анализаторы, внутреннее ухо, евстахиева труба, зрительный анализатор, рецепторы, сетчатка, слуховой анализатор, среднее
Строение и функции сердечно-сосудистой системы
Строение и функции сердечно-сосудистой системы
С функциональной точки зрения сердечно-сосудистая система образована двумя родственными структурами. Первая состоит из сердца, артерий, капилляров и вен, которые обеспечивают замкнутый круговорот крови, вторая – из сети
Глава 1 Строение и функции иммунной системы
Глава 1 Строение и функции иммунной системы
Иммунология – наука о системе, обеспечивающей защиту организма от интервенции генетически чужеродных биологических структур, способных нарушить гомеостаз.Иммунная система является одной из систем жизнеобеспечения, без
3.8.2. Белки
Белки — высокомолекулярные органические соединения, состоящие из остатков аминокислот, соединённых в длинную цепочку пептидной связью.
В состав белков живых организмов входит всего 20 типов аминокислот, все из которых относятся к альфа-аминокислотами, а аминокислотный состав белков и их порядок соединения друг с другом определяются индивидуальным генетическим кодом живого организма.
Одной из особенностей белков является их способность самопроизвольно формировать пространственные структуры характерные только для данного конкретного белка.
| первичная | последовательность соединения остатков аминокислот | |
| вторичная |
локальное упорядочивание фрагмента полипептидной цепи в спирали |
|
| третичная |
пространственная ориентация полипептидной спирали или способ ее укладки определенном объеме в глобулы (клубки) или фибриллы (нити) |
Из-за специфики своего строения белки могут обладать разнообразными свойствами. Например, белки, имеющие глобулярную четвертичную структуру, в частности белок куриного яйца, растворяются в воде с образованием коллоидных растворов. Белки, обладающие фибриллярной четвертичной структурой в воде не растворяются. Фибриллярными белками, в частности, образованы ногти, волосы, хрящи.
Химические свойства белков
Гидролиз
Все белки способны вступать в реакцию гидролиза. В случае полного гидролиза белков образуется смесь из α-аминокислот:
Белок + nH2O => смесь из α-аминокислот
Денатурация
Разрушение вторичной, третичной и четвертичной структур белка без разрушения его первичной структуры называют денатурацией. Денатурация белка может протекать под действием растворов солей натрия, калия или аммония – такая денатурация является обратимой:
Денатурация же протекающая под действием излучения (например, нагрева) или обработке белка солями тяжелых металлов является необратимой:
Так, например, необратимая денатурация белка наблюдается при термической обработке яиц в процессе их приготовления. В результате денатурации яичного белка его способность растворяться в воде с образованием коллоидного раствора исчезает.
Качественные реакции на белки
Биуретовая реакция
Если к раствору, содержащему белок добавить 10%-й раствор гидроксида натрия, а затем небольшое количество 1 %-го раствора сульфата меди, то появится фиолетовое окрашивание.
раствор белка + NаОН(10%-ный р-р) + СuSO4 = фиолетовое окрашивание
Ксантопротеиновая реакция
растворы белка при кипячении с концентрированной азотной кислотой окрашиваются в желтый цвет:
раствор белка + HNO3(конц.) => желтое окрашивание
Биологические функции белков
| каталитическая | ускоряют различные химические реакции в живых организмах | ферменты |
| структурная | строительный материал клеток | коллаген, белки клеточных мембран |
| защитная | защищают организм от инфекций | иммуноглобулины, интерферон |
| регуляторная | регулируют обменные процессы | гормоны |
| транспортная | перенос жизненно-необходимых веществ от одних частей организма к другим | гемоглобин переносит кислород |
| энергетическая | снабжают организм энергией | 1 грамм белка может обеспечить организм энергией в количестве 17,6 кДж |
| моторная (двигательная) | любые двигательные функции организма | миозин (мышечный белок) |













